Регрессивный аутизм и митохондриальная дисфункция
В научно-исследовательских центрах в США, которые получают солидное финансирование, больных аутизмом сначала проверяют на наличие у них митохондриальных расстройств и таких хорошо известных генетических поломок, как синдром Мартина-Белла (синдром ломкой X-хромосомы).
Затем приходит черед анализа хромосом при помощи ДНК-чипов, что позволяет выявить генетические поломки у 15-20% страдающих РАС. В других странах эта технология еще малодоступна.
Частота митохондриальной дисфункции в популяции и при РАС
Считается, что частота митохондриальной дисфункции (исключая людей с РАС) составляет 1:8 500. При этом существуют оценки, по которым каждый 200-ый человек (!) имеет гены, которые можно связать с митохондриальной дисфункцией (далее — МтД).
Это позволяет предположить, как возникает патология:
- На недостаточную функцию (первый фактор слабости) действует воспаление и/или другие обстоятельства (второй фактор слабости), что приводит к регрессивному аутизму.
Это также позволяет говорить о том, что поиск причин аутизма исключительно в генах бесплоден. Только присутствие генетического дефекта ещё не означает, что он проявится в патологии. Для возникновения болезни нужны дополнительные факторы.
Прием карнитина как маркер митохондриальной дисфункции
Если вашему ребенку становится лучше от пищевой добавки L-карнитин, то есть вероятность того, что в вашем случае присутствует МтД, которая порождает аутизм.
Как лечение МтД уменьшает симптомы аутизма
Опишем теорию вкратце. Недостаточная работа митохондрий либо напрямую провоцирует регрессивный аутизм, либо ухудшает его течение.
Если своевременно восстановить работу этой системы, то можно ограничить вред, нанесенный нервным тканям, и существенно продвинуться в лечении.
Какие вещества могут быть опасны при митохондриальной дисфункции?
При МтД следует избегать следующих препаратов:
- Парацетамол
- Аспирин
- Стероиды
- Статины
- Вальпроевая кислота
- Рисперидон
- Галоперидол
- Некоторые антидепрессанты группы СИОЗС
Это связано с тем, что все вышеперечисленные соединения оказывают токсическое действие на митохондрии.
Предлагаем вашему вниманию выдержки из статьи доктора Келли о связи аутизма и митохондриальной дисфункции.
Большинство детей, у которых аутизм является вторичным по отношению к митохондриальной дисфункции
Такие регрессы имели место в возрасте от 12 до 30 месяцев. Последующая история болезни АВМтД типична для регрессивного аутизма, когда большая часть детей демонстрирует частичное выздоровление — между 3-мя и 10-ью годами.
Принципиальная клиническая разница между АВМтД и нерегрессивным аутизмом отражается в следующих частностях:
- Небольшая миопатия (слабый мышечный тонус)
- Повышенная утомляемость
- Небольшие моторные судороги в годы, которые следуют за регрессом.
*Отметим, что набор признаков может отличаться у разных пациентов.
Некоторые пациенты с подтвержденным АВМтД переживают лишь ограниченный период проблем в развитии, который длится несколько месяцев, и демонстрируют более полное выздоровление по сравнению с теми, кто переживает существенный регресс в аутизм во время периода неврологической хрупкости. Следует отметить также братьев и сестер детей с АВМтД. У многих сиблингов детей с РАС есть все биохимические признаки АВМтД, но отсутствуют или минимальны аномалии развития и поведения (СДВГ, обсессивно-компульсивное расстройство).
Начать лечение АВМтД как можно быстрее после регресса
Хотя необратимый вред здоровью у больных АВМтД может быть значительным – особенно у тех, кто пострадал более чем от одного эпизода регресса,
Кроме того, определенная надежда на коррекцию патологии остается у большинства пациентов. Поскольку неограниченно долгое время возможно частичное облегчение симптомов аутизма в результате терапии, направленной на выравнивание метаболизма.
Что включает в себя лечение АВМтД
Лечение АВМтД включает:
- Стимуляцию работы митохондриального комплекса путем использования:
- L-карнитина
- Тиамина
- Никотинамида
- Пантотеновой кислоты
- Необходимо также защитить клетки от свободных радикалов при помощи
- Витамина С
- Витамина Е
- Липоевой кислоты
- Кофермента Q10.
Как диагностируется митохондриальная дисфункция у ребенка
МтД можно считать самой распространенной причиной регрессивного аутизма, и она объективно выявляется в лабораторных условиях.
Однако относительно небольшие биохимические аномалии часто опускаются, когда проводится традиционное исследование метаболизма.
В некоторых случаях все результаты анализов находятся в пределах нормы, но ненормальные пропорции между метаболитами позволяют говорить о наличии МтД.
В институте Кеннеди-Кригера мы наладили технологию выявления пациентов с АВМтД, что стало возможным по двум причинам:
- Наш центр специализируется на РАС и расстройствах метаболизма;
- У нас есть соответствующее оборудование.
Важность анамнеза ребенка (истории болезни и жизни)
Знание естественного течения аутизма при МтД и событий, сопровождающих период регресса, также важны для постановки диагноза, как и понимание ключевых биохимических аномалий.
- До регресса все заболевшие дети имели нормальную или отлично развитую речь и не имели других неврологических проблем, за исключением небольших задержек в развитии крупной моторики и гипотонии в отдельных случаях.
- Регресс часто можно четко соотнести с каким-то событием. Обычно это детская болезнь, например, воспаление среднего уха, фарингит, ОРВИ. Изредка это вакцинация – чаще всего вакциной против кори, свинки и краснухи или бывшей вакциной АКДС.
- Общая черта всех идентифицированных случаев регресса — воспаление.
- Регресс происходит или остро во время болезни, или в течение 14 дней после использования вакцины против кори, свинки и краснухи.
- Регресс приводит к типичной картине аутизма — с острой или под-острой утратой речи, самостимуляцией, утратой глазного контакта и других социальных навыков.
- Хотя неврологический регресс при многих митохондриальных и других метаболических расстройствах происходит на фоне сопутствующего болезни голода, многие дети с АВМтД продолжают питаться нормально в период кризиса
- Более того, регресс во время болезни может произойти вне зависимости от того, наблюдалась лихорадка или нет.
Дестабилизация работы митохондрий со стороны иммунной системы
Природа регресса и время его наступления позволяют предположить, что недостаточность в работе митохондрий вызывается дестабилизацией митохондриальной функции со стороны иммунной системы.
Стабильное использование мозгом НАДН-дегидрогеназного комплекса близко к 50%. Если его активность сокращается вполовину из-за болезни, то всего 5-10% дальнейшего снижения митохондриальной активности могут привести к тому, что клеткам критически не хватает энергии, и они гибнут.
Системное воспаление и митохондриальная дисфункция
Кроме вышесказанного, к развитию и лечению АВМтД могут иметь прямое отношение факторы питания, влияющие на развитие воспалительного процесса. В последнее время в диетах западного мира произошел опасный сдвиг — ограничение животных жиров и увеличение количества растительных масел. В рационе младенцев и маленьких детей мы наблюдаем рост потребления омега-6 жирных кислот, которые поддерживают системное воспаление.
Установленная связь между воспалением и МтД может частично объяснить все возрастающее число случаев регрессивного аутизма у пациентов, у которых наблюдается нетипичное течение дисфункции НАДН-дегидрогеназного комплекса.
В этом отношении АВМтД становится еще одним комплексным заболеванием воспалительной природы — наряду с другими болезнями, все чаще наблюдаемыми в последние 20-30 лет. Среди них: астма, воспалительные заболевания кишечника, атопический дерматит, эозинофильный гастроэнтерит и др.
Если предполагать, что системное воспаление – частая причина регресса у детей с АВМтД, то необходимо использовать противовоспалительные агенты, включая ибупрофен и средства, подавляющие лейкотриеновые рецепторы (монтелукаст и зафирлукаст). Это должно предотвратить усиление аутических симптомов у детей с АВМтД.
Не так давно отмечено увеличение риска аутического регресса после использования вакцины против кори, свинки и краснухи у детей, которым давали парацетамол (сильный оксидант). Этот факт может быть истолкован как повышение риска регресса у тех детей, которым не давали ибупрофен.
Более того, процесс постепенного отказа от использования аспирина в педиатрии, что произошло в 80-90-е годы, мог сыграть определенную роль в том, что заболеваемость аутизмом пошла вверх. (Отметим, однако, что с позиций эпидемиологии отказ от аспирина скорее всего не является единственным или важнейшим фактором того, что заболеваемость РАС возросла).
Особенности клинического течения АВМтД
- У большинства пациентов с АВМтД наблюдался четко выраженный эпизод острой или под-острой утраты речи и регресса социальных навыков.
- У некоторых начало болезни проявлялось как период относительной стагнации развития, который длился от нескольких месяцев до 1 года и больше.
- Как минимум 90% таких случаев – регресса или стагнации – происходят в возрасте между 12 и 30 месяцем.
Как лечить АВМтД из-за недостаточности в работе НАДН-дегидрогеназного комплекса
Цели лечения АВМтД, который связан с недостаточной работой НАДН-дегидрогеназного комплекса:
- Усилить деятельность НАДН-дегидрогеназного комплекса
- Укрепить систему защиты митохондрий от оксидативного стресса
- Избегать состояний, которые могут ухудшить работу митохондрий или предъявлять повышенные требования к затратам энергии, а именно:
- Голодание
- Воспалительные процессы
- Использование лекарств, которые подавляют работу НАДН-дегидрогеназного комплекса.
Плана лечения, который учитывает 1 и 2 цели, опирается на использование следующих средств:
- L-Карнитин (50 мг/кг веса в день)
- Кофермент Q10 (10 мг/кг веса в день)
- Витамин С (30 мг/кг веса в день)
- Витамин Е (25 МЕ/кг веса в день)
- Липоевая кислота (10 мг/кг веса в день)
- Пантотеновая кислота (витамин В5) (10 мг/кг веса в день)
- Никотинамид (7,5 мг/кг веса в день) (не обязательно)
- Тиамин (витамин В1) (15 мг/кг веса в день) (не обязательно)
Если терапия карнитином приводит к немедленному улучшению поведения у детей с регрессивным аутизмом, то причиной болезни, скорее всего, является недостаточной работой НАДН-дегидрогеназного комплекса.
Выраженная вялость после пробуждения как клинический признак МтД
Еще одно важное клиническое наблюдение состоит в том, что у многих детей с МтД больше симптомов проявляется сразу после пробуждения — до завтрака (раздражительность, слабость, аномальная вялость). Для АВМтД этот симптом, однако, не так распространен, как для других митохондриальных болезней.
Для детей старше 1 года, у которых очевидны или предполагаются такие утренние проявления болезни, сырой (!) кукурузный крахмал существенно отдаляет пик «ночного голода». Средняя пропорция рассчитывается так: 1 гр сырого кукурузного крахмала на 1 кг веса ребенка. У дошкольников и детей с чутким ЖКТ следует начинать с 0,25 гр на 1 кг веса, постепенно наращивая дозировку. Остановиться следует на том количестве, которое обеспечивает нормально бодрое пробуждение утром.
Сырой кукурузный крахмал дают в прохладной воде или натуральном НЕсладком йогурте. Только в отсутствие глюкозы он обеспечивает медленно перевариваемый источник углеводов, который может поддерживать нормальный уровень глюкозы в крови 5-8 часов подряд.
Вакцины и митохондриальные расстройства
Некоторые врачи короткое время соотносили с аутическим регрессом и другими митохондриальными расстройствами использование на 2-м году жизни ребенка вакцины против кори, свинки и краснухи. Без сомнения, некоторые случаи регресса являются случайными, поскольку возраст вакцинации от кори, свинки и краснухи совпадает с периодом неврологической хрупкости.
У некоторых детей регресс, который может быть связан с вакцинацией, наблюдался с пиком воспалительной реакции на 8-10 день после вакцинации. К сожалению, растущий отказ семей от прививок в США и других странах практически гарантирует, что в ближайшем будущем следует ждать эпидемий краснухи, кори и свинки.
Смеси для вскармливания с вредной структурой жирных кислот
Как мы уже упоминали, в настоящее время в смесях и готовых кашах для младенцев преобладают растительные жиры. Этот вид жиров считается поддерживающим воспаление, поскольку в них содержатся низкие уровни омега-3 жирных кислот и большие количества линолевой кислоты и других омега-6 кислот.
Общество начинает ощущать серьезные последствия этой тенденции. Проведенное в 2000 году исследование показало, что у младенцев возрастом от 2 до 4-х месяцев, которых кормили грудью, уровень докозагексаеновой кислоты (класс омега-3) в два раза выше чем у тех малышей, которые питались смесями.
Другие омега-3 кислоты также имеют более высокий уровень при грудном вскармливании. Иммунологические последствия такой разницы не исследовались. Можно только предполагать, что усредненно здоровый ребенок не будет иметь очевидных негативных последствий от диеты, в которой не хватает омега-3 жирных кислот.
Однако у ребенка с шатким равновесием в работе митохондрий возможное воспалительное воздействие таких диет может стать дополнительным фактором, который поддержит развитие регрессивного аутизма вследствие инфекции.
Одно из недавних исследований связывает снижение синтеза холестерина с редкими случаями не-регрессивного аутизма. В свете этого можно предполагать, что ранняя отмена грудного вскармливания и существенный сдвиг в составах смесей в сторону растительных жиров с низким содержанием холестерина стали одним из факторов повышения заболеваемости регрессивным и нерегрессивным аутизмом.
В целом проводимые за последние 20 лет исследования показывают следующее. Отсутствие или ранний уход с грудного вскармливания связан с повышением заболеваемости аутизмом.
Самый простой способ достаточного поступления в организм омега-3 жирных кислот — использовать пищевые добавки, например, масло семян льна и жир лососевых рыб.
Как достигнуть цели №3 в плане лечения АВМтД
Третий пункт плана лечения требует осторожного отношения к медпрепаратам, в частности к тем, которые регулируют поведение. Они могут не иметь вредоносного действия, когда их принимают пациенты с нормальной работой митохондриального комплекса. Однако у детей с АВМтД эти препараты могут еще больше слабить функцию митохондрий (в случаях, когда НАДН-дегидрогеназный комплекс работает со сбоями и дозировка препарата высока).
К таким средствам относятся типичные и атипичные нейролептики, такие как рисперидон, галоперидол и некоторые антидепрессанты группы СИОЗС. Хотя эти препараты используются чаще всего для детей постарше, которые вышли из периода неврологической хрупкости, этот теоретический риск нужно учитывать всегда, когда врачи выписывают нейролептики – как новые, так и давно присутствующие в медицинской практике.
Перевод с дополнением. Источник:
http://epiphanyasd.blogspot.ru/2014/10/regressive-autism-and-mitochondria-part.html?m=1
www.corhelp.ru
симптомы, причины, лечение, профилактика, осложнения
Врачи начали наблюдать за тем, как проявляются митохондриальные заболевания ещё в 20-м веке. Стремясь определить, от чего может быть любая из митохондриальных болезней, специалисты обнаружили более 50 разновидностей болезней, которые имеют связь с нарушениями, затрагивающими митохондрии.
В зависимости от причин, различают три основных подгруппы митохондриальных заболеваний, а именно:
- Болезни, вызванные мутациями митохондриальной ДНК. Подобные дефекты имеют связь с точечной мутацией различных элементов и наследуются преимущественно от матери. Также, болезни может вызвать структурная дислокация. К этой категории болезней относятся такие наследственные синдромы Кернса-Сейра, Пирсона, Лебера и т. д.
- Болезни, вызванные дефектами на уровне ядерной ДНК. Мутации влекут за собой нарушение функционирования митохондрий. Кроме того, они могут вызывать негативные изменения ферментов, участвующих в циклическом биохимическом процессе, в частности – обеспечении клеток в организме кислородом. Сюда можно отнести синдромы Люфта и Альперса, диабетические заболевания и т. д.
- Болезни, вызванные дефектами на уровне ядерной ДНК и, как следствие, вызывающие вторичную деформацию ДНК митохондрий. К списку вторичных изменений относятся печеночная недостаточности и синдромы, типа того что был выявлен Де Тони-Дебре-Фанкони.
На протяжении длительного срока времени, мутации и, как следствие, митохондриальные болезни, могут не проявляться у несовершеннолетнего пациента. Однако, с течением времени, скопление нездоровых органелл увеличивается, в результате, начинаются проявления первых признаков того или иного заболевания.
Так как заболевания митхондриальной группы представляют собой целую группу патологий, то и признаки этих болезней существенно различаются в зависимости от того, какие органы и системы детского организма были повреждены. Учитывая связь между дефектами митохондрий и энергетической функцией, можно определить особенную подверженность поражению нервной и мышечной систем.
Среди характерных признаков патологии мышечной системы можно распознать:
- Ограничение или полное отсутствие двигательной активности в связи с невозможностью выполнять обычные действия из-за ослабленности мышц или, как называют это состояние – миопатии.
- Пониженное артериальное давление.
- Болевой синдром или мышечные спазмы, сопровождаемые сильными болями.
У детей в первую очередь проявляется головная боль, интенсивная и повторяющаяся рвота, ослабленность после минимальных физических нагрузок.
Если речь идёт о поражении нервной системы, то здесь имеют место быть следующие проявления:
- отставание в психомоторном развитии;
- неспособность выполнять действия, с которыми ребёнок справлялся ранее – регресс развития;
- судорожные припадки;
- периодические проявления апноэ и тахипноэ;
- частая потеря сознания и впадение в кому;
- изменения на уровне кислотно-щелочного баланса;
- изменение походки.
У детей старшего возраста можно заметить онемение, паралич, потерю чувствительности, инсультоподобные приступы, патологии в виде непроизвольных движений и т. д.
Затрагивание органов чувств выражается в ухудшении зрительной функции, птозах, катарактах, дефектах глазной сетчатки и поля зрения, ухудшении слуха или полной глухоте нейросенсорного характера. Поражение органов в детском организме проявляются в виде проблем с сердцем, печенью, почками, поджелудочной железой. Что касается болезней, связанных с эндокринной системой, то здесь отмечаются:
- отставание в росте и половом развитии,
- пониженная выработка глюкозы организмом,
- дисфункция щитовидки,
- прочие проблемы с метаболизмом.
Диагностика митохондриальных заболеваний у ребёнка
Для того чтобы диагностировать наличие митохондриальных болезней, врач изучает анамнез, проводит физикальный осмотр, исследуя в первую очередь силу ребёнка и его выносливость. Дополнительно назначается обследование у невропатолога, включая оценку зрения, рефлексов, речевой и познавательной способностей. С помощью специализированных анализов – мышечная биопсия, МРС и так далее, – подтверждают имеющиеся подозрения. Также выполняется компьютерная и магнитно-резонансная томография и ДНК-диагностика с консультацией у генетиков.
То, чем опасны дефекты митохондрий, зависит от вида болезни. Например, при поражении мышечной системы, имеет место быть полный паралич и инвалидизация, в том числе интеллектуальный регресс.
Что можете сделать вы
Первая помощь со стороны родителей зависит от того, в чём именно заключаются проявления заболевания. В любом случае, при наличии малейших подозрений и отклонений от нормы, необходимо обратиться к специалисту и узнать, что делать с болезнью при её наличии.
Что делает врач
Вне зависимости от вида болезни, лечить её можно методом введения препаратов, нормализующих энергетический обмен. Также, ребёнку назначается симптоматическое и специализированное лечение в порядке, установленном для конкретного заболевания. Вылечить патологии быстрее или нормализовать состояние пациента помогают физические упражнения и физиотерапевтические процедуры.
Предотвратить митохондриальные болезни невозможно, так как они происходят на генетическом уровне. Единственный способ, позволяющий несколько минимизировать риски – это ведение здорового образа жизни без вредных привычек.
Вооружайтесь знаниями и читайте полезную информативную статью о заболевании митохондриальные заболевания у детей. Ведь быть родителями – значит, изучать всё то, что поможет сохранять градус здоровья в семье на отметке «36,6».
Узнайте, что может вызвать недуг , как его своевременно распознать. Найдите информацию о том, каковы признаки, по которым можно определить недомогание. И какие анализы помогут выявить болезнь и поставить верный диагноз.
В статье вы прочтёте всё о методах лечения такого заболевания, как митохондриальные заболевания у детей. Уточните, какой должна быть эффективная первая помощь. Чем лечить: выбрать лекарственные препараты или народные методы?
Также вы узнаете, чем может быть опасно несвоевременное лечение недуга митохондриальные заболевания у детей, и почему так важно избежать последствий. Всё о том, как предупредить митохондриальные заболевания у детей и не допустить осложнений.
А заботливые родители найдут на страницах сервиса полную информацию о симптомах заболевания митохондриальные заболевания у детей. Чем отличаются признаки болезни у детей в 1,2 и 3 года от проявлений недуга у деток в 4, 5, 6 и 7 лет? Как лучше лечить заболевание митохондриальные заболевания у детей?
Берегите здоровье близких и будьте в тонусе!
detstrana.ru
Митохондриальная дисфункция и аутизм
 Митохондриальный комплекс – это часть клеток, ответственная за выработку энергии. В дисфункции митохондрий видят одну из возможных причин многих проявлений аутизма.
Митохондриальный комплекс – это часть клеток, ответственная за выработку энергии. В дисфункции митохондрий видят одну из возможных причин многих проявлений аутизма.
Сразу отмечу, что имеется просто гигантское количество данных о митохондриях, которые нуждаются в систематизации, обобщении и создании рабочей модели. Генетика, сложные химические реакции, движение электронов и проницаемость клеточных мембран – все эти вопросы имеют отношение к проблеме эффективности функционирования митохондрий у больных РАС.
У большого числа детей с аутизмом наблюдаются сходные симптомы, которые могут быть вызваны недостаточной энергией клеток:
- Низкая активность гладкой мускулатуры. Это особенно пагубно сказывается на работе органов ЖКТ, что приводит к рефлюксу (забросу содержимого желудка в пищевод), дискинезиям, запору и разрастанию дрожжевых грибков из-за долгого нахождения пищи в кишечнике.
- Общая слабость мышц. Это приводит к неуклюжести и плохой крупной моторике, что в свою очередь вызывает задержки в развитии.
- Снижение эффективности детоксикации организма. Выполняющие детоксикацию органы, такие как печень, требуют очень большого количества энергии. Если ее нет, то не все токсины будут переработаны. В результате организм отравляется все больше и больше, а поступающие с пищей и водой потенциально вредные вещества оказывают неожиданно сильное действие.
- Недостаточная подпитка энергией нервной системы. Это приводит к искажению сигналов в сенсорной системе. Когда нервные импульсы от мозга к мышцам проходят с большим трудом, это еще больше препятствует плавности и четкости движений.
- Снижение энергетического потенциала клеток головного мозга. Лишенный достаточной энергии мозг не сможет полноценно выполнять свои функции: производить и поглощать нейромедиаторы, выращивать новые клетки, избавляться от старых и передавать сигналы. Как результат могут наблюдаться проблемы с памятью и концентрацией.
Если ребенок демонстрирует перечисленные симптомы, то задача врача — проверить работу всех систем организма и решить, необходимы ли лабораторные исследования митохондриальной функции.
Можно предполагать, что не все состояния, сопровождающие РАС, являются необратимыми. Насыщение определенных дефицитов, к которым относится и дисфункция митохондрий, позволит предоставить организму ребенка ту энергию, которой ему так остро не хватает.
В результате мы сможет наблюдать улучшение работы почти всех систем организма, что позволит повысить обучаемость пациента и облегчит его интеграцию в общество.
Перечень факторов и веществ, приводящих к ухудшению работы митохондрий:
- инфекции, особенно вирусные;
- воспалительный процесс;
- высокая температура;
- обезвоживание;
- длительный голод;
- сильная жара или мороз;
- парацетамол;
- нестероидные противовоспалительные препараты;
- антипсихотические средства;
- антидепрессанты;
- противоэпилептические средства;
- анестезия;
- тяжелые металлы;
- инсектициды;
- сигаретный дым.
Родителям детей с РАС следует избегать следующих обстоятельств:
- Прием детьми алкоголя
- Нахождение детей рядом с сигаретным дымом
- Прием в пищу блюд с глутаматом натрия (почти все переработанные продукты, которые можно найти на полках супермаркета)
- Использование при высокой температуре парацетамола (принимайте вместо него ибупрофен, который более безопасен)
- Прием антипсихотических средств.
Вот список антибиотиков, которые ухудшают работу митохондриальной системы:
- Линезолид
- Рифампицин
- Тетрациклин
- Хлорамфеникол
- Имипенем
- Пенициллин
- Цефалоспорины
Вот антибиотики, которые можно считать безопасными (на данный момент согласно мнению биомедицинского сообщества):
- Хинолоны (ципрофлоксацин, левофлоксацин, офлоксацин)
- Макролиды (азитромицин, кларитромицин, эритромицин)
- Сульфаниламид ко-тримоксазол
Лечение митохондриальных расстройств лучше всего проводить с помощью:
- Кетогенной диеты (большое количество жиров, достаточное – белков, низкое – углеводов)
- Используя витамины и пищевые добавки, которые помогут выправить ситуацию:
- Витамин В12 в виде подкожных инъекций
- Комплекс витаминов группы В, например B-50. Это все витамины группы В по 50мг каждый
- S-аденозилметионин (SAM, адеметионин)
- L-цистеин и глутатион
- Коэнзим Q10
- Экстракт Гинко Билоба
- Комплексы антиоксидантов, в которые входят витамины А, С, Е и минералы селен и цинк
Важно понимать, что проблема митохондриальной дисфункции при аутизме требует больше исследований. Все, с чем мы имеем дело в настоящее время – это наши предположения, а не твердые знания.
В условиях эпидемии аутизма целесообразно было бы рекомендовать педиатрам постоянно следить за новой информацией в этой области. Только в таком случае родителям детей с аутизмом не придется действовать на свой страх и риск.
Авторы:
доктор Брайан Д. Уделл,
Флорида, США,
доктор Ричард Фрай,
Нью-Йорк, США
Перевод с дополнениями
Источник:
www.corhelp.ru
Митохондриальный синдром у ребенка
Митохондриальные болезни, и в частности митохондриальный синдром, который может проявляться поражениями ЦНС, сердца и патологиями скелетной мускулатуры, сегодня являются одним из важнейших разделов нейропедиатрии.
Митохондрия – что это?
Как многие помнят из школьного курса биологии, митохондрия представляет собой одну из клеточных органелл, чьей основной функцией является образование в процессе клеточного дыхания молекулы АТФ. Кроме того, в ней происходит окисление жирных кислот, проходит цикл трикарбоновых кислот и множество других процессов. Исследования, проведенные в конце XX века, позволили выявить ключевое значение митохондрий еще и в таких процессах, как чувствительность к лекарствам, старение клеток, апоптоз (запрограммированная гибель клеток). Соответственно, нарушение их функций приводит к недостаточности энергообмена, и как следствие, повреждению и гибели клетки. Особенно ярко эти нарушения проявляются в клетках нервной системы и скелетной мускулатуры.

Митохондриология
Генетические исследования позволили определить, что митохондрии обладают собственным геномом, отличным от генома ядра клетки, и нарушения в ее функционировании чаще всего связаны с происходящими там мутациями. Все это позволило выделить научное направление, изучающее заболевания, связанные с нарушениями функций митохондрий, – митохондриальные цитопатии. Они могут быть как спорадическими, так и врожденными, наследующимися по линии матери.

Симптоматика
Митохондриальный синдром может проявиться в различных системах человека, но наиболее выраженные проявления получают неврологические симптомы. Это связано с тем, что нервная ткань наиболее сильно подвержена влиянию гипоксии. Характерными признаками, позволяющими подозревать митохондриальный синдром при поражении скелетной мускулатуры, являются гипотония, неспособность адекватно переносить физические нагрузки, различные миопатии, офтальмопарез (паралич глазодвигательных мышц), птоз. Со стороны нервной системы могут быть инсультоподобные проявления, судороги, пирамидные расстройства, расстройства психики. Как правило, митохондриальный синдром у ребенка всегда проявляется задержкой развития или утратой уже полученных навыков, нарушениями психомоторики. Со стороны эндокринной системы не исключено развитие диабета, нарушений функций щитовидной и поджелудочной желез, задержка роста, полового созревания. Поражения сердца могут развиваться как на фоне патологий других органов, так и изолированно. Митохондриальный синдром в этом случае представлен кардиомиопатией.
Диагностика
Митохондриальные болезни чаще всего обнаруживаются в период новорожденности или на первых годах жизни ребенка. По данным зарубежных исследований, эта патология диагностируется у одного новорожденного из 5 тысяч. Для диагностики проводят комплексное клиническое, генетическое, инструментальное, биохимическое и молекулярное обследование. На сегодняшний день существует целый ряд методов, позволяющих определить эту патологию.

- Электромиография – при нормальных результатах на фоне резко выраженной мышечной слабости у пациента позволяет подозревать митохондриальные патологии.
- Лактоацидоз очень часто сопровождает митохондриальные болезни. Конечно, только его присутствия недостаточно для постановки диагноза, но измерение уровня молочной кислоты в крови после физической нагрузки может быть очень информативным.
- Биопсия скелетных мышц и гистохимическое исследование полученного биоптата является наиболее информативным.
- Хорошие результаты показывают одновременное применение световой и электронной микроскопии скелетных мышц.
Митохондриальная энцефалопатия (синдром Лея)
Одним из самых частых заболеваний детского возраста, связанных с генетическими изменениями митохондрий, является синдром Лея, впервые описанный в 1951 году. Первые признаки появляются в возрасте от одного до трех лет, но возможны и более ранние манифестации — на первом месяце жизни или, напротив, после семи лет. Первые проявления заключаются в задержке развития, снижении массы тела, потере аппетита, повторной рвоте. Со временем присоединяется неврологическая симптоматика – нарушение тонуса мышц (гипотония, дистония, гипертонус), судороги, нарушение координации.

Болезнь затрагивает органы зрения: развивается атрофия зрительных нервов, дегенерация сетчатки, глазодвигательные нарушения. У большинства детей заболевание постепенно прогрессирует, нарастают признаки пирамидальных расстройств, появляются расстройства глотания, дыхательной функции.
Одним из детей, страдающих такой патологией, стал Пугачев Ефим, митохондриальный синдром которому был диагностирован в 2014 году. Его мама, Елена, просит помощи у всех неравнодушных людей.
Митохондриальный синдром у ребенка
Прогноз, к сожалению, на сегодняшний день чаще всего бывает неутешительным. Это связано как с поздней диагностикой болезни, отсутствием детальной информации о патогенезе, тяжелым состоянием пациентов, связанным с мультисистемностью поражений, так и с отсутствием единого критерия оценки эффективности терапии.

Таким образом, лечение подобных заболеваний находится еще в стадии разработки. Как правило, оно сводится к симптоматической и поддерживающей терапии.
fb.ru
Актуальные вопросы лечения митохондриальных нарушений uMEDp
Среди ярких событий современной медицинской науки одно из значимых мест занимает появление области, которую все чаще называют «митохондриальной медициной». Она интересна со многих точек зрения. Во-первых, как и полагается новому систематическому объединению, она знаменует собой выделение новых патологических процессов и нозологических форм. Во-вторых, ее безусловное прикладное значение определяется наличием специфической, так называемой энерготропной, терапии.
Первичные и вторичные митохондриальные нарушения
Ключевая область этого раздела медицины – наследственные синдромы, в основе которых лежат мутации генов, ответственных за митохондриальные белки (синдромы Кернса – Сейра, MELAS (mitochondrial encephalomyopathy, lactic acidosis, and stroke-like episodes), MERRF (myoclonic epilepsy with ragged red fibers), Пирсона, Барта и др.). Однако класс состояний, характеризующихся митохондриальной недостаточностью, отнюдь не ограничивается этими «первичными» митохондриальными заболеваниями. Огромное количество болезней включает в себя нарушения клеточного энергообмена в качестве «вторичных» звеньев патогенеза: синдром хронической усталости, мигрени, кардиомиопатии, гликогенозы, заболевания соединительной ткани, диабет, рахит, тубулопатии, панцитопения, гипопаратиреоз, печеночная недостаточность и др. Особое значение для практической медицины имеет изучение указанных нарушений в связи с разработкой в этой области эффективных методов терапевтической коррекции.
К настоящему времени наиболее изучены дефекты, связанные с дефицитом различных комплексов дыхательной цепи и некоторых ферментов матрикса. Появляются клинические описания дефекта и других ферментов, например, наружной митохондриальной мембраны [1], так что до полного представления о тонких механизмах митохондриальной дисфункции еще далеко, и часто речь идет о недостаточности митохондриальной функции в целом. Ткани и органы зависят от митохондриальной активности в различной степени [2–5]. В их ряду на первом месте стоят нервные элементы, затем сердечная и скелетная мышечная ткани, почки, эндокринные железы и печень. Увеличение количества митохондрий и их структурные нарушения широко определяются в эндотелиальных клетках, гладких миоцитах и перицитах различных сосудов [6].
К болезням, причиной которых являются мутации митохондриальных генов, относятся синдромы Кернса – Сейра (нарушения со стороны глаз, атаксия, мышечная слабость, нарушения сердечной проводимости и другие симптомы), Пирсона (вялость, нарушения со стороны крови, кишечника, поджелудочной железы), MELAS (энцефаломиопатия, лактат-ацидоз, инсультоподобные эпизоды), оптическая нейропатия Лебера и многие другие. Причем описание таких синдромов продолжается и сейчас – так, в XXI веке уже опубликованы описания нескольких новых заболеваний.
Поскольку все митохондрии достаются новому организму только от цитоплазмы яйцеклетки, многие митохондриальные заболевания являются или спорадическими, или наследуются с нарушением законов Менделя – «внеядерное» или «цитоплазматическое» наследование по материнской линии. Распространенность этих болезней плохо изучена, но ясно, что они относятся к сравнительно редким наследственным заболеваниям. Отсюда и малый интерес широкого круга медиков к митохондриальной патологии.
Однако эти заболевания, хотя и создали ядро «митохондриальной медицины», отнюдь не составляют всего ее спектра. В последние годы внимание медиков начал все больше приковывать следующий факт: несмотря на наличие в митохондриях собственной ДНК, кодируются ею всего около 2% белков, используемых в митохондриях. Иными словами, 98% наследственной информации о митохондриальных белках заложено в ядре, а значит, количество наследственных митохондриальных нарушений, связанных с ядерными мутациями, должно быть несоизмеримо больше тех, о которых упоминалось выше. А известно их на сегодняшний день не так много (среди них различные формы младенческих миопатий, болезни Альперса, Лея, Барта, Менкеса, синдромы недостаточности карнитина, некоторых ферментов цикла Кребса и дыхательной цепи), что понятно – маленькую митохондриальную ДНК гораздо легче изучать, чем гигантский ядерный геном. Таким образом, значительное число таких состояний сейчас можно предсказать только гипотетически.
Интенсивное изучение признаков болезней клеточной энергетики приводит к еще более важному выводу: распространенность состояний, связанных с митохондриальной недостаточностью, не ограничивается наследственными синдромами, вызываемыми мутациями генов, непосредственно ответственных за митохондриальные белки. Умеренные нарушения клеточной энергетики могут не проявляться в виде самостоятельного заболевания, однако сказываются на характере течения других болезней. Широчайший круг других заболеваний включает в себя те или иные нарушения клеточной энергетики как вторичные звенья патогенеза.
Проведенные недавно в нашем институте исследования группы из 100 детей, поступивших в генетическую клинику с недифференцированными нарушениями физического и нервно-психического развития, показали, что у 49 из них отмечены нарушения клеточного энергообмена. Кроме того, нами выявлено влияние митохондриальной недостаточности на характер послеожогового рубцевания у детей, течение тонзиллитов, некоторых кардиологических, наследственных соединительнотканных, урологических и других заболеваний. Изучение этих патологических состояний и распространение информации о важности анализа энергетических дисфункций тем более актуально, что в настоящее время существуют действенные методы коррекции митохондриальной недостаточности, которые помогают в лечении перечисленных выше, не всегда истинно «митохондриальных» заболеваний.
Многие факторы окружающей среды и лекарственные препараты, вероятно, представляют собой существенную причину патологических изменений митохондрий. К этим факторам относится действие алкилирующих агентов (например, нитрозамины из окружающей среды), гидроксильных радикалов, высоких доз ультрафиолетового и ионизирующего излучений, лекарственных препаратов (бриостатин, азидотимидин), других химических агентов (аллоксан, цианиды, моноокись углерода и др.). Причиной митохондриального повреждения может быть и недостаточность некоторых микроэлементов, например селена. Во многих случаях чувствительность митохондриальной ДНК к действию повреждающих факторов окружающей среды в несколько раз выше по сравнению с чувствительностью ядерного генома. В целом область патогенетически целесообразного использования препаратов, воздействующих на митохондрии, включает в себя:
Лечение:
- митохондриальных болезней;
- «вторичных» (эндогенных и экзогенных) митохондриальных нарушений при других заболеваниях и состояниях.
- возможных осложнений различных заболеваний у пациентов с энергодефицитным диатезом;
- преждевременных патологических нарушений, связанных с пожилым возрастом.
- Реабилитационные мероприятия при различных хронических заболеваниях.
Кроме того, целесообразно применение энерготропных препаратов в качестве стимуляторов адаптационных процессов при заболеваниях, не несущих митохондриальной дисфункции в качестве патогенетической составляющей. Эта область наименее изучена, однако, по нашим данным, повышенная митохондриальная пролиферация может обладать важным адаптационным потенциалом, компенсирующим функциональный дефект при некоторых заболеваниях (например, при врожденных структурных миопатиях).
Общая характеристика энерготропных препаратов
Потенциальные возможности лечения митохондриальных болезней распределяются по трем основным направлениям [7]:
- Применение фармакологических препаратов и биологически активных добавок.
- Модификация макронутриентной поддержки, диетотерапия.
- Использование реабилитационных методов лечебной физкультуры.
Терапевтические подходы к лечению митохондриальных болезней подразделяются на семь категорий [8]:
- паллиативная терапия;
- удаление вредных метаболитов;
- применение искусственных акцепторов электронов;
- применение метаболитов и кофакторов;
- применение поглотителей кислородных радикалов;
- генная терапия;
- генетическое консультирование.
Большая группа лекарственных препаратов, которые принято называть метаболическими, пользуется чрезвычайной популярностью у широкого круга врачей. Можно без преувеличения сказать, что лекарства и нелекарственные средства, в разных количествах и соотношениях содержащие аминокислоты и пептиды, витамины и витаминоподобные вещества, коферменты и микроэлементы, применяются во всех областях медицины и по любому поводу. Такая популярность, очевидно, может объясняться как их эффективностью при лечении разнообразных патологических состояний, так и относительной безвредностью. Это сочетание факторов приводит к тому, что врачу легче назначить тот или иной препарат «на всякий случай», чем разбираться в целесообразности такого назначения. В результате из-за бездумного применения, из-за отсутствия методологической базы страдает эффективность лечения, что, в свою очередь, часто порождает сомнение в его принципиальной результативности. Все это диктует необходимость создания рациональной концепции применения лекарственных средств, относимых к метаболическим [9].
Важная группа таких препаратов представлена так называемыми энерготропными средствами, то есть средствами, усиливающими интенсивность обмена энергии на клеточном уровне. Наибольшее значение в контексте настоящей статьи имеют препараты (в таблице представлены некоторые из них), воздействующие на процессы, происходящие в универсальных клеточных органеллах – митохондриях. Митохондрии выполняют много функций, однако их основная задача – образование молекул аденозинтрифосфата (АТФ) в биохимических циклах клеточного дыхания. Накопленная энергия в последующем используется в других участках клетки.
Нарушения функций митохондрий относятся к важнейшим (часто ранним) этапам повреждения клеток. Эти нарушения ведут к недостаточности энергообеспечения клеток, к нарушению многих других важных обменных процессов, к дальнейшему развитию клеточного повреждения, вплоть до гибели клетки. Для клинициста оценка степени митохондриальной дисфункции имеет существенное значение как для формирования представлений о сути и степени происходящих на тканевом уровне процессов, так и для разработки плана терапевтической коррекции патологического состояния. Степень выраженности патологического процесса в том или ином органе связана со степенью зависимости его тканевых элементов от эффективности аэробного окисления.
Несмотря на то что в основе митохондриальных заболеваний могут быть сотни первичных биохимических дефектов, основные изученные звенья патогенеза, на которых и основаны современные подходы к коррекции митохондриальной недостаточности, связаны с нарушением реакций окисления пирувата до ацетил-КоА с помощью пируватдегидрогеназного комплекса; окисления ацетил-КоА до углекислого газа и образования восстановленных носителей электронов NADH и FADh3; реокисления восстановленного коэнзима Q ферментами электронно-транспортной цепи внутренней митохондриальной мембраны; транспорта свободных жирных кислот через мембрану митохондрии в виде эфиров карнитина; окислительного дезаминирования аминокислот с последующим поступлением их углеродного скелета в цикл Кребса; перекисного окисления и образования свободных радикалов.
Оценка достоверной эффективности энерготропных препаратов при митохондриальных болезнях сложна по многим причинам [7]. Вариабельность комплексных фенотипов затрудняет сравнение даже двух отдельно взятых больных с одним и тем же заболеванием. Поражение различных органов усложняет сравнительную оценку эффективности результата в целом. Большой проблемой является отсутствие четких критериев оценки динамики заболевания, наиболее выраженные признаки которого – это такие спорадические события, как инсультоподобные эпизоды или судороги.
Все это во многом объясняет тот факт, что, проанализировав в огромной работе 1335 источников о лечении митохондриальных болезней, Джералд Пфеффер (G. Pfeffer) и соавт. [7] смогли отобрать только 12 исследований, строго соответствующих критериям рандомизированного клинического исследования, причем в большинстве случаев они касались воздействия на нервно-мышечные проявления митохондриальных заболеваний с возможностью долговременной оценки таких признаков, как мышечная сила.
Проблема выбора дозы энерготропных препаратов
Сложность проблемы определяется, в частности, двумя факторами: во-первых, бытующим требовательным ожиданием заместительного эффекта при терапии митохондриальных болезней, а во-вторых, недоверием многих клинических биохимиков и фармакологов к возможности легкого введения тех или иных органических молекул внутрь митохондрии. Исходя исключительно из подобных теоретических соображений, ставятся, например, под сомнение как обоснованность применения янтарной кислоты, одного из ключевых метаболитов митохондрий, так и достоверность наблюдаемых позитивных эффектов этого препарата. Однако недавними исследованиями М.Н. Кондрашовой и сотрудников ее школы показано, что терапевтический эффект янтарной кислоты основан не на заместительном принципе, а на сигнальном. Таким образом, чтобы получить эффект, совершенно не нужно заполнять все митохондрии во всех клетках организма янтарной кислотой путем искусственного введения в больших количествах, достаточно назначить микродозы (5–10 мг/кг/сут). В нашей работе, используя новые диагностические приемы с применением транскутанного мониторирования рО2 и рСО2, мы выявили наличие подобного эффекта у L-карнитина. Вполне вероятно, что подобный же принцип может быть применен и к другим лекарственным веществам, используемым в терапии полисистемных нарушений цитоэнергетики.
Кроме того, в настоящий момент недоверие к возможности введения тех или иных молекул в митохондрию значительно поколеблено благодаря открытию большого и сложного комплекса транспортных систем, обслуживающих эти органеллы [10]. Нельзя не упомянуть о работах, показывающих эффективность применения энерготропных препаратов в достаточно высоких дозах. Так, в работе Р. Боулса [11] описана эффективность применения больших доз коэнзима Q10 (10 мг/кг/сут, но не более 200 мг в сутки) и L-карнитина (100 мг/кг/сут, но не более 2 г в сутки) в лечении синдрома циклической рвоты и других состояний, предположительно связанных с митохондриальными дисфункциями, – мигренозной головной боли, миалгии и синдрома множественных локальных болей.
В настоящее время нет единого понимания, какая длительность курса может быть оптимальной при энерготропной терапии. Естественно, во многих случаях (например, при лечении хронических заболеваний) необходимо достаточно длительное лечение, особенно если принимать во внимание вероятность заместительного механизма действия. Однако, исходя из практического опыта многих клиницистов и с учетом рекомендаций патофизиологов, длительное постоянное применение энерготропных препаратов (во всяком случае некоторых) не нужно. Целесообразнее применять схемы с периодическими назначением (1–3 месяца) и отменой (примерно на такой же или несколько больший период). Таким образом, совершенно актуально использование как высокодозовых и длительных, так и низкодозовых кратковременных схем применения энерготропных препаратов. Поскольку выявление сигнальных и заместительных составляющих эффекта для большинства энерготропных препаратов – дело будущего, выбор схемы применения до сих пор зависит от искусства врача.
Коэнзим Q10
Коэнзим Q (коэнзим Q10, убихинон, витамин Q10) – небольшая жирорастворимая молекула, непосредственно участвующая в транспорте электронов по дыхательной цепи митохондрий. Она свободно диффундирует в мембранном бислое и помимо электронов передает ферментному комплексу III также и протоны, которые захватывает из водной среды. Убихинону свойственны витаминоподобные функции. Будучи введенным в организм, он оказывает значительный антиоксидантный эффект, повышает продукцию АТФ и стабилизирует состояние кальциевых каналов.
Коэнзим Q – один из наиболее распространенных и эффективных энерготропных препаратов [12, 13]. В суточных дозах 300–1500 мг он эффективен при дефиците убихинона, дефектах второго и третьего ферментных комплексов дыхательной цепи, клинически выражающихся в синдроме MILS (maternally inherited Leigh syndrome), синдромах MERRF, MELAS и Кернса – Сейра. Его высокая клиническая эффективность в лечении атаксии Фридрейха и других нейродегенеративных заболеваний показана в нескольких работах [14].
Эффект высоких доз коэнзима Q10 (600 мг 2 раза в день перорально в течение двух месяцев) у больных с синдромом MELAS, прогрессирующей наружной офтальмоплегией и некоторыми другими формами митохондриальных болезней был изучен в двойном слепом плацебоконтролируемом исследовании [7, 15]. Было показано, что на фоне увеличения концентраций коэнзима Q10 в крови снижался уровень лактата при кратковременной, но не при долгосрочной нагрузке. Достоверных изменений других биохимических показателей отмечено не было.
Так же как и для многих других энерготропных препаратов, примеры эффективного применения коэнзима Q10 часто можно обнаружить в работах, посвященных терапии состояний, связанных с различными вторичными проявлениями тканевой гипоксии. Так, Д.М. Ароновым и соавт. [16] было проведено рандомизированное проспективное исследование коэнзима Q10 (препарат Кудевита®) в лечении пациентов с ишемической болезнью сердца с сердечной недостаточностью II–III функционального класса. Пациенты основной группы принимали препарат в дозе 150 мг/сут: по 2 капсулы (60 мг) утром и 3 капсулы (90 мг) вечером. Одновременно пациенты основной и контрольной групп получали стандартную терапию, показанную при данном заболевании. В процессе исследования не назначали препараты, влияющие на метаболизм миокарда, кардиопротекторы и антиоксиданты (триметазидин, мельдоний, оксиметилэтилпиридина сукцинат, инозин, аденозинтрифосфат, кокарбоксилаза, витаминные и иные метаболические средства). Длительность наблюдения составила 3 месяца.
В результате было показано, что лечение больных хронической сердечной недостаточностью на фоне ишемической болезни сердца и перенесенного инфаркта миокарда, находящихся на поликлиническом наблюдении, оказало за относительно небольшой отрезок времени существенное влияние на состояние сердечно-сосудистой системы. При этом препарат способствовал снижению диастолического артериального давления, достоверному улучшению физической работоспособности, сократительной функции сердца и гемодинамики по данным ультразвукового исследования (УЗИ), улучшению картины электрокардиограммы (ЭКГ), указывающей на положительные сдвиги в метаболизме миокарда, липидного профиля плазмы крови. Клинически отмечалось уменьшение количества и выраженности приступов боли в груди; уменьшалась частота приема нитроглицерина.
Препараты, содержащие коэнзим Q10, хорошо знакомы врачам разных специальностей, но до недавнего времени они не могли широко применяться в лечебной практике, так как были представлены в России в виде БАД. Кудевита® в настоящее время является единственным зарегистрированным в России безрецептурным лекарственным препаратом с активным действующим веществом убидекаренон (коэнзим Q10) и, несомненно, поможет более успешно лечить различные заболевания у детей.
L-карнитин
Карнитин – низкомолекулярное соединение, производное аминомасляной кислоты. В тканях млекопитающих присутствует только L-стереоизомер (левокарнитин), именно он биологически эффективен. Карнитин принимает непосредственное участие в катаболизме липидов, обеспечивая перенос длинноцепочечных жирных кислот в виде сложных эфиров (ацилкарнитинов) из цитоплазмы через наружную и внутреннюю митохондриальные мембраны в матрикс митохондрий. Внутри митохондрий транспортированные жирные кислоты подвергаются бета-окислению с образованием ацетил-КоА, который служит субстратом для цикла трикарбоновых кислот Кребса и последующего синтеза АТФ в организме. Наряду с этим окисление жирных кислот – главный путь кетогенеза, а кетоновые тела являются дополнительным энергетическим источником для периферических тканей и головного мозга.
Влияние карнитина на жировой обмен осуществляется также его участием в цитоплазматическом синтезе жирных кислот путем обратного переноса необходимых для этого ацетильных групп митохондриального ацетил-КоА через митохондриальную мембрану в цитоплазму. Помимо перечисленного, карнитин регулирует отношение «ацил-КоА/свободный КоА» в митохондриях. Связывая ацильный радикал, он высвобождает КоА и тем самым активирует интенсивность энергетического метаболизма в тканях. Исключительное значение карнитина становится очевидным в условиях высокого расходования энергетических ресурсов – при заболеваниях, усиленных физических или эмоциональных нагрузках, а также при недостаточном питании. После истощения запасов углеводов липиды становятся главным источником синтеза АТФ в организме.
Другая важная функция карнитина заключается в его способности образовывать соединения с различными органическими кислотами, являющимися промежуточными продуктами окислительных процессов. Данные вещества, накапливаясь в митохондриях и цитоплазме клеток, оказывают мембранотоксическое действие и ингибируют активность ряда ферментов. Выведение этих токсичных органических соединений из организма происходит через почки в виде ацилкарнитинов.
Левокарнитин высокоэффективен при лечении как первичных форм дефицита карнитина, так и широкого круга заболеваний, связанных со вторичным снижением его содержания в организме. Кроме того, занимая уникальное положение относительно митохондрии и стимулируя приток в нее энергосубстратов, карнитин является универсальным стимулятором тканевого энергообмена, что актуально не только в отношении компенсации энергодефицита, но и в отношении компенсаторной адаптации практически к любым структурно-функциональным дефектам. Данные об эффективности применения препаратов L-карнитина у больных митохондриальными заболеваниями достаточно многочисленны [13, 17], хотя чаще описывают их применение в комплексе с другими энерготропными средствами (см. ниже).
Отдельно следует упомянуть о важности применения L-карнитина при формах его наследственной недостаточности. В качестве примера упомянем работу Е.А. Николаевой и соавт. [18], в которой была показана эффективность применения препарата Элькар® в дозе 800 мг/сут с двухлетнего возраста у больного с первичным системным дефицитом карнитина. Динамическое наблюдение в течение 2 лет показало выраженное улучшение самочувствия и состояния мальчика на фоне терапии Элькаром. Ребенок и его родители не предъявляли жалоб, связанных с лечением препаратом, физическое развитие в возрасте 4 лет было средним (вырос на 19 см), мышечный тонус физиологическим. В результате лечения отмечены положительные изменения со стороны сердца, улучшились биохимические показатели крови.
Креатин
Моногидрат креатина представляет собой дополнительный источник энергии. В отличие от нестабильных форм – чистого креатина и фосфата креатина, – моногидрат креатина прекрасно всасывается и с успехом применяется в спортивной медицине. Отмечена его эффективность в лечении различных митохондриальных болезней: синдромов Лея, Кернса – Сейра, MELAS и др. [14, 19–21]. Однако существуют и противоположные данные, не подтверждающие его эффективность при митохондриальных болезнях [12].
В рандомизированном плацебоконтролируемом исследовании [7, 22, 23] эффективности моногидрата креатина, применяемого в течение трех недель (4–10 г в сутки) у больных синдромом MELAS и митохондриальной миопатией, отмечено достоверное увеличение мышечной силы и снижение уровня лактата после нагрузки. В двойных слепых плацебоконтролируемых исследованиях у больных с прогрессирующей наружной офтальмоплегией и митохондриальной миопатией [24] (20 г в сутки в течение месяца) и у больных с хронической прогрессирующей наружной офтальмоплегией и с синдромом Кернса – Сейра [25] (150 мг/кг в течение 6 недель) клиническая эффективность моногидрата креатина не выявлена.
Дихлорацетат
Дихлорацетат – активатор пируватдегидрогеназы – уже значительное время активно изучается в качестве возможного средства исправления митохондриальных функций [12]. В ряде работ показана его эффективность при лечении синдрома MELAS [26, 27], дефицита пируватдегидрогеназного комплекса [28], а также при исправлении митохондриальных функций в опухолевых клетках, ведущем к позитивному эффекту при лечении рака. Некоторые исследователи столь высоко оценивают его лечебный потенциал, что назначают этот препарат несмотря на то, что применение дихлорацетата (в частности в суточных дозах 25 мг/кг) может вызывать развитие периферических полиневропатий [29].
В двойном слепом плацебоконтролируемом исследовании эффективности дихлорацетата у больных с различными митохондриальными заболеваниями [7, 30] (50 мг/кг в сутки в течение недели двумя курсами с интервалом три месяца) было отмечено значительное снижение концентраций лактата, пирувата и аланина в крови (в покое и после нагрузки), а в мозге – значительное снижение соотношения «лактат/креатин» и повышение соотношений «холин/креатин» и «ацетиласпартат/креатин». В других подобных работах [28, 31, 32] была также отмечена нормализация уровня лактата (а в первых двух из этих работ – и пирувата) после приема дихлорацетата.
Янтарная кислота
Сукцинат – один из эффективных медиаторов транспорта электронов, успешно использующийся при острых нарушениях тканевого дыхания. В отношении хронических расстройств целесообразность его применения спорна, однако в научной литературе приводятся описания эффективности сукцината при недостаточности I дыхательного комплекса [33] и при синдроме MELAS (длительная монотерапия суточной дозой 6 г) [34].
Фолиевая кислота
Фолиевая кислота – водорастворимый витамин (В9), необходимый в первую очередь при активной репликации ДНК, то есть делении клеток. Однако описан выраженный положительный эффект этого витамина в суточной дозе 1–2,5 мг/кг при синдроме Кернса – Сейра [33].
L-аргинин
L-аргинин – незаменимая для детей аминокислота, снабжающая азотом систему NO-синтаз. В настоящее время растет число указаний [12] на эффективность применения L-аргинина при синдроме MELAS, в частности, в отношении терапии инсультоподобных эпизодов и сердечно-сосудистых нарушений. Так, например, с использованием позитронно-эмиссионной томографии показано, что применение L-аргинина эффективно при лечении кардиомиопатии при синдроме MELAS [35].
Другие вещества
Наряду с вышеперечисленными, к веществам, несомненно позитивно влияющим на клеточный энергообмен, относят витамин Е (альфа-токоферол), витамин С (аскорбиновая кислота), липоевую кислоту, глутатион, рибофлавин, тиамин и др. Однако в литературе, посвященной митохондриальным болезням, пока не находится четких доказательств их эффективности (по крайней мере, в моноварианте), хотя эти вещества часто используются в комплексных схемах энерготропной терапии.
В настоящее время в различных, в первую очередь экспериментальных, работах активно исследуются новые вещества, представляющие собой потенциально перспективные препараты для лечения митохондриальных заболеваний – антиоксиданты в соединении с трифенилфосфониевым катионом (митохинон, MitoVitE, MitoTEMPOL, MitoPBN, смесь Скулачева), тролокс, SS-пептиды (Szeto-Schiller peptides) [14, 36, 37], ресвератрол [38], препараты, влияющие на сборку дыхательных комплексов [39], оптимизирующие обмен кальция [40], активаторы митохондриального биогенеза [41] и др.
Комплексная энерготропная терапия
Спектр потенциальных патологических нарушений клеточного энергообмена чрезвычайно велик (повреждения различных звеньев цикла Кребса, дыхательной цепи, бета-окисления и др.). Хотя перечень энерготропных препаратов также достаточно широк, далеко не всегда имеется возможность выявить конкретное точечное повреждение митохондрий и точно подобрать подходящий лекарственный препарат. В связи с этим наиболее эффективными в широкой клинической практике могут быть комплексы энерготропных препаратов, обладающих способностью воздействовать сразу на несколько ключевых этапов клеточного энергообмена. При этом на первое место по значимости выдвигаются такие препараты, как L-карнитин, коэнзим Q10, цитохром С и их комплексы с другими вышеперечисленными лекарственными средствами [42–44]. Схемы лекарственной коррекции цитоэнергетической недостаточности у детей активно разрабатываются в настоящее время в Московском НИИ педиатрии и детской хирургии и в Российском национальном исследовательском медицинском университете им. Н.И. Пирогова.
Так, данные Е.А. Николаевой свидетельствуют о том, что при митохондриальных энцефаломиопатиях комплексная энерготропная терапия позволяет добиться существенного клинического эффекта во всех сферах проявления патологического процесса. Результатом лечения является нарастание массы тела, уменьшение выраженности сердечно-сосудистых нарушений, снижение частоты приступов рвоты, судорог, уменьшение выраженности проявлений энцефалопатии и миопатии, снижение утомляемости. Некоторые примеры свидетельствуют о том, что эффективность правильно подобранной энерготропной терапии даже при тяжелых «первичных» митохондриальных синдромах может быть поразительной. В качестве одного из примеров можно привести историю болезни ребенка с синдромом Барта – одним из таких синдромов, клиническая картина которого характеризуется задержкой роста и психомоторного развития, миопатией, кардиомиопатией, нарушениями со стороны крови. Многолетнее лечение комплексом препаратов, включавшим в себя коэнзим Q10, цитохром С, L-карнитин (Элькар) и некоторые другие, привело к тому, что в подростковом возрасте главной проблемой этого мальчика с тяжелым наследственным заболеванием стали попытки избежать постановки на воинский учет.
В двойном слепом плацебоконтролируемом исследовании [7, 14, 45] у больных с такими митохондриальными заболеваниями, как синдром Кернса – Сейра, синдром MELAS, хроническая наружная офтальмоплегия, оптическая нейропатия Лебера, митохондриальная нейрогастроинтестинальная энцефаломиопатия, а также с митохондриальными заболеваниями с редкими точковыми мутациями была проведена оценка двухмесячного комплексного применения креатина, коэнзима Q10 и липоевой кислоты. В этой работе выявлено статистически достоверное снижение уровней лактата в плазме крови и 8-изопростана – в моче. У больных с синдромом MELAS отмечено также нарастание массы тела (не за счет жировой ткани). Есть указания [46] на то, что в лечении митохондриальных болезней (как психических, так и соматических нарушений) могут быть эффективны комплексы, содержащие коэнзим Q10 (200–400 мг/сут) и рибофлавин (100–400 мг/сут), в некоторых случаях с добавлением витамина С (1000 мг/сут), витамина Е (400 МЕ/сут), карнитина (2000 мг/сут), креатина (5000 мг/сут) и магнезии (250–500 мг/сут).
При заболеваниях, включающих в свой симптомокомплекс «вторичную» митохондриальную недостаточность, также можно добиться улучшения качества жизни больных. Приведем весьма «эффектный» пример: у низкорослых детей c различными неэндокринными наследственными заболеваниями на фоне лечения энерготропными препаратами – L-карнитином (Элькар), коэнзимом Q10 и другими – удается достичь значительной стимуляции роста – до 6–7 см в год. При некоторых заболеваниях благодаря энерготропной терапии впервые была продемонстрирована возможность относительного успеха в лечении (например, при лечении синдрома Ретта и туберозного склероза отмечено улучшение когнитивных и эмоциональных функций). Существенный позитивный эффект применения энерготропных препаратов наблюдался и в ряде других отделений нашего института: урологическом (при комплексном лечении гидронефроза и гиперактивного мочевого пузыря), ожоговом центре (при реабилитации детей после ожогов), кардиологии (при лечении кардиомиопатий, миокардиодистрофии и нарушений сердечного ритма), пульмонологии (при лечении ряда хронических заболеваний легких) и др.
Применение средств метаболической коррекции позволило оказать существенное влияние на состояние здоровья детей дошкольного возраста с различными вариантами нарушения речевого развития (общее недоразвитие речи, дислалия, задержка психоречевого развития), у детей с соединительнотканной дисплазией и в группе так называемых часто болеющих детей. Эти работы выполнялись нами совместно со специалистами Российского государственного медицинского университета им. Н.И. Пирогова (группа С.О. Ключникова). В лечении этих групп детей были применены комплексы, включающие коэнзим Q10, L-карнитин (Элькар), ряд других энерготропных препаратов. Указанное лечение дети получали, как правило, длительно, в течение 2–3 месяцев, после чего они проходили повторное обследование, позволившее выявить существенную положительную динамику в состоянии здоровья. Отмечались минимизация предъявляемых жалоб, улучшение сна и аппетита, исчезновение или снижение выраженности ряда клинических признаков заболеваний, нормализация лабораторных показателей; возрастала выносливость в отношении физических и интеллектуальных нагрузок.
Заключение
Все вышесказанное свидетельствует о необходимости научно-прикладных разработок, направленных на создание современных принципов энерготропного лечения (по отработке состава энерготропных комплексов, тщательному подбору доз активных веществ, определению оптимальных схем назначения, в том числе с учетом хронобиологических ритмов). Приведенные выше примеры свидетельствуют о необходимости именно комплексного использования таких средств. Однако при каждой нозологической форме должны разрабатываться свои специализированные комплексы, включающие патогенетически наиболее значимые компоненты клеточного энергообмена (например, коэнзим Q10, L-карнитин, цитохром С, янтарная кислота и др.).
umedp.ru
НАДХ как новое средство для борьбы с митохондриальной дисфункцией > НАДХ
Материалы доклада А. Ф. Тарасевича «НАДH as a new treatment for mitochondrial dysfunction» в Зальцбурге в апреле 2018 г.
Каждый из нас, находящийся в этом зале это удивительным образом устроенная, но абсолютно индивидуальная биохимическая фабрика, в которой одномоментно протекает более 10 миллионов биохимических реакций. Каждый из нас – это организм, состоящий из ста триллионов клеток; более 2,5 миллионов различных молекул, из которых более одного миллиона белков, 300 тысяч липидов и сотни тысяч других, простых и сложных соединений.

А вот с «химической точки зрения» наш организм имеет вполне конкретный и понятный состав. И большую часть в каждой клетке занимают три химических элемента: кислород, углерод и водород. Все остальные химические элементы лишь обслуживают взаимодействие «этого трио жизни».
Постоянное поддержание константы этих основных химических элементов на протяжении нашей жизни и является основой самой жизни. А нарушение этого равновесия приводит к заболеваниям и смерти.
Итак. Водород, кислород и углерод – вот основные игроки периодической системы химических элементов, которую открыл Д.И. Менделеев, вокруг которых и сформировалась жизнь на этой планете. И именно в такой последовательности они важны для получения энергии и поддержания жизни в любом живом организме.
А из всех возможных химических реакций для бесперебойного снабжения энергией каждой клетки, эволюционно была выбрана самая энергоемкая реакция – реакция дегидрирования. Только эта реакция позволяет получить максимальное количество энергии из минимально возможного количества субстратов. Именно эта реакция используется для запуска ракет в космос. И именно эта реакция является основа любого взрывного вещества.
 Реакция дегидрирования
Реакция дегидрирования 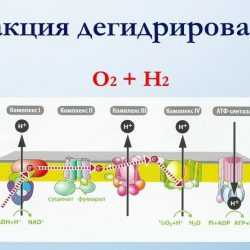 Реакция дегидрирования
Реакция дегидрирования  Реакция дегидрирования
Реакция дегидрированияНо почему же тогда мы не взрываемся? Дело в том, что в организмах всех живых существ, эта реакция растянута как во времени, так и в пространстве. И это все происходит на ферментных дыхательных комплексах митохондрий, расположенных последовательно на внутренней мембране митохондрий, где и разворачивается главная биохимическая реакция эволюции, в результате которой и образуется энергия для жизни каждого живого существа на этой планете.
Хочу напомнить всем первый закон термодинамики – Энергия вселенной не может ни создаваться, ни исчезать. Энергия вселенной постоянна. Она может превращаться из одной формы в другую. Таким образом, энергия пищи и энергия кислорода в реакции дегидрирования (энергия взрыва) на ферментных комплексах дыхательной цепи, расположенных на внутренней мембране митохондрий, превращается в «энергетическую валюту организма», в молекулы АТФ.
«Срок жизни» одной такой молекулы не более 5 сек. Практически сразу после синтеза она распадается, на АДФ и фосфат, отдавая выделившуюся энергию клетке для осуществления жизнедеятельности. Затем молекула АДФ возвращается в цитозоль митохондии для того, чтобы вновь присоединить фосфат, то есть запастись энергией и вновь передать эту энергию нуждающимся компартментам (органеллам) клетки. За одну минуту каждая молекула может сделать минимум десять таких превращений. А за сутки, каждый из нас синтезирует и тратит от 40 до 60 кг АТФ. Как это ни странно, но ни эволюция, ни Бог – не предусмотрели в организме живых существ отдельного органа, который бы отвечал за образование и обеспечение энергией все те миллионы биохимических реакций, которые происходят в наших организмах в настоящий момент. Поэтому клетка вынуждена была решать эту задачу самостоятельно, что и привело к симбиозу между бактериями, которые сейчас называются митохондриями, и древней ядерной клеткой. Этот великий симбиоз и привел к зарождению жизни на этой планете два с половиной миллиарда лет назад. Количество митохондрий в клетках различно – от 10 до 10.000 штук. Масса митохондрий 3-4 кг.
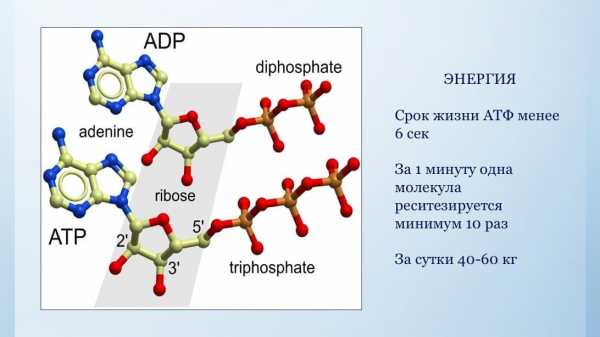
Для поддержания жизни каждой клетки необходима энергетическая валюта – АТФ, которая синтезируется из макроэргов пищи (жиров, белков и углеводов) при взаимодействии с кислородом. И большая часть этих взаимодействий происходят в митохондриях – энергетических станциях клетки. Но, к сожалению, с возрастом происходят нарушения в митохондриях, что снижает их производительность в производстве АТФ, что неминуемо отражается на здоровье и приводит к старению, болезням и смерти.

Что же происходит с возрастом в организме человека? Теория старения, которая носит название свободно радикальная теория, предложенная Денхамом Харманом и которой уже известна почти 70 лет, и, с каждым годом только пополняется все новыми данными, говорит о накоплении повреждений в организме и в митохондриях с возрастом. А теперь, давайте посмотрим на эти процессы с точки зрения энергообразования, то есть эффективности работы митохондрий прежде всего по производству АТФ.

Итак. На всех трех этапах катаболизма происходит снижение эффективного соотношения поставки в митохондрии макроэргов в виде моносахаридов (глюкозы), жирных кислот и аминокислот и кислорода.

Первый этап катаболизма, во время которого белки, липиды и углеводы пищи превращаются в моно вещества, с возрастом подвергается следующим изменениям. Нарастающая ферментопатия и возрастные нарушения (снижение) образования ферментов пищеварительной приводят к тому, что уже на этом этапе нарушается поставка макроэргов для получения энергии.

Дальше больше. Возраст зависимое тотальное повреждение микробиоты, сопровождающееся снижением коменциальной микрофлоры и ростом патогенной, лишь только дополняет первую – пищеварительную проблему, автоматически запуская другие патологические механизмы развития возрастных заболеваний. Совершенно недавно обнаруженная и доказанная взаимосвязь между митохондриальным пулом организма хозяина и микробиотическим пулом тонкого кишечника. Доказано, что повреждение последнего приводит к изменениям в работе митохондрий всего организма. Эти изменения происходят как на уровне угнетения активности первого и второго ферментных комплексов дыхательной цепи, так и в виде резкого уменьшения концентрации НАД+/НАДХ в цитозоле митохондрий.

Это, в свою очередь, очень быстро отражается на проницаемости эпителия тонкого кишечника, как главного «защитника» организма от агрессии окружающей среды. Даже незначительное снижение оксигенации эпителия тонкого кишечника, возникающая вследствие снижения капиллярного кровоснабжения, и, как следствие, нарастающей возраст зависимой тканевой гипоксии и увеличения эндотоксической нагрузки на эти клетки, мгновенно отражается на активности и эффективности работы митохондрий в этих клетках. А снижение концентрации НАД+/НАДХ и, как следствие, продукции АТФ в этих клетках резко снижает эффективность эпителиального барьера тонкого кишечника. Ведь через пищу мы больше всего контактируем с окружающим миром. За свою жизнь, каждый из нас, съедает до 70 тонн пищи, которая является чужеродным патогенным и антигенным материалом с точки зрения нашей иммунной системы. И границей, отделяющей нашу внутреннюю постоянную среду от внешнего мира, является эпителий тонкого кишечника, толщиной в одну клетку, с жизненным циклом в четыре дня. Постоянная «пищевая агрессия» приводит к повреждению столь тонкого защитного слоя, которая проявляется синдромом раздраженного кишечника или синдрома протекающей кишки.
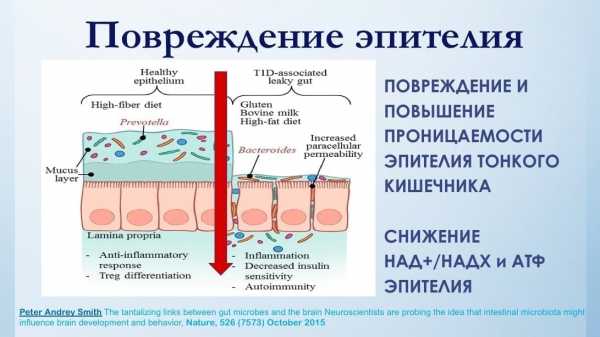
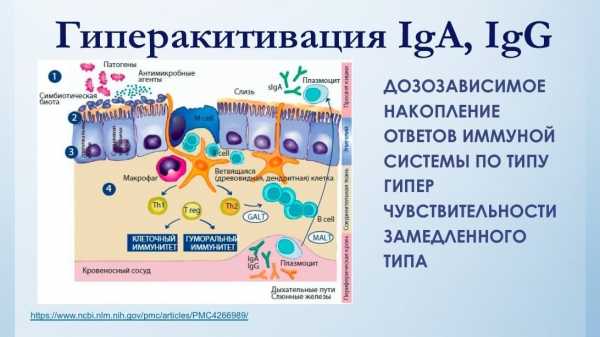
И не удивительно, что следствием этого является повышенная ответная иммунная реакция, а именно ее гуморальной части в виде патологически избыточного производства антител, особенно IgG, которая пытается нейтрализовать патологическую проницаемость продуктов из тонкого кишечника в кровеносное русло. Такое состояние слизистой тонкого кишечника, растянутое на годы, приводит к истощению и последующему срыву работы иммунной системы, которая проявляется в виде аутоиммунных заболеваний.
На втором и третьем этапах катаболизма возникают следующие возраст зависимые повреждения и «препятствия» к адекватному потребностям производству АТФ: это и прогрессирующее во времени доза зависимое повреждение межклеточного матрикса, прежде всего продуктами жизнедеятельности микробиоты тонкого кишечника, известного как эндотоксины и за счет гликирования белков матрикса.

Также происходит повреждение мембран самих клеток, возникающие как следствие активации перекисного окисления липидов, как следствие избыточного образования ROS в митохондриях. Инсулинорезистентность, как защитная реакция клетки на постпраниальную гипергликемию вносит свой вклад в развитие па
nadh.ru
Митохондриальная паталогия. — запись пользователя Milaya (Milasya) в сообществе Особенные дети, особенные семьи в категории Аутичный спектр
http://www.scipub.org/fulltext/ajbb/ajbb42208-217.pdf
Аннотация. Классическая болезнь митохондрий обнаруживается у некоторой части пациентов с аутизмом и обычно вызвана генетическими аномалиями или нарушениями респираторного пути митохондрий. Однако, во многих случаях аутизма, обнаруживаются признаки Митохондриевой Дисфункции (МД) без классических проявлений, ассоциируемых с митохондриевой болезнью. МД часто встречается у пациентов с аутизмом и проявляется менее выраженными симптомами. Она не проявляется явной митохондриевой патологией в образцах мышечной биопсии, несмотря на объективные проявления пониженного функционирования митохондрий. Этадисфункция вносит свой вклад во многие диагностические симптомы и множественные заболевания, наблюдаемые при аутизме, включая: когнитивные проблемы, проблемы с речью, анормальный энергетический метаболизм, хронические желудочо-кишечные проблемы, нарушения оксидации жирных кислот, и повышенный оксидативный стресс. МД и оксидативный стресс могут также объяснить повышенное соотношение мальчиков по сравнению с девочками среди аутистов из-за увеличенной уязвимости мужчин к этимдисфункциям. Биомаркеры митохондриевой дисфункции были установлены, однако мало используются, несмотря на доступные терапевтические методы лечения. Ввод биологически активных добавок для уменьшения оксидативного стресса совместно с элементами, поднимающими глутатион, а также ГБО (гипербарическая оксигенация) являются логическим подходом. Основная патофизиология и аутические симптомы могут улучшиться или прекратить ухудшаться, как только будет введено эффективное лечение МД.Решила здесь повторить состав мито-коктейля, чтобы не потерять опять:
Состав мито-коктейля:
CoQ10
Carnitine
Vitamin E
B50 (комплекс всех В-витаминов по 50мг каждый)
Vitamin C
Zinc
Selenium
Удивительно, но у нас, как и у Даны, добавка наконец последнего игредиента этого набора (у нас это был Co-Q10) действительно привело к хорошим результатам. В поведении, энергии.
PS Мито-коктейль — термин, введенный Даной, но вовсе не обязательно все ингредиенты смешивать в одном стаканчике. Главное — просто все их обеспечить, и не страшно, есдли что то будет даваться утром, а другое — вечеромот меня. дана — это американская мама, которая не вдав ни одного анализа восстановила полностью 2-х сыновей, а третий (боюсь соврать ), что-то в 15 лет развит на 10-11, а был в ооочень тяжелом состоянии.
www.babyblog.ru
