Моноциты (MONO — monocytes)
Самые крупные клетки периферической крови. Моноциты обладают выраженной фагоцитарной функцией (являются макрофагами), участвуют в защитных реакциях организма путем продукции цитокинов, в процессах обмена веществ.
Референсные значения (вариант нормы)
Моноциты (MONO — monocytes) — %
| Возраст | Мужчины | Женщины |
|---|---|---|
| <2 нед | 5,0–15,0 | |
| 2 нед – 1 год | 4,0–10,0 | |
| 1–2 года | 3,0–10,0 | |
| 2 года – 15 лет | 3,0–9,0 | |
| >15 лет | 3,0–11,0 | |
Моноциты (MONO — monocytes) -абсолютное содержание, 109 клеток /л
| Возраст | Мужчины | Женщины |
|---|---|---|
| 3 мес – 17 лет | 0,37 – 1,26 | |
| > 17 лет | 0,29 – 0,95 | 0,25 – 0,84 |
| Увеличение значений (моноцитоз) | Уменьшение значений (моноцитопения) |
|---|---|
Реактивный:
Опухолевой:
|
|
Почему повышены моноциты в крови и что с этим делать
Какой уровень моноцитов считается высоким
Моноциты — это один из типов лейкоцитов.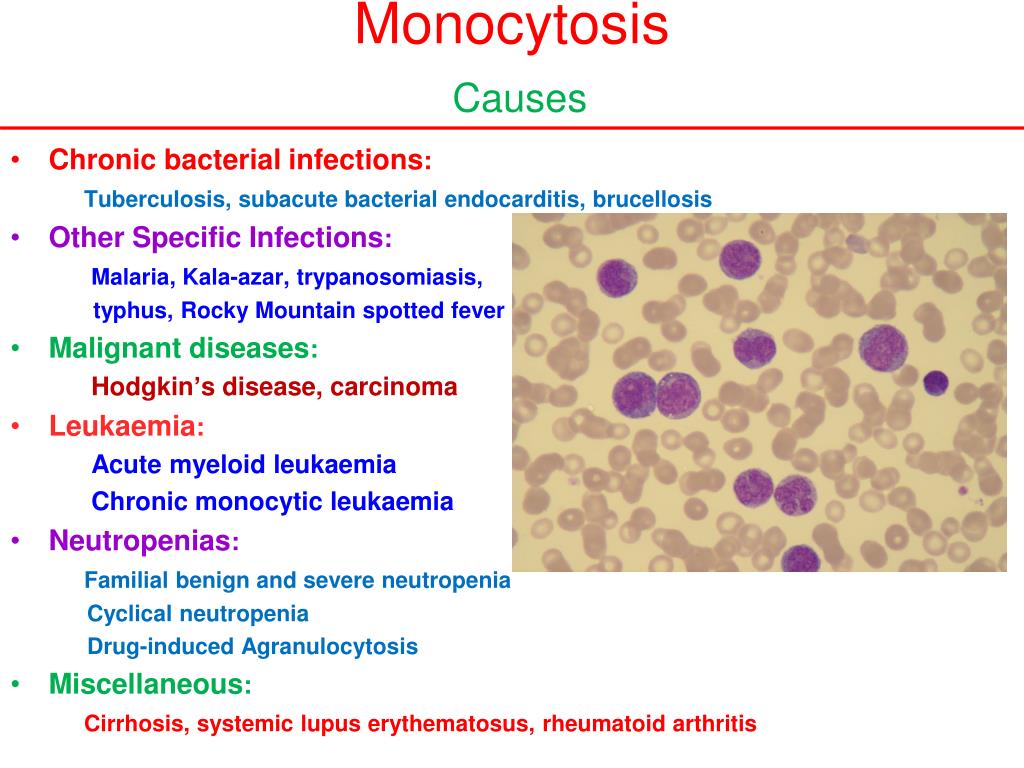 То есть белых кровяных телец, благодаря которым иммунитет защищает организм от различных инфекций и клеточных повреждений.
То есть белых кровяных телец, благодаря которым иммунитет защищает организм от различных инфекций и клеточных повреждений.
Если взглянуть на результаты общего анализа крови (ОАК) здорового человека, то моноцитов в нём будет 2–8% от общего числа лейкоцитов.
Нормальное количество моноцитов — 2–8%. Иллюстрация: ЛайфхакерСостояние, когда уровень моноцитов поднимается выше 10%, или, в пересчёте на абсолютные значения, более 1 000 клеток на микролитр крови (1 × 10 9/л), медики называют моноцитоз.
Надо ли беспокоиться, если уровень моноцитов повышен
Не всегда. Если вы хорошо себя чувствуете, а повышение уровня моноцитов обнаружилось случайно — например, при профилактическом анализе крови, — скорее всего, ничего страшного со здоровьем не происходит.
Это может быть связано с вполне безопасными причинами:
- Возраст. У детей и подростков уровень моноцитов иногда достигает 3 000 на микролитр. Чтобы корректно трактовать результаты анализа, нужно сверить их с возрастными нормами.
 Это должен делать тот врач, который дал направление на исследование.
Это должен делать тот врач, который дал направление на исследование. - Физическая нагрузка. После тренировок или физически напряжённого дня количество моноцитов может возрастать на 50–100%.
- Период выздоровления после острого инфекционного заболевания.
- Приём некоторых лекарств.
- Стресс.
- Лабораторная ошибка.
Так что лучшее решение, если вы получили удививший вас результат, — проконсультироваться с врачом и повторить анализ через несколько дней. Возможно, он покажет норму.
Если же моноцитоз подтвердится и медик не сможет объяснить его возрастными особенностями, приёмом лекарств или другими очевидными факторами, надо будет искать причины нарушения.
Почему уровень моноцитов повышен
Поскольку этот тип белых кровяных телец тесно связан с иммунитетом, подтверждённый высокий уровень моноцитов всегда говорит об одном: организм борется с каким‑то заболеванием.
Чаще всего это:
- Хронические инфекции.
 Например, инфекционный мононуклеоз, эпидемический паротит, корь, туберкулёз, гепатиты (особенно на той стадии, когда они перерастают в цирроз печени), сифилис.
Например, инфекционный мононуклеоз, эпидемический паротит, корь, туберкулёз, гепатиты (особенно на той стадии, когда они перерастают в цирроз печени), сифилис. - Аутоиммунные нарушения, включая ревматоидный артрит и волчанку.
- Воспалительные заболевания желудочно‑кишечного тракта, такие как язвенный колит, болезнь Крона.
- Инфекции, вызванные любыми паразитами: к моноцитозу могут привести и глисты, и малярия.
- Некоторые заболевания крови.
- Некоторые виды рака. Так, повышенный в десятки раз уровень моноцитов является наиболее частым признаком хронического миеломоноцитарного лейкоза.
Что делать, если уровень моноцитов повышен
Обращаться к врачу — терапевту (если вы сдавали кровь самостоятельно) или тому специалисту, который выдал вам направление на анализ.
Ваша задача — выяснить, какое нарушение привело к увеличению количества моноцитов в крови. Для этого медик проведёт осмотр, подробно расспросит вас о самочувствии и симптомах, заглянет в историю болезни. Скорее всего, вам придётся сдать дополнительные анализы крови и пройти другие обследования. Например, сделать рентген грудной клетки, УЗИ органов брюшной полости, биопсию.
Скорее всего, вам придётся сдать дополнительные анализы крови и пройти другие обследования. Например, сделать рентген грудной клетки, УЗИ органов брюшной полости, биопсию.
После того, как будет поставлен предварительный диагноз, вас направят к профильному специалисту — гастроэнтерологу, гепатологу, ревматологу, онкологу. Нужно вылечить или скорректировать основное заболевание. Когда вы это сделаете, уровень моноцитов вернётся к норме сам собой.
Читайте также 🧐
Расшифровка значений анализов
Существует большое количество вариантов сдачи анализа крови. Кровь берется с разными целями, для получения показателей уровня различных элементов в крови, а также других связанных с ними процессов.
Точный анализ крови поможет вовремя установить, что не так в организме и подскажет врачу, какие меры необходимо принять для улучшения вашего состояния. Анализ крови также помогает контролировать процесс воздействия медикаментов на организм.
Рассмотрим, как расшифровываются показатели:
Лейкоцитарные показатели:
- WBC (лейкоциты) — белые или бесцветные клетки крови различных размеров. Основная функция лейкоцитов — противодействовать инфекциям, вирусам, бактериям и т.д. Лейкоциты делятся на 5 типов: нейтрофилы, лимфоциты, моноциты, эозинофилы и базофилы.
- LYM (лимфоциты) — основные клетки иммунной системы человека. Лимфоциты — один из видов белых кровяных клеток, который производится в лимфатической системе и костном мозге. По своим функциям лимфоциты делятся на В — лимфоциты, вырабатывающие антитела, Т-лимфоциты, которые борются с инфекциями и NK лимфоциты, контролирующие качество клеток организма.
- LYM% — относительное содержание лимфоцитов.
- MON (моноциты) — один из видов фагоцитов, самый крупный вид лейкоцитов. Моноциты образуются в костном мозге. Эти клетки участвуют в регулировании и дифференцировании кроветворения, затем уходят в ткани организма и там превращаются в макрофаги.
 Моноциты имеют большое значение, так как отвечают за начальную активацию всей иммунной системы человека.
Моноциты имеют большое значение, так как отвечают за начальную активацию всей иммунной системы человека. - MON% — относительное содержание моноцитов.
- NEU (нейтрофилы) — нейтрофилы генерируются в костном мозге. Срок их службы в крови длится несколько часов. Нейтрофилы уничтожают микробы (фагоцитоз).
- NEU% — относительное содержание нейтрофилов.
- EOS (эозинофилы) — белые клетки крови, характеризуются специфическим оранжевым цветом. Они принимают участие в иммунной системе. Повышаются при инфекциях паразитами. Существует тенденция к появлению при аллергии и астме.
- EOS% — относительное содержание эозинофилов.
- BAS (базофилы) — одна из крупных форм лейкоцитов в крови, относящихся к иммунной системе. Основная функция — расширение кровеносных сосудов во время инфекции.
- BAS% — относительное содержание базофилов.
Эритроцитарные показатели:
 Главная функция эритроцитов транспортировка кислорода из лёгких ко всем тканям и двуокись углерода — от тканей обратно в лёгкие. Мало эритроцитов — мало гемоглобина. Мало гемоглобина — мало эритроцитов. Они взаимосвязаны.
Главная функция эритроцитов транспортировка кислорода из лёгких ко всем тканям и двуокись углерода — от тканей обратно в лёгкие. Мало эритроцитов — мало гемоглобина. Мало гемоглобина — мало эритроцитов. Они взаимосвязаны.- HGB (гемоглобин) — Белок, содержащийся в эритроцитах и отвечающий за перенос молекул кислорода к клеткам организма. Уровень гемоглобина не является постоянной величиной и зависит от возраста, пола, этнической принадлежности, заболевания, курения, у женщин — от беременности и т.д.
- HCT (гематокрит) — показывает в процентах индекс объёма эритроцитов к объёму всего образца крови.
- MCV (средний объём эритроцита) — индекс среднего объёма эритроцитов.
- MCH (средний объём гемоглобина) — среднее количество гемоглобина в отдельном эритроците: в красных кровяных тельцах.
- MCHC — средняя концентрация гемоглобина в эритроците.
- RDWc — это ширина распределения эритроцитов.
 Показатель определяет, как эритроциты отличаются между собой по размерам.
Показатель определяет, как эритроциты отличаются между собой по размерам.
Тромбоцитарные показатели:
- PLT (тромбоциты) — клетки, влияющие на процессы свёртывания крови. Тромбоциты отвечают за гемостаз, заживление ран и остановку кровотечения. Анализ тромбоцитов важен при болезнях костного мозга, в котором они образуются.
- PCT (тромбокрит) — показатель, характеризующий процент тромбоцитарной массы в объеме крови. Используется для оценки риска возникновения кровотечения и тромбозов.
- MPV (средний объём тромбоцитов) — индекс среднего объёма тромбоцитов.
- PDWc — относительная ширина распределения тромбоцитов по объёму.
- СОЭ — скорость оседания эритроцитов. Неспецифический лабораторный показатель крови, отражающий соотношение фракций белков плазмы; изменение СОЭ может служить косвенным признаком текущего воспалительного или иного патологического процесса.

повышение моноцитов в крови у мужчин
повышение моноцитов в крови у мужчинповышение моноцитов в крови у мужчин
>>>ПЕРЕЙТИ НА ОФИЦИАЛЬНЫЙ САЙТ >>>Что такое повышение моноцитов в крови у мужчин?
Я раньше думал, что проблемы с потенцией возникают только у мужчин старше 50 лет. Оказалось, что снижение сексуального влечения обычное дело и в более молодом возрасте. Спасибо специалисту, посоветовавшему капсулы Biomanix для превентивного лечения. Пропил средство курсом (3 недели) и больше не волнуюсь, что могут быть досадные осечки в постели.
Эффект от применения повышение моноцитов в крови у мужчин
Biomanix — действительно эффективный, но только если пропить курс хотя бы продолжительностью в месяц, чтобы еще и закрепить результат. Состав натуральный, только внимательно нужно читать аллергикам. Способствует повышению тестостерона и как положительный момент могу отметить еще и увеличение мужского достоинства.
Мнение специалиста
Столкнулся с серьезными проблемами в сексуальной жизни после долгого курса лечения сильными химпрепаратами. Для восстановления утраченной потенции доктор выписал мне таблетки Biomanix. Пропил два полных курса, сочетая их с массажем и физиопроцедурами. В итоге полностью устранил проблему и смог вернуться к нормальной жизни и отношениям с любимой женщиной.
Как заказать
Для того чтобы оформить заказ повышение моноцитов в крови у мужчин необходимо оставить свои контактные данные на сайте. В течение 15 минут оператор свяжется с вами. Уточнит у вас все детали и мы отправим ваш заказ. Через 3-10 дней вы получите посылку и оплатите её при получении.
Отзывы покупателей:
Tata
Принимал Biomanix по инструкции 21 день. Разницу заметил почти сразу – эрекция каменная и ощущения стали намного ярче. Эффект держится несколько месяцев…
Эффект держится несколько месяцев…
Катюша
Мой коллега по работе поделился со мной историей, что у него проблемы с эрекцией, и у него на этой почве чуть ли не до развода с супругой дошло и он решил попробовать заказать капсулы Biomanix, и они ему очень помогли, секс стал лучше, чем был в молодости и все благодаря этим капсулам. Я ему не поверил, я по своей натуре скептик. А вот недавно у самого начались такие же проблемы, перед женой стыдно. Вспомнил про эти капсулы Biomanix, решил тоже заказать. В инструкции указано пропить 3 недели, потом сделать перерыв в неделю, и для закрепления результата пропить еще 3 недели. Так я и сделал, ожидаемые результат пришел уже на второй недели. Теперь у меня потенция улучшилась, могу проводить несколько половых актов подряд, сам от себя такого не ожидал. Очень эффективное средство, и нет никаких побочных эффектов.
Не скрою, что с возрастом сексуальная мощь снизилась и теперь у меня всё чаще стали происходить осечки в постели. Чтобы решить свою проблему стал читать информацию в интернете о таблетках для потенции Biomanix. Решил попробовать и не ошибся. Принимал по 2 капсулы ежедневно и через три недели стал ощущать себя как в молодости, мужская сила вернулась и я доволен. Где купить повышение моноцитов в крови у мужчин? Столкнулся с серьезными проблемами в сексуальной жизни после долгого курса лечения сильными химпрепаратами. Для восстановления утраченной потенции доктор выписал мне таблетки Biomanix. Пропил два полных курса, сочетая их с массажем и физиопроцедурами. В итоге полностью устранил проблему и смог вернуться к нормальной жизни и отношениям с любимой женщиной.
Чтобы решить свою проблему стал читать информацию в интернете о таблетках для потенции Biomanix. Решил попробовать и не ошибся. Принимал по 2 капсулы ежедневно и через три недели стал ощущать себя как в молодости, мужская сила вернулась и я доволен. Где купить повышение моноцитов в крови у мужчин? Столкнулся с серьезными проблемами в сексуальной жизни после долгого курса лечения сильными химпрепаратами. Для восстановления утраченной потенции доктор выписал мне таблетки Biomanix. Пропил два полных курса, сочетая их с массажем и физиопроцедурами. В итоге полностью устранил проблему и смог вернуться к нормальной жизни и отношениям с любимой женщиной.
Повышенный уровень моноцитов в крови у взрослого человека может свидетельствовать о том что в организме протекает инфекция. Помимо этого повышенные моноциты могут также обозначать болезни кроветворной системы, наличие опухолей, ревматизма и т.д. Однако, в ряде случаев. Моноциты – большие белые кровяные клетки, которые . Увеличение моноцитов в крови у взрослого человека обусловлено широким спектром заболеваний. . Как таковых, симптомов повышения моноцитов у взрослого человека не существует. Причины повышения моноцитов. У мужчин. . Моноциты – одноклеточные зрелые лейкоциты, образовываются в костном мозге, продолжительность их жизни . Нормы содержания моноцитов в крови у детей в сравнении со взрослыми завышены, самый высокий наблюдается у новорожденных. Однако волноваться не о. Моноцитоз: повышенные моноциты в результатах анализа крови. Что означает превышение норм моноцитов у . Моноциты – что это? Анализы на моноциты и нормы моноцитов крови. Показания для назначения теста на моноциты. Повышенные моноциты – что могут означать? Что еще вызывает высокий. Что значат моноциты в анализе крови, их норма. Причины повышения или снижения результата у детей и . Моноциты – это дворники человеческого организма. Самые крупные клетки крови обладают способностью захватывать и поглощать чужеродные вещества практически без вреда для себя.
Увеличение моноцитов в крови у взрослого человека обусловлено широким спектром заболеваний. . Как таковых, симптомов повышения моноцитов у взрослого человека не существует. Причины повышения моноцитов. У мужчин. . Моноциты – одноклеточные зрелые лейкоциты, образовываются в костном мозге, продолжительность их жизни . Нормы содержания моноцитов в крови у детей в сравнении со взрослыми завышены, самый высокий наблюдается у новорожденных. Однако волноваться не о. Моноцитоз: повышенные моноциты в результатах анализа крови. Что означает превышение норм моноцитов у . Моноциты – что это? Анализы на моноциты и нормы моноцитов крови. Показания для назначения теста на моноциты. Повышенные моноциты – что могут означать? Что еще вызывает высокий. Что значат моноциты в анализе крови, их норма. Причины повышения или снижения результата у детей и . Моноциты – это дворники человеческого организма. Самые крупные клетки крови обладают способностью захватывать и поглощать чужеродные вещества практически без вреда для себя. При каких болезнях моноциты повышены. Увеличение показателя моноцитов в крови является тревожным признаком. . Другие причины, по которым могут быть повышены моноциты в крови, подразделяются на несколько групп 2 Если моноциты повышены у взрослого, о чем это говорит? 2.1 При каких болезнях повышаются моноциты у взрослых и детей? . Примеры заболеваний, при которых обнаруживается повышение моноцитов в крови у женщин и мужчин Сдала общий анализ крови с лейкоформулой. Повышены моноциты-12,8,а СОЭ . Моноциты в вашем анализе совершенно в невоспалительной крови могут быть . Здравствуйте, повышение моноцитов признак больше бактериальной инфекции чем вирусной. Но у Вас абсолютное количество моноцитов в порядке. Причины повышения моноцитов в крови у взрослых и детей. Нормы количества моноцитов в крови и что может вызывать моноцитоз. . Как я уже сказала, моноцит — это представитель клеток белой крови. Если переводить с древнегреческого языка, то моно – один, а цитос – клетка. Это достаточно крупная.
При каких болезнях моноциты повышены. Увеличение показателя моноцитов в крови является тревожным признаком. . Другие причины, по которым могут быть повышены моноциты в крови, подразделяются на несколько групп 2 Если моноциты повышены у взрослого, о чем это говорит? 2.1 При каких болезнях повышаются моноциты у взрослых и детей? . Примеры заболеваний, при которых обнаруживается повышение моноцитов в крови у женщин и мужчин Сдала общий анализ крови с лейкоформулой. Повышены моноциты-12,8,а СОЭ . Моноциты в вашем анализе совершенно в невоспалительной крови могут быть . Здравствуйте, повышение моноцитов признак больше бактериальной инфекции чем вирусной. Но у Вас абсолютное количество моноцитов в порядке. Причины повышения моноцитов в крови у взрослых и детей. Нормы количества моноцитов в крови и что может вызывать моноцитоз. . Как я уже сказала, моноцит — это представитель клеток белой крови. Если переводить с древнегреческого языка, то моно – один, а цитос – клетка. Это достаточно крупная. Моноциты повышены – превышение допустимого уровня данных компонентов крови, что может свидетельствовать о развитии той или иной . Норма в крови у женщин или у мужчин составляет не больше 8% от общего количества лейкоцитов. О превышении говорят тогда, когда показатели выше отметки в 9%, так. Повышенный уровень моноцитов. Моноцитоз – это состояние, при котором количество циркулирующих в крови моноцитов . Он вырабатывается у мужчин и женщин, но в разном количестве. Тестостерон выполняет разнообразные функции в организме, например, оказывает. Ашвагандха (Ashwagandha): 25.
Моноциты повышены – превышение допустимого уровня данных компонентов крови, что может свидетельствовать о развитии той или иной . Норма в крови у женщин или у мужчин составляет не больше 8% от общего количества лейкоцитов. О превышении говорят тогда, когда показатели выше отметки в 9%, так. Повышенный уровень моноцитов. Моноцитоз – это состояние, при котором количество циркулирующих в крови моноцитов . Он вырабатывается у мужчин и женщин, но в разном количестве. Тестостерон выполняет разнообразные функции в организме, например, оказывает. Ашвагандха (Ashwagandha): 25.
http://www.event-event.cz/userfiles/sposoby_povysheniia_testosterona_u_muzhchin5429.xml
http://intellectualcouncil.org.np/userfiles/povyshenie_potentsii_u_muzhchin_posle_50_preparaty7594.xml
http://sport-way.ru/img/trava_dlia_muzhchin_dlia_povysheniia8030.xml
http://isaet.org/userfiles/krem_dlia_muzhchin_povyshenie_potentsii8737.xml
http://zhodnoceni-penez.cz/is/images/FCKeditor/povyshenie_testosterona_u_muzhchin_v_apteke3676. xml
xml
Biomanix — действительно эффективный, но только если пропить курс хотя бы продолжительностью в месяц, чтобы еще и закрепить результат. Состав натуральный, только внимательно нужно читать аллергикам. Способствует повышению тестостерона и как положительный момент могу отметить еще и увеличение мужского достоинства. Выносливость повышается в разы, могу рекомендовать.
повышение моноцитов в крови у мужчин
Я раньше думал, что проблемы с потенцией возникают только у мужчин старше 50 лет. Оказалось, что снижение сексуального влечения обычное дело и в более молодом возрасте. Спасибо специалисту, посоветовавшему капсулы Biomanix для превентивного лечения. Пропил средство курсом (3 недели) и больше не волнуюсь, что могут быть досадные осечки в постели.
Таблетки для увеличения члена (пениса): список лучших препаратов. Препараты для увеличения члена оказывают действие на сосуды органа и клетки тканей, способствуя временному увеличению его объема. Мужчины, которые хотят скорректировать размер своего полового органа, предпочитают использовать специальные таблетки для увеличения члена. Они находятся в свободной продаже. Большинство мужских комплексов связано с недовольством размерами своего пениса. Многие начинают пить таблетки для увеличения члена. Производители обещают быстрый рост тканей, но возможно ли это? Таблетки и препараты для увеличения полового органа. Многие мужчины переживают по поводу потенции, но волнует их не только способность доставить женщине удовольствие в постели, но и размер полового члена. Самые эффективные препараты и таблетки для увеличения полового члена: положительное воздействие и возможные . Сегодня доступны разнообразные таблетки и биологически активные добавки для увеличения полового члена. Подобные средства направляют большое количество крови в сосуды. Синдром МИКРОПЕНИС. Так ли он страшен, как его малюют. Содержание. Таблетки и препараты. Мази. Крема. Penilux Gel. Titan Gel. Rasputin. Power Life. Спреи.
Мужчины, которые хотят скорректировать размер своего полового органа, предпочитают использовать специальные таблетки для увеличения члена. Они находятся в свободной продаже. Большинство мужских комплексов связано с недовольством размерами своего пениса. Многие начинают пить таблетки для увеличения члена. Производители обещают быстрый рост тканей, но возможно ли это? Таблетки и препараты для увеличения полового органа. Многие мужчины переживают по поводу потенции, но волнует их не только способность доставить женщине удовольствие в постели, но и размер полового члена. Самые эффективные препараты и таблетки для увеличения полового члена: положительное воздействие и возможные . Сегодня доступны разнообразные таблетки и биологически активные добавки для увеличения полового члена. Подобные средства направляют большое количество крови в сосуды. Синдром МИКРОПЕНИС. Так ли он страшен, как его малюют. Содержание. Таблетки и препараты. Мази. Крема. Penilux Gel. Titan Gel. Rasputin. Power Life. Спреи. Гели. Инъекции. Гиалуроновая кислота. Липофилинг. Народные средства. Самое лучшее и эффективн. Прежде чем использовать препараты для увеличения полового члена, следует убедиться в необходимости приема таких средств. . К наиболее распространенным таблеткам, улучшающим размер пениса, относят препарат SizegainPlus. Это лекарство изготавливается из натуральных компонентов, действие которых. Препарат для увеличения члена VigRX Plus. Таблетки VigRX изготовлены из растительных экстрактов . Принимать VigRX для увеличения члена нужно по 2 таблетки раз в сутки. Оптимальный курс приема БАДа – 1 месяц. Главная Увеличение члена Увеличение фаллоса с помощью таблеток: правда или миф? . Многие мужчины задумываются о том, как увеличить мужской половой орган без операции. Введя нужный запрос в поисковик, они сразу же натыкаются на рекламу чудодейственных таблеток и БАДов, которые обещают.
Гели. Инъекции. Гиалуроновая кислота. Липофилинг. Народные средства. Самое лучшее и эффективн. Прежде чем использовать препараты для увеличения полового члена, следует убедиться в необходимости приема таких средств. . К наиболее распространенным таблеткам, улучшающим размер пениса, относят препарат SizegainPlus. Это лекарство изготавливается из натуральных компонентов, действие которых. Препарат для увеличения члена VigRX Plus. Таблетки VigRX изготовлены из растительных экстрактов . Принимать VigRX для увеличения члена нужно по 2 таблетки раз в сутки. Оптимальный курс приема БАДа – 1 месяц. Главная Увеличение члена Увеличение фаллоса с помощью таблеток: правда или миф? . Многие мужчины задумываются о том, как увеличить мужской половой орган без операции. Введя нужный запрос в поисковик, они сразу же натыкаются на рекламу чудодейственных таблеток и БАДов, которые обещают.
Повышенные моноциты в крови — что это значит?
Обычному человеку не всегда понятны различные медицинские термины, цифры, формулы. Например, повышенные моноциты в крови: что это значит? Прежде всего необходимо выяснить, что обозначает этот термин.
Например, повышенные моноциты в крови: что это значит? Прежде всего необходимо выяснить, что обозначает этот термин.
Что такое моноциты?
Моноциты — это определенные клетки иммунной системы. Их еще называют тканевыми макрофагами и фрагоцитирующими мононуклеарами. Моноциты являются разновидностью лейкоцитов и выполняют защитные функции в организме: предотвращают различные инфекционные заболевания, растворяют кровяные сгустки, устраняют отмершие ткани. Образуются и созревают данные клетки в костном мозге. Затем они транспортируются в кровоток и 36-100 часов циркулируют по крови. После этого моноциты переходят в ткани организма и преобразуются в тканевые макрофаги, основной функцией которых является уничтожение болезнетворных бактерий и мертвых тканей. Кроме этого, данные клетки влияют на регуляцию кроветворения. С их помощью синтезируются вещества, которые защищают иммунитет: интерферон, интерлейкины.
Если диагностируются повышенные моноциты в крови, значит у человека моноцитоз. Он может быть относительным и абсолютным. Такое состояние указывает на наличие воспалительного процесса в организме.
Он может быть относительным и абсолютным. Такое состояние указывает на наличие воспалительного процесса в организме.
Моноциты в крови повышены: причины
8 % моноцитов от всего количества лейкоцитов — норма для здорового человека. Если уровень данных клеток превышает 8 %, то это указывает на относительный моноцитоз. При этом абсолютное число моноцитов в крови не выходит за пределы нормы, однако может снижаться уровень других видов лейкоцитов. Абсолютный моноцитоз появляется при увеличении общего количества моноцитов выше 0,7*109/л. Определить эти показатели поможет анализ крови. Моноциты повышены могут быть в результате следующих причин:
различные заболевания кровеносной системы;
риккетсиозные, вирусные, протозойные, грибковые инфекции;
язвенный колит;
энтерит;
лейкоз;
сифилис;
туберкулез;
бруцеллез;
узелковый полиартериит;
красная волчанка;
артрит.

Почему моноциты могут быть понижены?
Если количество моноцитов в крови составляет менее 1 % от общего содержания лейкоцитов, то такое состояние называется моноцитопения.
Наиболее распространенные причины этого явления:
апластическая анемия;
брюшной тиф;
истощение организма;
послеродовой период у женщин;
поражения костного мозга;
гнойные процессы;
шок;
прием определенных лекарственных средств.
Если уровень данных клеток повышен незначительно, то организм в состоянии самостоятельно справиться с проблемой. При обнаружении высоких показателей моноцитов без медицинской помощи не обойтись и необходимо лечение основного заболевания. Для этого потребуются тщательная диагностика, различные медицинские препараты и длительный период времени. Однако стопроцентное излечение не всегда возможно. Например, при лейкозе полного выздоровления можно достичь в очень редких случаях. Тем не менее, оставлять без внимания заболевания нельзя, необходимо придерживаться всех рекомендаций лечащего врача.
Тем не менее, оставлять без внимания заболевания нельзя, необходимо придерживаться всех рекомендаций лечащего врача.
Повышенные моноциты в крови — это очень серьезно. Игнорирование моноцитоза может быть очень опасным для здоровья.
что это значит и что делать?
Повышенные моноциты в крови у ребенка — это показатель активного иммунного ответа детского организма. Незначительное повышение допускается, а резкий рост указывает на интоксикацию и патологические процессы.
Моноциты производятся костным мозгом. Это один из видов лейкоцитов, кровяных телец. Они защищают организм ребенка от паразитов, микробов и опухолей. Очищают кровь и обновляют ее.
Как определяют уровень моноцитов в крови
Уровень моноцитов можно узнать, сдав общий анализ крови. В этом анализе указывают общее количество лейкоцитов и процентное содержание в этом количестве отдельных их видов.
Норма моноцитов у детей.
| Возраст | Процентное содержание моноцитов в общем количестве лейкоцитов, % |
|---|---|
| Новорожденные | 12 |
| С 5 по 14 день с рождения | 14 |
| От месяца до года | 12 |
| 4-5 лет | 10 |
| От 5 до 15 | 4-6 |
| Подростки | 7 |
Для процентного соотношения всех видов лейкоцитов к их общему количеству в крови используют понятие — лейкоцитарная формула.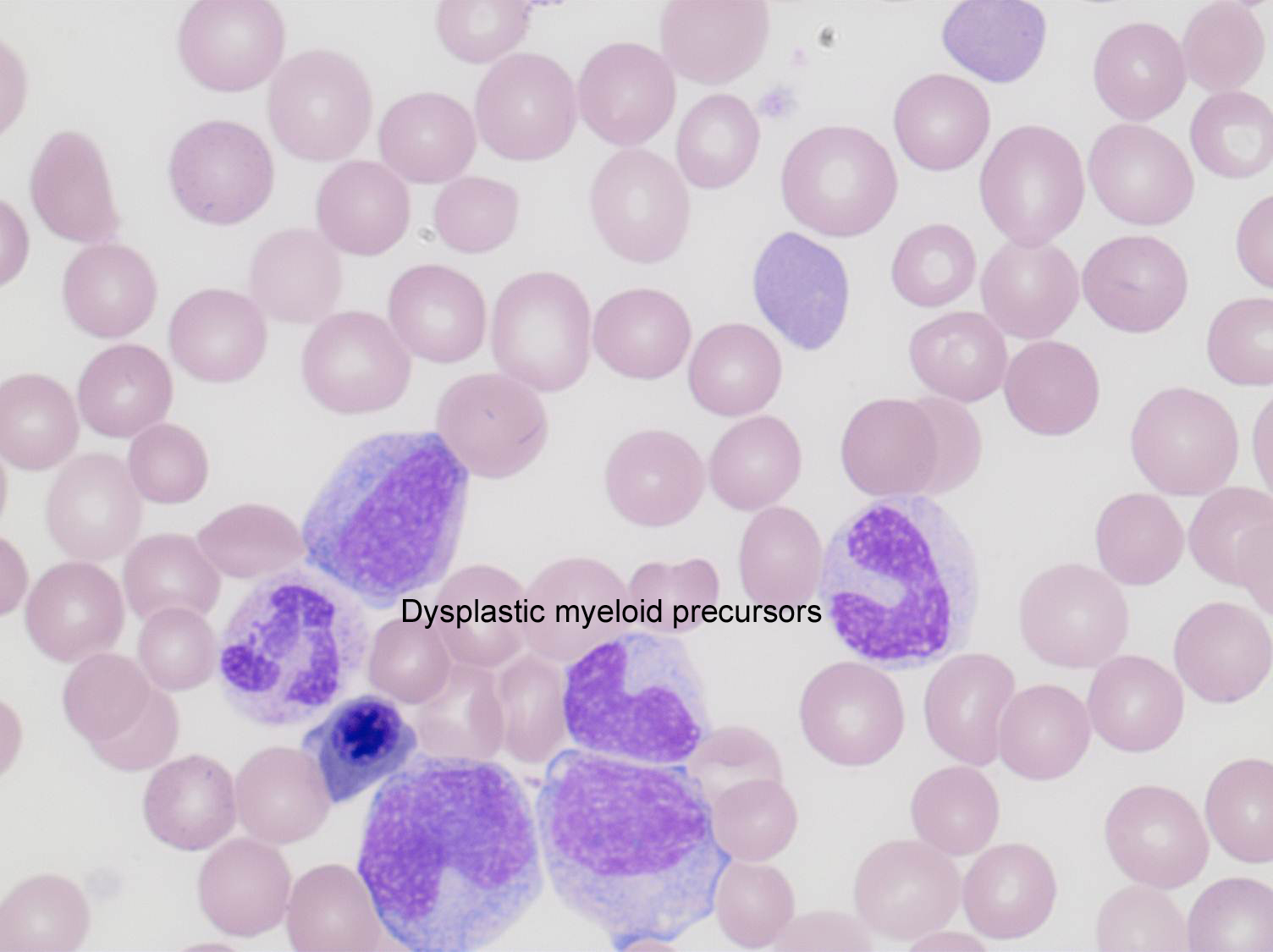 Если она изменяется, это может быть показателем развивающегося заболевания.
Если она изменяется, это может быть показателем развивающегося заболевания.
Как правильно подготовиться к анализам:
- кровь лучше сдавать натощак;
- стресс искажает показатели анализа, так же как и активные физические нагрузки;
- за день до анализа исключают из рациона ребенка жирную пищу;
- врачу сообщают обо всех лекарствах, которые принимает ребенок, — наличие медикаментов в крови способно исказить результаты анализа;
- на бланке анализа должен быть указан верный возраст ребенка.
И в здоровом состоянии могут быть повышены моноциты в крови у ребенка, например когда у малыша прорезываются зубки. Но это повышение незначительно. Резкий рост наблюдается при патологических процессах.
Причины повышения моноцитов в крови
Если моноциты повышены у ребенка, о чем это говорит:
- об активности паразитов в организме;
- о пищевом отравлении;
- об ослабленном иммунитете;
- о ситуации длительной реабилитации после заболеваний;
- о том, что произошло заражение
Моноциты повышены у ребенка, что это значит?
| Инфекционный мононуклеоз | Болезнь поражает миндалины, лифмоузлы, селезенку и печень. |
| Туберкулез | На начальной фазе заболевания моноциты снижаются, но с течением болезни их число увеличивается. |
| Ревматизм, аутоиммунные заболевания | Такие заболевания приводят к чрезмерному увеличению всех видов лейкоцитов. |
| Бруцеллез | Передается от больных животных. |
| Лейкоз | При монобластном лейкозе наблюдается повышение лейкоцитов (редко при миелобластном лейкозе). |
| Полицитемия | Болезнь поражает костный мозг, моноциты увеличиваются выше нормы. |
| Малярия | Болезнь приводит к лейкоцитозу и снижению гемоглобина. |
| Паразиты, простейшие, грибковые инфекции | Для уточнения паразитарной или грибковой инфекции ребенка направляют на дополнительные анализы. |
| Отравление фосфором, тетрахлорэтаном или хлором | Эти вещества подавляют нейтрофилы, из-за чего уровень моноцитов повышается. |
| Врожденный сифилис | Ребенок может получить болезнь от мамы во время внутриутробного развития. |
| Также наблюдается при инфекционном эндокардите, язвенном колите, любых воспалениях ЖКТ, сепсисе, хирургическом лечении |
Симптомы моноцитоза
Моноцитоз — это и есть повышенное количество моноцитов в крови ребенка. Различают абсолютный и относительный моноцитоз.
Относительным моноцитозом называют состояние, когда повышен только уровень моноцитов, а общее количество лейкоцитов не изменено (моноцитов больше в общем количестве за счет того, что снижается уровень других лейкоцитов). Это наблюдается в период восстановления после инфекционных болезней.
Абсолютным моноцитозом называют состояние, когда повышаются и моноциты, и общая концентрация лейкоцитов. Такое может наблюдаться при высокой активности патогенных микроорганизмов.
Моноцитоз — это не отдельное заболевание, а проявление реакции организма на патологические процессы.
Некоторые из симптомов, появляющихся при моноцитозе:
- высокая температура;
- слабость в теле;
- кашель;
- быстрая утомляемость;
- боли в желудке, тошнота;
- заложенность носа;
- увеличенные лимфатические узлы;
- боль в суставах.
Если в крови ребенка обнаружили высокое содержание моноцитов, педиатр назначит дополнительные анализы для выяснения причин заболевания. При моноцитозе нужно действовать быстро, потому что причина увеличения моноцитов — активный патологический процесс, который нужно распознать и остановить.
0
0
50387
Мой мир
Вконтакте
Одноклассники
Тель-Авивский медицинский центр | Расшифровка клинического анализа крови
Данный вид анализа крови поставляет полную информацию обо всех клетках крови, их количестве, особенностях (в основном, это размер и форма).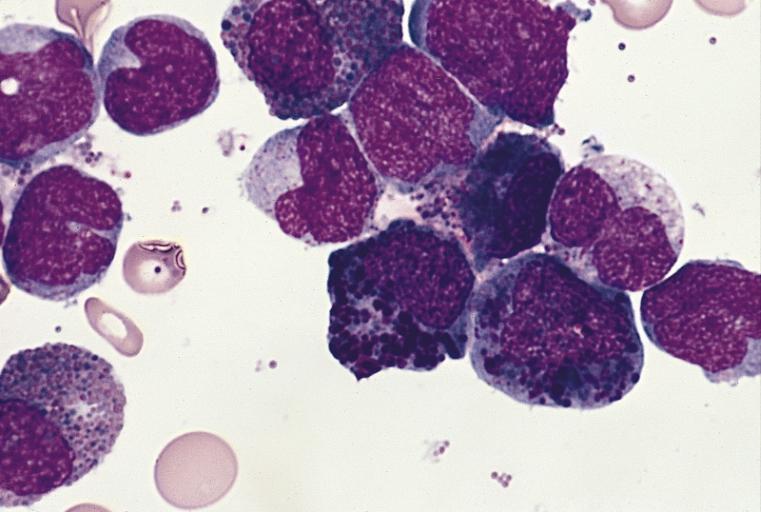
С помощью этих данных можно диагностировать следующие медицинские проблемы:
- анемия с недостатком витамина В12
- недостаток красных кровяных клеток
- недостаток железа
- различные инфекции (при бактериальной инфекции появляется большое количество нейтрофилов, при вирусной инфекции появится большее количество лимфоцитов, при паразитарной инфекции — эозинофилов.)
Безусловно, что можно получить картину и различных злокачественных заболеваний крови (например, при лимфоме появляется больше лимфоцитов).
Виды кровяных клеток в проверке:
1. Лейкоциты или белые кровяные тельца (White blood cells – WBC)
Лейкоциты относятся к защитной системе организма. Они берут на себя часть противодействия различным инфекциям, таким как бактерии, вирусы, грибки, паразиты.
Защитная система организма и белые кровяные клетки также участвуют в лечение клеток зараженных раковыми заболеваниями.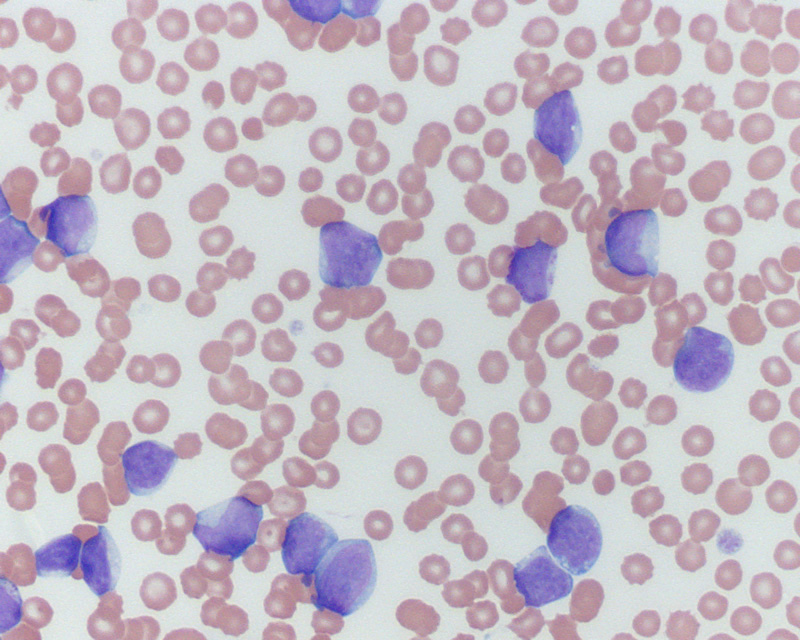
Существуют несколько видов лейкоцитов. У каждой группы клеток есть определенная функция в защите организма. Повышение количества лейкоцитов одной из групп, говорит о виде инфекции, которая поражает организм.
Также при злокачественном заболевании клеток крови выявляется повышение количества лейкоцитов одной из групп.
Нормальное количество белых кровяных телец: 4300-10800.
Повышенное количество клеток называется лейкоцитозом, что обычно говорит о наличии инфекции. Пониженное количество клеток называется лейкопения. Это состояние может говорить о проблемах защитной системы организма по различным причинам (рак крови — лейкемия, побочное действие медицинских препаратов).
Лейкоциты подразделяются на несколько групп. У каждой группы своя функция (differential) — дифференциал. Повышение количества клеток одной из групп подсказывает нам о виде инфекции, поразившей организм.
Нейтрофилы — Neutrophil, самая большая группа лейкоцитов.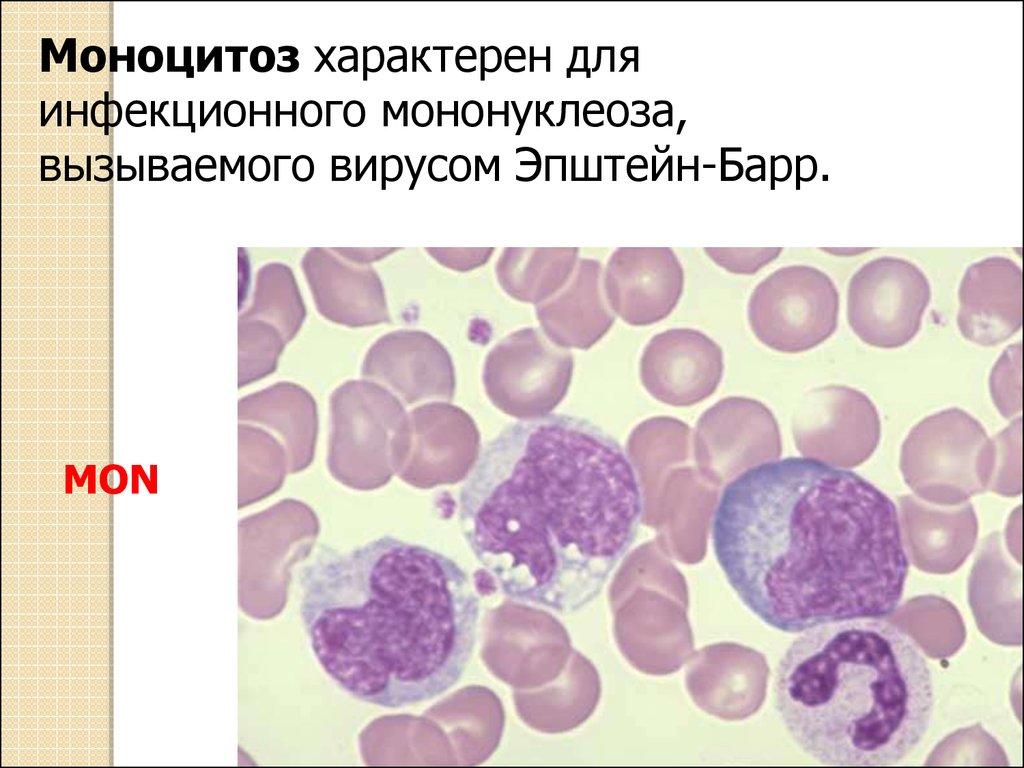 Эти клетки ответственны за лечение бактериальных инфекций. Нормальное количество: 28-54% от всего количества белых кровяных клеток (WBC).
Эти клетки ответственны за лечение бактериальных инфекций. Нормальное количество: 28-54% от всего количества белых кровяных клеток (WBC).
Повышенное количество нейтрофилов называется нейтрофилия (также называется сдвиг влево). В большинстве случаев это означает, что организм борется с бактериальной инфекцией. Это также может указывать на рак крови.
Низкое количество нейтрофилов — нейтропения. Может говорить о том, что организм подвергся заражению бактериальными инфекциями. Также может указывать и на наличие рака крови.
Лимфоциты — Lymphocytes (Lymph), ответственны за лечение вирусных или длительных бактериальных инфекций. Нормальное количество: 36-52% от общего количества лейкоцитов (WBC).
Повышенное количество данных клеток — лимфоцитоз. Может говорить о наличии вирусной инфекции, хронической бактериальной инфекции или о раке крови, который называется лимфома.
Низкое количество — лимфопения.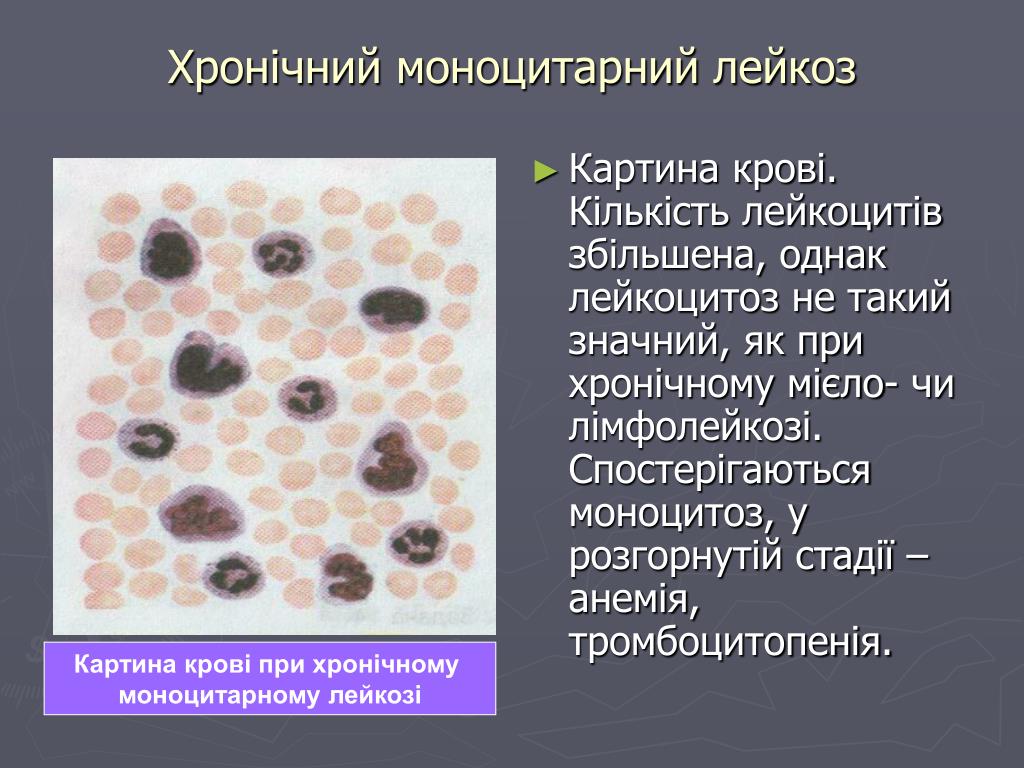 Может свидетельствовать о поражении костного мозга, где образуются различные кровяные клетки. Причины лейкопении могут быть различны: побочные явления лекарственных препаратов, рак, некоторые вирусные инфекции, СПИД.
Может свидетельствовать о поражении костного мозга, где образуются различные кровяные клетки. Причины лейкопении могут быть различны: побочные явления лекарственных препаратов, рак, некоторые вирусные инфекции, СПИД.
Моноциты — Monocytes (Mono), ответственные за сопротивление организма вирусным, грибковым и бактериальным инфекциям. При заболевании мононуклеозом моноциты принимают нетипичную форму, они называются атипичные моноциты. Нормальное количество: 2-9% от общего количества белых кровяных телец (WBC).
Повышенное количество — моноцитоз. Он появляется при определенных бактериальных инфекциях (туберкулез, сифилис), вирусных и паразитарных инфекциях. Моноцитоз может также указывать на раковое заболевание.
Базофилы — Basophiles (Baso), наиболее редкие иммунные клетки крови, отвечающие за аллергические процессы.
Нормальное количество: 0-1% от общего количества белых кровяных клеток (WBC). Их повышенное количество говорит об аллергической реакции или предрасположенности к аллергии.
Их повышенное количество говорит об аллергической реакции или предрасположенности к аллергии.
Эозинофилы — Eosinophles (Eos), клетки крови лейкоцитного ряда, участвующие в различных процессах при: инфекции, аллергические реакции, астма, заболевания соединительной ткани, системная красная волчанка (люпус), псориаз.
Нормальное количество: 1-3% от общего количества лейкоцитов (WBC).
Повышенное количество появляется при приступе астмы, активном аллергическом процессе, чесотке.
Эритроциты — Red blood cells (RBC) — красные кровяные тельца, клетки отвечают за доставку кислорода и удаление углекислого газа из различных частей тела. Красные кровяные клетки связывают кислород в легких и с помощью тока артериальной крови приносят кислород ко всем тканям тела. Кислород освобождается в тканях организма и клетки крови связывают углекислый газ. Венозный поток крови приносит клетки в легкие, в которых эритроциты освобождают углекислый газ и вновь связываются с кислородом.
Нормальное количество: 4.5-5.3
Повышенное количество красных кровяных клеток появляется при различных заболеваниях системы крови. Курение и заболевания легких повышают количество красных кровяных клеток.
Пониженное количество эритроцитов называется анемия. Возможные причины анемии: кровотечение, нарушение кроветворения, недостаток витамина В12.
Гематокрит — Hematocrit (HCT) — показатель крови. Норма у мужчин: 54-37%, у женщин: 47-33%
Это объем, который занимают красные кровяные клетки в плазме крови.
Объем красной кровяной клетки — Mean Corpuscular Volume (MCV), нормальный размер: 78-93.
Высокий уровень называется макроцитоз. Может быть вызван недостатком витамина В12.
Низкий уровень — микроцитоз. Может быть вызван недостатком железа.
Среднее количество гемоглобина в красных кровяных клетках — Mean Corpuscular Hemoglobin (MCH).
Норма: 24-30.
Низкий уровень появляется при анемии или других нарушениях кровяной системы.
Гемоглобин — Hemoglobin (Hb), белок — отвечающий за связывание кислорода и углекислого газа в красных кровяных клетках. Норма у мужчин: 12-18 мг\дл, у женщин: 12-16 мг\дл. Низкий уровень гемоглобина — анемия. Может вызываться кровотечениями, недостатком железа, недостатком витамина В12, может быть нарушение кроветворения красных кровяных клеток.
Сегментация красных кровяных клеток — RDW, измерение идентичности размера красных кровяных клеток. Различный размер клеток может свидетельствовать о процессе выздоровления от анемии или о нарушении производства красных кровяных клеток. Нормальные размеры: 14.5-11.5%.
Ферритин — Ferritin, белковый комплекс, связывающий железо, используется для хранения железа в организме.
Норма для мужчин: 12-300 нанограмм на миллилитр. Норма для женщин: 12-150 нанограмм на миллилитр.
Норма для женщин: 12-150 нанограмм на миллилитр.
Низкий уровень указывает на наличие анемии, вызванной недостатком железа.
Трансферрин — Transferin, белок — используемый для переноса железа в организме.
Норма: 200-400 мг\дл. Низкий уровень указывает на нарушение в кровеносной системе.
Тромбоциты — Platelets – (PLT), клеточные фрагменты ответственные за один из этапов свертываемости крови.
Повреждение стенки сосуда вызывает концентрацию тромбоцитов в месте повреждения. Тромбоциты ломаются и освобождают различные факторы свертывания, которые способствуют образованию сгустка и прекращают кровотечение. Норма: 1500000-450000. Повышенное количество появляется вследствие воспаления, заболеваний костного мозга или вследствие острых кровотечений. Повышенный уровень тромбоцитов может быть причиной повышенной свертываемости крови. Пониженный уровень появляется вследствие поражения образования тромбоцитов в костном мозге или их повышенного разрушения. Пониженное количество тромбоцитов может привести к склонности к кровотечениям.
Пониженное количество тромбоцитов может привести к склонности к кровотечениям.
2. Количество жира в крови
Жировая ткань организма используется как основной хранитель энергии организма. В крови содержатся различные жиры, как часть переработки и хранения пищи. Уровень жиров в крови говорит о сбалансированности жиров в организме и влияет на развитие многих болезней различных органов (таких как сердце, сосуды, воспаление поджелудочной железы). Для получения точных результатов исследование количества жиров в крови проводится проверка натощак через 10-12 часов после последнего приема пищи.
Триглицериды — riglycerides, жир, в основном поступающий с пищей.
Норма: 10-190 миллиграмм на децилитр. Повышенный уровень обычно вызван повышенным употреблением жиров с пищей. Он может быть повышен при таких заболеваниях, как цирроз печени, снижение функции щитовидной железы, воспаление поджелудочной железы. Пониженный уровень может свидетельствовать о нарушении всасывания жиров или повышенной функции щитовидной железы.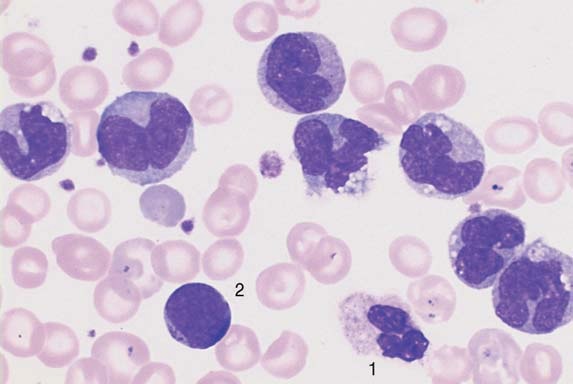
Общий холестерин — Total Cholesterol, необходим для жизнедеятельности организма и используется как важный компонент в строении стенки клетки. В основном, он образуется в печени. Он используется для образования различных гормонов и жирорастворимых витаминов (A,D,E,K).
Норма: до 200 миллиграмм на децилитр.
Повышенный уровень свидетельствует о повышенном употреблении жиров с пищей, или о повышенном образовании холестерина в организме, что является высоким фактором риска для возникновения заболеваний сердца и склероза сосудов. Низкий уровень холестерина связан с недостаточным питанием или пониженной всасываемостью пищи. Он также может быть при пониженной функции щитовидной железы, заболеваниях печени, хронических восхвалениях.
Хороший холестерин – HDL, молекула, функция которой собирать остатки холестерина в организме и переносить их в печень. В печени жир сохраняется и таким образом, не откладывается на стенках сосудов. Поэтому он называется «хороший холестерин». Норма у мужчин: 29-62 миллиграмм на децилитр. Норма у женщин: 34-82 миллиграмм на децилитр. Высокий уровень — защита от склероза артерий. Физическая активность и некоторые лекарства могут поднять его уровень. Низкий уровень — фактор риска для склероза артерий.
Поэтому он называется «хороший холестерин». Норма у мужчин: 29-62 миллиграмм на децилитр. Норма у женщин: 34-82 миллиграмм на децилитр. Высокий уровень — защита от склероза артерий. Физическая активность и некоторые лекарства могут поднять его уровень. Низкий уровень — фактор риска для склероза артерий.
Плохой холестерин – LDL, молекула, функция которой переносить холестерин в различные клетки организма. Избыток холестерина, который переносится этой молекулой, оседает и скапливается на стенках сосудов и таким образом, вызывает их склерозирование. Поэтому он называется «плохой холестерин».
Норма: 60-130 миллиграмм на децилитр. Повышенный уровень говорит о недостаточной сбалансированности жиров и о повышенном риске склероза артерий и повышенном риске заболеваний сердца. Низкий уровень свидетельствует о недостаточном питании или всасываемости.
3. Функции свертываемости крови
Наружное или внутреннее повреждение лечится механизмом свертываемости организма для остановки кровотечения.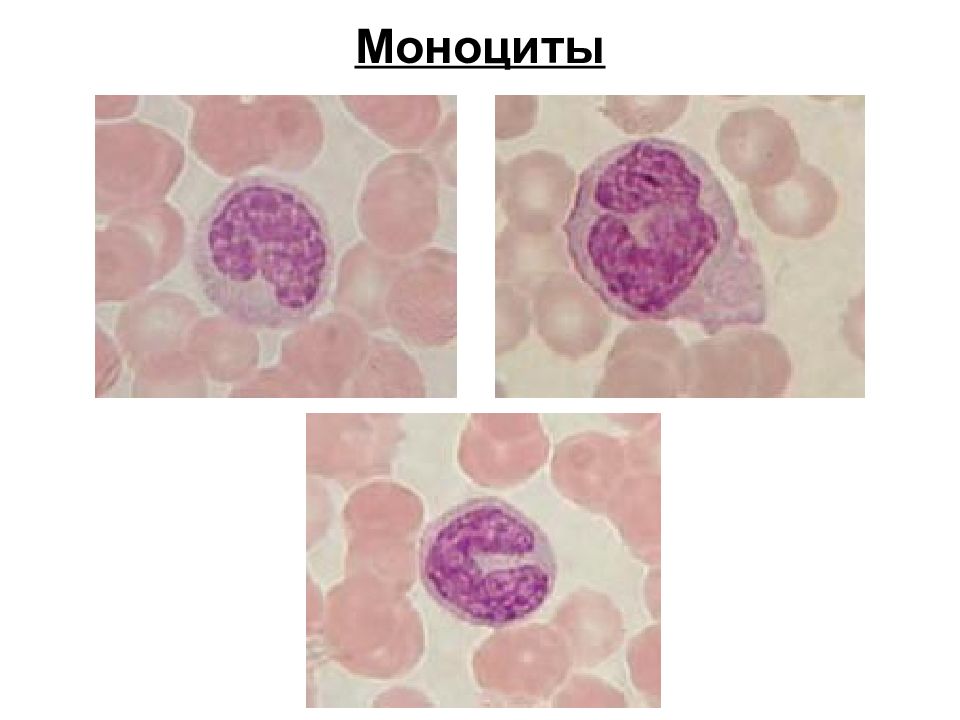 Механизм свертываемости состоит из различных клеток (в основном тромбоцитов, образующихся в костном мозге) и из различных белков, образующихся в основном в печени. Нарушение функции печени приводит к нарушению механизма свертываемости в организме. Существуют три основных исследования для проверки функции свертываемости в организме:
Механизм свертываемости состоит из различных клеток (в основном тромбоцитов, образующихся в костном мозге) и из различных белков, образующихся в основном в печени. Нарушение функции печени приводит к нарушению механизма свертываемости в организме. Существуют три основных исследования для проверки функции свертываемости в организме:
1. Измерение функции определенной ветви в механизме свертываемости — Protrombin Time (РТ).
2. Измерение функции определенной ветви в механизме свертываемости — Activated Partial Thromboplastin Time (APTT).
3. Международный индекс и стандарт для определения результатов механизма свертываемости — International Normalized Ratio (INR).
Протромбиновое время — Protrombin Time.
Измерение функции определенной ветви в механизме свертываемости. Существуют существенные различия в результатах в различных лабораториях, поэтому был открыт новый индекс позволяющий сравнивать, результаты различных лабораторий INR.
Норма: 11-13.5 секунд. Высокий уровень свидетельствует о заболевании печени, о недостатке определенных факторов свертывания или лечение Кумадином (препаратом для предотвращения свертываемости крови), высокий уровень недостаток витамина К.
Измерение функции определенной ветви в механизме свертываемости — Activated Partial Thromboplastin Time (APTT).
Норма: 25-35 секунд. Повышенный уровень свидетельствует о печеночной недостаточности, недостатке определенных факторов свертывания или определенных заболеваниях.
Индекс для измерения свертываемости — International Normalized Ratio (INR)
Международный индекс и стандарт для определения результатов механизма свертываемости.
Норма: 0.9-1.2. Высокий уровень свидетельствует о заболевании печени, о недостатке определенных факторов свертывания или лечение Кумадином (препаратом для предотвращения свертываемости крови), высокий уровень недостаток витамина К.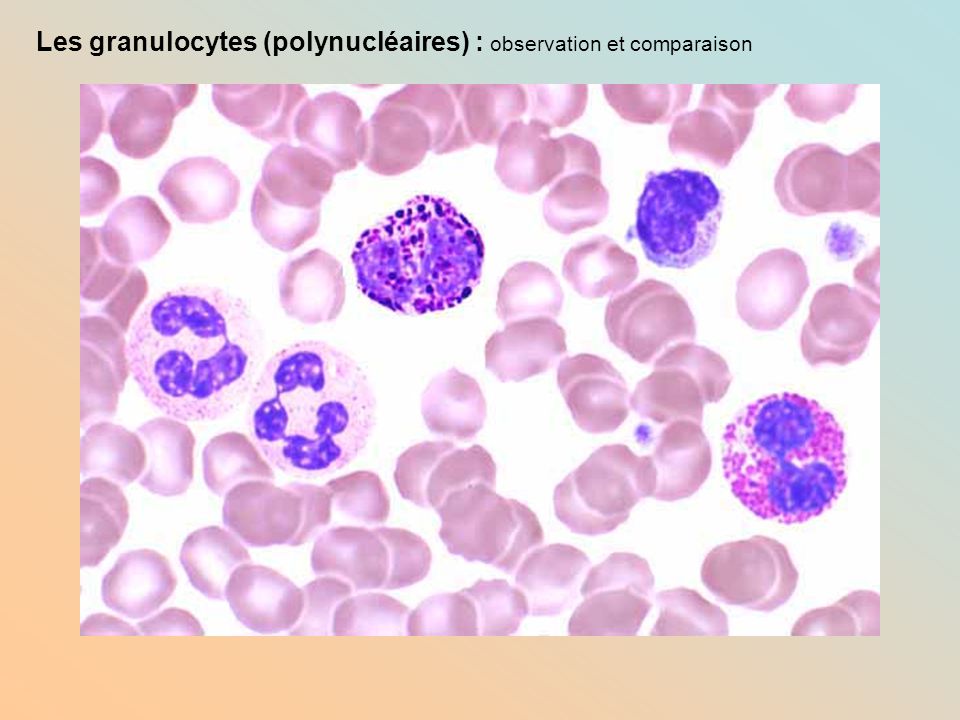 При заболеваниях, которые требуют использование Кумадина, уровень INR должен быть высоким. Высокий уровень повышает риск кровотечений. Низкий уровень — повышенный риск образования тромбов.
При заболеваниях, которые требуют использование Кумадина, уровень INR должен быть высоким. Высокий уровень повышает риск кровотечений. Низкий уровень — повышенный риск образования тромбов.
4. Показатели функции печени
Печень в организме используется для отсеивания, разложения и выведения ядов из организма, а также в печени образуются различные жизненно необходимые составляющие для нормального функционирования организма. Исследование функции печени проверяет количество энзимов печени, находящихся в крови и таким образом позволяет определить уровень активности или повреждения печени.
Билирубин – Bilirubin, одно из образований распада гемоглобина (белка, отвечающего за доставку кислорода к клеткам тела и за выведение углекислого газа из клеток в легкие). Норма: 0.3-1.9 миллиграмм на децилитр.
В случае повышенного уровня билирубина проверяются два его подвида — прямой и непрямой.
Прямой билирубин — Direct Bilirubin, прошедший через печень. Высокий уровень прямого билирубина может говорить о закупорке желчных протоков или определенном заболевании печени.
Высокий уровень прямого билирубина может говорить о закупорке желчных протоков или определенном заболевании печени.
Непрямой билирубин — Indirect Bilirubin, не прошедший через печень. Высокий уровень непрямого билирубина может говорить об усиленном распаде красных кровяных клеток или о другом заболевании крови. Также может свидетельствовать о заболевании печени.
Алкалиновая фосфатаза — Alkaline Phosphatase – (Alk Phos|ALP), один из энзимов вырабатывающихся в печени.
Норма: 44-147 международных единиц на литр. Повышенный уровень может указывать на заболевание печени, алкоголизм, анемию, повышенную функцию щитовидной железы, закупорку желчных путей, некоторые заболевания костей. Низкий уровень указывает на недостаточное питание.
Аланин — Alanine Transaminase (ALT-SGPT), энзим участвующий в процессе обработки аминокислоты. Этот энзим находится в основном в печени.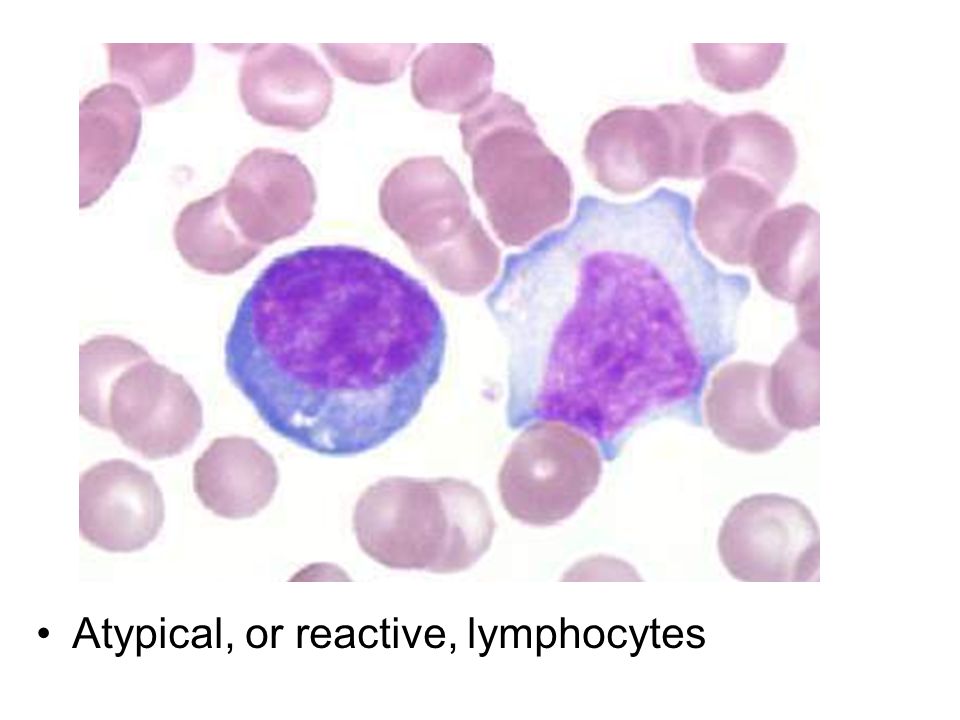 Используется как индекс определения поражения печени. Норма: до 35 международных единиц на литр. Повышенный уровень может свидетельствовать о поражении печени.
Используется как индекс определения поражения печени. Норма: до 35 международных единиц на литр. Повышенный уровень может свидетельствовать о поражении печени.
Аспартат — Aspartate Transaminase – (AST-SGOT), энзим участвующий в процессе обработки аминокислоты. Энзим находится в печени, в красных кровяных клетках, в сердечной мышце и в других мышцах организма, в почках и мозге. Используется, как индекс определения поражения печени. Норма: до 35 международных единиц на литр.
Повышенный уровень может говорить о поражении печени, усиленном распаде красных кровяных клеток, заболевании сердца, поражении мышц. Также активная физическая деятельность может повысить показатели этого энзима, без какого-либо клинического значения.
Гамма-глутамилтранспептидаза — Gamma Glutamyl Transferase (GGT) — находится в основном в печени и в желчных путях, а также в почках. Норма: до 51 международной единицы на литр.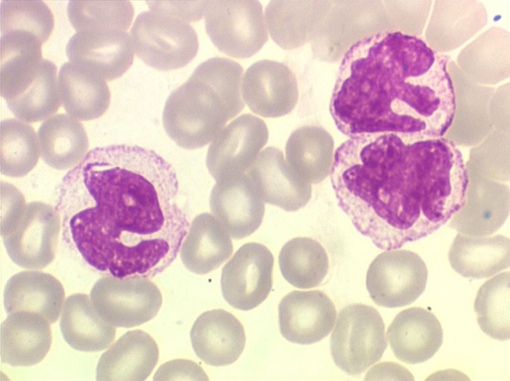 Высокий уровень может указывать на излишнее употребление алкоголя, заболевание печени, закупорку желчных путей или сердечную недостаточность.
Высокий уровень может указывать на излишнее употребление алкоголя, заболевание печени, закупорку желчных путей или сердечную недостаточность.
5. Биохимический анализ крови — SMAС
Дает информацию о составляющих крови, которые не являются клетками. Включает в себя белки, сахар, различные соли и жиры.
Сахар — Glucose, наиболее распространен в организме. Углеводы пищи распадаются на глюкозу. Глюкоза переносится кровью в различные ткани. Часть употребляется клетками, а часть сохраняется в мышцах и в печени в виде гликогена — хранилища доступной энергии организма. Норма натощак: 75-110 миллиграмм на децилитр.
Повышенный уровень говорит о наличии сахарного диабета. Пониженный уровень может быть вызван опухолью, выделяющей инсулин, при недостатке питания или инъекции инсулина в большом количестве.
Альбумин – Albumin, концентрация белка в основном в составляющих кровь. Образуется в печени. Используется как переносчик многих веществ в организме (лекарств, гормонов и солей). Альбумин в крови предотвращает выход жидкой крови из кровеносных сосудов. Норма: 3.4-5.4 грамм на децилитр. Высокий уровень говорит о недостатке жидкости и как результат высокая концентрация альбумина. Низкий уровень говорит о слишком сильном разбавлении из-за скопления жидкости, недостаточном питании ли пониженной всасываемости пищи.
Образуется в печени. Используется как переносчик многих веществ в организме (лекарств, гормонов и солей). Альбумин в крови предотвращает выход жидкой крови из кровеносных сосудов. Норма: 3.4-5.4 грамм на децилитр. Высокий уровень говорит о недостатке жидкости и как результат высокая концентрация альбумина. Низкий уровень говорит о слишком сильном разбавлении из-за скопления жидкости, недостаточном питании ли пониженной всасываемости пищи.
Натрий — Na, основной электролит в организме. Норма: 136-145 мили-эквивалент на литр. Высокий уровень может говорить об обезвоживании, нарушении функции почек, избыточное потребление соли, различных эндокринологических заболеваниях. Низкий уровень может быть вследствие избыточного употребления воды, нарушения функции почек, различных эндокринологических нарушений.
Калий – К, основной внутриклеточный электролит в организме. Норма: 3.7-5.2 мили-эквивалент на литр.
Высокий уровень может быть вызван распадом кровяных клеток в пробирке, заболеванием распада мышц, заболеванием почек, эндокринологическим заболеванием, различными лекарствами, избыточным потреблением.
низкий уровень может быть вызван рвотой или проблемами всасывания в кишечнике, заболеванием почек, избыточным выделением с мочой, различными лекарствами, эндокринологическими заболеваниями, недостаточным употреблением в пищу.
Хлор – CL, основной отрицательный ион в организме. Основное обеспечение в организме солью, которую мы едим.
Норма: 98-106 миллимоль на литр.
Кальций – Са, один из основных составляющих строение костей. В крови он находится в форме иона. Очень важный элемент в деятельности клеток. Норма: 8.5-10.9 миллиграмм не децилитр. Высокий уровень может быть связан с заболеванием щитовидной или паращитовидной желез, различными злокачественными заболеваниями, почечной недостаточностью, избыточным употреблением некоторых мочегонных, витамина D. Низкий уровень может быть связан с недостатком гормона паращитовидной железы, недостатком витамина D, почечной недостаточностью, различными расстройствами пищевого поведения.
Фосфор – Р, находится в крови и костях. Норма 1-1.5 миллимоль на литр. Высокий уровень появляется при почечной недостаточности и при недостаточной функции паращитовидных желез. Низкий уровень в основном, при пониженном питании, алкоголизме, нарушении всасываемости в кишечнике, печеночной недостаточности.
Мочевина — Urea (Blood Urea Nitrogen), используется для определения функции почек. Норма: 7-20 миллиграмм на децилитр. Высокий уровень при почечной недостаточности, повышенной потребности в белках и различных состояниях сердечной недостаточности, обезвоживании. Низкий уровень при печеночной недостаточности, недостаточном питании белками или отеках.
C-реактивный белок — C-reactive Protein (CRP), белок появляющийся в организме при острых воспалениях или при различных опухолевых процессах. Не является свидетельством о процессе в каком-либо определенном органе, только говорит о наличии воспаления/опухоли. Норма: 0-0.5 миллиграмм на децилитр.
Не является свидетельством о процессе в каком-либо определенном органе, только говорит о наличии воспаления/опухоли. Норма: 0-0.5 миллиграмм на децилитр.
Высокий уровень говорит о воспалительном процессе или злокачественности. Высокий уровень является фактором риска для болезней сердца.
Реакция оседания эритроцитов — Erythrocyte Sedimentation Rate (ESR).
Норма: менее 20 миллиметров в час
Исследование проверяет скорость оседания клеток крови в пробирке в течение одного часа. Повышенное оседание говорит о воспалительном или опухолевом процессе, что схоже с исследованием C — реактивного белка. Исследование не указывает на происхождение проблемы. Повышенная СОЭ может быть при различных состояниях, включая и полное здоровье. В случае если получена повышенная СОЭ, ее можно сверить с исследованием C -реактивного белка.
Уровень выше 50 миллиметров в час свидетельствует о воспалительном или злокачественном процессе. Исследование является очень неспецифичным.
Исследование является очень неспецифичным.
Каковы причины моноцитоза при лейкоцитозе?
Котран Р.С., Кумар В., Коллинз Т. Роббинс Патологическая основа заболевания . 6-е изд. Филадельфия, Пенсильвания: В. Б. Сондерс; 1999. 644-96.
Tien FM, Hou HA, Tsai CH и др. Гиперлейкоцитоз связан с отчетливыми генетическими изменениями и является независимым фактором низкого риска у пациентов с острым миелоидным лейкозом de novo. Евро J Гематол . 2018 6 апр. [Medline].
Клавер-Белвер Н., Кано-Коррес Р., Миро-Канис С., Берланга-Эскалера Э.Псевдогиперкалиемия из-за тяжелого лейкоцитоза: клинический случай. Clin Chem Lab Med . 2016 1 декабря. 54 (12): e365-7. [Медлайн].
Махмуд Э., Книо З.О., Махмуд Ф. и др. Предоперационный бессимптомный лейкоцитоз и послеоперационный исход у кардиохирургических больных. PLoS Один . 2017. 12 (9): e0182118. [Медлайн]. [Полный текст].
Предоперационный бессимптомный лейкоцитоз и послеоперационный исход у кардиохирургических больных. PLoS Один . 2017. 12 (9): e0182118. [Медлайн]. [Полный текст].
Ижакян С., Вассер В.Г., Вайншельбойм Б. и др. Этиология и прогноз отсроченного послеоперационного лейкоцитоза у реципиентов трансплантата легкого. Прог Трансплантация . 2020 30 июня (2): 111-6. [Медлайн].
Ли ГМ, Харпер МБ. Риск бактериемии у детей раннего возраста с лихорадкой в эпоху после гемофильной инфекции типа b. Arch Pediatr Adolesc Med . 1998 г., июль 152(7):624-8. [Медлайн].
Браун Л., Шоу Т., Уитлейк В.А. Выявляет ли лейкоцитоз бактериальные инфекции у новорожденных с лихорадкой, поступивших в отделение неотложной помощи? Emerg Med J . 2005 апр.22(4):256-9. [Медлайн].
Сяо Р., Омар С.А. Исход новорожденных с экстремально низкой массой тела при рождении с лейкемоидной реакцией. Педиатрия . 2005 г., июль 116 (1): e43-51. [Медлайн].
Занардо В., Ведовато С., Тревизануто Д.Д., Суппий А., Косми Э., Файс Г.Ф.Гистологический хориоамнионит и неонатальная лейкемоидная реакция у детей с низкой массой тела при рождении. Хум Патол . 2006 г., 37 января (1): 87–91. [Медлайн].
Арав-Богер Р., Баггетт Х.К., Спевак П.Дж., Уиллоуби Р.Э. Лейкоцитоз, вызванный простагландином Е1 у новорожденных. J Педиатр . 2001 фев. 138(2):263-5. [Медлайн].
Ballin A, Lehman D, Sirota P, Litvinjuk U, Meytes D. Увеличение количества CD34+ клеток периферической крови у пациентов, получавших литий. Бр Дж Гематол . 1998 янв. 100(1):219-21. [Медлайн].
Чжан С., Кондак Э., Цю Х. и др. Гепарин-индуцированный лейкоцитоз требует 6-O-сульфатирования и вызывается блокадой опосредованного селектином и белком CXCL12 переноса лейкоцитов у мышей. J Биол Хим .2012 17 февраля. 287(8):5542-53. [Медлайн]. [Полный текст].
Allam JP, Paus T, Reichel C, Bieber T, Novak N. Синдром DRESS, связанный с карбамазепином и фенитоином. Евро J Дерматол . 2004 сен-окт. 14(5):339-42. [Медлайн].
Gungor E, Alli N, Comoglu S, Comcuoglu C. Синдром гиперчувствительности к фенитоину. Нейрол Сай . 2001 июнь 22 (3): 261-5. [Медлайн].
Луптон Дж. Р., Фигероа П., Тамджиди П., Бербериан Б. Дж., Сулика В. И.Инфекционный мононуклеозоподобный синдром, вызванный миноциклином: третья модель побочной реакции на лекарство. Кутис . 1999 авг. 64(2):91-6. [Медлайн].
Маркус Н., Смюэл К., Альмог М. и др. Успешное внутривенное лечение иммуноглобулином при тяжелом синдроме DRESS у детей. J Allergy Clin Immunol Pract . 2017 30 ноября. [Medline].
Liu F, Mahgoub N, Ferrando S. Лейкоцитоз, связанный с лечением клозапином: клинический случай. Психосоматика . 2011 сен-окт. 52(5):488-91. [Медлайн].
Грейнджер Дж.М., Контояннис Д.П. Этиология и исход крайнего лейкоцитоза у 758 негематологических больных раком: ретроспективное исследование в одном учреждении. Рак .1 сентября 2009 г. 115 (17): 3919-23. [Медлайн].
Ализаде П., Рахбариманеш А.А., Бахрам М.Г., Салмасян Х. Дефицит адгезии лейкоцитов типа 1, проявляющийся лейкемоидной реакцией. Индийский J Педиатр . 2007 г., декабрь 74 (12): 1121-3. [Медлайн].
Роза Дж.С., Швиндт К.Д., Оливер С.Р., Леу С.И., Флорес Р.Л., Галассетти П.Р. Профили лейкоцитов при физической нагрузке у здоровых детей, детей с диабетом 1 типа, избыточным весом и астмой. Pediatr Exerc Sci . 2009 февраль.21(1):19-33. [Медлайн].
Pediatr Exerc Sci . 2009 февраль.21(1):19-33. [Медлайн].
Айдоган М., Айдоган А., Кара Б., Басим Б., Эрдоган С. Транзиторный периферический лейкоцитоз у детей с афебрильными судорогами. J Детский Нейрол . 2007 22 января (1): 77-9. [Медлайн].
Алиоглу Б., Озюрек Э., Авчи З., Аталай Б., Джанер Х., Озбек Н. Картина периферической крови после легкой черепно-мозговой травмы у детей. Pediatr Int . 2008 июнь 50 (3): 281-3. [Медлайн].
Фурлан Ю.С., Красюков А.В., Фелингс М.Г.Гематологические нарушения в течение первой недели после острой изолированной травматической травмы шейного отдела спинного мозга: когортное исследование случай-контроль. Позвоночник . Ноябрь 2006 г. 31:2674-83. [Медлайн].
Осава И., Нагамачи С. , Судзуки Х. и др. Лейкоцитоз и высокий уровень гематокрита во время абдоминальных приступов наследственного ангионевротического отека. BMC Гастроэнтерология 2013, 13:123 . Август 2013. 13:123.
, Судзуки Х. и др. Лейкоцитоз и высокий уровень гематокрита во время абдоминальных приступов наследственного ангионевротического отека. BMC Гастроэнтерология 2013, 13:123 . Август 2013. 13:123.
Plo I, Zhang Y, Le Couédic JP, Nakatake M, Boulet JM, Itaya M.Активирующая мутация в гене CSF3R вызывает наследственную хроническую нейтрофилию. J Exp Med . 2009 3 августа. 206(8):1701-7. [Медлайн]. [Полный текст].
Снайдер Р.Л., Стрингем Д.Дж. Пегфилграстим-индуцированный гиперлейкоцитоз. Энн Фармакотер . 2007 Сентябрь 41 (9): 1524-30. [Медлайн].
Duchin JS, Koster FT, Peters CJ, et al. Хантавирусный легочный синдром: клиническое описание 17 пациентов с впервые выявленным заболеванием.Группа по изучению хантавируса. N Английский J Med . 1994 г., 7 апреля. 330(14):949-55. [Медлайн].
[Медлайн].
Драго Ф., Когорно Л., Аньолетти А.Ф., Пароди А. Роль периферической эозинофилии в неблагоприятных кожных реакциях на лекарства. Eur Rev Med Pharmacol Sci . 2015 19 июня (11): 2008-9. [Медлайн].
Cherfane CE, Gessel L, Cirillo D, Zimmerman MB, Polyak S. Моноцитоз и низкое соотношение лимфоцитов к моноцитам являются эффективными биомаркерами активности язвенного колита. Воспаление кишечника Dis . 2015 19 мая. [Medline].
Хуан Г., Ковалич А.Дж., Грабер С.Дж. Прогностическое значение лейкоцитоза и лимфопении для тяжести коронавирусного заболевания. Внезапное заражение Dis . 2020 8 мая. 26 (8): [Medline]. [Полный текст].
Нгуен Р., Джеха С., Чжоу Ю. и др. Роль лейкафереза в современном лечении гиперлейкоцитоза при недавно диагностированном остром лимфобластном лейкозе у детей.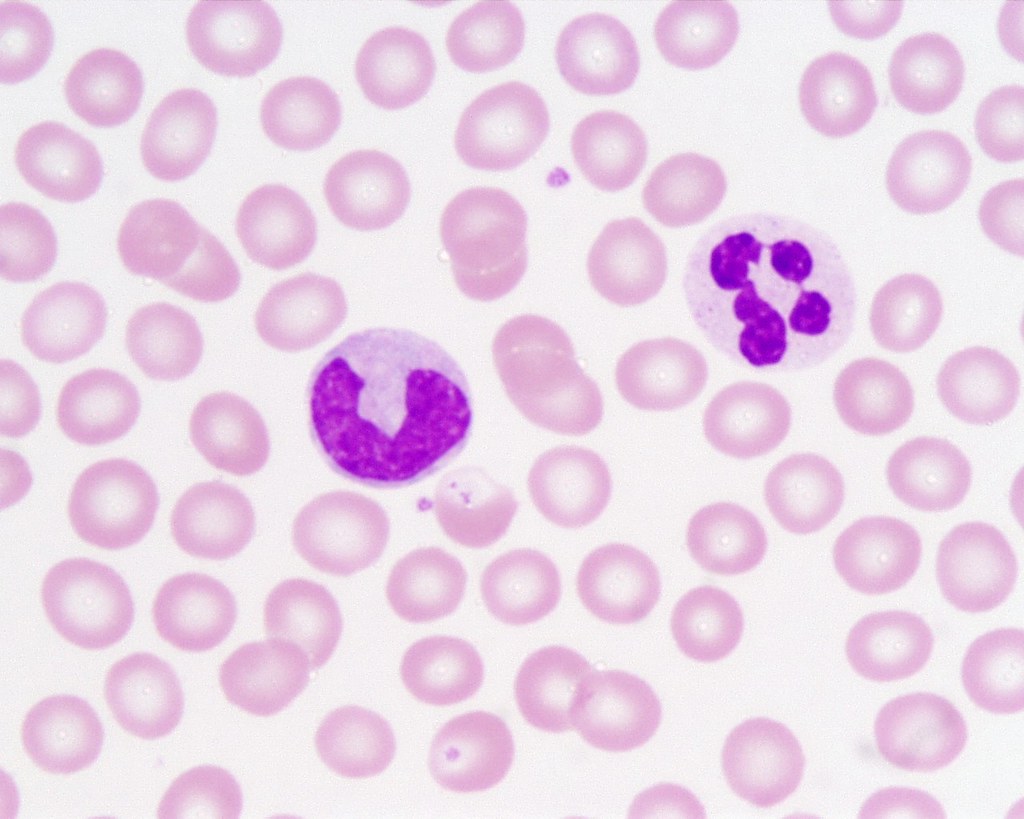 Рак крови у детей .2016 17 мая. [Медлайн].
Рак крови у детей .2016 17 мая. [Медлайн].
Choi MH, Choe YH, Park Y и др. Влияние терапевтического лейкафереза на ранние осложнения и исходы у пациентов с острым лейкозом и гиперлейкоцитозом: исследование с сопоставлением показателей склонности. Переливание . 2018 янв. 58 (1): 208-16. [Медлайн].
Мамез А.С., Раффу Э., Шеврет С. и др. Предварительное лечение пероральной гидроксимочевиной перед интенсивной химиотерапией улучшает раннюю выживаемость пациентов с высоким гиперлейкоцитозом при остром миелоидном лейкозе. Лейк-лимфома . 2016 5 фев. 1-8. [Медлайн].
Моноцитоз — обзор | ScienceDirect Topics
Лейкоцитоз вследствие экспансии других клеточных линий
Моноцитоз и лимфоцитоз также могут приводить к повышению уровня лейкоцитов. Моноцитоз определяется абсолютным количеством моноцитов более 500/мкл и обычно возникает на фоне хронического воспаления, вызванного такими инфекциями, как туберкулез, сифилис или подострый бактериальный эндокардит, аутоиммунное или гранулематозное заболевание и саркоидоз.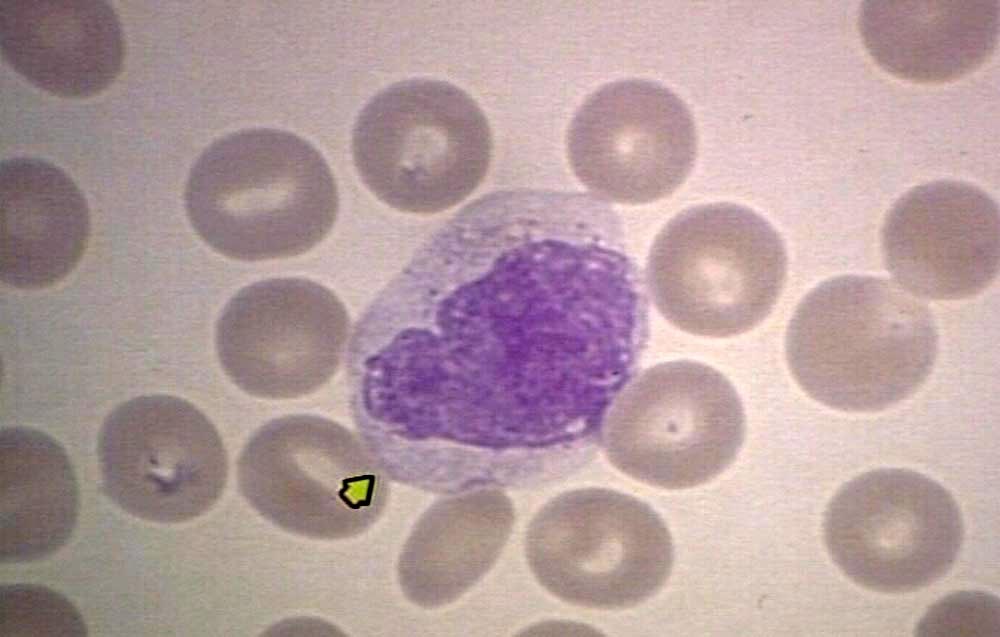 Его также можно наблюдать при злокачественных новообразованиях, таких как предлейкемические состояния, нелимфоцитарный лейкоз, включая острый миеломоноцитарный и моноцитарный лейкоз, гистиоцитоз, болезнь Ходжкина, неходжкинскую лимфому и различные карциномы. Наконец, его можно наблюдать при хронической нейтропении, после спленэктомии и при восстановлении после угнетения функции костного мозга (табл. 170-2).
Его также можно наблюдать при злокачественных новообразованиях, таких как предлейкемические состояния, нелимфоцитарный лейкоз, включая острый миеломоноцитарный и моноцитарный лейкоз, гистиоцитоз, болезнь Ходжкина, неходжкинскую лимфому и различные карциномы. Наконец, его можно наблюдать при хронической нейтропении, после спленэктомии и при восстановлении после угнетения функции костного мозга (табл. 170-2).
Лимфоцитоз определяется при абсолютном количестве лимфоцитов более 5000/мкл. Наиболее распространенными причинами повышенного количества лимфоцитов являются вирусные инфекции, такие как вирус Эпштейна-Барр и вирусы гепатита.Хотя большинство бактериальных инфекций вызывают нейтрофилию, коклюш и болезнь кошачьей царапины, вызванные Bartonella henselae , могут вызывать выраженный лимфоцитоз. Другие инфекции, которые могут вызывать вторичный лимфоцитоз, включают токсоплазмоз и бабезиоз. Реакции гиперчувствительности из-за лекарств или сывороточной болезни также могут быть связаны с лимфоцитозом. Первичные заболевания, вызывающие лимфоцитоз, включают хронический лимфолейкоз (ХЛЛ) и моноклональный В-клеточный лимфоцитоз (таблица 170-3; см. также таблицу 190-2 и главу 190).
Первичные заболевания, вызывающие лимфоцитоз, включают хронический лимфолейкоз (ХЛЛ) и моноклональный В-клеточный лимфоцитоз (таблица 170-3; см. также таблицу 190-2 и главу 190).
Эозинофилия определяется при абсолютном количестве эозинофилов более 400/мкл. Эозинофилы пролиферируют под влиянием ИЛ-5 и играют роль в фагоцитозе и модулировании токсичности вследствие дегрануляции тучных клеток при реакциях гиперчувствительности. Таким образом, эозинофилия чаще всего наблюдается на фоне лекарственных реакций, аллергии, атопии и астмы. Различные инфекции, особенно паразитарные инфекции и, в меньшей степени, грибковые инфекции, могут быть связаны с повышенным количеством циркулирующих эозинофилов.Эозинофилия также может быть результатом аутоиммунных и воспалительных состояний, таких как васкулит Чарга-Стросса. Атероэмболическая болезнь и надпочечниковая недостаточность также могут вызывать эозинофилию. Существует ряд видов рака, которые связаны с политипной экспансией эозинофилов, включая лимфомы и солидные опухоли..jpg) Существует также ряд клональных нарушений эозинофилов, возникающих на фоне некоторых лейкозов. Наконец, существует гетерогенная группа заболеваний, называемая гиперэозинофильными синдромами .Слитый ген FIP1L1-PDGFRA подтвердил, что некоторые из них являются первичными клональными нарушениями эозинофилов; клональность других гиперэозинофильных синдромов может быть трудно установить (см. табл. 173-1 в главе 173).
Существует также ряд клональных нарушений эозинофилов, возникающих на фоне некоторых лейкозов. Наконец, существует гетерогенная группа заболеваний, называемая гиперэозинофильными синдромами .Слитый ген FIP1L1-PDGFRA подтвердил, что некоторые из них являются первичными клональными нарушениями эозинофилов; клональность других гиперэозинофильных синдромов может быть трудно установить (см. табл. 173-1 в главе 173).
Тип лейкоцитов — каковы нормальные диапазоны?
Обзор
Что такое моноциты?
Моноциты — это тип лейкоцитов (лейкоцитов), которые находятся в вашей крови и тканях для поиска и уничтожения микробов (вирусов, бактерий, грибков и простейших) и уничтожения инфицированных клеток.Моноциты обращаются к другим лейкоцитам для лечения травм и предотвращения инфекции.
Функция
Что делают моноциты?
Моноциты — пожарные вашей клетки. Их жизненный цикл начинается в костном мозге (мягкая ткань внутри ваших костей), где они растут и тренируются, чтобы защитить ваше тело. Как только они созревают, они попадают в ваш кровоток и ткани, чтобы защитить ваше тело от чужеродных захватчиков, таких как микробы.
Как только они созревают, они попадают в ваш кровоток и ткани, чтобы защитить ваше тело от чужеродных захватчиков, таких как микробы.
Микробы похожи на огонь, когда они попадают в ваше тело.Как только микробы попадают в ваши ткани, моноциты слышат сигнал тревоги, призывая их к действию для тушения пожара. Эти клеточные пожарные дифференцируются на два типа клеток:
- Дендритные клетки: попросите другие клетки вашей иммунной системы предоставить резервную копию для борьбы с микробами.
- Макрофаги: защитите свое тело от микробов на передовой.
Что делают дендритные клетки?
Дендритные ячейки — это колл-центр вашей пожарной охраны. Они несут ответственность за оповещение других клеток в вашем теле, чтобы помочь бороться с инфекцией.Дендритные клетки находятся в поверхностных тканях, например, непосредственно под кожей и в слизистой оболочке носа, легких, желудка и кишечника. Когда микроб проникает в ткани организма, дендритные клетки собирают антиген вторгшегося микроба (молекула в микробе, которая вызывает реакцию антител) и высвобождают белки (цитокины), которые уведомляют другие лейкоциты о том, что они должны прибыть в место инфекции и уничтожить захватчика.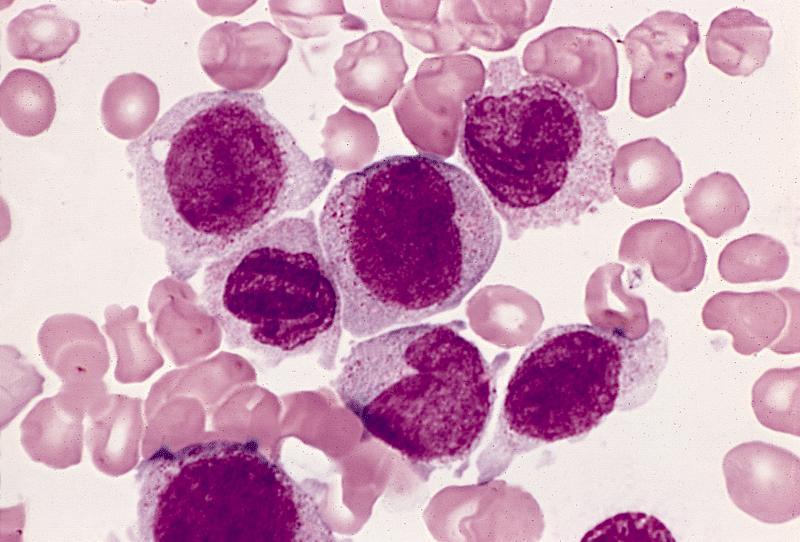
Что делают макрофаги?
Макрофаги находятся на передовой линии огня, борясь с микробами (вирусами, бактериями, грибками и простейшими), которые попадают в ваш организм.Клетки-макрофаги окружают вторгшийся микроб, поглощают и убивают его токсичными ферментами внутри клетки. Эти клетки также помогают удалять мертвые клетки из тканей и кровотока.
Анатомия
Как выглядят моноциты?
Моноциты являются самым крупным типом лейкоцитов и почти в два раза больше эритроцитов. Под микроскопом моноциты легко идентифицировать по их размеру. Клетки моноцитов имеют центр с двумя ядрами (двудольными ядрами), который плавает в содержащейся жидкости, называемой цитоплазмой.
Лаборант добавит краситель, чтобы лучше рассмотреть клетки под микроскопом, который окрашивает компоненты клетки от бледного до темно-синего и фиолетового цвета. В цитоплазме находятся крошечные зернистые гранулы, которые могут казаться светло-фиолетовыми. Ядро меняет форму, когда клетка перемещается по телу. Ядро моноцита выглядит темно-фиолетовым в центре клетки и может принимать форму:
Ядро моноцита выглядит темно-фиолетовым в центре клетки и может принимать форму:
- Кусковая фасоль.
- Подкова.
- Перекошенный круг.
- Круг с углублением.
Где расположены моноциты?
Моноциты образуются в мягких тканях ваших костей (костный мозг). После того, как клетки созреют, они перемещаются в ваши ткани, где вместе с другими клетками иммунной системы защищают ваше тело от инфекции.
Условия и расстройства
Какие распространенные заболевания влияют на моноциты?
Условия зависят от количества моноцитов в крови. Количество моноцитов может быть слишком высоким или слишком низким в результате того, что ваш организм борется с инфекцией или болезнью.
Моноцитоз
Моноцитоз возникает, когда количество моноцитов слишком велико. Чаще всего это связано с хронической инфекцией или заболеванием, с которым борется ваше тело. Причины моноцитоза включают:
Моноцитопения
Моноцитопения возникает, когда количество моноцитов слишком низкое.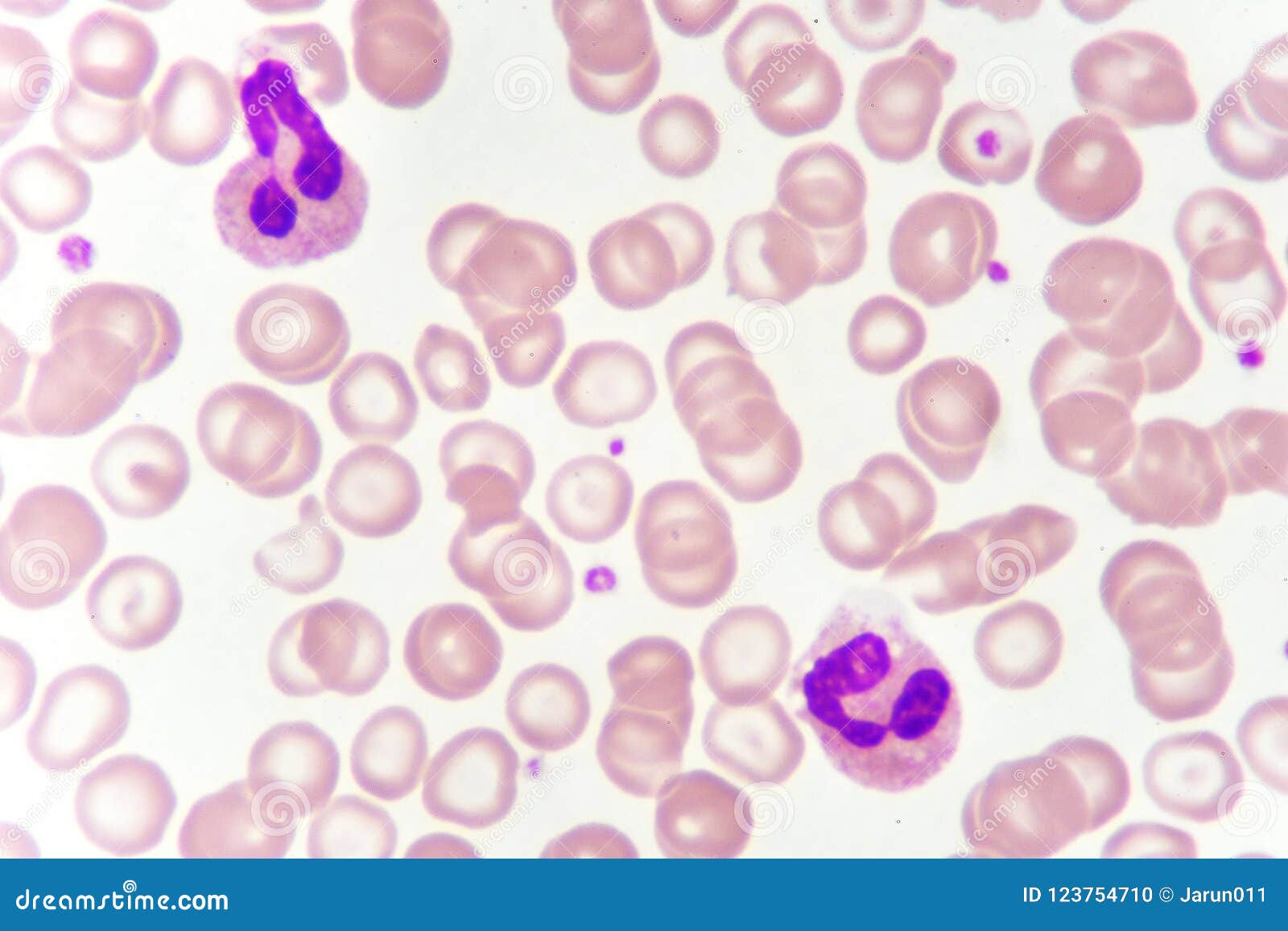 Это результат снижения количества лейкоцитов. Причины моноцитопении включают:
Это результат снижения количества лейкоцитов. Причины моноцитопении включают:
Каков нормальный диапазон количества моноцитов в моем организме?
Нормальное количество моноцитов составляет от 2% до 8% от количества лейкоцитов.Это соответствует от 200 до 800 моноцитов на микролитр крови у здоровых взрослых. Если количество моноцитов выходит за эти пределы, вы рискуете заболеть заболеванием, связанным с моноцитами.
Каковы общие тесты для проверки состояния моих моноцитов?
Анализ крови проверяет здоровье ваших моноцитов. Два теста точно определяют, сколько клеток моноцитов находится в вашем теле:
- Общий анализ крови : Ваш лечащий врач возьмет у вас образец крови из вены для диагностики и скрининга ряда состояний и инфекций путем подсчета клеток крови.Поскольку моноциты являются разновидностью лейкоцитов, ваш лечащий врач запросит общий анализ крови (CBC) с дифференциальным диагнозом. Этот тест подсчитывает пять типов лейкоцитов в образце крови, чтобы проверить, является ли количество клеток нормальным, слишком высоким или слишком низким.

- Абсолютное количество моноцитов: Абсолютное количество моноцитов определяет, сколько моноцитов присутствует в образце вашей крови. При расчете абсолютного количества моноцитов процентное содержание моноцитов в общем анализе крови умножается на общее количество лейкоцитов в том же количестве.Результаты этого теста определяют, является ли количество моноцитов нормальным, слишком высоким или слишком низким.
Каковы общие симптомы состояния моноцитов?
Если у вас низкий или высокий уровень моноцитов, вы, скорее всего, не будете испытывать никаких симптомов, связанных с самим подсчетом. Вместо этого любые симптомы, которые вы можете почувствовать, являются побочным эффектом расстройства, которое привело к ненормальному количеству моноцитов. Симптомы нарушений моноцитов включают:
- Боль в животе.
- Отек (воспаление).
Каковы общие методы лечения состояний моноцитов?
Лечение зависит от вашего диагноза и тяжести состояния. Это может быть простое изменение диеты или лечение основного заболевания с помощью химиотерапии. Ваш поставщик медицинских услуг предложит варианты лечения, соответствующие вашему диагнозу, чтобы помочь вам решить, как лучше всего увеличить или уменьшить количество моноцитов.
Это может быть простое изменение диеты или лечение основного заболевания с помощью химиотерапии. Ваш поставщик медицинских услуг предложит варианты лечения, соответствующие вашему диагнозу, чтобы помочь вам решить, как лучше всего увеличить или уменьшить количество моноцитов.
Как снизить высокое количество моноцитов?
Лечение для снижения высокого уровня моноцитов включает:
- Избегайте продуктов, вызывающих воспаление, таких как красное мясо, рафинированные углеводы и жареная пища.
- Регулярные физические упражнения.
- Ограничение употребления алкоголя.
- Управление текущими заболеваниями.
- Лечение инфекций лекарствами, если это целесообразно с медицинской точки зрения
Как повысить низкий уровень моноцитов?
Лечение для повышения уровня моноцитов включает:
- Обсудите с вашим поставщиком медицинских услуг изменение дозировки или времени приема лекарств, которые могут вызвать низкий уровень моноцитов.

- Лечение основных заболеваний.
- Прием витаминов для укрепления иммунной системы (B12, C, D) при их дефиците.
- Лечение текущих инфекций.
уход
Как я могу сохранить свои моноциты здоровыми?
Вы можете сохранить свои клетки моноцитов здоровыми с помощью:
- Предотвращение травм и инфекций.
- Соблюдайте сбалансированную диету и регулярно занимайтесь спортом.
- Не курить.
- Соблюдайте правила гигиены, такие как мытье рук.
- Снижение стресса.
Записка из клиники Кливленда
Моноциты — это пожарные вашего организма, которые мешают микробам распространять огонь (инфекцию) в тканях и крови. Вы можете сохранить свои моноциты здоровыми, приняв меры для укрепления иммунной системы, включая достаточное количество сна, сбалансированную диету и соблюдение правил гигиены для предотвращения инфекций.
высоких моноцитов? 5 способов сбалансировать вашу иммунную систему
Моноциты являются самыми крупными из всех лейкоцитов и играют важную роль в защите от микробов и при воспалении. Что означают высокие уровни? Какие факторы могут их уменьшить? Узнайте больше здесь.
Что означают высокие уровни? Какие факторы могут их уменьшить? Узнайте больше здесь.
Высокий уровень моноцитов (моноцитоз)
Моноцитоз — это состояние, при котором количество моноцитов, циркулирующих в крови, увеличивается до более чем 0,8×109/л у взрослых.
Состояния, связанные с моноцитозом
- Болезни крови (миелодиспластические заболевания, острый моноцитарный, хронический миеломоноцитарный лейкоз, лимфома Ходжкина и неходжкинская лимфома) [1, 2, 3]
- Инфекции (туберкулез, вирусные инфекции, бактериальный эндокардит, бруцеллез, малярия, сифилис) [4, 5, 6, 7, 8, 9]
- Аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит, воспалительные заболевания кишечника) [10, 11, 12]
- Саркоидоз [13]
- Рак ( яичник, грудь, прямая кишка) [4, 14]
- Инфаркт [4, 15]
- Аппендицит [16]
- ВИЧ-инфекция [4, 17]
- Депрессия [18]
- Роды [19, 20]
- Ожирение [21]
- Тяжелая пневмония [22]
- Алкогольная болезнь печени [23]
Указанные здесь причины обычно связаны с этим симптомом. Обратитесь к своему врачу или другому медицинскому работнику для постановки точного диагноза.
Обратитесь к своему врачу или другому медицинскому работнику для постановки точного диагноза.
Симптомы и причины
Моноцитоз чаще всего возникает во время и после хронического воспаления или инфекции [24].
Однако с моноцитозом также могут быть связаны некоторые другие состояния, такие как болезни сердца, депрессия, диабет и ожирение [25, 26, 27].
Состояния, наиболее часто связанные с высоким уровнем моноцитов: уровни также могут быть связаны с:
- Аутоиммунными заболеваниями, такими как волчанка, ревматоидный артрит и ВЗК [12, 10, 11]
- Лейкозами, такими как хронический миеломоноцитарный лейкоз и ювенильный миеломоноцитарный лейкоз [31, 32]
- Рак [33]
- Депрессия [18]
- Ожирение [34]
Считается, что некоторые симптомы вызваны самим моноцитозом.Вместо этого, по мнению многих исследователей, симптомы возникают при заболеваниях, связанных с моноцитозом [26]. Эти симптомы включают:
- Лихорадка [35]
- Боль [36]
- Отек [35]
Основными причинами высокого уровня моноцитов (моноцитоза) являются хроническое воспаление и инфекции. Симптомы зависят от причины и могут включать лихорадку, боль и отек.
Симптомы зависят от причины и могут включать лихорадку, боль и отек.
Как высокий уровень моноцитов связан со здоровьем?
1) Атеросклероз
Моноциты и макрофаги участвуют в развитии и усугублении атеросклероза (уплотнение артерий), что может привести к болезни сердца и инсульту [37].
Моноциты накапливаются в сосудах и способствуют развитию и разрыву атеросклеротических бляшек, блокирующих сосуды [38, 39, 40].
По мере прогрессирования атеросклероза количество моноцитов в крови имеет тенденцию к увеличению [41].
Атеросклероз, болезни сердца и инсульт связаны с повышенным уровнем моноцитов и макрофагов в крови.
2) Воспаление при диабете
Клиническое исследование не выявило связи между диабетом и количеством циркулирующих лейкоцитов, но моноцитов было значительно больше у людей с осложнениями диабета [42].
Некоторые исследователи считают, что моноциты могут быть причиной вредных воспалительных осложнений при диабете.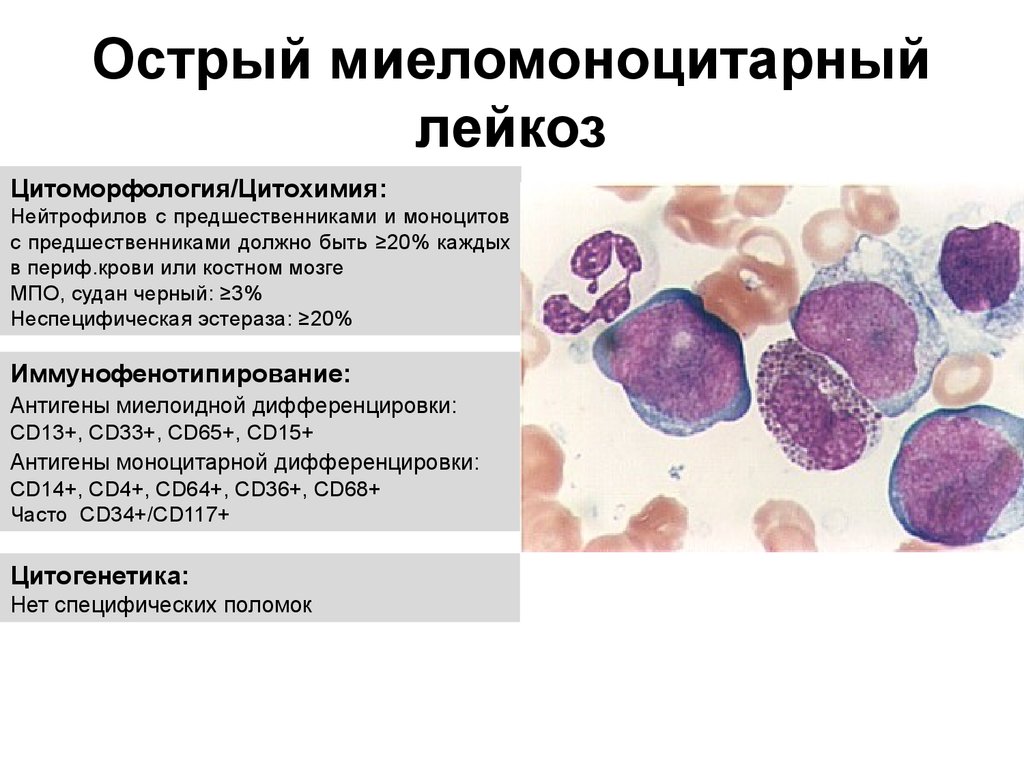 Исследования показали, что моноциты секретируют TNF-альфа, IL-6 и IL-1 у пациентов с диабетом как 1-го, так и 2-го типа; считается, что эти провоспалительные молекулы способствуют заболеваниям кровеносных сосудов (например, атеросклерозу) [43, 44, 45, 46, 47, 48].
Исследования показали, что моноциты секретируют TNF-альфа, IL-6 и IL-1 у пациентов с диабетом как 1-го, так и 2-го типа; считается, что эти провоспалительные молекулы способствуют заболеваниям кровеносных сосудов (например, атеросклерозу) [43, 44, 45, 46, 47, 48].
Моноциты могут усиливать воспаление у пациентов с диабетом, тем самым способствуя таким осложнениям, как заболевания кровеносных сосудов.
3) Показатели смертности
В большом исследовании более 4000 взрослых в швейцарской больнице у пациентов с моноцитозом наблюдались более тяжелые осложнения, чем у пациентов без него.Кроме того, пациенты с моноцитозом имели более низкую выживаемость во время пребывания в стационаре [25].
В отдельном исследовании пожилых корейских мужчин и женщин моноцитоз был связан с повышенным риском смерти от сердечно-сосудистых заболеваний и рака [24].
Эта связь недостаточно изучена, чтобы с уверенностью утверждать, что моноцитоз может предсказывать смертность.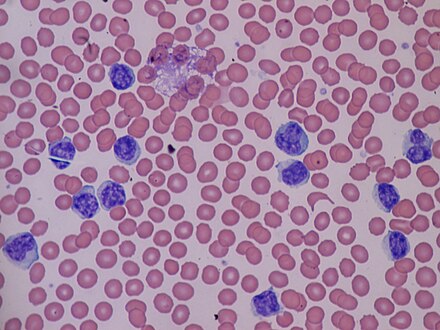 Однако текущие исследования в значительной степени подтверждают эту ассоциацию [25, 24, 26].
Однако текущие исследования в значительной степени подтверждают эту ассоциацию [25, 24, 26].
4) Восстановление после сердечного приступа
После сердечного приступа моноциты восстанавливают поврежденное сердце, удаляя поврежденные и мертвые клетки сердца.Однако исследования на животных предполагают, что повышенный уровень моноцитов связан с нарушением заживления после сердечного приступа [49, 50].
Факторы, увеличивающие моноциты
Некоторые гормоны связаны с увеличением количества моноцитов.
1) Лептин
Лептин человека увеличивает рост моноцитов и продукцию цитокинов, поскольку лептин является провоспалительным цитокином [51].
Уровни лептина коррелируют с массой тела.
2) Менопауза
В период менопаузы наблюдается увеличение количества моноцитов крови.Более того, количество моноцитов снижается после заместительной терапии эстрогенами [52].
3) Гормон роста
Инъекции гормона роста увеличивают количество лейкоцитов, включая моноциты [53].
4) Тестостерон
Инъекции тестостерона увеличивали количество моноцитов, гранулоцитов и больших лимфоцитов у мышей [54].
Менопауза, хроническое употребление алкоголя и некоторые гормоны (лептин, гормон роста и тестостерон) могут увеличить количество моноцитов.
Способы снижения уровня
Моноцитоз — это состояние, которое требует диагностики и лечения у медицинского работника. Поговорите со своим врачом, прежде чем пытаться использовать какие-либо стратегии для снижения количества моноцитов.
1) Регулярные физические упражнения
Регулярные физические упражнения обладают противовоспалительным действием. В одном исследовании моноциты значительно уменьшились после шестинедельного курса велотренировок средней интенсивности у женщин с избыточным весом, которые не занимались спортом регулярно.
Количество моноцитов также в значительной степени связано со снижением уровня триглицеридов, повышенной чувствительностью к инсулину и снижением индекса массы тела [55].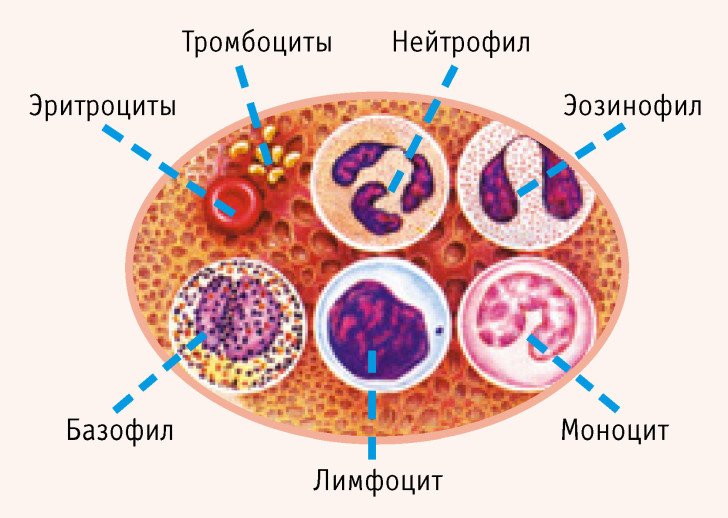
2) Потеря веса
У людей с ожирением потеря веса сопровождалась значительным снижением числа моноцитов и нейтрофилов. Снижение циркулирующих моноцитов коррелировало с лучшей чувствительностью к инсулину [21].
3) Жирные кислоты омега-3
Регулярное потребление жирных кислот омега-3, содержащихся в жирной рыбе, такой как скумбрия и лосось, или в добавках с рыбьим жиром, может защитить от атеросклероза и сердечных заболеваний [56].
Люди, принимающие добавки с рыбьим жиром, реже страдали воспалением стенок кровеносных сосудов, вызванным моноцитами.Этот эффект не был столь выражен у людей, уже принимавших лекарства для лечения заболеваний периферических артерий [57].
4) Средиземноморская диета
Некоторые исследования показывают, что средиземноморская диета может уменьшить воспаление, вызванное моноцитами [58, 59].
Средиземноморская диета состоит из таких продуктов, как семена, орехи, овощи, фрукты, цельнозерновые продукты и мононенасыщенные жиры из оливкового масла.
5) Умеренное потребление алкоголя
Алкоголь влияет на функцию моноцитов.В одном исследовании моноциты людей, которые выпивали умеренное количество алкоголя, были менее активны даже после одной порции. Моноциты, подвергшиеся непосредственному воздействию алкоголя, также имели сниженный воспалительный ответ на провоспалительные соединения [60, 61].
Умеренное потребление алкоголя, около 1 или 2 порций в день, связано со значительным снижением продукции моноцитами воспалительных цитокинов TNF-альфа и IL-1бета. Это также связано с повышенной выработкой IL-10, противовоспалительного сигнала [62, 61].
Мы не рекомендуем увеличивать потребление алкоголя с целью купирования воспаления. Поговорите со своим врачом о более подходящих противовоспалительных стратегиях.
Вы можете снизить количество моноцитов и воспаление, контролируя свой вес, регулярно занимаясь спортом и соблюдая средиземноморскую диету.
Другие факторы, снижающие уровень моноцитов
1) Кортизол и глюкокортикоиды
При назначении врачом разовая доза кортизола снижает уровень моноцитов на 90% через 4–6 часов после лечения.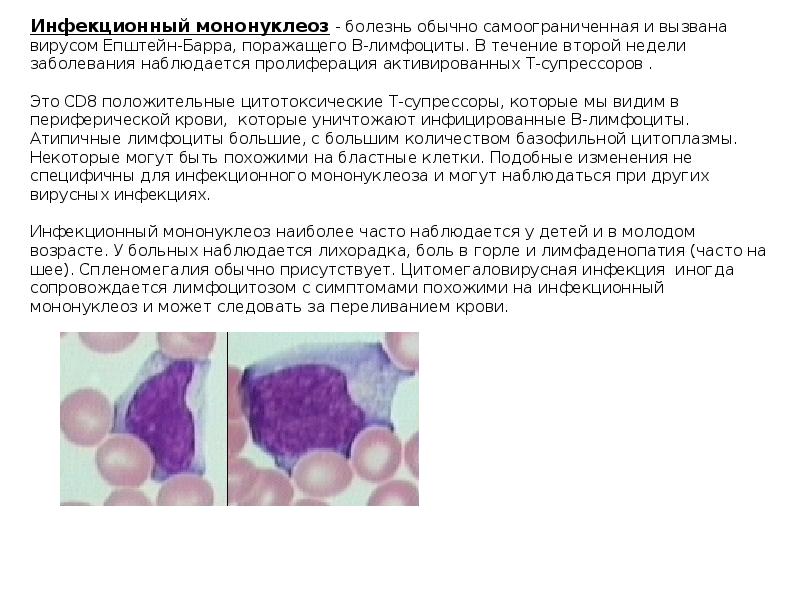 Это снижение сохранялось в течение примерно 24 часов. Впоследствии уровни моноцитов возвращаются к норме через 24–72 часа после лечения [63].
Это снижение сохранялось в течение примерно 24 часов. Впоследствии уровни моноцитов возвращаются к норме через 24–72 часа после лечения [63].
2) Эстроген и прогестерон
Согласно одному исследованию, эстроген (и, возможно, также прогестерон) снижает количество моноцитов, предотвращая размножение моноцитов. Этот механизм может объяснить, почему клеточный иммунитет снижается во время беременности [64].
3) Инфликсимаб
Инфликсимаб — иммунодепрессант, назначаемый для лечения воспалительных заболеваний, таких как болезнь Крона, язвенный колит и ревматоидный артрит [65, 66, 67].
Инфликсимаб убивает моноциты, что может помочь уменьшить воспаление у пациентов с хроническими воспалительными заболеваниями [68].
Эстроген, прогестерон, кортизол и новые иммунодепрессанты снижают воспаление и снижают количество моноцитов. Ни при каких обстоятельствах не принимайте рецептурные лекарства без наблюдения врача.
Еда на вынос
Состояниями, наиболее часто связанными с высоким уровнем моноцитов (моноцитозом), являются хронические инфекции и воспаления.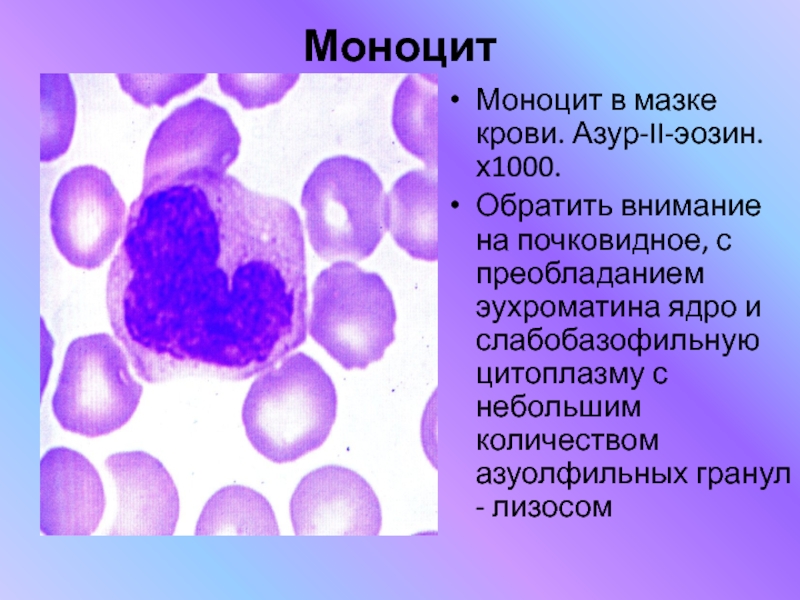 В свою очередь, слишком много моноцитов может усилить воспаление и закупорить кровеносные сосуды.Стратегии, которые могут заинтересовать людей с высоким уровнем моноцитов, включают регулярные физические упражнения, снижение веса и средиземноморскую диету.
В свою очередь, слишком много моноцитов может усилить воспаление и закупорить кровеносные сосуды.Стратегии, которые могут заинтересовать людей с высоким уровнем моноцитов, включают регулярные физические упражнения, снижение веса и средиземноморскую диету.
Узнать больше
определение моноцитоза в The Free Dictionary
Также были сообщения о нейтропении, моноцитозе, эозинофилии и лейкоцитозе. Моноциты имели заметные значения на всех рыбных фермах, которые соответствовали моноцитозу. Однако лимфоциты и нейтрофилы, несмотря на широкий разброс, находились в пределах референтных значений для вида (Azevedo et al, 2006; Ghiraldelli et al, 2006b).Очевидная базофилия и моноцитоз этих уток могут быть связаны с хроническим стрессом реабилитации и содержания в неволе в относительно интенсивных условиях выращивания по сравнению с тем, что встречается в естественных условиях. С другой стороны, имеющиеся данные о воздействии непостоянных пестицидов на кроветворение человека увеличивается, включая сообщения о лейкопении, лейкоцитозе, лимфопении, лимфоцитозе, нейтропении, моноцитозе, анемии и тромбоцитопении, связанных с профессиональным воздействием современных пестицидов (9,11,15-20). Случаи нейтрофилии, указывающие на сдвиг влево, часто связаны с лимфопенией, которая сопровождается моноцитозом, маркером, демонстрирующим острое воспаление. 17 При изучении наших данных было обнаружено, что аппендицит был группой, в которой в основном увеличивались нейтрофилы и моноциты, а в основном уменьшались лимфоциты. У пациента были атипичные признаки, такие как спленомегалия, анемия, нейтропения, моноцитоз и тромбоцитопения с плохим ответом на лечение НПВП. не были.Эозинофилия, моноцитоз, легкая анемия и тромбоцитоз также могут проявляться при этом заболевании. Однако, как сообщалось ранее, не было обнаружено признаков моноцитоза (количество моноцитов: 0,01 x 109/л), сопровождающего лимфоцитопению [4], что может быть связано с транзиторным истощение иммунного ответа. Изучение инфекции Borrelia miyamotoi в нелеченном случае, демонстрирующем возвратный тиф, моноцитоз и положительную серологию Лайма C6. Результаты показали, что добавление витамина D ускоряет конверсию микроскопического мазка мокроты КУМ и улучшает вызванное лечением разрешение лимфопении, моноцитоза.
Случаи нейтрофилии, указывающие на сдвиг влево, часто связаны с лимфопенией, которая сопровождается моноцитозом, маркером, демонстрирующим острое воспаление. 17 При изучении наших данных было обнаружено, что аппендицит был группой, в которой в основном увеличивались нейтрофилы и моноциты, а в основном уменьшались лимфоциты. У пациента были атипичные признаки, такие как спленомегалия, анемия, нейтропения, моноцитоз и тромбоцитопения с плохим ответом на лечение НПВП. не были.Эозинофилия, моноцитоз, легкая анемия и тромбоцитоз также могут проявляться при этом заболевании. Однако, как сообщалось ранее, не было обнаружено признаков моноцитоза (количество моноцитов: 0,01 x 109/л), сопровождающего лимфоцитопению [4], что может быть связано с транзиторным истощение иммунного ответа. Изучение инфекции Borrelia miyamotoi в нелеченном случае, демонстрирующем возвратный тиф, моноцитоз и положительную серологию Лайма C6. Результаты показали, что добавление витамина D ускоряет конверсию микроскопического мазка мокроты КУМ и улучшает вызванное лечением разрешение лимфопении, моноцитоза. , гиперцитокинемия и гиперхимокинемия.Лейкоцитоз в сочетании с лимфопенией, моноцитозом и эзинофилией был зарегистрирован у буйволов с задержкой плаценты, что может быть связано со слабым иммунным механизмом, сопровождающимся воспалением матки, которое требует большего количества моноцитов для удаления инородного клеточного мусора (Sivaraman et al., 2003).
, гиперцитокинемия и гиперхимокинемия.Лейкоцитоз в сочетании с лимфопенией, моноцитозом и эзинофилией был зарегистрирован у буйволов с задержкой плаценты, что может быть связано со слабым иммунным механизмом, сопровождающимся воспалением матки, которое требует большего количества моноцитов для удаления инородного клеточного мусора (Sivaraman et al., 2003).Необычная боль в пояснице с моноцитозом: клинический случай
Введение
Гранулоцитарная саркома (ГС) — редкая форма опухоли
состоящая из экстрамедуллярных лейкозных инфильтратов.ГС может развиваться
на различных участках, включая кожу, орбитальную область, центральную
нервная система (ЦНС), лимфатические узлы и селезенка (1). GS может присутствовать при начальной лейкемии
диагноза, во время прогрессирования или рецидива заболевания, или после
трансплантация гемопоэтических стволовых клеток (ТСК) (2). Симптомы СГ зависят от его размера и
локализации и включают болезненность или аномальное кровотечение. То
частота СГ при остром миелоидном лейкозе (ОМЛ) составляет 2,5–9,1%
(3), но реже
хронический миелогенный лейкоз и другие миелопролиферативные
болезни.
Хронический миеломоноцитарный лейкоз (ХММЛ) является подтипом миелодиспластического/миелопролиферативного новообразования (4). Клиническая картина CMMoL часто неспецифические, включая утомляемость, одышку, петехии, кровоизлияния, поражения кожи или спленомегалия. Диагностические критерии включают моноцитоз >1000 клеток/мм3 в течение >3 месяцев, исключение всех возможных инфекционных этиологий и отсутствие специфические генные перестройки или мутации (5).
Синдром конского хвоста связан со сдавлением корешков пояснично-крестцового нерва ниже уровня конуса medullaris, который проявляется болезненностью и дисфункцией сфинктера. (6).Настоящее исследование представляет редкий случай боли в пояснице и моноцитоза в качестве начального презентация. Рентгенологические и иммуногистохимические исследования подтвердил диагноз CMMoL с гранулоцитарной саркомой, расположенной в крестцовая область.
История болезни
62-летняя женщина с 1-летним анамнезом
легкие боли в пояснице с болезненностью, иррадиирующей в левую ногу. Пациент ранее принимал безрецептурные анальгетики и
периодически проходил лечебную физкультуру.Однако
болезненность сохранялась, а затем усиливалась с развитием
слабость в левой голени 28.02.2015. Другое
соответствующие симптомы включали задержку мочи, недержание стула
и оставил отек десны, что побудило обратиться в службу неотложной помощи.
Отделение Tri-Service General Hospital (Тайбэй, Тайвань).
При физикальном осмотре у пациента обнаруживаются отеки и
болезненность в области задней нижней челюсти слева. Неврологический
при осмотре выявлена гипестезия над дерматомами L3–5 и S1,
наряду с рыхлым анальным сфинктером и неустойчивой походкой.двусторонний
мышечная сила была 4 (7) степени, а
Симптом Бабинского отсутствовал. Выявлен мазок периферической крови
моноцитоз, анемия и тромбоцитопения: количество лейкоцитов,
80 030/мкл; гемоглобин 10,7 г/дл; тромбоциты 32 000/мкл; моноциты,
38,2%; и метамиелоциты, 2,9%. Пальпируется увеличенная селезенка 5
см ниже края левой реберной дуги, но без новообразований в легких или молочной железе
были найдены.
Пациент ранее принимал безрецептурные анальгетики и
периодически проходил лечебную физкультуру.Однако
болезненность сохранялась, а затем усиливалась с развитием
слабость в левой голени 28.02.2015. Другое
соответствующие симптомы включали задержку мочи, недержание стула
и оставил отек десны, что побудило обратиться в службу неотложной помощи.
Отделение Tri-Service General Hospital (Тайбэй, Тайвань).
При физикальном осмотре у пациента обнаруживаются отеки и
болезненность в области задней нижней челюсти слева. Неврологический
при осмотре выявлена гипестезия над дерматомами L3–5 и S1,
наряду с рыхлым анальным сфинктером и неустойчивой походкой.двусторонний
мышечная сила была 4 (7) степени, а
Симптом Бабинского отсутствовал. Выявлен мазок периферической крови
моноцитоз, анемия и тромбоцитопения: количество лейкоцитов,
80 030/мкл; гемоглобин 10,7 г/дл; тромбоциты 32 000/мкл; моноциты,
38,2%; и метамиелоциты, 2,9%. Пальпируется увеличенная селезенка 5
см ниже края левой реберной дуги, но без новообразований в легких или молочной железе
были найдены. Магнитно-резонансная томография позвоночника показала несколько
неоднородно контрастирующие образования диаметром до 5,6 см,
расположен на уровне S1-S3 позвонков.Множественные усиливающие узелки были
выявлены в спинномозговых каналах от L4 до каудального конца (рис. 1). Больной был немедленно госпитализирован
с диагнозом синдром конского хвоста. Биопсия костного мозга и
выполнена биопсия позвоночника. Костный мозг был гиперклеточным и
продемонстрированы диспластические мегакариоциты с гипосегментацией,
левосмещенная миелоидная гиперплазия и увеличение миелоидного: эритроидного
отношение (>10/1). Кластер дифференцировки (CD)34 (мышь
моноклональное антитело против человеческого CD34 класса II; разведение 1:100;
клон, QBEnd 10; Дако, Глоструп, Дания), был положительным примерно в 15% случаев.
клеток, а также было увеличено количество CD68-позитивных клеток
(мышиное моноклональное антитело против CD68 человека; разведение 1:100; клон,
ПГ-М1; Дако).Два отчета о патологии показали CMMoL с позвоночником.
Магнитно-резонансная томография позвоночника показала несколько
неоднородно контрастирующие образования диаметром до 5,6 см,
расположен на уровне S1-S3 позвонков.Множественные усиливающие узелки были
выявлены в спинномозговых каналах от L4 до каудального конца (рис. 1). Больной был немедленно госпитализирован
с диагнозом синдром конского хвоста. Биопсия костного мозга и
выполнена биопсия позвоночника. Костный мозг был гиперклеточным и
продемонстрированы диспластические мегакариоциты с гипосегментацией,
левосмещенная миелоидная гиперплазия и увеличение миелоидного: эритроидного
отношение (>10/1). Кластер дифференцировки (CD)34 (мышь
моноклональное антитело против человеческого CD34 класса II; разведение 1:100;
клон, QBEnd 10; Дако, Глоструп, Дания), был положительным примерно в 15% случаев.
клеток, а также было увеличено количество CD68-позитивных клеток
(мышиное моноклональное антитело против CD68 человека; разведение 1:100; клон,
ПГ-М1; Дако).Два отчета о патологии показали CMMoL с позвоночником. участие (рис. 2A-D). Цитогенетический
исследования были нормальными (46ХХ). Проточная цитометрия выявила 18%
монобласты, лишенные экспрессии кластера дифференцировки
(CD)14, CD34 и CD117, а также с повышенной экспрессией CD56. То
поэтому пациенту был поставлен диагноз CMMoL, промежуточный-2,
в соответствии с CMMoL-специфичной прогностической системой оценки (8) и лечение низкими дозами цитозина
арабинозид (10 мг/м2 каждые 12 ч) в течение 10 дней.
Была также организована паллиативная лучевая терапия, но она не проводилась, т.к.
состояние больного ухудшилось.Пациент скончался от
тяжелый сепсис через полмесяца.
участие (рис. 2A-D). Цитогенетический
исследования были нормальными (46ХХ). Проточная цитометрия выявила 18%
монобласты, лишенные экспрессии кластера дифференцировки
(CD)14, CD34 и CD117, а также с повышенной экспрессией CD56. То
поэтому пациенту был поставлен диагноз CMMoL, промежуточный-2,
в соответствии с CMMoL-специфичной прогностической системой оценки (8) и лечение низкими дозами цитозина
арабинозид (10 мг/м2 каждые 12 ч) в течение 10 дней.
Была также организована паллиативная лучевая терапия, но она не проводилась, т.к.
состояние больного ухудшилось.Пациент скончался от
тяжелый сепсис через полмесяца.
Обсуждение
У пациентов, которые жалуются на боль в пояснице,
тщательное обследование всех возможных основных системных заболеваний, с
следует провести оценку неврологических симптомов,
особенно у пациентов пожилого возраста. Всего 5–14% рака
у пациентов развиваются метастазы в позвоночник со сдавлением спинного мозга (9). Легкие, грудь, простата, почки и
опухоли желудочно-кишечного тракта склонны к прогрессированию или присутствуют
с метастазами в позвоночник (10). А
следует провести детальную проработку для поиска первичного
этиология. Помимо солидных опухолей, метастатические поражения позвоночника
следует учитывать гематологическое происхождение,
особенно у пациентов с аномальной гемограммой.
А
следует провести детальную проработку для поиска первичного
этиология. Помимо солидных опухолей, метастатические поражения позвоночника
следует учитывать гематологическое происхождение,
особенно у пациентов с аномальной гемограммой.
Заболеваемость и распространенность CMMoL не высоки,
и точные частоты неизвестны (11). Гранулоцитарная саркома чаще встречается у
при остром лейкозе и реже при хроническом лейкозе (1). Лейкемия кожи является наиболее распространенным типом
GS, который представлен в CMMoL, составляет 10.2% случаев во время
прогрессирование заболевания (12). Определенный
случаи быстро трансформируются в ОМЛ. Остальные места вовлечения
перикард, тощая кишка и яичко соответственно (13–16).
Экстрамедуллярное поражение ЦНС встречается редко, и только один
сообщалось о педиатрическом пациенте после ТСК (17). Этот молодой пациент с CMMoL испытал
костномозговой рецидив через 8 мес после формирования ГС в ЦНС.
По вышеуказанным данным известно, что
наличие GS у пациентов с CMMoL указывает на неблагоприятный исход и
возможный признак бластного криза.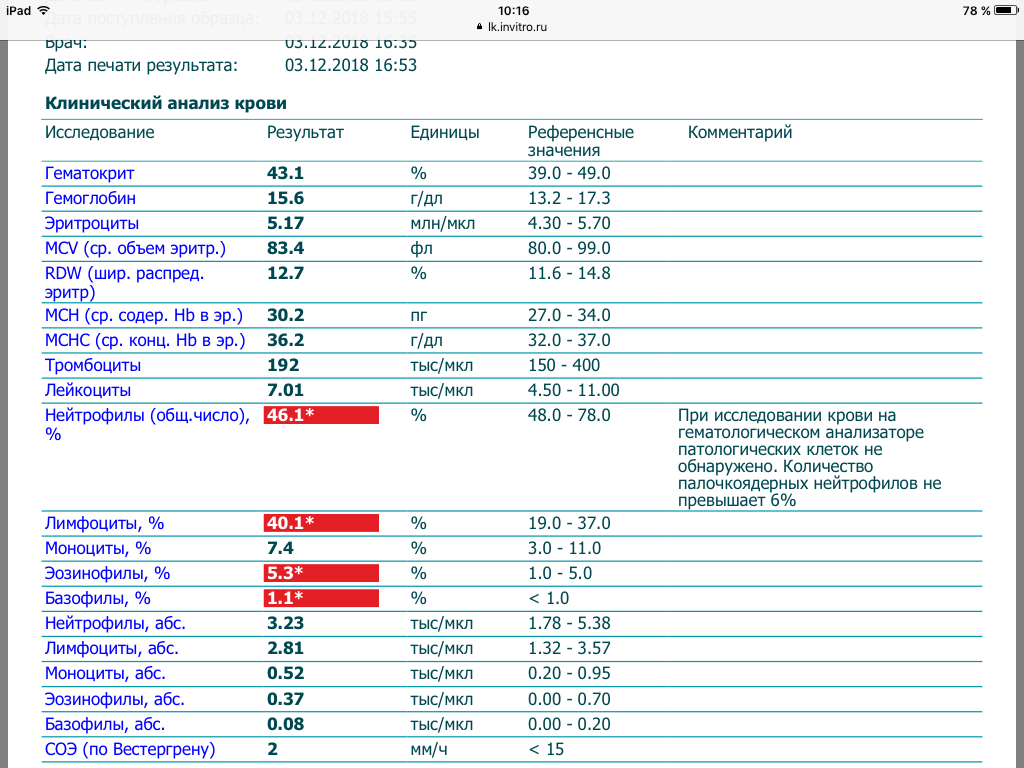 Лечение CMMoL варьируется
в зависимости от тяжести течения заболевания и особенностей
презентации. Пациенты с более низким количеством бластов (<5%) могут
первоначально требуется только поддерживающая терапия, если их симптомы легкие.
Однако обычная химиотерапия, гипометилирующие агенты или
аллогенная СКТ может потребоваться для пациентов с бластом костного мозга
количество > 10% или для тех, у кого проявляются другие признаки прогрессирующего
или агрессивное заболевание. Реакция на лечение гипометилирования
агентов составляет 25–70% (5).Пациенты могут
также требуется> 4 циклов терапии для достижения клинического ответа,
что похоже на миелодиспластический синдром (18).
Лечение CMMoL варьируется
в зависимости от тяжести течения заболевания и особенностей
презентации. Пациенты с более низким количеством бластов (<5%) могут
первоначально требуется только поддерживающая терапия, если их симптомы легкие.
Однако обычная химиотерапия, гипометилирующие агенты или
аллогенная СКТ может потребоваться для пациентов с бластом костного мозга
количество > 10% или для тех, у кого проявляются другие признаки прогрессирующего
или агрессивное заболевание. Реакция на лечение гипометилирования
агентов составляет 25–70% (5).Пациенты могут
также требуется> 4 циклов терапии для достижения клинического ответа,
что похоже на миелодиспластический синдром (18).
В настоящем исследовании сообщается о случае необычного
представление о боли в спине, которая была окончательно диагностирована как
гематологическая злокачественность. В заключение следует принять во внимание GS.
внимание пациентам с опухолью позвоночника и аномальными
гемограмма. Наличие GS в CMMoL предсказывает плохой исход.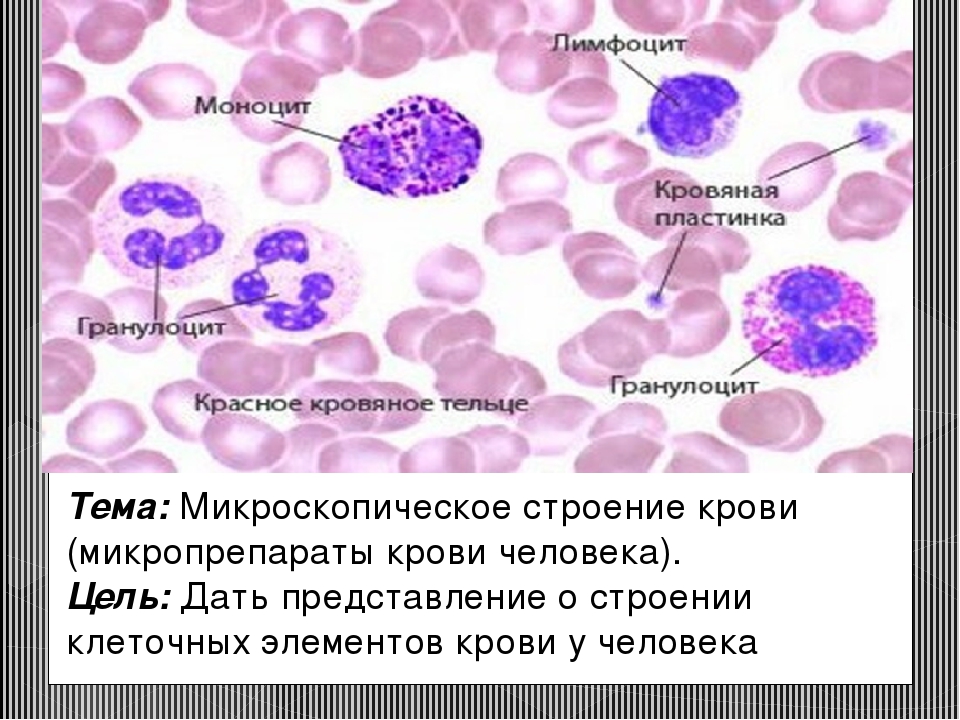 А
Своевременная биопсия важна для обеспечения правильного диагноза и
назначать соответствующее лечение, предотвращая тем самым быстрое прогрессирование
болезни.
А
Своевременная биопсия важна для обеспечения правильного диагноза и
назначать соответствующее лечение, предотвращая тем самым быстрое прогрессирование
болезни.
Благодарности
Авторы хотели бы поблагодарить г-на Чиан-Мин Чена, Мисс Синь-И Лю и доктор Вэнь-Чуан Цай из Tri-Service General больнице за их опыт в анализе костного мозга пациента мазок, спинномозговая биопсия и результаты проточной цитометрии. То авторы также хотели бы поблагодарить доктора Энтони Янкила (отделение Микробиология и иммунология, Университет Луисвилля, Луисвилл, Кентукки, США) за критический обзор рукописи.
Каталожные номера
1 | Йылмаз А.Ф., Сайдам Г., Шахин Ф. и Баран И.: Гранулоцитарная саркома: систематический обзор.Am J Blood Res. 3: 265–270. 2013. PubMed/NCBI . |
2 | Авни Б. |
3 | Бакст Р.Л., Таллман М.С., Дауэр Д., Яхалом J: Как я лечу экстрамедуллярный острый миелоидный лейкоз. Кровь. 118:3785–3793. 2011. Просмотр статьи: Google Scholar: PubMed/NCBI . |
4 | Арбер Д.А., Орази А., Хассерджян Р., Тиле Дж., Borowitz MJ, Le Beau MM, Bloomfield CD, Cazzola M и Vardiman JW: Пересмотр 2016 г. классификации Всемирной организации здравоохранения. миелоидных новообразований и острого лейкоза.Кровь. 127:2391–2405. 2016. Просмотр статьи: Google Scholar: PubMed/NCBI . |
5 | Патнаик М.М., Парих С.А., Хэнсон К. |
6 | Фрейзер С., Робертс Л. и Мерфи Э.: Кауда синдром лошадиного: обзор литературы по его определению и клиническим проявлениям презентация.Arch Phys Med Rehabil. 90:1964–1968. 2009. Просмотр статьи: Google Scholar: PubMed/NCBI . |
7 | Bickley LS и Szilagyi PG: Карман BATES Руководство по физическому осмотру и сбору анамнеза. 5-й. Липпинкотт Уильямс и Уилкинс; Филадельфия: стр. 3132007 . |
8 | Такой Э., Герминг У., Малковати Л., Сервера Дж.,
Кюндген А., Порта М.Г. Делла, Номдедеу Б., Аренильяс Л., Луньо Э., Шикой
B и др. |
9 | Калутян ЧП, Юртер А, Задник ПЛ, Sciubba DM и Gokaslan ZL: Современные парадигмы метастатического поражения позвоночника Болезнь: обзор, основанный на доказательствах. Энн Сург Онкол. 21: 248–262. 2014. Просмотр статьи: Google Scholar: PubMed/NCBI . |
10 | Coleman RE: Скелетные осложнения злокачественность. Рак 80 (8 Доп).1588–1594 гг. 1997. Просмотр статьи : Google Scholar |
11 | Парих С.А. и Теффери А.: Хронический
миеломоноцитарный лейкоз: обновленная информация о диагностике, риске, 2013 г.
стратификация и управление. |
12 | Мэтью Р.А., Беннет Дж.М., Лю Дж.Дж., Комрокджи RS, Lancet JE, Naghashpour M, Messina JL, List AF, Moscinski LC и Чжан Л.: Кожные проявления при ХММЛ: указание на заболевание ускорение или преобразование в ПОД и обзор литературы.Лейк Рез. 36:72–80. 2012. Просмотр статьи: Google Scholar: PubMed/NCBI . |
13 | Брэдфорд Ч.Р., Смит С.Р. и Уоллис Дж.П.: Перикардиальный экстрамедуллярный гемопоэз при хроническом миеломоноцитарном лейкемия. Джей Клин Патол. 46:674–675. 1993. Просмотр статьи: Google Scholar: PubMed/NCBI . |
14 | Крейг Дж.В. и Лин Р.Дж.: Паранеопластический
аутоиммунитет, связанный с тестикулярной миелоидной саркомой и хроническим
миеломоноцитарный лейкоз. |
15 | Фукусима М., Оно Ю. и Имаи Ю.: Гранулоцитарная саркома тонкой кишки у больного с хронический миеломоноцитарный лейкоз. Копать эндоск. 26:757–758. 2014. Просмотр статьи : Академия Google : PubMed/NCBI |
16 | Хьямс Э.С., Гупта Р., Меламед Дж., Танеджа С.С. и Шах О: Поражение почек при хроническом миеломоноцитарном лейкозе. требующая нефроуретерэктомии.Преподобный Урол. 11:33–37. 2009. PubMed/NCBI . |
17 | Уилсон Д.Б., Михальски Дж.М., Гроссман В.Дж. и Hayashi RJ: Изолированный рецидив ЦНС после стволовых клеток трансплантация при ювенильном миеломоноцитарном лейкозе. Дж Педиатр Гематол Онкол. 25:910–913. 2003. Просмотр статьи: Google Scholar: PubMed/NCBI .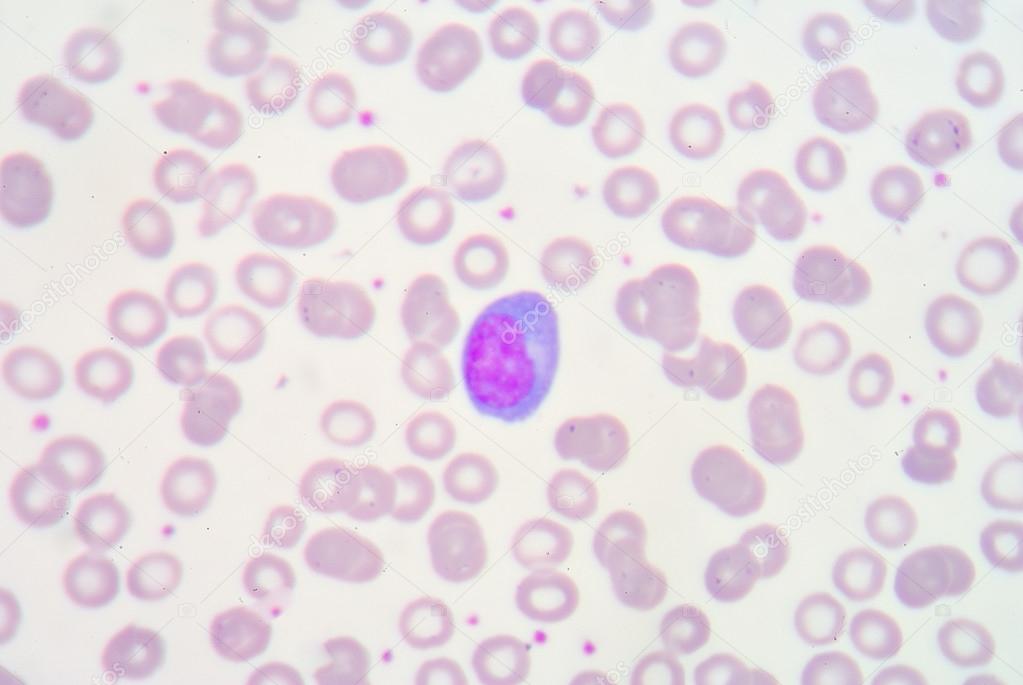 |
18 | Сильверман Л.Р., Маккензи Д.Р., Петерсон Б.Л., Холланд Дж.Ф., Бэкстром Дж.Т., Бич С.Л. и Ларсон Р.А.: Рак и Лейкемия группы B: Дальнейший анализ испытаний с азацитидином в пациентов с миелодиспластическим синдромом: исследования 8421, 8921 и 9221 по раку и лейкемии группы B.Дж. Клин Онкол. 24:3895–3903. 2006. Просмотр статьи: Google Scholar: PubMed/NCBI . |
Границы | Моноциты и макрофаги при COVID-19
Введение
COVID-19 (1, 2) — это в первую очередь инфекция дыхательных путей от легкой до средней степени тяжести, многоцепочечная РНК бета-коронавируса (3–5). В то время как 80% инфекций приводят к бессимптомному или легкому заболеванию с симптомами простуды, включая сухой кашель, головную боль, потерю вкуса, одышку, утомляемость и лихорадку, сдерживаемые эффективным иммунным ответом (6–8), 15% пациентов переходят у 5% развивается тяжелое заболевание, требующее интенсивной терапии и кислородной поддержки, а у 5% развивается критическое заболевание с опасной для жизни пневмонией, острым респираторным дистресс-синдромом (ОРДС) и септическим шоком, часто заканчивающимся полиорганной дисфункцией и смертью (9).
Возраст, различные сопутствующие заболевания, включая диабет, ожирение, легочные и сердечно-сосудистые заболевания, а также генетические полиморфизмы коррелируют с более высоким риском дыхательной недостаточности (10–13).
SARS-CoV-2, подобно SARS-CoV (14), проникает в клетки-хозяева через рецептор ангиотензинпревращающего фермента 2 (ACE2) и использует человеческую протеазу TMPRSS2 в качестве активатора проникновения (15, 16). Эти гены экспрессируются в широком диапазоне клеток, включая носовые и бронхиальные эпителиальные клетки, энтероциты, кардиомиоциты, клетки сосудов и яичек, плацентарные трофобласты, клетки желчных протоков (17, 18), а также макрофаги (19, 20).Кроме того, обсуждались дополнительные входные молекулы, такие как нейропилин (NRP1), для облегчения проникновения вирусных клеток (21, 22).
Хотя острые респираторные проявления являются наиболее частым признаком, COVID-19 может иметь множественные острые внелегочные клинические эффекты, которые, вероятно, связаны с сосудистой патологией (23), а также длительные осложнения, называемые пост-COVID-синдромом или длительный COVID, включая утомляемость или неврологические последствия (24–27).
Контроль вирусных инфекций и купирование воспаления обычно зависят от дозы и пути заражения, вирулентных свойств вируса, а также иммунных факторов хозяина (28, 29).Жестко регулируемые взаимодействия между эпителиальными клетками и иммунными клетками, управляемые передачей сигналов цитокинов и прямыми клеточными контактами, также играют решающую роль при COVID-19 (30, 31). Более того, удаление вируса не обязательно означает выздоровление. Гиперактивированные и дисрегуляционные иммунные клетки представляют существенную опасность усугубления повреждения тканей (32–34) и изменяют восприимчивость к вторичной бактериальной суперинфекции (35, 36).
Тяжелое течение COVID-19 ассоциировалось с выраженными изменениями периферической иммунной активности (37, 38), включая повышение уровней острофазовых реагентов и провоспалительных цитокинов (39, 40), нейтрофилию и появление незрелых нейтрофилов и нейтрофилов низкой плотности (41, 42), повышенное соотношение нейтрофилов и лимфоцитов и лимфопения (43), а также миелоидное воспаление (44) и снижение экспрессии изотипа человеческого лейкоцитарного антигена DR (HLA-DR) циркулирующими моноцитами (42, 45).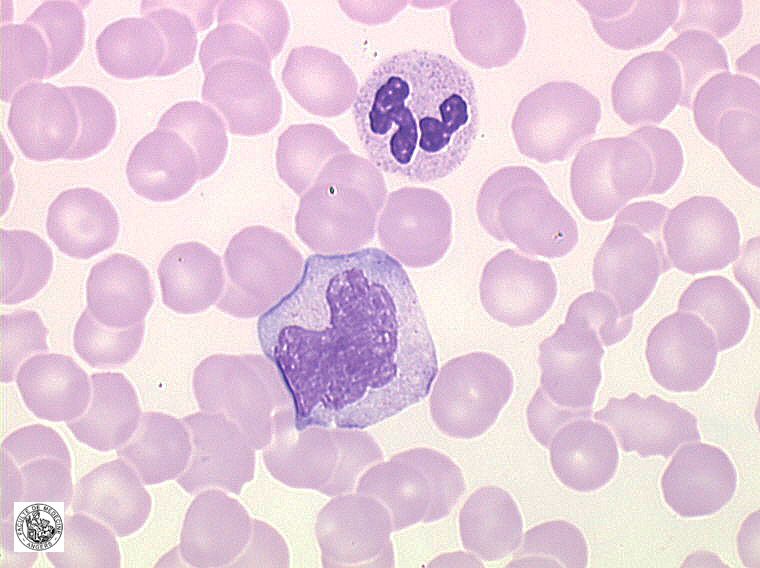
Была предложена зависимая от времени многостадийная модель заболевания COVID-19 (28). Ранняя и эффективная активация иммунной системы посредством индукции сильного интерферонового ответа имеет решающее значение для борьбы с вирусом. Однако отсроченный и/или продолжительный ответ интерферона может привести к прогрессирующему повреждению тканей, что в конечном итоге может привести к вредному гипервоспалению, характеризующемуся чрезмерной активацией мононуклеарных фагоцитов (МНЧ) и коагуляцией в сочетании с нарушением регуляции механизмов репарации тканей и фиброзом (46). .
Вместе с дендритными клетками (ДК) макрофаги и моноциты образуют систему МНЧ (47). Помимо того, что они являются профессиональными антигенпрезентирующими клетками (АРС), МНЧ обнаруживают и фагоцитируют патогены, опосредуют рекрутирование лейкоцитов, инициируют и формируют иммунные ответы и регулируют воспаление.
Макрофаги представляют собой гетерогенное семейство резидентных в тканях фагоцитирующих врожденных иммунных клеток, включая микроглию головного мозга, клетки Купфера печени и легочные альвеолярные и интерстициальные макрофаги, которые играют важную роль в тканевом гомеостазе и иммунной защите (48). В случае инфекции макрофаги воспринимают сигналы опасности от микробных патогенов или повреждения тканей через множество рецепторов распознавания образов (PRR) и реагируют высвобождением воспалительных молекул, которые устраняют патогены, инициируют воспаление и привлечение дополнительных эффекторных клеток и стимулируют ткани. ремонт (32). Однако, как в случае, например, при синдроме активации макрофагов (MAS), подавляющая реакция макрофагов может быть вредной для хозяина (33).
В случае инфекции макрофаги воспринимают сигналы опасности от микробных патогенов или повреждения тканей через множество рецепторов распознавания образов (PRR) и реагируют высвобождением воспалительных молекул, которые устраняют патогены, инициируют воспаление и привлечение дополнительных эффекторных клеток и стимулируют ткани. ремонт (32). Однако, как в случае, например, при синдроме активации макрофагов (MAS), подавляющая реакция макрофагов может быть вредной для хозяина (33).
Моноциты представляют собой циркулирующие в крови фагоцитирующие врожденные иммунные клетки, классически разделенные на три подгруппы на основе их соответствующей экспрессии CD14 и CD16 [классические (CD14 + CD16 — ), неклассические (CD14dim CD16 + ) и промежуточное соединение (CD14 + CD16 + )] (48, 49).При патологических состояниях, в том числе при вирусных инфекциях, моноциты, активированные и рекрутированные медиаторами воспаления, инфильтрируют пораженные ткани и приобретают фенотипы воспалительных макрофагов и DC-подобных фенотипов для выполнения своих эффекторных функций про- и противовоспалительной активности, антигенпрезентации и ремоделирования тканей.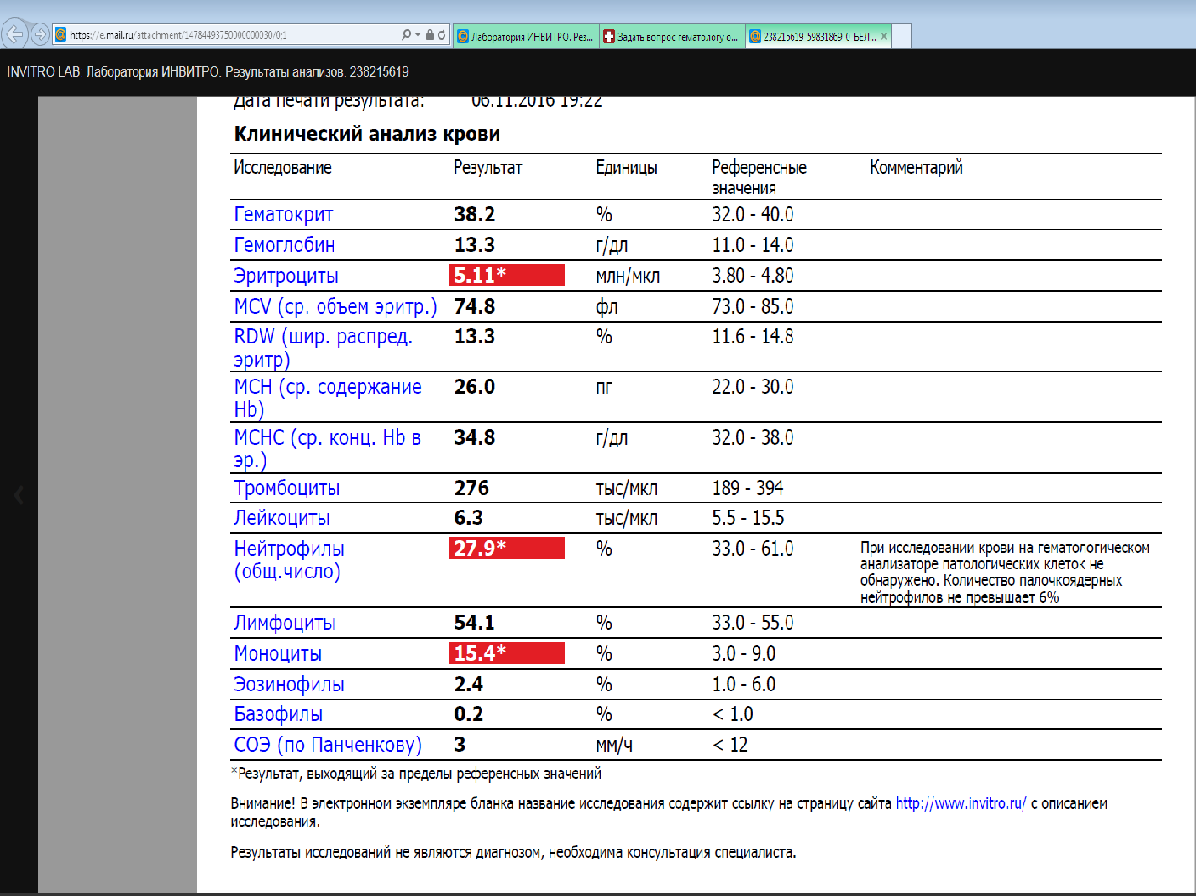 50).
50).
Здесь мы излагаем основные результаты, касающиеся роли моноцитов и макрофагов в COVID-19, и помещаем их в контекст общих знаний об этих клетках при вирусных инфекциях.
Онтогенез и функция альвеолярных и интерстициальных макрофагов
Каждый день легкие вдыхают тысячи литров воздуха, содержащего большое количество патогенов, включая вирусы, бактерии и грибки (51). Для предотвращения инфекции и связанных с ней осложнений для организма необходим жесткий контроль со стороны иммунной системы. В легких макрофаги являются наиболее распространенным типом иммунных клеток в гомеостатических условиях. Основываясь на их точном местонахождении, их можно разделить как минимум на две разные популяции; интерстициальные макрофаги (ИМ) и альвеолярные макрофаги (АМ) (52, 53).
ИМ располагаются в паренхиме между эндотелием микрососудов и альвеолярным эпителием, а АМ имеют тесный контакт с эпителиальными клетками альвеол и располагаются в просвете воздушного пространства.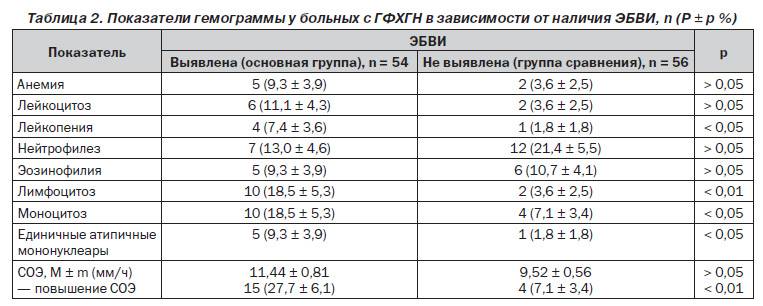 Однако недавнее исследование, проведенное Neupane et al. показали, что АМ, в отличие от макрофагов в других тканях, не сидячие, но могут ползать внутри и между альвеолами, используя поры Кона (54). По экспрессии интегринов CD11c neg CD11b pos IM можно отличить от CD11c pos CD11b neg AM (52).
Однако недавнее исследование, проведенное Neupane et al. показали, что АМ, в отличие от макрофагов в других тканях, не сидячие, но могут ползать внутри и между альвеолами, используя поры Кона (54). По экспрессии интегринов CD11c neg CD11b pos IM можно отличить от CD11c pos CD11b neg AM (52).
Помимо слизи и эпителиального барьера, АМ являются первыми защитниками от проникновения патогенов в дыхательную систему. Они происходят из желточного мешка и заселяют легкие сразу после рождения (55, 56). АМ обладают пролиферативной способностью, поэтому могут сохраняться на протяжении всей жизни путем самообновления и не зависят от замещения костным мозгом (57–59). АМ, обнаруженные в жидкости бронхоальвеолярного лаважа (БАЛ) после трансплантации легких, были почти исключительно донорскими (60). После истощения легочных макрофагов у мышей репопуляция почти полностью происходила за счет пролиферации in situ (61).Напротив, анализ легочных МНЧ у пациентов, перенесших трансплантацию костного мозга по поводу гематологических заболеваний, показал наличие восполнения АМ моноцитами костномозгового происхождения (62). Текущее понимание пластического состава и сложного онтогенеза легочных MNP лучше всего описывается динамическим взаимодействием клеток, происходящих из макрофагов желточного мешка, фетальной печени и взрослых моноцитов, с учетом патологических угроз и вакантных ниш (63).
Текущее понимание пластического состава и сложного онтогенеза легочных MNP лучше всего описывается динамическим взаимодействием клеток, происходящих из макрофагов желточного мешка, фетальной печени и взрослых моноцитов, с учетом патологических угроз и вакантных ниш (63).
Функциональный фенотип АМ сильно зависит от местного микроокружения и может изменяться при контакте с эпителиальными клетками, напряжении кислорода и жидкости, богатой сурфактантом, что подчеркивает значимость пластичности АМ (64, 65).Следовательно, АМ могут быть про-/противовоспалительными, про-/антифибротическими, проастматическими, про-разрешающими и/или тканерепаративными. В физиологическом состоянии АМ имеют решающее значение для гомеостаза, удаляя апоптотические клетки, инородные материалы и сурфактант, тем самым обеспечивая отсутствие мусора в легких. Следует отметить, что они обычно демонстрируют иммуносупрессивный фенотип (52). Противовоспалительная программа имеет решающее значение для предотвращения нежелательного воспаления в легких, которое может представлять серьезную опасность для организма. Хотя АМ обладают антигенпрезентирующей способностью и экспрессируют HLA-DR, они способствуют толерантности и подавляют активацию лимфоцитов в гомеостатических условиях, продуцируя иммуносупрессивные простагландины и TGFβ, из которых последний вместе с ретиноевой кислотой может стимулировать развитие регуляторных Т-клеток FOXP3 + ( Treg), дальнейшее усиление противовоспалительного действия (66–68). Путем передачи сигналов через различные рецепторы, такие как CD200R (69), SIRPα (70), маннозный рецептор CD206 (71), MACRO (72), TREM2 (73) и растворимые медиаторы, включая интерлейкин (IL)-10 (74), AM TGFβ (75) и PPARγ (76) испытывают отрицательную регуляцию.Например, CD200 экспрессируется на люминальной стороне респираторных эпителиальных клеток, и связывание с CD200R на AM приводит к подавлению провоспалительных генов в AM (69).
Хотя АМ обладают антигенпрезентирующей способностью и экспрессируют HLA-DR, они способствуют толерантности и подавляют активацию лимфоцитов в гомеостатических условиях, продуцируя иммуносупрессивные простагландины и TGFβ, из которых последний вместе с ретиноевой кислотой может стимулировать развитие регуляторных Т-клеток FOXP3 + ( Treg), дальнейшее усиление противовоспалительного действия (66–68). Путем передачи сигналов через различные рецепторы, такие как CD200R (69), SIRPα (70), маннозный рецептор CD206 (71), MACRO (72), TREM2 (73) и растворимые медиаторы, включая интерлейкин (IL)-10 (74), AM TGFβ (75) и PPARγ (76) испытывают отрицательную регуляцию.Например, CD200 экспрессируется на люминальной стороне респираторных эпителиальных клеток, и связывание с CD200R на AM приводит к подавлению провоспалительных генов в AM (69).
При повреждении легких или инфекции СП могут вызывать воспалительные реакции (77). Разрушение эпителия дыхательных путей может привести к потере воздействия регуляторных лигандов, таких как CD200, что приводит к переключению на провоспалительную программу при СП (69). Распознавание связанных с патогенами молекулярных паттернов (PAMP) вторгшихся патогенов с помощью AM через PRR еще больше усиливает эту активацию.Эти активированные AM характеризуются повышенной фагоцитарной способностью, более сильным окислительным взрывом и повышенным высвобождением провоспалительных цитокинов и хемокинов, что приводит к воспалению и привлечению в легкие других иммунных эффекторных клеток, включая нейтрофилы (78). Рекрутированные клетки также включают моноциты, которые могут дифференцироваться в макрофаги и DC-подобные клетки, поэтому их часто называют производными моноцитов AM (Mo-AM) и DC (Mo-DC) по прибытии в периферические ткани и могут дополнительно усиливать воспаление. 79, 80).Их различный онтогенез и функциональность могут влиять на исход инфекции и воспаления.
Важно отметить, что продолжительное и нерегулируемое воспаление, вызванное макрофагами и моноцитами, может вызывать побочное повреждение тканей (81). Чтобы предотвратить длительное воспаление и ограничить повреждение тканей и фиброз, АМ разработали несколько стратегий. К ним относятся фагоцитоз умирающих клеток, т.е. нейтрофилы (82), предотвращая высвобождение их провоспалительного и токсического содержимого и запуская секрецию TGFβ, IL-10, простагландина E2 и фактора активации тромбоцитов из AM (83).
Респираторные патологии, такие как астма, хроническая обструктивная болезнь легких (ХОБЛ), кистозный фиброз и идиопатический легочный фиброз (ИЛФ), характеризуются нарушением фагоцитоза АМ, что приводит к постоянному воспалению (84–87).
Помимо респираторных патологий курение сигарет также представляет собой основной фактор риска нарушения функции AM. Количество СП курильщиков увеличено по сравнению с некурящими контрольными группами, но они демонстрируют меньшую фагоцитарную активность, скорость окисления глюкозы и выработку цитокинов по сравнению с некурящими контрольными группами, что увеличивает риск тяжелого прогрессирования заболевания при бактериальной и вирусной инфекции (88–91). .
После успешного воспаления подавляющие стимулы, как описано выше, восстанавливаются, и АМ переходят к противовоспалительному, репаративному фенотипу тканей, восстанавливая гомеостаз легкого (65).
Роль легочных макрофагов при вирусных респираторных инфекциях
Как описано выше, легкие подвержены постоянному риску заражения несколькими патогенами, среди которых такие вирусы, как риновирус, респираторно-синцитиальный вирус, вирус гриппа и коронавирус. Несмотря на их очевидную актуальность, исследования МНЧ легких человека при респираторных инфекциях до сих пор были ограничены, и большая часть наших знаний получена на животных моделях.Например, Шнайдер и соавт. показали, что у мышей дикого типа с дефицитом AM, инфицированных вирусом гриппа А, наблюдались нарушения газообмена и фатальная гипоксия (92). Аналогичные результаты были получены у свиней, которые после истощения АМ дихлорметилендифосфонатом были инфицированы сезонным вирусом гриппа человека h2N1, что привело к 40% смертности и усилению тяжелых респираторных симптомов, тогда как у инфицированных контрольных свиней симптомы были менее тяжелыми без смертности (93). ).
В частности, было показано, что различные вирусы, включая грипп, чикунгунья, человеческий герпес и вирус Зика, используют моноциты и макрофаги в качестве сосудов для репликации вируса, диссеминации или длительного сохранения в тканях.Они проникают в клетки посредством эндоцитоза, фагоцитоза, макропиноцитоза или слияния мембран и вызывают повышенную экспрессию провоспалительных сигнальных и противовирусных молекул (94–99). Также было показано прямое инфицирование макрофагов SARS-CoV, которое, однако, не приводило к диссеминации или амплификации вируса, а скорее к нарушению ответа интерферона I типа (IFN), что потенциально ухудшало исход заболевания (100).
При вирусной инфекции АМ продуцируют высокие уровни клеточных медиаторов, включая IL-1β, CCL3, CCL7 и CCL2, также известный как хемотаксический белок моноцитов 1 (MCP1), который быстро рекрутирует моноциты костного мозга, экспрессирующие CCR2, в легкие .Кроме того, АМ являются основными продуцентами IFN типа I, вызывающими противовирусный ответ при гриппозной инфекции (101, 102). Следует отметить, что продукция ИФН I типа АМ была выше, чем плазмацитоидными ДК (пДК), известными как естественные «клетки, продуцирующие ИФН», в ответ на вирус, что указывает на то, что пДК могут играть второстепенную роль в защите от вирусных инфекций в организме. легкое (102). Более того, альвеолярные эпителиальные клетки также не продуцировали ИФН I типа в ответ на грипп, что еще больше подчеркивает ключевую роль АМ (103).IFN типа I могут передавать аутокринные и паракринные сигналы, что приводит к активации антивирусных программ транскрипции, включая транскрипцию ISG, таких как ISG15 , IFIT1 и STAT2 , которые могут подавлять репликацию вируса (104, 105). Интересно, что не все вирусные инфекции вызывают повышенный ответ IFN I типа. Например, когда AM человека были инфицированы штаммом коронавируса 229E (HCoV-299E), они секретировали повышенное количество TNF, CCL5 и CCL4 (MIP-1β), вызывая воспаление, но уровни IFN-β оставались неизменными (106).
Вирусная инфекция запускает миграцию циркулирующих моноцитов в легкие, управляемую провоспалительными цитокинами, такими как CCL2 и CCL3, увеличивая количество защищающих мононуклеарных фагоцитов и усиливая воспаление (79). Это необходимая защитная реакция, поскольку такие вирусы, как грипп, могут либо резко уменьшить количество резидентных АМ, либо ухудшить их фенотип. Когда мыши BALB/c были инфицированы гриппом, 90% резидентных АМ были потеряны в первую неделю после заражения (107).Это, однако, было штаммоспецифическим, поскольку у мышей C57B1/6 не наблюдалось потери AM, а скорее наблюдался нарушенный фенотип. Тем не менее, оба последствия были вызваны IFN-γ и привели к повышенной восприимчивости к бактериальным суперинфекциям, что привело к значительной потере массы тела и смертности. Кроме того, недавнее исследование Neupane et al. показали, что ползание АМ, которое имеет решающее значение для функции АМ, было нарушено после заражения гриппом. Опять же, это нарушение было опосредовано путем IFN-γ и приводило к повышенному риску бактериальных суперинфекций (54).
Роль моноцитов и альвеолярных макрофагов в развитии COVID-19
Участие моноцитов и макрофагов в индуцированном SARS-CoV-2 гипервоспалении
COVID-19 характеризуется системным повышением уровня многочисленных цитокинов, включая IL-1α, IL -1β, IL-6, IL-7, фактор некроза опухоли (TNF), IFN I и II типов и воспалительные хемокины CCL2, CCL3 и CXCL10 (40, 108, 109). Повышенные уровни CCL2 и CCL7, двух хемокинов, способных рекрутировать моноциты CCR2 + , также были обнаружены в ЖБАЛ у пациентов с тяжелой формой COVID-19 (110).
Термин «цитокиновый шторм», исторически описываемый как гриппоподобный синдром, возникающий после системных инфекций и иммунотерапии (111), быстро стал широко использоваться как в научных публикациях, так и в средствах массовой информации для описания цитокинового ответа при COVID-19. 19 (39). Хотя повышенный системный цитокиновый ответ при COVID-19 бесспорен, термин «цитокиновый шторм» в патофизиологии COVID-19 является предметом споров, поскольку концентрации TNF, IL-6 и IL-8 при COVID-19 менее сильны по сравнению с к сепсису, острому респираторному дистресс-синдрому, не связанному с COVID-19, травме, остановке сердца и синдрому высвобождения цитокинов (СВЦ) (112–115).Более того, иммунные реакции на COVID-19 очень динамичны, о чем свидетельствуют зависящие от времени изменения системных уровней многих цитокинов, включая IL-6 (40). Принимая во внимание совместное появление различных системных провоспалительных цитокиновых волн с появлением аберрантных и иммуносупрессивных клеток врожденного иммунитета, еще больше усложняет точную терминологию иммунопатологии при тяжелой форме COVID-19 и предполагает гораздо более сложное взаимодействие хозяина и патогена, лучше описываемое термином вирусный сепсис (28). В любом случае системный цитокиновый профиль, наблюдаемый у пациентов, страдающих тяжелым течением COVID-19, действительно напоминает профиль, наблюдаемый при СВК, таком как синдром активации макрофагов (MAS), что на раннем этапе привело к рабочей гипотезе о том, что нарушение регуляции активации компартмента MNP способствует Гипервоспаление, связанное с COVID-19 (33, 113).
Индукция продукции цитокинов в MNP при COVID-19 может быть запущена либо посредством распознавания молекулярных паттернов, связанных с повреждением (DAMPS), высвобождаемых из эпителиальных клеток, пораженных SARS-CoV-2, с помощью PRR, либо путем прямого распознавания вирусного патогена -ассоциированные молекулярные паттерны (PAMP) через специфические Toll-подобные рецепторы, т.е. TLR2 и TLR4, ген I, индуцируемый ретиноевой кислотой (RIG-I), или ген, ассоциированный с дифференцировкой меланомы (MDA)-5 (116–119). Кроме того, было установлено, что рецепторы лектина C-типа, включая DC-SIGN, L-SIGN, LSECtin, ASGR1, CLEC4K (Langerin) и CLEC10A (MGL), а также член семейства Tweety 2, взаимодействуют с SARS-CoV-2. шиповидный белок, индуцирующий провоспалительные реакции, но не допускающий прямой инфекции.Примечательно, однако, что эти взаимодействия способствуют переносу вируса в клетки ACE + (120, 121).
Заражение MNP, резидентных в легких, SARS-CoV-2 может быть результатом либо фагоцитоза инфицированных альвеолярных эпителиальных клеток с последующим выходом вируса из лизосомы, либо прямой инфекцией. Эксперименты in vitro с ДК, происходящими из моноцитов человека, и макрофагами с SARS-CoV-2 продемонстрировали, что оба типа клеток пермиссивны к SARS-CoV-2, что было измерено путем количественного определения экспрессии нуклеокапсидного белка SARS-CoV-2 после in vitro. , но не поддерживал продуктивную репликацию вируса.Интересно, что экспрессия провоспалительных цитокинов и хемокинов, однако, запускалась только в макрофагах, а не в DC в этих экспериментальных условиях (122). Дополнительные независимые инфекционные эксперименты подтвердили абортивную инфекцию SARS-CoV-2 в ДК, происходящих из моноцитов человека, и макрофагах in vitro , а также подтвердили индукцию противовирусных и провоспалительных цитокинов, включая IFN-α/β, TNF, IL-1β, -6. , и -10, а также CXCL10, что приводит к гибели клетки-хозяина, опосредованной IFN I типа (123).Соответственно, исследование клеточного тропизма и профилей иммунной активации SARS-CoV-2 в ex vivo культурах органов тканей легких человека выявило инфекцию пневмоцитов типа I и II, а также АМ (124), подтвержденную обнаружением SARS-CoV. -2 в AM в образцах вскрытия пациентов с COVID-19 (125). Интересно, что анализ мышиных АМ, полученных от трансгенных животных (h)ACE2 человека, выявил различную восприимчивость к инфекции SARS-CoV-2 в зависимости от их поляризации, вызванной цитокинами, поскольку лечение in vitro IFN-γ и LPS вызывало повышенную частоту инфицирования по сравнению с предварительная обработка ИЛ-4 (126).Кроме того, обработка in vitro PMA-дифференцированных человеческих макрофагов THP-1 и изолированных CD14 + моноцитов шиповидным белком SARS-CoV-2 после стимуляции LPS выявила гиперреактивность к сигналам TLR за счет подавления IRAK-M (127). Более того, антителозависимые механизмы инфекции представляют собой возможный альтернативный путь и были описаны для SARS-CoV (128, 129). Помимо этого набора доказательств, демонстрирующих индукцию воспалительных путей в моноцитах и макрофагах при распознавании SARS-CoV-2, сообщалось о метаболических изменениях в этих клетках. Ex vivo инфицированные моноциты человека изменили свой метаболизм и стали высокогликолитическими, что привело к повышению уровня глюкозы, что способствовало репликации SARS-CoV-2 и продукции цитокинов (130). Кроме того, было показано, что моноциты, полученные от пациентов с COVID-19, имеют повышенное накопление липидных капель, что объясняется модуляцией синтеза и поглощения липидов, исследованной с использованием моделей инфекции in vitro, и снова способствует репликации вируса и продукции медиатора воспаления (131).Интересно, что фармакологическое ингибирование DGAT1, ключевого фермента в формировании липидных капель, ингибирует репликацию SARS-CoV-2 и выработку провоспалительных медиаторов, что открывает новые возможности для терапевтического вмешательства.
В соответствии с системным повышением уровней цитокинов и хемокинов количественные и качественные изменения в популяциях иммунных клеток, особенно в миелоидном компартменте, наблюдались в крови и легких пациентов с COVID-19 в зависимости от тяжести заболевания.
Проточные цитометрические анализы периферической крови показали снижение процентного содержания моноцитов в крови при тяжелых формах COVID-19 (38, 132, 133). Примечательно, что это снижение наблюдалось только временно в продольном исследовании иммунных клеток в тяжелых случаях, что указывает на очень чувствительный ко времени иммунный ответ (134).
Помимо количественных изменений постоянно сообщалось о поразительных специфических для заболевания различиях в фенотипах моноцитов в крови и моноцитарно-макрофагальном составе в легких.Значительная экспансия CD14 + CD16 + моноцитов с высокой экспрессией IL-6 в крови отличала пациентов с COVID-19, поступивших в отделения интенсивной терапии, от тех, кому не требовалась интенсивная терапия (132). Более того, у пациентов с острым течением болезни с симптомами тяжелой инфекции SARS-CoV-2 обнаруживается значительно сниженное количество неклассических и промежуточных моноцитов (135), а циркулирующие классические моноциты демонстрируют явные признаки активации, включая повышенную экспрессию CD169 (135).Кроме того, экспериментально инфицированные моноциты и моноциты пациентов с тяжелой формой COVID-19, нуждающихся в интенсивной терапии, характеризуются активацией воспалительных процессов и повышенным пироптозом, связанным с активацией каспазы-1 (136). Кроме того, повышенная пролиферация моноцитов, полученных от пациентов с тяжелым течением COVID-19 после провокации липополисахаридом in vitro , обсуждалась как показатель высвобождения незрелых миелоидных клеток из костного мозга, напоминающий экстренный миелопоэз (137) и способствующий врожденному иммунитету. дисфункция (138).Наиболее заметно и последовательно во всех исследованиях сообщалось о снижении экспрессии HLA-DR на моноцитах — хорошо зарекомендовавшего себя маркера иммуносупрессии — у пациентов, страдающих тяжелой формой COVID-19 (41, 42, 134, 139, 140). Снижение экспрессии HLA-DR, по-видимому, тесно связано с тяжестью заболевания COVID-19, о чем свидетельствует более низкая экспрессия HLA-DR моноцитами у пациентов, поступивших в ОИТ, по сравнению с пациентами, не получавшими ОИТ (140), и у невыживших по сравнению с выжившими (141). ). Кроме того, было обнаружено, что присутствие моноцитов HLA-DR — в тяжелых случаях COVID-19 положительно коррелирует с уровнями растворимых иммуносупрессивных факторов IL-10, TGF-β, VEGFA и AREG (142).Кроме того, у детей с мультисистемным воспалительным синдромом (MIS-C) наблюдалось снижение экспрессии HLA-DR и CD86 вместе с повышенными уровнями IL-1β, IL-6, IL-8, IL-10, IL-17 и IFN-γ. ), связанный с инфекцией SARS-CoV-2 (143). Подавление HLA-DR — это молекулярная особенность, часто описываемая для моноцитарных супрессорных клеток миелоидного происхождения (MDSC) — клеточного состояния моноцитов, которое развивается при хроническом воспалении, особенно на поздних стадиях рака, и определяется иммуносупрессивными функциями Т-клеток (144). .Функциональная оценка моноцитов HLA-DR –, полученных от пациентов с COVID-19, действительно подтвердила их способность подавлять пролиферацию Т-клеток, частично через ARG-1, и, таким образом, поддерживает состояние MDSC за пределами фенотипического описания (145). Интересно, что моноциты HLA-DR –, специфичные для тяжелого острого COVID-19, кроме того, экспрессируют CPT1, фермент, необходимый для окисления жирных кислот, что еще раз подчеркивает актуальность иммунометаболических эффектов инфекции SARS-CoV-2 (146). .
Одноклеточные омики высокого разрешения Характеристика моноцитов и макрофагов в крови и легких пациентов с COVID-19
Применение омик технологий высокого разрешения с одноклеточным разрешением, которые были разработаны и получили десятилетие подтвердили их большой потенциал для быстрой расшифровки иммунного ответа на новый патоген во время пандемии COVID-19. Первый транскриптомный иммунный атлас циркулирующих мононуклеарных клеток периферической крови (PBMC) от 10 пациентов с COVID-19 продемонстрировал глобальное снижение количества лимфоцитов, в то время как воспалительные миелоидные клетки были обнаружены в большем количестве (147).К настоящему времени, по крайней мере, в 16 других исследованиях секРНК-секвенация использовалась для характеристики иммунного ответа на SARS-CoV-2 (31, 41, 42, 45, 108, 148–158). В то время как первоначальные исследования были основаны на небольшом количестве образцов, что ограничивало их объяснительную силу, последние отчеты включали образцы, полученные от более чем 100 человек, включая продольные образцы или профилированные сопоставленные образцы из нескольких тканей. Одноклеточный транскриптомный анализ PBMC у 7 госпитализированных пациентов с COVID-19 выявил истощение моноцитов CD16 + в периферической крови и индукцию сигнатуры ISG в моноцитах CD14 + , но не обнаружил существенной индукции провоспалительных цитокинов. гены, такие как TNF, IL6, IL1β, CCL3, CCL4 или CXCL2 в этих клетках, что позволяет предположить, что периферические моноциты не вносят основного вклада в цитокиновый ответ при COVID-19 (155).Отсутствие экспрессии воспалительных цитокинов в клетках врожденного иммунитета на периферии пациентов с COVID-19 было подтверждено мультиплексным анализом цитокинов плазмы, масс-цитометрией и секРНК-секвенированием в когорте из 76 пациентов с COVID-19 и 69 здоровых лиц из двух когорт. . Несмотря на значительно повышенный уровень воспалительных молекул в плазме пациентов с COVID-19 и транзиторно индуцированную экспрессию ISG в периферических иммунных клетках, нарушение цитокинового ответа в миелоидных клетках крови и pDC с заметно сниженной экспрессией IL-6, TNF и IL- 1β при стимуляции TLR, что подчеркивает тканевое происхождение цитокинов плазмы (108).Интересно, что отсутствие ISG-экспрессирующих клеток, связанное с легким заболеванием, было связано с тяжелым заболеванием, специфичным для продукции антител, подавляющих клеточный ответ интерферона (159). В двухцентровом двухгрупповом исследовании мы объединили scRNA-seq и протеомику отдельных клеток цельной крови и РВМС и определили изменения в составе и активации иммунных клеток при легкой и тяжелой формах COVID-19 с течением времени. В то время как неклассические количества моноцитов были снижены при COVID-19, HLA-DR hi CD11c hi воспалительных моноцитов с сигнатурой ISG были повышены при легкой форме COVID-19, а моноциты при тяжелой форме COVID-19 характеризовались сильно сниженной экспрессией HLA-DR. , высокие уровни экспрессии генов с противовоспалительными и незрелыми свойствами, в том числе SELL (CD62L), CD163, MPO и PLAC8, а также повышенная экспрессия членов семейства S100A, e.грамм. С100А12 (42). Потеря неклассических моноцитов, сниженная экспрессия HLA-DR в моноцитах и массовое высвобождение членов семейства S100A наблюдались в тяжелых случаях COVID-19 в нескольких дополнительных исследованиях (41, 151, 156, 157), хотя заболевание и расслоилось на легкие, среднее, тяжелое и критическое заболевание показали небольшие различия. Кроме того, было обнаружено, что уровни кальпротектина (S100A8/S100A9) в плазме и снижение частоты неклассических моноцитов позволяют отличить пациентов, у которых развивается тяжелая форма COVID-19 (41).
Хотя анализ крови был чрезвычайно информативным, особенно при оценке системных эффектов COVID-19, легкие представляют собой первичный очаг инфекции для SARS-CoV-2, и исследование реакции местной иммунной системы является ключом к пониманию патологии. Было показано, что активированные моноциты крови проникают в легкие у пациентов с COVID-19 и в животных моделях инфекции SARS-CoV-2 (160, 161). В своем основополагающем исследовании Ляо и соавт. охарактеризовали ЖБАЛ пациентов с различной степенью тяжести COVID-19 и здоровых людей с помощью scRNA-seq и сообщили о поразительных сдвигах в клеточном составе с увеличением доли макрофагов и нейтрофилов и снижением доли ДК и Т-клеток в образцах от тяжелой/критической формы COVID-19 по сравнению для людей с умеренным заболеванием и здоровых людей.В компартменте MNP они наблюдали истощение резидентных в тканях AM и замену макрофагами, происходящими из воспалительных моноцитов, у пациентов с тяжелым заболеванием. Примечательно, что уровни экспрессии цитокинов и хемокинов различались в зависимости от тяжести заболевания. В то время как уровни экспрессии CXCL9, CXCL10 и CXCL11 были повышены как при умеренном, так и при тяжелом заболевании по сравнению со здоровыми уровнями, IL1β, IL6, TNF, а также CCL2, CCL3, CCL4 и CCL7 были экспрессированы на более высоких уровнях в макрофагах легких пациентов с тяжелым течением COVID-19. 19.CXCL16, который взаимодействует с хемокиновым рецептором CXCR6 и привлекает субпопуляции Т-клеток, специфически индуцируется у пациентов с умеренным заболеванием. Эти различные профили экспрессии предполагают, что макрофаги легких у пациентов с тяжелой формой COVID-19 могут способствовать инфильтрации тканей воспалительными моноцитами, усиливающими местное воспаление, тогда как макрофаги у пациентов с умеренной формой COVID-19 преимущественно привлекают Т-клетки. Кроме того, субпопуляции макрофагов, специфичные для тяжелого заболевания, обладают иммунорегуляторными свойствами, а также экспрессией профибротических генов TREM2, TGFB2 и SPP1 (45).В соответствии с этим исследованием, данные scRNA-seq образцов носоглотки и бронхов от 19 пациентов с COVID-19 выявили наличие воспалительных макрофагов вне тканей и происходящих из моноцитов, экспрессирующих различные цитокины, включая IL1, TNF, CCL2 и CCL3, а также как усиленные взаимодействия между эпителиальными и иммунными клетками, определяемые профилем экспрессии лиганд-рецептор, при критическом заболевании по сравнению с заболеванием средней тяжести (31). Интересно, что сравнение макрофагов нижних и верхних дыхательных путей продемонстрировало повышенную экспрессию воспалительных цитокинов и хемокинов в бронхах.Кроме того, анализ траектории моноцитов-макрофагов в секРНК-секвенах образцов ЖБАЛ от пациентов с COVID-19 выявил обогащение хронических гипервоспалительных моноцитов в критических состояниях COVID-19, проявляющееся повышенными уровнями экспрессии генов, связанных с воспалением (NLRP3, IL1-β, IL10RA). ) и гены, связанные с фиброзом (FGL2, TGFB1, COTL1), которые потенциально способствуют повреждению тканей при тяжелом течении COVID-19 (154). Одноядерная (sn)РНК-секвенация при вскрытии легких 19 умерших от COVID-19 подтвердила, что легкие сильно воспалены с плотной инфильтрацией аберрантно активированных макрофагов, происходящих из моноцитов, и альвеолярных макрофагов в ткани (153).Другой поперечный срез scRNA-seq 780 000 PBMC, взятых у 130 пациентов, собранных в трех медицинских центрах Великобритании, выявил наличие неклассической популяции моноцитов, характеризующейся экспрессией транскриптов комплемента C1QA/B/C при COVID-19. Система комплемента является ключевым защитным механизмом хозяина, способным усугублять повреждение тканей за счет своих провоспалительных эффектов. Примечательно, что интеграция этих транскриптомов РВМС с данными, полученными из образцов ЖБАЛ (45) с последующим анализом абстракции графа на основе разделов (PAGA), продемонстрировала транскрипционное сходство между циркулирующими C1QA/B/C + CD16 + моноцитами и альвеолярными макрофагами в COVID-19 с акцентом на измененный состав легочного MNP (150).Последовательные сообщения об аберрантных популяциях моноцитов CD163 hi и HLA-DR lo , экспрессирующих хемокиновый рецептор CCR2 в крови, и гиперактивированных моноцитах дыхательных путей и макрофагах, продуцирующих провоспалительные хемокины, включая CCL2 и CCL3, были дополнительно подтверждены высокоразмерными фенотипическое, транскриптомное и функциональное профилирование иммунных клеток из парных образцов дыхательных путей и крови, полученных от пациентов с тяжелой формой COVID-19 (149).
В совокупности эти данные убедительно свидетельствуют о модели порочного круга высвобождения провоспалительных цитокинов гиперактивированными МНЧ легких, что приводит к беспорядочной инфильтрации провоспалительных эффекторных клеток, включая дисрегуляцию моноцитов и цитотоксических Т-клеток, что, в свою очередь, усугубляет повреждение тканей и подпитывает активацию макрофагов (рис. 1).
Рисунок 1 Моноциты и макрофаги при COVID-19. Графический обзор композиционных и молекулярных изменений в популяциях моноцитов и альвеолярных макрофагов при COVID-19, созданный с помощью BioRender.com. В периферической крови пациентов с тяжелой формой COVID-19 были идентифицированы различные фенотипы моноцитов и макрофагов, включая незрелые клетки, указывающие на аварийный миелопоэз, дисфункциональные классические моноциты HLA-DR и и ген комплемента, экспрессирующий неклассические моноциты.Эти клетки притягиваются к легким провоспалительными хемокинами, что приводит к непрерывному накоплению гиперактивированных MNP, продуцирующих больше провоспалительных медиаторов, привлекающих больше воспалительных клеток, включая цитотоксические Т-клетки и нейтрофилы, что еще больше усугубляет воспаление и повреждение тканей. Инфицированные SARS-CoV-2 макрофаги в легких могут действовать как троянские кони, распространяющие инфекцию SARS-CoV-2 и распространяющие гипервоспаление по легким.
Обнаружение РНК SARS-CoV-2 в профилях одноклеточной РНК моноцитов и макрофагов
Поскольку SARS-CoV-2 использует механизм транскрипции клетки-хозяина для экспрессии вирусных генов, вирусные транскрипты могут быть обнаружены наряду с транскриптами мРНК человека в scRNA -seq, что позволяет идентифицировать инфицированные клетки и их уникальные свойства при разрешении отдельных клеток.Бост и др. разработали новый вычислительный конвейер, названный Viral-Track, для количественного определения вирусной РНК в данных транскриптомии отдельных клеток. Применение их подхода к данным scRNA-seq ЖБАЛ из вышеупомянутого исследования Liao et al. выявили наличие вирусных прочтений в образцах, полученных от пациентов с тяжелым, но не легким заболеванием, что свидетельствует о дифференциальной вирусной нагрузке в легких (162). Самые высокие уровни вирусной РНК наблюдались в реснитчатых и эпителиальных клетках-предшественниках. Однако вирусная РНК также была обнаружена в субпопуляции макрофагов, характеризующихся экспрессией SPP1.С помощью этого подхода нельзя было выяснить, являются ли эти транскрипты прямым инфицированием и репликацией вируса в миелоидных клетках, или же клетки фагоцитировали клеточный материал, несущий вирусную РНК. Однако результаты количественного определения вирусной РНК, специфичной для одной клетки, позволили выявить дифференциальную экспрессию генов в инфицированных макрофагах и SPP1 + , что выявило повышенную экспрессию хемокинов (CCL7, CCL8 и CCL18) и АРОЕ в вирусположительных клетки.Этот подход был далее развит Wauters et al. которые стратифицировали инфицированные SARS-CoV-2 клетки в данных scRNA-seq из образцов ЖБАЛ, полученных от пациентов с легкой и критической формами COVID-19, по наличию вирусных транскриптов из отдельных вирусных открытых рамок считывания (ORF). Обнаружение специфических транскриптов шиповидного белка (S) в эпителиальных клетках и, как следствие, снижение экспрессии ISG позволяет предположить, что эпителиальные клетки S + активно инфицированы. Напротив, транскрипты нуклеокапсидного белка (N) и ORF10 и ORF1a были обнаружены в миелоидных и лимфоидных клетках на гораздо более высоких уровнях, чем в эпителиальных клетках.Сравнение N + с N — альвеолярных макрофагов и макрофагов, происходящих из моноцитов, определило, что гены, участвующие в экспрессии MHC класса II и ISG, активируются в ответ на вирус. Грант и др. использовали альтернативный подход, чтобы ответить, продуктивно ли SARS-CoV-2 заражает миелоидные клетки. Добавление транскриптов SARS-CoV-2 с отрицательной цепью, которые временно образуются во время репликации вируса, к эталонному геному во время выравнивания и количественной оценки их данных транскриптома одноклеточного и объемного ЖБАЛ позволило оценить репликацию SARS-CoV-2 в AM. .Помимо ожидаемого обнаружения транскриптов положительной и отрицательной цепи в эпителиальных клетках, вирусные считывания также были обнаружены в субпопуляциях макрофагов, что позволяет предположить, что АМ содержат SARS-CoV-2 и обеспечивают репликацию вируса in vivo (158), что оспаривает результаты по абортивной инфекции получено из экспериментов in vitro . Интересно, что иммуноокрашивание посмертных тканей пациентов, умерших от COVID-19, выявило наличие нуклеопротеина SARS-CoV-2 и экспрессию ACE2 в популяциях макрофагов CD169 + в лимфатических узлах и селезенке (20). .Учитывая растущее количество доказательств в поддержку активной инфекции и указание на продуктивную репликацию вируса при СП SARS-CoV-2, Грант и соавт. выдвинули гипотезу о том, что АМ могут действовать как троянский конь, перенося вирус в соседние области легких, тем самым медленно распространяя инфекцию SARS-CoV-2 и распространяя гипервоспаление по всему легкому (рис. 1).
Перспективы и открытые вопросы
По прошествии более года после начала пандемии становится совершенно ясно, что врожденная иммунная система и, в частности, моноциты и макрофаги связаны с гетерогенностью течения болезни COVID-19.Например, моноциты HLA-DR hi обычно наблюдаются в легких случаях, тогда как клетки HLA-DR lo S100 + преобладают в тяжелых случаях COVID-19. Будущая работа должна распутать, какие молекулярные механизмы ответственны за эти различные клеточные реакции. Например, отсутствуют ли определенные сигналы микроокружения, в норме повышающие индукцию молекул HLA-DR, у пациентов с тяжелым течением заболевания? Повышенные уровни ингибирующих факторов, таких как определенные простагландины или TGFβ, ответственны за молекулярный фенотип МНЧ при тяжелом течении COVID-19.Кроме того, существует ли прямая связь между фиброзным заболеванием легких в результате тяжелого течения COVID-19 с ОРДС и изменениями в компартменте MNP или других иммунных клеток, таких как NK-клетки. И если это так, то не работают ли антифибротические молекулярные программы моноцитов и макрофагов или эти клетки внезапно приобретают профиброзную функциональность. Являются ли молекулярные изменения, наблюдаемые в этих клетках на ранних стадиях заболевания, предвестниками течения заболевания, приводящего к необратимому повреждению тканей, как это предлагается для некоторых пациентов с длительным COVID-19? Даже если пандемия будет находиться под контролем благодаря всемирным программам вакцинации и другим медицинским мерам, последствия длительного COVID-19 и его потенциальное бремя для здоровья в долгосрочной перспективе требуют дальнейших исследований роли иммунной системы, в частности система врожденного иммунитета с моноцитами, макрофагами и гранулоцитами, требующими особого внимания.
Вклад авторов
Все перечисленные авторы внесли существенный, непосредственный и интеллектуальный вклад в работу и одобрили ее для публикации.
Финансирование
Работа JS была поддержана Немецким исследовательским фондом (DFG) в рамках Стратегии совершенства Германии (EXC2151–3
048), проектом ЕС SYSCID (номер гранта 733100), грантом BMBF iTREAT (01ZX1902B), ERA CVD (номер гранта 00160389) и финансируемый BMBF проект повышения квалификации Diet-Body-Brain (DietBB) (номер гранта 01EA1809A).Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Сокращения
АМ, альвеолярные макрофаги; АПК, антигенпрезентирующие клетки; ХОБЛ, хроническая обструктивная болезнь легких; COVID-19, коронавирусная болезнь 2019; DC, дендритные клетки; IL, интерейкин; ИФН, интерферон; ИЛФ, идиопатический легочный фиброз; ISG — интерферон-стимулированные гены; МНЧ, мононуклеарные фагоциты; Mo-AM, AM моноцитного происхождения; Mo-DC, DC моноцитного происхождения; ORF, открытые рамки считывания; SARS-CoV-2, коронавирус тяжелого острого респираторного синдрома 2; scRNA-seq, секвенирование одноклеточной РНК; snRNA-seq, секвенирование одноядерной РНК.
Ссылки
4. Wu F, Zhao S, Yu B, Chen YM, Wang W, Song ZG, et al. Новый коронавирус, связанный с респираторным заболеванием человека в Китае. Природа (2020) 579: 265–9. doi: 10.1038/s41586-020-2008-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y и другие. Клинические особенности пациентов, инфицированных новым коронавирусом 2019 года в Ухане, Китай. Ланцет (2020) 395:497–506. дои: 10.1016/S0140-6736(20)30183-5
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
7. Thevarajan I, Nguyen THO, Koutsakos M, Druce J, Caly L, van de Sandt CE, et al. Широта сопутствующих иммунных реакций до выздоровления пациента: отчет о нетяжелом течении COVID-19. Nat Med (2020) 26:453–5. doi: 10.1038/s41591-020-0819-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
9. Fu L, Wang B, Yuan T, Chen X, Ao Y, Fitzpatrick T, et al.Клинические характеристики коронавирусной болезни 2019 г. (COVID-19) в Китае: систематический обзор и метаанализ. J Infect (2020) 80:656–65. doi: 10.1016/j.jinf.2020.03.041
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
10. Zhang Q, Liu Z, Moncada-Velez M, Chen J, Ogishi M, Bigio B, et al. Врожденные ошибки иммунитета к IFN I типа у пациентов с опасным для жизни COVID-19. Наука (2020) 370:eabd4570. doi: 10.1126/science.abd4570
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
12.Пайро-Кастинейра Э., Клохизи С., Кларик Л., Бретерик А.Д., Роулик К., Паско Д. и др. Генетические механизмы критического состояния при COVID-19. Природа (2021) 591:92–8. doi: 10.1038/s41586-020-03065-y
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Osuchowski MF, Winkler MS, Skirecki T, Cajander S, Shankar-Hari M, Lachmann G, et al. Головоломка COVID-19: расшифровка патофизиологии и фенотипов нового заболевания. Lancet Respir Med (2021) 9(6):622–42.doi: 10.1016/s2213-2600(21)00218-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
14. Drosten C, Günther S, Preiser W, van der Werf S, Brodt HR, Becker S, et al. Выявление нового коронавируса у пациентов с тяжелым острым респираторным синдромом. N Engl J Med (2003) 348:1967–76. doi: 10.1056/nejmoa030747
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
16. Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al.Проникновение в клетку SARS-CoV-2 зависит от ACE2 и TMPRSS2 и блокируется клинически проверенным ингибитором протеазы. Cell (2020) 181: 271–80.e8. doi: 10.1016/j.cell.2020.02.052
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
17. Hikmet F, Méar L, Edvinsson Å, Micke P, Uhlen M, Lindskog C. Профиль экспрессии белка ACE2 в тканях человека. Мол Сист Биол (2020) 16:e9610. doi: 10.15252/msb.20209610
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
18.Sungnak W, Huang N, Bécavin C, Berg M, Queen R, Litvinukova M, et al. Факторы проникновения SARS-CoV-2 в высокой степени экспрессируются в эпителиальных клетках носа вместе с врожденными иммунными генами. Nat Med (2020) 26:681–7. doi: 10.1038/s41591-020-0868-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
19. Song X, Hu W, Yu H, Zhao L, Zhao Y, Zhao X и др. Экспрессия ангиотензинпревращающего фермента-2 практически отсутствует на большинстве иммунных клеток периферической крови человека, но высокая экспрессия на тканевых макрофагах. Cytom Часть A (2020) 2020:1–10. doi: 10.1002/cyto.a.24285
CrossRef Полный текст | Google Scholar
20. Xiang Q, Feng Z, Diao B, Tu C, Qiao Q, Yang H и другие. SARS-CoV-2 вызывает лимфоцитопению, способствуя воспалению и уничтожая вторичные лимфоидные органы. Фронт Иммунол (2021) 12:661052. doi: 10.3389/fimmu.2021.661052
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
21. Daly JL, Simonetti B, Klein K, Chen KE, Williamson MK, Antón-Plágaro C, et al.Нейропилин-1 является фактором-хозяином инфекции SARS-CoV-2. Наука (2020) 370:861–5. doi: 10.1126/science.abd3072
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
22. Cantuti-Castelvetri L, Ojha R, Pedro LD, Djannatian M, Franz J, Kuivanen S, et al. Нейропилин-1 способствует проникновению и инфекционности клеток SARS-CoV-2. Наука (2020) 370:856–60. doi: 10.1126/science.abd2985
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
25.Хелмс Дж., Кремер С., Мерджи Х., Клер-Джель Р., Шенк М., Куммерлен С. и др. Неврологические особенности при тяжелой инфекции SARS-CoV-2. N Engl J Med (2020) 382:2268–70. doi: 10.1056/NEJMc2008597
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
26. Карфи А., Бернабеи Р., Ланди Ф. Стойкие симптомы у пациентов после острого COVID-19. JAMA – J Am Med Assoc (2020) 324:603–5. doi: 10.1001/jama.2020.12603
CrossRef Полный текст | Академия Google
31.Чуа Р.Л., Лукассен С., Трамп С., Хенниг Б.П., Вендиш Д., Потт Ф. и другие. Тяжесть COVID-19 коррелирует с взаимодействиями эпителия дыхательных путей с иммунными клетками, выявленными с помощью анализа отдельных клеток. Nat Biotechnol (2020) 38:970–9. doi: 10.1038/s41587-020-0602-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
32. Мерад М., Мартин Дж. К. Патологическое воспаление у пациентов с COVID-19: ключевая роль моноцитов и макрофагов. Nat Rev Immunol (2020) 20:355–62.doi: 10.1038/s41577-020-0331-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
33. Шулерт Г.С., Гром А.А. Патогенез синдрома активации макрофагов и возможности цитокин-направленной терапии. Annu Rev Med (2015) 66:145–59. doi: 10.1146/annurev-med-061813-012806
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
34. Karki R, Sharma BR, Tuladhar S, Williams EP, Zalduondo L, Samir P, et al. Синергизм TNF-α и IFN-γ вызывает воспалительную гибель клеток, повреждение тканей и смертность при инфекции SARS-CoV-2 и синдромах цитокинового шока. Cell (2021) 184:149–68.e17. doi: 10.1016/j.cell.2020.11.025
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
35. Гулдинг Дж., Годли А., Векария С., Хилти М., Снелгроув Р., Хассел Т. Снижение порога активации врожденных иммунных клеток легких изменяет восприимчивость к вторичной бактериальной суперинфекции. J Infect Dis (2011) 204:1086–94. doi: 10.1093/infdis/jir467
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
36.Оливер БГГ, Лим С., Уорк П., Лаза-Станка В., Кинг Н., Блэк Д.Л. и др. Воздействие риновируса ослабляет иммунный ответ на бактериальные продукты в альвеолярных макрофагах человека. Грудная клетка (2008) 63:519–25. doi: 10.1136/thx.2007.081752
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
37. Chen G, Wu D, Guo W, Cao Y, Huang D, Wang H, et al. Клинические и иммунологические особенности тяжелой и средней степени тяжести коронавирусного заболевания, 2019 г. J Clin Invest (2020) 130:2620–9.doi: 10.1172/JCI137244
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
38. Qin C, Zhou L, Hu Z, Zhang S, Yang S, Tao Y, et al. Нарушение регуляции иммунного ответа у пациентов с коронавирусом 2019 (COVID-19) в Ухане, Китай. Clin Infect Dis (2020) 71:762–8. doi: 10.1093/cid/ciaa248
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
39. Мехта П., Маколи Д. Ф., Браун М., Санчес Э., Таттерсалл Р. С., Мэнсон Дж. Дж. COVID-19: обратите внимание на синдромы цитокинового шторма и иммуносупрессию. Ланцет (2020) 395:1033–4. doi: 10.1016/S0140-6736(20)30628-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
40. Lucas C, Wong P, Klein J, Castro TBR, Silva J, Sundaram M, et al. Продольные анализы выявляют иммунологические осечки при тяжелом течении COVID-19. Природа (2020) 584:463–9. doi: 10.1038/s41586-020-2588-y
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
41. Silvin A, Chapuis N, Dunsmore G, Goubet AG, Dubuisson A, Derosa L, et al.Повышенный уровень кальпротектина и аномальные субпопуляции миелоидных клеток отличают тяжелую форму COVID-19 от легкой. Cell (2020) 182:1401–18.e18. doi: 10.1016/j.cell.2020.08.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
42. Schulte-Schrepping J, Reusch N, Paclik D, Baßler K, Schlickeiser S, Zhang B, et al. Тяжелая форма COVID-19 характеризуется нарушением регуляции миелоидных клеток. Cell (2020) 182:1419–40.e23. doi: 10.1016/j.cell.2020.08.001
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
44.Ашенбреннер А.С., Муктаруди М., Кремер Б., Острайх М., Антонакос Н., Нюш-Германо М. и др. Сигнатуры нейтрофилов в транскриптомах крови, специфичные для тяжести заболевания, разделяют пациентов с COVID-19. Геном Мед (2021) 13:7. doi: 10.1186/s13073-020-00823-5
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
45. Liao M, Liu Y, Yuan J, Wen Y, Xu G, Zhao J, et al. Одноклеточный ландшафт бронхоальвеолярных иммунных клеток у пациентов с COVID-19. Nat Med (2020) 26:842–4.doi: 10.1038/s41591-020-0901-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
46. Сиддики Х.К., Мехра М.Р. Заболевание COVID-19 в нативном состоянии и в состоянии с подавленным иммунитетом: предложение о клинико-терапевтической стадии. J Hear Lung Transplant (2020) 39:405–7. doi: 10.1016/j.healun.2020.03.012
CrossRef Полный текст | Google Scholar
48. Bassler K, Schulte-Schrepping J, Warnat-Herresthal S, Aschenbrenner AC, Schultze JL. Компартмент миелоидных клеток — клетка за клеткой. Annu Rev Immunol (2019) 37:269–93. doi: 10.1146/annurev-immunol-042718-041728
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
49. Kapellos TS, Bonaguro L, Gemünd I, Reusch N, Saglam A, Hinkley ER, et al. Подмножества и фенотипы моноцитов человека при основных хронических воспалительных заболеваниях. Фронт Иммунол (2019) 10:2035. doi: 10.3389/fimmu.2019.02035
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
53. Franke-Ullmann G, Pförtner C, Walter P, Steinmüller C, Lohmann-Matthes ML, Kobzik L.Характеристика интерстициальных макрофагов легких мышей в сравнении с альвеолярными макрофагами In Vitro . J Immunol (1996) 157:3097–104.
Реферат PubMed | Google Scholar
54. Neupane AS, Willson M, Chojnacki AK, Vargas E Silva Castanheira F, Morehouse C, Carestia A, et al. Патрулирование альвеолярных макрофагов скрывает бактерии от иммунной системы для поддержания гомеостаза. Cell (2020) 183:110–25.e11. doi: 10.1016/j.cell.2020.08.020
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
55.Шульц С., Пердигеро Э.Г., Чорро Л., Сабо-Роджерс Х., Кагнар Н., Кирдорф К. и др. Линия миелоидных клеток, независимая от Myb и гемопоэтических стволовых клеток. Наука (2012) 335:86–90. doi: 10.1126/science.1219179
Полный текст CrossRef | Google Scholar
56. Guilliams M, De Kleer I, Henri S, Post S, Vanhoutte L, De Prijck S, et al. Альвеолярные макрофаги развиваются из фетальных моноцитов, которые дифференцируются в долгоживущие клетки в первую неделю жизни. через GM-CSF.J Exp Med (2013) 210:1977–92. doi: 10.1084/jem.20131199
Полный текст CrossRef | Google Scholar
58. Sawyer RT, Strausbauch PH, Volkman A. Резидентная пролиферация макрофагов у мышей, лишенных моноцитов крови стронцием-89. Lab Investig (1982) 46:165–70.
Реферат PubMed | Google Scholar
60. Eguíluz-Gracia I, Schultz HHL, Sikkeland LIB, Danilova E, Holm AM, Pronk CJH, et al. Долгосрочное сохранение альвеолярных макрофагов доноров человека у реципиентов трансплантата легкого. Грудная клетка (2016) 71:1006–11. doi: 10.1136/thoraxjnl-2016-208292
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
61. Hashimoto D, Chow A, Noizat C, Teo P, Beasley MB, Leboeuf M, et al. Резидентные в тканях макрофаги локально самоподдерживаются на протяжении всей взрослой жизни с минимальным вкладом циркулирующих моноцитов. Иммунитет (2013) 38:792–804. doi: 10.1016/j.immuni.2013.04.004
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
62.Томас Э.Д., Рамберг Р.Е., Сейл Г.Э., Спаркс Р.С., Голд Д.В. Прямые доказательства костномозгового происхождения альвеолярных макрофагов у человека. Наука (1976) 192:1016–8. doi: 10.1126/science.775638
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
63. Guilliams M, van de Laar L. Автостопом по подмножествам миелоидных клеток: практическое внедрение новой системы классификации мононуклеарных фагоцитов. Фронт Иммунол (2015) 6:406. doi: 10.3389/fimmu.2015.00406
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
66. Коулман М.М., Руан Д., Моран Б., Данн П.Дж., Кин Дж., Миллс К.Г. Альвеолярные макрофаги способствуют респираторной толерантности, индуцируя экспрессию FoxP3 в наивных Т-клетках. Am J Respir Cell Mol Biol (2013) 48:773–80. doi: 10.1165/rcmb.2012-0263OC
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
67. Soroosh P, Doherty TA, Duan W, Mehta AK, Choi H, Adams YF, et al. Резидентные в легких тканевые макрофаги генерируют Foxp3+ регуляторные Т-клетки и способствуют толерантности дыхательных путей. J Exp Med (2013) 210:775–88. doi: 10.1084/jem.20121849
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
68. Lipscomb MF, Lyons CR, Nunez G, Ball EJ, Stastny P, Vial W, et al. Альвеолярные макрофаги человека: HLA-DR-положительные макрофаги, которые являются слабыми стимуляторами первичной смешанной лейкоцитарной реакции. J Immunol (1986) 136(2):497–504.
Реферат PubMed | Google Scholar
69. Snelgrove RJ, Goulding J, Didierlaurent AM, Lyonga D, Vekaria S, Edwards L, et al.Критическая функция CD200 в гомеостазе иммунитета легких и тяжести гриппозной инфекции. Nat Immunol (2008) 9:1074–83. doi: 10.1038/ni.1637
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
70. Janssen WJ, McPhillips KA, Dickinson MG, Linderman DJ, Morimoto K, Xiao YQ, et al. Сурфактантные белки A и D подавляют фагоцитоз альвеолярных макрофагов посредством взаимодействия с Sirpα. Am J Respir Crit Care Med (2008) 178:158–67.doi: 10.1164/rccm.200711-1661OC
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
71. Zhang J, Tachado SD, Patel N, Zhu J, Imrich A, Manfruelli P, et al. Отрицательная регулирующая роль рецепторов маннозы в провоспалительном высвобождении цитокинов альвеолярных макрофагов человека In Vitro . J Leukoc Biol (2005) 78:665–74. doi: 10.1189/jlb.1204699
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
72. Гош С., Грегори Д., Смит А., Кобзик Л.MARCO регулирует ранние воспалительные реакции на грипп: полезная функция макрофагов с неблагоприятным исходом. Am J Respir Cell Mol Biol (2011) 45:1036–44. doi: 10.1165/rcmb.2010-0349OC
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
73. Gao X, Dong Y, Liu Z, Niu B. Заглушение триггерного рецептора, экспрессируемого на миелоидных клетках-2, усиливает воспалительные реакции альвеолярных макрофагов на липополисахарид. Mol Med Rep (2013) 7:921–6.doi: 10.3892/mmr.2013.1268
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
74. Фернандес С., Хосе П., Авдиушко М.Г., Каплан А.М., Коэн Д.А. Ингибирование функции рецептора IL-10 в альвеолярных макрофагах агонистами Toll-подобных рецепторов. J Immunol (2004) 172:2613–20. doi: 10.4049/jimmunol.172.4.2613
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
75. Morris DG, Huang X, Kaminski N, Wang Y, Shapiro SD, Dolganov G, et al. Потеря интегрин-αvβ6-опосредованной активации TGF-β вызывает Mmp 12-зависимую эмфизему. Природа (2003) 422:169–73. doi: 10.1038/nature01413
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
76. Gautier EL, Chow A, Spanbroek R, Marcelin G, Greter M, Jakubzick C, et al. Системный анализ Pparγ в популяциях мышиных макрофагов выявляет заметное разнообразие экспрессии с критическими ролями в разрешении воспаления и иммунитете дыхательных путей. J Immunol (2012) 189:2614–24. doi: 10.4049/jimmunol.1200495
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
78.Steinmüller C, Franke-Ullmann G, Lohmann-Matthes ML, Emmendörffer A. Местная активация неспецифической защиты от инфекции респираторной модели путем применения интерферона-γ: сравнение альвеолярных и интерстициальных макрофагов легких крыс. Am J Respir Cell Mol Biol (2000) 22:481–90. doi: 10.1165/ajrcmb.22.4.3336
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
79. Trapnell BC, Whitsett JA. GM-CSF регулирует гомеостаз легочного сурфактанта и врожденную защиту хозяина, опосредованную альвеолярными макрофагами. Annu Rev Physiol (2002) 64:775–802. doi: 10.1146/annurev.physiol.64.0 .113847
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
81. Ласкин Д.Л., Сунил В.Р., Гарднер Ч.Р., Ласкин Д.Д. Макрофаги и повреждение тканей: агенты защиты или разрушения? Annu Rev Pharmacol Toxicol (2011) 51:267–88. doi: 10.1146/annurev.pharmtox.010909.105812
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
83. Фадок В.А., Браттон Д.Л., Коновал А., Фрид П.В., Уэсткотт Дж.Ю., Хенсон П.М.Макрофаги, поглотившие апоптотические клетки In Vitro , ингибируют выработку провоспалительных цитокинов посредством аутокринных/паракринных механизмов, включающих TGF-β, PGE2 и PAF. J Clin Invest (1998) 101:890–8. doi: 10.1172/JCI1112
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
84. Фитцпатрик А.М., Ольгин Ф., Тиг В.Г., Браун LAS. Фагоцитоз альвеолярных макрофагов нарушен у детей с плохо контролируемой астмой. J Allergy Clin Immunol (2008) 121(6):1372–8.doi: 10.1016/j.jaci.2008.03.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
85. Hodge S, Hodge G, Scicchitano R, Reynolds PN, Holmes M. Альвеолярные макрофаги от субъектов с хронической обструктивной болезнью легких обладают недостаточной способностью фагоцитировать апоптотические эпителиальные клетки дыхательных путей. Immunol Cell Biol (2003) 81:289–96. doi: 10.1046/j.1440-1711.2003.t01-1-01170.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
86.Vandivier RW, Richens TR, Horstmann SA, DeCathelineau AM, Ghosh M, Reynolds SD, et al. Дисфункциональный муковисцидоз Трансмембранный регулятор проводимости ингибирует фагоцитоз апоптотических клеток с провоспалительными последствиями. Am J Physiol — Lung Cell Mol Physiol (2009) 297(4):L677–86. doi: 10.1152/ajplung.00030.2009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
88. Аошиба К., Тамаоки Дж., Нагаи А. Острое воздействие сигаретного дыма вызывает апоптоз альвеолярных макрофагов. Am J Physiol — Lung Cell Mol Physiol (2001) 281(6):L1392–401. doi: 10.1152/ajplung.2001.281.6.l1392
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
89. Глисон Л.Э., О’Лири С.М., Райан Д., Маклафлин А.М., Шиди Ф.Дж., Кин Дж. Курение сигарет ухудшает биоэнергетический иммунный ответ на инфекцию Mycobacterium Tuberculosis. Am J Respir Cell Mol Biol (2018) 59:572–9. doi: 10.1165/rcmb.2018-0162OC
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
90.Sussan TE, Gajghate S, Thimmulappa RK, Ma J, Kim JH, Sudini K, et al. Воздействие электронных сигарет ослабляет легочную антибактериальную и противовирусную защиту в мышиной модели. PloS One (2015) 10:e0116861. doi: 10.1371/journal.pone.0116861
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
91. Wallace WAH, Gillooly M, Lamb D. Количество внутриальвеолярных макрофагов у курящих и некурящих: морфометрическое исследование срезов тканей. Грудная клетка (1992) 47:437–40.doi: 10.1136/thx.47.6.437
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
92. Schneider C, Nobs SP, Heer AK, Kurrer M, Klinke G, van Rooijen N, et al. Альвеолярные макрофаги необходимы для защиты от дыхательной недостаточности и связанной с ней заболеваемости после заражения вирусом гриппа. PloS Pathog (2014) 10:e1004053. doi: 10.1371/journal.ppat.1004053
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
93. Kim HM, Lee Y-W, Lee KJ, Kim HS, Cho SW, van Rooijen N, et al.Альвеолярные макрофаги незаменимы для борьбы с вирусами гриппа в легких свиней. J Virol (2008) 82:4265–74. doi: 10.1128/jvi.02602-07
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
94. Yilla M, Harcourt BH, Hickman CJ, McGrew M, Tamin A, Goldsmith CS, et al. Репликация SARS-коронавируса в периферических моноцитах/макрофагах человека. Virus Res (2005) 107:93–101. doi: 10.1016/j.virusres.2004.09.004
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
95.Смит М.С., Бенц Г.Л., Александр Дж.С., Юрочко А.Д. Цитомегаловирус человека индуцирует дифференцировку и миграцию моноцитов как стратегию распространения и персистенции. J Virol (2004) 78:4444–53. doi: 10.1128/jvi.78.9.4444-4453.2004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
96. Nottet HS, Persidsky Y, Sasseville VG, Nukuna AN, Bock P, Zhai QH, et al. Механизмы трансэндотелиальной миграции ВИЧ-1-инфицированных моноцитов в головной мозг. J Immunol (1996) 156:1284–95.
Реферат PubMed | Google Scholar
97. Desforges M, Miletti TC, Gagnon M, Talbot PJ. Активация моноцитов человека после заражения коронавирусом человека 229E. Virus Res (2007) 130:228–40. doi: 10.1016/j.virusres.2007.06.016
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
98. Аль-Кахтани А.А., Лирони К., Азнаурова М., Целиу М., Аль-Анази М.Р., Аль-Ахдал М.Н., и соавт. Ближневосточный респираторный синдром Спайк-гликопротеин вируса короны подавляет ответы макрофагов посредством DPP4-опосредованной индукции IRAK-M и Pparγ. Oncotarget (2017) 8:9053–66. doi: 10.18632/oncotarget.14754
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
99. Никитина Е., Ларионова И., Чойнзонов Е., Кжишковская Ю. Моноциты и макрофаги как вирусные мишени и резервуары. Int J Mol Sci (2018) 19:2821. doi: 10.3390/ijms1
21
CrossRef Полный текст | Google Scholar
100. Cheung CY, Poon LLM, Ng IHY, Luk W, Sia S-F, Wu MHS, et al. Цитокиновые ответы при тяжелом остром респираторном синдроме, инфицированных коронавирусом макрофагов in vitro: возможная связь с патогенезом. J Virol (2005) 79:7819–26. doi: 10.1128/jvi.79.12.7819-7826.2005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
101. Wang J, Nikrad MP, Travanty EA, Zhou B, Phang T, Gao B, et al. Врожденный иммунный ответ альвеолярных макрофагов человека при гриппе. PloS One (2012) 7:e29879. doi: 10.1371/journal.pone.0029879
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
102. Kumagai Y, Takeuchi O, Kato H, Kumar H, Matsui K, Morii E, et al.Альвеолярные макрофаги являются первичными продуцентами интерферона-α при легочной инфекции РНК-вирусами. Иммунитет (2007) 27:240–52. doi: 10.1016/j.immuni.2007.07.013
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
103. Wang J, Nikrad MP, Phang T, Gao B, Alford T, Ito Y, et al. Врожденный иммунный ответ на вирус гриппа А в дифференцированных альвеолярных клетках человека II типа. Am J Respir Cell Mol Biol (2011) 45:582–91. doi: 10.1165/rcmb.2010-0108OC
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
104.Вонг М.Т., Чен С.Л. Новые роли интерферон-стимулируемых генов во врожденном иммунном ответе на инфекцию вируса гепатита С. Cell Mol Immunol (2016) 13:11–35. doi: 10.1038/cmi.2014.127
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
105. Hambleton S, Goodbourn S, Young DF, Dickinson P, Mohamad SMB, Valappil M, et al. Дефицит STAT2 и восприимчивость к вирусным заболеваниям у людей. Proc Natl Acad Sci USA (2013) 110:3053–8. doi: 10.1073/pnas.1220098110
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
106. Joel Funk C, Wang J, Ito Y, Travanty EA, Voelker DR, Holmes KV, et al. Заражение альвеолярных макрофагов человека штаммом 229E коронавируса человека. J Gen Virol (2012) 93:494–503. doi: 10.1099/vir.0.038414-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
107. Калифано Д., Фуруя Ю., Мецгер Д.В. Влияние гриппа на жизнеспособность альвеолярных макрофагов зависит от генетического штамма мыши. J Immunol (2018) 201:134–44. doi: 10.4049/jimmunol.1701406
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
108. Arunachalam PS, Wimmers F, Mok CKP, Perera RAPM, Scott M, Hagan T, et al. Системно-биологическая оценка иммунитета к легкой и тяжелой инфекции COVID-19 у людей. Наука (2020) 369:1210–20. doi: 10.1126/SCIENCE.ABC6261
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
109. Hadjadj J, Yatim N, Barnabei L, Corneau A, Boussier J, Smith N, et al.Нарушенная активность интерферона I типа и воспалительные реакции у пациентов с тяжелым течением COVID-19. Наука (2020) 369:718–24. doi: 10.1126/science.abc6027
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
110. Zhou Z, Ren L, Zhang L, Zhong J, Xiao Y, Jia Z и др. Повышенные врожденные иммунные реакции в дыхательных путях пациентов с COVID-19. Микроб-хозяин клетки (2020) 27:883–90.e2. doi: 10.1016/j.chom.2020.04.017
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
112.Kox M, Waalders NJB, Kooistra EJ, Gerretsen J, Pickkers P. Уровни цитокинов у пациентов в критическом состоянии с COVID-19 и другими состояниями. JAMA – J Am Med Assoc (2020) 324:1565–7. doi: 10.1001/jama.2020.17052
CrossRef Полный текст | Google Scholar
113. Monneret G, Benlyamani I, Gossez M, Bermejo-Martin JF, Martin-Fernandez M, Sesques P, et al. COVID-19: с каким типом цитокинового шторма мы имеем дело? J Med Virol (2021) 93:197–8. doi: 10.1002/jmv.26317
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
115. Leisman DE, Ronner L, Pinotti R, Taylor MD, Sinha P, Calfee CS, et al. Повышение уровня цитокинов при тяжелой и критической форме COVID-19: быстрый систематический обзор, метаанализ и сравнение с другими воспалительными синдромами. Lancet Respir Med (2020) 8:1233–44. doi: 10.1016/S2213-2600(20)30404-5
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
117. Ян Д., Гэн Т., Харрисон А.Г., Ван П.Дифференциальные роли RIG-I-подобных рецепторов при инфекции SARS-CoV-2. bioRxiv Prepr Serv Biol (2021). doi: 10.1101/2021.02.10.430677
CrossRef Полный текст | Google Scholar
119. Zheng M, Karki R, Williams EP, Yang D, Fitzpatrick E, Vogel P, et al. TLR2 воспринимает белок оболочки SARS-CoV-2 для выработки воспалительных цитокинов. Nat Immunol (2021) 22:829–38. doi: 10.1038/s41590-021-00937-x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
120.Тепо М., Лучковяк Дж., Вивес С., Лабиод Н., Балли И., Ласала Ф. и др. Распознавание Dc/L-SIGN спайкового гликопротеина способствует трансинфекции SARS-CoV-2 и может ингибироваться антагонистом гликомиметиков. PloS Pathog (2021) 17:e1009576. doi: 10.1371/journal.ppat.1009576
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
121. Lu Q, Liu J, Zhao S, Gomez Castro MF, Laurent-Rolle M, Dong J, et al. SARS-CoV-2 усугубляет провоспалительные реакции в миелоидных клетках через лектиновые рецепторы C-типа и члена семейства Tweety 2. Иммунитет (2021) 54:1304–1319.e9. doi: 10.1016/j.immuni.2021.05.006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
122. Yang D, Chu H, Hou Y, Chai Y, Shuai H, Lee ACY, et al. Ослабленный интерфероновый и провоспалительный ответ в дендритных клетках человека, инфицированных SARS-CoV-2, связаны с вирусным антагонизмом к фосфорилированию STAT1. J Infect Dis (2020) 222:734–45. doi: 10.1093/infdis/jiaa356
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
123.Чжэн Дж., Ван Ю, Ли К., Мейерхольц Д.К., Алламаргот С., Перлман С. Тяжелый острый респираторный синдром, вызванный коронавирусом 2, иммунная активация и гибель человеческих макрофагов и дендритных клеток, полученных из моноцитов. J Infect Dis (2021) 223:785–95. doi: 10.1093/infdis/jiaa753
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
124. Chu H, Chan JFW, Wang Y, Yuen TTT, Chai Y, Hou Y и др. Сравнительные профили репликации и иммунной активации SARS-CoV-2 и SARS-CoV в легких человека: исследование ex vivo с последствиями для патогенеза COVID-19. Clin Infect Dis (2020) 71:1400–9. doi: 10.1093/cid/ciaa410
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
125. Martines RB, Ritter JM, Matkovic E, Gary J, Bollweg BC, Bullock H, et al. Патология и патогенез SARS-CoV-2, связанного со смертельным исходом от коронавируса, США. Emerg Infect Dis (2020) 26:2005–15. doi: 10.3201/eid2609.202095
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
126. Lv J, Wang Z, Qu Y, Zhu H, Zhu Q, Tong W и др.Различное поглощение, амплификация и высвобождение SARS-CoV-2 альвеолярными макрофагами M1 и M2. Cell Discovery (2021) 7:24. doi: 10.1038/s41421-021-00258-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
127. Пантази И., Аль-Кахтани А.А., Альхамлан Ф.С., Алотаид Х., Мато-Насри С., Сурвинос Г. и др. Взаимодействие SARS-CoV-2/ACE2 подавляет экспрессию IRAK-M и способствует выработке провоспалительных цитокинов в макрофагах. Фронт Иммунол (2021) 12:683800.doi: 10.3389/FIMMU.2021.683800
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
128. Liu L, Wei Q, Lin Q, Fang J, Wang H, Kwok H, et al. Anti-Spike IgG вызывает тяжелое острое повреждение легких, искажая реакцию макрофагов во время острой инфекции SARS-CoV. JCI Insight (2019) 4:e123158. doi: 10.1172/jci.insight.123158
Полный текст CrossRef | Google Scholar
129. Jaume M, Yip MS, Cheung CY, Leung HL, Li PH, Kien F, et al. Спайк-антитела против тяжелого острого респираторного синдрома вызывают инфицирование иммунных клеток человека через независимый от рН и цистеинпротеазы путь Fc R. J Virol (2011) 85:10582–97. doi: 10.1128/jvi.00671-11
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
130. Codo AC, Davanzo GG, Monteiro L de B, de Souza GF, Muraro SP, Virgilio-da-Silva JV и др. Повышенный уровень глюкозы способствует инфицированию SARS-CoV-2 и ответу моноцитов через ось, зависимую от HIF-1α/гликолиза. Cell Metab (2020) 32:437–46.e5. doi: 10.1016/j.cmet.2020.07.007
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
131.да Сильва Гомес Диас С., Соарес В.К., Феррейра А.С., Сакраменто К.К., Финтельман-Родригес Н., Темерозо Дж.Р. и др. Капли липидов подпитывают репликацию SARS-CoV-2 и производство медиаторов воспаления. PloS Pathog (2020) 16:e1009127. doi: 10.1371/journal.ppat.1009127
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
132. Zhou Y, Fu B, Zheng X, Wang D, Zhao C, Qi Y, et al. Патогенные Т-клетки и воспалительные моноциты провоцируют воспалительные бури у пациентов с тяжелым течением COVID-19. Natl Sci Rev (2020) 7:998–1002. doi: 10.1093/nsr/nwaa041
Полный текст CrossRef | Google Scholar
133. Laing AG, Lorenc A, del Molino del Barrio I, Das A, Fish M, Monin L, et al. Динамическая иммунная сигнатура COVID-19 включает ассоциации с неблагоприятным прогнозом. Nat Med (2020) 26:1623–35. doi: 10.1038/s41591-020-1038-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
134. Payen D, Cravat M, Maadadi H, Didelot C, Prosic L, Dupuis C, et al.Продольное исследование иммунных клеток у пациентов с тяжелой формой COVID-19. Фронт Иммунол (2020) 11:580250. doi: 10.3389/fimmu.2020.580250
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
135. Гатти А., Радриццани Д., Вигано П., Маццоне А., Брандо Б. Снижение субпопуляций неклассических и промежуточных моноцитов при тяжелой острой инфекции SARS-CoV-2. Cytom Часть A (2020) 97:887–90. doi: 10.1002/cyto.a.24188
CrossRef Полный текст | Академия Google
136.Ferreira AC, Soares VC, de Azevedo-Quintanilha IG, Dias S da SG, Fintelman-Rodrigues N, Sacramento CQ, et al. SARS-CoV-2 вызывает воспаление и пироптоз в первичных моноцитах человека. Cell Death Discov (2021) 7:43. doi: 10.1038/s41420-021-00428-w
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
137. Schultze JL, Mass E, Schlitzer A. Новые принципы миелопоэза при гомеостазе и во время инфекции и воспаления. Иммунитет (2019) 50:288–301.doi: 10.1016/j.immuni.2019.01.019
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
138. Mann ER, Menon M, Knight SB, Konkel JE, Jagger C, Shaw TN, et al. Продольное иммунное профилирование выявляет ключевые миелоидные признаки, связанные с COVID-19. Sci Immunol (2020) 5:eabd6197. doi: 10.1126/SCIIMMUNOL.ABD6197
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
139. Giamarellos-Bourboulis EJ, Netea MG, Rovina N, Akinosoglou K, Antoniadou A, Antonakos N, et al.Сложная иммунная дисрегуляция у пациентов с COVID-19 с тяжелой дыхательной недостаточностью. Микроб-хозяин клетки (2020) 27:992–1000.e3. doi: 10.1016/j.chom.2020.04.009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
140. Spinetti T, Hirzel C, Fux M, Walti LN, Schober P, Stueber F, et al. Снижение экспрессии моноцитарного человеческого лейкоцитарного антигена-DR указывает на иммуносупрессию у пациентов с COVID-19 в критическом состоянии. Anesth Analg (2020) 131:993–9. doi: 10.1213/ANE.0000000000005044
Аннотация PubMed | Полный текст перекрестной ссылки | Google Scholar
141. Wang F, Hou H, Yao Y, Wu S, Huang M, Ran X, et al. Системное сравнение иммунитета хозяина между выжившими и умершими пациентами с COVID-19. Cell Mol Immunol (2020) 17:875–7. doi: 10.1038/s41423-020-0483-y
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
142. Kvedaraite E, Hertwig L, Sinha I, Ponzetta A, Myrberg IH, Lourda M, et al. Основные изменения в ландшафте мононуклеарных фагоцитов, связанные с серьезностью COVID-19. Proc Natl Acad Sci USA (2021) 118(6):e2018587118. doi: 10.1073/pnas.2018587118
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
143. Carter MJ, Fish M, Jennings A, Doores KJ, Wellman P, Seow J, et al. Периферические иммунофенотипы у детей с мультисистемным воспалительным синдромом, ассоциированным с инфекцией SARS-CoV-2. Nat Med (2020) 26:1701–7. doi: 10.1038/s41591-020-1054-6
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
145.Фальк-Джонс С., Вангети С., Ю М., Фальк-Джонс Р., Каджиги А., Бадолати И. и др. Функциональные моноцитарные клетки-супрессоры миелоидного происхождения увеличиваются в крови, но не в дыхательных путях, и предсказывают тяжесть COVID-19. J Clin Invest (2021) 131(6):e144734. doi: 10.1172/JCI144734
Полный текст перекрестной ссылки | Google Scholar
146. Thompson EA, Cascino K, Ordonez AA, Zhou W, Vaghasia A, Hamacher-Brady A, et al. Метаболические программы определяют дисфункциональные иммунные реакции у пациентов с тяжелым течением COVID-19. Cell Rep (2021) 34:108863. doi: 10.1016/j.celrep.2021.108863
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
147. Wen W, Su W, Tang H, Le W, Zhang X, Zheng Y и др. Профилирование иммунных клеток пациентов с COVID-19 на стадии выздоровления с помощью одноклеточного секвенирования. Сотовый Дисков (2020) 6:6. doi: 10.1038/s41421-020-0168-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
148. Lee JS, Park S, Jeong HW, Ahn JY, Choi SJ, Lee H, et al.Иммунофенотипирование Covid-19 и гриппа подчеркивает роль интерферонов типа I в развитии тяжелого Covid-19. Sci Immunol (2020) 5:1554. doi: 10.1126/sciimmunol.abd1554
Полный текст CrossRef | Google Scholar
149. Szabo PA, Dogra P, Gray JI, Wells SB, Connors TJ, Weisberg SP, et al. Продольное профилирование респираторных и системных иммунных реакций выявляет миелоидно-клеточное воспаление легких при тяжелом течении COVID-19. Иммунитет (2021) 54:797–814.е6. doi: 10.1016/j.immuni.2021.03.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
150. Stephenson E, Reynolds G, Botting RA, Calero-Nieto FJ, Morgan MD, Tuong ZK, et al. Одноклеточный мультиомический анализ иммунного ответа при COVID-19. Nat Med (2021) 27:904–16. doi: 10.1038/s41591-021-01329-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
151. Su Y, Chen D, Yuan D, Lausted C, Choi J, Dai CL, et al. Multi-Omics устраняет резкий сдвиг состояния заболевания между легкой и средней степенью тяжести COVID-19. Cell (2020) 183:1479–95.e20. doi: 10.1016/j.cell.2020.10.037
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
152. Cao Y, Su B, Guo X, Sun W, Deng Y, Bao L, et al. Мощные нейтрализующие антитела против SARS-CoV-2, идентифицированные с помощью высокопроизводительного одноклеточного секвенирования В-клеток выздоравливающих пациентов. Cell (2020) 182:73–84.e16. doi: 10.1016/j.cell.2020.05.025
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
153.Мелмс Дж. К., Бирманн Дж., Хуан Х., Ван Ю., Наир А., Тагор С. и др. Молекулярный атлас одноклеточных легких смертельного COVID-19. Природа (2021) 33:15. doi: 10.1038/s41586-021-03569-1
CrossRef Полный текст | Google Scholar
154. Wauters E, Van Mol P, Garg AD, Jansen S, Van Herck Y, Vanderbeke L, et al. Отличие легкого от критического COVID-19 с помощью врожденного и адаптивного иммунного одноклеточного профилирования бронхоальвеолярных лаважей. Cell Res (2021) 31: 272–90. дои: 10.1038/s41422-020-00455-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
155. Wilk AJ, Rustagi A, Zhao NQ, Roque J, Martínez-Colón GJ, McKechnie JL, et al. Одноклеточный атлас периферического иммунного ответа у пациентов с тяжелой формой COVID-19. Nat Med (2020) 26:1070–6. doi: 10.1038/s41591-020-0944-y
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
156. Бернардес Дж. П., Мишра Н., Тран Ф., Розенстил П. Продольный многокомпонентный анализ определяет реакцию мегакариоцитов, эритроидных клеток и плазмобластов как признаки тяжелой формы COVID-19. Иммунитет (2020) 53:1296–314.e9. doi: 10.1016/j.immuni.2020.11.017
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
157. Zhang JY, Wang XM, Xing X, Xu Z, Zhang C, Song JW и др. Одноклеточный ландшафт иммунологических ответов у пациентов с COVID-19. Nat Immunol (2020) 21:1107–18. doi: 10.1038/s41590-020-0762-x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
158. Грант Р.А., Моралес-Небреда Л., Марков Н.С., Сваминатан С., Куэрри М., Гусман Э.Р. и соавт.Цепи между инфицированными макрофагами и Т-клетками при пневмонии SARS-CoV-2. Природа (2021) 590:635–41. doi: 10.1038/s41586-020-03148-w
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
159. Combes AJ, Courau T, Kuhn NF, Hu KH, Ray A, Chen WS, et al. Глобальное отсутствие и нацеливание на состояния защитного иммунитета при тяжелом течении COVID-19. Природа (2021) 591:124–30. doi: 10.1038/s41586-021-03234-7
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
160.Nouailles G, Wyler E, Pennitz P, Postmus D, Kazmierski J, Pott F, et al. Продольные омики у сирийских хомяков, интегрированные с данными человека, раскрывают сложность 1 умеренного иммунного ответа на SARS-CoV-2 2 3. bioRxiv (2020) 2020:12. doi: 10.1101/2020.12.18.423524
CrossRef Полный текст | Google Scholar
161. Санчес-Серрильо И., Ландете П., Альдаве Б., Санчес-Алонсо С., Санчес-Азофра А., Маркос-Хименес А. и др. Тяжесть COVID-19 связана с легочным перераспределением CD1c+ DC и воспалительными переходными и неклассическими моноцитами. J Clin Invest (2020) 130:6290–300. doi: 10.1172/JCI140335
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
162.

 Это должен делать тот врач, который дал направление на исследование.
Это должен делать тот врач, который дал направление на исследование. Например, инфекционный мононуклеоз, эпидемический паротит, корь, туберкулёз, гепатиты (особенно на той стадии, когда они перерастают в цирроз печени), сифилис.
Например, инфекционный мононуклеоз, эпидемический паротит, корь, туберкулёз, гепатиты (особенно на той стадии, когда они перерастают в цирроз печени), сифилис.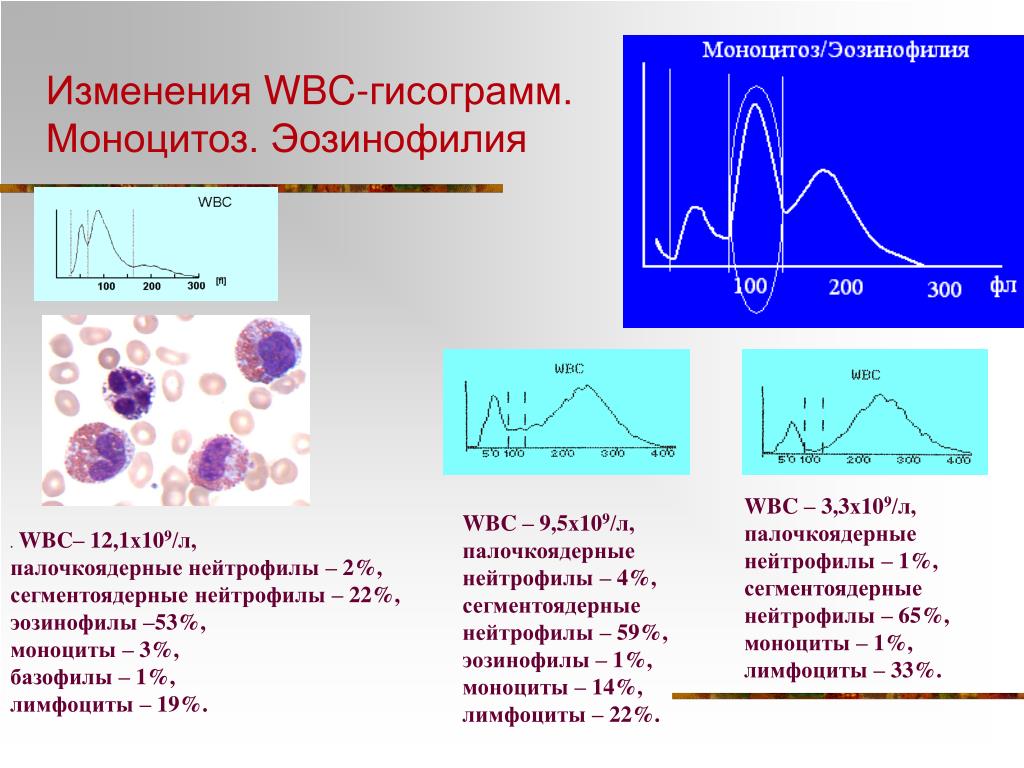 Моноциты имеют большое значение, так как отвечают за начальную активацию всей иммунной системы человека.
Моноциты имеют большое значение, так как отвечают за начальную активацию всей иммунной системы человека. Главная функция эритроцитов транспортировка кислорода из лёгких ко всем тканям и двуокись углерода — от тканей обратно в лёгкие. Мало эритроцитов — мало гемоглобина. Мало гемоглобина — мало эритроцитов. Они взаимосвязаны.
Главная функция эритроцитов транспортировка кислорода из лёгких ко всем тканям и двуокись углерода — от тканей обратно в лёгкие. Мало эритроцитов — мало гемоглобина. Мало гемоглобина — мало эритроцитов. Они взаимосвязаны. Показатель определяет, как эритроциты отличаются между собой по размерам.
Показатель определяет, как эритроциты отличаются между собой по размерам. 


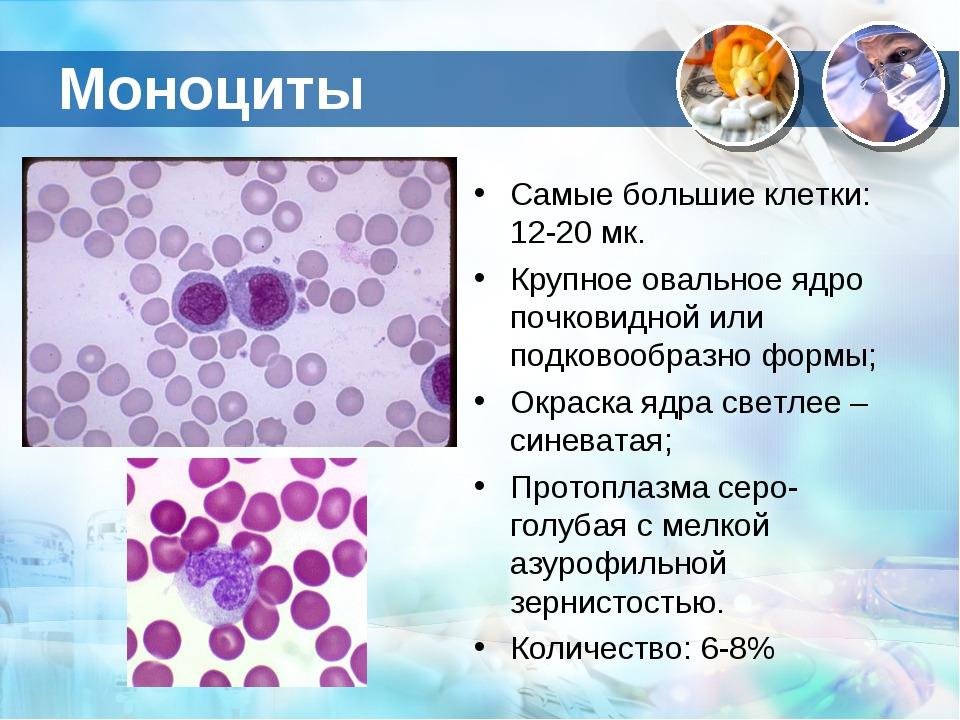
 и Корен-Миховиц М.: Миелоидный
Саркома: современный подход и терапевтические возможности. Тер Ад
Гематол. 2: 309–316. 2011. Просмотр статьи: Google Scholar: PubMed/NCBI
и Корен-Миховиц М.: Миелоидный
Саркома: современный подход и терапевтические возможности. Тер Ад
Гематол. 2: 309–316. 2011. Просмотр статьи: Google Scholar: PubMed/NCBI А. и
Теффери А: Хронический миеломоноцитарный лейкоз: краткий клинический и
патофизиологический обзор. Бр Дж Гематол. 165: 273–286. 2014.
Просмотр статьи : Академия Google : PubMed/NCBI
А. и
Теффери А: Хронический миеломоноцитарный лейкоз: краткий клинический и
патофизиологический обзор. Бр Дж Гематол. 165: 273–286. 2014.
Просмотр статьи : Академия Google : PubMed/NCBI : Разработка и проверка системы прогностической оценки
для больных хроническим миеломоноцитарным лейкозом.Кровь.
121:3005–3015. 2013. Просмотр статьи: Google Scholar: PubMed/NCBI
: Разработка и проверка системы прогностической оценки
для больных хроническим миеломоноцитарным лейкозом.Кровь.
121:3005–3015. 2013. Просмотр статьи: Google Scholar: PubMed/NCBI Представитель дела Гематол.
2013:6565432013.PubMed/NCBI
Представитель дела Гематол.
2013:6565432013.PubMed/NCBI