как выглядит и проявляется, последствия
Стафилококк относится к группе микробов широко распространенных в окружающей среде. Для большинства людей стафилококки не опасны, являясь частью условно-патогенной флоры. Но, если стафилококк выявляется у маленьких детей – это может быть опасным. За счет сниженного иммунитета новорожденные могут заражаться стафилококком с развитием тяжелых инфекций.
Новорожденные обладают сниженным иммунитетом, особенно, если они рождены ранее срока, беременность была тяжелой или протекала с осложнениями, был гестоз. Также особенно подвержены стафилококку новорожденные малыши с низкой массой тела к рождению, наличием врожденных отклонений в развитии, при нарушении гигиены ребенка и плохом за ним уходе. Ребенок из стерильных условий матки попадает в среду, полную микробов, они активно заселяют его кожу и пищеварительный тракт, слизистые.
Вызывать патологии могут разные виды стафилококка. К ним относятся:
- кишечный стафилококк у новорожденных, который может давать заболевания пищеварительного тракта или мочеполовой системы
- гемолитический стафилококк у новорожденных, который может приводить к ангинам или поражениям дыхательных путей
- золотистый стафилококк, который может давать поражения всех внутренних органов вплоть до сепсиса (заражение крови, всего организма).
- эпидермальный стафилококк у новорожденных, который поражает слизистые и кожу у сильно ослабленных детей, нарушает заживление ран.
Чем опасен стафилококк у новорожденных
Стафилококковая инфекция у совсем малышей может давать разные проявления болезни, от поражений кожи до поражения практически всех внутренних органов. Некоторые формы стафилококка, особенно внутрибольничные, могут быть очень агрессивными. Они дают тяжелые пневмонии, пиелонефриты, поражения организма в виде сепсиса – заражение крови с крайне тяжелым течением. Инфекция может развиваться быстро и буквально за пару дней приобрести тяжелое агрессивное течение потому, что иммунитет новорожденного не в силах побороть инфекцию. Стафилококки широко распространены, они могут попасть к ребенку о матери, от персонала или других детей, носителей стафилококка или больных инфекцией.
Они дают тяжелые пневмонии, пиелонефриты, поражения организма в виде сепсиса – заражение крови с крайне тяжелым течением. Инфекция может развиваться быстро и буквально за пару дней приобрести тяжелое агрессивное течение потому, что иммунитет новорожденного не в силах побороть инфекцию. Стафилококки широко распространены, они могут попасть к ребенку о матери, от персонала или других детей, носителей стафилококка или больных инфекцией.
Эпидермальный стафилококк у новорожденных
Данный вид стафилококковой инфекции приводит к поражениям слизистых носа, горла, кожных покровов и глаз. На коже здоровых носителей с крепким иммунитетом он не приносит никакого вреда. А вот у ослабленных новорожденных он может давать развитие достаточно тяжелого стафилококкового поражения, которое потребует лечения в стационаре и длительного восстановления. Обычно такой стафилококк дает кожные формы с гнойничками, поражения носоглотки и дыхательной системы и инфицируют послеоперационные раны.
Как выглядит стафилококк у новорожденных
Сложно однозначно ответить, как выглядит стафилококк у новорожденных, потому что форм стафилококковой инфекции очень много. Если инфекция поражает кожные покровы, возникают особые поражения кожи – пиодермии. Проявления сыпи при стафилококке у новорожденных можно посмотреть на фото, обычно это обильная гнойничковая сыпь на коже с краснотой и мокнутием, могут быть нагноения вплоть до абсцессов, фурункулов и карбункулов, которые нужно немедленно лечить.
Во многих медицинских руководствах есть фото проявлений стафилококка у новорожденных. Это поражения глаз, слизистых рта, кожных покровов или общее поражение организма вплоть до сепсиса.
Как проявляется стафилококк у новорожденных
Проявления стафилококка у малышей будут зависеть от того, какой вид стафилококка подцепил малыш и насколько слабы его системы защиты. При поражении кожи возникают гнойничковые высыпания с краснотой и воспалением, вплоть до формирования обширных гнойных поражений — абсцессов.
При поражении носоглотки развиваются насморк, боли в горле вплоть до ангины, кашель и признаки простуды. Но протекает такая простуда тяжело, с высокой температурой и интоксикацией. Поражения глаз выражаются в гнойном конъюнктивите и блефарите, могут серьезно поражаться роговица и другие ткани глаза. Кишечные проявления стафилококка будут проявляться сильными поносами, рвотами и признаками кишечной инфекции. Дети плачут и капризничают из-за болей в животе. Инфекция может протекать тяжело с сильным обезвоживанием, температурой и токсикозом. Могут поражаться почки с изменениями в моче – лейкоцитами, кровью, гноем. Но особенно опасно состояние сепсиса – это проникновение стафилококка в кровь и распространение его по всем органам и системам, внутри которых формируются гнойные очаги. Это смертельно опасное осложнение стафилококковой инфекции, которого никак нельзя допускать!
Последствия стафилококка у новорожденных
Обычно стафилококки хорошо лечатся, они чувствительны к антибиотикам и инфекцию у ребенка достаточно быстро устраняют.
Оцените материал:
спасибо, ваш голос принят
как выглядит и проявляется, последствия
Стафилококк относится к группе микробов широко распространенных в окружающей среде. Для большинства людей стафилококки не опасны, являясь частью условно-патогенной флоры. Но, если стафилококк выявляется у маленьких детей – это может быть опасным. За счет сниженного иммунитета новорожденные могут заражаться стафилококком с развитием тяжелых инфекций.
Но, если стафилококк выявляется у маленьких детей – это может быть опасным. За счет сниженного иммунитета новорожденные могут заражаться стафилококком с развитием тяжелых инфекций.
Новорожденные обладают сниженным иммунитетом, особенно, если они рождены ранее срока, беременность была тяжелой или протекала с осложнениями, был гестоз. Также особенно подвержены стафилококку новорожденные малыши с низкой массой тела к рождению, наличием врожденных отклонений в развитии, при нарушении гигиены ребенка и плохом за ним уходе. Ребенок из стерильных условий матки попадает в среду, полную микробов, они активно заселяют его кожу и пищеварительный тракт, слизистые. Если организм незрелый и иммунная защита слаба, микробы могут активизироваться и дать заболевание.
Вызывать патологии могут разные виды стафилококка. К ним относятся:
- кишечный стафилококк у новорожденных, который может давать заболевания пищеварительного тракта или мочеполовой системы
- гемолитический стафилококк у новорожденных, который может приводить к ангинам или поражениям дыхательных путей
- золотистый стафилококк, который может давать поражения всех внутренних органов вплоть до сепсиса (заражение крови, всего организма).

- эпидермальный стафилококк у новорожденных, который поражает слизистые и кожу у сильно ослабленных детей, нарушает заживление ран.
Чем опасен стафилококк у новорожденных
Стафилококковая инфекция у совсем малышей может давать разные проявления болезни, от поражений кожи до поражения практически всех внутренних органов. Некоторые формы стафилококка, особенно внутрибольничные, могут быть очень агрессивными. Они дают тяжелые пневмонии, пиелонефриты, поражения организма в виде сепсиса – заражение крови с крайне тяжелым течением. Инфекция может развиваться быстро и буквально за пару дней приобрести тяжелое агрессивное течение потому, что иммунитет новорожденного не в силах побороть инфекцию. Стафилококки широко распространены, они могут попасть к ребенку о матери, от персонала или других детей, носителей стафилококка или больных инфекцией.
Эпидермальный стафилококк у новорожденных
Данный вид стафилококковой инфекции приводит к поражениям слизистых носа, горла, кожных покровов и глаз.
Как выглядит стафилококк у новорожденных
Сложно однозначно ответить, как выглядит стафилококк у новорожденных, потому что форм стафилококковой инфекции очень много. Если инфекция поражает кожные покровы, возникают особые поражения кожи – пиодермии. Проявления сыпи при стафилококке у новорожденных можно посмотреть на фото, обычно это обильная гнойничковая сыпь на коже с краснотой и мокнутием, могут быть нагноения вплоть до абсцессов, фурункулов и карбункулов, которые нужно немедленно лечить.
Во многих медицинских руководствах есть фото проявлений стафилококка у новорожденных. Это поражения глаз, слизистых рта, кожных покровов или общее поражение организма вплоть до сепсиса.
Это поражения глаз, слизистых рта, кожных покровов или общее поражение организма вплоть до сепсиса.
Как проявляется стафилококк у новорожденных
Проявления стафилококка у малышей будут зависеть от того, какой вид стафилококка подцепил малыш и насколько слабы его системы защиты. При поражении кожи возникают гнойничковые высыпания с краснотой и воспалением, вплоть до формирования обширных гнойных поражений — абсцессов.
При поражении носоглотки развиваются насморк, боли в горле вплоть до ангины, кашель и признаки простуды. Но протекает такая простуда тяжело, с высокой температурой и интоксикацией. Поражения глаз выражаются в гнойном конъюнктивите и блефарите, могут серьезно поражаться роговица и другие ткани глаза. Кишечные проявления стафилококка будут проявляться сильными поносами, рвотами и признаками кишечной инфекции. Дети плачут и капризничают из-за болей в животе. Инфекция может протекать тяжело с сильным обезвоживанием, температурой и токсикозом. Могут поражаться почки с изменениями в моче – лейкоцитами, кровью, гноем.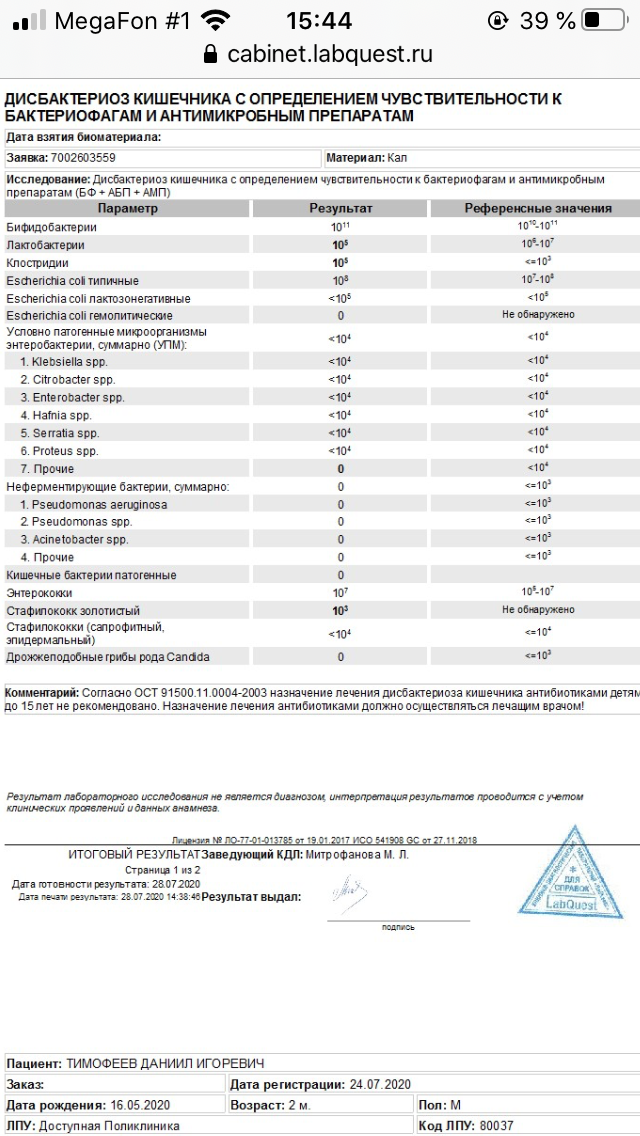 Но особенно опасно состояние сепсиса – это проникновение стафилококка в кровь и распространение его по всем органам и системам, внутри которых формируются гнойные очаги. Это смертельно опасное осложнение стафилококковой инфекции, которого никак нельзя допускать!
Но особенно опасно состояние сепсиса – это проникновение стафилококка в кровь и распространение его по всем органам и системам, внутри которых формируются гнойные очаги. Это смертельно опасное осложнение стафилококковой инфекции, которого никак нельзя допускать!
Последствия стафилококка у новорожденных
Обычно стафилококки хорошо лечатся, они чувствительны к антибиотикам и инфекцию у ребенка достаточно быстро устраняют. Но иногда стафилококковая инфекция переходит в бессимптомное носительство, ребенок может заражать других детей и носить в себе «бомбу часовым механизмом». При ослаблении иммунитета стафилококк может активироваться и дать тяжелые проявления инфекции. Важно полностью избавляться от патогенных форм стафилококка, чтоб не рисковать здоровьем малыша.
Теги по теме: здоровьемалыш 0-1Оцените материал:
спасибо, ваш голос принят
возможные причины появления и терапия
Стафилококк у новорожденных — это заболевание, бактерия которого имеет шаровидную форму.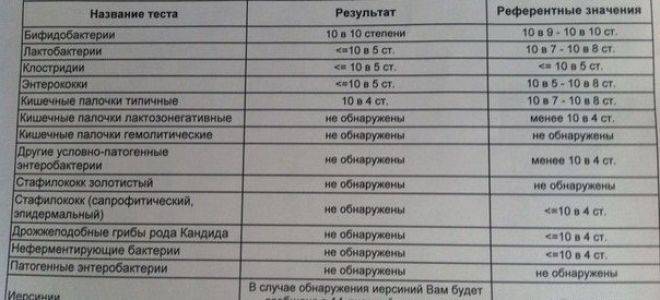 Локализуется на теле, но при попадании в организм вызывает патологические процессы. Поскольку не все препараты разрешаются детям грудного возраста, то бороться с заболеванием достаточно нелегко.
Локализуется на теле, но при попадании в организм вызывает патологические процессы. Поскольку не все препараты разрешаются детям грудного возраста, то бороться с заболеванием достаточно нелегко.
Причины
В первую очередь, причиной возникновения стафилококка у новорожденных детей является ослабленный иммунитет после рождения. После появления на свет малыш сразу же пытается адаптироваться к окружающей среде, и его организм начинают заселять различные бактерии.
Наиболее этому заболеванию в условиях ослабленного иммунитета подвержены дети, которые родились преждевременно, либо если роды проходили посредством кесарева сечения.
У детей, родившихся раньше срока, иммунитет всегда ослаблен, поэтому возникают большие риски заражения инфекциями. Неправильный уход за ребенком и несоблюдение правил гигиены способствуют заболеванию стафилококком.
Еще одной причиной является прямое заражение от матери к ребенку. В этом случае способов несколько: при прохождении по родовым путям матери, при наличии патологий беременности, через грудное молоко матери, в том числе из-за несоблюдения правил гигиены. Мать может быть заражена инфекцией и при контакте с ребенком любым из способов передать ее ему.
Мать может быть заражена инфекцией и при контакте с ребенком любым из способов передать ее ему.
Стафилококком ребенок может заразиться в роддоме и от медицинского персонала. Заражение такой инфекцией способствует развитию других заболеваний у грудничка.
Симптомы
Как распознать, что организм малыша инфицирован палочкой стафилококка? Какие симптомы этой болезни? Грудной ребенок не умеет говорить, поэтому рассказать о его болезни может лишь его поведение. Ниже перечислены общие симптомы стафилококка у новорожденного:
- Инфекция попадает в пищеварительный тракт ребенка через ротовую полость и дыхательные пути, поражая эти органы.
- Попадание бактерии в дыхательные пути будет провоцировать непрекращающийся ринит, нарушение аппетита.
- При поражении ротовой полости мы наблюдаем наличие гнойного налета на небе, миндалинах и языке, повышение температуры.
- Зев воспаляется.
- Грудничок отказывается от еды, становится капризным, плачет.

Заражение стафилококком чаще всего происходит через пищевые пути, поэтому очень часто обнаруживают стафилококк в кале. В нормальных показателях его там быть не должно.
При наличии бактерии в кале есть вероятность развития гастрита. Признаки стафилококка у новорожденных в кишечнике таковы: рвота, бледность кожи, диарея, высыпания фурункулов на кожных покровах. Могут иметь присутствие боль в животе, головокружение и слабость. Одним из серьезных осложнений стафилококка может стать сепсис, когда инфекция распространяется через кровь по организму. Сепсис часто становится причиной смерти. Чтобы избежать такого исхода, необходимо своевременно назначить лечение.
Виды
На сегодняшний день существует более 25 видов стафилококка. Наиболее опасны для человека 4 разновидности. Для того чтобы определиться с лечением заболевания, надо установить, к какому виду оно относится, поскольку симптоматика у детей проявляется разная.
Сапрофитный стафилококк
Наименее редко встречается у детей и считается самым безопасным в сравнении с другими видами. Поражает мочеполовую систему — мочевой пузырь, образуя воспаления. Инфекция образуется на кожных покровах и слизистых мочеполовой системы. Также поражаются почки, образуя воспаления. Возникают боли внизу живота и частое мочеиспускание. Выявить данный вид можно, сдав клинический анализ мочи. Чаще всего проявляется у матери.
Поражает мочеполовую систему — мочевой пузырь, образуя воспаления. Инфекция образуется на кожных покровах и слизистых мочеполовой системы. Также поражаются почки, образуя воспаления. Возникают боли внизу живота и частое мочеиспускание. Выявить данный вид можно, сдав клинический анализ мочи. Чаще всего проявляется у матери.
Эпидермальный стафилококк
Очагом поражения становятся кожные покровы и слизистые оболочки. Такому виду наиболее подвержены дети с ослабленным иммунитетом, родившиеся преждевременно и перенесшие хирургическое вмешательство. При ослабленном организме возможно заражение крови. Обнаружить симптомы может врач при осмотре ребенка.
Гемолитический стафилококк
Опасен тем, что поражает слизистые, от чего очень по симптоматике похож на ОРВИ. Пробуждает воспалительные реакции, поражает мочеиспускательную систему. Бактериальный посев поможет обнаружить данный вид стафилококка. Лечение большинством антибиотиков может быть малоэффективным.
Золотистый стафилококк — распространенная болезнь
Самый опасный из всех разновидностей — золотистый стафилококк у новорожденных.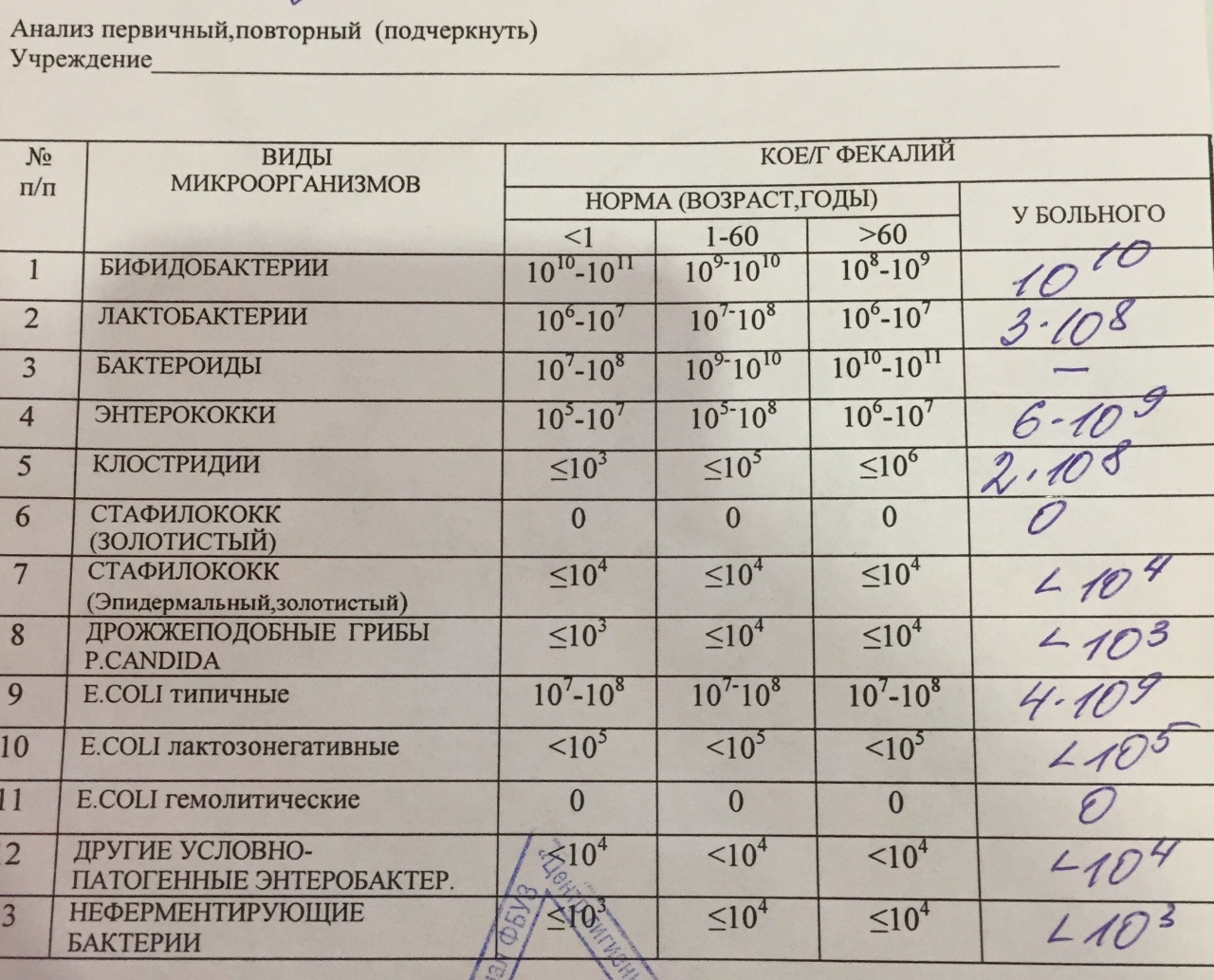 Может спровоцировать множество других заболеваний с отягчающими последствиями. Симптомы могут быть обнаружены уже через несколько часов после заражения. Вызывает воспалительные процессы, живет и размножается в различных органах ребенка, тем самым и вызывает другие болезни. Инфекция способна переносить высокую и низкую температуры. Вырабатывает сильнейшие яды в процессе активности, такие токсины могут вызвать высыпания на коже как при ожогах. Сохраняет устойчивость к этиловому спирту, большинству антибиотиков, перекиси водорода, но чувствителен к зеленке. Лечение может не назначаться, если инфекция выявлена, но не активна, то есть никак не проявляется. Золотистый стафилококк, обнаруженный в крови, может вызвать тяжелые последствия.
Может спровоцировать множество других заболеваний с отягчающими последствиями. Симптомы могут быть обнаружены уже через несколько часов после заражения. Вызывает воспалительные процессы, живет и размножается в различных органах ребенка, тем самым и вызывает другие болезни. Инфекция способна переносить высокую и низкую температуры. Вырабатывает сильнейшие яды в процессе активности, такие токсины могут вызвать высыпания на коже как при ожогах. Сохраняет устойчивость к этиловому спирту, большинству антибиотиков, перекиси водорода, но чувствителен к зеленке. Лечение может не назначаться, если инфекция выявлена, но не активна, то есть никак не проявляется. Золотистый стафилококк, обнаруженный в крови, может вызвать тяжелые последствия.
Стафилококк является бактерией, которая выделяет очень сильный и опасный токсин, неблагоприятно воздействующий на организм. Эта бактерия в организме имеется в небольшом количестве и обычно не причиняет особого вреда, но при ослаблении иммунитета стафилококк активно размножается, что нередко приводит к появлению гнойно-воспалительного процесса. В особенности золотистый стафилококк может быть опасным для новорожденных, так как у малышей иммунитет еще полностью не сформирован, и у него нет сил противостоять агрессивному воздействию микроба. Вместе с этим у ребенка могут развиться довольно опасные патологии, даже самые тяжелые, например, менингит или сепсис.
В особенности золотистый стафилококк может быть опасным для новорожденных, так как у малышей иммунитет еще полностью не сформирован, и у него нет сил противостоять агрессивному воздействию микроба. Вместе с этим у ребенка могут развиться довольно опасные патологии, даже самые тяжелые, например, менингит или сепсис.
Известно, что золотистый стафилококк – это в большинстве случаев внутрибольничная инфекция, поэтому груднички могут заразиться ею от матери, персонала роддома или загрязненных предметов, не прошедших должную стерилизацию.
Диагностика
Проведение диагностики на выявление стафилококка у новорожденных проводится в случае выявления симптоматики данного заболевания. Мать и ребенок сдают анализы методом лабораторной бактериологической диагностики. Материалом для исследования у матери служит грудное молоко, сцеживаемое с каждой груди, а у грудничка берется биоматериал в зависимости от появления симптомов:
- Если появляются симптомы стафилококка у новорожденного, похожие на ОРВИ, – берут соскоб из зева и носа.

- При появлении дисбактериоза или симптомов кишечных инфекций на исследование сдают кал.
- Если на кожном покрове малыша появились высыпания, то соскоб собирают из ран ребенка.
- Анализ крови проводят для установления интенсивности воспалительного процесса. Сдача анализов определяет культуру и тип бактерий, поражающих организм ребенка.
Проведение данных исследований поможет понять, на каком этапе находится заражение инфекцией и какими методами лечить инфицированных. Возможно, потребуется провести дополнительные исследования для назначения наиболее эффективного лечения. При выявлении положительного результата лечение назначают и матери, и ребенку.
Инфекция в кале
Стафилококки у новорожденных в кале были определены еще в конце 19-го века. Они способны собираться в группы, создавая рисунок в виде грозди винограда. Стафилококки способны вызывать множество болезней не только у животных, но и у людей. Саму по себе бактерию стафилококка можно найти у любого человека на земле. Так как он относится к условно-патогенным микробам, то в малом количестве для здорового человека не представляет вреда. Но если у ребенка явным образом видны признаки стафилококковой инфекции, такие как температура, расстройство пищеварения, диарея, рвота, то необходимо обратиться к врачу.
Так как он относится к условно-патогенным микробам, то в малом количестве для здорового человека не представляет вреда. Но если у ребенка явным образом видны признаки стафилококковой инфекции, такие как температура, расстройство пищеварения, диарея, рвота, то необходимо обратиться к врачу.
Методология исследования заключается в отборе материала для отправки в лабораторию. В качестве диагностируемого материала может использоваться мазок или кал. Если на фоне превышения нормы количества стафилококковых колоний в кале имеются признаки интоксикации, в обязательном порядке необходимо провести комплекс лечебных процедур, назначаемых доктором, а если количество стафилококковых колоний в кале находится в пределах нормы, то необходимо провести ряд лечебных процедур для общего укрепления иммунитета ребенка. При лечении детей в большинстве случаев доктора назначают препараты на основе антибиотиков из ряда пенициллиновых или цефалоспоринов.
Медикаментозное лечение
Стафилококковая инфекция встречается чаще всего у детей. Она находится на первом месте среди инфекционных заболеваний. Чаще всего инфекция обнаруживается в дыхательных путях, в пищеварительной системе, в кишечнике, а также проявляет себя на коже. Бактерии стафилококка можно выявить только благодаря анализу кала, крови, и на отдельных участках кожи взятия — мазка или соскоба. Точный диагноз и разновидность может определить только специалист. Он определит симптомы и лечение стафилококка у новорожденных.
Она находится на первом месте среди инфекционных заболеваний. Чаще всего инфекция обнаруживается в дыхательных путях, в пищеварительной системе, в кишечнике, а также проявляет себя на коже. Бактерии стафилококка можно выявить только благодаря анализу кала, крови, и на отдельных участках кожи взятия — мазка или соскоба. Точный диагноз и разновидность может определить только специалист. Он определит симптомы и лечение стафилококка у новорожденных.
Если инфекция обнаружена на поверхности коже (раны, гнойники, и т. д.) или в носу, то ранки обрабатываются чаще всего обычной зеленкой, мазью Вишневского, также можно обработать перекисью водорода.
Если стафилококк обнаружен в носу или во рту, можно использовать промывание и полоскание.
Что касается антибиотиков, назначаются препараты на основе пенициллина. Также следует принимать витамины и различные микроэлементы для хорошего обмена веществ. Также принимают иммуноглобулины, чтобы восстановить функции организма, и бактериофаги.
Народные методы лечения
Нередко для лечения стафилококка используют народные методы:
- Для обработки пораженной кожи применяют отвар череды: 500 г сухой травы череды необходимо залить 2 л кипятка и проварить 15 минут. После этого отвар оставляют на полчаса, процеживают и перед купанием добавляют в ванночку.
- Также эффективно использование чесночного компресса: 50 г мелко порезанного чеснока заливается стаканом теплой воды и настаивается на протяжении 2 часов. Затем в полученном настое смачивают салфетку и на час прикладывают к требуемому участку кожи.
- Хорошо лечится золотистый стафилококк отваром из цветов лабазника корня аира, ромашки, плодов укропа, травы душицы и синюхи, листьев кипрея и мяты, шишек хмеля. Для приготовления берется по 2 ст. л. всех ингредиентов и смешивается с 1 л воды. Настаивается смесь около 10 часов, после чего процеживается и принимается трижды в день по 100 мл перед едой.
Профилактика
Для профилактики стафилококка у новорожденного, фото которых размещено выше, необходимо дать малышу сразу же приступить к контакту с мамой. Для этого рекомендуется прикладывание к груди в первые пару минут от рождения, совместное пребывание в палате. Также не рекомендуется задерживаться в родильном доме дольше, чем на три дня.
Для этого рекомендуется прикладывание к груди в первые пару минут от рождения, совместное пребывание в палате. Также не рекомендуется задерживаться в родильном доме дольше, чем на три дня.
Особо важно соблюдать личную гигиену новорожденного.
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
14151617181920
21222324252627
28
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Мар
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Что такое стафилококк? Когда он опасен, а когда с ним можно дружить?
Стафилококк обитает везде.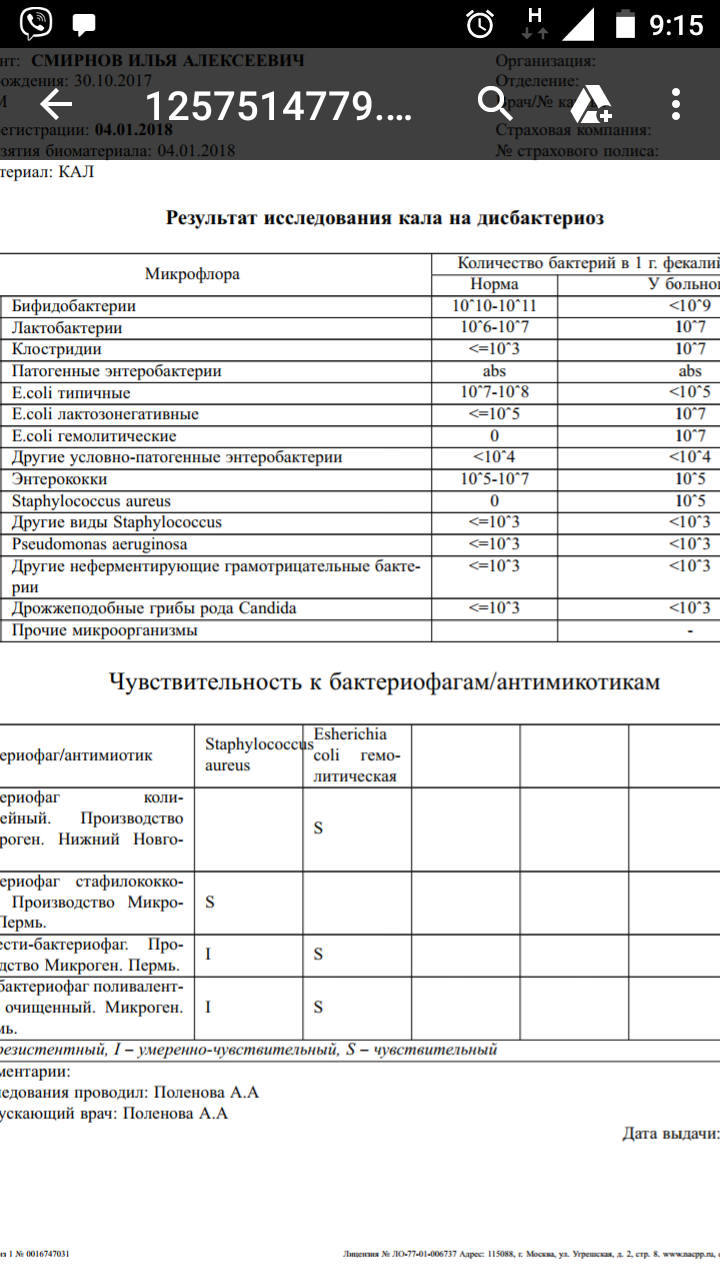 На сегодняшний день известно о пятидесяти его видах, среди которых только пятнадцать могут быть выявлены на коже или слизистых человека. Однако только три вида могут нанести вред, и то при некоторых обстоятельствах.
На сегодняшний день известно о пятидесяти его видах, среди которых только пятнадцать могут быть выявлены на коже или слизистых человека. Однако только три вида могут нанести вред, и то при некоторых обстоятельствах.
Излишняя стерильность – лучшая обитель для стафилококка
Многие убеждены, что соблюдая излишнюю стерильность в доме, уберегают себя от всевозможных заболеваний. На самом деле это не совсем так. Ежедневная тщательная уборка, граничащая с дезинфекцией, убивает многие бактерии и в таких случаях стафилококк – самый настоящий «царь горы». Многие кокки устойчивые даже к самой настоящей дезинфекции. И когда уничтожаются бактерии, которые способны их вытеснить, они начинают активно размножаться. Именно поэтому стафилококк может часто «подселиться» в больницах. Среда должна быть естественной. Тогда в ней будет и естественная «бактериальная гармония», не причиняющая вред здоровью.
Основные виды человеческого стафилококка
Наиболее агрессивными кокками считаются: сапрофитный, золотистый и эпидермальный.
Сапрофитный стафилококк наносит вред чаще женщинам, чем мужчинам. Он проявляется в виде воспалительных процессов в мочевом пузыре (цистит) и почках.
Золотистый стафилококк (aureus), который получил название благодаря своему цвету, наиболее «грозный» среди других. Он провоцирует большое количество заболеваний (от угрей до сепсиса и инфекционно-токсического шока) и поражает разные органы. Если его не лечить, то может быть в некоторых случаях даже летальный исход.
Эпидермальный стафилококк обычно «любит» оседать на слизистых оболочках и коже. У людей с хорошим иммунитетом, как правило, не возникает с ним проблем. Если бакпосев выявил эпидермальный стафилококк в пределах нормы, то трогать его не следует. Особенно, если кокк не докучает. Однако, когда он присутствует внутри организма тяжелобольного человека, то может спровоцировать очень серьезное ухудшение состояния и заболевания. В некоторых случаях он может вызывать гнойнички.
Распространяется стафилококк с помощью носителей бактерии. Причем многие носители (бессимптомные) сами не подозревают о его существовании. По некоторым данным, 40% здоровых людей имеют стафилококк.
Процесс инфицирования стафилококком
Очень важно знать для выяснения причин инфицирования кокками источники, с помощью которых они внедряются в организм.
— Капельно-воздушный путь. Таким образом бактерию может передать больной с пневмонией. Во время кашля кокки витают в воздухе и оседают на предметы интерьера.
— Заражение через еду. В некачественном мясе и немытых продуктах часто может обитать золотистый стафилококк. Первый симптом «нежелательного гостя» — пищевое отравление. Если вовремя не принять меры, может случиться сильнейшая интоксикация организма со всеми дальнейшими негативными последствиями.
— Пренебрежение правилами личной гигиены. Использование вещей и средств личной гигиены человека, больного стафилококком, особенно лицами с плохим иммунитетом.
— Повреждения кожи и слизистых. Даже посредством микротравм бактерия с легкостью внедряется в организм и быстро в нем размножается. Особая группа риска – больные с плохим иммунитетом в послеоперационном состоянии.
Ключевыми факторами для прогрессирования стафилококка являются: слабый иммунитет, иммунодепрессанты (препараты для угнетения иммунитета, например при трансплантации органов), длительный прием антибиотиков, некоторые хронические заболевания.
Основные симптомы стафилококка
Симптомы достаточно разнообразны, а их характер зависит от вида кокка. Тем не менее, точно определить его присутствие поможет бактериальный посев.
Кожные болезни. Угри, фурункулы, абсцессы и иные подобные проявления.
Ангина. Со стафилококком она протекает очень тяжело и часто сопровождается осложнениями.
Уретрит. Стафилококк в этом случае оседает на слизистой уретры, нанося вред всей мочеполовой системе. Он может образоваться из-за сомнительных половых контактов с носителями бактерии.
Он может образоваться из-за сомнительных половых контактов с носителями бактерии.
Простатит и аденома простаты. Ослабленный иммунитет позволяет коккам двигаться и размножаться по уретре, уязвляя все мочеполовые мужские органы.
У мужчин обычно стафилококк поражает кожные покровы и мочеполовую систему. В некоторых случаях он внедряется во внутренние органы и может вызвать сепсис и токсический шок.
Как выявить стафилококк?
Основной метод выявления – бактериальный посев. Для его осуществления происходит забор материалов, в которых бактерия локализуется. Результат посева выявляет тип кокка и его количество.
Лечение стафилококковых инфекций
Избавиться от стафилококка довольно сложно, но возможно. Основная сложность лечения в том, что он устойчивый ко многим антибиотикам. Более того, побороть его простыми антибиотиками практически нереально. Он быстро становится к ним нечувствительный. Его живучесть заключается в содержании пенициллиназы, расщепляющий молекулы антибиотиков. На сегодняшний день высокую эффективность в борьбе с кокком показали бактериофаги, стафилококковый анатоксин и метициллин. В комплексе с основным средством лечения следует повышать иммунитет, употреблять витаминные и минеральные комплексы и улучшать обмен веществ в организме. В том числе эффективный хирургический метод, предусматривающий локальное удаление очагов (фурункулы, гнойники).
Он быстро становится к ним нечувствительный. Его живучесть заключается в содержании пенициллиназы, расщепляющий молекулы антибиотиков. На сегодняшний день высокую эффективность в борьбе с кокком показали бактериофаги, стафилококковый анатоксин и метициллин. В комплексе с основным средством лечения следует повышать иммунитет, употреблять витаминные и минеральные комплексы и улучшать обмен веществ в организме. В том числе эффективный хирургический метод, предусматривающий локальное удаление очагов (фурункулы, гнойники).
Для поднятия иммунитета можно употреблять женьшень, родиолу, расторопшу, эхинацею и китайский лимонник. Кожные проявления можно смазывать зеленкой, которую очень не любит стафилококк.
Стафилококковая бактерия может стать серьезным поводом для беспокойства, если она провоцирует заболевания. В остальных случаях, если кокки не докучают и в небольших количествах присутствуют в организме, обычно проблем не возникает. Устранять их не нужно. Более того, дружи с ними, пока они тебя не трогают.
Более того, дружи с ними, пока они тебя не трогают.
Источник
Наука: Наука и техника: Lenta.ru
Многие ученые и врачи считают, что человечество вступает в новую эру, когда антибиотики, спасающие множество жизней, перестают быть эффективными против новых штаммов микробов. Ситуация обостряется с каждым годом во многом из-за того, что люди злоупотребляют препаратами и буквально сами взращивают неуязвимые бактерии. Золотистый стафилококк, устойчивый к метициллину, — как раз один из таких смертельно опасных монстров. «Лента.ру» пишет, чем опасны новые штаммы стафилококков, откуда они появились и можно ли их победить.
Тяжелый случай
В 2008 году в педиатрическое отделение при Университете Аристотеля (Греция) поступила десятилетняя девочка с царапиной на локте правой руки. У ребенка в последние три дня держалась высокая температура 40 градусов, и она с трудом могла двигать правой ногой. Врачи диагностировали воспаление правого тазобедренного сустава. Заподозрив бактериальную инфекцию, врачи назначили антибиотик клоксациллин. Тогда они еще не знали, что столкнулись со смертельно опасным противником.
Заподозрив бактериальную инфекцию, врачи назначили антибиотик клоксациллин. Тогда они еще не знали, что столкнулись со смертельно опасным противником.
Состояние девочки ухудшалось с каждым часом. Проявились симптомы поражения мозга и серьезные нарушения дыхания из-за проникновения инфекции в легкие. Стало ясно, что клоксациллин не помогает, поэтому было назначено сразу несколько новых антибиотиков. На пятый день рентген показал обширное поражение правой бедренной кости и прилегающей мышечной ткани. Доктора провели дренирование мягких тканей на ноге и выпустили гной, в котором кишели метициллинрезистентные золотистые стафилококки (МРЗС).
Микробные культуры золотистого стафилококка
Фото: Andrei Papkou
Девочка находилась в критическом состоянии целую неделю, после чего ее самочувствие стало улучшаться благодаря интенсивной терапии. Однако инфекция терроризировала организм ребенка в течение нескольких месяцев, бактерии практически «объели» кость. На полное восстановление организма после тяжелой инфекции потребовалось три года. Девочке сильно повезло, потому что благополучный исход составляет лишь небольшой процент подобных случаев.
Девочке сильно повезло, потому что благополучный исход составляет лишь небольшой процент подобных случаев.
МРЗС обычно связан с внутрибольничными инфекциями. Иными словами, пациенты в больницах, имеющие раны и ослабленный иммунитет, являются основной группой риска. Золотистый стафилококк способен выживать в почти стерильных условиях и распространяется несмотря на дезинфекцию. Но, к сожалению, МРЗС встречается и за пределами больниц, в этом случае он называется бытовым. Именно его подхватила десятилетняя пациентка через обыкновенную царапину. Стафилококк может и не вызвать инфекции, но если организм по какой-то причине ослаблен, последствия могут быть катастрофическими.
Поедающие заживо
МРЗС является одной из тех самых «пожирающих плоть бактерий», о которых СМИ рассказывают леденящие душу истории. Этот микроб отвечает за треть всех случаев некротизирующего фасциита — тяжелой инфекции, буквально разъедающей мягкие ткани организма. Входными воротами для смертельно опасного микроба может быть порез или ожог, хотя известны случаи, когда фасциит развивался после употребления сырых морепродуктов. Зубные болезни тоже повышают риск инфекции.
Зубные болезни тоже повышают риск инфекции.
Впрочем, некротизирующий фасциит можно предотвратить, если правильно ухаживать за ранами, мыть руки и следить за гигиеной полости рта. При лечении врачи ампутируют пораженные ткани и вводят ударную смесь антибиотиков. Однако даже при правильном и своевременном лечении треть пациентов умирает.
Легкие, пораженные стафилококком
Фото: Wikipedia
В 2015 году врачи сообщили о крайне необычном случае некротизирующего фасциита, вызванного бытовым стафилококком. Инфекция развивалась молниеносно у пациента с нормальной иммунной системой. Мужчина в возрасте 52 лет поступил в больницу с невыносимой болью в левом бедре и отеком, который держался уже неделю. На коже ноги виднелись гематомы, пузыри, а пораженные участки потеряли чувствительность. Несмотря на агрессивную терапию, хирургическую обработку раны и прием антибиотиков широкого спектра действия больной скончался от сепсиса менее чем через 24 часа после обращения. У мужчины не было никаких травм или предполагаемых контактов с МРЗС, однако он лечился от остеоартроза левого колена периодическими инъекциями стероидов. Последняя инъекция была сделана за три недели до начала симптомов.
Последняя инъекция была сделана за три недели до начала симптомов.
МРЗС вызывает не только инфекции мягких тканей. Стафилококк наряду с некротизирующим фасциитом способен провоцировать смертельную некротизирующую пневмонию или внутреннюю гангрену, быстро разрушающую легочные ткани. В большинстве случаев заболевание приводит к летальному исходу, даже несмотря на ударную дозу сильнодействующих антибиотиков, нацеленных против стафилококков. Такая пневмония чаще развивается у детей и молодых взрослых, особенно после вирусной респираторной инфекции, однако поражает и людей старшего возраста.
Опасный вид
Ежегодно в США регистрируется почти 300 тысяч госпитализаций, связанных с золотистым стафилококком, при этом почти половина приходится на МРЗС. Бытовой стафилококк отличается от внутрибольничного генетически. В Северной Америке наиболее распространен «суперзаразный» штамм USA300.
Материалы по теме:
Устойчивость к метициллину придает ген mecA, располагающийся в так называемой стафилококковой кассетной хромосоме (SCC, staphylococcal cassette chromosome), которые у разных штаммов имеют разное строение. Бытовые штаммы имеют меньшую и менее сложную версию SCC, специалисты ее обозначают как SCC mecA типа IVa. Она содержит меньше генов, способствующих устойчивости, чем внутрибольничные виды МРЗС, однако включает уникальные гены вирулентности, то есть способности вызывать заболевания или гибель организма. Таким образом бытовые штаммы легче поддаются лечению, но они убивают быстрее, чем те, что атакуют пациентов больниц и клиник. Гены вирулентности производят токсины, представляющие опасность даже для здоровых людей с нормальным иммунитетом. Один из таких токсинов — лейкоцидин Пантона-Валентайна (PVL) — помогает бактерии бороться с клетками иммунитета. Попадание МРЗС, вырабатывающих PVL, в организм человека часто приводит к инфекции мягких тканей, в том числе некротизирующему фасцииту.
Бытовые штаммы имеют меньшую и менее сложную версию SCC, специалисты ее обозначают как SCC mecA типа IVa. Она содержит меньше генов, способствующих устойчивости, чем внутрибольничные виды МРЗС, однако включает уникальные гены вирулентности, то есть способности вызывать заболевания или гибель организма. Таким образом бытовые штаммы легче поддаются лечению, но они убивают быстрее, чем те, что атакуют пациентов больниц и клиник. Гены вирулентности производят токсины, представляющие опасность даже для здоровых людей с нормальным иммунитетом. Один из таких токсинов — лейкоцидин Пантона-Валентайна (PVL) — помогает бактерии бороться с клетками иммунитета. Попадание МРЗС, вырабатывающих PVL, в организм человека часто приводит к инфекции мягких тканей, в том числе некротизирующему фасцииту.
Распространение золотистого стафилококка в Европе
Изображение: Wikipedia
Штамм USA300 прибыл в Северную Америку в первой половине XX века из Европы, где он появился в середине XIX века. Тогда он был менее заразным и не имел многих мутаций, сейчас делающих его смертельно опасным. Роковую роль в создании супермикроба-монстра сыграл заразивший стафилококк вирус — бактериофаг ϕSa2USA, который нес в себе ген, кодирующий PVL. В начале третьего тысячелетия штамм получил широкое распространение в США, а также переселился в Южную Америку, Европу, Африку и Азиатско-Тихоокеанский регион. Считается, что к 2001 году МРЗС колонизировал примерно восемь процентов населения США.
Роковую роль в создании супермикроба-монстра сыграл заразивший стафилококк вирус — бактериофаг ϕSa2USA, который нес в себе ген, кодирующий PVL. В начале третьего тысячелетия штамм получил широкое распространение в США, а также переселился в Южную Америку, Европу, Африку и Азиатско-Тихоокеанский регион. Считается, что к 2001 году МРЗС колонизировал примерно восемь процентов населения США.
Бой с монстром
Журналистка Соня Шах в своей книге «Пандемия: Всемирная история смертельных вирусов» так вспоминает свою встречу с бытовым МРЗС, которым заразился ее сын: «Педиатр, обычно шутливая и жизнерадостная, взглянув на колено моего сына, резко посуровела. Назначение она выписала, не дожидаясь результатов анализов: сильный антибиотик клиндамицин, старый добрый и надежный бактрим и в придачу жесткий режим избавления от гноя с помощью горячих компрессов и выдавливания… Каждую каплю требовалось аккуратно подбирать и удалять, чтобы она не просочилась в микротрещины на коже или, что еще хуже, не поселилась на полотенцах, постелях, обивке или свободных поверхностях, где она может ждать своего часа целый год».
Золотистый стафилококк
Фото: Wikipedia
Ребенок выздоровел, однако, несмотря на все усилия и гигиенические процедуры, семье не удалось полностью избавиться от МРЗС. Рецидив сначала случился у сына, так как стафилококк поселился у него в организме, иногда проявляясь в виде болезненных нарывов, наполненных гноем. Через некоторое время инфекция перешла и на журналистку. Шах пишет, что хроническая инфекция затихла сама собой, несмотря на всю борьбу с коварными микробами. Тем не менее в запущенных случаях иногда единственным способом остановить заражение остается ампутация конечностей.
Пока МРЗС остается восприимчив к ряду антибиотиков, не принадлежащих бета-лактамам. Однако обнаруживаются новые штаммы, которые проявляют устойчивость и к другим лекарствам. Ситуацию осложняет то, что антибиотики применяют повсеместно и часто неправильно, что только провоцирует размножение бактерий, вызывающих трудноизлечимые или вообще неизлечимые инфекции. При этом антибиотики новых классов изобретаются достаточно редко, а эффективных заменителей, к сожалению, пока не существует.
Стафилококковая инфекция – лечение, симптомы, причины болезни, первые признаки
Описание
Стафилококковая инфекция – большая и разнородная группа заболеваний, которые вызываются бактериями рода стафилококков, имеют коды по МКБ А05.0, А41.0, А41.1, А41.2, А48.3. Диагностируется преимущественно у детей и ослабленных пациентов. Может поражать кожу, мягкие ткани, кости, суставы и внутренние органы. Возбудители провоцируют фурункулы, абсцессы, нагноение ран, менингит, эндокардит, пневмонию, пищевые отравления и другие патологии. Становятся причиной развития сепсиса и тяжелых внутрибольничных инфекций.
Стафилококки – грамположительные микроорганизмы шарообразной формы (кокки) из семейства Micrococcaceae. Могут размножаться как в кислородной, так и в бескислородной среде. Долго остаются жизнеспособными в неблагоприятных условиях, устойчивы к нагреванию, заморозке, солнечному свету, воздействию спирта и хлорсодержащих антисептиков. Погибают при обработке перекисью водорода, продолжительном кипячении. Наибольшее клиническое значение имеет золотистый стафилококк, реже болезнь вызывают эпидермальные и сапрофитные стафилококки.
Наибольшее клиническое значение имеет золотистый стафилококк, реже болезнь вызывают эпидермальные и сапрофитные стафилококки.
Источниками инфицирования становятся как пациенты, страдающие любой формой стафилококковой инфекции, так и здоровые носители. Бессимптомное носительство выявляется у 20-30% здоровых людей, обычно бактерия обнаруживается в носовых ходах. Особую опасность в качестве распространителей представляют медработники, у которых часто обнаруживаются антибиотикоустойчивые штаммы. Иногда микробы попадают в организм больного от коров, собак, свиней или лошадей.
Преобладают контактный и воздушно-капельный пути передачи возбудителя. Возможно алиментарное заражение через молочные продукты или кондитерские изделия. В 70-80% стафилококки обладают резистентностью к антибиотикам из группы пенициллинов. На этих микробов нередко не действуют тетрациклины, аминогликозиды и хлорамфениколы (левомицетин и аналоги).
Стафилококки проникают в организм через слизистые оболочки, раны, ссадины и царапины. Очаги во внутренних органах образуются при распространении бактерий с кровью. При алиментарном заражении имеет значение количество токсинов, пищевые токсикоинфекции возникают при употреблении продуктов, обильно обсемененных стафилококком.
Очаги во внутренних органах образуются при распространении бактерий с кровью. При алиментарном заражении имеет значение количество токсинов, пищевые токсикоинфекции возникают при употреблении продуктов, обильно обсемененных стафилококком.
Возникновению болезни способствуют ослабление организма и снижение иммунитета. Стафилококковая инфекция чаще диагностируется у детей первых 3 лет жизни. Является значимой причиной развития внутрибольничной инфекции у людей, страдающих эндокринными и тяжелыми соматическими заболеваниями, вирусными инфекциями, различными иммунодефицитами. Вероятность патологии повышается при продолжительном приеме антибиотиков, иммунодепрессантов и гормональных препаратов, проведении рентгенотерапии и химиотерапии.
Симптомы
Фото: gooddoctor.ru
Проявления стафилококковой инфекции определяются локализацией патологического процесса.
Поражения мягких тканей
Для фурункулов, карбункулов, гидраденита характерно образование очага синюшно-багровой окраски. Через 1-3 дня боли становятся дергающими, пульсирующими, лишают ночного сна. Возможны гипертермия, синдром интоксикации. После вскрытия гнойника состояние улучшается.
Через 1-3 дня боли становятся дергающими, пульсирующими, лишают ночного сна. Возможны гипертермия, синдром интоксикации. После вскрытия гнойника состояние улучшается.
Абсцесс представляет собой гнойный очаг, ограниченный капсулой. При флегмоне процесс распространяется по туловищу или конечности. Состояние при абсцессах и флегмонах среднетяжелое или тяжелое, отмечается лихорадка, выраженная интоксикация. Панариций поражает пальцы рук, возможны как легкие поверхностные формы (паронихия, подкожный панариций), так и тяжелые поражения (сухожильный, суставной, костный панариций).
У новорожденных развиваются пузырчатка, пиодермии, генерализованная скарлатиноподобная сыпь, локальное буллезное импетиго. Источником инфекции чаще становится пупочная ранка. Наблюдаются отслойка эпителия, формирование сливающихся пузырей, наполненных прозрачной стерильной жидкостью.
ЛОР-органы и бронхолегочная система
При поражении миндалин стафилококковая инфекция вызывает банальную острую ангину, которая в последующем иногда переходит в хронический тонзиллит. Синуситы и трахеиты обычно становятся осложнением респираторных вирусных инфекций.
Синуситы и трахеиты обычно становятся осложнением респираторных вирусных инфекций.
Пневмония стафилококковой этиологии выявляется редко. Для этой формы воспаления легких типичны тяжелое течение, яркий интоксикационный синдром, нарушения дыхания, выраженная одышка. Патология может осложняться эмпиемой плевры и абсцессом легких, представляющими серьезную угрозу для жизни больного.
Нервная система и органы чувств
Гнойный менингит развивается в результате проникновения стафилококковой инфекции из околоносовых пазух, фурункулов и ран на лице. Сопровождается неврологическими нарушениями, менингеальными симптомами, эпилептическими припадками, расстройствами сознания.
Наружный и средний отит возникают на фоне гайморита, ангины, других ЛОР-заболеваний, вызванных стафилококком. Заболевание проявляется болями, гнойными выделениями, снижением слуха, появлением посторонних шумов. Пациенты со стафилококковым конъюнктивитом жалуются на рези, слезотечение. За ночь гнойные выделения накапливаются и склеивают ресницы.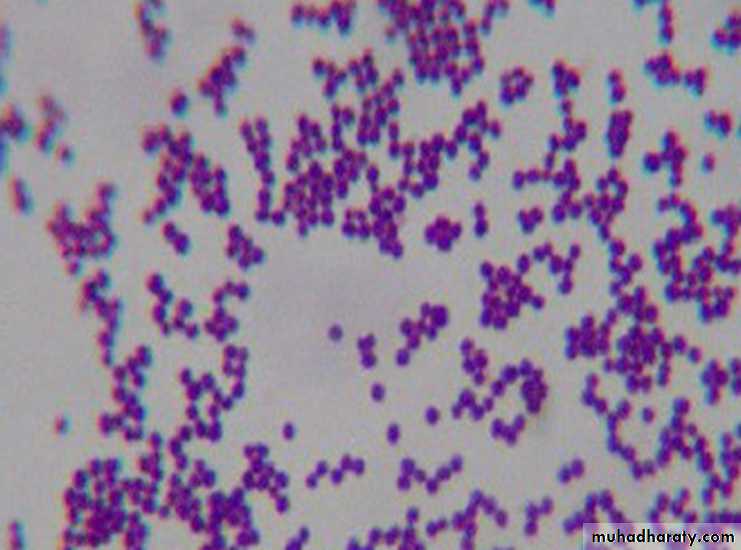
Кости и суставы
Стафилококковый остеомиелит обычно имеет гематогенный характер, развивается у детей, чаще поражает плечевую, бедренную, большеберцовую кости. На фоне интоксикации и гипертермии появляются нестерпимые рвущие, выкручивающие, дергающие боли, усиливающиеся при малейших движениях. При прорыве гнойника за пределы кости развивается флегмона окружающих тканей, которая вскрывается наружу с образованием свища.
Гнойные артриты являются осложнением остеомиелита, стафилококковой инфекции мягких тканей. Пациентов беспокоят резкие стреляющие или пульсирующие болевые ощущения. Сустав отекает, краснеет. Движения становятся невозможными из-за боли. Для артрита и остеомиелита характерны ознобы, выраженная гипертермия, разбитость. Возможны нарушения сознания.
Сердечно-сосудистая система
Гнойный перикардит, как правило, возникает вторично при распространении инфекции у больных пневмонией, абсцессом легкого, эмпиемой плевры. Из-за сдавления сердечной мышцы гноем, скопившимся в сердечной сумке, появляются нарушения сердечной деятельности: боли, тахикардия, цианоз кожи, мучительная одышка. Возможна тампонада сердца.
Возможна тампонада сердца.
Стафилококковый эндокардит чаще диагностируется после открытых операций на сердце. Проявляется повышением температуры тела, слабостью, кашлем, одышкой, болями в грудной клетке. Поражение клапанов приводит к развитию приобретенных пороков сердца и сердечной недостаточности. Флебиты осложняют течение абсцессов и инфицированных ран. Вена болезненная, напряженная, просматривается под кожей в виде красной полосы.
Мочевыводящие и половые органы
Наиболее грозными заболеваниями мочеполовой системы, вызываемыми стафилококками, являются острый гнойный пиелонефрит, абсцесс почки, пионефроз, эндометрит, пиометра. Стафилококковая инфекция проникает в почки или матку гематогенно либо восходящим путем – через уретру, мочевой пузырь, влагалище. Отмечаются боли, интоксикация, ознобы, специфические выделения, изменения мочи.
Пищеварительная система
Самая распространенная разновидность стафилококковой инфекции ЖКТ – пищевой токсикоз. Возникает при употреблении продуктов, содержащих большое количество стафилококковых токсинов. Развивается всего через 1-2 часа после приема пищи. Протекает с тошнотой, рвотой, слабостью, ощущением бурления в животе, диареей, симптомами интоксикации. Возможно обезвоживание.
Развивается всего через 1-2 часа после приема пищи. Протекает с тошнотой, рвотой, слабостью, ощущением бурления в животе, диареей, симптомами интоксикации. Возможно обезвоживание.
Стафилококковый сепсис
Заражение крови может осложнить течение любой стафилококковой инфекции. Чаще выявляется при гнойном поражении легких, сердца и почек, крупных очагах в мягких тканях, костях и суставах. Наблюдаются тяжелые ознобы, волнообразная лихорадка. Черты лица заостряются, кожа становится серой или желтоватой. Нарушается сознание.
Страдают функции внутренних органов, развивается сердечно-сосудистая, дыхательная и почечная недостаточность. Возможно появление вторичных гнойных очагов. Тяжелейшим осложнением сепсиса становится инфекционно-токсический шок, который в 90% заканчивается гибелью больного.
Диагностика
Фото: love.zapilili.ru
Ведущую роль в диагностике стафилококковой инфекции любой локализации играют результаты лабораторных исследований мазков, смывов, мокроты, раневого отделяемого. Применяют следующие методы:
Применяют следующие методы:
- Бактериоскопия. Материал окрашивают и изучают под микроскопом. Обнаруживаются неподвижные шарообразные бактерии, которые группируются по 2-3 штуки, формируют типичную картину виноградной грозди.
- Микробиологическое исследование. Материал засевают на питательные среды, инкубируют в течение 1 суток. При обнаружении типичных колоний делают бактериоскопию, оставшуюся часть колонии пересевают и выдерживают еще 3 суток для уточнения вида возбудителя и определения антибиотикочувствительности.
- Серологические методики. Показаны при хронических формах стафилококковой инфекции. Чаще проводят РНГА или реакцию нейтрализации. Реже выполняют ИФА.
План других диагностических мероприятий определяется локализацией инфекционного очага. По показаниям назначают рентгенографию костей конечностей или грудной клетки, бронхоскопию, ЭКГ, эхокардиографию, люмбальную пункцию, иные исследования. Для оценки общего состояния организма и сохранности функций внутренних органов используют общие и биохимические анализы крови и мочи.
Для оценки общего состояния организма и сохранности функций внутренних органов используют общие и биохимические анализы крови и мочи.
Лечение
Фото: scaner.pro
Лечение может быть консервативным либо оперативным. План терапевтических мероприятий зависит от локализации и тяжести процесса. При ограниченных поражениях кожи, неосложненных ЛОР-патологиях, легкой форме пищевой токсикоинфекции взрослым и детям старшего возраста показана симптоматическая терапия, пациенты наблюдаются амбулаторно.
При тяжелых формах стафилококковой инфекции все больные госпитализируются вне зависимости от возраста. Новорожденных, особенно недоношенных, направляют в стационар даже при слабо выраженной симптоматике. Обязательным условием при обнаружении стафилококка является изоляция в течение 1 недели для предупреждения распространения внутрибольничной инфекции.
В рамках консервативного лечения проводят антибиотикотерапию и иммунокоррецию, вводят специфические противостафилококковые медикаменты. При необходимости выполняют хирургические операции и манипуляции: вскрытие и дренирование гнойных очагов, иссечение некротизированных тканей, перевязки, промывания полостей антисептическими растворами. В тяжелых случаях показана массивная инфузионная терапия, лечение в условиях реанимационного отделения.
При необходимости выполняют хирургические операции и манипуляции: вскрытие и дренирование гнойных очагов, иссечение некротизированных тканей, перевязки, промывания полостей антисептическими растворами. В тяжелых случаях показана массивная инфузионная терапия, лечение в условиях реанимационного отделения.
При пищевых токсикоинфекциях промывают желудок, назначают обильное питье, производят внутривенные инфузии для восстановления водно-солевого баланса.
Лекарства
Фото: theconversation.com
Для лечения стафилококковой инфекции используют препараты следующих групп:
- Антибиотики. На начальном этапе назначают полусинтетические пенициллины или цефалоспорины внутримышечно. При сепсисе, менингите, абсцессе легкого, других тяжелых патологиях вводят 2 антибиотика в максимальных дозах внутривенно. После получения результатов микробиологического исследования схему антибиотикотерапии корректируют с учетом чувствительности возбудителя.
- Гипериммунный антистафилококковый иммуноглобулин.
 Рекомендован при генерализации процесса, тяжелых формах стафилококковой инфекции, особенно – у детей раннего возраста. Медикамент вводится внутримышечно каждый день или через день.
Рекомендован при генерализации процесса, тяжелых формах стафилококковой инфекции, особенно – у детей раннего возраста. Медикамент вводится внутримышечно каждый день или через день. - Гипериммунная антистафилококковая плазма. В состав препарата входят антитела к стафилококку. Осуществляется внутривенное введение с периодичностью 1-3 суток.
- Стафилококковый анатоксин. Необходим при затяжном течении сепсиса, пневмонии и кожных инфекций, обусловленном снижением иммунных сил организма. Способствует выработке собственного стафилококкового антитоксина. Применяется подкожно с постепенным увеличением дозы.
Симптоматическая терапия осуществляется согласно общим рекомендациям по лечению того или иного заболевания. Чаще всего назначаются обезболивающие и противовоспалительные препараты.
Информация носит справочный характер и не является руководством к действию. Не занимайтесь самолечением. При первых симптомах заболевания обратитесь к врачу.
Народные средства
Фото: extract.market
Народные средства играют незначительную роль в лечении стафилококковой инфекции, применяются только в легких случаях и по согласованию с врачом. При ангине используют полоскания с отварами ромашки, шалфея, череды, бузины, календулы. Для укрепления иммунитета у взрослых полезны имбирный напиток, алоэ с орехами и медом, отвар эхинацеи, компот с шиповником. Детям можно употреблять травяные чаи, компот из шиповника, ореховую смесь с клюквой и яблоками.
Следует помнить, что стафилококковая инфекция чревата осложнениями, представляющими опасность для жизни. Самолечением нельзя ограничиваться даже при легких формах болезни. При появлении симптомов заболевания необходимо срочно обратиться к врачу.
Информация носит справочный характер и не является руководством к действию. Не занимайтесь самолечением. При первых симптомах заболевания обратитесь к врачу.Источники
- Инфекционные болезни: национальное руководство.
 Краткое издание/ под ред. Ющука Н.Д., Венгерова Ю.В. – 2019.
Краткое издание/ под ред. Ющука Н.Д., Венгерова Ю.В. – 2019. - Стафилококковые инфекции/ Ахтамов М.А., Сидикова К.А. – 1981.
- Инфекционные болезни у детей/ Учайкин В.Ф., Нисевич Н.И., Шамшева О.В. – 2013.
- Стафилококки и стафилококковая инфекция/ под ред. Иванова Н.Р. – 1980.
Ваши комментарии о симптомах и лечении
Staphylococcus epidermidis, выделенных у новорожденных, экспрессируют пилусоподобные структуры и ингибируются антимикробным пептидом, производным кателицидина, LL37
пациентов.
Комитет по этике Каролинской университетской больницы одобрил исследование, и родители дали свое информированное согласие на участие. За исключением одного недоношенного ребенка с сепсисом CoNS, все беременности и роды были в срок и без осложнений (GA 40 ± 1 нед; среднее значение ± стандартное отклонение). Было 11 мальчиков и 10 девочек с массой тела при рождении 3735 ± 582 г (среднее значение ± стандартное отклонение).Все новорожденные протекали без осложнений и находились на исключительно грудном вскармливании по требованию. Никакой антимикробной терапии ни мать, ни их потомство не получали, и дети родились в течение 24 часов после разрыва плодных оболочек. Амниотическая жидкость во всех случаях была прозрачной. Младенцам был 1 день (1 ± 0,3 дня; среднее значение ± стандартное отклонение) на момент сбора образцов, и ни один из младенцев не купался и не находился за пределами больницы. Одна биопсия была взята из очага токсической эритемы у здорового однодневного ребенка, как описано ранее (3).
Никакой антимикробной терапии ни мать, ни их потомство не получали, и дети родились в течение 24 часов после разрыва плодных оболочек. Амниотическая жидкость во всех случаях была прозрачной. Младенцам был 1 день (1 ± 0,3 дня; среднее значение ± стандартное отклонение) на момент сбора образцов, и ни один из младенцев не купался и не находился за пределами больницы. Одна биопсия была взята из очага токсической эритемы у здорового однодневного ребенка, как описано ранее (3).
Бактериальные штаммы.
Кожные мазки для микробных культур брали в соответствии с больничной практикой с поверхности нормальной кожи ( n = 9) и с участков с токсической эритемой ( n = 12), но никогда с участков, покрытых подгузником. Мы выделили CoNS у 17 младенцев и с помощью системы идентификации API STAPH V4.0 (BioMérieux, Marcy l-Etoile, Франция) идентифицировали 16 из этих штаммов как S. epidermidis .
Всего 13 S.epidermidis были выбраны случайным образом для дальнейшего исследования. Были изучены восемь образцов из нормальной кожи (клинический изолят, ДИ-1–8), четыре из очагов токсической эритемы (КИ-9–12) и один изолят крови, полученный от недоношенного ребенка (КИ-13) с клиническими проявлениями сепсиса. В качестве эталонных штаммов мы включили S. epidermidis ATCC 35984, S. epidermidis ATCC 12228, Staphylococcus aureus ATCC 29213 и Escherichia coli ATCC 25925 для определения минимальной ингибирующей концентрации.
Были изучены восемь образцов из нормальной кожи (клинический изолят, ДИ-1–8), четыре из очагов токсической эритемы (КИ-9–12) и один изолят крови, полученный от недоношенного ребенка (КИ-13) с клиническими проявлениями сепсиса. В качестве эталонных штаммов мы включили S. epidermidis ATCC 35984, S. epidermidis ATCC 12228, Staphylococcus aureus ATCC 29213 и Escherichia coli ATCC 25925 для определения минимальной ингибирующей концентрации.
Чувствительность к противомикробным препаратам S. epidermidis (CI-1–13; ATCC 12228; ATCC 35984; ATCC 29213; ATCC 25922) определяли методом микроразведений в бульоне в соответствии с рекомендациями Института клинических и лабораторных стандартов (CLSI; 21). Очищенный бульон Мюллера-Хинтона (MHB; BD Diagnostic systems, NJ) использовали, как описано ранее, поскольку было обнаружено, что стандартный MHB недооценивает активность противомикробных пептидов (22, 23). Поскольку S. epidermidis не могли расти в рафинированном MHB, для экспериментов использовали смесь 1:1 обычного MHB и очищенного MHB. Исходный раствор пептида LL37 (Innovagen, Lund, Sweden) готовили путем добавления пептида к очищенному MHB, содержащему 0,05% уксусной кислоты, для предотвращения осаждения пептида. Инокулят стандарта McFarland 0,5, соответствующий примерно 10 8 колониеобразующих единиц (КОЕ) на мл, получали путем суспендирования бактериальных колоний в PBS. Из этой суспензии готовили разведение 1:10, и 5 мкл этого раствора суспендировали в титрационных микропланшетах, содержащих 100 мкл очищенного MHB с добавлением LL37, что соответствует конечной суспензии 5 × 10 4 КОЕ на лунку.Лунки титрационного микропланшета содержали LL37 в концентрациях от 0,25 до 256 мг·л -1 (2-кратные разведения). Минимальную ингибирующую концентрацию (МИК) регистрировали как наименьшую концентрацию, полностью ингибирующую рост, регистрируемую невооруженным глазом. Лунки, содержащие очищенный MHB без LL37, использовали для контроля роста. Титрационные микропланшеты считывали после 18-часовой инкубации при 35°С.
Исходный раствор пептида LL37 (Innovagen, Lund, Sweden) готовили путем добавления пептида к очищенному MHB, содержащему 0,05% уксусной кислоты, для предотвращения осаждения пептида. Инокулят стандарта McFarland 0,5, соответствующий примерно 10 8 колониеобразующих единиц (КОЕ) на мл, получали путем суспендирования бактериальных колоний в PBS. Из этой суспензии готовили разведение 1:10, и 5 мкл этого раствора суспендировали в титрационных микропланшетах, содержащих 100 мкл очищенного MHB с добавлением LL37, что соответствует конечной суспензии 5 × 10 4 КОЕ на лунку.Лунки титрационного микропланшета содержали LL37 в концентрациях от 0,25 до 256 мг·л -1 (2-кратные разведения). Минимальную ингибирующую концентрацию (МИК) регистрировали как наименьшую концентрацию, полностью ингибирующую рост, регистрируемую невооруженным глазом. Лунки, содержащие очищенный MHB без LL37, использовали для контроля роста. Титрационные микропланшеты считывали после 18-часовой инкубации при 35°С.
Просвечивающая электронная микроскопия.
Поверхностные структуры S. epidermidis визуализировали с помощью просвечивающей электронной микроскопии (ЭМ) с отрицательным окрашиванием, при которой бактерии (CI-1–13; ATCC 12228; ATCC 35984) выращивали на чашках с кровяным агаром в течение 36–48 ч или в бульон для инфузии мозга и сердца (BHI) (BD Diagnostic systems, NJ) с начальной точки OD 600 0.05 до середины логарифмической фазы. Колонии, выращенные на чашках с агаром, ресуспендировали в 1% растворе параформальдегида, тогда как жидкие культуры центрифугировали при 1500×g в течение 3 мин, а затем ресуспендировали в 4% растворе параформальдегида в течение 15 мин. Затем следовали два цикла центрифугирования и ресуспендирования в PBS. Аликвоту 4 мкл добавляли на сетку, покрытую поддерживающей пленкой Formvar, покрытой углеродом, на 5 мин. Избыток раствора отмачивали фильтровальной бумагой, сетку окрашивали 0,5% раствором уранилацетата в воде в течение 5 мин и сушили на воздухе. Образцы визуализировали в электронном микроскопе Tecnai FEI 10 при 80 кВ. Трансмиссионный ЭМ-анализ всегда проводился сразу после фиксации бактерий.
Образцы визуализировали в электронном микроскопе Tecnai FEI 10 при 80 кВ. Трансмиссионный ЭМ-анализ всегда проводился сразу после фиксации бактерий.
Кроме того, S. epidermidis (CI-9) инкубировали в течение 1 ч при 37°C с 2 мг·мл -1 протеиназы K (Sigma-Aldrich Chemical Co., Сент-Луис, Миссури) или 30 мкг·мл -1 ДНКазы (RQ1, Promega, Мэдисон, Висконсин) после обработки, как описано ранее. Результаты анализировали с помощью отрицательного окрашивания.
Иммуноголд EM.
Для визуализации участков связывания Fbe на поверхности бактерий была проведена ЭМ иммунозолота на S. epidermidis (CI-9–12). Бактерии выращивали, как описано ранее, и 4 мкл бактериального образца добавляли к никелевым сеткам, покрытым формваром, на 5 мин. Чтобы свести к минимуму неспецифическое мечение, сетки инкубировали в 1% BSA и 1% желатине, а затем инкубировали с овечьим поликлональным анти-Fbe (Jan-Ingmar Flock, Karolinska Institutet, Швеция) и разбавляли 1:10. После промывания добавляли вторичные антитела, конъюгированные с золотом, в соотношении 1:50 (ослиный антиовечий IgG, частицы золота размером 5 нм).Наконец, сетки окрашивали в течение 15 с водным уранилацетатом и обрабатывали в электронном микроскопе Tecnai FEI 10 при 80 кВ.
После промывания добавляли вторичные антитела, конъюгированные с золотом, в соотношении 1:50 (ослиный антиовечий IgG, частицы золота размером 5 нм).Наконец, сетки окрашивали в течение 15 с водным уранилацетатом и обрабатывали в электронном микроскопе Tecnai FEI 10 при 80 кВ.
Выделение геномной ДНК.
Геномную ДНК готовили с использованием мини-набора QIAmp DNA (Qiagen, Hilden, Germany) по указанию производителя с модификацией, согласно которой клетки инкубировали при 37°C в течение 1 ч с 200 мкг·мл -1 лизостафина (Sigma -Aldrich Chemical Co., Сент-Луис, Миссури) перед стадией лизиса; через 1 ч к клеткам добавляли 20 мкл протеиназы К (Qiagen, Hilden, Германия) и инкубировали культуру при 56°С в течение 30 мин, затем при 95°С в течение 15 мин для лизиса клеток.
ПЦР-амплификация гена
аар . Анализы ПЦР, использованные в этом исследовании для обнаружения присутствия гена аар в S. epidermidis (CI-I-13; ATCC 35984; ATCC 12228), были выполнены путем амплификации двух разных фрагментов аар с использованием две пары праймеров, которые амплифицируют нуклеотиды 1140–1772 (праймеры аар-1 и аар-2) и 7023–7172 (праймеры аар-3 и аар-4) (табл. 1). Реакции ПЦР содержали 10 мкл экстрагированной ДНК, 1 × буфер II для ПЦР (Applied Biosystems, Фостер-Сити, Калифорния), 3 мМ MgCl 2 (Applied Biosystems, Фостер-Сити, Калифорния), 0.2 мМ dNTP (Applied Biosystems, Фостер-Сити, Калифорния), 0,2 мкМ каждого праймера и 1,25 ед. ДНК-полимеразы Ampli Taq Gold (Applied Biosystems, Фостер-Сити, Калифорния), а также воду, добавленную к конечному объему 50 мкл. Положительный контроль (геномная ДНК S. epidermidis ATCC 35984) и отрицательный контроль (реакционная смесь без ДНК) включали в каждый цикл ПЦР. Анализ ПЦР проводили на термоциклере PTC-200 Peltier (MJ Research Inc., Scandinavian Diagnostics Services, Фалькенберг, Швеция) при следующих условиях: начальная стадия денатурации при 95°C в течение 12 мин, затем 30 мин. циклы амплификации (95°С, 30 с; 58°С, 30 с; и 72°С, 60 с) и финальная стадия удлинения при 72°С в течение 7 мин.Электрофорез проводили на продуктах ПЦР с использованием 2% сборного агарозного геля E-Gel, содержащего бромистый этидий (Invitrogen, Carlsbad, CA), и продукты идентифицировали с помощью УФ-освещения.
1). Реакции ПЦР содержали 10 мкл экстрагированной ДНК, 1 × буфер II для ПЦР (Applied Biosystems, Фостер-Сити, Калифорния), 3 мМ MgCl 2 (Applied Biosystems, Фостер-Сити, Калифорния), 0.2 мМ dNTP (Applied Biosystems, Фостер-Сити, Калифорния), 0,2 мкМ каждого праймера и 1,25 ед. ДНК-полимеразы Ampli Taq Gold (Applied Biosystems, Фостер-Сити, Калифорния), а также воду, добавленную к конечному объему 50 мкл. Положительный контроль (геномная ДНК S. epidermidis ATCC 35984) и отрицательный контроль (реакционная смесь без ДНК) включали в каждый цикл ПЦР. Анализ ПЦР проводили на термоциклере PTC-200 Peltier (MJ Research Inc., Scandinavian Diagnostics Services, Фалькенберг, Швеция) при следующих условиях: начальная стадия денатурации при 95°C в течение 12 мин, затем 30 мин. циклы амплификации (95°С, 30 с; 58°С, 30 с; и 72°С, 60 с) и финальная стадия удлинения при 72°С в течение 7 мин.Электрофорез проводили на продуктах ПЦР с использованием 2% сборного агарозного геля E-Gel, содержащего бромистый этидий (Invitrogen, Carlsbad, CA), и продукты идентифицировали с помощью УФ-освещения.
Наконец, продукты ПЦР очищали с помощью набора JETquick PCR Purification Spin Kit (Genomed GmbH, Бад-Эйнхаузен, Германия) и секвенировали обе нити с использованием BigDye Terminator v3.1 Набор для циклического секвенирования (Applied Biosystems, Фостер-Сити, Калифорния) с праймерами аар-1, аар-2, аар-3 и аар-4.Продукты реакции анализировали с помощью анализатора ДНК Applied Biosystems 3730 (MMK, больница Каролинского университета, Стокгольм, Швеция). Полученные хроматограммы анализировали с помощью Applied Biosystem Sequence Scanner v1.0, а последовательности ДНК затем использовали для поиска в базе данных с использованием функции BLAST в базе данных NCBI (www.ncbi.nlm.nih.gov) для идентификации продуктов реакции.
Определение образования биопленки.
Образование биопленки определяли по способности клеток прикрепляться к лункам титрационного микропланшета. S. epidermidis (CI-1–13, ATCC 12228, ATCC 35984) выращивали в течение ночи в бульоне BHI, после чего 200 мкл культуры, разведенной в бульоне BHI до 0,05 ОП, добавляли в каждую лунку 96 планшет для микротитрования из полистирола с лунками (Corning Incorporated Life Sciences, Лоуэлл, Массачусетс). Был включен отрицательный контроль бульона BHI без бактерий, и каждый эксперимент был выполнен в пяти повторяющихся лунках. После инкубации при 37°С в течение 20 ч каждую лунку дважды промывали 200 мкл PBS, сушили и окрашивали 150 мкл 0.1% (об./об.) кристаллического фиолетового (Sigma-Aldrich Chemical Co.) в течение 10 мин. Избыток кристаллического фиолетового удаляли путем промывания планшетов проточной водопроводной водой, связанный кристаллический фиолетовый растворяли в 200 мкл этанол-ацетона (4:1, об./об.) и измеряли оптическую плотность при 590 нм.
S. epidermidis (CI-1–13, ATCC 12228, ATCC 35984) выращивали в течение ночи в бульоне BHI, после чего 200 мкл культуры, разведенной в бульоне BHI до 0,05 ОП, добавляли в каждую лунку 96 планшет для микротитрования из полистирола с лунками (Corning Incorporated Life Sciences, Лоуэлл, Массачусетс). Был включен отрицательный контроль бульона BHI без бактерий, и каждый эксперимент был выполнен в пяти повторяющихся лунках. После инкубации при 37°С в течение 20 ч каждую лунку дважды промывали 200 мкл PBS, сушили и окрашивали 150 мкл 0.1% (об./об.) кристаллического фиолетового (Sigma-Aldrich Chemical Co.) в течение 10 мин. Избыток кристаллического фиолетового удаляли путем промывания планшетов проточной водопроводной водой, связанный кристаллический фиолетовый растворяли в 200 мкл этанол-ацетона (4:1, об./об.) и измеряли оптическую плотность при 590 нм.
Иммунофлуоресценция LL37.
Биопсия криосрезов кожи, полученная из очага ЭТ, была зафиксирована в 2% забуференном формальдегиде, блокирована и пермеабилизирована нормальной козьей сывороткой в PBS с 1% BSA и 0,1% сапонином. Срезы инкубировали сначала с 1:100 кроличьим поликлональным античеловеческим LL37 (Innovagen, Лунд, Швеция), а затем с Cy3-меченым вторичным козьим антикроличьим IgG (Jackson ImmunoResearch Laboratories Inc., West Grow, PA). На заключительном этапе предметные стекла инкубировали с DAPI (Molecular Probes, Eugene, OR), промывали и фиксировали с помощью Shandon Immu-Mount (Thermo Electron Corporation, Питтсбург, Пенсильвания). Конфокальные изображения регистрировали с помощью конфокального микроскопа Zeiss 510 META с использованием объективов с числовой апертурой 10×/0,3 и 5×/0,16.Флуоресценцию Cy3 детектировали путем возбуждения при 543 нм с детектированием с длинным проходом при 560 нм. Флуоресценция ядер DAPI на некоторых изображениях использовалась в качестве эталона, обнаруженная при возбуждении на длине волны 405 нм с полосовым фильтром 420–480 нм (на рис. 1 не показан). Контроль аутофлуоресценции и неспецифического связывания осуществляли путем исключения первичного антитела.
Срезы инкубировали сначала с 1:100 кроличьим поликлональным античеловеческим LL37 (Innovagen, Лунд, Швеция), а затем с Cy3-меченым вторичным козьим антикроличьим IgG (Jackson ImmunoResearch Laboratories Inc., West Grow, PA). На заключительном этапе предметные стекла инкубировали с DAPI (Molecular Probes, Eugene, OR), промывали и фиксировали с помощью Shandon Immu-Mount (Thermo Electron Corporation, Питтсбург, Пенсильвания). Конфокальные изображения регистрировали с помощью конфокального микроскопа Zeiss 510 META с использованием объективов с числовой апертурой 10×/0,3 и 5×/0,16.Флуоресценцию Cy3 детектировали путем возбуждения при 543 нм с детектированием с длинным проходом при 560 нм. Флуоресценция ядер DAPI на некоторых изображениях использовалась в качестве эталона, обнаруженная при возбуждении на длине волны 405 нм с полосовым фильтром 420–480 нм (на рис. 1 не показан). Контроль аутофлуоресценции и неспецифического связывания осуществляли путем исключения первичного антитела.
Комбинированные широкопольные конфокальные и ДИК-микрофотографии среза токсической эритемы. Сильный иммуносигнал кателицидинового противомикробного пептида LL37 достигает уровня кожи.Обратите внимание на изображение с малым увеличением ( A ) слабую, но однородную экспрессию пептида во всем эпидермальном слое. При большем увеличении ( B ) можно идентифицировать многочисленные рассеянные клетки с разной степенью экспрессии пептидов в дерме. Для справки широкопольное изображение ДИК показано на ( C ), а комбинированное изображение ДИК и конфокальное изображение показано на ( D ). Граница между эпидермисом и дермой отмечена белой пунктирной линией. Используемая цветовая шкала представляет собой шкалу свечения в диапазоне от белого для самых сильных иммунных сигналов через желтый до темно-красного для самых слабых ( цветная полоса, вставка ).Пруток: А , 200 мкм; B–D , 100 мкм.
Сильный иммуносигнал кателицидинового противомикробного пептида LL37 достигает уровня кожи.Обратите внимание на изображение с малым увеличением ( A ) слабую, но однородную экспрессию пептида во всем эпидермальном слое. При большем увеличении ( B ) можно идентифицировать многочисленные рассеянные клетки с разной степенью экспрессии пептидов в дерме. Для справки широкопольное изображение ДИК показано на ( C ), а комбинированное изображение ДИК и конфокальное изображение показано на ( D ). Граница между эпидермисом и дермой отмечена белой пунктирной линией. Используемая цветовая шкала представляет собой шкалу свечения в диапазоне от белого для самых сильных иммунных сигналов через желтый до темно-красного для самых слабых ( цветная полоса, вставка ).Пруток: А , 200 мкм; B–D , 100 мкм.
Границы | Staphylococcus epidermidis сенсибилизирует перинатальное гипоксически-ишемическое повреждение головного мозга у самцов, но не у самок мышей
Введение
Крайняя степень недоношенности связана с повышенной смертностью и заболеваемостью (1). Несмотря на улучшение показателей выживаемости недоношенных детей с годами, преждевременные роды остаются серьезной проблемой для здоровья, особенно для детей, перенесших сепсис (2). Из-за инвазивных процедур и широкого использования медицинских устройств некоторые инфекции представляют особый риск для недоношенных детей (3, 4).Коагулазонегативные стафилококки Staphylococcus epidermidis образуют биопленки на медицинских устройствах и являются одной из наиболее частых внутрибольничных инфекций у недоношенных детей и стали преобладающими возбудителями сепсиса с поздним началом (5, 6).
Несмотря на улучшение показателей выживаемости недоношенных детей с годами, преждевременные роды остаются серьезной проблемой для здоровья, особенно для детей, перенесших сепсис (2). Из-за инвазивных процедур и широкого использования медицинских устройств некоторые инфекции представляют особый риск для недоношенных детей (3, 4).Коагулазонегативные стафилококки Staphylococcus epidermidis образуют биопленки на медицинских устройствах и являются одной из наиболее частых внутрибольничных инфекций у недоношенных детей и стали преобладающими возбудителями сепсиса с поздним началом (5, 6).
Клинические и экспериментальные данные связывают перинатальную инфекцию и воспаление с последующими неврологическими последствиями и последствиями для развития (7). Сепсис может вызывать нейровоспаление, приводящее к активации нейротоксических процессов (8). Существует повышенный риск нарушения развития нервной системы у младенцев, перенесших сепсис, и метаанализ показал, что сепсис коагулазонегативных стафилококков у младенцев с очень низкой массой тела при рождении связан с более высокой частотой церебрального паралича (9).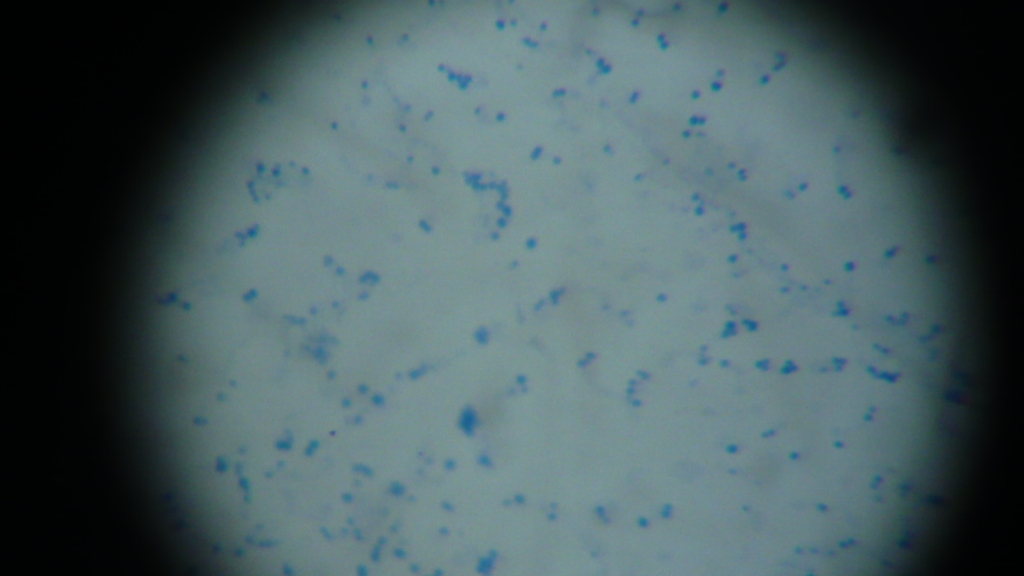 Кроме того, инфекция у недоношенных детей связана с большей частотой последующих кардиореспираторных событий, таких как апноэ и гипоксемия (10), и признано, что неонатальная энцефалопатия, вероятно, является многофакторной, когда как материнские, так и неонатальные инфекции могут усугублять гипоксически-ишемическую (ГИ) черепно-мозговая травма (11).
Кроме того, инфекция у недоношенных детей связана с большей частотой последующих кардиореспираторных событий, таких как апноэ и гипоксемия (10), и признано, что неонатальная энцефалопатия, вероятно, является многофакторной, когда как материнские, так и неонатальные инфекции могут усугублять гипоксически-ишемическую (ГИ) черепно-мозговая травма (11).
Мы и другие продемонстрировали, что синтетические соединения, такие как Pam 3 CSK 4 , агонист Toll-подобного рецептора (TLR) 2 , который имитирует аспекты воспаления, вызываемого грамположительными бактериями, повышают уязвимость мозга к последующая ГИ у новорожденных мышей (12, 13).Недавно мы расширили эти результаты, чтобы показать, что живая бактериальная инфекция S. epidermidis , индуцированная за 14 часов до HI, также повышает чувствительность головного мозга к усилению повреждения (14). Однако известно, что в экспериментальных исследованиях важен временной интервал между заражением и последующим HI (15). Таким образом, чтобы проверить гипотезу о том, что инфекция S. epidermidis повышает уязвимость к HI, главным образом во время продолжающейся инфекции, мы использовали нашу модель самоочищающейся системной инфекции S. epidermidis у новорожденных мышей для изучения влияния инфекции на HI. травмы со временем.
Таким образом, чтобы проверить гипотезу о том, что инфекция S. epidermidis повышает уязвимость к HI, главным образом во время продолжающейся инфекции, мы использовали нашу модель самоочищающейся системной инфекции S. epidermidis у новорожденных мышей для изучения влияния инфекции на HI. травмы со временем.
Система комплемента является важным компонентом врожденной защиты хозяина, усиливая уничтожение патогенов и уничтожение микробов. Система комплемента нарушена у недоношенных детей и связана с преждевременными родами и предрасположенностью к неонатальному сепсису (16). Белок компонента комплемента 5 (С5) при активации расщепляется на два белковых фрагмента: С5а и С5b. Передача сигналов C5a через рецепторы C5a играет важную роль в развитии сепсиса (17). C5 также был вовлечен в повреждение головного мозга (18, 19), а C5a повышен в ЦСЖ недоношенных детей (20).Поэтому мы также исследовали участие передачи сигналов C5 после инфекции S. epidermidis . Мы демонстрируем, что временной интервал между заражением S. epidermidis и HI имеет решающее значение для повышения чувствительности мозга к повреждению HI и что эффекты зависят от пола, поскольку они были очевидны только у самцов мышей.
epidermidis и HI имеет решающее значение для повышения чувствительности мозга к повреждению HI и что эффекты зависят от пола, поскольку они были очевидны только у самцов мышей.
Материалы и методы
Животные
мыши дикого типа C57Bl/6J были приобретены в лабораториях Janvier Labs (Le Genest-Saint-Isle, Франция) и Charles River Laboratories (Sulzfeld, Германия) и были выращены в виварии Гетеборгского университета (экспериментальная биомедицина, Университет Гетеборг).Мышей содержали с нормальным 12-часовым циклом свет/темнота (свет включался в 06:00) и доступом к стандартной лабораторной диете (B&K, Solna, Швеция) и питьевой воде в контролируемой температуре окружающей среде (20–20°C). 22°С). Все эксперименты на животных были одобрены Комитетом по этике животных Гётеборга (№ 663/2017). Использовали мышей обоих полов. Пол устанавливали при визуальном осмотре. В каждой экспериментальной группе мышей получали не менее чем из трех разных пометов.
Дизайн исследования
Ранее мы показали, что инфекция S. epidermidis может повышать уязвимость развивающегося мозга к HI (14).Чтобы оценить потенцирование повреждения головного мозга после инфекции S. epidermidis с течением времени, мышей подвергали комбинации инфекции S. epidermidis и HI. Для воздействия неонатальной инфекции мышам внутрибрюшинно вводили стерильный физиологический раствор или 3,5 × 10 7 колониеобразующих единиц (КОЕ) S. epidermidis на постнатальный день (PND) 4, как описано ранее (14). HI индуцировали через 24 часа (PND5) или 5 дней (PND9) после инъекции S. epidermidis .Время HI было основано на нашем предыдущем исследовании, которое показало, что инфекция продолжалась через 24 часа, но в основном исчезала через 5 дней (14). Животных умерщвляли на PND14-PND16 для нейропатологического исследования (рис. 1А).
epidermidis может повышать уязвимость развивающегося мозга к HI (14).Чтобы оценить потенцирование повреждения головного мозга после инфекции S. epidermidis с течением времени, мышей подвергали комбинации инфекции S. epidermidis и HI. Для воздействия неонатальной инфекции мышам внутрибрюшинно вводили стерильный физиологический раствор или 3,5 × 10 7 колониеобразующих единиц (КОЕ) S. epidermidis на постнатальный день (PND) 4, как описано ранее (14). HI индуцировали через 24 часа (PND5) или 5 дней (PND9) после инъекции S. epidermidis .Время HI было основано на нашем предыдущем исследовании, которое показало, что инфекция продолжалась через 24 часа, но в основном исчезала через 5 дней (14). Животных умерщвляли на PND14-PND16 для нейропатологического исследования (рис. 1А).
Рисунок 1 . Схематический обзор дизайна экспериментального исследования . (A) мышам C57Bl/6J вводили внутрибрюшинно в PND4 3,5 × 10 7 КОЕ S.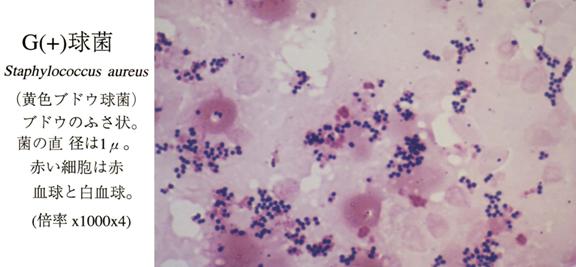 epidermidis или физиологический раствор с последующей процедурой гипоксии-ишемии (HI) через 24 часа (PND5) или 5 дней (PND9) после инъекции.Мозг собирали на PND14 или 16 для оценки невропатологии. (B) Вторую группу животных умерщвляли перед HI для оценки воспалительной реакции и активации комплемента и передачи сигналов в крови, печени и головном мозге.
epidermidis или физиологический раствор с последующей процедурой гипоксии-ишемии (HI) через 24 часа (PND5) или 5 дней (PND9) после инъекции.Мозг собирали на PND14 или 16 для оценки невропатологии. (B) Вторую группу животных умерщвляли перед HI для оценки воспалительной реакции и активации комплемента и передачи сигналов в крови, печени и головном мозге.
Чтобы понять молекулярные механизмы, лежащие в основе сенсибилизации головного мозга во время HI, другой группе животных вводили внутрибрюшинно в PND4 3,5 × 10 7 КОЕ S. epidermidis или физиологический раствор (без HI).Через 24 часа или 5 дней после инъекции S. epidermidis /солевого раствора образцы крови, печени и головного мозга были собраны для биохимического анализа (рис. 1В).
Процедура гипоксии-ишемии
детеныша PND5 и PND9 подверглись неонатальному HI, как описано ранее (21, 22). Щенков анестезировали изофлураном (IsoFlo vet 100%; Abbott Laboratories Ltd, Иллинойс, США), 5% для индукции и 1,5% для поддерживающей терапии в газовой смеси кислород-азот 1:1. Левую общую сонную артерию перевязали 7.0 шелковым швом (Ethicon; Vömel, Германия), разрез закрыли и инфильтрировали местным анестетиком (ксилокаин 20 мг/мл, гидрохлорид лидокаина; Astra Zeneca, Södertälje, Швеция). После операции мышей возвращали к их самкам на 1 ч, а затем помещали в камеру с циркулирующим влажным воздухом (36 °С). В камере мыши PND5 подвергались 10-минутному воздействию воздуха, затем 60-минутной гипоксии (10% O 2 в 90% N 2 ), а затем еще 10 минут воздуха. Мышей PND9 лечили таким же образом, за исключением того, что время гипоксии составляло 50 мин.Эта процедура приводит к аналогичной степени повреждения головного мозга у мышей PND5 и PND9, как показано ранее (21, 23) и на дополнительном рисунке 1. После гипоксического воздействия детенышей возвращали к их самкам до умерщвления.
Левую общую сонную артерию перевязали 7.0 шелковым швом (Ethicon; Vömel, Германия), разрез закрыли и инфильтрировали местным анестетиком (ксилокаин 20 мг/мл, гидрохлорид лидокаина; Astra Zeneca, Södertälje, Швеция). После операции мышей возвращали к их самкам на 1 ч, а затем помещали в камеру с циркулирующим влажным воздухом (36 °С). В камере мыши PND5 подвергались 10-минутному воздействию воздуха, затем 60-минутной гипоксии (10% O 2 в 90% N 2 ), а затем еще 10 минут воздуха. Мышей PND9 лечили таким же образом, за исключением того, что время гипоксии составляло 50 мин.Эта процедура приводит к аналогичной степени повреждения головного мозга у мышей PND5 и PND9, как показано ранее (21, 23) и на дополнительном рисунке 1. После гипоксического воздействия детенышей возвращали к их самкам до умерщвления.
Подготовка тканей и иммуногистохимия
Мышей PND14 (т.е. через 9 дней после HI в PND5) или PND16 (т.е. через 7 дней после HI в PND9) глубоко анестезировали путем внутрибрюшинного введения пентобарбитала (Pentacour) и интракардиально перфузировали 0,9% физиологическим раствором, а затем 6% забуференным формальдегидом ( Гистофикс; Гистолаб). Мозг собирали и хранили в том же растворе фиксатора при 4°С до обезвоживания и заливки в парафин. Для иммуногистохимического анализа мозг делался на срезы толщиной 7 мкм на микротоме, и на основе принципа систематической выборки каждый 50-й срез использовался для иммуногистохимического окрашивания. Срезы головного мозга нагревали при 65°С в течение 30 мин с последующей депарафинизацией в ксилоле и спирте определенной степени. Выделение антигена проводили путем кипячения срезов тканей в 0,01 М буфере лимонной кислоты (pH 6.0). Затем срезы мозга промывали в PBS, блокировали активность эндогенной пероксидазы 3% H 2 O 2 в PBS с последующим блокированием неспецифического связывания 4% козьей сывороткой в PBS. Срезы инкубировали при 4°C в течение ночи с первичными антителами против ассоциированного с микротрубочками белка-2 (MAP-2; клон HM-2, 1:1000; каталог Sigma-Aldrich № M4403) или основного белка миелина (MBP; клон SMI-94). , 1:1000; каталог BioLegend № 836504), затем инкубация в течение 1 ч с биотинилированными вторичными антителами лошади против мыши (1:250; каталог Vector Laboratories № BA-2001) и набором VECTASTAIN Elite ABC HRP (Vector Laboratories) согласно инструкциям производителя.
Мозг собирали и хранили в том же растворе фиксатора при 4°С до обезвоживания и заливки в парафин. Для иммуногистохимического анализа мозг делался на срезы толщиной 7 мкм на микротоме, и на основе принципа систематической выборки каждый 50-й срез использовался для иммуногистохимического окрашивания. Срезы головного мозга нагревали при 65°С в течение 30 мин с последующей депарафинизацией в ксилоле и спирте определенной степени. Выделение антигена проводили путем кипячения срезов тканей в 0,01 М буфере лимонной кислоты (pH 6.0). Затем срезы мозга промывали в PBS, блокировали активность эндогенной пероксидазы 3% H 2 O 2 в PBS с последующим блокированием неспецифического связывания 4% козьей сывороткой в PBS. Срезы инкубировали при 4°C в течение ночи с первичными антителами против ассоциированного с микротрубочками белка-2 (MAP-2; клон HM-2, 1:1000; каталог Sigma-Aldrich № M4403) или основного белка миелина (MBP; клон SMI-94). , 1:1000; каталог BioLegend № 836504), затем инкубация в течение 1 ч с биотинилированными вторичными антителами лошади против мыши (1:250; каталог Vector Laboratories № BA-2001) и набором VECTASTAIN Elite ABC HRP (Vector Laboratories) согласно инструкциям производителя. Срезы визуализировали раствором 0,5 мг/мл 3,3-диаминобензидина, усиленным 15 мг/мл сульфата аммония и никеля, 2 мг/мл β-D-глюкозы, 0,4 мг/мл хлорида аммония и 0,01 мг/мл β- глюкозооксидаза (все от Sigma-Aldrich). На последнем этапе окрашенные срезы обезвоживали в спирте (70, 95, 99%), очищали в ксилоле и закрывали покровным стеклом.
Срезы визуализировали раствором 0,5 мг/мл 3,3-диаминобензидина, усиленным 15 мг/мл сульфата аммония и никеля, 2 мг/мл β-D-глюкозы, 0,4 мг/мл хлорида аммония и 0,01 мг/мл β- глюкозооксидаза (все от Sigma-Aldrich). На последнем этапе окрашенные срезы обезвоживали в спирте (70, 95, 99%), очищали в ксилоле и закрывали покровным стеклом.
Анализ травм головного мозга
Количественно определяли повреждение серого вещества на срезах, окрашенных на MAP-2, который маркирует нейроны и дендриты, а количество белого вещества определяли на срезах, окрашенных на MBP, который маркирует миелин.Изображения были сняты на световом микроскопе (Olympus BX60) с использованием 4-кратного объектива. Области интереса (ROI) с MAP-2 или MBP-положительной иммунореактивностью в полушариях, ипсилатеральных и контралатеральных по отношению к перевязанной артерии, были очерчены и измерены с помощью программного обеспечения ImageJ (v1.52a, NIH, USA). Анализ серого вещества проводился в областях мозга, начиная от переднего полосатого тела до середины структуры гиппокампа (5 уровней, включая кору, 3 уровня, включая дорсальный гиппокамп и таламус, и 3 уровня, включая полосатое тело).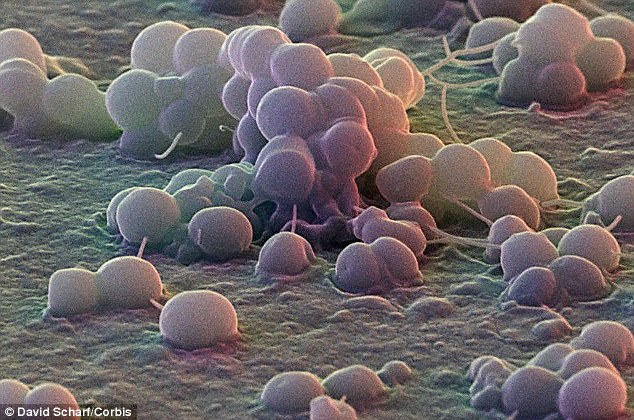 Сумма MAP-2-положительных областей в коре, гиппокампе, таламусе и стриатуме рассматривалась как измерение всего полушария головного мозга.
Сумма MAP-2-положительных областей в коре, гиппокампе, таламусе и стриатуме рассматривалась как измерение всего полушария головного мозга.
Миелинизированные области определяли как интегральную плотность MBP-положительного окрашивания (т. е. произведение площади и среднего значения серого в области интереса). Окрашивание MBP измеряли на 2 уровнях в подкорковом белом веществе, на 2 уровнях в фимбриях гиппокампа и на 3 уровнях в стриатуме. Процент потери MAP-2 и MBP-положительной ткани рассчитывали на каждом уровне следующим образом: [(контралатеральная сторона – ипсилатеральная сторона)/контралатеральная сторона × 100%].Среднее процентное значение потери ткани для всех уровней сравнивали между животными.
Сбор проб для биохимического анализа
Через 24 часа (PND5) или 5 дней (PND9) после заражения или инъекции физиологического раствора ( n = 10/группа лечения/пол) мышей глубоко анестезировали путем внутрибрюшинного введения пентобарбитала (Pentacour). Приблизительно 20 мкл крови собирали путем пункции сердца и смешивали с 5 мкл 50 мМ ЭДТА. Затем мышам транскардиально перфузировали О.Собирали 9% физиологический раствор, головной мозг и печень и мгновенно замораживали в сухом льду.
Затем мышам транскардиально перфузировали О.Собирали 9% физиологический раствор, головной мозг и печень и мгновенно замораживали в сухом льду.
Для анализа белков головной мозг и печень гомогенизировали в 1000 мкл PBS, не содержащего РНКазы, содержащего 0,5% коктейль ингибиторов протеаз (№ по каталогу Sigma P8340), 5 мМ ЭДТА и 1% Triton X-100 с помощью ультразвука (амплитуда 40%, 10 импульсов). , 1,2 с каждый). Затем лизаты центрифугировали (10 000 x g, 10 мин, 4°C), а очищенные супернатанты хранили при -80°C. Концентрации белка измеряли с использованием набора для анализа белка Pierce BCA (Thermo Fisher Scientific) в соответствии с инструкциями производителя.
Анализ цитокинов и хемокинов
Набор Bio-Plex Pro Mouse Cytokine Standard 23-Plex (Bio-Rad, № по каталогу M600009RDPD), проанализированный на системе Bio-Plex 200 (Bio-Rad), использовали для определения цитокинового профиля плазмы мышей PND5 и PND9 в соответствии с к инструкциям производителя. Образцы плазмы перед анализом разводили 1/5 в разбавителе для образцов Bio-plex.
Измерение мозга CCL2
Концентрацию белка CCL2 в лизатах головного мозга анализировали с помощью набора для твердофазного иммуноферментного анализа (ELISA) и стандарта (набор CCL2/JE/MCP-1 DuoSet ELISA, R&D Systems, № по каталогу DY479-05) в соответствии с инструкциями производителя.
Измерение плазмы, головного мозга и печени C5a
КонцентрацииC5a измеряли с использованием набора C5a DuoSet ELISA для мышей (R&D Systems, номер по каталогу DY2150) в соответствии с инструкциями производителя. Плазму мышей PND5 и PND9 разводили 1/200, тогда как лизаты мозга разводили 1/50 в разбавителе реагента. Лизаты печени из образцов PND5 и PND9 разводили 1/50 и 1/200 соответственно.
Измерение экспрессии мРНК C5, C5aR1 и C5aR2 в головном мозге и печени
Тотальную РНК получали из лизатов головного мозга и печени в свободном от РНКазы PBS с использованием RNeasy Mini Kit (Qiagen) в соответствии с инструкциями производителя и измеряли с помощью NanoDrop 2000 (Thermo Fisher Scientific). РНК подвергали обратной транскрипции в кДНК с использованием набора для обратной транскрипции QuantiTect (Qiagen). Все образцы кДНК разбавляли водой без нуклеаз до конечного объема 50 мкл. Количественную RT-qPCR в реальном времени проводили с помощью амплификатора Touch в реальном времени (Bio-Rad, Hercules, CA, USA). Каждая 20 мкл реакционная смесь содержала 10 мкл мастер-микса Fast SYBR (Qiagen), 2 мкл 10-кратного набора праймеров (Qiagen) для C5 — QT00102032; C5a-рецептор 1 (C5aR1) — QT00288232 и C5a-рецептор 2 (C5aR2) — QT02532803, 6 мкл H 2 O и 2 мкл кДНК.Температурный профиль ПЦР составлял 95°С в течение 2 мин с последующими 40 циклами амплификации (95°С в течение 10 с и 60°С в течение 30 с).
РНК подвергали обратной транскрипции в кДНК с использованием набора для обратной транскрипции QuantiTect (Qiagen). Все образцы кДНК разбавляли водой без нуклеаз до конечного объема 50 мкл. Количественную RT-qPCR в реальном времени проводили с помощью амплификатора Touch в реальном времени (Bio-Rad, Hercules, CA, USA). Каждая 20 мкл реакционная смесь содержала 10 мкл мастер-микса Fast SYBR (Qiagen), 2 мкл 10-кратного набора праймеров (Qiagen) для C5 — QT00102032; C5a-рецептор 1 (C5aR1) — QT00288232 и C5a-рецептор 2 (C5aR2) — QT02532803, 6 мкл H 2 O и 2 мкл кДНК.Температурный профиль ПЦР составлял 95°С в течение 2 мин с последующими 40 циклами амплификации (95°С в течение 10 с и 60°С в течение 30 с).
Значения для каждого гена нормализовали по концентрации кДНК в каждом образце ОТ, измеренной с использованием набора для анализа одноцепочечной ДНК QUANT-IT™ OLIGREN (Invitrogen) в соответствии с инструкциями производителя. Величину экспрессии целевого гена рассчитывали следующим образом: ([кДНК целевого гена /среднее общее количество кДНК во всех образцах]/общее количество кДНК целевого гена ).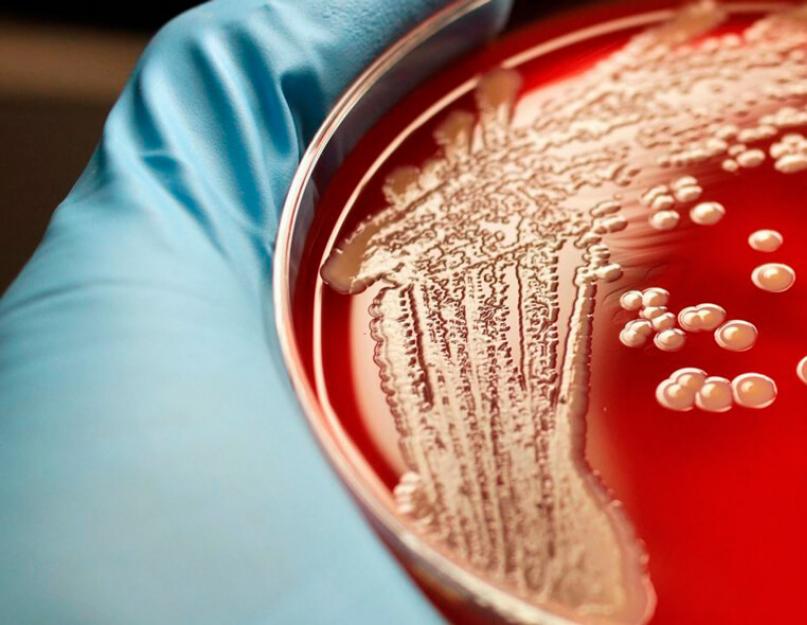
Статистический анализ
Статистический анализ выполнен с помощью GraphPad Prism v.8. Описательные данные представлены в виде диаграмм с медианой и усами на уровне 10–90-го процентиля. Нормальное распределение данных исследовали путем построения графика Q-Q, а в случаях ненормального распределения выполняли логарифмическое преобразование данных. Взаимодействие между независимыми переменными (бактериальная инфекция и пол) и основное влияние пола или бактериальной инфекции на повреждение головного мозга проверяли с помощью двухфакторного дисперсионного анализа (двухфакторный дисперсионный анализ). Апостериорный анализ между группами был выполнен с использованием теста множественных сравнений Сидака. P — значения <0,05 считались статистически значимыми.
Результаты
Staphylococcus epidermidis Сенсибилизирует гипоксически-ишемическое поражение головного мозга у мужчин, но не у женщин Чтобы оценить окно повышенной уязвимости к HI после бактериемии S.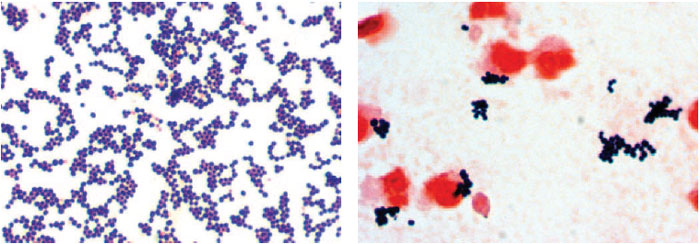 epidermidis , мы индуцировали HI либо через 24 часа после заражения, когда бактериемия была высокой, либо через 5 дней после заражения, когда количество бактерий в крови было значительно снижено (14). ).Мы оценили изменения в белом и сером веществе в PND14-PND16, что соответствует возрасту, когда миелинизация устанавливается и выявляется с помощью иммуногистохимического окрашивания у мышей (24). Поскольку инфекция и воспаление могут влиять на перинатальное повреждение головного мозга в зависимости от пола, в обзоре Ardalan et al. (25), невропатологический исход определяли у щенков мужского и женского пола отдельно.
epidermidis , мы индуцировали HI либо через 24 часа после заражения, когда бактериемия была высокой, либо через 5 дней после заражения, когда количество бактерий в крови было значительно снижено (14). ).Мы оценили изменения в белом и сером веществе в PND14-PND16, что соответствует возрасту, когда миелинизация устанавливается и выявляется с помощью иммуногистохимического окрашивания у мышей (24). Поскольку инфекция и воспаление могут влиять на перинатальное повреждение головного мозга в зависимости от пола, в обзоре Ardalan et al. (25), невропатологический исход определяли у щенков мужского и женского пола отдельно.
S. epidermidis бактериемия, инициированная за 24 часа до HI, потенцирующая повреждение головного мозга у самцов, но не у самок мышей (рис. 2).Двухсторонний ANOVA регионарного анализа серого вещества выявил значительную взаимосвязь между полом и бактериальной инфекцией в коре [ F (1, 48) = 4,28, p = 0,04]. Значимые основные эффекты бактериальной инфекции наблюдались в стриатуме и тотальных полушариях [ F (1, 48) = 8,08, p = 0,006; F (1, 48) = 4,68, p = 0,03], при этом значимые основные эффекты пола наблюдались в коре, таламусе, стриатуме и тотальных полушариях соответственно [ F (1, 48) = 12. 13, р = 0,001; Ф (1, 48) = 8,03, р = 0,006; Ф (1, 48) = 6,47, р = 0,01; F (1, 48) = 7,81, р = 0,006]. Потеря ткани во всем полушарии головного мозга была выше у самцов мышей, инфицированных S. epidermidis , по сравнению с самцами, обработанными физиологическим раствором ( p = 0,01), но не у самок мышей. В частности, региональный анализ серого вещества показал, что мышей-самцов, инфицированных S. epidermidis , имели повышенную потерю ткани в коре головного мозга ( p = 0.02) и в стриатуме ( p = 0,01) по сравнению с самцами мышей, которым вводили физиологический раствор. При анализе всего полушария ( p = 0,0008), коры головного мозга ( p = 0,0008), таламуса ( p = 0,005) и полосатого тела ( p = 0,005) у инфицированных мышей-самцов по сравнению с самками мышей было обнаружено достоверное увеличение повреждения. 0,01). S.
13, р = 0,001; Ф (1, 48) = 8,03, р = 0,006; Ф (1, 48) = 6,47, р = 0,01; F (1, 48) = 7,81, р = 0,006]. Потеря ткани во всем полушарии головного мозга была выше у самцов мышей, инфицированных S. epidermidis , по сравнению с самцами, обработанными физиологическим раствором ( p = 0,01), но не у самок мышей. В частности, региональный анализ серого вещества показал, что мышей-самцов, инфицированных S. epidermidis , имели повышенную потерю ткани в коре головного мозга ( p = 0.02) и в стриатуме ( p = 0,01) по сравнению с самцами мышей, которым вводили физиологический раствор. При анализе всего полушария ( p = 0,0008), коры головного мозга ( p = 0,0008), таламуса ( p = 0,005) и полосатого тела ( p = 0,005) у инфицированных мышей-самцов по сравнению с самками мышей было обнаружено достоверное увеличение повреждения. 0,01). S. epidermidis не увеличивал потерю ткани серого вещества у самок мышей по сравнению с контрольной группой, которой вводили физиологический раствор, ни в одной исследованной области.
epidermidis не увеличивал потерю ткани серого вещества у самок мышей по сравнению с контрольной группой, которой вводили физиологический раствор, ни в одной исследованной области.
Рисунок 2 . S. epidermidis за 24 часа до гипоксии-ишемии потенцирует повреждение серого вещества у новорожденных самцов мышей. Мышам PND4 вводили физиологический раствор или S. epidermidis и через 24 ч подвергали гипоксии-ишемии. (A) Повреждение серого вещества головного мозга оценивали с помощью иммуногистохимии белка 2, ассоциированного с микротрубочками (MAP-2), в PND14 во всем полушарии головного мозга, коре головного мозга, гиппокампе, таламусе и стриатуме ( n = 12 самцов, находящихся в физиологическом растворе; n = 11 с.epidermidis самцов; n = 17 солевых самок и n = 13 S. epidermidis самок). (B) Репрезентативные изображения (4 × объектив) срезов головного мозга самцов мышей PND14, окрашенных MAP-2 на уровне гиппокампа и полосатого тела после инъекции физиологического раствора или S. epidermidis при PND4 в сочетании с гипоксией-ишемией через 24 часа . Изображения области CA3 гиппокампа и полосатого тела, полученные на световом микроскопе с 20-кратным объективом.Данные представлены в виде медианы и 10–90 -го -го процентиля. Статистическое сравнение между группами S. epidermidis и физиологическим раствором для каждой области мозга выполняли с использованием двухфакторного дисперсионного анализа с множественным сравнением Сидака апостериорного теста ; * р < 0,05, ** р < 0,01 и *** р < 0,001.
epidermidis при PND4 в сочетании с гипоксией-ишемией через 24 часа . Изображения области CA3 гиппокампа и полосатого тела, полученные на световом микроскопе с 20-кратным объективом.Данные представлены в виде медианы и 10–90 -го -го процентиля. Статистическое сравнение между группами S. epidermidis и физиологическим раствором для каждой области мозга выполняли с использованием двухфакторного дисперсионного анализа с множественным сравнением Сидака апостериорного теста ; * р < 0,05, ** р < 0,01 и *** р < 0,001.
S. epidermidis бактериемия, инициированная за 24 часа до HI, потенцирующая повреждение белого вещества у самцов, но не у самок мышей (рис. 3).Выявлена значительная взаимосвязь между сексом и бактериальной инфекцией, а также основное влияние секса на повреждение белого вещества в подкорковой области [ F (1, 47) = 4,82, p = 0,01; F (1, 47) = 7,92, p = 0,007] и фимбрий гиппокампа [ F (1, 47) = 4,82, p = 0,003; F (1, 47) = 7,58, р = 0,008]. Кроме того, в фимбриях было обнаружено влияние бактериальной инфекции на потерю белого вещества [ F (1, 47) = 8.36, p = 0,005] и полосатое тело [ F (1, 47) = 8,48, p = 0,005]. Апостериорный анализ продемонстрировал повышенную потерю ткани белого вещества у самцов мышей, инфицированных S. epidermidis , по сравнению с контролем, получавшим физиологический раствор, в подкорковом белом веществе ( p = 0,01), фимбрии гиппокампа ( p = 0,003) и полосатое тело ( р = 0,004). В соответствии с результатами MAP-2, в подкорковом белом веществе было обнаружено значительное увеличение потери ткани ( p = 0.001), фимбрии гиппокампа ( p = 0,003) и полосатое тело ( p = 0,02) у инфицированных S. epidermidis мышей-самцов по сравнению с инфицированных S. epidermidis самок мышей. S. epidermidis не увеличивал потерю ткани белого вещества у самок мышей по сравнению с контрольной группой, которой вводили физиологический раствор, в любой исследованной области.
Кроме того, в фимбриях было обнаружено влияние бактериальной инфекции на потерю белого вещества [ F (1, 47) = 8.36, p = 0,005] и полосатое тело [ F (1, 47) = 8,48, p = 0,005]. Апостериорный анализ продемонстрировал повышенную потерю ткани белого вещества у самцов мышей, инфицированных S. epidermidis , по сравнению с контролем, получавшим физиологический раствор, в подкорковом белом веществе ( p = 0,01), фимбрии гиппокампа ( p = 0,003) и полосатое тело ( р = 0,004). В соответствии с результатами MAP-2, в подкорковом белом веществе было обнаружено значительное увеличение потери ткани ( p = 0.001), фимбрии гиппокампа ( p = 0,003) и полосатое тело ( p = 0,02) у инфицированных S. epidermidis мышей-самцов по сравнению с инфицированных S. epidermidis самок мышей. S. epidermidis не увеличивал потерю ткани белого вещества у самок мышей по сравнению с контрольной группой, которой вводили физиологический раствор, в любой исследованной области.
Рисунок 3 . S. epidermidis за 24 часа до гипоксии-ишемии потенцирует повреждение белого вещества у новорожденных самцов мышей.Мышам PND4 вводили физиологический раствор или S. epidermidis и через 24 ч подвергали гипоксии-ишемии. (A) Повреждение белого вещества головного мозга оценивали с помощью иммуногистохимии основного белка миелина (MBP) в PND14 в подкорковой области, фимбрии гиппокампа и стриатуме самцов (M) и самок (F) мышей ( n = 12 солевых самцов n = 11 S. epidermidis самцов, n = 16 солевых самок и n = 13 S. epidermidis самок). (B) Репрезентативные изображения (4 × объектив) срезов головного мозга самцов мышей PND14, окрашенных MBP на уровне гиппокампа и полосатого тела после инъекции физиологического раствора или S. epidermidis в PND4 в сочетании с гипоксией-ишемией через 24 часа. Изображения фимбрии и полосатого тела гиппокампа, полученные на световом микроскопе с 20-кратным объективом. Данные представлены в виде медианы и 10–90 -го -го процентиля. Статистическое сравнение между группами S. epidermidis и физиологическим раствором для каждой области мозга выполняли с использованием двухфакторного дисперсионного анализа с множественным сравнением Сидака апостериорного теста ; * р < 0.05 и ** р < 0,01.
Данные представлены в виде медианы и 10–90 -го -го процентиля. Статистическое сравнение между группами S. epidermidis и физиологическим раствором для каждой области мозга выполняли с использованием двухфакторного дисперсионного анализа с множественным сравнением Сидака апостериорного теста ; * р < 0.05 и ** р < 0,01.
Когда временной интервал между заражением S. epidermidis и HI был увеличен до 5 дней, не было выявлено значимого взаимодействия между полом и бактериальной инфекцией, а также не было значимого влияния пола и бактериальной инфекции на степень потери ткани серого или белого вещества. (Рисунок 4). Никаких существенных различий в исходном повреждении HI между самцами и самками мышей в любом возрасте после обработки физиологическим раствором и HI не наблюдалось (рис. 2–4). Точно так же не было различий в общем повреждении полушария между животными, подвергшимися воздействию физиологического раствора и HI в PND5 и PND9 (дополнительная фигура 1).
Рисунок 4 . S. epidermidis за 5 дней до гипоксии-ишемии не потенцирует неонатальное повреждение головного мозга. Мышам PND4 вводили физиологический раствор или S. epidermidis и через 5 дней подвергали гипоксии-ишемии. (A) Повреждение серого вещества головного мозга оценивали с помощью иммуногистохимии MAP-2 в PND16 во всем полушарии головного мозга, коре головного мозга, гиппокампе, таламусе и стриатуме самцов (M) и самок (F) мышей. (B) Повреждение белого вещества головного мозга оценивали с помощью иммуногистохимии MBP на PND16 в подкорковой области, фимбриях гиппокампа и стриатуме. n = 12 солевых самцов; n = 15 S. epidermidis самцов; n = 16 солевых самок и n = 14 S. epidermidis самок. Данные представлены в виде медианы и 10–90 -го -го процентиля. Статистическое сравнение проводилось между группами S. epidermidis и физиологическим раствором для каждой области мозга с использованием двухстороннего дисперсионного анализа с множественным сравнением Сидака апостериорного теста .
Для оценки воспалительных процессов, связанных с повышенной уязвимостью к поражению ГИ, мы обследовали животных через 24 ч и 5 дней после введения S.epidermidis или инъекция физиологического раствора перед HI. Сначала мы измерили концентрации воспалительных цитокинов в плазме, используя 23-плексную цитометрическую матрицу. Двухфакторный дисперсионный анализ концентраций цитокинов в плазме не выявил значимого взаимодействия между полом и бактериальной инфекцией через 24 часа или 5 дней после заражения (таблицы 1, 2), но было выявлено значительное основное влияние бактериальной инфекции на уровни цитокинов и хемокинов в плазме при 24 ч, включая IL-1b [ F (1, 36) = 48.45, p < 0,0001], ИЖ-2 [ F (1, 36) = 16,53, p = 0,0002], ИЖ-5 [ F (1, 36) = 20047 (1, 36) (1, 36) = 16,53 p < 0,0001], ИЖ-6 [ F (1, 36) = 19,32, p < 0,0001], ИЖ-10 [ F (1, p, 36) < 0,0001], IL-12(p40) [ F (1, 36) = 33,7, p < 0,0001], IL-13 [ F (1, 9009, ) 8 = 33,7 р < 0. 0001], ИЛ-17 [ F (1, 36) = 6,99, р = 0,012], Г-КСФ [ F (1, 36) = 41,20 < 1, 36 р 90] , GM-CSF [ F (1, 36) = 16,36, p = 0,0003], KC [ F (1, 36) = 34,86, p0 (CCLMC <1], -1) [ F (1, 36) = 45,44, p < 0,0001], CCL3 (MIP1a) [ F (1, 36) = 34,57, < 90,00001], CCL4 (MIP1b) [ F (1, 36) =30,77, p < 0,0001] и CCL5 (RANTES) [ F (1, 36) = , p 10,51 = 0,002] (рис. 5А). Уровни IL-2, IL-17 и CCL5 через 24 ч после заражения регулировались в зависимости от пола. В частности, мы наблюдали активацию IL-2 ( p = 0,02) у самцов и CCL5 ( p = 0,01) у самок, в то время как IL-17 был понижен у самцов ( p = 0,02) (рис. 5А, Таблица 1).Через 5 дней после заражения уровни IL-6 и G-CSF повышались у самцов, тогда как уровни IL-5 и G-CSF снижались у инфицированных S. epidermidis самок по сравнению с контрольными животными (фиг.
0001], ИЛ-17 [ F (1, 36) = 6,99, р = 0,012], Г-КСФ [ F (1, 36) = 41,20 < 1, 36 р 90] , GM-CSF [ F (1, 36) = 16,36, p = 0,0003], KC [ F (1, 36) = 34,86, p0 (CCLMC <1], -1) [ F (1, 36) = 45,44, p < 0,0001], CCL3 (MIP1a) [ F (1, 36) = 34,57, < 90,00001], CCL4 (MIP1b) [ F (1, 36) =30,77, p < 0,0001] и CCL5 (RANTES) [ F (1, 36) = , p 10,51 = 0,002] (рис. 5А). Уровни IL-2, IL-17 и CCL5 через 24 ч после заражения регулировались в зависимости от пола. В частности, мы наблюдали активацию IL-2 ( p = 0,02) у самцов и CCL5 ( p = 0,01) у самок, в то время как IL-17 был понижен у самцов ( p = 0,02) (рис. 5А, Таблица 1).Через 5 дней после заражения уровни IL-6 и G-CSF повышались у самцов, тогда как уровни IL-5 и G-CSF снижались у инфицированных S. epidermidis самок по сравнению с контрольными животными (фиг. 5B, таблица 2).
5B, таблица 2).
Таблица 1 . Цитокины и хемокины через 24 часа после заражения S. epidermidis .
Таблица 2 . Цитокины и хемокины через 5 дней после заражения S. epidermidis .
Рисунок 5 . Инфекция S. epidermidis индуцирует плазменные провоспалительные цитокины и хемокины.Мышам PND4 вводили физиологический раствор или S. epidermidis , а плазму анализировали на цитокины и хемокины через (A) через 24 часа или (B) через 5 дней ( n = 10 мышей/пол/группа). Данные представлены в виде медианы и 10–90 -го -го процентиля. Статистическое сравнение между группами S. epidermidis и физиологическим раствором проводили с использованием двухфакторного дисперсионного анализа с множественным сравнением Сидака апостериорного теста ; * р < 0,05, ** р < 0.01 и *** р < 0,001. # указывает на данные, представленные до преобразования журнала.
Чтобы оценить, вызывает ли S. epidermidis воспалительную реакцию в незрелом мозге, с помощью ELISA оценивали концентрации CCL2 в гомогенатах мозга через 24 часа и 5 дней после заражения (рис. 6). Уровни CCL2 в головном мозге колебались от 6,2 до 255 мкг/мл через 24 часа (рис. 6А), но от 1,5 до 17,1 мкг/мл через 5 дней (рис. 6В) после заражения. Анализ концентрации CCL2 в головном мозге не выявил значительного взаимодействия между полом и бактериальной инфекцией через 24 часа или 5 дней после заражения, но было выявлено значительное влияние бактериальной инфекции на уровни CCL2 в головном мозге через 24 часа [ F (1, 17) = 36.84, p < 0,0001] и 5 d [ F (1, 19) = 7,20, p = 0,01]. По сравнению с их соответствующими солевыми когортами, концентрации CCL2 в головном мозге инфицированных мышей через 24 часа были значительно выше как у самцов, так и у самок (в 18,2 раза у самцов, p = 0,007; в 16,4 раза у самок, p = 0,001) ( Рисунок 6А). Через 5 дней после заражения у инфицированных самцов все еще наблюдалось увеличение CCL2 (в 2,1 раза, p = 0,006), хотя и меньшее, чем через 24 часа (рис. 6В).
Через 5 дней после заражения у инфицированных самцов все еще наблюдалось увеличение CCL2 (в 2,1 раза, p = 0,006), хотя и меньшее, чем через 24 часа (рис. 6В).
Рисунок 6 . Уровни CCL2 повышаются в головном мозге после инфекции S. epidermidis . Мышам PND4 вводили физиологический раствор или S. epidermidis и анализировали через (A) через 24 часа ( n = 5 самцов с физиологическим раствором; n = 4 самцов S. epidermidis ; n 40010 = самок с физиологическим раствором). , и n = 8 S. epidermidis самок) или (B) 5 дней ( n = 7 солевых самцов; n = 6 S.epidermidis самок; n = 3 солевых самки и n = 7 S. epidermidis самок) после заражения. Концентрации CCL2 в головном мозге представлены как медиана и 10–90 -й -й процентиль. Статистическое сравнение между группами S. epidermidis и физиологическим раствором было выполнено с использованием двухстороннего дисперсионного анализа с последующим тестом множественного сравнения Сидака post-hoc ; ** р < 0,01 и *** р < 0,001.
Чтобы изучить влияние инфекции S. epidermidis на активацию белка комплемента, мы измерили уровни C5a в плазме, головном мозге и печени с помощью ELISA. Двусторонний ANOVA не выявил значимого взаимодействия между полом и бактериальной инфекцией через 24 часа и 5 дней после заражения; но наблюдалось значительное основное влияние бактериальной инфекции на уровни C5a в плазме в обе временные точки [ F (1, 36) = 16.53, р = 0,0002; F (1, 36) = 21,71, p < 0,0001 соответственно, рис. 7А,Б]. В частности, уровни C5a в плазме были значительно снижены через 24 часа после инъекции S. epidermidis у самцов по сравнению с контрольной группой, обработанной физиологическим раствором ( p = 0,001). Это различие не наблюдалось у самок ( p = 0,09, рис. 7А). Напротив, через 5 дней после инъекции S. epidermidis наблюдалось повышение уровня C5a в плазме у представителей обоих полов ( p = 0.002 у мужчин и p = 0,007 у женщин, рис. 7Б). Не было обнаружено различий в уровнях C5a в головном мозге (рис. 7C, D) или в печени (рис. 7E, F) ни в зависимости от пола, ни в момент времени.
epidermidis наблюдалось повышение уровня C5a в плазме у представителей обоих полов ( p = 0.002 у мужчин и p = 0,007 у женщин, рис. 7Б). Не было обнаружено различий в уровнях C5a в головном мозге (рис. 7C, D) или в печени (рис. 7E, F) ни в зависимости от пола, ни в момент времени.
Рисунок 7 . Концентрация C5a в плазме снижается через 24 часа после инфицирования S. epidermidis . Мышам PND4 вводили физиологический раствор или S. epidermidis и анализировали уровни C5a в плазме, головном мозге и печени через (A, C, E) через 24 ч или (B, D, F) через 5 дней после введения. инфекция ( n = 10 мышей/пол/группа).Данные представлены в виде медианы и 10–90 -го -го процентиля. Статистическое сравнение между группами S. epidermidis и физиологическим раствором проводилось с использованием двухфакторного дисперсионного анализа с последующим апостериорным тестом множественного сравнения Сидака ; ** р < 0,01.
Чтобы оценить передачу сигналов C5 после заражения S. epidermidis , мы измерили экспрессию мРНК C5, C5aR1 и C5aR2 в головном мозге и печени.Анализ экспрессии C5, C5aR1 и C5aR2 в головном мозге и печени через 24 ч и 5 дней после инфицирования не выявил значимого взаимодействия между полом и бактериальной инфекцией, но было выявлено значительное влияние бактериальной инфекции на экспрессию C5aR1 и C5aR2 в мозге. печень 5 дней после инфекции [ F (1, 36) = 49,11, p < 0,0001; F (1, 36) = 5,25, p = 0,02 соответственно] и влияние пола на экспрессию C5aR1 в печени 5 d после инфицирования [ F (1, 36) = 5 .55, p = 0,02] (рис. 8). Через 5 дней после инфицирования уровень C5aR2 значительно повышался только в печени инфицированных самцов по сравнению с группой, получавшей физиологический раствор ( p = 0,02), в то время как экспрессия C5aR1 в печени постоянно повышалась у представителей обоих полов ( p < 0,0001 у животных). у самцов и p = 0,002 у самок; рис. 8Б). Экспрессия C5aR2 повышалась в мозге инфицированных самок ( p = 0,04), но не у самцов мышей через 24 часа после S.epidermidis (рис. 8А).
у самцов и p = 0,002 у самок; рис. 8Б). Экспрессия C5aR2 повышалась в мозге инфицированных самок ( p = 0,04), но не у самцов мышей через 24 часа после S.epidermidis (рис. 8А).
Рисунок 8 . Компонент комплемента C5 и экспрессия рецептора после инфекции S. epidermidis . Мышам PND4 вводили физиологический раствор или S. epidermidis , и мРНК, участвующую в передаче сигналов C5 (C5, C5aR1, C5aR2), анализировали с помощью ПЦР в (A) через 24 часа или (B) через 5 дней в головном мозге и печени. ( n = 10 мышей/пол/группа). Данные представлены в виде медианы и 10–90 -го -го процентиля.Статистическое сравнение между группами S. epidermidis и физиологическим раствором было выполнено с использованием двухстороннего дисперсионного анализа с последующим тестом множественного сравнения Сидака post-hoc ; * р < 0,05, ** р < 0,01 и *** р < 0,001.
Обсуждение
Чтобы изучить влияние перинатальной инфекции на церебральную уязвимость, мы исследовали влияние S. epidermidis , наиболее распространенной нозокомиальной инфекции у недоношенных детей, на поражение HI у новорожденных мышей.Здесь мы впервые показываем, что уязвимость к поражению головного мозга HI после инфекции S. epidermidis зависит как от времени, так и от пола, с повышенной чувствительностью у мужчин.
Ранее мы сообщали, что заражение S. epidermidis за 14 ч до HI у новорожденных (PND4) мышей повышает чувствительность головного мозга к церебральному повреждению (14) и что внутривенная инъекция S. epidermidis при PND0 нарушает развитие мозга (26). . Известно, что S. epidermidis активирует TLR2 (27), но S.epidermidis , индукция неонатального повреждения головного мозга является как TLR2-зависимой, так и независимой (26). Кроме того, известно, что врожденный иммунный ответ на S. epidermidis у недоношенных детей зависит от возраста (28). Мы и другие продемонстрировали, что введение специфических агонистов TLR2 до HI увеличивает уязвимость к повреждению головного мозга (12, 13). Предыдущие исследования также показали, что уязвимость к ГИ после вызванного ЛПС воспаления зависит от временного интервала между ЛПС и ГИ (15).Это говорит о том, что время заражения имеет важное значение. Подтверждая это, мы обнаружили в настоящем исследовании, что временной интервал между заражением S. epidermidis и индукцией HI определяет невропатологический исход, по крайней мере, у самцов мышей.
Мы и другие продемонстрировали, что введение специфических агонистов TLR2 до HI увеличивает уязвимость к повреждению головного мозга (12, 13). Предыдущие исследования также показали, что уязвимость к ГИ после вызванного ЛПС воспаления зависит от временного интервала между ЛПС и ГИ (15).Это говорит о том, что время заражения имеет важное значение. Подтверждая это, мы обнаружили в настоящем исследовании, что временной интервал между заражением S. epidermidis и индукцией HI определяет невропатологический исход, по крайней мере, у самцов мышей.
Развитие мозга представляет собой процесс полового диморфизма, включающий нейротрансмиссию и/или генетические и метаболические реакции (29, 30). Кроме того, перинатальные осложнения зависят от пола. Например, более высокая частота преждевременных родов наблюдается у мальчиков (31), а ГИ чаще поражает мальчиков, чем девочек (32).Повышенная распространенность среди мужчин также наблюдается при некоторых нарушениях развития нервной системы, таких как аутизм (33) и синдром дефицита внимания с гиперактивностью (34, 35). Важные данные указывают на то, что половой диморфизм воспалительной реакции является основным фактором полового предубеждения при нервно-психических расстройствах (25). Элегантный эксперимент Villa et al. недавно продемонстрировано, что микроглия самок и самцов различаются и что микроглия самок, трансплантированная в мозг самцов мышей, сохраняет свои половые особенности и обеспечивает нейропротекцию у самцов после инсульта у взрослых (36).Подтверждая предыдущие данные, демонстрирующие повышенную уязвимость мужчин к воспалению и травме головного мозга, наше настоящее исследование показывает, что S. epidermidis избирательно повышает чувствительность мужчин к травме головного мозга HI.
Важные данные указывают на то, что половой диморфизм воспалительной реакции является основным фактором полового предубеждения при нервно-психических расстройствах (25). Элегантный эксперимент Villa et al. недавно продемонстрировано, что микроглия самок и самцов различаются и что микроглия самок, трансплантированная в мозг самцов мышей, сохраняет свои половые особенности и обеспечивает нейропротекцию у самцов после инсульта у взрослых (36).Подтверждая предыдущие данные, демонстрирующие повышенную уязвимость мужчин к воспалению и травме головного мозга, наше настоящее исследование показывает, что S. epidermidis избирательно повышает чувствительность мужчин к травме головного мозга HI.
В настоящем исследовании повышенная уязвимость головного мозга у самцов наблюдалась только при индукции HI через 24 часа, но не через 5 дней после заражения. Чтобы исследовать роль воспаления в эти два момента времени, когда сенсибилизация была и не была выявлена, мы провели анализы цитокинов и хемокинов в крови и мозге самцов и самок мышей.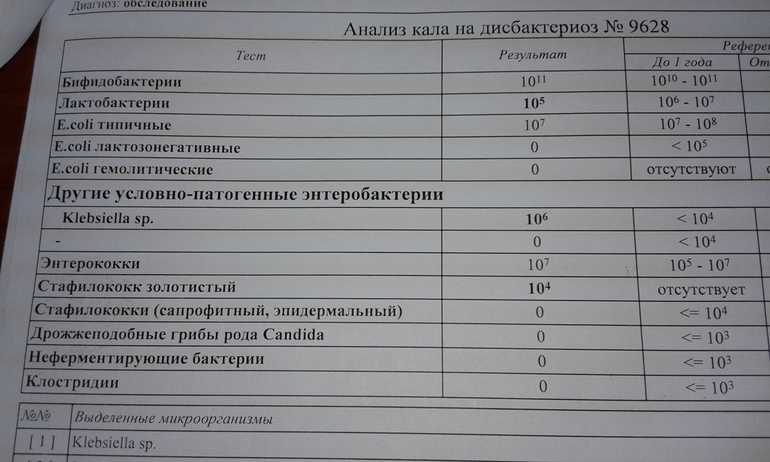 Хотя мы наблюдали значительную активацию нескольких про- и противовоспалительных цитокинов в крови через 24 часа после заражения S. epidermidis , только IL-2, CCL5 и IL-17 регулировались в зависимости от пола. Через 5 дней после заражения уровень большинства цитокинов снизился до исходного уровня, и только IL-6 и G-CSF оставались повышенными у самцов. В соответствии с нашими выводами, крысы PND10 обоего пола, зараженные смесью бактериальных или вирусных компонентов, показали повышенную регуляцию цитокинов и хемокинов крови (сыворотки) в PND12, возвращаясь к конститутивным уровням через 5 дней (37).
Хотя мы наблюдали значительную активацию нескольких про- и противовоспалительных цитокинов в крови через 24 часа после заражения S. epidermidis , только IL-2, CCL5 и IL-17 регулировались в зависимости от пола. Через 5 дней после заражения уровень большинства цитокинов снизился до исходного уровня, и только IL-6 и G-CSF оставались повышенными у самцов. В соответствии с нашими выводами, крысы PND10 обоего пола, зараженные смесью бактериальных или вирусных компонентов, показали повышенную регуляцию цитокинов и хемокинов крови (сыворотки) в PND12, возвращаясь к конститутивным уровням через 5 дней (37).
Появляется все больше данных, подтверждающих половой диморфизм в ответе цитокинов на определенные бактериальные инфекции, такие как перепроизводство IL-2 у мужчин (38). Однако, насколько нам известно, исследований, посвященных зависимым от пола различиям IL-2, CCL5 или IL-17 при неонатальном сепсисе, не проводилось. Клинические исследования противоречивы и демонстрируют либо снижение (39), либо повышение уровня CCL5 в крови при неонатальном сепсисе (40). IL-17 важен для иммунного надзора, а снижение уровня IL-17A у недоношенных новорожденных связано с повышенным риском бактериемии (41).С другой стороны, патологически повышенный уровень IL-17 может быть опасен для новорожденных, поскольку он также связан с воспалительными заболеваниями, такими как астма (42).
IL-17 важен для иммунного надзора, а снижение уровня IL-17A у недоношенных новорожденных связано с повышенным риском бактериемии (41).С другой стороны, патологически повышенный уровень IL-17 может быть опасен для новорожденных, поскольку он также связан с воспалительными заболеваниями, такими как астма (42).
ИЛ-6 и Г-КСФ имеют прогностическое значение при неонатальном сепсисе (43, 44), а уровень ИЛ-6 остается высоким у новорожденных с неблагоприятным исходом после гипоксически-ишемической энцефалопатии (45). В этом исследовании уровни IL-6 и G-CSF в плазме повышались у обоих полов через 24 часа, но оставались повышенными через 5 дней только у мужчин. Точно так же в головном мозге CCL2 активировался как у самцов, так и у самок через 24 часа, но только у самцов через 5 дней после заражения.Таким образом, эти цитокины и хемокины могут быть важными факторами, более выраженными у самцов. Интересно, что в соответствии с нашими предыдущими выводами не было четкого перевода концентрации CCL2 в крови на экспрессию в головном мозге (46).
Белки комплемента и их протеолитические фрагменты важны для фагоцитоза нейтрофилов и моноцитов (47), а дефицит белков в каскаде комплемента связан с повышенной восприимчивостью к перинатальным инфекциям, смертностью и низкой массой тела при рождении (48).Мы обнаружили двухфазный ответ C5a в плазме самцов мышей после заражения S. epidermidis со снижением уровней C5a через 24 часа и повышением уровней C5a через 5 дней после заражения. Аналогичная тенденция наблюдалась у самок через 24 часа, и мы не можем исключить, что у самок могло быть начальное значительное снижение уровней C5a в другие моменты времени по сравнению с теми, которые мы оценивали в настоящем исследовании. Двухфазный характер C5a подобен пациентам, госпитализированным с различными типами травм, приводящих к синдрому системной воспалительной реакции, когда нижестоящий комплекс атаки мембраны комплемента (MAC) снижается в 1-й день и увеличивается на 2-7 дни (49).Первоначальное снижение уровня C5a может быть связано с временным истощением комплемента в присутствии бактерий или воспаления.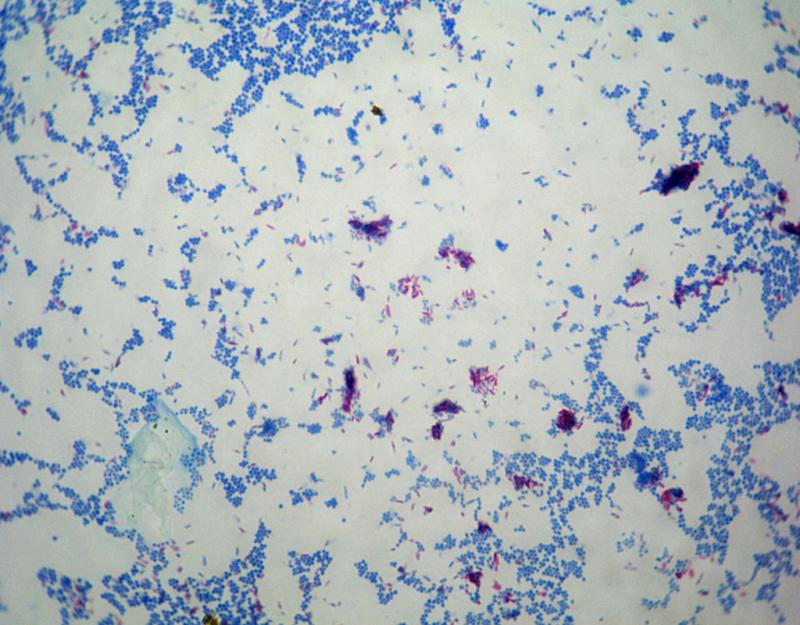 Кроме того, продукция внеклеточных протеаз из S. epidermidis может инактивировать ингибиторы сериновой и цистеиновой протеиназ плазмы человека и, таким образом, разрушать C5 (50, 51), что также может объяснить наблюдаемое нами раннее снижение C5a в плазме. В соответствии с этой гипотезой мы обнаружили изменение или даже повышение уровня C5a в плазме через 5 дней после заражения, когда бактериальная нагрузка в крови значительно снижается (14).
Кроме того, продукция внеклеточных протеаз из S. epidermidis может инактивировать ингибиторы сериновой и цистеиновой протеиназ плазмы человека и, таким образом, разрушать C5 (50, 51), что также может объяснить наблюдаемое нами раннее снижение C5a в плазме. В соответствии с этой гипотезой мы обнаружили изменение или даже повышение уровня C5a в плазме через 5 дней после заражения, когда бактериальная нагрузка в крови значительно снижается (14).
Снижение уровня C5a может привести к ухудшению исхода заболевания, поскольку у мышей с дефицитом C5 наблюдается нарушение бактериального клиренса (52), а исследование взрослых пациентов с дисфункцией головного мозга, вызванной сепсисом, выявило корреляцию между снижением уровня C5a и повышенной смертностью (53). Новорожденные крысы демонстрируют повышенную экспрессию рецепторов C5a и C5 в крови и мозге после HI, которая снижается при терапевтической гипотермии, что позволяет предположить, что C5a оказывает повреждающее действие на мозговую ткань (18, 19). Напротив, даже несмотря на то, что экспрессия рецептора С5 была увеличена в печени, мы не обнаружили каких-либо серьезных изменений в экспрессии мРНК рецепторов С5 или С5 в мозге инфицированных мышей до HI. Будущие исследования, изучающие передачу сигналов C5 после комбинации инфекции S. epidermidis и HI, могут выявить более убедительные доказательства роли комплемента C5 в повреждении головного мозга. Кроме того, поскольку рецепторы С5 в основном экспрессируются в микроглии, будущие исследования, изучающие клеточную экспрессию рецепторов С5 при воздействии S.epidermidis может предоставить дополнительные подтверждающие данные.
Напротив, даже несмотря на то, что экспрессия рецептора С5 была увеличена в печени, мы не обнаружили каких-либо серьезных изменений в экспрессии мРНК рецепторов С5 или С5 в мозге инфицированных мышей до HI. Будущие исследования, изучающие передачу сигналов C5 после комбинации инфекции S. epidermidis и HI, могут выявить более убедительные доказательства роли комплемента C5 в повреждении головного мозга. Кроме того, поскольку рецепторы С5 в основном экспрессируются в микроглии, будущие исследования, изучающие клеточную экспрессию рецепторов С5 при воздействии S.epidermidis может предоставить дополнительные подтверждающие данные.
В заключение, наши результаты демонстрируют, что неонатальная гипоксия-ишемия в сочетании с продолжающейся инфекцией S. epidermidis в сочетании с усиленным воспалением увеличивает уязвимость развивающегося мозга в зависимости от времени и пола. Повышенная экспрессия ряда цитокинов и хемокинов и сниженное содержание белка С5а в крови были связаны с повышенной уязвимостью самцов. Эти результаты согласуются с более высокой частотой перинатального повреждения головного мозга у новорожденных мальчиков (32).В целом, мы даем свежий взгляд на то, как системная инфекция S. epidermidis влияет на развивающийся мозг.
Эти результаты согласуются с более высокой частотой перинатального повреждения головного мозга у новорожденных мальчиков (32).В целом, мы даем свежий взгляд на то, как системная инфекция S. epidermidis влияет на развивающийся мозг.
Заявление о доступности данных
Все наборы данных, созданные для этого исследования, включены в статью/дополнительный материал.
Заявление об этике
Исследование на животных было рассмотрено и одобрено Комитетом по этике животных Гётеборга (№ 663/2017).
Вклад авторов
Это исследование было задумано и разработано, а рукопись составлена GG, JL и CM.Эксперименты проводили GG, PS, JL и MA. Анализ данных был выполнен GG, JL, MA и CE. Все авторы критически рассмотрели и отредактировали работу.
Финансирование
Это исследование было поддержано VINNOVA VINNMER Marie-Curie Incoming (2015-01505-JL), Wilhelm & Martina Lundgrens Foundation (2016-1323, 2017-1966, 2018-2465-JL) (2019-2902-MA), Lilla Barnets Fund (20170806—JL), Мемориальный фонд Анны-Брита и Бо Кастегренс (LA2017-0269—JL), Stiftelsen Mary von Sydows, född Wijk, donationsfond (2019-2419—GG), Шведский исследовательский совет (VR-2017-01409— CM), Фонд Åhlen (CM), Служба общественного здравоохранения университетской больницы Сальгренска (ALFGBG-722491—CM) и Шведский фонд мозга (FO2017-0063, FO2019-0270—CM).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fimmu.2020.00516/full#supplementary-material
.Каталожные номера
1. Серениус Ф., Каллен К., Бленноу М., Эвальд У., Феллман В., Холмстром Г. и соавт.Исход развития нервной системы у крайне недоношенных детей через 2,5 года после активной перинатальной помощи в Швеции. ЯМА . (2013) 309:1810–20. doi: 10.1001/jama.2013.3786
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
2. Strunk T, Inder T, Wang X, Burgner D, Mallard C, Levy O. Воспаление, вызванное инфекцией, и повреждение головного мозга у недоношенных детей. Ланцет Infect Dis . (2014) 14:751–62. doi: 10.1016/S1473-3099(14)70710-8
(2014) 14:751–62. doi: 10.1016/S1473-3099(14)70710-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
7.Хагберг Х., Маллард С., Ферриеро Д.М., Ваннуччи С.Дж., Левисон С.В., Векслер З.С. и др. Роль воспаления в перинатальной травме головного мозга. Нат Рев Нейрол . (2015) 11:192–208. doi: 10.1038/nrneurol.2015.13
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
8. Meneses G, Cardenas G, Espinosa A, Rassy D, Perez-Osorio IN, Barcena B, et al. Сепсис: разработка новых альтернатив для уменьшения нейровоспаления и ослабления повреждения головного мозга. Ann NY Acad Sci . (2019) 1437:43–56.doi: 10.1111/nyas.13985
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
9. Alshaikh B, Yusuf K, Sauve R. Исходы развития нервной системы у младенцев с очень низкой массой тела при рождении с неонатальным сепсисом: систематический обзор и метаанализ. Дж Перинатол . (2013) 33:558–64. doi: 10.1038/jp.2012.167
(2013) 33:558–64. doi: 10.1038/jp.2012.167
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
10. Hofstetter AO, Legnevall L, Herlenius E, Katz-Salamon M. Кардиореспираторное развитие у крайне недоношенных детей: уязвимость к инфекциям и сохранение событий после доношенного возраста. Акта Педиатр . (2008) 97: 285–92. doi: 10.1111/j.1651-2227.2007.00618.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
11. Аслам С., Стрикленд Т., Моллой Э.Дж. Неонатальная энцефалопатия: необходимость распознавания множественной этиологии для оптимального лечения. Передний Педиатр . (2019) 7:142. doi: 10.3389/fped.2019.00142
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
12. Mottahedin A, Svedin P, Nair S, Mohn CJ, Wang X, Hagberg H, et al.Системная активация толл-подобного рецептора 2 подавляет митохондриальное дыхание и усугубляет гипоксически-ишемическое повреждение в развивающемся мозге.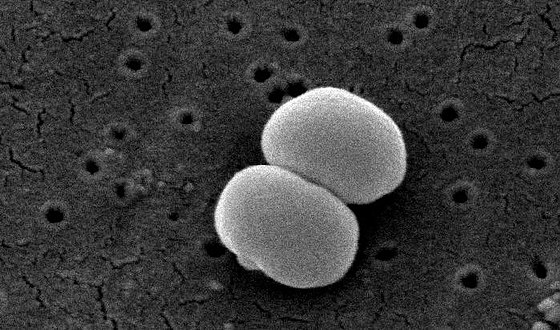 J Cereb Blood Flow Metab . (2017) 37:1192–8. дои: 10.1177/0271678X176
J Cereb Blood Flow Metab . (2017) 37:1192–8. дои: 10.1177/0271678X176
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
13. Falck M, Osredkar D, Maes E, Flatebo T, Wood TR, Walloe L, et al. Гипотермия оказывает нейропротекторное действие после тяжелой гипоксически-ишемической травмы головного мозга у новорожденных крыс, предварительно подвергшихся воздействию PAM3CSK4. Дев Нейроски . (2018) 40:189–97. дои: 10.1159/000487798
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
14. Lai JCY, Svedin P, Ek CJ, Mottahedin A, Wang X, Levy O, et al. Ванкомицин является защитным в неонатальной мышиной модели Staphylococcus epidermidis -потенцированного гипоксически-ишемического повреждения головного мозга. Антимикробные агенты Chemother . (2020) 64: e02003-19. doi: 10.1128/AAC.02003-19
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
15. Eklind S, Mallard C, Arvidsson P, Hagberg H. Липополисахарид вызывает как первичную, так и вторичную фазу сенсибилизации в развивающемся мозге крысы. Педиатр Рез . (2005) 58:112–6. дои: 10.1203/01.PDR.0000163513.03619.8D
Eklind S, Mallard C, Arvidsson P, Hagberg H. Липополисахарид вызывает как первичную, так и вторичную фазу сенсибилизации в развивающемся мозге крысы. Педиатр Рез . (2005) 58:112–6. дои: 10.1203/01.PDR.0000163513.03619.8D
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
18. Павловский Д., Тандиил Дж., Монах П.Н., Ветсел Р.А., Тейлор С.М., Вудрафф ТМ. Генерация компонента комплемента С5а ишемическими нейронами способствует апоптозу нейронов. ФАСЭБ Дж .(2012) 26:3680–90. doi: 10.1096/fj.11-202382
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
19. Shah TA, Nejad JE, Pallera HK, Lattanzio FA, Farhat R, Kumar PS, et al. Терапевтическая гипотермия модулирует уровни факторов комплемента C3a и C5a в крысиной модели гипоксически-ишемической энцефалопатии. Педиатр Рез . (2017) 81: 654–62. doi: 10.1038/pr.2016.271
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
20.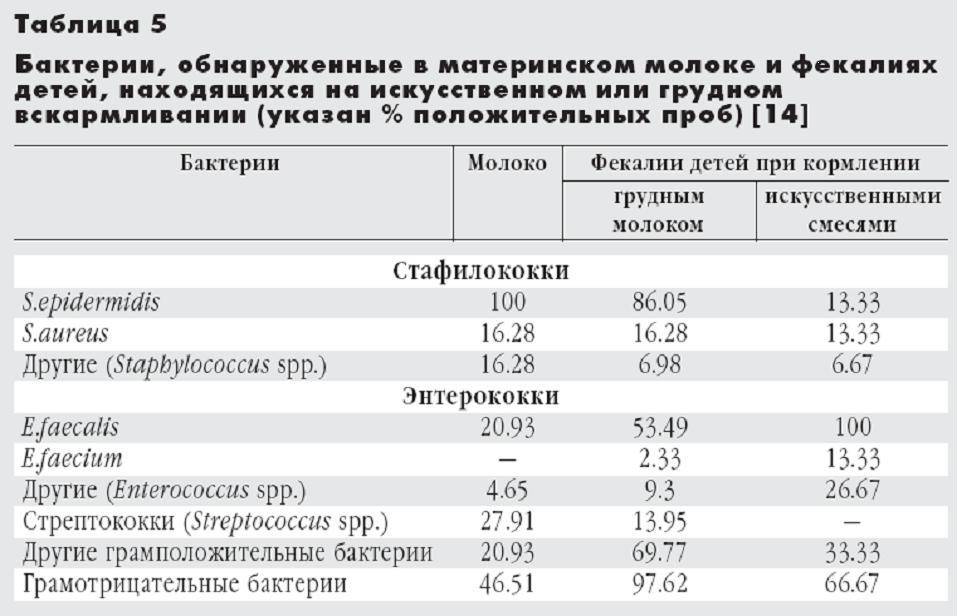 Патаки Р., Хоуи Ф.А., Жирарди Г., Бордман Дж.П.Комплемент С5а присутствует в спинномозговой жидкости новорожденных людей и повышен в связи с преждевременными родами. J Matern Fetal Neonatal Med . (2017) 30:2413–6. дои: 10.1080/14767058.2016.1251896
Патаки Р., Хоуи Ф.А., Жирарди Г., Бордман Дж.П.Комплемент С5а присутствует в спинномозговой жидкости новорожденных людей и повышен в связи с преждевременными родами. J Matern Fetal Neonatal Med . (2017) 30:2413–6. дои: 10.1080/14767058.2016.1251896
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
21. Albertsson AM, Bi D, Duan L, Zhang X, Leavenworth JW, Qiao L, et al. Иммунный ответ после гипоксии-ишемии в мышиной модели преждевременного повреждения головного мозга. J Нейровоспаление . (2014) 11:153. doi: 10.1186/s12974-014-0153-z
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
22.Сведин П., Хагберг Х., Савман К., Чжу С., Маллард С. Нокаут гена матриксной металлопротеиназы-9 защищает незрелый мозг после церебральной гипоксии-ишемии. Дж Нейроски . (2007) 27:1511–8. doi: 10.1523/JNEUROSCI.4391-06.2007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
23. Zhu C, Wang X, Xu F, Bahr BA, Shibata M, Uchiyama Y, et al. Влияние возраста на апоптотические и другие механизмы гибели клеток после церебральной гипоксии-ишемии. Гибель клеток Отличие .(2005) 12:162–76. doi: 10.1038/sj.cdd.4401545
Zhu C, Wang X, Xu F, Bahr BA, Shibata M, Uchiyama Y, et al. Влияние возраста на апоптотические и другие механизмы гибели клеток после церебральной гипоксии-ишемии. Гибель клеток Отличие .(2005) 12:162–76. doi: 10.1038/sj.cdd.4401545
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
24. Винче А., Мазло М., Сересс Л., Комоли С., Абрахам Х. Коррелятивное световое и электронно-микроскопическое исследование постнатальной миелинизации мозолистого тела мышей. Int J Dev Neurosci . (2008) 26:575–84. doi: 10.1016/j.ijdevneu.2008.05.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
25. Ардалан М., Чумак Т., Векслер З., Маллард С.Зависимые от пола эффекты перинатального воспаления на головной мозг: значение для нервно-психических расстройств. Int J Mol Sci . (2019) 20:E2270. дои: 10.3390/ijms20092270
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
26.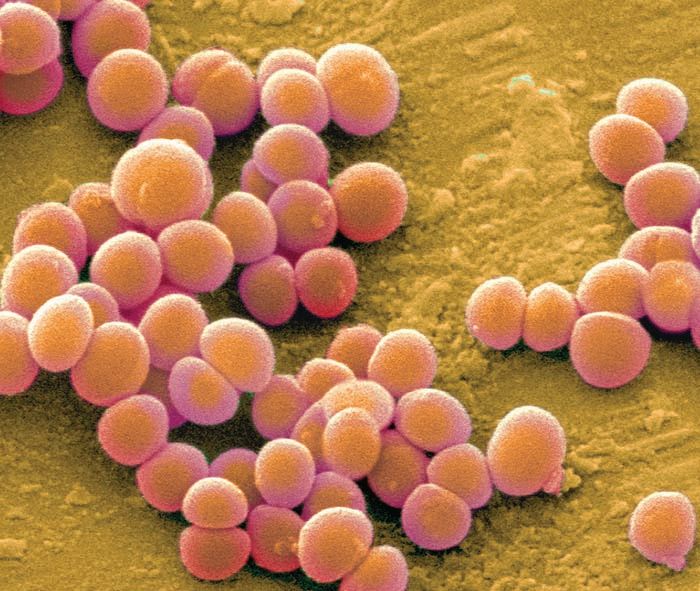 Bi D, Qiao L, Bergelson I, Ek CJ, Duan L, Zhang X, et al. Бактеремия Staphylococcus epidermidis индуцирует повреждение головного мозга у новорожденных мышей посредством толл-подобных рецепторов 2-зависимых и -независимых путей. J Заразить Dis .(2015) 212:1480–90. doi: 10.1093/infdis/jiv231
Bi D, Qiao L, Bergelson I, Ek CJ, Duan L, Zhang X, et al. Бактеремия Staphylococcus epidermidis индуцирует повреждение головного мозга у новорожденных мышей посредством толл-подобных рецепторов 2-зависимых и -независимых путей. J Заразить Dis .(2015) 212:1480–90. doi: 10.1093/infdis/jiv231
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
27. Strunk T, Power Coombs MR, Currie AJ, Richmond P, Golenbock DT, Stoler-Barak L, et al. TLR2 опосредует распознавание живых эпидермальных стафилококков и устранение бактериемии. ПЛОС ОДИН . (2010) 5:e10111. doi: 10.1371/journal.pone.0010111
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
28. Strunk T, Prosser A, Levy O, Philbin V, Simmer K, Doherty D, et al.Реагирование моноцитов человека на комменсальную бактерию Staphylococcus epidermidis развивается на поздних сроках беременности. Педиатр Рез . (2012) 72:10–8. doi: 10.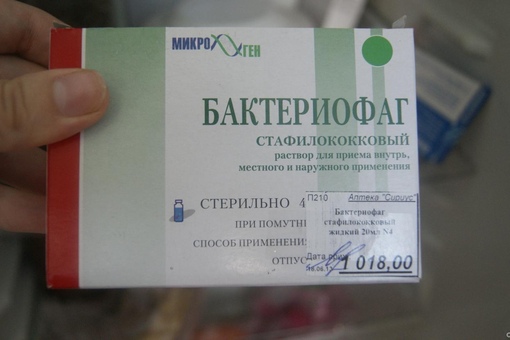 1038/pr.2012.48
1038/pr.2012.48
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
29. Lim S, Han CE, Uhlhaas PJ, Kaiser M. Предпочтительное отслоение в процессе развития человеческого мозга: возрастные и половые структурные связи в данных диффузионно-тензорной визуализации (DTI). Кора головного мозга . (2015) 25:1477–89.doi: 10.1093/cercor/bht333
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
34. Поланчик Г., де Лима М.С., Орта Б.Л., Бидерман Дж., Роде Л.А. Распространенность СДВГ во всем мире: систематический обзор и метарегрессионный анализ. Am J Психиатрия . (2007) 164:942–8. doi: 10.1176/ajp.2007.164.6.942
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
36. Вилла А, Гелоса П., Кастильони Л., Чимино М., Рицци Н., Пепе Г. и др. Половые особенности микроглии взрослых мышей. Представитель ячейки . (2018) 23:3501–11. doi: 10.1016/j.celrep.2018.05.048
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
37. Брюс М., Штрайфель К.М., Бусалис К.А., Хойер Л., Гонсалес Э.А., Ли С. и соавт. Острая активация периферического иммунитета изменяет экспрессию цитокинов и активацию глии в раннем постнатальном мозге крыс. J Нейровоспаление . (2019) 16:200. doi: 10.1186/s12974-019-1569-2
Брюс М., Штрайфель К.М., Бусалис К.А., Хойер Л., Гонсалес Э.А., Ли С. и соавт. Острая активация периферического иммунитета изменяет экспрессию цитокинов и активацию глии в раннем постнатальном мозге крыс. J Нейровоспаление . (2019) 16:200. doi: 10.1186/s12974-019-1569-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
38.Васкес-Мартинес Э.Р., Гарсия-Гомес Э., Камачо-Арройо И., Гонсалес-Педрахо Б. Половой диморфизм при бактериальных инфекциях. Биол Пол Дифференциал . (2018) 9:27. doi: 10.1186/s13293-018-0187-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
40. Стоевска М., Васек-Буко М., Якуб Б., Вишневска-Ульфиг Д., Голеневска-Крол А., Шиманска А. и соавт. Оценка концентрации сывороточного хемокина RANTES в качестве биомаркера в диагностике ранних тяжелых инфекций у новорожденных. Postepy Hig Med Dosw . (2016) 70: 272–9. дои: 10.5604/17322693.1198990
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
41. Шелонка Р.Л., Махешвари А., Карло В.А., Тейлор С., Хансен Н.И., Шендель Д.Э. и соавт. Цитокины Т-клеток и риск инфекции кровотока у детей с экстремально низкой массой тела при рождении. Цитокин . (2011) 53:249–55. doi: 10.1016/j.cyto.2010.11.003
Шелонка Р.Л., Махешвари А., Карло В.А., Тейлор С., Хансен Н.И., Шендель Д.Э. и соавт. Цитокины Т-клеток и риск инфекции кровотока у детей с экстремально низкой массой тела при рождении. Цитокин . (2011) 53:249–55. doi: 10.1016/j.cyto.2010.11.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
44.Леаль Ю.А., Альварес-Немедьеи Х., Лавадорес-Мэй А.И., Хирон-Каррильо Х.Л., Седильо-Ривера Р., Веласкес Х.Р. Цитокиновый профиль как диагностический и прогностический фактор при неонатальном сепсисе. J Matern Fetal Neonatal Med . (2019) 32:2830–6. дои: 10.1080/14767058.2018.1449828
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
45. Orrock JE, Panchapakesan K, Vezina G, Chang T, Harris K, Wang Y, et al. Ассоциация повреждения головного мозга и неонатального цитокинового ответа при терапевтической гипотермии у новорожденных с гипоксически-ишемической энцефалопатией. Педиатр Рез . (2016) 79:742–7. doi: 10.1038/pr.2015.280
doi: 10.1038/pr.2015.280
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
46. Mottahedin A, Smith PL, Hagberg H, Ek CJ, Mallard C. Опосредованный TLR2 перенос лейкоцитов в развивающийся мозг. J Лейкок Биол . (2017) 101: 297–305. doi: 10.1189/jlb.3A1215-568R
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
48. Cedzynski M, Swierzko AS, Kilpatrick DC. Факторы лектинового пути активации комплемента и их клинические ассоциации у новорожденных. Дж Биомед Биотехнолог . (2012) 2012: 363246. дои: 10.1155/2012/363246
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
49. Li Y, Zhao Q, Liu B, Dixon A, Cancio L, Dubick M, et al. Ранняя комплементопатия предсказывает исходы у пациентов с травмой. Открытая неотложная помощь хирурга-травматолога . (2019) 4:e000217. doi: 10.1136/tsaco-2018-000217
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
50. Дубин Г., Хмель Д., Мак П., Раквальска М., Ржичон М., Дубин А.Молекулярное клонирование и биохимическая характеристика протеаз из Staphylococcus epidermidis . Биол Хим . (2001) 382:1575–82. дои: 10.1515/BC.2001.192
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
51. Мун Дж.Л., Банбула А., Олекси А., Мэйо Дж.А., Трэвис Дж. Выделение и характеристика высокоспецифичной сериновой эндопептидазы из перорального штамма Staphylococcus epidermidis . Биол Хим . (2001) 382:1095–9.doi: 10.1515/BC.2001.138
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
52. Flierl MA, Rittirsch D, Nadeau BA, Day DE, Zetoune FS, Sarma JV, et al. Функции компонентов комплемента С3 и С5 при сепсисе. ФАСЭБ Дж . (2008) 22:3483–90. doi: 10.1096/fj.08-110595
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
53. Orhun G, Tuzun E, Ozcan PE, Ulusoy C, Yildirim E, Kucukerden M, et al. Связь между воспалительными маркерами и когнитивным исходом у пациентов с острой мозговой дисфункцией вследствие сепсиса. Норо Псикиятр Арс . (2019) 56: 63–70. doi: 10.29399/npa.23212
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Staphylococcus aureus в неонатальном центре: чувствительные к метициллину штаммы должны быть главной проблемой | Antimicrobial Resistance & Infection Control
Jacquot A, Neveu D, Aujoulat F, Mercier G, Marchandin H, Jumas-Bilak E, et Picaud J-C: Динамика и клиническая эволюция бактериальной микрофлоры кишечника у крайне недоношенных пациентов.J Педиатр. 2011, 158 (3): 390-396.
ПабМед Статья Google Scholar
Marchant EA, Boyce GK, Sadarangani M, et Lavoie PM: Неонатальный сепсис, вызванный коагулазонегативными стафилококками. Клин Дев Иммунол. 2013, 2013: 586076-
PubMed ПабМед Центральный Статья Google Scholar
Чжон И.С., Чжон Дж.С. и Чой Э.О. Внутрибольничная инфекция в отделении интенсивной терапии новорожденных (ОИТН), Южная Корея.BMC Infect Dis. 2006, 6: 103-
PubMed ПабМед Центральный Статья Google Scholar
Healy CM, Palazzi DL, Edwards MS, Campbell JR, et Baker CJ: Особенности инвазивного стафилококкового заболевания у новорожденных. Педиатрия. 2004, 114 (4): 953-961.
ПабМед Статья Google Scholar
Giuffrè M, Bonura C, Cipolla D, et Mammina C: инфекция MRSA в отделении интенсивной терапии новорожденных.Expert Rev Anti Infect Ther. 2013, 11 (5): 499-509.
ПабМед Статья Google Scholar
Нюбель Ю., Нахтнебель М., Фалькенхорст Г., Бенцлер Дж., Хехт Дж., Кубе М., Брокер Ф., Меллинг К., Бюрер К., Гастмайер П., Пининг Б., Бенке М., Денерт М., Лайер Ф., Витте В., et Экманнс Т: Передача MRSA в отделении интенсивной терапии новорожденных: эпидемиологический и геномный филогенетический анализ. ПЛОС Один. 2013, 8 (1): e54898-
PubMed ПабМед Центральный Статья Google Scholar
Nelson MU, et Gallagher PG: Метициллин-резистентный золотистый стафилококк в отделении интенсивной терапии новорожденных.Семин Перинатол. 2012, 36 (6): 424-430.
ПабМед ПабМед Центральный Статья Google Scholar
Geva A, Wright SB, Baldini LM, Smallcomb JA, Safran C, et Gray E: Распространение метициллин-резистентного Staphylococcus aureus в крупном третичном отделении интенсивной терапии интенсивной терапии: сетевой анализ. Педиатрия. 2011, 128 (5): e1173-1180.
ПабМед ПабМед Центральный Статья Google Scholar
Ван дер Ми-Марке Н., Франсуа П., Домелье А.С., Арно Л., Жирар Н., Шренцель Дж., Квентин Р. и др. Исследовательская группа по инфекциям кровотока Réseau des Hygiénistes du Centre: тандемный повторный анализ с переменным числом и мультилокус данные типирования последовательности подтверждают эпидемиологические изменения, наблюдаемые со штаммами Staphylococcus aureus, выделенными из инфекций кровотока.Дж. Клин Микробиол. 2009, 47 (9): 2863-2871.
ПабМед КАС ПабМед Центральный Статья Google Scholar
van der Mee-Marquet N, Epinette C, Loyau J, Arnault L, Domelier AS, Losfelt B, Girard N, Quentin R, et Группа изучения инфекций кровотока Relais d’Hygiène du Centre: выделены штаммы Staphylococcus aureus от инфекций кровотока значительно изменился в 2006 году. J Clin Microbiol. 2007, 45 (3): 851-857.
ПабМед КАС ПабМед Центральный Статья Google Scholar
Graham PL, Morel A-S, Zhou J, Wu F, Della-Latta P, Rubenstein D, et Saiman L: Эпидемиология метициллин-чувствительного золотистого стафилококка в отделении интенсивной терапии новорожденных. Infect Control Hosp Epidemiol. 2002, 23 (11): 677-682.
ПабМед Статья Google Scholar
Weist K, Wendt C, Petersen LR, Versmold H, et Rüden H: Вспышка пиодермий среди новорожденных, вызванная ультразвуковым гелем, загрязненным метициллин-чувствительным золотистым стафилококком.Infect Control Hosp Epidemiol. 2000, 21 (12): 761-764.
ПабМед КАС Статья Google Scholar
Wilcox MH, Fitzgerald P, Freeman J, Denton M, Gill AB, Hoy C, Parnell P, Porter C, Haspinall L, et Hawkey P: Пятилетняя вспышка метициллин-чувствительного Staphylococcus aureus phage type 53,85 в областном неонатальном отделении. Эпидемиол инфекции. 2000, 124 (1): 37-45.
ПабМед КАС ПабМед Центральный Статья Google Scholar
Boers SA, van Ess I, Euser SM, Jansen R, Tempelman FRH, et Diederen BMW: Вспышка полирезистентного метициллин-чувствительного штамма Staphylococcus aureus (MR-MSSA) в ожоговом центре: важность рутинного молекулярного печатание.Бернс. 2011, 37 (5): 808-813.
ПабМед КАС Статья Google Scholar
Линдквист М., Исакссон Б., Самуэльссон А., Нильссон Л.Е., Халлгрен А.: Клональная вспышка метициллин-чувствительного золотистого стафилококка с сопутствующей устойчивостью к эритромицину, клиндамицину и тобрамицину в шведском округе. Scand J Infect Dis. 2009, 41 (5): 324-333.
ПабМед КАС Статья Google Scholar
Acton DS, Plat-Sinnige MJT, van Wamel W, de Groot N, et van Belkum A: Кишечный носитель Staphylococcus aureus: как его частота соотносится с частотой назального носительства и каково его клиническое значение?.Eur J Clin Microbiol Infect Dis. 2009, 28 (2): 115-127.
ПабМед КАС Статья Google Scholar
Bhalla A, Aron DC, et Donskey CJ: Колонизация кишечника золотистым стафилококком связана с повышенной частотой S. aureus на коже госпитализированных пациентов. BMC Infect Dis. 2007, 7: 105-
ПабМед ПабМед Центральный Статья Google Scholar
Durand S, Rideau Batista Novais A, Mesnage R, Combes C, Didelot M-N, Lotthé A, Filleron A, Baleine J, et Cambonie G: Валидация внутрибольничной инфекции в неонатологии: новый метод стандартизированного наблюдения.2014, В печати
Google Scholar
Predari SC, Ligozzi M, et Fontana R: Генотипическая идентификация метициллин-резистентных коагулазонегативных стафилококков с помощью полимеразной цепной реакции. Противомикробные агенты Chemother. 1991, 35 (12): 2568-2573.
ПабМед КАС ПабМед Центральный Статья Google Scholar
Corne P, Marchandin H, Jonquet O, Campos J, et Bañuls A-L: Молекулярные доказательства того, что носовое носительство Staphylococcus aureus играет роль в инфекциях дыхательных путей у пациентов в критическом состоянии.Дж. Клин Микробиол. 2005, 43 (7): 3491-349.
ПабМед КАС ПабМед Центральный Статья Google Scholar
Kuo CY, Huang YC, Huang DT-N, Chi H, Lu CY, Chang LY, Chi CY, Ho YH, Huang YC, Liu CC, et Huang LM: Распространенность и молекулярная характеристика колонизации Staphylococcus aureus среди новорожденных Отделения интенсивной терапии в Тайване. Неонатология. 2013, 105 (2): 142-148.
ПабМед Статья Google Scholar
Полин Р.А., Денсон С., Брейди М.Т., Комитет по плодам и новорожденным и Комитет по инфекционным заболеваниям: стратегии профилактики внутрибольничных инфекций в отделении интенсивной терапии.Педиатрия. 2012, 129 (4): 1085-1093.
Артикул Google Scholar
Lam BCC, Lee J, et Lau YL: Гигиена рук в отделении интенсивной терапии новорожденных: мультимодальное вмешательство и влияние на внутрибольничную инфекцию. Педиатрия. 2004, 114 (5): 565-571.
Артикул Google Scholar
Pessoa-Silva CL, Dharan S, Hugonnet S, Touveneau S, Posfay-Barbe K, Pfister R, et Pittet D: Динамика бактериального заражения рук во время обычного неонатального ухода.Infect Control Hosp Epidemiol. 2004, 25 (3): 192-197.
ПабМед Статья Google Scholar
Treakle AM, Thom KA, Furuno JP, Strauss SM, Harris AD, et Perencevic EN: Бактериальное заражение белых халатов медицинских работников. Am J Infect Control. 2009, 37 (2): 101-105.
ПабМед ПабМед Центральный Статья Google Scholar
Bertin ML, Vinski J, Schmitt S, Sabella C, Danziger-Isakov L, McHugh M, Procop GW, Hall G, Gordon SM, et Goldfarb J: Вспышка метициллин-резистентного Staphylococcus aureus, колонизация и инфекция у новорожденного реанимационное отделение эпидемиологически связано с медицинским работником с хроническим отитом.Infect Control Hosp Epidemiol. 2006, 27 (6): 581-585.
ПабМед Статья Google Scholar
Полин Р.А. и Сайман Л.: Внутрибольничные инфекции в отделении интенсивной терапии новорожденных. Необзоры. 2003, 4 (3): e81-e89.
Артикул Google Scholar
Полин Р.А., Денсон С., Брейди М.Т., Комитет по плодам и новорожденным и Комитет по инфекционным заболеваниям: эпидемиология и диагностика инфекций, связанных с оказанием медицинской помощи, в отделении интенсивной терапии новорожденных.Педиатрия. 2012, 129 (4): e110-1109.
Артикул Google Scholar
Huang Y-C, Chou Y-H, Su L-H, Lien R-I, et Lin TY: Колонизация метициллин-устойчивым золотистым стафилококком и его связь с инфекцией среди младенцев, госпитализированных в отделения интенсивной терапии новорожденных. Педиатрия. 2006, 118 (2): 469-474.
ПабМед Статья Google Scholar
Morioka I, Takahashi N, Kitajima H, t Комитет по профилактике инфекций и продвижению вакцин Японского общества медицины недоношенных и новорожденных: распространенность MRSA-колонизированных пациентов в отделениях неонатальной помощи Японии в 2011 г.Педиатр Междунар. 2013, 56 (2): 211-214.
Артикул Google Scholar
Сайман Л., Кронквист А., Ву Ф., Чжоу Дж., Рубенштейн Д., Эйснер В., Крайсвирт Б.Н. и Делла-Латта П.: Вспышка метициллин-резистентного золотистого стафилококка в отделении интенсивной терапии новорожденных. Infect Control Hosp Epidemiol. 2003, 2 (5): 317-321.
Артикул Google Scholar
Деколонизация родителей может сократить распространение стафилококка среди новорожденных бактерии новорожденным в отделениях интенсивной терапии.
Результаты исследования, в ходе которого было установлено, что деколонизация S aureus , колонизированных родителями, снижает риск приобретения новорожденными штаммов S aureus , которые были такими же, как у их родителей, являются значительными, поскольку S aureus является ведущая причина внутрибольничных инфекций в отделениях интенсивной терапии новорожденных (ОИТН) с потенциально разрушительными последствиями. Многие стратегии профилактики инфекций в отделениях интенсивной терапии сосредоточены на снижении риска заражения новорожденных бактериями от медицинских работников или в больничной среде.
Но авторы исследования говорят, что результаты показывают, что родители являются основным резервуаром для патогена, и что деколонизация родителей, колонизированных S aureus , может уменьшить этот резервуар и риск заражения.
Новое вмешательство показывает многообещающие результаты
В ходе двойного слепого исследования, проведенного клиницистами и исследователями из Школы медицины Университета Джона Хопкинса в Балтиморе и Школы общественного здравоохранения Блумберга при Джоне Хопкинсе, родители новорожденных в двух отделениях интенсивной терапии были обследованы на предмет наличия у них золотистый .
Затем родители с положительными результатами скрининга были рандомизированы для получения либо 2% интраназальной мази мупироцина и 2% салфеток, пропитанных хлоргексидином (группа вмешательства), либо 2% интраназальной вазелиновой мази и нелекарственных мыльных салфеток (группа плацебо) в течение 5 дней. Родителям разрешили посещать своего ребенка во время учебы.
Первичным результатом исследования было неонатальное приобретение штамма S aureus , который был конкордантным штамму, обнаруженному у их родителей во время скрининга перед рандомизацией (исходный штамм S aureus ) в течение 90 дней.Вторичные исходы включали неонатальное заражение любым штаммом S. aureus и неонатальную инфекцию S. aureus . Всего было рандомизировано 236 пар новорожденных и родителей (117 в группу вмешательства и 119 в группу плацебо), и 190 новорожденных были включены в окончательный анализ.
К 90 дню 74 новорожденных (38,9%) приобрели штамм S. aureus , из которых 42 (56,8%) имели штамм, соответствующий родительскому исходному штамму. Но только 13 из 89 (14.6%) новорожденных в группе вмешательства приобрели штамма S. aureus , соответствующие исходному уровню, по сравнению с 29 из 101 (28,7%) в группе плацебо. Разница рисков составила -14,1% (95% доверительный интервал [ДИ], -30,8% до 3,9%), а отношение рисков [ОР] составило 0,43 (95,2% ДИ, 0,16 до 0,79).
Кроме того, меньшее количество новорожденных в группе вмешательства (28 из 89, 31,4%) заразились каким-либо штаммом S. aureus , чем в группе плацебо (46 из 101, 45,5%), что свидетельствует о том, что стратегия деколонизации снижает риск новорожденный, приобретающий S. aureus в течение 90 дней (ЧСС, 0.57; 95% ДИ, от 0,31 до 0,88). У одного новорожденного в каждой группе развилась инфекция S. aureus .
«Эти результаты предоставляют ранние доказательства того, что лечение родителей, колонизированных S aureus , может обеспечить новое вмешательство для снижения риска передачи S aureus новорожденным в отделении интенсивной терапии новорожденных, в период высокого риска инвазивной болезни S aureus . «, — пишут авторы исследования.
Авторы также отмечают, что, поскольку в обоих отделениях интенсивной терапии были проведены программы наблюдения и деколонизации S aureus , влияние вмешательства на приобретение S aureus в отделениях интенсивной терапии новорожденных без таких программ потребует дальнейшего изучения.Кроме того, приверженность стратегии деколонизации, возможно, была переоценена.
«Необходимы дальнейшие исследования, чтобы воспроизвести эти результаты и оценить их обобщаемость», — пишут они.
В сопроводительной редакционной статье клиницисты из Медицинского центра Ирвинга Колумбийского университета и Нью-Йоркской пресвитерианской больницы в Нью-Йорке пишут, что исследование предлагает «новую и многообещающую стратегию для решения весьма актуальной, часто неразрешимой клинической проблемы».
См.114, № 2 Метициллин-резистентный Staphylococcus aureus (MRSA) — повсеместно обитающий в организме человека и один из важных возбудителей неонатальных инфекций. МРЗС связан со значительной смертностью и заболеваемостью, особенно у очень недоношенных новорожденных. Кроме того, MRSA может быть связан с неблагоприятными отдаленными неонатальными исходами, создавая значительное бремя болезни. Недавние достижения в молекулярной микробиологии пролили свет на эволюцию структуры популяции MRSA и факторов вирулентности, которые могут способствовать эпидемическим волнам MRSA во всем мире.Обладая замечательной генетической гибкостью, MRSA успешно развил устойчивость к широкому спектру антибиотиков, включая ванкомицин, а также к антисептикам. Перед лицом этих новых проблем, связанных с MRSA, наш арсенал противоинфекционных стратегий очень ограничен и в значительной степени зависит от мер профилактики. Активное наблюдение за культурами с последующей деколонизацией может быть многообещающим подходом к борьбе с инфекциями MRSA, поскольку его эффективность и безопасность в конкретной популяции новорожденных еще предстоит изучить в крупных многоцентровых исследованиях. © 2018 Автор(ы) Опубликовано S. Karger AG, Базель С момента первого зарегистрированного случая метициллин-резистентной инфекции Staphylococcus aureus (MRSA) у новорожденного в 1980-х годах MRSA стал значимой причиной неонатальной заболеваемости и смертности [1]. Очень незрелые недоношенные дети особенно восприимчивы к инфекциям MRSA, а новорожденные с массой тела при рождении (МТ) < 1500 г могут составлять примерно 80% всех случаев неонатальных инфекций MRSA [2, 3].Как показало национальное когортное исследование в США, частота инфекций, вызванных MRSA, оставалась стабильной в течение последних 2 десятилетий и составляла около 10 на 10 000 госпитализированных младенцев, в то время как частота инфекций, вызванных чувствительным к метициллину Staphylococcus aureus , заметно снизилась [3]. ]. Более того, недавние эпидемиологические исследования пролили свет на эволюцию клонов MRSA и растущую устойчивость MRSA к противомикробным веществам, указывая на замечательную приспособляемость MRSA к антиинфекционным стратегиям и его значение в качестве успешного глобального патогена [4].До 2016 г. во всем мире было зарегистрировано более 20 вспышек MRSA в отделениях интенсивной терапии новорожденных (ОИТН), большинство из которых произошло в Европе и США [5-11]. Эти проблемы, связанные с MRSA, побуждают нас тщательно и всесторонне исследовать его эпидемиологию, клинические характеристики и патогенность, чтобы уменьшить бремя неонатальных инфекций MRSA. Мы провели поиск в PubMed литературы, опубликованной с 1 января 1998 г. по 1 февраля 2018 г., используя следующие термины: «новорожденный», или «новорожденный», или «младенец», или «преждевременные роды», или «недоношенный младенец». или «преждевременные роды» и «метициллин-резистентный Staphylococcus aureus » или « Staphylococcus aureus ».«Языковых ограничений не применялось. В списках литературы выявленных исследований и обзорных статей был проведен поиск дополнительных ссылок. Текущие данные о колонизации MRSA среди населения в целом ограничены и в основном основаны на исследованиях, проведенных в развитых регионах. Было продемонстрировано, что приблизительно одна треть общей популяции может быть колонизирована S. aureus [12, 13]. Новорожденные, вероятно, приобретут S.aureus через родовые пути, при грудном вскармливании, при контакте с людьми и окружающей средой [14, 15]. В одном лонгитюдном исследовании сообщалось, что уровень колонизации S. aureus составляет 40–50% в течение первых 8 недель жизни с последующим постепенным снижением примерно до 20% в возрасте 6 месяцев [14]. Как и у взрослых, распространенность MRSA в общей неонатальной популяции оценивается в 1,5% [13, 16], при этом преобладающим местом колонизации MRSA являются передние отделы носа [16].Другие части тела, такие как пупок, глотка, подмышечная впадина, пах и промежность, в меньшей степени содержат MRSA [14, 16]. Текущие данные демонстрируют более высокий уровень колонизации MRSA у госпитализированных новорожденных, чем в общей неонатальной популяции, в пределах от 3,9 до 32% среди учреждений [5, 6, 17-20]. Это можно объяснить повышенной распространенностью MRSA в медицинских учреждениях по сравнению с населением [12]. В Европе 8 из 30 стран сообщили о процентном содержании MRSA в инвазивных штаммах S.aureus составляет более 25% [21]. Кроме того, госпитализированные новорожденные находятся в тесном контакте с медицинскими работниками, частота носительства MRSA у которых, по-видимому, в 2–3 раза выше, чем в общей популяции [11, 22]. Широкие межучрежденческие различия в частоте колонизации MRSA могут быть объяснены демографическими характеристиками пациентов, политикой скрининга на MRSA, стратегиями инфекционного контроля и, что более важно, наличием вспышки MRSA. Примечательно, что новорожденные, которые не были колонизированы при поступлении в отделение интенсивной терапии, могут заразиться MRSA в среднем в течение 9 дней (диапазон: 1–91 день) [6], а частота заражения MRSA во время госпитализации в отделение интенсивной терапии, как сообщается, составляет 6.1% (95% ДИ 2,8–10,6) [16]. Примерно у 1 из 5 новорожденных, колонизированных MRSA, может развиться инфекция [5, 6, 18, 19], что соответствует относительному риску 24,2 (95% ДИ 8,9–66,0) по сравнению с неколонизированными новорожденными [16]. Среднее время между колонизацией MRSA и началом инфекции может составлять от 4 до 9 дней [18, 20]. Установлено, что недоношенность является основным фактором риска колонизации MRSA и последующих инфекций [2, 17, 19, 23]. Заболеваемость инфекциями MRSA у новорожденных с массой тела ≤1000 г, как сообщается, составляет 53.4 на 10 000 детей по сравнению с 23,2, 7,9 и 5,0 на 10 000 детей с массой тела 1 001–1 500, 1 501–2 500 и > 2 500 г соответственно [2]. Другие факторы риска инфекций MRSA включают длительную госпитализацию, переполненность и нехватку персонала в неонатальных отделениях, длительное использование респираторной поддержки, внутрисосудистых катетеров, антибиотиков и полного парентерального питания, а также хирургические вмешательства [6, 18, 19]. Клинические проявления инфекций MRSA могут варьироваться от легких очаговых инфекций, таких как конъюнктивит и инфекции кожи и мягких тканей, до более тяжелых форм, таких как синдром токсического шока [24], и даже инвазивных инфекций, таких как сепсис, некротизирующая пневмония, менингит, эндокардит, остеомиелит. , абсцессы печени и инфекции мочевыводящих путей [2, 18, 23, 25-27].Сепсис, особенно сепсис с поздним началом, в настоящее время является наиболее частым проявлением инвазивных инфекций MRSA, причем одна треть случаев представляет собой сепсис MRSA [2, 25]. Однако, хотя и спорадически, сепсис с ранним началом, вызванный MRSA, также был зарегистрирован в промышленно развитых странах [23, 25]. Данные из развивающихся стран отсутствуют. Следует отметить, что клинические симптомы и признаки в начале инфекции MRSA могут быть весьма неспецифичными [23], что подчеркивает важность тщательного наблюдения за пациентом и своевременного доступа к лабораторной и микробиологической диагностике.В настоящее время уровень смертности от инфекций, вызванных MRSA, широко варьируется в зависимости от учреждения, примерно от 2,9 до 28% [3, 9, 19, 23]. Хотя, по-видимому, нет различий между MRSA и метициллин-чувствительным S. aureus с точки зрения их клинических проявлений и смертности [3, 23, 28], у новорожденных, инфицированных MRSA, может быть более высокая частота повторных госпитализаций и более длительное течение инфекции, чем у новорожденных. Случаи MSSA [26, 29]. Неонатальные инфекции вызывают повышенный риск краткосрочной заболеваемости и смертности, а также неблагоприятных отдаленных исходов, особенно у очень недоношенных новорожденных [30-32].В нескольких исследованиях была предоставлена информация о специфических патогенах MRSA. Однако имеется значительное количество данных о том, что S. aureus является вторым наиболее распространенным возбудителем неонатального сепсиса с поздним началом в некоторых странах [33], сразу после коагулазонегативных стафилококков [34]. Как показали ограниченные популяционные исследования, частота инфицирования S. aureus может составлять 0,6 на 1000 живорождений [23], 4,0–5,3 на 1000 госпитализаций новорожденных и 22 на 1000 госпитализированных новорожденных с очень низкой массой тела (ОНМТ) [23]. 3, 23], при этом на MRSA приходится примерно 28% всех S.aureus [3, 26]. У детей с ОНМТ, инфицированных грамположительными бактериями, риск бронхолегочной дисплазии и церебрального паралича был значительно выше, чем у их сверстников без инфекций [30-32]. Для детей раннего возраста с инфекциями, вызванными некоагулазонегативными стафилококками, грамположительными бактериями, скорректированное ОШ бронхолегочной дисплазии составило 1,41 (95% ДИ 1,18–1,68) [30], а скорректированное ОШ церебрального паралича оказалось в диапазоне от 1,5 (95% ДИ 1,0–2.4) до 4,05 (95% ДИ 1,48–11,07) [31, 32]. Примечательно, что внутрижелудочковое кровоизлияние и инфаркт таламуса были обнаружены во время или после инфекции S. aureus у детей с ОНМТ [35]. Показано, что частота тяжелого некротизирующего энтероколита и ретинопатии недоношенных у глубоконедоношенных детей с грамположительными бактериальными инфекциями почти в 3 раза выше, чем в неинфицированной контрольной группе [30]. Кроме того, инфекции, вызванные некоагулазонегативными стафилококками, грамположительными бактериями, могут быть связаны с двукратным увеличением риска нарушения зрения и роста головы по сравнению с неинфицированными младенцами [32].В свете приведенной выше информации бремя краткосрочной и долгосрочной неонатальной заболеваемости, вызванной MRSA, может быть значительным, особенно у детей с ОНМТ. В будущем необходимы многоцентровые исследования для описания клинической картины инфекций MRSA. Впервые о MRSA сообщили в 1960-х годах, а устойчивость MRSA к метициллину и другим бета-лактамным антибиотикам достигается благодаря мобильному генетическому элементу, называемому стафилококковой хромосомной кассетой mec (SCC mec ) [4].До 1990-х годов считалось, что MRSA распространен только в медицинских учреждениях [4]. С тех пор сообщалось об эпидемических волнах инфекций MRSA в сообществах на разных континентах [4, 36]. Внебольничный MRSA (CA-MRSA) традиционно считается более вирулентным, но менее устойчивым к антибиотикам, чем MRSA, ассоциированный с оказанием медицинской помощи (HA-MRSA) [37]. Генотипические характеристики, лежащие в основе этого различия фенотипов, включают исключительное носительство лейкоцидина Пантона-Валентайна и более высокую экспрессию других токсинов в CA-MRSA, чем в HA-MRSA [37, 38].Кроме того, мелкие штаммы SCC mec , такие как IV, V и VII, чрезмерно представлены в CA-MRSA, тогда как большинство штаммов HA-MRSA несут более крупные SCC mec типов I, II и III [37]. Однако эволюция и передача MRSA способствовали недавнему появлению CA-MRSA в медицинских учреждениях, включая отделение интенсивной терапии [4, 17, 18, 26, 36, 37]. Накопленные данные показывают, что генотипические и фенотипические различия между CA-MRSA и HA-MRSA, возможно, стали менее четкими [4, 36-38].Примечательно, что MRSA, связанный с домашним скотом, стал еще одним важным источником инфекций MRSA в сообществах и медицинских учреждениях, особенно в Европе, что указывает на важность зоонозных резервуаров для передачи MRSA [39]. Эпидемиологические исследования последнего десятилетия показали, что большинство инфекций MRSA во всем мире связано с ограниченным числом клональных линий [4, 38, 39]. Наиболее распространенные штаммы MRSA, выделенные в неонатальных отделениях, относятся к сиквенс-типам (ST) 1, 5, 8 и 22 (рис.1) [6-9, 17-19, 22, 40-44]. Многие из этих клонов характеризуются способностью образовывать биопленку, выработкой токсинов и генетической гибкостью, которые будут кратко представлены в следующем разделе. Для получения более подробной информации о вирулентности MRSA читатели могут обратиться к обзору в другом месте [45]. Преимущественно устойчивые к метициллину клоны Staphylococcus aureus , о которых сообщалось при неонатальных инфекциях. Указанные штаммы MRSA были выделены в одном или нескольких отделениях для новорожденных в конкретной стране.ST, тип последовательности. Биопленки представляют собой сообщество бактерий и продуцируемый бактериями внеклеточный матрикс [46]. Они представляют собой особый способ роста, который защищает бактерии от атаки противомикробных веществ и иммунной системы хозяина [46]. Показано, что преобладающие клоны MRSA в США и Европе, т. е. ST8 и ST22, являются сильными производителями биопленки [47]. Прикрепление и агрегация MRSA на постоянных устройствах и тканях хозяина в значительной степени опосредованы факторами слипания и белками, связывающими фибронектин, эластин и коллаген [45].Помимо своей роли в формировании биопленки, эти поверхностные белки могут вызывать воспалительную реакцию у хозяина, характеризующуюся высвобождением фактора некроза опухоли-α, интерлейкина-1α (IL-1α), IL-1β, IL-6 и IL. -10 [48, 49]. Эти медиаторы воспаления могут быть вовлечены в патогенез S. aureus -индуцированного эндокардита или артрита, как показано в экспериментах на животных [48, 49]. MRSA продуцирует широкий спектр токсинов, включая фенолорастворимые модули, лейкотоксины (лейкоцидин Пантона-Валентайна, LukED и LukAB/DH), гемолизины, эксфолиативные токсины, стафилококковые энтеротоксины и токсин-1 синдрома токсического шока [50].Токсины могут способствовать персистенции MRSA в организме хозяина, рецидивам инфекций, повреждению тканей и продукции провоспалительных цитокинов [47, 51, 52]. Иммунный ответ новорожденных на MRSA до сих пор не выяснен [53]. Некоторые данные свидетельствуют о том, что новорожденные склонны к развитию гипервоспаления при стафилококковых инфекциях [54, 55]. Такое несбалансированное воспаление считается ключевым механизмом долгосрочных неонатальных заболеваний, таких как бронхолегочная дисплазия, некротизирующий энтероколит, ретинопатия недоношенных и церебральный паралич [56]. Гипервариабельный генетический фон MRSA в основном заключается в приобретении им мобильных генетических элементов [37]. Поглощение SCC mec типа IV, локуса, кодирующего лейкоцидин Panton-Valentine, и катаболического мобильного элемента аргинина предком штамма ST8 приводит к USA300, который считается наиболее распространенным клоном MRSA в США и некоторых европейских странах. странах [37]. В то время как SCC mec и лейкоцидин Panton-Valentine придают USA300 устойчивость к антибиотикам и инвазивность, катаболический подвижный элемент аргинин способствует ускользанию от иммунного ответа и повышению выживаемости MRSA в организме хозяина [37, 57].Другим примером является растворимый в феноле фактор вирулентности modulin-mec, который сочетает в себе устойчивость к антибиотикам и продукцию токсинов [51]. Недавно было обнаружено, что недавно идентифицированный локус гена, названный sasX , который может способствовать назальной колонизации MRSA, легочным инфекциям и образованию абсцессов, распространяется от ST239 к другим клонам MRSA, таким как ST5 [58]. Помимо β-лактамных антибиотиков, было продемонстрировано, что широкий спектр других антибиотиков проявляет сниженную эффективность против MRSA [2, 17], в основном из-за бактериальных генетических мутаций и приобретения плазмид [4, 59].Хотя ванкомицин считается препаратом последней инстанции при стафилококковых инфекциях, сообщалось о промежуточном ванкомицине S. aureus и даже о устойчивых к ванкомицину S. aureus [59, 60]. Сниженная чувствительность ванкомицина к MRSA представляет серьезную проблему для противоинфекционного лечения MRSA у новорожденных, поскольку ванкомицин является эмпирическим антибиотиком выбора у новорожденных с сепсисом и обширными кожными инфекциями, особенно в регионах с высокой распространенностью MRSA. 61, 62].Подходы, нацеленные на вирулентные детерминанты MRSA, могут быть многообещающими [50], а их эффективность и безопасность еще предстоит подтвердить в неонатальной популяции. На сегодняшний день наилучшей стратегией лечения неонатальных инфекций MRSA является профилактика, а не лечение. Инфицированию MRSA в значительной степени предшествует колонизация MRSA, и каждый дополнительный день контакта с нелеченым колонизированным младенцем может увеличить риск заражения MRSA на 6% [63]. Таким образом, деколонизация может предотвратить инфицирование MRSA путем устранения бактериального резервуара [64, 65].Недавнее исследование показало, что 86% отделений интенсивной терапии интенсивной терапии в 58 странах внедрили активные культуры для наблюдения и стратегии деколонизации MRSA с использованием назального мупироцина с антисептическими ваннами или без них [66]. Активное культуральное наблюдение и деколонизация способствовали резкому снижению колонизации MRSA и инфекций в некоторых центрах и, по-видимому, являются экономически эффективными [67, 68]. Однако в других центрах до 50% новорожденных могут быть персистентно колонизированы или реколонизированы MRSA, и у части пациентов может развиться последующая инфекция, несмотря на деколонизацию [11, 63, 69].Примечательно, что текущий протокол деколонизации MRSA в значительной степени основан на рекомендациях для взрослых [65], а надежных доказательств его экстраполяции на новорожденных мало [70]. В настоящее время еще предстоит решить следующие вопросы эпиднадзора за MRSA и деколонизации у новорожденных: (1) применение универсального и целевого активного культивирования у новорожденных с высоким риском колонизации и инфицирования MRSA [10, 64], (2) определение оптимальных временных точек наблюдения для лучшей идентификации колонизированных новорожденных [10, 64] и (3) преимущества скрининга экстраназальных участков для раннего выявления колонизированных младенцев [10, 16, 64].Кроме того, необходимо определить важность новых методов скрининга, таких как полимеразная цепная реакция и полногеномное секвенирование [6, 7, 10, 16, 64]. Поскольку сообщалось о резистентности MRSA к мупироцину и антисептикам [18, 44, 71], эффективность назального применения мупироцина при первичной и персистирующей деколонизации MRSA требует проверки [10, 70, 72]. Наконец, потенциальные побочные эффекты антисептических ванн, такие как такие как раздражение кожи и токсичность [73], а также непротивомикробные стратегии, такие как материнский контакт кожа к коже для деколонизации MRSA, остаются предметом обсуждения [74]. Помимо эпиднадзора и деколонизации, общепризнано, что строгая гигиена рук имеет первостепенное значение для прерывания передачи MRSA [64, 65]. Другие меры, которые могут способствовать профилактике инфекций MRSA, включают групповое наблюдение и изоляцию MRSA-позитивных пациентов, барьерные меры предосторожности, обучение медицинских работников, предотвращение скученности палат и, в некоторых отделениях, наблюдение и деколонизацию медицинских работников и посещающих родителей. 6, 11, 22, 64, 65, 69]. Повышенная выживаемость очень недоношенных детей может способствовать росту популяции детей, подверженных риску колонизации MRSA и последующих инфекций. Несмотря на обилие данных, полученных из неонатальных отделений по всему миру, не хватает многоцентровых или популяционных исследований для выяснения эпидемиологии и клинических характеристик неонатальной колонизации и инфекций MRSA. Такие данные необходимы для точной оценки бремени болезни, вызванной MRSA, и для помощи в процессах принятия решений, касающихся эпиднадзора и профилактики.Кроме того, новые методы обнаружения и ликвидации MRSA должны противостоять быстрой эволюции структуры популяции MRSA и патогенных факторов. Из-за растущей устойчивости MRSA к антибиотикам и неуверенности в эффективности и безопасности стратегий деколонизации у новорожденных ключом к лечению неонатальных инфекций MRSA по-прежнему являются базовые профилактические меры. Авторы заявляют об отсутствии потенциального конфликта интересов. Авторы заявляют об отсутствии источников финансирования. Эта статья находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND). Использование и распространение в коммерческих целях, а также любое распространение измененного материала требует письменного разрешения. Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации. Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности.Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством. Отказ от ответственности: заявления, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и участникам, а не издателям и редакторам. Появление рекламы и/или ссылок на продукты в публикации не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор(ы) отказываются от ответственности за любой ущерб людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в содержании или рекламе. Бактерии, устойчивые к лекарствам, доминировали в заголовках новостей и привлекали внимание экспертов в области общественного здравоохранения, но исследование, проведенное экспертами из Детского центра Джона Хопкинса и DCRI, показывает, что нерезистентные бактериальные инфекции возникают гораздо чаще и могут так же сильно поражать новорожденных. как их устойчивые к лекарствам родственники. Исследование, описанное в выпуске JAMA Pediatrics от 19 октября, показало, что неустойчивые формы распространенной бактерии Staphylococcus aureus поражают более чем в два раза больше детей, чем штаммы, устойчивые к антибиотикам, и имеют такой же высокий уровень смертности. Результаты, по словам исследователей, резко противоречат общепризнанным выводам среди взрослых, у которых лекарственно-устойчивые инфекции вызывают смерть гораздо чаще, чем нерезистентные формы. Ученые подозревают, что это несоответствие может быть связано, среди прочего, с различиями между молодыми и старыми иммунными системами. «Тот факт, что клоп хорошо реагирует на антибиотики, не означает, что он менее опасен», — говорит старший исследователь Аарон Милстоун, доктор медицинских наук, специалист по инфекционным заболеваниям Детского центра Джонса Хопкинса.«Если не обнаружить и не лечить на ранней стадии, инвазивные инфекции кровотока, вызываемые стафилококком, могут нанести организму новорожденного такой же вред, как и формы, устойчивые к антибиотикам». По оценкам экспертов, более 5000 новорожденных в Соединенных Штатах ежегодно заболевают инвазивными стафилококковыми инфекциями, которые особенно распространены среди недоношенных детей и детей с ослабленной иммунной системой. Стафилококковые инфекции, у которых развились механизмы уклонения от лечения препаратом выбора первого ряда метициллином, известны как метициллинрезистентные штаммы S.золотистый (МРЗС). Исследователи говорят, что эта способность может затмить опасность более распространенных форм бактерии, известной как метициллин-чувствительный золотистый стафилококк (MSSA). По словам Милстоуна, многие отделения интенсивной терапии новорожденных (ОИТН) в США уже проводят тщательный скрининг на наличие устойчивых к лекарствам бактерий и принимают ряд мер предосторожности для снижения риска заражения и передачи инфекции. Однако исследователи говорят, что новые результаты показывают, что такие протоколы и меры могут потребоваться для всех форм стафилококка, а не только против тех, которые невосприимчивы к метициллину. Выводы, основанные на медицинских картах более чем 3800 младенцев с инвазивными стафилококковыми инфекциями, проходивших лечение в отделениях интенсивной терапии в США в период с 1997 по 2012 год, показывают почти равные показатели смертности после инвазивных инфекций MSSA и MRSA. В частности, общая смертность младенцев от инфекций, вызванных MSSA и MRSA, составляла 10 и 12 процентов соответственно, но, по словам исследователей, важно отметить, что MSSA вызывает в 2,5 раза больше инфекций, чем MRSA среди новорожденных, при этом 2474 ребенка получали препарат. -чувствительный штамм по сравнению с 926 случаями заражения лекарственно-устойчивым штаммом в течение периода исследования. Исследователи предупреждают, что инвазивные инфекции любым микроорганизмом остаются чрезвычайно редкими — 0,4 процента новорожденных в исследовании были инфицированы любым штаммом. «Мы добились больших успехов в выявлении устойчивых к лекарствам организмов и сокращении их распространения», — говорит автор исследования П. Брайан Смит, доктор медицины, магистр здравоохранения, MHS, DCRI ( на фото ). «Эти результаты подтверждают постоянную необходимость делать все возможное для предотвращения всех типов инфекций в дошкольных учреждениях». Виктор Попула из Johns Hopkins был соисследователем исследования.Среди других исследователей были Джессика Эриксон, Дэниел Бенджамин, Вэнс Фаулер, Дэниел Бенджамин-младший и Риз Кларк. TY — JOUR T1 — Бактериальная колонизация госпитализированных новорожденных T2 — Конкуренция между Staphylococcus aureus и Staphylococcus epidermidis AU — Lee Kananurak, Anchasa AU — Tran, Michelle Tn AU — Connolly, Patricia A. AU — Polage, Christopher R AU — Iwase, Tadayuki AU — Bevins, Charles L AU — Underwood, Mark PY — 2019/7/1 1 — 20 N2 — ПРЕДПОСЫЛКИ: У взрослых Staphylococcus epidermidis и Staphylococcus aureus конкурируют за колонизацию слизистой оболочки носа, а штаммы S. epidermidis, продуцирующие сериновую протеазу Esp, уничтожают колонизацию S. aureus в носу. Наблюдаются ли подобные явления у новорожденных, неизвестно.МЕТОДЫ: Мазки из носа брали при поступлении и выписке у новорожденных (n = 90 и 83 соответственно) в отделении интенсивной терапии новорожденных в Детской больнице Калифорнийского университета в Дэвисе. Мазки культивировали на S. aureus и S. epidermidis. Изоляты S. epidermidis тестировали на экспрессию Esp, общую активность секретируемых протеаз и ингибирование биопленки. РЕЗУЛЬТАТЫ. Ни у одного ребенка при поступлении не было выявлено золотистого стафилококка. Колонизация S. epidermidis была редкой при поступлении у врожденных детей (2,5%), но часто встречалась у детей, переведенных из специализированных больниц (50%).При выписке большинство детей (96%) были колонизированы стафилококками. Колонизация S. aureus реже встречалась у младенцев с колонизацией S. epidermidis (9%) и чаще у младенцев без S. epidermidis (77%) (относительный риск колонизации S. aureus у младенцев, колонизированных S. epidermidis, 0,18, 95%). доверительный интервал: 0,089-0,34, P <0,0001). По сравнению со штаммами S. epidermidis от младенцев без S. aureus, S. epidermidis от младенцев, колонизированных совместно с S. aureus, имел более низкую общую активность протеолитических ферментов и сниженную способность ингибировать биопленку, но не имел более низкой частоты положительности Esp.ВЫВОДЫ: У госпитализированных новорожденных колонизация S. epidermidis оказывает защитное действие против колонизации S. aureus. Секреция протеаз S. epidermidis является возможным механизмом ингибирования колонизации S. aureus; однако в этой когорте новорожденных источник основной протеазной активности, вероятно, не Esp. AB — ПРЕДПОСЫЛКИ: У взрослых Staphylococcus epidermidis и Staphylococcus aureus конкурируют за колонизацию слизистой оболочки носа, а штаммы S. epidermidis, продуцирующие сериновую протеазу Esp, уничтожают S.колонизация носа aureus. Наблюдаются ли подобные явления у новорожденных, неизвестно. МЕТОДЫ: Мазки из носа брали при поступлении и выписке у новорожденных (n = 90 и 83 соответственно) в отделении интенсивной терапии новорожденных в Детской больнице Калифорнийского университета в Дэвисе. Мазки культивировали на S. aureus и S. epidermidis. Изоляты S. epidermidis тестировали на экспрессию Esp, общую активность секретируемых протеаз и ингибирование биопленки. РЕЗУЛЬТАТЫ. Ни у одного ребенка при поступлении не было выявлено золотистого стафилококка. Колонизация S. epidermidis при поступлении у врожденных детей была редкой (2.5%), но часто встречается у младенцев, переведенных из направляющих больниц (50%). При выписке большинство детей (96%) были колонизированы стафилококками. Колонизация S. aureus реже встречалась у младенцев с колонизацией S. epidermidis (9%) и чаще у младенцев без S. epidermidis (77%) (относительный риск колонизации S. aureus у младенцев, колонизированных S. epidermidis, 0,18, 95%). доверительный интервал: 0,089-0,34, P <0,0001). По сравнению со штаммами S. epidermidis от младенцев без S. aureus, S. epidermidis от младенцев, совместно колонизированных S.aureus имел более низкую общую активность протеолитических ферментов и сниженную способность ингибировать биопленку, но не имел более низкой частоты положительности Esp. ВЫВОДЫ: У госпитализированных новорожденных колонизация S. epidermidis оказывает защитное действие против колонизации S. aureus. Секреция протеаз S. epidermidis является возможным механизмом ингибирования колонизации S. aureus; однако в этой когорте новорожденных источник основной протеазной активности, вероятно, не Esp. УР — http://www.scopus.com/inward/record.url?scp=85068197647&partnerid=8yflogxk UR — http://www.scopus.com/inward/Cityby.URL?SCP=85068197647&PARTNERID=8YFLOGXK U2 — 10.1097 / INF.0000000000002285 DO — 10.1097 / INF.0000000000002285 Введение
Поиск литературы
Колонизация новорожденных MRSA и инфекции
Динамический сдвиг в популяции MRSA
Патогенные факторы MRSA
Рис. 1.
Формирование биопленки
Токсины
Генетическая гибкость
Лечение и профилактика неонатальных инфекций MRSA
Заключение
Заявление о раскрытии информации
Источники финансирования
Распространенные стафилококковые инфекции столь же смертельны для новорожденных, как и лекарственно-устойчивые штаммы
Конкуренция между Staphylococcus aureus и Staphylococcus epidermidis — UC Davis
00000002285
м3 — Статья
C2 — 30985510
AN — SCOPUS: 85068197647
VL — 38
SP — 682
EP — 682
EP — 686
Jo — Джодиатрическая инфекционная болезнь
JF — Журнал детских инфекционных заболеваний
SN — 0891-3668
IS — 7
ER —
.


 Рекомендован при генерализации процесса, тяжелых формах стафилококковой инфекции, особенно – у детей раннего возраста. Медикамент вводится внутримышечно каждый день или через день.
Рекомендован при генерализации процесса, тяжелых формах стафилококковой инфекции, особенно – у детей раннего возраста. Медикамент вводится внутримышечно каждый день или через день. Краткое издание/ под ред. Ющука Н.Д., Венгерова Ю.В. – 2019.
Краткое издание/ под ред. Ющука Н.Д., Венгерова Ю.В. – 2019.