Наследственная тромбофилия
Склонность к патологическому свертыванию крови, или тромбофилия может обнаруживаться у пациентов, столкнувшихся с опасным состоянием — тромбозом 1. И у многих из них склонность к повышенному тромбообразованию передалась по наследству. Почему развивается наследственная тромбофилия. Какие симптомы появляются при данном состоянии, как ее диагностировать и лечить?
Генетические факторы
Тромбофилия, которая передается по наследству, — генетически обусловленная склонность к формированию тромбов. При сочетании двух и более нарушений в системе свертывания выраженные тромботические расстройства могут развиваться уже в раннем детстве. Однако чаще наследственное повышение свертываемости крови вызвано одним нарушением, которое выявляется случайно при лабораторном исследовании крови 2.
Выделяют два основных типа тромбофилий: гематогенные, связанные с изменениями свертывающей системы крови, и негематогенные. На сегодня известны как минимум 20 генетических факторов, связанных с развитием заболевания.
Установленные:
- фактор V Лейден — мутация, при которой из-за замены аминокислот в белковой цепи V фактора свертывания он становится устойчивым к действию одного из основных противосвертывающих агентов, активированного протеина С.
- Мутация G20210А протромбина II, при которой изменяется уровень фактора свертывания крови II протромбина.
- Дефицит протеина С, инактивирующего факторы свертывания крови Va и VIIIa. Встречается реже, чем две предыдущие мутации, обычно приводит к развитию семейного венозного тромбоза.
- • Дефицит антитромбина, основного белкового фактора, который угнетает свертывание крови. Передается по аутосомно-доминантному типу, то есть проявляется только при наличии хотя бы одного дефектного гена.
Неопределённые:
- Дисфибриногенемия — состояние, при котором содержание фибриногена соответствует норме, однако сама молекула фибриногена изменена.
 Чаще передается по аутосомному типу наследования, то есть для проявления заболевания дефектный ген должен передаться от обоих родителей. Обычно проявляется умеренными кровотечениями на фоне травмы или хирургического вмешательства.
Чаще передается по аутосомному типу наследования, то есть для проявления заболевания дефектный ген должен передаться от обоих родителей. Обычно проявляется умеренными кровотечениями на фоне травмы или хирургического вмешательства. - Гипергомоцистеинемия. Может быть одновременно и наследственным, и приобретенным нарушением 2. Связана с редкими генетическими поломками, которые приводят к повышению концентрации гомоцистеина в моче, плазме крови. Гомоцистеин проявляет выраженный токсический эффект, повреждая внутреннюю поверхность сосудов, значительно увеличивая риск тромбозов.
- Дисфибриногенемия — состояние, при котором содержание фибриногена соответствует норме, однако сама молекула фибриногена изменена.
Редкие.
К редким факторам тромбофилии относятся повышение концентрации факторов свертывания крови VIII, IX, XI, VII, XII, дефицит плазминогена, активация тканевого плазминогена, повышение липопротеина А, полиморфизм гликопротеина тромбоцитов, дефект гена тромбомодулина, другие факторы.
Как проявляется тромбофилия?
Наличие тромбофилии можно заподозрить при следующих состояниях 2:
- Повторная венозная тромбоэмболия
- Венозный тромбоз в возрасте младше 40 лет
- Венозная тромбоэмболия у родственников
- Тромбоз необычной локализации, например, брыжеечной вены, почечной вены, печени, церебральный тромбоз.

Необходимо отметить, что чаще всего тромбофилия приводит к тромбозу вен, однако недостаточность протеинов С, S и антитромбина могут проявляться также тромбозами в артериях. Последние становятся причиной инфаркта миокарда и острого нарушения мозгового кровообращения — инсульта.
Диагностика тромбофилии
Своевременная диагностика генетической (наследственной) тромбофилии играет важную роль в прогнозе заболевания. Раннее выявление заболевания позволяет внести необходимые коррективы в образ жизни и таким образом предупредить патологическое тромбообразование.
Поскольку передающаяся по наследству тромбофилия может быть связана с различными генетическими факторами, диагностика ее носит комплексный характер. Задача врача — подтвердить или опровергнуть наличие мутаций, связанных с нарушением свертывающей активности крови.
К числу анализов, которые придется сдать при подозрениях на наследственную тромбофилию, относятся3:
Развернутая коагулограмма с определением уровня факторов свертывания крови, физиологических антикоагулянтов.
Коагулограмма позволяет выявить отклонения в системе гемостаза и определить тип тромбофилии, недостаточность каких именно факторов свертываемости наблюдается.
- Определение уровня гомоцистеина, позволяющее диагностировать гипергомоцистеинемию.
- Определение содержания тромбомодулина, активности фактора Виллебранда, а также концентрации эндотелина-1, необходимые для получения информации о возможном поражении сосудов вследствие тромбофилии.
- Генетическое исследование полиморфизма генов тех факторов, которые участвуют в гемостазе.
Наследственная тромбофилия и беременность
Связь между передаваемыми по наследству тромбофилиями и осложнениями беременности, например, преэклампсией, эклампсией, самопроизвольным прерыванием беременности, задержкой развития плода, отслойкой плаценты до сих пор остается противоречивой4. И тем не менее, некоторые акушерские осложнения все же вызваны тромбофилиями.
Так, ряд исследований свидетельствует о возможной связи между потерей плода во втором и третьем триместрах беременности с наличием наследственной тромбофилии6.
Тем не менее, наличие тромбофилии, которая заложена генетически, у беременных женщин может повышать риск венозных тромбоэмболических осложнений5. Даже в норме, у здоровых женщин во время беременности свертывающая система крови активируется: наблюдается физиологическая гиперкоагуляция (повышение свертываемости крови), также имеется венозный застой. Однако, у беременных женщин, страдающих тромбофилией, коагуляция еще более увеличивается, что и может приводить к повышению риска тромбообразования, прежде всего в венозных сосудах
Формированию венозного застоя у будущих мам может способствовать и снижение физической активности, например, при некоторых осложнениях беременности, а также после кесарева сечения 7.
Диагностика тромбофилии при беременности затруднена, поскольку ряд показателей повышается как при патологии, так и у здоровых женщин, причем чем больше срок беременности, тем выше риск тромбоза. Чтобы поставить диагноз, прибегают к генетическому исследованию, которое обычно проводится по рекомендации лечащего врача при наличии определенных показаний, например, при наличии перенесенного венозного тромбоза нижних конечностей или наличии венозных тромбозов у близких родственников.
Профилактика тромбозов
Профилактика тромбозов при тромбофилии в большинстве случаев основана на изменении образа жизни. Пациентам рекомендуют избегать тяжелых физических нагрузок и травм, при этом сохраняя прежний объем физической активности. Важная мера профилактики — ношение компрессионного трикотажа. Врачи всегда принимают решение о профилактических мерах строго индивидуально после оценки тромботического риска.
Список литературы
- Kyrle P.A., Rosendaal F.R., Eichinger S.

- Khan S., Dickerman J.D. Hereditary thrombophilia. // Thromb. J. BioMed Central. 2006;4:15.
- Васильев С.А., Виноградов В.Л., и соавт. Тромбозы и тромбофилии: классификация, диагностика, лечение, профилактика // РМЖ — 2013.- № 17. — С.896.
- Robertson L. et al. Thrombophilia in pregnancy: a systematic review // Br. J. Haematol. Blackwell Science Ltd.2006;132(2):171–196.
- Sibai B.M., How H.Y., Stella C.L. Thrombophilia in pregnancy: Whom to screen, when to treat. 2007;19(1):50–64.
- Battinelli E.M., Marshall A., Connors J.M. The role of thrombophilia in pregnancy. // Thrombosis. Hindawi.2013; 2013:516420.
- Андрияшкин А.В. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений // Флебология — 2015. –Т. 9. – № 2. –С.1–52.
SARU.ENO.19.03.0436
Тромбофилия врожденная и приобретенная, тромбофилия при беременности — лечение и риски
Тромбофилия — что это за болезнь?
Что это такое тромбофилия? С чем связано заболевание и насколько опасно? Эти вопросы волнуют многих людей при обращении к врачу. Тромбофилия является болезнью, при которой повышается риск развития рецидивирующих тромбозов, причем их локализация многообразна. Частое образование тромбов обуславливается приобретенной или врожденной патологией клеток крови.
Тромбофилия является болезнью, при которой повышается риск развития рецидивирующих тромбозов, причем их локализация многообразна. Частое образование тромбов обуславливается приобретенной или врожденной патологией клеток крови.
Тромбообразование — это процесс формирования сгустков крови там, где повреждается сосудистая стенка, его цель — обеспечить сохранность сосудистой системы. Сам по себе данный процесс физиологически нормальный, он препятствует избыточной кровопотере в местах повреждений. Но если тромботический процесс избыточный, то имеет место уже патологический тромбоз. При ответе на вопрос, что это такое тромбофилия, можно привести наглядный пример в виде фото, где показана повышенная активность клеток крови и образование тромба. Болезнь не всегда сопровождается тромбоэмболией или тромбозом, однако сильно повышается риск образования тромбов в различных местах кровеносной системы.
Сейчас современная медицина озабочена проблемой данного заболевания, поскольку довольно часто возникают летальные исходы из-за закупорки кровеносного сосуда. Больше всего диагностируется наследственная тромбофилия. По статистике, в Европе около 15% людей страдают этим заболеванием.
Больше всего диагностируется наследственная тромбофилия. По статистике, в Европе около 15% людей страдают этим заболеванием.
Не стоит путать такие понятия как тромбофилия и трипофилия. Это совершенно несвязанные между собой термины. Но иногда можно услышать вопрос: трипофилия, что это такое? Понятие означает фобию, боязнь скопления предметов имеющих закругленную форму, кластерных отверстий. Так что трипофилия — это страх и дискомфорт, связанный, например, с семенами лотоса, сотами, а не заболевание, которое проявляет себя патологиями в организме.
Признаки тромбофилии
При болезни часто не бывает никаких симптомов. Иногда встречаются тромбозы в венах голени. Это вызывает покраснение, отек и неприятные ощущения. Такие признаки тромбофилии называют тромбозом глубоких вен. Сгустки крови или тромбы подлежат лечению при помощи специальных препаратов, разжижающих кровь. Диагностировать данное заболевание при тромбофилии можно на аппаратах, позволяющих получить фото, например, провести ультразвуковое обследование.
Тромбы опасны не только для здоровья, они могут привести к летальному исходу, если оторвутся и попадут в кровоток к жизненно важным органам.
При появлении тромба появляются следующие симптомы:
Виды заболевания
При ответе на вопрос, что такое тромбофилия, необходимо понять то, что развитие болезни может зависеть от многих факторов. Ее носителями, по статистике, являются практически две пятых населения Земли. С каждым годом регистрируется рост болезни. Есть два основных вида патологии — тромбофилия врожденная и приобретенная. При наследственном заболевании в генах обнаруживаются различные аномалии. Больше всего встречаются следующие факторы:
- дефицит протеина S и C, а также антитротромбина III. Протеины регулируют интенсивность свертываемости, поэтому при их недостаточности образуется избыточное тромбообразование. Антитромбин III создает соединения с тромбином, это приводит к взаимной инактивации. Компонент является одним из самых важных в противосвертывающей системе;
- молекулярные аномалии фибриногена;
- полиморфизм гена V фактора.
 Появляется дефект в гене, который несет информацию о пятом факторе свертывания крови. Данный фактор еще называют мутацией Лейдена;
Появляется дефект в гене, который несет информацию о пятом факторе свертывания крови. Данный фактор еще называют мутацией Лейдена; - замена одного нуклеотида G20210A;
- повышение уровня липопротеинов.
Тромбофилии, возникающие в результате приема медикаментов, травм или при сопутствующих болезнях, являются приобретенными. Они не возникают неожиданно и спонтанно, появлению патологии всегда есть причина.
- Выделяют еще некоторые виды заболевания:
- гематогенная тромбофилия. Из-за нарушения состава крови, аномалий в системе свертывания или тромбоцитарного гемостаза появляется склонность к повторяющимся тромбозам кровеносных сосудов различной локализации. Это один самых опасных видов болезни. На фото показано, как из-за нарушений, причиной которых стала тромбофилия, образуется тромб. Он может стать причиной тромбоэмболии, т.е. произойдет острая закупорка сосуда. Различают два вида гематогенных тромбофилий. Первая группа связана с изменениями клеточного состава крови и ее реологических свойств.
 Вторая группа связана с первичными нарушениями в системе гемостаза;
Вторая группа связана с первичными нарушениями в системе гемостаза; - гемодинамическая тромбофилия связана с нарушениями работы системы кровообращения;
- к сосудистой тромбофилии относят такие заболевания, как васкулит и атеросклероз.
Тромбофилия при беременности
Часто так совпадает, что себя одновременно проявляет наследственная тромбофилия и беременность. Это связывают с тем, что у женщины, которая ждет ребенка, образуется дополнительный круг кровообращения — плацентарный, он имеет свои специфические особенности и дает дополнительную нагрузку на организм. Тромбофилия — это такое заболевание, при котором нарушается система свертывания крови, возникает возможность серьезных осложнений, поэтому беременность и тромбофилия является опасным сочетанием, которое требует к себе повышенного внимания женщины и врачей.
В организме женщины во время развития беременности происходят большие изменения, в частности, повышается свертываемость крови. Это связано с уменьшением кровопотери при родах или такими патологическими состояниями, как отслойка плаценты, выкидыш. При тромбофилии риск образования тромбов является высоким, поэтому, когда к нему присоединяется еще и физиологические особенности течения беременности в виде повышенной свертываемости, то возникает еще большая опасность.
Это связано с уменьшением кровопотери при родах или такими патологическими состояниями, как отслойка плаценты, выкидыш. При тромбофилии риск образования тромбов является высоким, поэтому, когда к нему присоединяется еще и физиологические особенности течения беременности в виде повышенной свертываемости, то возникает еще большая опасность.
Часто у беременных возникает гематогенный вид болезни, связанный с антифосфолипидным синдромом. При этом течение болезни обычно непредсказуемо и универсальной схемы лечения нет. Обычно тромбофилия может себя никак не проявлять, но при беременности риск тромбозов увеличивается в шесть раз. Главной опасностью может стать выкидыш на небольшом сроке беременности. Чревато это состояние тем, что тромбы могут образоваться в сосудах, которые ведут к плаценте, что вызывает у плода гипоксию и задержку развития. В организм ребенка перестают поступать питательные вещества, что приводит к фетоплацентарной недостаточности, отслоению плаценты, порокам развития, выкидышам и к преждевременным родам.
Считается, что болезнь никак себя не проявляет до десяти недель. Нет данных о влиянии патологии на развитие беременности на ранних сроках. Во втором триместре обычно тромбофилия также ведет себя спокойно, и неприятные последствия редко возникают. Риск развития осложнений увеличивается после 30 недель, тогда может возникнуть отслойка плаценты.
Если при заболевании удается выносить ребенка, то роды обычно происходят раньше положенного срока, на 35-37 неделе. Этот вариант развития событий считается благоприятным.
При постановке диагноза во время беременности врач должен рассказать женщине о том, что такое тромбофилия, и незамедлительно назначить лечение. Курс терапии состоит из медикаментозных препаратов, особой диеты и физических упражнений. При неукоснительном выполнении всех врачебных рекомендаций шансы выносить и родить здорового ребенка велики. Важно помнить о том, что, скорее всего, произойдут преждевременные роды до 40 недель. Но при современном уровне медицины выхаживают младенцев, рождающихся и на более ранних сроках, поэтому тромбофилия не является приговором для женщины, которая хочет иметь детей. Важно при наличии диагноза «генетическая тромбофилия» заранее планировать беременность, и тогда снизятся риски возможных осложнений.
Важно при наличии диагноза «генетическая тромбофилия» заранее планировать беременность, и тогда снизятся риски возможных осложнений.
Если Вы обнаружили у себя схожие симптомы, незамедлительно обратитесь к врачу. Легче предупредить болезнь, чем бороться с последствиями.
Диагностика заболевания
Обычно диагностика тромбофилии имеет ряд сложностей. В основном это происходит потому, что болезнь может себя никак не проявлять и не давать никаких симптомов. Для уточнения заболевания необходимо обратиться к флебологу, он использует визуальный осмотр больного, аппаратную и лабораторную диагностику.
При первичном осмотре врач определяет месторасположение поврежденного участка и степень его изменений. Обычно пациенты жалуются на отеки, гипертермию в области расположения вен с варикозным расширением, тянущие боли после сидения или ходьбы. При пальпации определяется выраженная болезненность. Уже на основании этих признаков доктор назначает общий анализ крови, исследования на содержание Д-димера, коагулограмму.
Лабораторный анализ на тромбофилию включает в себя исследование генов тромбоцитарных рецепторов, факторов свертываемости крови, фибринолиза и др. По сути, определяются генетические маркеры тромбофилии, которые играют важную роль в появлении врожденного вида болезни. Бывает два вида полиморфизма — гетерозиготный и гомозиготный. Последний из них считается более серьезным в плане проявления осложнений и лечения.
Необходимость проведения анализов на генетические маркеры определяется врачом флебологом индивидуально и зависит от клинической картины. Показаниями для проведения данной лабораторной диагностики является:
- наличие в молодом возрасте тромбоэмболических болезней;
- варикозное расширение вен;
- инсульт и инфаркт;
- сердечно-сосудистые заболевания у ближайших родственников;
- нарушения, связанные с течением беременности: фетоплацентарная недостаточность, задержка внутриутробного развития, гибель плода, отслойка плаценты, невынашивание беременности, выкидыши на ранних сроках, токсикозы, тяжелые формы гестоза;
- применение оральных контрацептивов;
- рецидивирующие тромбоэмболии;
- ожирение.

Очень информативна инструментальная диагностика заболевания. Компьютерные программы выдают подробные результаты состоянию вен, клапанов, просветов, тромботических масс.
- Ультразвуковая допплерография позволяет определить скорость и направление кровотока на различных участках сосуда. Данный способ не предоставляет возможности изучить данные о структуре и анатомии вен.
- Ультразвуковая ангиография нижних конечностей. Исследование основано на способности тканей различно отражать и поглощать ультразвуковые волны. Исследование проводится только по серьезным показаниям, поскольку является инвазивным методом диагностики. Во время процедуры в сосуд вводится контрастное вещество, прибор отслеживает его движение, тем самым создается трехмерная картинка всех вен и артерий. Рекомендуется проводить ангиографию уже после проведения допплерографии.
- Флебография — рентгенологическое исследование с применением контрастного йодсодержащего вещества.

- Флебосцинтиграфия — процедура также основана на методе введения контрастного вещества, здесь им является радиоактивный изотоп с малым периодом полураспада.
- Спиральная компьютерная томография — это новый точный способ диагностики. Позволяет создать объемную 3D-реконструкцию и определить состояние и расположение вен. Такая процедура незаменима при экстренной диагностике тромбоэмболии.
- Магнитно-резонансная томография.
После постановки диагноза доктор расскажет, что это за болезнь, тромбофилия, и назначит необходимое лечение. Дополнительно пациентам назначается рентгенография грудной клетки для предупреждения тромбоэмболии легочной артерии. Полноценную диагностику можно пройти в любом современном флебологическом центре.
Тромбофилия — лечение
Лечение тромбофилии начинается с выбора квалифицированного врача, его целью является устранение тромботических осложнений.
Назначаются медикаментозные препараты:
- антикоагулянты (низкомолекулярные гепарины), которые понижают свертывание крови;
- антиагреганты для профилактики тромбоэмболий;
- препараты, улучшающие функцию печени;
- фибринолитические средства;
- фолиевая кислота имеет показания при некоторых видах заболевания;
- при риске отека мозга рекомендуются глюкокортикоидные препараты (дексаметазон).

Для предотвращения осложнений рекомендуется использовать профилактические мероприятия. Особенно это касается периода беременности:
- занятия лечебной физкультурой;
- отсутствие подъема тяжестей, длительного стояния;
- ношение медицинского компрессионного трикотажа или эластичных бинтов;
- плавание;
- электромагнитная терапия;
- самомассаж;
- правильное питание;
- фитотерапия.
При тромбофилии рекомендуется делать следующее упражнение: лежа на спине, поднимать и опускать ноги без резких движений. Возможно использование гирудотерапии, где применяются специальные медицинские пиявки.
Лечение тромбофилии во время беременности
Часто именно в период ожидания ребенка проявляет себя генетическая тромбофилия, поэтому лечение беременных с таким диагнозом должно быть начато как можно раньше. При этом используются примерно такие же препараты, как и для других категорий.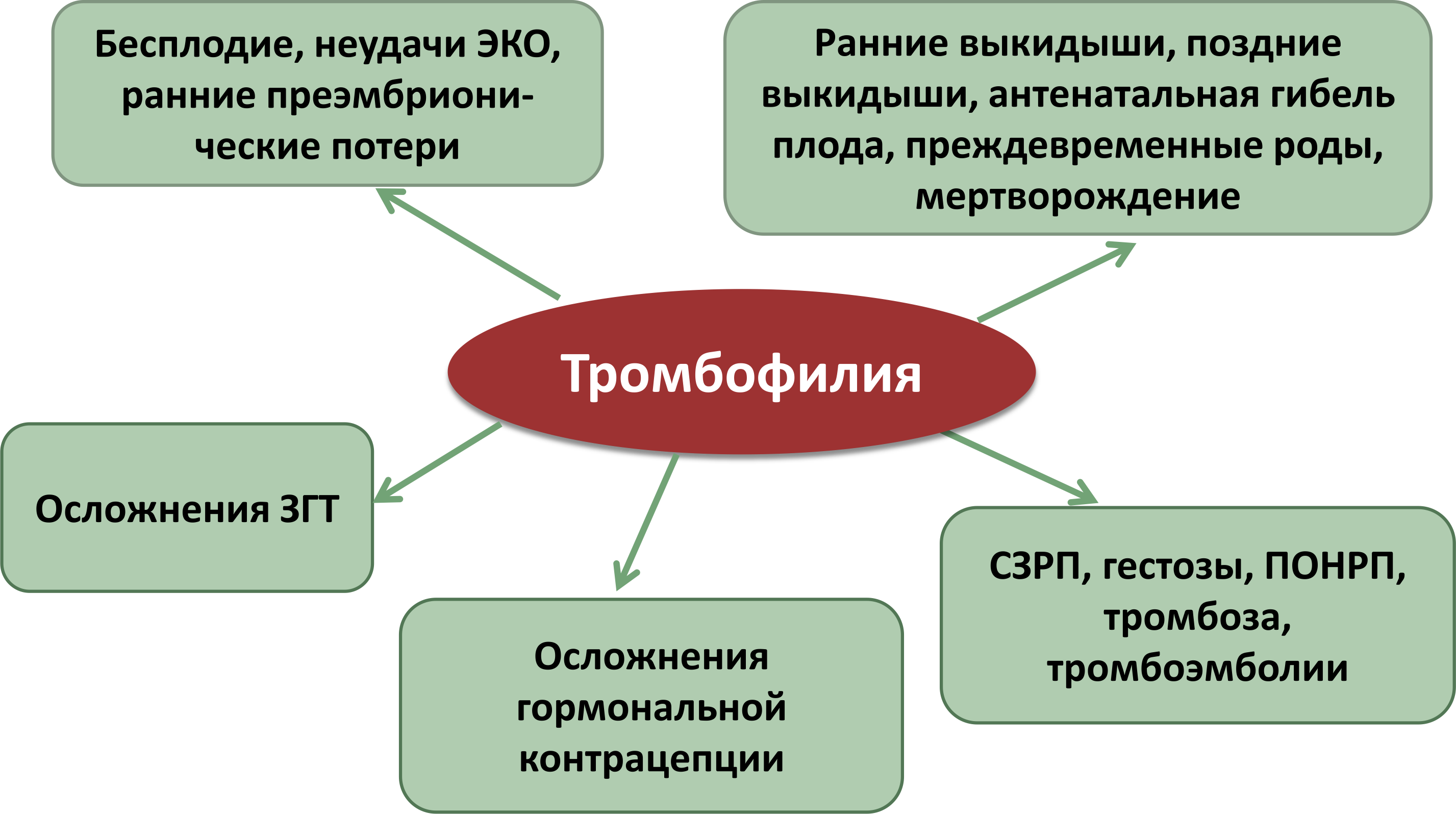 В практике применяются следующие основные и вспомогательные медикаментозные средства лечения:
В практике применяются следующие основные и вспомогательные медикаментозные средства лечения:
- Аэсцин;
- Надропарин кальция;
- Троксерутин;
- Маннол;
- Дексаметазон;
- Фраксипарин;
- Фемибион-2;
- Вессел Дуэ Ф;
- иногда при АФС для профилактики тромбозов, а также для предотвращения гестоза назначается аспирин.
Во время беременности существуют определенные показания для госпитализации пациентов:
- дородовая госпитализация в акушерско-гинекологический стационар при тромбозе церебральных вен;
- наблюдается варикозное расширение вен, в этом случае пациентку направляют в хирургический стационар, решается вопрос о сохранении или прерывании беременности;
- больных госпитализируют в нейрохирургический стационар, если произошло неуточненное венозное осложнение.
Тромбофилия — лечение народными средствами
Народный опыт собрал в себя множество рецептов, некоторые из которых будут полезны для снижения свертывания крови.
- Настойка софоры японской. Нужно взять 100 грамм семян и залить их полулитром хорошей водки. Настоять две недели в темном месте. Средство принимают 3 раза в день до приема пищи, 10 капель настойки разводят в четверти стакана воды.
- Хорошо зарекомендовал себя виноградный сок, его ежедневное употребление снижает активность тромбоцитов.
- Настой из лабазника. 2 чайные ложки необходимо залить стаканом кипятка, процедить и пить до еды по одной трети стакана.
- Полезно употреблять настои, варенье, компоты из ягод и листьев малины.
- Чеснок является одним из уникальных природных средств, которые могут разжижать кровь, поэтому можно включить в свой рацион 2-3 зубчика.
- Используется экстракт листьев гинкго билоба.
- Многокомпонентный настой. Череда, зверобой по 20 грамм; плоды кориандра, корень солодки голой, сушеница топяная, ромашка, льнянка, донник по 10 грамм. Смесь трав заливают 500 мл кипятка и делают выдержку в течение 2 часов.
 Затем настой процеживают и пьют, можно добавить мед. Дозировка составляет 200 мл два раза в день через час после еды.
Затем настой процеживают и пьют, можно добавить мед. Дозировка составляет 200 мл два раза в день через час после еды.
Нельзя использовать при заболевании травы, обладающие кровесвертывающим действием, — водяной перец, крапиву. Перед применением народных средств нужно обязательно проконсультироваться с врачом, многие из них имеют противопоказания.
Диета при тромбофилии
При заболевании назначается специальный антитромботический рацион. Необходимо ограничить продукты, которые могут повысить вязкость крови. Диета должна исключать следующие продукты питания:
- сало, жирное мясо, наваристый бульон;
- шоколад;
- цельное молоко;
- бобовые;
- говяжью печень;
- твердые сорта сыра;
- кофе, большое количество зеленого чая;
- сельдерей, петрушку, шпинат;
- нельзя употреблять в пищу острые и жирные блюда.
Желательно употреблять те продукты, которые снижают свертываемости крови:
- клюкву, калину, бруснику, черноплодную рябину;
- морепродукты;
- имбирь;
- морскую капусту;
- красные морсы и соки;
- злаковые каши — перловую, овсяную, ячневую, гречневую,
- сухофрукты — финики, курагу, инжир, изюм, чернослив.

Опасность и факторы риска возникновения
На развитие заболевания влияет наследственный фактор (тромбофилия генетическая). Но существуют и некоторые приобретенные риски:
- заболевания крови. Эритремия, атеросклероз, варикозное расширение вен нижних конечностей, артериальная гипертензия;
- косвенно на развитие патологии могут повлиять и болезни, влияющие на двигательную активность (болезнь Шляттера), злокачественные образования, аутоиммунные заболевания (антифосфолипидный синдром, системная красная волчанка), поликистоз почек;
- инфекционные процессы;
- перенесенный инфаркт или инсульт;
- хирургические вмешательства;
- катетеризация вен;
- заболевания печени;
- ожирение;
- период беременности;
- нефротический синдром;
- некоторые лекарственные препараты (оральные контрацептивы, преднизолон).
Профилактика осложнений тромбофилии
Насколько бы профессиональный не был врач, нельзя перекладывать ответственность за свое здоровье только на достижения современной медицины, важно помнить, что каждый человек сам тоже должен заботиться о нем. Для того чтобы предотвратить появления осложнений при тромбофилии, нужно выполнять ряд простых правил:
Для того чтобы предотвратить появления осложнений при тромбофилии, нужно выполнять ряд простых правил:
- пересмотреть свой образ жизни. Сегодня риску болезни подвержены все, кто много сидит и мало двигается. Умеренная физическая активность, зарядка, лечебная физкультура только укрепят здоровье;
- правильный рацион питания, отказ от чрезмерного употребления жирного и копченого, а также промышленных полуфабрикатов;
- уменьшить количество потребляемого мяса;
- специальный питьевой режим — необходимо выпивать не менее полутора литра чистой воды в день;
- профилактические врачебные осмотры.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
Сгустки крови, наследственная тромбофилия и COVID-19
Недавние сообщения в средствах массовой информации из ряда европейских стран предполагают, что могут быть причины для беспокойства в отношении вакцины Oxford AstraZeneca COVID-19 и аномального свертывания крови. По данным норвежского агентства по лекарствам (NoMA), после недавнего обзора было выявлено четыре новых случая «серьезного свертывания крови у взрослых» (1). Австрия приостановила использование одной конкретной партии вакцины после двух событий, включая человека с диагнозом множественные сгустки крови, который в конечном итоге умер через 10 дней после получения вакцины (2). В целом более десятка европейских стран приостановили использование вакцины AstraZeneca (3).
По данным норвежского агентства по лекарствам (NoMA), после недавнего обзора было выявлено четыре новых случая «серьезного свертывания крови у взрослых» (1). Австрия приостановила использование одной конкретной партии вакцины после двух событий, включая человека с диагнозом множественные сгустки крови, который в конечном итоге умер через 10 дней после получения вакцины (2). В целом более десятка европейских стран приостановили использование вакцины AstraZeneca (3).
После этих отчетов AstraZeneca опубликовала обновленные данные о безопасности своей вакцины против COVID-19. Основываясь на имеющихся научных данных вакцинации более 17 миллионов человек в Европейском союзе (ЕС) и Великобритании, компания сообщает, что «нет доказательств повышенного риска тромбоэмболии легочной артерии, тромбоза глубоких вен (ТГВ) или тромбоцитопении, в любой определенной возрастной группе, поле, партии или в любой конкретной стране ». Заверения поступили также от Всемирной организации здравоохранения (ВОЗ), которая в настоящее время проводит собственное расследование. Д-р Мариангела Симао, помощник Генерального директора ВОЗ по доступу к лекарствам и продуктам медицинского назначения, прокомментировала: «ВОЗ полностью придерживается позиции, согласно которой мы должны продолжать иммунизацию, пока мы не проясним причинно-следственную связь». Европейское агентство по лекарственным средствам (EMA) опубликовало заявление, в котором говорится, что преимущества вакцинации AstraZeneca-Oxford перевешивают риски ее отказа. В Великобритании Управление по регулированию лекарственных средств и товаров медицинского назначения (MHRA) заявило, что нет никаких доказательств того, что вакцина вызвала проблемы, и люди все равно должны пойти и пройти вакцинацию, когда их об этом попросят.
Д-р Мариангела Симао, помощник Генерального директора ВОЗ по доступу к лекарствам и продуктам медицинского назначения, прокомментировала: «ВОЗ полностью придерживается позиции, согласно которой мы должны продолжать иммунизацию, пока мы не проясним причинно-следственную связь». Европейское агентство по лекарственным средствам (EMA) опубликовало заявление, в котором говорится, что преимущества вакцинации AstraZeneca-Oxford перевешивают риски ее отказа. В Великобритании Управление по регулированию лекарственных средств и товаров медицинского назначения (MHRA) заявило, что нет никаких доказательств того, что вакцина вызвала проблемы, и люди все равно должны пойти и пройти вакцинацию, когда их об этом попросят.
Несмотря на эти заверения, многие будут обеспокоены личным риском тромботического события. Предрасположенность к образованию тромбов, так называемое «состояние гиперкоагуляции», может возникать из-за лежащих в основе генетических мутаций или приобретенных изменений в механизме свертывания крови. Чаще всего это сочетание генетических и приобретенных факторов. В общей популяции распространенность наследственного тромботического синдрома в настоящее время оценивается в 1 человек на 2500-5000; распространенность увеличивается до 4% у пациентов с тромбозами в анамнезе (4). Унаследованные состояния гиперкоагуляции включают:
Чаще всего это сочетание генетических и приобретенных факторов. В общей популяции распространенность наследственного тромботического синдрома в настоящее время оценивается в 1 человек на 2500-5000; распространенность увеличивается до 4% у пациентов с тромбозами в анамнезе (4). Унаследованные состояния гиперкоагуляции включают:
- Лейденская мутация фактора V (G1691A / R506Q)
- Мутация протромбина (фактор II) (G20210A)
- Повышенный уровень гомоцистеина
- MTHR (677 C> T)
- MTHR (1298 А> С)
- Дефицит естественных белков свертывания крови, например протеина С
Лабораторный «скрининг» на тромбофилию часто включает ряд тестов, включая как функциональную оценку свертывания, так и генетический анализ. Выбор того, какие генетические мутации проверять, часто зависит от этнической принадлежности обслуживаемого населения и местных руководящих принципов, принимающих во внимание клиническую применимость.
Фактор V Лейдена (FVL) является наиболее частой из этих наследственных причин.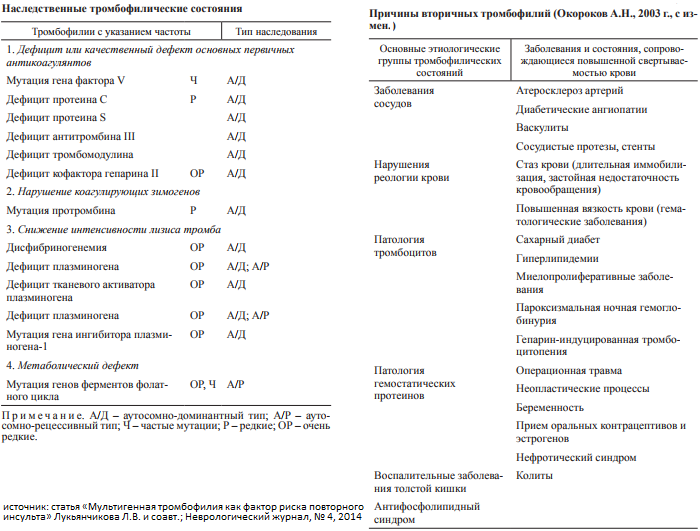 Это вызвано заменой одного нуклеотида, приводящей к мутации R506Q, что приводит к устойчивости фактора V к инактивации активированного протеина C (APC). Гетерозиготность по фактору V Лейден встречается у 3-8% населения США и Европы и составляет 40-50% всех случаев наследственных состояний гиперкоагуляции (5). Риск образования сгустка в течение жизни у гетерозигот составляет около 10%, а у гомозигот он возрастает до 80% (6). Считается, что распространенность гетерозиготной мутации протромбина G20210A составляет около 1.5% в Великобритании (7).
Это вызвано заменой одного нуклеотида, приводящей к мутации R506Q, что приводит к устойчивости фактора V к инактивации активированного протеина C (APC). Гетерозиготность по фактору V Лейден встречается у 3-8% населения США и Европы и составляет 40-50% всех случаев наследственных состояний гиперкоагуляции (5). Риск образования сгустка в течение жизни у гетерозигот составляет около 10%, а у гомозигот он возрастает до 80% (6). Считается, что распространенность гетерозиготной мутации протромбина G20210A составляет около 1.5% в Великобритании (7).
В справочнике по тестированию лабораторий ARUP (6) предлагается рассматривать тестирование на FVL:
- Одна неспровоцированная венозная тромбоэмболия, особенно в возрасте до 50 лет.
- Рецидивирующие сгустки крови
- Сгустки крови в необычных местах
- В личном анамнезе были тромбы и у одного члена семьи был тромб в возрасте до 50 лет или у двух или более членов семьи со сгустками
- Лица с низкой активностью резистентности к активированному протеину C (APC)
Эти рекомендации в целом соответствуют рекомендациям, выпущенным NICE и Британским обществом гематологии (BSH) в Великобритании для скрининга на тромбофилию. Однако во многих странах обследование на тромбофилию может также рассматриваться у женщин, которые, к сожалению, пережили повторный выкидыш. Тромбофилия — частая причина повторного невынашивания беременности, о ней сообщалось до 40–50% случаев (8). Сама по себе беременность — это приобретенная форма гиперкоагуляции, которая усугубляется, когда у женщины есть предрасположенность, такая как FVL.
Однако во многих странах обследование на тромбофилию может также рассматриваться у женщин, которые, к сожалению, пережили повторный выкидыш. Тромбофилия — частая причина повторного невынашивания беременности, о ней сообщалось до 40–50% случаев (8). Сама по себе беременность — это приобретенная форма гиперкоагуляции, которая усугубляется, когда у женщины есть предрасположенность, такая как FVL.
Выявление людей с основной генетической предрасположенностью важно как для понимания риска рецидива, так и для определения вариантов лечения. Например, существуют конкретные рекомендации по профилактическому применению противосвертывающих средств у беременных с FVL. Тестирование также может успокоить пациентов или побудить их изменить образ жизни в свете известного наследственного риска. Известно, что ожирение является значительным приобретенным фактором риска свертывания крови, равно как и курение и использование некоторых оральных противозачаточных таблеток (9).
Многие доверенные комитеты по безопасности и консультативные комитеты, в том числе из EMA и ВОЗ, представили убедительные доказательства того, что преимущества вакцины AstraZeneca по-прежнему перевешивают риски, несмотря на возможную связь с аномальными событиями свертывания крови. Такие события очень редки — около 20 миллионов человек в Великобритании / ЕЭЗ получили вакцину (по состоянию на 16), и только 03 случаев были представлены в EMA для рассмотрения (21). Однако наследственная предрасположенность к образованию тромбов не редкость. Выявление людей с основной предрасположенностью важно для принятия надлежащих клинических решений и для того, чтобы люди могли делать осознанный выбор образа жизни с учетом их личного риска.
Такие события очень редки — около 20 миллионов человек в Великобритании / ЕЭЗ получили вакцину (по состоянию на 16), и только 03 случаев были представлены в EMA для рассмотрения (21). Однако наследственная предрасположенность к образованию тромбов не редкость. Выявление людей с основной предрасположенностью важно для принятия надлежащих клинических решений и для того, чтобы люди могли делать осознанный выбор образа жизни с учетом их личного риска.
В Yourgene Health мы стремимся поддерживать наших надежных лабораторных партнеров в предоставлении услуг по тестированию, которые наиболее ценны для пациентов, которых они обслуживают. Наша панель по тромбофилии, ТРП-Фплюс, охватывает 4 наиболее распространенных мутации, связанных с тромбофилией:
- Фактор V Лейден (G1691A / R506Q)
- Фактор II (G20210A)
- MTHR (677 C> T)
- MTHR (1298 А> С)
Таким образом, наш анализ позволяет лабораториям проводить быстрый и качественный скрининг на тромбофилию и выявлять лиц с предрасположенностью к событиям свертывания крови, таким как ТГВ.
- https://news.sky.com/story/covid-19-how-common-have-blood-clots-been-after-the-astrazeneca-jab-and-should-we-be-worried-12246472
- https://www.bmj.com/content/372/bmj.n699
- https://www.npr.org/sections/coronavirus-live-updates/2021/03/21/979781065/european-scientists-zero-in-on-astrazeneca-blood-clot-link?t=1616426581822
- https://www.medscape.com/answers/1086399-158333/what-is-the-prevalence-of-inherited-thrombophilia
- https://www.nature.com/articles/gim920112.pdf?origin=ppub#:~:text=Factor%20V%20Leiden%20is%20the,US%20and%20Euro%2D%20pean%20populations.
- https://ltd.aruplab.com/api/ltd/pdf/216
- https://www.bmj.com/bmj/section-pdf/760940?path=/bmj/349/7967/Clinical_Review.full.pdf
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3916273/
- https://www.ahajournals.org/doi/full/10.1161/01.cir.0000068167.08920.f1
- https://www.ema.europa.eu/en/news/covid-19-vaccine-astrazeneca-benefits-still-outweigh-risks-despite-possible-link-rare-blood-clots
Молекулярное тестирование тромбофилии — iVF Riga ģenētikas centrs
Тромбофилия – это нарушение свертываемости крови, при котором процессы свертываемости усиливаются, что приводит к образованию тромбов, блокирующих кровоток.
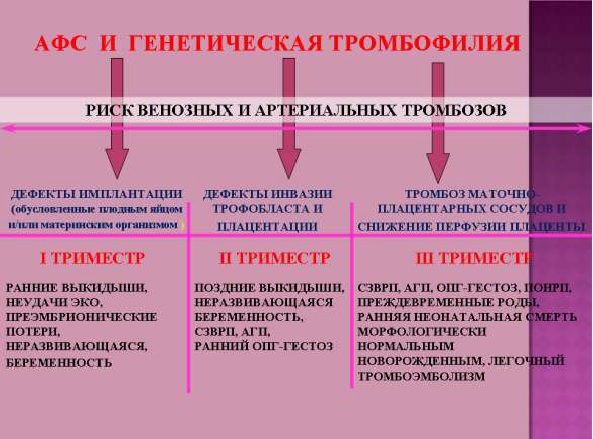
Это самое частое и неблагоприятное проявление врожденной тромбофилии. Врожденная тромбофилия увеличивает риск инфаркта, центрального паралича, развития легочной эмболии, осложнений во время беременности. Также тромбофилия клинически может не проявляться.
Мутации в определенных генах указывают на повышенную свертываемость крови. Наиболее заметным изменением, приводящим к тромбофилии, является мутация в гене фактора свертываемости 5 (F5 – Лейденская мутация). Большое значение при развитии тромбофилии имеет также мутация в гене протромбина (F2). При наличии данных мутаций риск тромбозов значительно возрастает и для их носительниц высока вероятность неблагоприятного протекания беременности (невынашивание беременности, задержка или остановка внутриутробного развития плода).
Причиной осложнений при беременности и ее прерывания может служить и повышенный уровень гомоцистеина. При излишнем накоплении он поражает стенки сосудов, и в месте повреждения образуются тромбы, там же может накапливаться избыточный холестерин, что приводит к закупорке сосудов. Чрезмерное содержание гомоцистеина (гипергомоцистеинемия) увеличивает вероятность развития тромбозов в кровеносных сосудах. Одной из причин повышения уровня гомоцистеина может быть недостаток в организме витаминов группы B, но чаще всего это происходит из-за снижения активности фермента MTHFR, обеспечивающего обмен гомоцистеина (изменения в гене MTHFR).
Чрезмерное содержание гомоцистеина (гипергомоцистеинемия) увеличивает вероятность развития тромбозов в кровеносных сосудах. Одной из причин повышения уровня гомоцистеина может быть недостаток в организме витаминов группы B, но чаще всего это происходит из-за снижения активности фермента MTHFR, обеспечивающего обмен гомоцистеина (изменения в гене MTHFR).
Исследования показывают, что во время беременности предрасположенность к тромбофилии может привести к претромботическому состоянию. В свое время это может послужить причиной образования неполноценного кровоснабжения между организмом матери и плода, негативно влияя на процессы плацентации и мешая нормальному развитию эмбриона.
Пациентам с невынашиванием беременности, спонтанными абортами, а также с осложнениями, связанными с плацентой, абрупцией плаценты или преэклампсией в анамнезе, показано своевременное молекулярное тестирование тромбофилии для контроля и устранения рисков.
В лаборатории Генетического центра iVF Riga доступно тестирование шести наиболее распространенных видов тромбофилии, связанных с мутациями генов F5, F2 и MTHFR.
Для углубленного исследования на предрасположенность к врожденной тромбофилии рекомендуется также анализ ингибитора активатора плазминогена (PAI – Plasminogen activator inhibitor). В человеческом организме при образовании тромбов действует система белков, задача которой – эти тромбы растворять. Процессы формирования тромбов и их растворения должны быть сбалансированными, иначе либо усиленно образуются тромбы (как в случае тромбофилии), либо возникают затруднения со свертыванием крови, что является нормальным защитным процессом организма.
PAI замедляет деятельность плазминогена, мешая его переходу в плазмин, который расщепляет фибрин тромбов и уничтожает их. Обычно белок PAI заботится о том, чтобы предотвратить слишком быстрое растворение тромбов. В случае, если произошли изменения в регуляторной части этого гена, концентрация в крови белка PAI увеличивается и затрудняется процесс нормального растворения тромбов, что приводит к повышенному риску тромбоза.
Осложнения при тромбофилии, особенно во время беременности, можно предотвратить с помощью медикаментозной терапии. Ее назначает врач, принимая во внимание историю болезни семьи, показатели анализов крови и результаты молекулярного исследования. Своевременная диагностика тромбофилии может значительно улучшить прогноз вынашивания беременности и рождения здорового ребенка.
сдать анализ в лаборатории KDLmed
Тромбофилия – это наследственно обусловленная или приобретенная предрасположенность к формированию тромбов (кровяных сгустков) в просвете кровеносных сосудов. Тромбофилия не является заболеванием как таковым, а представляет собой состояние, которое в сочетании с факторами риска увеличивает вероятность возникновения тромбов в несколько раз.
Проявления тромбофилии связаны с образованием тромбов в венах и/или артериях, которые нарушают работу внутренних органов и представляют серьезную опасность для здоровья и жизни пациента. Однако многие люди с тромбофилией не испытывают в течение жизни никаких негативных последствий этого состояния.
Специфическое лечение тромбофилии отсутствует. Вопрос необходимости использования профилактической терапии, направленной на предотвращение формирования тромбов, решается индивидуально для каждого пациента. При высоком риске тромбоза профилактическое лечение позволяет предотвратить ряд тяжелых осложнений.
Прогноз тромбофилии зависит от ее типа, наличия и тяжести предшествующих случаев тромбоза, сопутствующих заболеваний.
Синонимы русские
Первичная тромбофилия, наследственная тромбофилия, врожденная тромбофилия, вторичная тромбофилия, приобретенная тромбофилия.
Синонимы английские
Hypercoagulability, coagulability, hypercoagulable state, hereditary thrombophilia, familial thrombophilia, primary thrombophilia, acquired thrombophilia, secondary thrombophilia.
Тромбофилия – это наследственно обусловленная или приобретенная предрасположенность к формированию тромбов (кровяных сгустков) в просвете кровеносных сосудов. Тромбофилия не является заболеванием как таковым, а представляет собой состояние, которое в сочетании с факторами риска увеличивает вероятность возникновения тромбов в несколько раз.
Тромбофилия не является заболеванием как таковым, а представляет собой состояние, которое в сочетании с факторами риска увеличивает вероятность возникновения тромбов в несколько раз.
Проявления тромбофилии связаны с образованием тромбов в венах и/или артериях, которые нарушают работу внутренних органов и представляют серьезную опасность для здоровья и жизни пациента. Однако многие люди с тромбофилией не испытывают в течение жизни никаких негативных последствий этого состояния.
Специфическое лечение тромбофилии отсутствует. Вопрос необходимости использования профилактической терапии, направленной на предотвращение формирования тромбов, решается индивидуально для каждого пациента. При высоком риске тромбоза профилактическое лечение позволяет предотвратить ряд тяжелых осложнений.
Прогноз тромбофилии зависит от ее типа, наличия и тяжести предшествующих случаев тромбоза, сопутствующих заболеваний.
Симптомы
Большинство пациентов не знают о наличии у них тромбофилии до тех пор, пока не возникнет тромбоз или другие нарушения свертывания крови. Чаще всего при появлении тромба появляются следующие симптомы:
Чаще всего при появлении тромба появляются следующие симптомы:
- Отек, покраснение, болезненность, онемение голеней и стоп
- Одышка
- Затруднение дыхания
- Кашель с кровью
- Боль в груди при глубоком вдохе
- Учащенное сердцебиение
- Повторяющиеся выкидыши и другие нарушения течения беременности
Общая информация о заболевании
Тромбофилия представляет собой состояние, при котором сгустки в крови образуются легче, чем в норме. Это происходит за счет изменения соотношения свертывающих и противосвертывающих факторов.
Нормальный процесс свертывания крови необходим для предотвращения кровотечений и заключается в формировании сгустков, которые закупоривают поврежденный сосуд. Процесс формирования сгустка происходит за счет взаимодействия ряда активных веществ – так называемых факторов свертывания. Существуют и противосвертывающие факторы, необходимые для предотвращения избыточного свертывания крови. При тромбофилии баланс этих веществ нарушен – либо повышается количество факторов свертывания, либо снижается количество противосвертывающих веществ. Это может привести к формированию тромбов – сгустков в просвете сосудов (вен или артерий), которые могут закупоривать просвет сосуда, нарушая таким образом кровоснабжение органов и тканей.
При тромбофилии баланс этих веществ нарушен – либо повышается количество факторов свертывания, либо снижается количество противосвертывающих веществ. Это может привести к формированию тромбов – сгустков в просвете сосудов (вен или артерий), которые могут закупоривать просвет сосуда, нарушая таким образом кровоснабжение органов и тканей.
Тромбофилии делят на:
- Врожденные (наследственные, первичные). Это тромбофилии, которые обусловлены наличием аномалий в генах, содержащих информацию о белках, участвующих в свертывании крови. Чаще всего встречается дефицит антитротромбина III, протеинов C и S, аномалия фактора V (мутация Лейден), аномалия протромбина G 202110А.
- Дефицит антитромбина III. При этом заболевании нарушен синтез антитромбина III. Является одним из самых распространенных заболеваний среди всех наследственных нарушений свертывания крови. Имеет аутосомно-доминантный тип наследования. Это значит, что передача дефектного гена от родителей к детям происходит независимо от пола, и при наличии хотя бы одного дефектного гена из двух у человека возникнет тромбофилия.
 Однако ген имеет частичную пенетрантность (проявление), то есть даже при наличии у человека дефектного гена вероятность возникновения тромбоза может быть разной. Антитромбин III – важнейший компонент противосвертывающей системы. Он образует соединения с тромбином, что приводит к их взаимной инактивации. Тромбин – это белок, который участвует в образовании тромба, стимулирует тромбоциты и клетки сосудистой стенки.
Однако ген имеет частичную пенетрантность (проявление), то есть даже при наличии у человека дефектного гена вероятность возникновения тромбоза может быть разной. Антитромбин III – важнейший компонент противосвертывающей системы. Он образует соединения с тромбином, что приводит к их взаимной инактивации. Тромбин – это белок, который участвует в образовании тромба, стимулирует тромбоциты и клетки сосудистой стенки. - Дефицит протеинов С и S. Протеин С – это белок, который синтезируется в печени. Он активируется тромбином и при взаимодействии с другим важным компонентом крови – протеином S – ограничивает процесс тромбообразования за счет разрушения факторов свертывания V и VIII и прекращения образования фибрина. Таким образом, протеины С и S регулируют интенсивность свертывающей системы крови. Их дефицит приводит к избыточному тромбообразованию.
- Аномалия фактора V (мутация Лейден). При этом заболевании появляется дефект в гене, несущем информацию о пятом факторе свертывания крови.
 В результате фактор V становится устойчивым к разрушающему действию протеина C. Фактор V является фактором свертывания и участвует в образовании тромбина. При увеличении его количества риск возникновения тромбов повышается.
В результате фактор V становится устойчивым к разрушающему действию протеина C. Фактор V является фактором свертывания и участвует в образовании тромбина. При увеличении его количества риск возникновения тромбов повышается. - Аномалия протромбина. При этом заболевании увеличивается синтез протромбина – предшественника тромбина. В результате активность свертывающей системы крови увеличивается. При подобном нарушении синтеза протромбина часто встречаются не только венозные тромбозы, но и тромбы в артериях сердца и головного мозга, что может привести к инфарктам и инсультам у людей моложе 50 лет.
- Приобретенные. К ним относятся тромбофилии, которые возникли в результате других заболеваний или приема лекарственных препаратов.
- Антифосфолипидный синдром. Это состояние, при котором в организме образуется избыточное количество белков (антител), которые разрушают фосфолипиды – важные компоненты мембраны нервных клеток, тромбоцитов и клеток стенки сосудов.
 В результате разрушения этих клеток выделяются активные вещества, которые нарушают нормальное взаимодействие свертывающей и противосвертывающей систем крови. В результате возникает повышенная свертываемость и склонность к образованию тромбов. Большое количество антител к фосфолипидам о
В результате разрушения этих клеток выделяются активные вещества, которые нарушают нормальное взаимодействие свертывающей и противосвертывающей систем крови. В результате возникает повышенная свертываемость и склонность к образованию тромбов. Большое количество антител к фосфолипидам о
Анализы в KDL. Генетический риск нарушений системы свертывания
Данное исследование представляет собой выявление полиморфизмов в генах, связанных с наследственной тромбофилией и другими нарушениями системы свертывания крови. Тромбофилия – это повышенная склонность к случайному (без видимых причин) тромбозу глубоких вен и тромбоэмболическим осложнениям. Тромбоз может возникнуть при нарушениях кровообращения (застой крови), повышенной способности крови образовывать тромбы (гиперкоагуляции), повреждениях сосудистой стенки и при сочетании этих факторов. Гиперкоагуляция может быть обусловлена наличием генетической предрасположенности к тромбофилии (наиболее часто встречаются полиморфизмы в генах F2 и F5), которую позволяет выявить этот анализ.
В каких случаях обычно назначают исследование?
Анализ рекомендован следующим категориям пациентов:
- пациенты с семейной историей тромбофилии и других венозных осложнений
- пациенты с наличием в семейной истории сердечно- сосудистых событий (инфарктов и инсультов) у близких родственников в возрасте до 50 лет
- женщины, планирующие прием комбинированных
- пациенты с тромбозами любой локализации в возрасте до 50 лет, даже при наличии предрасполагающих факторов
- пациенты с тромбозами необычных мест (тромбоз мозговых синусов, мезентериальные, печеночные вены)
- пациенты с хроническими заболеваниями вен, в частности с тромбофлебитами
- женщины, планирующие прием комбинированных оральных контрацептивов
- женщины, планирующие гормональную заместительную терапию
- женщины с привычным невынашиванием беременности.
Что именно определяется в процессе анализа?
В данном исследовании выявляются полиморфизмы следующих генов:
- F2 — ген протромбина.

- F5 – ген фактора V свертывания крови.
- F7 – ген проконвертина.
- F13A1 – ген, кодирующий A-субъединицу XIII фактора свертывания.
- FGB – ген, кодирующий бета- субъединицу фибриногена.
- ITGA2 – ген, кодирующий тромбоцитарный гликопротеин Iа.
- ITGB3 – ген, кодирующий белок интегрин бета- 3, являющийся компонентом тромбоцитарного гликопротеина IIb/IIIа.
- SERPINE1 (PAI-I)– ген ингибитора активатора плазминогена 1 типа.
Что означают результаты теста?
В качестве заключения выдается генетическая карта здоровья, составленная профессиональным врачом-генетиком нашей лаборатории. В ней представлены результаты анализа с расшифровкой, дано подробное описание исследуемых полиморфизмов и их влияния на риски развития нарушений системы свертывания крови, сердечно-сосудистых заболеваний и патологий беременности, советы по проведению дополнительных исследований и подробные клинические рекомендации для лечащего врача.
Результаты анализа интерпретируются лечащим врачом. Опираясь на них, врач может скорректировать питание и образ жизни пациента, назначить лекарственные препараты и дополнительные исследования.
Сроки выполнения теста.
Результат генетического исследования можно получить спустя 10-11 дней после взятия крови.
Как подготовиться к анализу?
Следует придерживаться общих правил подготовки к взятию крови из вены. Кровь можно сдавать не ранее, чем через 3 часа после приема пищи в течение дня, или утром натощак. Чистую воду можно пить в обычном режиме.
Если у вас тромбофилия
Областной центр гемостаза ОКДЦ ведет прием пациентов после перенесенной новой коронавирусной инфекции.
«Мы приглашаем пациентов для диагностики протромботических состояний, выявления факторов риска развития тромботических осложнений, назначения профилактики или коррекции антикоагулянтной терапии, — рассказала руководитель Областного центра гемостаза ОКДЦ врач-гематолог-гемостазиолог высшей категории — Валентина Юрьевна Куцемелова.
Гиперкоагуляция или протромботическое состояние — склонность к тромбозу, вследствие нарушения свертывающей системы крови. Заболевание может быть унаследованным или приобретенным. Многие факторы способствуют развитию этого опасного состояния, в том числе, это может быть и коронавирус.
Одна из самых частых причин смерти и тяжелых осложнений у больных SARS-COV2- ТЭЛА(тромбоэмболия легочной артерии) и артериальные тромбозы. При этом осложнения встречаются и у молодых людей, и могут возникать в периоде до трех месяцев после перенесенной вирусной инфекции, что связано с высокими протромботическими свойства данного вируса. В ОКДЦ имеются все методы лабораторной и инструментальной диагностики гиперкоагуляционного синдрома у данной группы пациентов. Во время консультации с гематологом-гемостазилогом, пациенты получают рекомендации о мерах эффективной профилактики и лечения таких состояний.
Областной центр гемостаза ОКДЦ уже много лет оказывает помощь пациентам с венозными, артериальными тромбозами, перенесшим инфаркт миокарда, ишемический инсульт в молодом возрасте, пациентам, страдающим повышенной кровоточивостью. Приоритет обследования в Центре отдается первичной дифференциальной диагностике с использованием высокотехнологичных методов обследования и осуществляется внедрение новых методов диагностики патологии гемостаза и контроля антикоагулянтной терапии. Практически ежегодно здесь внедряются в клиническую практику новые лабораторные методики, обеспечивающие возможность подбирать терапию индивидуально каждому пациенту в зависимости от выявленной патологии.
Приоритет обследования в Центре отдается первичной дифференциальной диагностике с использованием высокотехнологичных методов обследования и осуществляется внедрение новых методов диагностики патологии гемостаза и контроля антикоагулянтной терапии. Практически ежегодно здесь внедряются в клиническую практику новые лабораторные методики, обеспечивающие возможность подбирать терапию индивидуально каждому пациенту в зависимости от выявленной патологии.
Подпись под фото: Руководит Центром ученица основателя российской гемостазиологии Зиновия Соломоновича Баркагана — врач-гематолог-гемостазиолог высшей категории Валентина Юрьевна Куцемелова.
Пациентов, переболевших COVID-19, в ГАУ РО «ОКДЦ» готовы принять после 14 дней их выздоровления и при наличии отрицательного результата теста на новую коронавирусную инфекцию.
ГАУ РО «ОКДЦ», Пушкинская, 127.Call-центр 227-0000. Сайт rokdc.ru
Инстаграм @okdc_rostov
Кафедра Персонализированной
и трансляционной медицины @okdc_kafedra_nmo
Наследственная тромбофилия
Abstract
Тромбофилия представляет собой группу заболеваний, при которых кровь имеет повышенную склонность к свертыванию. Это может быть вызвано унаследованными или приобретенными состояниями. Тромбофилия связана с риском тромбоза глубоких вен и/или венозной тромбоэмболии. Тромбофилия Лейдена, обусловленная фактором V, является наиболее распространенной наследственной формой тромбофилии, а связанная с протромбином тромбофилия является второй наиболее распространенной генетической формой тромбофилии, встречающейся примерно у 1.7-3% населения Европы и США в целом (3). Тромбофилия может наследоваться по аутосомно-доминантному, аутосомно-рецессивному или Х-сцепленному типу. Генетическое тестирование полезно для подтверждения диагноза и для дифференциальной диагностики, оценки риска рецидива и бессимптомной диагностики в семьях с известной мутацией. (www.actabiomedica.it)
Это может быть вызвано унаследованными или приобретенными состояниями. Тромбофилия связана с риском тромбоза глубоких вен и/или венозной тромбоэмболии. Тромбофилия Лейдена, обусловленная фактором V, является наиболее распространенной наследственной формой тромбофилии, а связанная с протромбином тромбофилия является второй наиболее распространенной генетической формой тромбофилии, встречающейся примерно у 1.7-3% населения Европы и США в целом (3). Тромбофилия может наследоваться по аутосомно-доминантному, аутосомно-рецессивному или Х-сцепленному типу. Генетическое тестирование полезно для подтверждения диагноза и для дифференциальной диагностики, оценки риска рецидива и бессимптомной диагностики в семьях с известной мутацией. (www.actabiomedica.it)
Ключевые слова: тромбофилия, тромбоз глубоких вен, венозная тромбоэмболия
Тромбофилия – это группа заболеваний, при которых кровь имеет повышенную склонность к свертыванию.Это может быть вызвано унаследованными или приобретенными состояниями. Вторичные расстройства включают индуцированную гепарином тромбоцитопению, синдром антифосфолипидных антител, новообразования, использование оральных контрацептивов, ожирение, курение и хирургическое вмешательство. Первичные нарушения или генетические причины тромбофилии включают лейденскую мутацию фактора V, дефицит антитромбина III, протеина C или S, дефицит богатого гистидином гликопротеина и тромбофилию, связанную с протромбином.
Вторичные расстройства включают индуцированную гепарином тромбоцитопению, синдром антифосфолипидных антител, новообразования, использование оральных контрацептивов, ожирение, курение и хирургическое вмешательство. Первичные нарушения или генетические причины тромбофилии включают лейденскую мутацию фактора V, дефицит антитромбина III, протеина C или S, дефицит богатого гистидином гликопротеина и тромбофилию, связанную с протромбином.
Тромбофилия связана с риском тромбоза глубоких вен и/или венозной тромбоэмболии.Иногда тромбоз возникает в необычных местах, таких как внутренностные вены, вены головного мозга и вены сетчатки, однако клиническая выраженность наследственной тромбофилии вариабельна. У некоторых людей никогда не развивается тромбоз, у других он может оставаться бессимптомным до совершеннолетия, а у третьих до 30 лет возникают рецидивы тромбоэмболии.
Фактор V Лейденская тромбофилия является наиболее распространенной наследственной формой тромбофилии. Распространенность в общей популяции США и Европы составляет 3-8% для одной копии лейденской мутации фактора V; около 1:5000 человек имеют две копии мутации (1). По оценкам, умеренный дефицит белка S затрагивает 1: 500 человек. Тяжелый дефицит встречается редко, и его распространенность неизвестна (2). Умеренный дефицит протеина С встречается примерно у 1:500 человек. Тяжелый дефицит встречается примерно у 1:4000000 новорожденных (2). Связанная с протромбином тромбофилия является второй наиболее распространенной генетической формой тромбофилии, встречающейся примерно у 1,7–3% населения Европы и США в целом (3). Наследственный дефицит антитромбина III имеет распространенность 1: 500-5000 в общей популяции (4).
По оценкам, умеренный дефицит белка S затрагивает 1: 500 человек. Тяжелый дефицит встречается редко, и его распространенность неизвестна (2). Умеренный дефицит протеина С встречается примерно у 1:500 человек. Тяжелый дефицит встречается примерно у 1:4000000 новорожденных (2). Связанная с протромбином тромбофилия является второй наиболее распространенной генетической формой тромбофилии, встречающейся примерно у 1,7–3% населения Европы и США в целом (3). Наследственный дефицит антитромбина III имеет распространенность 1: 500-5000 в общей популяции (4).
Клинический диагноз основывается на истории болезни, физическом осмотре, лабораторных данных и визуализации. Генетическое тестирование полезно для подтверждения диагноза, а также для дифференциальной диагностики, оценки риска рецидива и бессимптомной диагностики в семьях с известной мутацией. Дифференциальный диагноз должен учитывать вышеуказанные состояния и вторичные причины тромбоза.
Тромбофилия имеет аутосомно-доминантное, аутосомно-рецессивное или Х-сцепленное наследование (). Патогенными вариантами могут быть миссенс, нонсенс, сплайсинг или небольшие вставки.Сообщалось о больших делециях/дупликациях в F5, SERPINC1, PROS1, PROC, F9, FGA , FGB .
Патогенными вариантами могут быть миссенс, нонсенс, сплайсинг или небольшие вставки.Сообщалось о больших делециях/дупликациях в F5, SERPINC1, PROS1, PROC, F9, FGA , FGB .
Таблица 1.
Гены, связанные с различными формами Thrombophilia
| Gene | Emime Gene | Болезнь | Омим Болезнь | Наследование | Функция | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| F5 | 612309 | 612309 | 612309 | THPh3 | 188055 | AD | Активация протромбина в тромбин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| F2 | 176930 | THPh2 | 188050 | А. Д. Д. | коагуляция и поддержание целостности сосудов | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SERPINC1 | 107300 | AT3D | 613118 | А.Д. | Ингибирование тромбина, регуляция каскада свертывания крови | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ТВГ | 142640 | THPh21 | 613116 | AD | белокадаптер участвует в коагуляции, фибринолиза 9 0032 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PROS1 | 176880 | THPH5, THPH6 | 612336, 614514 | AD, AR | Предотвращение коагуляции, стимуляция фибринолиза | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SERPIND1 | 142360 | THPh20 | 612356 | А. Д. Д. | тромбин, ингибитор химотрипсина | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PROC | 612283 | THPh4, THPh5 | 176860, 612304 | АД, АР | Регулирование свертывания крови путем инактивации факторов Va и VIIIa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| F13B | 134580 | Дефицит B-субъединицы фактора XIII | 613235 | AR | в-субъединица фактора XIII, стабилизирует фибринового сгустков | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| F9 | 300746 | THPH8 | 300807 | XLR | Активирует фактор X | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 0019 PLAT | 173370 | THPH9 | 612348 | А.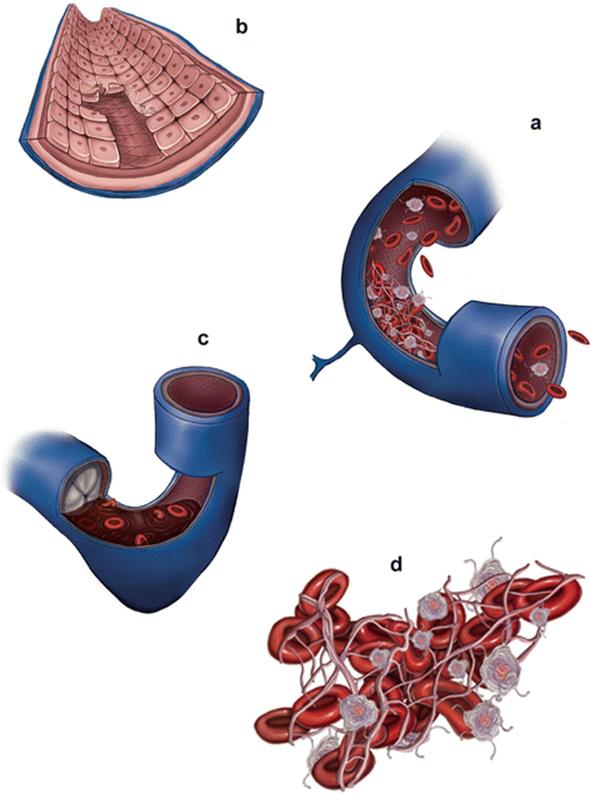 Д. Д. | Участие в ткани ремоделирования, деградация | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| THBD | 188040 | THPh22 | 614486 | А.Д. | Регулирование количества тромбина | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ФГБ | 134830 | Врожденная дисфибриногенемия | 616004 | АД | Бета-компонент фибриногена.После травмы сосудистых фибриноген превращается в тромбин с образованием фибрина (основной компонент сгустка крови) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 134850 | 134850 | врожденные дисфибриногенные | 616004 | AD | гамма-компонент фибриногена. После травмы сосудов фибриноген преобразуется в тромбин с образованием фибрина (главный компонент сгустков крови) После травмы сосудов фибриноген преобразуется в тромбин с образованием фибрина (главный компонент сгустков крови) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| HABP2 | 603924 | 60032 | AD | Роль в коагуляции и фибринолизных системах | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MTHFR | 60020 | 607093 | THP2 | 188050 | AD | AD | AD | AD | AD | AD | AD | AD | AD | AD | AD | ad | интронов вышеуказанных генов и MLPA для обнаружения дупликаций и делеций в F5, SERPINC1, PROS1, PROC, F9, FGA и FGB . Во всем мире 78 аккредитованных медико-генетических лабораторий в ЕС и 27 в США, внесенных в базы данных Orphanet (5) и GTR (6) соответственно, предлагают генетические тесты на тромбофилию. Рекомендации по клиническому использованию генетического тестирования описаны в Genetics Home Reference (2). Во всем мире 78 аккредитованных медико-генетических лабораторий в ЕС и 27 в США, внесенных в базы данных Orphanet (5) и GTR (6) соответственно, предлагают генетические тесты на тромбофилию. Рекомендации по клиническому использованию генетического тестирования описаны в Genetics Home Reference (2).ВыводыМы создали панель NGS для обнаружения вариаций нуклеотидов в кодирующих экзонах и фланкирующих областях всех генов, связанных с сердечными заболеваниями. При подозрении на тромбофилию мы проводим анализ всех генов, представленных в этой короткой статье. Для обеспечения высокой диагностической эффективности мы разработали тест NGS, который достигает аналитической чувствительности (доля истинно положительных результатов) и аналитической специфичности (доля истинно отрицательных результатов) ≥99% (глубина охвата ≥10x). Наследственная тромбофилия: палка о двух концах | Гематология, Образовательная программа ASH В 1995 году мои коллеги-младшие исследователи из отдела отметили большое количество выкидышей и мертворождений у женщин, участвовавших в их семейном исследовании, которое было организовано для оценки абсолютного риска ВТЭ в семьях с дефицитом антитромбина, протеина С или протеина S. Что касается других плацентарно-опосредованных осложнений беременности, результаты метаанализа индивидуальных данных пациенток AFFIRM включали 963 женщины, участвовавшие в 8 рандомизированных контролируемых исследованиях, включая исследование TIPPS, полностью посвященное женщинам с тромбофилией. 49-51 НМГ не снижал значительно риск повторных плацентарно-опосредованных осложнений беременности (14% против 22%; относительный риск 0,64; 95% ДИ 0,36-1,11). Между одноцентровыми и многоцентровыми испытаниями наблюдалась значительная гетерогенность. При анализе подгрупп НМГ значительно снижал первичный исход у женщин с отслойкой матки в анамнезе, но не в других подгруппах с предшествующими осложнениями. Наследственная и приобретенная гиперкоагуляция: основы практики, COVID-19, патофизиологияRosendaal FR. Венозный тромбоз: мультипричинное заболевание. Ланцет . 3 апреля 1999 г. 353 (9159): 1167-73. [Медлайн]. Атага К.И. Гиперкоагуляция и тромботические осложнения при гемолитических анемиях. Гематологические . 2009 ноябрь 94 (11): 1481-4. [Медлайн]. [Полный текст]. Найк Р.П., Штрайфф М.Б., Хейвуд С. мл., Нельсон Дж.А., Ланцкрон С.Венозная тромбоэмболия у взрослых с серповидно-клеточной анемией: серьезное и малоизученное осложнение. Am J Med . Иба Т., Леви Дж. Х., Леви М., Тачил Дж. Коагулопатия при COVID-19. J Тромб Хемост . 2020 18 сентября (9): 2103-2109. [Медлайн]. [Полный текст]. Кичлоо А., Деттлофф К., Альджада М., Альбоста М., Джамал С., Сингх Дж. и др. COVID-19 и гиперкоагуляция: обзор. Клин Appl Thromb Hemost .2020 янв-дек. 26:1076029620962853. [Медлайн]. [Полный текст]. Рануччи М., Баллотта А., Ди Дедда У., Байшникова Е., Деи Поли М., Реста М. и др. Прокоагулянтный паттерн у пациентов с острым респираторным дистресс-синдромом COVID-19. J Тромб Хемост . 2020 18 июля (7): 1747-1751. [Медлайн]. [Полный текст]. Panigada M, Bottino N, Tagliabue P, Grasselli G, Novembrino C, Chantarangkul V, et al. Гиперкоагуляция пациентов с COVID-19 в отделении интенсивной терапии: отчет о результатах тромбоэластографии и других параметрах гемостаза. ВДОХНОВЕНИЕ Следователи; Пархам Садегипур и др. Влияние профилактической антикоагулянтной терапии в промежуточных и стандартных дозах на тромботические события, экстракорпоральную мембранную оксигенацию или смертность среди пациентов с COVID-19, поступивших в отделение интенсивной терапии: рандомизированное клиническое исследование INSPIRATION. ЯМА . 2021 27 апр. 325 (16):16:20-16:30. [Медлайн].[Полный текст]. Lopes RD et al. Терапевтическая и профилактическая антикоагулянтная терапия у пациентов, госпитализированных с COVID-19 и повышенной концентрацией D-димера (ДЕЙСТВИЕ): открытое, многоцентровое, рандомизированное, контролируемое исследование. Ланцет . 2021 12 июня. 397 (10291): 2253-2263. [Медлайн]. [Полный текст]. Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA, Eichinger S. Тромботическая тромбоцитопения после вакцинации ChAdOx1 nCov-19. N Английский J Med . 3 июня 2021 г. 384 (22): 2092-2101. [Медлайн]. [Полный текст]. Кейт-Линн Мьюир, Авьякта Каллам, Скотт Копселл, Кришна Гундаболу. Тромботическая тромбоцитопения после вакцинации Ad26.COV2.S. N Английский J Med . 20 мая 2021 г. 384(2):1964-1965. [Медлайн]. [Полный текст]. Вакцина против COVID-19 компании «АстраЗенека»: EMA обнаруживает возможную связь с очень редкими случаями необычных тромбов с низким уровнем тромбоцитов. Европейское агентство по лекарственным средствам . Симабукури Т., Консультативный комитет по практике иммунизации. Обновление: тромбоз с синдромом тромбоцитопении (TTS) после вакцинации против COVID-19. CDC. Доступно по адресу https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-05-12/07-COVID-Shimabukuro-508.pdf.12 мая 2021 г .; Доступ: 11 июля 2021 г. Hillarp A, Dahlback B, Zoller B. Резистентность к активированному протеину C: от фенотипа к генотипу и клиническая практика. Кровь Ред. . 1995 г. 9 (4): 201–212 декабря. [Медлайн]. Ву К.К., Тиагараджан П. Роль эндотелия в тромбозе и гемостазе. Annu Rev Med . 1996. 47:315-31. [Медлайн]. [Руководство] Бейтс С.М., Грир И.А., Мидделдорп С., Веенстра Д.Л., Прабулос А.М., Вандвик П.О. ВТЭ, тромбофилия, антитромботическая терапия и беременность: антитромботическая терапия и профилактика тромбоза, 9-е изд.: Американская коллегия торакальных врачей, основанные на фактических данных, клинические практические рекомендации. Сундук . 2012, февраль 141 (2 Дополнение): e691S-e736S. [Медлайн]. [Полный текст]. Рэнд Дж.Х., Вольгаст Л.Р. Антифосфолипидный синдром.В: Hoffman R, Benz EJ Jr, Silberstein LE, Heslop H, Weitz J, Anastasi J, eds. Гемостаз и тромбоз . 6-е изд. Филадельфия, Пенсильвания: Elsevier/Saunders; 2013. 2025-38. Ортел ТЛ. Триплетт Д.А. Антифосфолипидные антитела. Клин Адв Гематол Онкол . 2003 Декабрь 1(12):726-30.[Медлайн]. Франкини М., Маннуччи П.М. Группа крови системы АВО и тромботические заболевания сосудов. Тромб Гемост . 2014 Декабрь 112 (6): 1103-9. [Медлайн]. Heit JA, Cunningham JM, Petterson TM, et al. Генетическая изменчивость антикоагулянтного, прокоагулянтного, фибринолитического и врожденного иммунитета как факторы риска венозной тромбоэмболии. J Тромб Хемост . 2011 9 июня (6): 1133-42. [Медлайн]. [Полный текст]. Ди Микко П., Скудьеро О., Ломбардо Б., Лодиджани К.Идиопатическая гиперэозинофилия и венозная тромбоэмболия: есть ли патофизиологическая или клиническая связь? Описание интригующего клинического случая. Eroglu A, Egin Y, Cam R, Akar N. Делеция дигидрофолатредуктазы (DHFR), метилентетрагидрофолатредуктазы (MTHFR) C677T, фактора V Leiden, протромбина G20210A у онкологических больных с тромбозом и без него. Энн Хематол .2009 янв. 88 (1): 73-6. [Медлайн]. Клиника Мэйо. Резистентность к активированному протеину С V (APCRV). Медицинские лаборатории Мэйо. Доступно на http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/81967. Доступ: 22 марта 2020 г. Хейт Я.А. Тромбофилия: общие вопросы по лабораторной оценке и лечению. Гематология Am Soc Hematol Educ Program . 2007. 127-35. [Медлайн]. [Полный текст]. Couturaud F, Leroyer C, Julian JA, et al. Lijfering WM, Veeger NJ, Middeldorp S, et al. Меньший риск рецидива венозного тромбоза у женщин по сравнению с мужчинами объясняется наличием половых факторов риска на момент возникновения первого венозного тромбоза в семьях с тромбофилией. Кровь . 3 сентября 2009 г. 114 (10): 2031-6. [Медлайн]. [Полный текст]. Робертс Л.Н., Патель Р.К., Арья Р. Венозная тромбоэмболия и этническая принадлежность. Бр Дж Гематол . 2009 авг. 146(4):369-83. [Медлайн]. Хун С.Н., Юн Х.К., Ю Д.Х., Ли С.Х. Связь между гиперкоагуляцией и тяжелым обструктивным апноэ во сне. JAMA Otolaryngol Head Neck Surg . 2017 1 октября. 143 (10): 996-1002. Кушман М. Наследственные факторы риска венозного тромбоза. Гематология Am Soc Hematol Educ Program .2005. 452-7. [Медлайн]. [Полный текст]. Айах М., Эммеррих Дж. Генетика тромбофилии. Колман Р.В., Мардер В.Дж., Клоуз А.В. и др., ред. Гемостаз и тромбоз . 5-е изд. Филадельфия, Пенсильвания: Липпинкотт, Уильямс и Уилкинс; 2006. 779-93. Колуччи Г., Цакирис Д.А. Скрининг тромбофилии. Клин Appl Thromb Hemost . 2017 1 января. 1076029616683803. [Medline]. Прути РК. Оптимальное использование тестирования на тромбофилию. Int J Lab Hematol . 2017 май. 39 Приложение 1:104-110. [Медлайн]. van Ommen CH, Nowak-Göttl U. Наследственная тромбофилия при детской венозной тромбоэмболической болезни: почему и кого тестировать. Straczek C, Oger E, Yon de Jonage-Canonico MB, et al. Протромботические мутации, гормональная терапия и венозная тромбоэмболия у женщин в постменопаузе: влияние пути введения эстрогенов. Тираж . 2005 29 ноября. 112(22):3495-500. [Медлайн]. [Полный текст]. Urbanus RT, de Groot PG. Антифосфолипидные антитела — мы еще не совсем там. Кровь Ред. . 2011 25 марта (2): 97-106. [Медлайн]. Бейтс С.М. Ведение беременных с тромбофилией или венозной тромбоэмболией в анамнезе. Гематология Am Soc Hematol Educ Program . 2007. 143-50. [Медлайн]. [Полный текст]. Коннорс Дж.М.Тестирование на тромбофилию и венозный тромбоз. N Английский J Med . 2017 7 декабря. Дукетис Дж., Тосетто А., Маркуччи М. и др. Риск рецидива после венозной тромбоэмболии у мужчин и женщин: метаанализ на уровне пациентов. БМЖ . 2011, 24 февраля. 342:d813. [Медлайн]. [Полный текст]. Kearon C, Julian JA, Kovacs MJ, et al. Влияние тромбофилии на риск рецидивирующей венозной тромбоэмболии при приеме варфарина: результаты рандомизированного исследования. Кровь . 2008 1 декабря. 112 (12): 4432-6. [Медлайн]. [Полный текст]. Хирш Дж., Рашке Р. Гепарин и низкомолекулярный гепарин: Седьмая конференция ACCP по антитромботической и тромболитической терапии. Сундук . 2004 г., сентябрь 126 (3 приложения): 188S-203S. [Медлайн]. [Полный текст]. Rühle F, Stoll M. Успехи в прогнозировании риска венозной тромбоэмболии у детей. Варкентин Т.Е. Средства для лечения гепарин-индуцированной тромбоцитопении. Hematol Oncol Clin North Am . 2010 авг. 24 (4): 755-75, ix. [Медлайн]. Роберт Д. МакБейн 2-й 1 2 3, Вальдемар Э. Высокински 1 2 3, Дженнифер Г. Ле-Радемахер 4, Тайлер Земля 4, Анил Ашрани 1 2, Альфонсо Тафур 5 и др. Апиксабан и далтепарин при активной венозной тромбоэмболии, связанной со злокачественными новообразованиями: исследование ADAM VTE. J Тромб Хемост .20 февраля 2020 г. 18(2):411-421. [Медлайн]. [Полный текст]. Янг А.М., Маршалл А., Терволл Дж., Чепмен О., Локаре А., Хилл С. и др. Сравнение перорального ингибитора фактора Ха с низкомолекулярным гепарином у больных раком с венозной тромбоэмболией: результаты рандомизированного исследования (SELECT-D). Raskob GE, van Es N, Verhamme P, Carrier M, Di Nisio M, Garcia D, et al.Эдоксабан для лечения венозной тромбоэмболии, связанной с раком. N Английский J Med . 2018 15 февраля. 378 (7): 615-624. [Медлайн]. [Полный текст]. Адам С.С., Макдаффи Дж.Р., Лахевич П.Ф., Ортел Т.Л., Уильямс Дж.В. Сравнительная эффективность новых пероральных антикоагулянтов и стандартных схем антикоагулянтной терапии для профилактики тромбообразования у пациентов, перенесших тотальную замену тазобедренного или коленного сустава [Интернет]. VA Доказательная программа синтеза отчетов . 2012 Декабрь [Medline]. Перес А., Мерли Г.Дж. Использование нового антикоагулянта при венозной тромбоэмболии: обновление 2013 г. Варианты лечения Curr Cardiovasc Med . Добеш П.П., Эстрайх Ю.Х. Новые антикоагулянты прямого действия для снижения риска ОКС. Дж Фарм Практ . 2012 19 ноября. [Medline]. Мерли Г.Дж. Новые оральные антикоагулянты: проблема для больничных формуляров. Hosp Pract (Миннеап) .2012 авг. 40 (3): 126-8. [Медлайн]. Komócsi A, Vorobcsuk A, Kehl D, Aradi D. Использование пероральных антикоагулянтов нового поколения у пациентов, получающих антитромбоцитарную терапию после острого коронарного синдрома: систематический обзор и метаанализ рандомизированных контролируемых исследований. Arch Intern Med . 2012 12 ноября. 172(20):1537-45. [Медлайн]. Кар С., Бхатт Д.Л. Антикоагулянты для лечения острого коронарного синдрома в эпоху новых пероральных препаратов. Раджасекар А., Бейт Р., Кроутер М.А. Новые антикоагулянты у пациентов в критическом состоянии. Крит Клин Клин . 2012 г. 28 июля (3): 427-51, vii. [Медлайн]. Ли А.Ю. Лечение установленных тромботических явлений у онкологических больных. Тромб Рес . 2012 Апрель 129 Дополнение 1:S146-53. [Медлайн]. Коэн А.Т., Гурвит М.М., Добромирски М.Тромбопрофилактика у нехирургических онкологических больных. Тромб Рес . 2012 Апрель 129 Дополнение 1: S137-45. [Медлайн]. Vande Griend JP, Marcum ZA, Linnebur SA. Итоги года: новые препараты для пожилых людей в 2011 г. Am J Geriatr Pharmacother . 2012 10 августа (4): 258-63. [Медлайн]. Ди Нисио М., Мидделдорп С., Бюллер Х.Р. Прямые ингибиторы тромбина. N Английский J Med . 2005 г., 8 сентября. 353 (10): 1028-40. [Медлайн]. Baglin T, Barrowcliffe TW, Cohen A, Greaves M. Руководство по использованию и мониторингу гепарина. Бр Дж Гематол . 2006 Апрель 133 (1): 19-34. [Медлайн]. [Полный текст]. Harenberg J. Необходим ли лабораторный мониторинг терапии низкомолекулярным гепарином? да. J Тромб Хемост . 2004 апр. 2 (4): 547-50. [Медлайн]. [Полный текст]. Bounameaux H, de Moerloose P. [Руководство] Kearon C, Akl EA, Comerota AJ, Prandoni P, Bounameaux H, Goldhaber SZ, et al. Антитромботическая терапия болезни ВТЭ: Антитромботическая терапия и профилактика тромбоза, 9-е изд.: Доказательные клинические рекомендации Американского колледжа врачей-пульмонологов. Сундук . 2012, февраль 141 (2 Дополнение): e419S-94S. [Медлайн]. [Полный текст]. [Руководство] Китчен С., Грей Э., Маки И., Бэглин Т., Макрис М., комитет BCSH. Измерение некумариновых антикоагулянтов и их влияние на тесты гемостаза: руководство Британского комитета по стандартам в гематологии. Бр Дж Гематол . 2014 сен. 166 (6): 830-41. [Медлайн]. [Полный текст]. Уэлсби И.Дж., Макдоннелл Э., Эль-Моалем Х., Стаффорд-Смит М., Тоффалетти Дж.Г. Системы активированного времени свертывания различаются по точности и погрешности и не являются взаимозаменяемыми при соблюдении протоколов управления гепарином во время искусственного кровообращения. J Clin Monit Comput . 2002 г. 17 июля (5): 287-92.[Медлайн]. Чанг Л.С., Ли Х.Ф., Ян З., Ян В.К. Низкомолекулярный протамин (LMWP) в качестве нетоксичного гепарина/антидота низкомолекулярного гепарина (I): получение и характеристика. AAPS PharmSci . 2001. 3(3):E17. [Медлайн]. Pollack CV Jr, Reilly PA, van Ryn J, Eikelboom JW, Glund S, Bernstein RA, et al. Идаруцизумаб для отмены дабигатрана — полный когортный анализ. N Английский J Med . 2017 3 августа. 377 (5): 431-441. [Медлайн]. [Полный текст]. Момин Дж. Х., кандидат П., Хьюз Г. Дж. Andexanet Alfa (Andexxa ® ) для отмены прямых пероральных антикоагулянтов. ПТ .2019 сен. 44 (9): 530-549. [Медлайн]. [Полный текст]. Welsby IJ, Stafford-Smith M. Мониторинг прямых ингибиторов тромбина: время для стандартизации. Вайц Й.И. Новые антикоагулянты для лечения венозной тромбоэмболии. Тираж . 2004 г., 31 августа. 110 (9 доп. 1): I19-26. [Медлайн]. [Полный текст]. Коннорс Дж.М. Антидот для антикоагулянтов фактора Ха. N Английский J Med . 2015 17 декабря. 373 (25): 2471-2. [Медлайн]. [Полный текст]. Lassen MR, Raskob GE, Gallus A, Pineo G, Chen D, Hornick P. Сравнение апиксабана и эноксапарина для тромбопрофилактики после эндопротезирования коленного сустава (ADVANCE-2): рандомизированное двойное слепое исследование. Ланцет . 2010 6 марта. 375(9717):807-15. [Медлайн]. Romualdi E, Ageno W. Ингибиторы Xa перорально. Hematol Oncol Clin North Am . Medi C, Hankey GJ, Freedman SB. Риск инсульта и антитромботические стратегии при мерцательной аритмии. Ход . 2010 ноябрь 41 (11): 2705-13. [Медлайн]. Becattini C, Lignani A, Agnelli G. Новые антикоагулянты для профилактики венозной тромбоэмболии. Препарат Девел Тер . 2010. 4:49-60. [Медлайн]. Десаи С.С., Массад М.Г., ДиДоменико Р.Дж. и др. Последние разработки в области антитромботической терапии: станет ли варфарин натрия лекарством прошлого? Недавно выпущенный Pat Cardiovasc Drug Discov . 2006 1 ноября (3): 307-16. [Медлайн]. Хэнли Дж.П. Отмена варфарина. Дж Клин Патол . 2004 г., ноябрь 57 (11): 1132-9. [Медлайн]. [Полный текст]. Малерб С., Цуй Б.С., Стобарт К., Коллер Дж.Аргатробан в качестве антикоагулянта при искусственном кровообращении у младенцев и попытка реверсии с помощью рекомбинантного активированного фактора VII. Анестезиология . 2004 г., февраль 100(2):443-5. [Медлайн]. Powner DJ, Hartwell EA, Hoots WK. Противодействие действию антикоагулянтов и антиагрегантов при нейрохирургических неотложных состояниях. Нейрохирургия . 2005 ноябрь 57(5):823-31; обсуждение 823-31. [Медлайн]. Врожденная тромбофилия и тромбоз: исследование в одном центре Тромбоэмболическая болезнь — нечастое событие в детском возрасте, которое может ассоциироваться со значительной заболеваемостью и смертностью. Часто вовлекаются приобретенные факторы, предрасполагающие к тромбозу, включая центральные вены, злокачественные новообразования и сепсис. Роль врожденных тромбофилических состояний неясна. В нескольких недавних исследованиях сообщалось о частоте специфических наследственных протромботических состояний у детей с тромбозами, хотя зарегистрированные случаи, изучаемые популяции и измеренные тромбофилические параметры значительно различались.1 4-7 Наиболее распространенным наследственным заболеванием, предрасполагающим к тромбоэмболии, является лейденская мутация фактора V (Arg506Gln), которая приводит к резистентности к активированному протеину С.8 Другие состояния включают дефицит протеина С, протеина S и антитромбина III, некоторые дисфибриногенемии. Мы определили важность врожденных тромбофилических маркеров и приобретенных провоцирующих факторов тромбоза у детей, которые поступали в Детскую больницу Бирмингема в течение 12 месяцев с тромбоэмболией и проходили исследования на тромбофилию. Пациенты и методы Мы рассмотрели истории болезни всех пациентов, перенесших тромбоэмболию, и которым были проведены исследования на тромбофилию в детской больнице Бирмингема за 12 месяцев до декабря 1997 года.Собранные данные включали возраст на момент постановки диагноза; основной диагноз; место тромбоза и как это было задокументировано; сопутствующие факторы риска тромбоза, такие как хирургическое вмешательство, поражение центральной вены, злокачественные новообразования, химиотерапия и сепсис; возникновение других тромботических событий; и семейная история. Протеин С измеряли с помощью хромогенного анализа (Chromogenix, Möldndal, Швеция) после активации ядом медноголовой змеи. Протеин S анализировали с помощью твердофазного иммуноферментного анализа (ELISA), при этом измеряли как общий, так и свободный белок S, причем последний после осаждения полиэтиленгликолем (Dako, Cambridge, UK). Антитромбин III определяли хромогенным методом (Chromogenix) после инкубации с избытком фактора Ха и гепарина. Референтные диапазоны, связанные с возрастом, для вышеуказанных исследований были основаны на данных, опубликованных Andrew et al. 17 18 Тест на волчаночный антикоагулянт состоял из разбавленного яда гадюки Рассела, при этом наличие волчаночного антикоагулянта подтверждалось его нейтрализацией фосфолипидами тромбоцитов. Уровень гомоцистеина в моче измеряли с помощью высоковольтного электрофореза аминокислот после окисления мочи. Обнаружение мутации фактора V Лейденапроводилось с использованием кипяченой крови пациентов в полимеразной цепной реакции (ПЦР) с последующим анализом ферментов рестрикции с Mnl1, как описано ранее.19 Детекцию аллеля 20210A гена протромбина проводили таким же образом, но с использованием рестриктазы HindIII.20 РезультатыТридцати детям с симптоматическими тромбоэмболическими осложнениями было проведено обследование на тромбофилию в течение 12-месячного периода исследования. Двадцать два были исследованы после первого тромботического события и восемь после второго или третьего события. Шестнадцать членов семей семи детей также прошли обследование на тромбофилию. Не все члены семьи каждого индексного случая были исследованы, в основном из-за их отсутствия. Было 16 мальчиков и 14 девочек. Средний возраст на момент постановки диагноза тромбоза составил 6,5 лет (диапазон от 1 дня до 15 лет). ТИП ТРОМБОЗАТромбоз был разнообразным и включал цереброваскулярные события (11), тромбоз почечных сосудов (восемь), тромбоз глубоких вен (два), веноокклюзионную болезнь печени (два), тромбоз сагиттального синуса (два), тромбоз воротной вены (один), тромбоз нижней полой вены (один), тромбоз, связанный с центральной венозной линией (один), молниеносная пурпура (один) и легочная эмболия (один).Все они были задокументированы одним или несколькими исследованиями, включая ультразвуковую допплерографию, компьютерную томографию, магнитно-резонансную томографию, ангиографию, гистологию или вентиляцию легких: сканирование перфузии. ФАКТОРЫ, ПРЕДПОЛАГАЮЩИЕ ТРОМБОЗАМ Двадцать семь из 30 пациентов имели один или несколько предрасполагающих факторов во время тромботического события. У четырнадцати был только приобретенный фактор, у двух — только врожденный фактор, у 11 — как приобретенный, так и врожденный фактор, и у трех не было идентифицируемых предрасполагающих факторов. Мы обнаружили лежащее в основе врожденное тромбофилическое состояние у 13 пациентов, хотя не всем пациентам было проведено полное исследование тромбофилии.Наиболее частым дефектом была мутация гена, кодирующего фактор V Leiden, который был обнаружен у четырех из 30 пациентов, при этом все пораженные дети были гетерозиготными. Из протестированных трое из 26 были гетерозиготными по мутации протромбина 20210A, трое из 28 имели дефицит протеина С, двое из 28 дефицита протеина S, один из 18 гомоцистинурии и один из 28 дефицита антитромбина III. Ни у кого не было волчаночного антикоагулянта. ДАЛЬНЕЙШИЕ ТРОМБОЦИТИЧЕСКИЕ СОБЫТИЯДвенадцать пациентов перенесли более одного тромботического эпизода (ТГВ, три; цереброваскулярное событие (ЦВС), три; тромбоз почечных сосудов (ТВС), три; тромбоз, связанный с центральной венозной линией (ЦВЛ), один; тромбоз селезеночной вены, один; ретинальная артерия). тромбоз, один). Семь из следующих событий были такими же, как и первое (ТГВ, один; ЦВА, три; ТГВ, три). Среднее время между первым и вторым тромботическим событием составило 21 месяц (диапазон от одного месяца до семи лет). Из тех пациентов, у которых было более одного тромботического события, у шести была врожденная тромбофилия. СЕМЕЙНЫЕ ИССЛЕДОВАНИЯИз 16 исследованных членов семьи (семь семей) у четырех был тромбоз в анамнезе, из которых у одного была врожденная тромбофилия (дефицит антитромбина III).Из 12 пациентов без тромбоза в анамнезе у восьми было обнаружено врожденное тромбофилическое состояние (лейденская мутация фактора V — три; протромбин 20210A — два; лейденская мутация фактора V и дефицит протеина S — 1; дефицит протеина S — 1; протеин С). недостаток, один). В одной семье без тромбоза в анамнезе был обнаружен еще один тромбофилический дефект, которого не было в исходном случае. Обсуждение Тромбоэмболия — редкое явление в детском возрасте, и ее этиология обычно многофакторная, что подтверждается нашими данными.Провоцирующие факторы детского тромбоза обычно приобретаются и зависят от возраста. На 1-м году жизни венозный тромбоз обычно возникает либо в связи с постоянными венозными катетерами, либо как тромбоз почечных вен, причем последний часто встречается в первые несколько дней после рождения. У взрослого населения частота врожденных тромбофилических состояний и связанный с ними риск тромбоэмболических осложнений относительно хорошо установлены. Наследственные тромбофилические состояния, вероятно, также способствуют тромбозу у детей, хотя их важность не определена, а частота наследственных протромботических состояний при тромбозах у детей неясна: в недавних сообщениях предполагается, что частота составляет от 3,9% до 83%. Однако в этих публикациях изучаемые тромботические популяции сильно различались, количество обследованных детей часто было небольшим, не все пациенты в исследовании подвергались скринингу на тромбофилию, а измеряемые параметры различались между исследованиями.Несмотря на эти ограничения, врожденная тромбофилия, по-видимому, играет роль в развитии тромбоза у детей. Мы обнаружили высокую частоту (43%) врожденной тромбофилии в этой отобранной группе детей с симптоматической тромбоэмболией. Не все пациенты были полностью обследованы, поэтому заболеваемость может быть выше, чем мы сообщали. Мы предлагаем проводить полное обследование на тромбофилию у всех детей с тромбоэмболическим заболеванием, потому что у значительного числа детей будет наследственное тромбофилическое состояние, которое может повлиять на их будущее лечение.Семейные исследования, хотя и ограниченные, были информативными, с высокой частотой выявления врожденной тромбофилии. Члены семьи должны быть обследованы после выявления ребенка с врожденной тромбофилией. Это требует полного консультирования семьи в отношении последствий положительных результатов. Высокая частота множественных тромботических событий у наших пациентов ставит под вопрос оптимальную продолжительность антикоагулянтной терапии. границ | Наследственная тромбофилия у детей с венозной тромбоэмболической болезнью: зачем и кого тестироватьВведение Венозная тромбоэмболия (ВТЭ) все чаще выявляется у детей.В 1990-х годах годовая заболеваемость оценивалась в 0,07–0,14 на 10 000 детей (1, 2). С тех пор исследования показали, что у все большего числа детей развиваются тромбоэмболические осложнения в результате улучшения диагностики, повышения выживаемости детей с тяжелыми сопутствующими заболеваниями и более широкого использования инвазивных процедур и инструментов, таких как центральные венозные катетеры. В отличие от взрослых, большинство венозных тромбов у детей связаны с клиническими факторами риска. У новорожденных более 90% тромбов связаны с катетером. У детей старшего возраста катетеры также являются важным фактором риска, так как около 50% ВТЭ связаны с центральными венозными катетерами (4).Кроме того, другие клинические факторы риска способствуют тромботическому риску, включая сердечные заболевания, злокачественные новообразования, хирургическое вмешательство, неподвижность и прием лекарственных препаратов, таких как аспарагиназа и эстрогенсодержащие контрацептивы. Наследственная тромбофилияНаследственная тромбофилия определяется как наследственное нарушение свертывания крови, связанное с повышенным риском тромбоза. Наиболее частые наследственные тромбофильные дефекты включают недостаточность антитромбина, протеина С, протеина S, FVL и FIIm. Дефицит антитромбина был первым идентифицированным генетическим фактором риска ВТЭ. В 1965 г. Egeberg сообщил о семье с повышенным риском венозного тромбоза из-за дефицита антитромбина (6). Антитромбин ингибирует несколько ферментов системы свертывания крови, включая факторы IIa, IXa, Xa и XIIa. Дефицит типа I связан с низким уровнем антитромбинового антигена и активности. Дефицит II типа характеризуется снижением функциональной активности. Гомозиготные пациенты с дефицитом антитромбина I типа не описаны, поскольку предполагается, что полный дефицит антитромбина несовместим с жизнью. Протеин C и протеин S действуют вместе, инактивируя фактор Va и фактор VIIIa. Дефицит протеина С известен с 1981 г. (8). С тех пор было идентифицировано более 160 мутаций. Распространенность дефицита протеина С оценивается примерно в 2% (7). Описаны два типа дефицита протеина С. Дефицит типа 1 связан со снижением уровня антигена, а также функциональной активности протеина С. При дефиците типа II уровень активности протеина С снижен в большей степени, чем уровень антигена. Дефицит протеина S был впервые описан в 1984 г. (9). Распространенность низкая и колеблется от 0,026 до 0,13% (7). В плазме присутствуют две формы протеина S: около 60 % связано с регулятором комплемента С4b-связывающим белком, а остальные 40 % циркулируют в виде свободного протеина S. Только свободный протеин S может служить кофактором для активированного протеина С. три типа дефицита протеина S. Типы I и III являются количественными недостатками. При типе I уровни как свободного, так и общего белка S низкие, тогда как при дефиците типа III снижены только уровни свободного белка S.Дефицит типа II представляет собой качественное нарушение с нормальным антигеном и сниженным уровнем активности белка S. Дефицит как протеина C, так и S может проявляться в гетерозиготной, гомозиготной или сложной гетерозиготной формах, хотя последние две формы встречаются крайне редко. У этих пациентов наблюдается молниеносная пурпура новорожденных (10, 11). В младенчестве диагноз дефицита гомозиготного протеина C или S можно поставить, измерив функциональную активность протеина C или S, которая будет неопределяемой. FVL является наиболее распространенным наследственным тромбофилическим дефектом, хотя его распространенность широко варьирует. Распространенность гетерозиготной FVL колеблется от 1 до 9% в европейских странах, тогда как она редко встречается у африканцев и азиатов (14). FVL характеризуется заменой глутамина на аргинин в положении 506 белка фактора V в сайте расщепления активированного белка С.Он вызывает резистентность фактора Va к расщеплению активированным протеином С, что приводит к избытку фактора Va и, как следствие, к состоянию гиперкоагуляции (15, 16). FIIm является вторым наиболее частым наследственным тромбофилическим дефектом. У европеоидов распространенность этой мутации составляет около 2% (17). Он характеризуется точечной мутацией (нуклеотид 20210 G на А) в гене протромбина, которая связана с повышенным уровнем протромбина, предшественника тромбина (18). Повышенный уровень протромбина увеличивает период полувыведения фактора Va.Поскольку фактор Va, связанный в комплексе протромбин-фактор Va, устойчив к расщеплению активированного протеина С, повышенные уровни протромбина увеличивают время полужизни фактора Va, что приводит к гиперкоагуляции. Почему мы должны проверять на наследственную тромбофилию у детей с первым венозным тромбозом?В целом существует три возможных аргумента в пользу проведения теста на тромбофилию у детей с первым венозным тромбозом. Во-первых, если существует связь между наследственной тромбофилией и развитием тромбоза у детей, идентификация тромбофилического дефекта может помочь узнать, почему у молодого пациента развился тромбоз, особенно если тромботическое событие не было спровоцировано.Во-вторых, следует провести тестирование, если положительный результат теста изменит тактику ведения пациента, например пролонгирует антикоагулянтную профилактику повторных тромботических явлений. Наконец, тестирование педиатрического пациента с ВТЭ может помочь выявить бессимптомных родственников, которые могут избежать тромботических факторов риска и получить пользу от тромбопрофилактики в ситуациях высокого риска. Связь между наследственной тромбофилией и венозным тромбозомПациенты, родители и их врачи часто хотели бы получить объяснение явления ВТЭ.Было опубликовано несколько серий случаев, исследований случай-контроль, регистров и когортных исследований, в которых изучалось влияние наследственной тромбофилии на ВТЭ у детей. В 2008 г. Young et al. включили эти исследования в метаанализ, который показал, что у детей с первой ВТЭ вероятность наследственной тромбофилии выше, чем у контрольной группы (19). Отношение шансов варьировало от 2,63 [95% доверительный интервал (ДИ), 1,61–4,29] для FIIm до 8,73 (95% ДИ, 3,12–24,42) для дефицита антитромбина. Эти ОШ напоминали относительные риски, обнаруженные у взрослых с ВТЭ (20).Так, в целом наследственная тромбофилия способствует развитию ВТЭ у детей. Тестирование на тромбофилию может выявить одну из причин тромботического события у педиатрического пациента. Однако идентификация тромбофилического дефекта не исключает других факторов риска, как показано в метаанализе. Более 70% пациентов имели как минимум один клинический фактор риска, что свидетельствует о том, что одного тромбофилического дефекта обычно недостаточно для развития тромбоза у детей. Связь между наследственной тромбофилией и некоторыми подгруппами пациентов менее ясна.Важным ограничением вышеупомянутого метаанализа было то, что подгруппы пациентов, такие как спровоцированная или неспровоцированная, неонатальная ВТЭ и ВТЭ, связанная с катетером, не могли быть проанализированы отдельно из-за небольших групп и нечетких определений в первоначальных исследованиях. Тем не менее, другие исследования показали, что распространенность наследственной тромбофилии, по-видимому, выше у подростков с неспровоцированным тромбозом и у детей с положительным семейным анамнезом по ВТЭ и ниже у детей с сердечными заболеваниями или злокачественными новообразованиями с катетер-ассоциированным тромбозом (21–24).У новорожденных с тромбозом, связанным с катетером, только в нескольких небольших исследованиях изучалась распространенность дефектов тромбофилии, которые обнаруживались редко (25–27). Тромбофилия и лечение тромбозаБолее важной причиной в пользу тестирования на тромбофилию может быть необходимость корректировки лечения тромбоза в случае положительного результата. В настоящее время выявление наследственного тромбофилического дефекта не меняет неотложной антитромботической тактики у детей (28).Изменится ли продолжительность антикоагулянтной терапии после обнаружения тромбофилического дефекта, зависит от риска побочных эффектов антикоагулянтной терапии, таких как массивное кровотечение, риск рецидива ВТЭ и предпочтений пациента. У взрослых ежегодная частота больших кровотечений при длительном приеме антикоагулянтов составляет 1,5–2% (29, 30). Как правило, кумулятивная безрецидивная выживаемость у детей составляет 92% через 1 год и 82% через 7 лет наблюдения (24). Янг и др.изучали связь между наследственной тромбофилией и рецидивирующей ВТЭ у детей (19). Их метаанализ показал значительную, но умеренную связь со всеми тромбофильными дефектами, кроме FVL. ОШ варьировались от 2,15 (95% ДИ, 1,12–4,10) для FIIm до 3,76 (95% ДИ, 1,76–8,04) для дефицита протеина S. Дети с двумя и более тромбофилическими дефектами имели самый высокий риск рецидива ВТЭ (ОШ 4,91; 95% ДИ 3,12–7,74). Риск рецидива тромбоза у детей с тромбофилией был несколько выше, чем у взрослых (табл. 1).Это может быть вызвано отсутствием профилактической антикоагулянтной терапии в ситуациях высокого риска после первого тромботического события. У детей не было принято проводить тромбопрофилактику в ситуациях высокого риска, таких как неподвижность, хирургическое вмешательство или травма. У взрослых, как и у детей, незначительное повышение риска рецидива у пациентов с наследственной тромбофилией не привело к коррекции продолжительности антикоагулянтной терапии. Таблица 1. Ассоциация наследственной тромбофилии с риском ВТЭ у детей . Совсем недавно Limperger et al. изучали ежегодную частоту рецидивов у детей после первой некатетерной ВТЭ (31). В целом расчетный риск рецидива ВТЭ составил 1,5% в год. У детей с тромбофилией высокого риска ежегодная частота рецидивов составляла 5,4% (95% ДИ, 2,6–10%), у детей с дефицитом антитромбина — только 1,3% (95% ДИ, 0,3–3,8%) и 0,7% (95%). % ДИ, 0,08–2,4%) у пациентов с дефицитом протеина С и протеина S соответственно. У пациентов без тромбофилии ежегодная частота рецидивов равнялась 0.9% (95% ДИ, 0,4–1,8%). Таким образом, основываясь на этих результатах, особенно у пациентов с дефицитом антитромбина повышен риск рецидива. Эти пациенты могут быть идентифицированы путем тестирования и могут получить пользу от профилактических стратегий. Эти профилактические стратегии могут включать бессрочную антикоагулянтную терапию антагонистами витамина К или прерывистую антикоагулянтную терапию в ситуациях высокого риска. Обе стратегии у детей еще не изучались. Как и в исследовании Limperger et al., 9 из 10 детей с дефицитом антитромбина спровоцировали рецидив ВТЭ, последней стратегии с прерывистой антикоагулянтной терапией может быть достаточно для предотвращения рецидива ВТЭ с меньшим риском кровотечения.Однако можно возразить, что каждый молодой пациент должен получать прерывистую профилактическую антикоагулянтную терапию в ситуациях высокого риска после первой ВТЭ, независимо от наличия наследственной тромбофилии. Из-за снижения риска кровотечения новые прямые пероральные антикоагулянты могут иметь благоприятное соотношение пользы и риска для длительной антикоагулянтной терапии у детей с дефицитом антитромбина в будущем. Выявление бессимптомных родственниковПредполагается, что тестирование на наследственную тромбофилию у детей с ВТЭ позволяет выявить бессимптомных членов семьи с тромбофилией.Пострадавшие родственники будут иметь возможность избегать факторов риска, таких как курение и ожирение, получать информацию о тромботических рисках контрацепции и беременности и использовать тромбопрофилактику в ситуациях высокого риска. Хольцхауэр и др. исследовали общую годовую заболеваемость ВТЭ у родственников первой и второй линии педиатрических пациентов с ВТЭ и наследственной тромбофилией (32). Абсолютный риск первого тромботического события в год у бессимптомных родственников был не очень высоким.Он был выше у носителей дефицита антитромбина, протеина С или S (2,82%; 95% ДИ, 1,63–4,80%), чем у носителей FIIm или FVL (0,42%; 95% ДИ, 0,17–1,01% и 0,25%; 95). % ДИ, 0,12–0,53%), соответственно. У родственников без наследственной тромбофилии абсолютный риск ВТЭ в год составил 0,10% (95% ДИ, 0,06–0,17%). Таким образом, как и у взрослых, наследственные тромбофилические дефекты можно разделить на тромбофилию низкого риска, включая FVL и FIIm, и тромбофилию высокого риска, включая дефицит антитромбина, протеина C или S (32, 33).Примечательно, что почти 65% ВТЭ у родственников первой и второй степени родства детей с ВТЭ с тромбофилией в исследовании Holzhauer et al. была связана с клиническими факторами риска. Таким образом, обсуждения с бессимптомными родственниками о том, как избежать факторов риска образа жизни, таких как ожирение и курение, и, в конечном итоге, тромбопрофилактики в ситуациях высокого риска может быть достаточно для предотвращения большинства ВТЭ, независимо от наследственного статуса тромбофилии. Перед началом приема оральных контрацептивов рекомендуется скрининг подросткам детородного возраста с семейным анамнезом тромбоза и/или тромбофилии (34).Комбинированные оральные контрацептивы являются важным фактором риска ВТЭ. Риск тромбообразования намного выше у женщин с тромбофилией высокого риска, чем у женщин с тромбофилией низкого риска. Годовой риск тромбообразования при приеме комбинированных пероральных контрацептивов составляет 4,3% для бессимптомных носителей с положительной родственной первой степени родства с ВТЭ и тромбофилией высокого риска. Риск составляет всего 0,2–0,5 в год использования для бессимптомных носителей с положительным результатом у родственника первой степени родства с ВТЭ и тромбофилией низкого риска (35). Как следствие, может быть целесообразным тестирование подростков из семей с высоким риском тромбофилии, чтобы избежать использования комбинированных контрацептивов.Однако в случае сильного семейного анамнеза по ВТЭ следует избегать применения комбинированных контрацептивов и у бессимптомных носителей низкой тромбофилии. При консультировании таких пациентов важно понимать, что в семьях с семейным анамнезом ВТЭ и/или тромбофилии риск тромбообразования также повышен у здоровых родственников из-за еще неизвестных генетических переменных и/или клинических факторов риска (35). Следовательно, отрицательный результат теста на тромбофилию может вызвать ложную уверенность. Таким образом, в некоторых рекомендациях рекомендуется рассматривать альтернативные методы контрацепции у женщин с ВТЭ у ближайших родственников независимо от результатов тестирования (36). Недостатки тестированияОдним из недостатков тестирования детей с ВТЭ может быть психологический стресс от осознания того, что они являются носителями наследственного тромбофилического дефекта. Нет доступных исследований, изучающих психологическое воздействие тестирования на тромбофилию у детей. У взрослых тестирование на тромбофилию не вызывает психологического стресса или беспокойства (37, 38). Еще одним недостатком могут быть потенциальные проблемы с медицинским страхованием или страхованием жизни в будущем.Один из пациентов в исследовании Bank et al. подвергся дискриминации со стороны страховой компании из-за FVL. Остальные 16 пациентов не проинформировали страховые компании (39). Наконец, тестирование на тромбофилию стоит дорого. Многие тесты назначаются неправильно (40, 41). Надлежащее тестирование на тромбофилию снизит затраты. Кого следует тестировать на наследственную тромбофилию у детей с первым тромботическим событием?Как упоминалось ранее, вероятность обнаружения наследственной тромбофилии варьируется в зависимости от группы детей с ВТЭ.Наследственная тромбофилия, по-видимому, присутствует у подростков с неспровоцированным тромбозом и у детей с положительным семейным анамнезом. В исследовании Revel-Vilk и соавт. тромбофилия была выявлена только у 13% всех 171 детей с ВТЭ, но у 60% подростков с неспровоцированным тромбозом (22). Рууд и др. показали в поперечном исследовании, что положительный семейный анамнез по ВТЭ увеличивает относительный риск наследственной тромбофилии у ребенка до 2,35 (95% ДИ, 1,1–5,2) (42). Кроме того, в проспективном когортном исследовании 100 новорожденных и детей с ВТЭ положительный семейный анамнез оказался единственным предиктором наличия наследственной тромбофилии (ОШ 14.9; 95% ДИ, 1,9–113) (24). У новорожденных и детей с катетерными тромбозами тромбофилию выявляли реже. Например, Салонваара и др. описали 10 новорожденных с симптоматическим тромбозом, связанным с катетером. Только у 1 из 10 пациентов была FVL (26). Альбисетти и др. изучали распространенность тромбофилии у онкологических больных с катетер-ассоциированным тромбозом и без него. Тромбофилия была обнаружена у 4% онкологических больных с ВТЭ и у 12% больных без ВТЭ (21). Наконец, Том и соавт.не смогли найти связь между катетер-ассоциированной ВТЭ и тромбофилией у кардиологических педиатрических пациентов (23). Таким образом, тестирование на тромбофилию представляется целесообразным у подростков с неспровоцированной ВТЭ и у детей с положительным семейным анамнезом по ВТЭ и менее полезным у новорожденных и детей после первого эпизода катетер-ассоциированной ВТЭ. РезюмеНаличие наследственных тромбофилических дефектов у новорожденных и детей с первым случаем ВТЭ не влияет на первичную антитромботическую тактику и, хотя может быть одной из причин тромботических событий, редко влияет на долгосрочное лечение.Однако наличие дефицита антитромбина с высоким риском рецидивирующего тромбоза может потребовать корректировки долгосрочного лечения. У этих детей прерывистая антикоагулянтная терапия в ситуациях высокого риска может помочь предотвратить повторные тромботические эпизоды. Кроме того, тестирование может быть полезным для выявления бессимптомных родственниц с тромбофилией, которые могут получить больше информации о здоровом образе жизни и рисках комбинированных оральных контрацептивов в фертильном возрасте. С другой стороны, можно утверждать, что все дети с первой ВТЭ являются кандидатами на профилактическую антикоагулянтную терапию в ситуациях высокого риска, а не только дети с дефицитом антитромбина.А положительного семейного анамнеза по ВТЭ может быть достаточно, чтобы выбрать менее тромботические методы контрацепции, такие как препараты, содержащие только прогестерон (таблица 2). Таблица 2. Аргументы за и против тестирования на тромбофилию у детей с венозной тромбоэмболией (ВТЭ) . Следовательно, тестирование на наследственную тромбофилию у детей с первым эпизодом ВТЭ не следует проводить на рутинной основе. У новорожденных и детей с тромбозом, связанным с катетером, наследственная тромбофилия, по-видимому, в меньшей степени способствует возникновению тромбоза, чем у подростков с неспровоцированным тромбозом и у детей с положительным семейным анамнезом по ВТЭ.Поэтому особенно эти последние группы кажутся кандидатами на тестирование. У этих детей решение о тестировании должно приниматься на индивидуальной основе после надлежащего консультирования до и после тестирования опытным врачом, обсуждения недостатков и преимуществ тестирования, предпочтений пациента и последствий результатов тестирования после тестирование. Вклад авторовCO и UN-G участвовали в разработке концепции рукописи.CO написал рукопись, UN-G прочитал, отредактировал и утвердил окончательный вариант рукописи. Заявление о конфликте интересовАвторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов. СокращенияВТЭ, венозная тромбоэмболия; FVL, лейденская мутация фактора V; FIIm, мутация протромбина; ДИ, доверительный интервал. Ссылки1.Эндрю М., Дэвид М., Адамс М., Али К., Андерсон Р., Барнард Д. и др. Венозные тромбоэмболические осложнения (ВТЭ) у детей: первые анализы канадского регистра ВТЭ. Кровь (1994) 83:1251–7. Реферат PubMed | Академия Google 2. van Ommen CH, Heijboer H, Buller HR, Hirasing RA, Heijmans HS, Peters M. Венозная тромбоэмболия у детей: проспективный двухлетний регистр в Нидерландах. J Pediatr (2001) 139:676–81. doi: 10.1067/mpd.2001.118192 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google 3.Raffini L, Huang YS, Witmer C, Feudtner C. Резкий рост венозной тромбоэмболии в детских больницах США с 2001 по 2007 год. Pediatrics (2009) 124:1001–8. doi:10.1542/peds.2009-0768 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google 5. Гольденберг Н.А., Донадини М.П., Кан С.Р., Кроутер М., Кенет Г., Новак-Готтл У. и соавт. Посттромботический синдром у детей: систематический обзор частоты встречаемости, достоверности показателей результатов и прогностических факторов. Haematologica (2010) 95:1952–9. doi:10.3324/гематол.2010.026989 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google 6. Эгеберг О. Наследственный дефицит антитромбина, вызывающий тромбофилию. Thromb Diath Haemorrh (1965) 13:516–30. Академия Google 10. Kroiss S, Albisetti M. Использование концентратов человеческого протеина С в лечении пациентов с тяжелым врожденным дефицитом протеина С. Biologics (2010) 4:51–60. Реферат PubMed | Академия Google 11. Махасандана С., Суватте В., Чуансумрит А., Марлар Р.А., Манко-Джонсон М.Дж., Джейкобсон Л.Дж. и соавт. Дефицит гомозиготного протеина S у младенца с молниеносной пурпурой. J Pediatr (1990) 117:750–3. дои: 10.1016/S0022-3476(05)83335-9 Полнотекстовая перекрестная ссылка | Академия Google 12. Эндрю М., Паес Б., Джонстон М. Развитие системы гемостаза у новорожденных и детей раннего возраста. Am J Pediatr Hematol Oncol (1990) 12:95–104.дои: 10.1097/00043426-19 | 00-00019
| 1. | Heijboer H., Brandjes D. P., Buller H. R., Sturk A., ten Cate J. W.Дефицит коагуляционных и фибринолитических белков у амбулаторных больных с тромбозом глубоких вен. Н. англ. Дж. Мед. 32319 | 21516 |
| 2. | Pabinger I., Brucker S., Kyrle PA, Schneider B., Korninger HC, Niessner H., Lechner K. Наследственный дефицит антитромбина III, протеина C и протеина S: распространенность у пациентов с наличием в анамнезе венозных тромбозов и критериями рационального скрининга пациентов. Кровавый коагул. Фибринолиз 31992547553 | |
| 3. | Ван дер Меер Ф. Дж., Костер Т., Ванденбрук Дж. П., Бриет Э., Розендаал Ф. Р. Лейденское исследование тромбофилии (LETS). Тромб. Гемост. 781997631635 | |
| 4. | Dahlback B., Carlsson M., Svensson P. J. Семейная тромбофилия из-за ранее неизвестного механизма, характеризующегося плохой антикоагулянтной реакцией на активированный протеин C: прогнозирование кофактора к активированному протеину C. Proc. Натл. акад. науч. | 310041008 |
| 5. | Bertina RM, Koeleman BOC, Koster T., Rosendaal FR, Dirven RJ, de Ronde H., van der Velden PA, Reitsma PH Мутация фактора V свертывания крови, связанная с резистентностью к активированному белку C. Nature 36919946467 | |
| 6. | Poort SR, Rosendaal FR, Reitsma PH, Bertina RMA общая генетическая вариация в 3′-нетранслируемой области гена протромбина связана с повышенным уровнем протромбина в плазме и увеличением венозного тромбоза. Кровь 88199636983703 | |
| 7. | D’Angelo A., Selhub J. Гомоцистеин и тромботическая болезнь. Blood | 7111 |
| 8. | Makris M., Preston FE, Beauchamp NJ, Cooper PC, Daly ME, Hampton KK, Bayliss P., Peake IR, Miller GJCo-наследование всех 20210A ген увеличивает риск тромбоза у лиц с семейной тромбофилией. Тромб. Гемост. 78199714261429 | |
| 9. | Прайс Д. Т., Ридкер П. М. Лейденская мутация фактора V и риск тромбоэмболических заболеваний: клиническая перспектива. Энн. Стажер Мед. 1271997895903 | |
| 10. | Селигсон У., Зивелин А. Тромбофилия как мультигенное заболевание. Тромб. Гемост. 781997297301 | |
| 11. | Рис К.Д., Кокс М., Клегг Дж.Б. Мировое распределение фактора V Лейден. Ланцет 346199511331134 | |
| 12. | Svennson P.J., Dahlback B. Устойчивость к активированному протеину С как основа венозного тромбоза. Н. англ. Дж. Мед. 3301994517522 | |
| 13. | Ridker P. M., Glynn R.J., Miletich J.P., Goldhaber S.Z., Stampfer M.J., Hennekens C.H. Энн. Стажер Мед. 1261997528531 | |
| 14. | Симиони П., Prandoni P., Lensing AWA, Scudeller A., Sardella C., Prins M. H., Villalta S., Dazzi F., Girolami A. Риск рецидивирующей венозной тромбоэмболии у пациентов с мутацией arg506-gln в гене фактор V (Фактор V Лейден). Н. англ. Дж. Мед. 3361997399403 | |
| 15. | Айхингер С., Пабингер И., Штумпфлен А., Хиршл М., Белончик К., Шнайдер Б., Маннхальтер К., Минар Э., Лехнер К., Кирле П.А.Риск рецидивирующей венозной тромбоэмболии у пациентов с фактором V и без него. Тромб. Гемост. 781997624628 | |
| 16. | Ридкер П. М., Милетич Дж. П., Штампфер М. Дж., Гольдхабер С. З., Линдпайнтнер К., Хеннекенс С. Х. Фактор В. Лейден и риски рецидивирующей идиопатической венозной тромбоэмболии. Тираж 92199528002802 | |
| 17. | Hille E. T., Westendorp R. G., Vandenbroucke J. P., Rosendaal F. R. Смертность и причины смерти в семьях с лейденской мутацией фактора V (резистентность к активированному белку) Кровь 89199719631967 | |
| 18. | Rees D.C., Liu Y.T., Cox M.J., Elliott P., Wainscoat J.S.Factor V Leiden и термолабильная метилентетрагидрофолатредуктаза в глубокой старости. Тромб. Гемост. 78199713571359 | |
| 19. | Brown K., Luddington R., Williamson D., Baker P., Baglin T. Риск венозной тромбоэмболии, связанный с переходом G в A в положении 20210 в 3′-нетранслируемой области гена протромбина. руб. Дж. Гематол. 9819979 | |
| 20. | Камминг А. М., Кини С., Салден А., Бхавнани М., Шве К. Х., Хей С. Р. Вариант гена протромбина G20210A: распространенность в популяции антикоагулянтной клиники Великобритании. руб. Дж. Гематол. 981997353355 | |
| 21. | den Heijer M., Koster T., Blom HJ, Bos G.M.J., Briet E., Reitsma P.H., Vandenbroucke J.P., Rosendaal F.R. фактор риска аспергемии тромбоза. Н. англ. Дж. Мед. 3341996759762 | |
| 22. | Ридкер П. М., Хеннекенс С. Х., Сельхуб Дж., Милетич Дж. П., Малинов М. Р., Штампфер М. Дж. Взаимосвязь гипергомоцист(е)эмболии, риска венозной тромбоэмболии V и фактора V Лейдена. Циркуляция 95199717771782 | |
| 23. | Милетич Дж., Шерман Л., Броз Г. Дж. Отсутствие тромбоза у субъектов с гетерозиготным дефицитом протеина С. Н. англ. Дж. Мед. 3171987991996 | |
| 24. | McColl M., Tait RC, Walker ID, Perry DJ, McCall F., Conkie JA Низкая частота тромбозов у доноров крови и их родственников с наследственным дефицитом антитромбина и протеина C: корреляция с типом дефекта, семейным анамнезом и отсутствие лейденской мутации фактора V. Кровавый коагул. Фибринолиз 71996689694 | |
| 25. | Allaart C.F., Poort S.R., Rosendaal F.R., Reitsma P.H., Bertina R.M., Briet E. Повышенный риск венозного тромбоза у носителей наследственного дефицита протеина С. Lancet 3411993134138 | |
| 26. | Бовилл Э. Г., Бауэр К. А., Дикерман Дж. Д., Каллас П., Уэст Б. Клинический спектр дефицита гетерозиготного протеина С у крупного новоанглийского родственника. Кровь 731989712717 | |
| 27. | Pabinger I., Kyrle PA, Heistinger M., Eichinger S., Wittmann E., Lechner K. Риск тромбоэмболии у бессимптомных пациентов с дефицитом протеина C и протеина S: a проспективное когортное исследование. Тромб. Гемост. 711994441445 | |
| 28. | Reitsma P.H., Poort S.R., Allaart C.F., Briet E., Bertina R.M. Спектр генетических дефектов в группе из 40 голландских семей с симптоматическим дефицитом белка C типа I: гетерогенность и эффекты основателя. Кровь 7819918 | |
| 29. | Koeleman B.P., Reitsma P.H., Allaart C.F., Bertina R.M. Резистентность к активированному протеину C как дополнительный фактор риска тромбоза в семьях с дефицитом протеина C. Кровь 84199410311035 | |
| 30. | Engesser L., Broekmans A.W., Briet E., Brommer E.J., Bertina R.M. Наследственный дефицит протеина S: клинические проявления. Энн. Стажер Мед. 1061987677682 | |
| 31. | Conard J., Horellou M.H., Van Dreden P., Lecompte T., Samama M. Тромбоз и беременность при врожденном дефиците AT III, протеина C или протеина S: исследование 78 женщин. Тромб. Гемост. 6319320 | |
| 32. | Хирш, Дж., М. Х. Принс и М. Самама. 1994. Подход к тромбофилическому пациенту. В Гемостаз и тромбоз: основные принципы и клиническая практика. 3-е изд. Липпинкотт, Филадельфия. | |
| 33. | Biron C., Lamarti H., Schved J. F., Jeanjean P., Masmejean C., Claustres M., Aguilar-Martinez P. Стратегии диагностики резистентности к активированному протеину C: необходимо ли генотипирование? Р. В. Колман, Дж. Хирш, В. Дж. Мардер и Э. В. Зальцман, редакторы. клин. лаборатория Гематол. 1919976771 | |
| 34. | Британский комитет по стандартам в области гематологии Руководство по исследованию и лечению тромбофилии. Дж. Клин. Патол. 4319 709 | |
| 35. | Бауэр К.А. Ведение больных с наследственными пороками, предрасполагающими к тромбозам, в том числе беременных. Тромб. Гемост. 741199594100 |
ВРОЖДЕННАЯ ТРОМБОФИЛИЯ В ДЕТСТВЕ 33
Хотя относительно редко (распространенность неизвестна), тромбоэмболические осложнения возникают у детей и вызывают значительную заболеваемость с иногда летальным исходом.Литература о тромбозах у детей ограничена несколькими сообщениями о случаях, поэтому большая часть информации получена из исследований у взрослых. Основными наследственными аномалиями, предрасполагающими к тромбозу, являются дефицит естественных ингибиторов гемостаза (антитромбина III-ATIII-, протеина C-PC-, протеина S-SP) и дисфибриногенемия. Другими наследственными аномалиями, связь которых не доказана, являются: дефицит плазминогена (plg), дефицит кофактора гепарина II (HC-II), богатый гистидином кислый гликопротеин, повышенный уровень ингибитора активатора плазминогена (PAI) или сниженный уровень тканевого плазминогена. активатор (t-PA).Недавно наследственная резистентность к активированному протеину С (APCr) была описана как патогенный фактор риска тромбоза. APCr вызывается единственной точечной мутацией в гене фактора V более чем в 90% случаев.
Имеются убедительные доказательства того, что частота тромботических событий увеличивается с возрастом. Риск тромбоза при гетерозиготном дефиците ATIII, PC или PS крайне низок в первое десятилетие жизни, начинает увеличиваться во втором десятилетии и к пятому десятилетию у 70-80% больных с любым типом дефицита развивается тромбоз с или без провокации.У детей с наследственным дефицитом ингибиторов тромбоз обычно развивается при наличии вторичного тромботического стимула, такого как травма, длительная иммобилизация, местная инфекция, рак или его лечение.

 Чаще передается по аутосомному типу наследования, то есть для проявления заболевания дефектный ген должен передаться от обоих родителей. Обычно проявляется умеренными кровотечениями на фоне травмы или хирургического вмешательства.
Чаще передается по аутосомному типу наследования, то есть для проявления заболевания дефектный ген должен передаться от обоих родителей. Обычно проявляется умеренными кровотечениями на фоне травмы или хирургического вмешательства.

 Появляется дефект в гене, который несет информацию о пятом факторе свертывания крови. Данный фактор еще называют мутацией Лейдена;
Появляется дефект в гене, который несет информацию о пятом факторе свертывания крови. Данный фактор еще называют мутацией Лейдена; Вторая группа связана с первичными нарушениями в системе гемостаза;
Вторая группа связана с первичными нарушениями в системе гемостаза;


 Затем настой процеживают и пьют, можно добавить мед. Дозировка составляет 200 мл два раза в день через час после еды.
Затем настой процеживают и пьют, можно добавить мед. Дозировка составляет 200 мл два раза в день через час после еды.
 Однако ген имеет частичную пенетрантность (проявление), то есть даже при наличии у человека дефектного гена вероятность возникновения тромбоза может быть разной. Антитромбин III – важнейший компонент противосвертывающей системы. Он образует соединения с тромбином, что приводит к их взаимной инактивации. Тромбин – это белок, который участвует в образовании тромба, стимулирует тромбоциты и клетки сосудистой стенки.
Однако ген имеет частичную пенетрантность (проявление), то есть даже при наличии у человека дефектного гена вероятность возникновения тромбоза может быть разной. Антитромбин III – важнейший компонент противосвертывающей системы. Он образует соединения с тромбином, что приводит к их взаимной инактивации. Тромбин – это белок, который участвует в образовании тромба, стимулирует тромбоциты и клетки сосудистой стенки. В результате фактор V становится устойчивым к разрушающему действию протеина C. Фактор V является фактором свертывания и участвует в образовании тромбина. При увеличении его количества риск возникновения тромбов повышается.
В результате фактор V становится устойчивым к разрушающему действию протеина C. Фактор V является фактором свертывания и участвует в образовании тромбина. При увеличении его количества риск возникновения тромбов повышается. В результате разрушения этих клеток выделяются активные вещества, которые нарушают нормальное взаимодействие свертывающей и противосвертывающей систем крови. В результате возникает повышенная свертываемость и склонность к образованию тромбов. Большое количество антител к фосфолипидам о
В результате разрушения этих клеток выделяются активные вещества, которые нарушают нормальное взаимодействие свертывающей и противосвертывающей систем крови. В результате возникает повышенная свертываемость и склонность к образованию тромбов. Большое количество антител к фосфолипидам о
 .Действительно, они обнаружили, что риск у женщин с дефицитом повышен в 2 раза по сравнению с родственниками без дефицита 38 В нашем семейном исследовании фактора V в Лейдене, 39 , но не в нашем исследовании протромбина 20210A, 34 мы наблюдали подобное явление . С тех пор в многочисленных исследованиях изучалась связь между наследственной тромбофилией и различными осложнениями беременности, начиная от однократного выкидыша и заканчивая внутриутробной гибелью плода, преэклампсией, HELLP (гемолиз, повышенный уровень печеночных ферментов и низкий уровень тромбоцитов) и отслойкой плаценты. 27,40 Тестирование женщин с осложнениями беременности вскоре стало общепринятой клинической практикой, но доказательных данных о последующих терапевтических последствиях не было. Этот частый клинический вопрос подогрел мой интерес не только к ассоциациям и абсолютным рискам, но и к проверке часто обсуждаемой гипотезы о том, что антикоагулянтная терапия низкомолекулярным гепарином (НМГ) может улучшить исход беременности у женщин с наследственной тромбофилией и без нее, а также с необъяснимыми рецидивирующими заболеваниями.
.Действительно, они обнаружили, что риск у женщин с дефицитом повышен в 2 раза по сравнению с родственниками без дефицита 38 В нашем семейном исследовании фактора V в Лейдене, 39 , но не в нашем исследовании протромбина 20210A, 34 мы наблюдали подобное явление . С тех пор в многочисленных исследованиях изучалась связь между наследственной тромбофилией и различными осложнениями беременности, начиная от однократного выкидыша и заканчивая внутриутробной гибелью плода, преэклампсией, HELLP (гемолиз, повышенный уровень печеночных ферментов и низкий уровень тромбоцитов) и отслойкой плаценты. 27,40 Тестирование женщин с осложнениями беременности вскоре стало общепринятой клинической практикой, но доказательных данных о последующих терапевтических последствиях не было. Этот частый клинический вопрос подогрел мой интерес не только к ассоциациям и абсолютным рискам, но и к проверке часто обсуждаемой гипотезы о том, что антикоагулянтная терапия низкомолекулярным гепарином (НМГ) может улучшить исход беременности у женщин с наследственной тромбофилией и без нее, а также с необъяснимыми рецидивирующими заболеваниями. выкидыш.Это был мой первый личный опыт успешной организации и проведения многоцентрового рандомизированного клинического исследования, инициированного исследователем, которое называлось ALIFE. 41 Несмотря на то, что набор и проведение исследования были сложными, а результат был отрицательным, я считаю его завершение, публикацию и влияние на клиническую практику ярким событием в своей карьере. После примерно 15 лет различных клинических испытаний, проведенных коллегами по всему миру, мы теперь знаем, что НМГ не повышает вероятность живорождения у женщин с необъяснимым привычным невынашиванием беременности. 42-45 Однако мы все еще не уверены, относится ли это также к женщинам с наследственной тромбофилией. 46,47 В исследовании ALIFE в подгруппе женщин с наследственной тромбофилией (n = 47) отмечена тенденция к преимуществу НМГ и аспирина (относительный риск живорождения 1,31 [95% ДИ, 0,74–2,33] для НМГ и аспирин по сравнению с плацебо; относительный риск живорождения 1,22 [95% ДИ, 0,69–2,16] для аспирина с соответствующей абсолютной разницей в показателях живорождения 16.
выкидыш.Это был мой первый личный опыт успешной организации и проведения многоцентрового рандомизированного клинического исследования, инициированного исследователем, которое называлось ALIFE. 41 Несмотря на то, что набор и проведение исследования были сложными, а результат был отрицательным, я считаю его завершение, публикацию и влияние на клиническую практику ярким событием в своей карьере. После примерно 15 лет различных клинических испытаний, проведенных коллегами по всему миру, мы теперь знаем, что НМГ не повышает вероятность живорождения у женщин с необъяснимым привычным невынашиванием беременности. 42-45 Однако мы все еще не уверены, относится ли это также к женщинам с наследственной тромбофилией. 46,47 В исследовании ALIFE в подгруппе женщин с наследственной тромбофилией (n = 47) отмечена тенденция к преимуществу НМГ и аспирина (относительный риск живорождения 1,31 [95% ДИ, 0,74–2,33] для НМГ и аспирин по сравнению с плацебо; относительный риск живорождения 1,22 [95% ДИ, 0,69–2,16] для аспирина с соответствующей абсолютной разницей в показателях живорождения 16. 3% [95% ДИ, от -18,2% до 50,8%] и 11,8% [95% ДИ, от -21,1% до 44,6%] соответственно). 41 На основе этих результатов мы инициировали исследование ALIFE2, в которое с 2013 года включались пациенты из Нидерландов, Великобритании и Бельгии, а вскоре, надеюсь, и из США и Словении. 48
3% [95% ДИ, от -18,2% до 50,8%] и 11,8% [95% ДИ, от -21,1% до 44,6%] соответственно). 41 На основе этих результатов мы инициировали исследование ALIFE2, в которое с 2013 года включались пациенты из Нидерландов, Великобритании и Бельгии, а вскоре, надеюсь, и из США и Словении. 48  Следует отметить, что со временем ассоциации наследственной тромбофилии и осложнений беременности становились менее сильными или даже отсутствовали при оценке более качественных проспективных исследований. 52
Следует отметить, что со временем ассоциации наследственной тромбофилии и осложнений беременности становились менее сильными или даже отсутствовали при оценке более качественных проспективных исследований. 52  2013 май. 126 (5): 443-9. [Медлайн].
2013 май. 126 (5): 443-9. [Медлайн]. J Тромб Хемост . 2020 18 (7) июля: 1738-1742. [Медлайн]. [Полный текст].
J Тромб Хемост . 2020 18 (7) июля: 1738-1742. [Медлайн]. [Полный текст]. 04.07.2021. Доступно по адресу https://www.ema.europa.eu/en/news/astrazenecas-covid-19-vaccine-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-low-blood.
04.07.2021. Доступно по адресу https://www.ema.europa.eu/en/news/astrazenecas-covid-19-vaccine-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-low-blood. Тромбоз и антифосфолипидный синдром. Гематология Am Soc Hematol Educ Program . 2005. 462-8. [Медлайн]. [Полный текст].
Тромбоз и антифосфолипидный синдром. Гематология Am Soc Hematol Educ Program . 2005. 462-8. [Медлайн]. [Полный текст]. J Blood Med . 2020. 11:73-76. [Медлайн]. [Полный текст].
J Blood Med . 2020. 11:73-76. [Медлайн]. [Полный текст].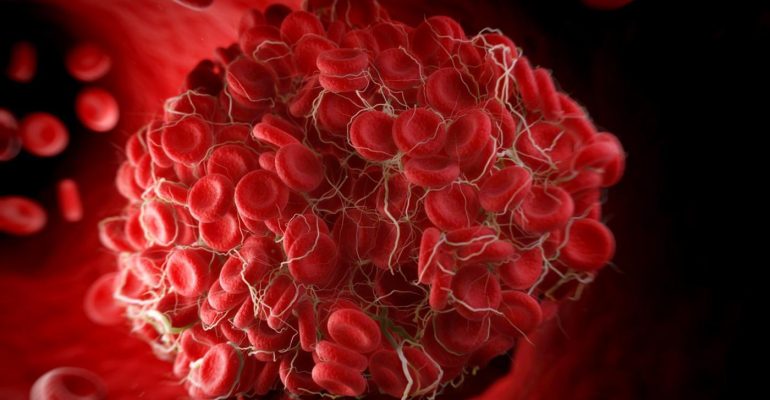 Факторы, предсказывающие риск тромбоза у родственников пациентов с неспровоцированной венозной тромбоэмболией. Сундук . 2009 10 июля. epub перед печатью. [Медлайн].
Факторы, предсказывающие риск тромбоза у родственников пациентов с неспровоцированной венозной тромбоэмболией. Сундук . 2009 10 июля. epub перед печатью. [Медлайн]. [Медлайн].
[Медлайн]. Передний Педиатр . 2017. 5:50. [Медлайн]. [Полный текст].
Передний Педиатр . 2017. 5:50. [Медлайн]. [Полный текст].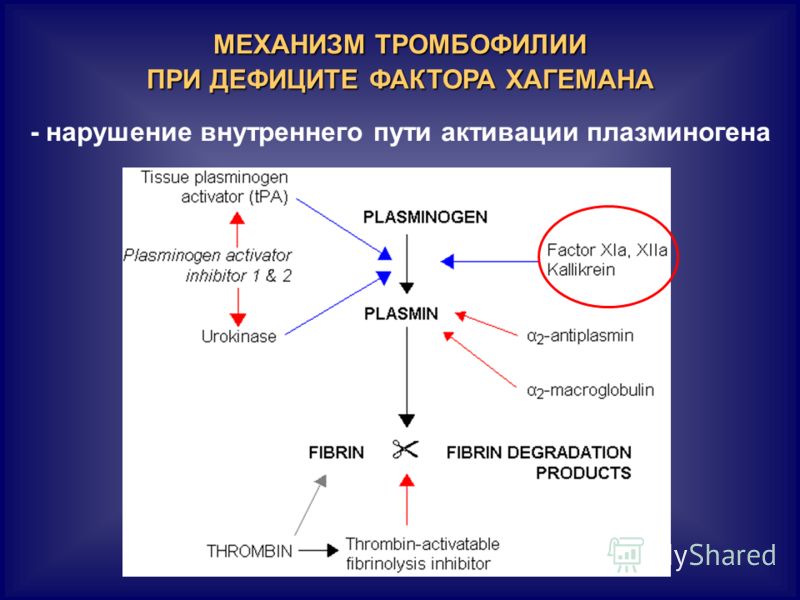 377 (23): 2298. [Медлайн]. [Полный текст].
377 (23): 2298. [Медлайн]. [Полный текст]. Бр Дж Гематол . 2017 19 декабря. 82 (1): 25-6. [Медлайн].
Бр Дж Гематол . 2017 19 декабря. 82 (1): 25-6. [Медлайн]. J Клин Онкол . 2018 10 июля. 36 (20): 2017-2023. [Медлайн]. [Полный текст].
J Клин Онкол . 2018 10 июля. 36 (20): 2017-2023. [Медлайн]. [Полный текст]. 6 февраля 2013 г. [Medline].
6 февраля 2013 г. [Medline]. Коронарная артерия Dis . 2012 сен. 23 (6): 380-90. [Медлайн].
Коронарная артерия Dis . 2012 сен. 23 (6): 380-90. [Медлайн]. Необходим ли лабораторный мониторинг терапии низкомолекулярным гепарином? № J Thromb Haemost . 2004 апр. 2 (4): 551-4. [Медлайн]. [Полный текст].
Необходим ли лабораторный мониторинг терапии низкомолекулярным гепарином? № J Thromb Haemost . 2004 апр. 2 (4): 551-4. [Медлайн]. [Полный текст]. Анестезиология . 2004 г., октябрь 101 (4): 1048-9. [Медлайн].
Анестезиология . 2004 г., октябрь 101 (4): 1048-9. [Медлайн]. 2010 авг. 24(4):727-37, viii-ix.[Медлайн].
2010 авг. 24(4):727-37, viii-ix.[Медлайн]. Заболеваемость венозной тромбоэмболией стабильно составляет около 0,7/100 000 в год1.
2 с младенцами и подростками в группе наибольшего риска. В большинстве случаев обнаруживается лежащий в основе провоцирующий фактор, а во многих случаях присутствуют два или более провоцирующих фактора.1-4
Заболеваемость венозной тромбоэмболией стабильно составляет около 0,7/100 000 в год1.
2 с младенцами и подростками в группе наибольшего риска. В большинстве случаев обнаруживается лежащий в основе провоцирующий фактор, а во многих случаях присутствуют два или более провоцирующих фактора.1-4 , дисплазминогенемия и другие фибринолитические дефекты. К этим нарушениям также можно добавить недавно описанную мутацию протромбина 20210A.9 Гомоцистинурия также связана с тромбозом в детском возрасте.Эти различные состояния могут сочетаться друг с другом, увеличивая риск.10-16
, дисплазминогенемия и другие фибринолитические дефекты. К этим нарушениям также можно добавить недавно описанную мутацию протромбина 20210A.9 Гомоцистинурия также связана с тромбозом в детском возрасте.Эти различные состояния могут сочетаться друг с другом, увеличивая риск.10-16 Исследования тромбофилии состояли из измерения активности протеина С, общего и свободного антигена протеина S, активности антитромбина III, скрининга фактора V Лейдена и протромбина 20210A, определения уровня гомоцистеина в моче и скрининга волчаночного антикоагулянта.
Исследования тромбофилии состояли из измерения активности протеина С, общего и свободного антигена протеина S, активности антитромбина III, скрининга фактора V Лейдена и протромбина 20210A, определения уровня гомоцистеина в моче и скрининга волчаночного антикоагулянта.

 Наиболее часто наблюдаемыми приобретенными факторами были предшествующее лихорадочное/вирусное заболевание или послеоперационное состояние, и то, и другое наблюдалось у 9 пациентов. У четырех пациентов было основное злокачественное заболевание, и они получали химиотерапию через постоянные центральные венозные линии. У одного ребенка был нефротический синдром, у одного — грамотрицательный сепсис и у одного — общий вариабельный иммунодефицит.
Наиболее часто наблюдаемыми приобретенными факторами были предшествующее лихорадочное/вирусное заболевание или послеоперационное состояние, и то, и другое наблюдалось у 9 пациентов. У четырех пациентов было основное злокачественное заболевание, и они получали химиотерапию через постоянные центральные венозные линии. У одного ребенка был нефротический синдром, у одного — грамотрицательный сепсис и у одного — общий вариабельный иммунодефицит. Один пациент был гетерозиготен как по фактору V Лейдена, так и по протромбину 20210А. Единственными двумя пациентами без дополнительных приобретенных провоцирующих факторов были один с дефицитом протеина S, у которого развился подвздошно-бедренный тромбоз глубоких вен (ТГВ), и один с внепеченочным тромбозом воротной вены и дефицитом протеина С.
Один пациент был гетерозиготен как по фактору V Лейдена, так и по протромбину 20210А. Единственными двумя пациентами без дополнительных приобретенных провоцирующих факторов были один с дефицитом протеина S, у которого развился подвздошно-бедренный тромбоз глубоких вен (ТГВ), и один с внепеченочным тромбозом воротной вены и дефицитом протеина С. Из них у двух не было других идентифицируемых факторов риска во время тромбоза (дефицит протеина С и протромбина 20210A). Из остальных четырех у одного была гомоцистинурия и вирусное заболевание, у одного фактор V Лейден и пересадка почки, у одного дефицит антитромбина III и вирусное заболевание, у одного дефицит протеина С и грамотрицательный сепсис. Из шести пациентов без врожденной тромбофилии приобретенные провоцирующие факторы были выявлены у четырех (вирусное заболевание (один), трансплантация почки (два), общий вариабельный иммунодефицит и центральная венозная недостаточность (один)).Только один из этих пациентов принимал антикоагулянты (варфарин) во время второго случая, и тромбоз был связан с центральной венозной линией и не имел врожденной тромбофилии. Третье событие произошло у трех пациентов, два из которых были связаны только с приобретенным провоцирующим фактором (гемодиализный катетер; почечный трансплантат), а один — только с врожденным тромбофилическим состоянием (протромбин 20210A).
Из них у двух не было других идентифицируемых факторов риска во время тромбоза (дефицит протеина С и протромбина 20210A). Из остальных четырех у одного была гомоцистинурия и вирусное заболевание, у одного фактор V Лейден и пересадка почки, у одного дефицит антитромбина III и вирусное заболевание, у одного дефицит протеина С и грамотрицательный сепсис. Из шести пациентов без врожденной тромбофилии приобретенные провоцирующие факторы были выявлены у четырех (вирусное заболевание (один), трансплантация почки (два), общий вариабельный иммунодефицит и центральная венозная недостаточность (один)).Только один из этих пациентов принимал антикоагулянты (варфарин) во время второго случая, и тромбоз был связан с центральной венозной линией и не имел врожденной тромбофилии. Третье событие произошло у трех пациентов, два из которых были связаны только с приобретенным провоцирующим фактором (гемодиализный катетер; почечный трансплантат), а один — только с врожденным тромбофилическим состоянием (протромбин 20210A).
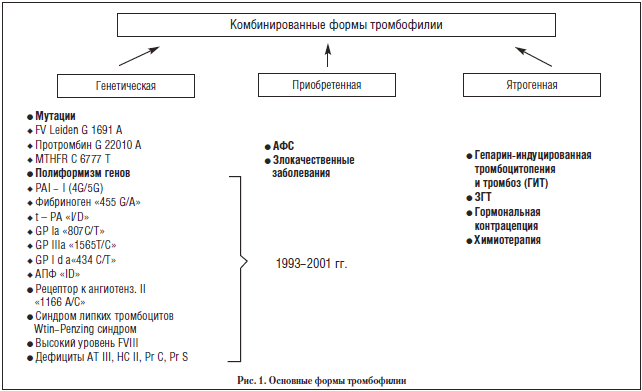 У детей старшего возраста центральные венозные оттоки остаются одним из наиболее частых провоцирующих факторов, и в большинстве исследований они являются предполагаемым пусковым фактором по крайней мере у 25% пациентов. тромбоз.
У детей старшего возраста центральные венозные оттоки остаются одним из наиболее частых провоцирующих факторов, и в большинстве исследований они являются предполагаемым пусковым фактором по крайней мере у 25% пациентов. тромбоз. Это имеет тенденцию происходить только тогда, когда присутствует один или несколько приобретенных провоцирующих факторов, тем самым обнажая лежащий в основе наследственный дефект.
3-7
Это имеет тенденцию происходить только тогда, когда присутствует один или несколько приобретенных провоцирующих факторов, тем самым обнажая лежащий в основе наследственный дефект.
3-7 У половины из них была врожденная тромбофилия, а у четырех из этих шести был идентифицируемый приобретенный фактор риска во время второго события.Некоторые из этих дальнейших событий могли бы быть предотвращены либо более длительным периодом антикоагулянтной терапии, либо селективной антикоагулянтной терапией в периоды повышенного риска тромбоза. Мы подчеркиваем необходимость проведения контролируемых клинических испытаний для определения как оптимальной продолжительности, так и оптимального диапазона антикоагулянтной терапии у детей, перенесших тромбоз.
У половины из них была врожденная тромбофилия, а у четырех из этих шести был идентифицируемый приобретенный фактор риска во время второго события.Некоторые из этих дальнейших событий могли бы быть предотвращены либо более длительным периодом антикоагулянтной терапии, либо селективной антикоагулянтной терапией в периоды повышенного риска тромбоза. Мы подчеркиваем необходимость проведения контролируемых клинических испытаний для определения как оптимальной продолжительности, так и оптимального диапазона антикоагулянтной терапии у детей, перенесших тромбоз. С 2001 по 2007 г. диагноз ВТЭ увеличился с 34 до 58 случаев на 10 000 госпитализаций в США (3). Это увеличение наблюдалось во всех возрастных категориях.Новорожденные и подростки имеют наибольший риск ВТЭ (4). Это серьезное заболевание, которое приводит к смертности и заболеваемости. Смертность составляет около 2%. Заболеваемость включает отсутствие рассасывания тромба у 50% пациентов и развитие посттромботического синдрома примерно у 30% пациентов (5).
С 2001 по 2007 г. диагноз ВТЭ увеличился с 34 до 58 случаев на 10 000 госпитализаций в США (3). Это увеличение наблюдалось во всех возрастных категориях.Новорожденные и подростки имеют наибольший риск ВТЭ (4). Это серьезное заболевание, которое приводит к смертности и заболеваемости. Смертность составляет около 2%. Заболеваемость включает отсутствие рассасывания тромба у 50% пациентов и развитие посттромботического синдрома примерно у 30% пациентов (5). Эти клинические факторы риска могут спровоцировать ВТЭ у пациентов с тромбофилией. До сих пор ведутся споры о том, полезно ли тестировать тромбофилию у детей с первым венозным тромбозом. В этой статье будут обсуждаться возможные аргументы в пользу тестирования наследственной тромбофилии, включая лейденскую мутацию фактора V (FVL), мутацию протромбина (FIIm) и недостаточность антитромбина, протеина С или протеина S, а также предлагаются некоторые группы детей, которые могут быть кандидатами. для тестирования.
Эти клинические факторы риска могут спровоцировать ВТЭ у пациентов с тромбофилией. До сих пор ведутся споры о том, полезно ли тестировать тромбофилию у детей с первым венозным тромбозом. В этой статье будут обсуждаться возможные аргументы в пользу тестирования наследственной тромбофилии, включая лейденскую мутацию фактора V (FVL), мутацию протромбина (FIIm) и недостаточность антитромбина, протеина С или протеина S, а также предлагаются некоторые группы детей, которые могут быть кандидатами. для тестирования. Он был первым, кто использовал термин тромбофилия. Дефицит антитромбина, по-видимому, встречается очень редко с распространенностью около 0,02% в общей популяции (7).
Он был первым, кто использовал термин тромбофилия. Дефицит антитромбина, по-видимому, встречается очень редко с распространенностью около 0,02% в общей популяции (7).
 Однако диагностика гетерозиготного дефицита белка C, S или антитромбина будет сложной задачей, поскольку уровни всех антикоагулянтных белков физиологически ниже у здоровых (недоношенных) новорожденных по сравнению с уровнями взрослых в результате гемостаза, связанного с развитием (12).Уровни белка S и антитромбина достигают уровня взрослых в течение первых 6 месяцев жизни. Уровни протеина С могут оставаться низкими до подросткового возраста (13).
Однако диагностика гетерозиготного дефицита белка C, S или антитромбина будет сложной задачей, поскольку уровни всех антикоагулянтных белков физиологически ниже у здоровых (недоношенных) новорожденных по сравнению с уровнями взрослых в результате гемостаза, связанного с развитием (12).Уровни белка S и антитромбина достигают уровня взрослых в течение первых 6 месяцев жизни. Уровни протеина С могут оставаться низкими до подросткового возраста (13).