Анализ кала на стафилококк в Москве
Стафилококковые бактерии получили свое название благодаря своей форме в виде шара. На данный момент известно о существовании пятидесяти видов стафилококков. Данная группа микроорганизмов разделилась на две части. Одни стафилококки прекрасно уживаются с человеком, не причиняя ему вреда. Другие становятся причиной достаточно серьезных заболеваний.
Наибольшую опасность представляет золотистый стафилококк, который способен поражать любой орган, в том числе мозг сердце и мочеполовые органы. Сердечно-сосудистая, мочеполовая центральная нервная система являются самыми уязвимыми в этом отношении. Заражение может проходить как воздушно-капельным путем или при контакте через кожу и слизистые. Данный возбудитель является причиной многих заболеваний. Его очень трудно уничтожить, так как он с легкостью приспосабливается к любым неблагоприятным условиям, устойчив к действию большинства видов антибиотиков и антисептиков.
Показания к анализу
Проявление стафилококковой инфекции весьма специфично, поэтому врач отправляет пациента на обследование при обнаружении следующих симптомов:
- Кожных высыпаний.
- Насморка.
- Боли в горле.
- Кашля, влажного или сухого.
- Повышенной температуры.
В тяжелых случаях, из-за отравления токсинами выделяемыми бактериями, может произойти потеря сознания, так как продукты жизнедеятельности микроорганизмов вызывают падение давления.
При размножении стафилококков в кишечнике появляются все признаки дисбактериоза. В этом случае у пациента появляются следующие жалобы:
- Тошнота, которая сменяется частыми продолжительными рвотами.
- Плохой аппетит или отвращение к еде.

- Разлитые боли в области живота.
- Понос, при котором в кале имеется слизь и примесь крови.
Данные симптомы характерны для многих патологий и не всегда связанных со стафилококками, но в пяти процентах случаев при анализе обнаруживают именно бактерии этого вида.
В группу риска по инфекционным заболеваниям, спровоцированным золотистым стафилококком, входят люди с ослабленным иммунитетом:
- Новорожденные дети.
- Пожилые люди.
- Пациенты, прошедшие курс лучевой терапии.
- Страдающие СПИД и носители ВИЧ.
Проблемы с желудочно-кишечным трактом, спровоцированные стафилококками, могут возникнуть не только по причине отравления, но и из-за длительного приема антибиотиков и других типов препаратов, уничтожающих нормальную флору в кишечнике. Обследование на стафилококки проходят все работники хирургических и родильных отделений.
Подготовка к процедуре
При подготовке к данному виду обследований необходимо соблюсти ряд правил, лишь в этом случае будет получен максимально точный результат.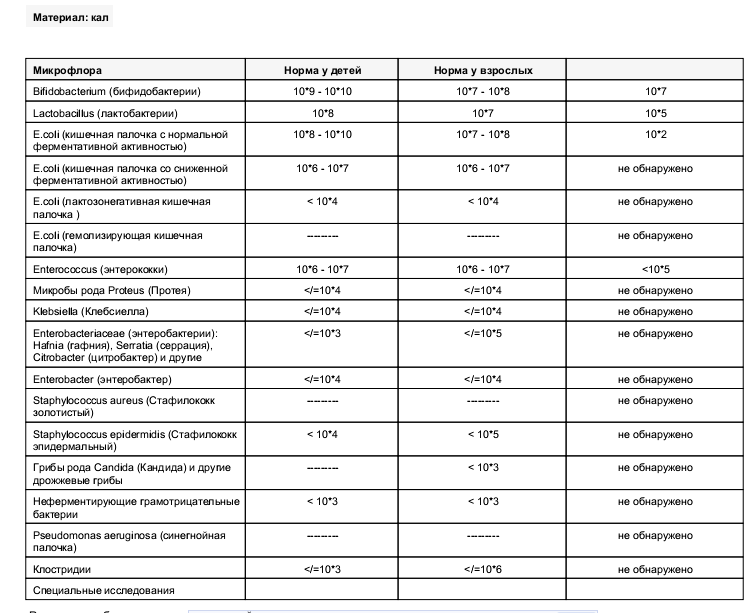
- За семь дней до проведения исследования прекращают прием всех медикаментов, особенно антибиотиков и противовоспалительных.
- Накануне анализа нельзя принимать слабительные средства.
- Материал для изучения должен оказаться в лаборатории не позднее трех часов с момента взятия.
- Кал непродолжительное время можно хранить в холодильнике.
- Для хранения и доставки кала используют только стерильную емкость.
Ложный результат может появиться из-за подавления патологической бактериальной флоры лекарственными препаратами. А также при нарушении правил забора образца для исследования.
Как проводится анализ
При обнаружении стафилококков в кале могут быть использованы несколько методов:
- Микроскопический.
- Серологический.
- Бактериологический.
При первом случае кокки определяются и подсчитываются при окрашивании по Граму.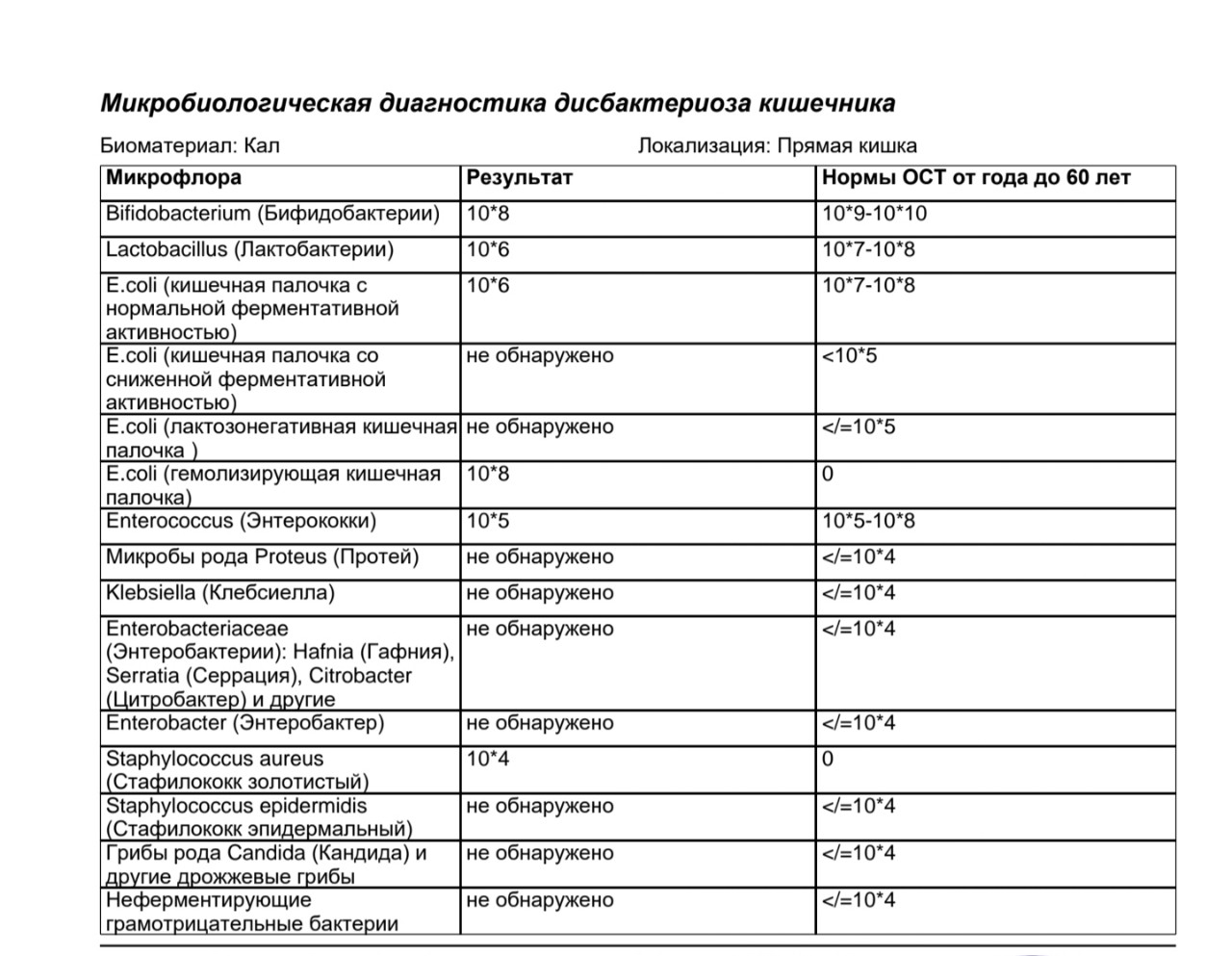 Второй метод является скорее вспомогательным и проводится параллельно с изучением фекалий. На пробу берут кровь и в плазме ищут антитела к возбудителю.
Второй метод является скорее вспомогательным и проводится параллельно с изучением фекалий. На пробу берут кровь и в плазме ищут антитела к возбудителю.
При третьем методе проводят посев в питательную среду бактерий, и после увеличения колонии проводят изучение внешнего вида выращенных бактерий. К примеру, колония золотистого стафилококка имеет ровный край с радужным венчиком вокруг и цвет окрашивания от золотистого до белого.
Анализ кала при положительном результате первого анализа берется повторно через три дня.
Нормы и расшифровка результата
Анализ может иметь два значения: положительный и отрицательный.
При отрицательном вредных микроорганизмов не обнаруживают среди выращенных экземпляров.
При положительном возбудители в кале есть, и значение приобретает их количественный показатель. При незначительном количестве, речь идет о носительстве. Потенциальный возбудитель есть, но его рост подавляется иммунитетом.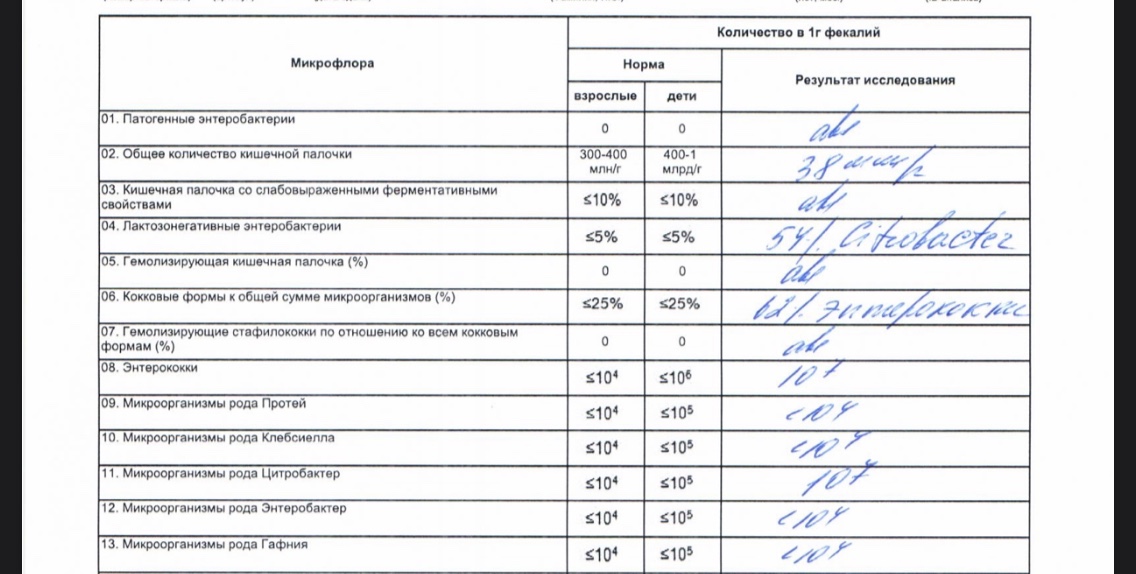
Посев на золотистый стафилококк (S. aureus), количественный результат
Микробиологическое исследование, позволяющее выявить инфицированность золотистым стафилококком и определить количество возбудителя. При выявлении патогенных и/или условно-патогенных микроорганизмов будет определена их чувствительность к антимикробным препаратам (антибиотикам и бактериофагам). В ином случае чувствительность к антибиотикам и бактериофагам не определяется, т.к. не имеет диагностического значения.
Staphylococcus aureus culture, MRSA culture (Methicillin-resistant S. aureus culture), quantitative.
Микробиологический метод.
Какой биоматериал можно использовать для исследования?
Грудное молоко, кал, мазок из зева, мазок с конъюнктивы, мазок из носа, мазок урогенитальный (с секретом предстательной железы), мокроту, отделяемое раны, отделяемое уха, ректальный мазок, среднюю порцию утренней мочи.
Как правильно подготовиться к исследованию?
Золотистые стафилококки (Staphylococcus aureus) – грамположительные условно-патогенные бактерии рода Staphylococcus, являющиеся наиболее частой причиной стафилококковых, в частности внутрибольничных, инфекций. Золотистые стафилококки в норме могут располагаться на коже, слизистой оболочке носа и реже в гортани, влагалище, кишечнике. Они встречаются у 30 % здоровых людей.
Если у человека слабая иммунная система или нарушен нормальный состав микрофлоры, то при повреждении кожи (слизистых оболочек) золотистый стафилококк может приводить к разнообразным местным и системным инфекционно-воспалительным поражениям:
- кожи (карбункулам, импетиго, фолликулиту),
- молочных желез (маститу),
- дыхательных путей и ЛОР-органов (тонзиллиту, гаймориту, отиту, фарингиту, ларинготрахеиту, пневмонии),
- мочевыводящих путей (уретриту, циститу, пиелонефриту),
- пищеварительной системы (энтероколиту, аппендициту, перитониту, парапроктиту, холециститу),
- костно-суставной системы (остеомиелиту, артриту).

В отдельных случаях возможна генерализация инфекции с развитием септикопиемии. Производимый золотистым стафилококком энтеротоксин вызывает пищевые отравления и синдром токсического шока. Основные источники инфекции: здоровые (носители) и больные люди, домашние и сельскохозяйственные животные, а также пища, содержащая возбудителя инфекции (чаще всего это сахаросодержащие молочные продукты). Инфицирование может происходить контактным и воздушно-пылевым путем. Возможно аутоинфицирование.
Для идентификации золотистого стафилококка проводится посев клинического материала на питательные среды, где при наличии S. aureus через 18-24 часа наблюдается рост колоний золотистого цвета.
Определение количества бактерий может потребоваться, например, чтобы понять, нужно ли проводить лечение: в некоторых случаях, если количество небольшое, лечение не проводится. Решение о его необходимости зависит от клинических проявлений, а также от количества стафилококка. При небольшом содержании микробов и отсутствии симптоматики лечение может вообще не понадобиться, т.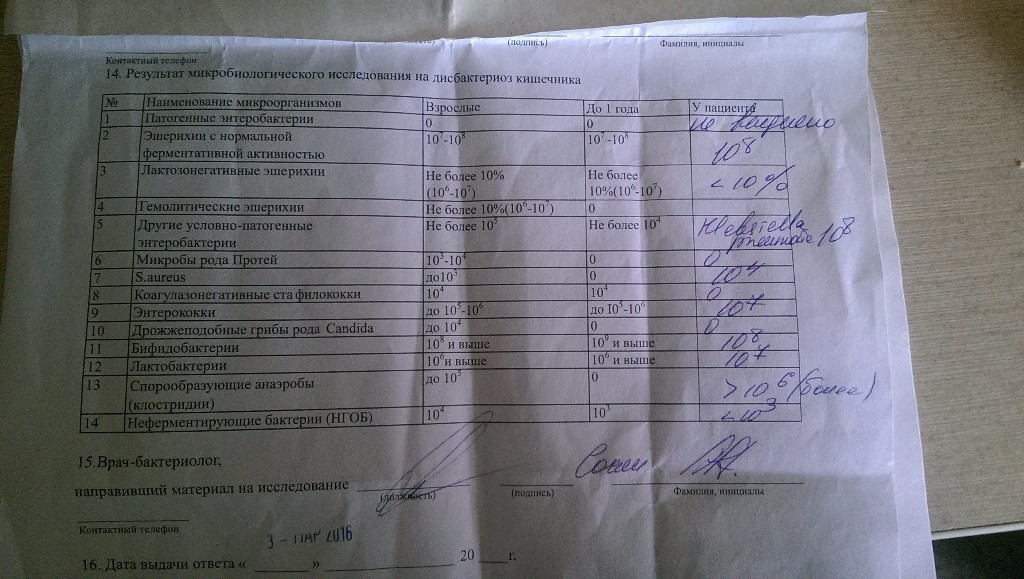
Наличие стафилококка не обязательно означает инфекцию, это может быть бессимптомное носительство, например при посеве мазков из носа и зева носительством считается количество бактерий до 10
Многое зависит от возраста пациента. Например, золотистый стафилококк в количестве 104 является вполне нормальным показателем для детей старше 1 года, но у грудных детей в таком количестве уже потребует лечения.
В любом случае наличие стафилококка при отсутствии симптомов болезни – еще не повод к назначению лекарств.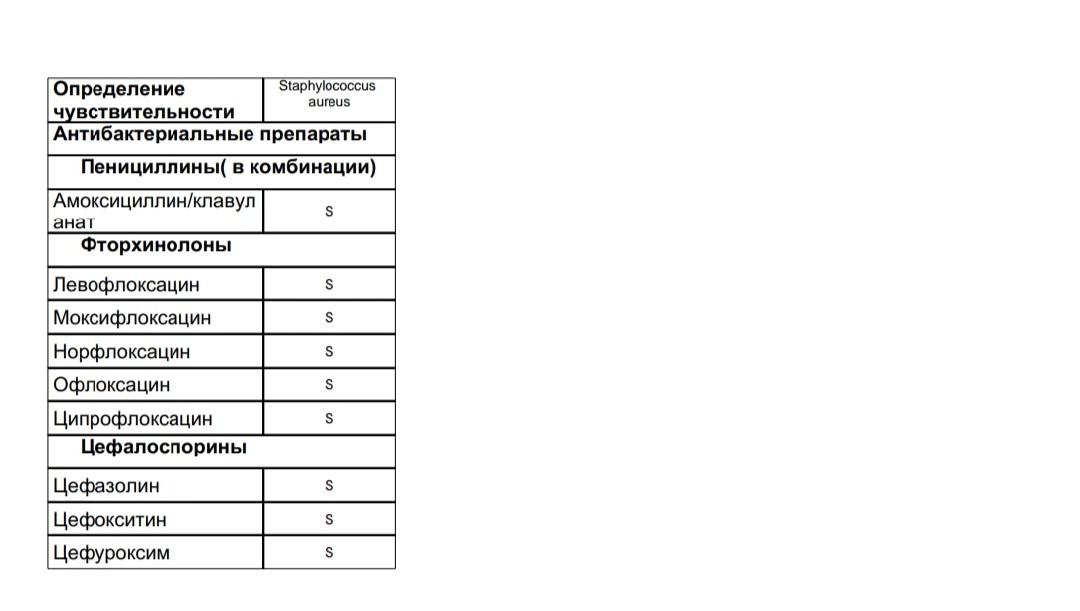
Количество стафилококка может определяться до и после лечения. Если выясняется, что рост возбудителя обильный, значит, инфекция набирает обороты, предыдущая терапия была неудачной и срочно требуется новый курс лечения; умеренный и скудный рост микроорганизмов по результатам последних анализов говорит об успешности терапии. Кроме того, в дальнейшем необходимо контролировать количество стафилококков в течение 1 или 2 месяцев после пройденного лечения.
Отмечено также, что после пребывания больных в хирургической клинике стафилококк обнаруживался у них вдвое чаще, чем при поступлении. У больных, поступающих в стационары, наблюдается замена антибиотикочувствительных стафилококков на антибиотикоустойчивые.
Лечение больных стафилококковой болезнью препаратами пенициллина или другими давно применяемыми антибиотиками часто остается безрезультатным, поскольку такие препараты нередко только усугубляют тяжесть течения инфекции. Поэтому так важно установить, какие антибиотики будут эффективны при лечении стафилококка.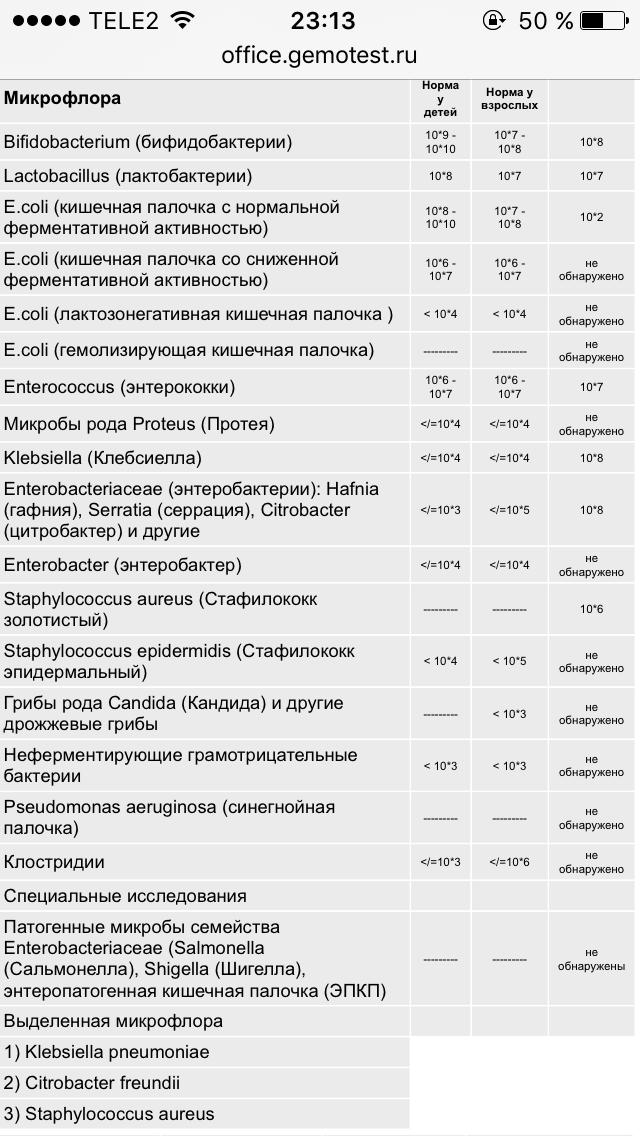
Для чего используется исследование?
- Для определения целесообразности лечения.
- Для дифференциации бактерионосительства и опасного инфицирования.
- Для контроля за состоянием пациента после проведенного лечения.
- Для того чтобы подтвердить, что стафилококк является причиной возникшего заболевания (об этом свидетельствуют высокие показатели посева).
Референсные значения: нет роста.
Золотистый стафилококк в мазке в небольших количествах является частью нормальной микрофлоры человека. Значительное повышение стафилококка в мазке может быть симптомом воспалительного процесса, кожных инфекций (угри и пр.) и очень опасных заболеваний (пневмония, остеомиелит, эндокардит и др.). Результат посева интерпретирует врач исходя из того, в каком количестве выделены микроорганизмы.
Золотистый стафилококк у грудничка | Уроки для мам
О страшном и коварном стафилококке вы наверняка наслышаны. Ваши подруги только и говорят об этой инфекции, как причине всех простудных и кишечных заболеваний. В чем-то они правы, стафилококк вполне может вызывать различные недуги, особенно у новорожденного, но прежде чем рваться в бой с инфекцией, необходимо разобраться.
Ваши подруги только и говорят об этой инфекции, как причине всех простудных и кишечных заболеваний. В чем-то они правы, стафилококк вполне может вызывать различные недуги, особенно у новорожденного, но прежде чем рваться в бой с инфекцией, необходимо разобраться.
Стафилококк – это не диагноз, вы должны знать, что существует несколько десятков разновидностей этой инфекции, и только три из них – опасны для здоровья. Так вот, в эту тройку недругов, наряду с эпидермальным и сапфоритным, входит и золотистый стафилококк. Диагноз золотистый стафилококк у грудничка и должен вызвать у вас беспокойство.
Что такое золотистый стафилококк?
Кокки – это не что иное, как бактерии, они есть у каждого живого организма, могут мирно сосуществовать долгое время, не проявляя своей болезнетворной натуры. А вот стрептококки – это группа кокков. Эти микроорганизмы группируются вместе и образуют своеобразный микроорганизм.
Но вам рано еще бояться, так как не все стрептококки опасны для организма.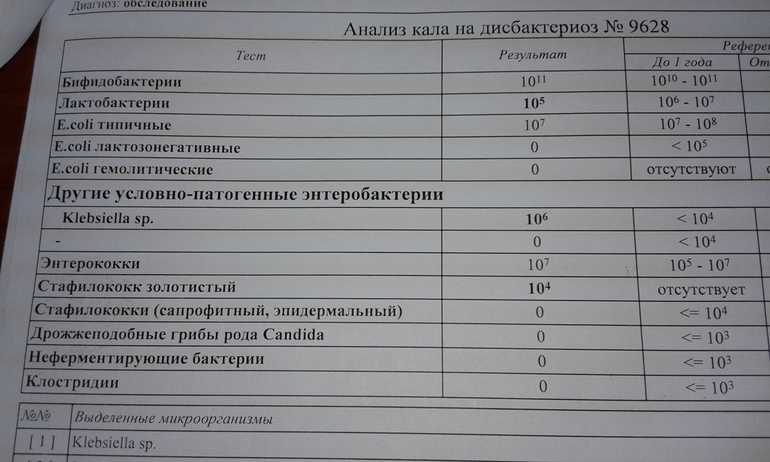 Из 27 видов, известных на сегодняшний день, только три из них приносят вред человеческому организму, и то, при определенных ситуациях.
Из 27 видов, известных на сегодняшний день, только три из них приносят вред человеческому организму, и то, при определенных ситуациях.
Золотистый стафилококк у новорожденных занимает лидирующие позиции в антирейтинге.
Что же такое золотистый стафилококк? Именно этот организм чаще всего становится причиной серьезных заболеваний.
- Проникает куда угодно и поражает любые органы;
- Опасен для людей любого возраста, от младенца до старика;
- Устойчив к лекарственным препаратам;
- Золотистый стафилококк не берет ни солнце, ни кипячение при 150 градусах, ни этиловый спирт, ни соленый раствор, даже перекись водорода эта бактерия превращает в союзники, выделяя из нее кислород.
Этот микроэлемент может долгое время присутствовать в вашем организме, и при ослаблении иммунной системы ринутся в бой.
Свое название этот подвид получил по цвету: под микроскопом скопление золотистых стафилококков имеет ярко выраженный желтый окрас. Выделяется он среди своих собратьев сильнейшей поражающей способностью, а еще неимоверной устойчивостью к лечебным и профилактическим мерам.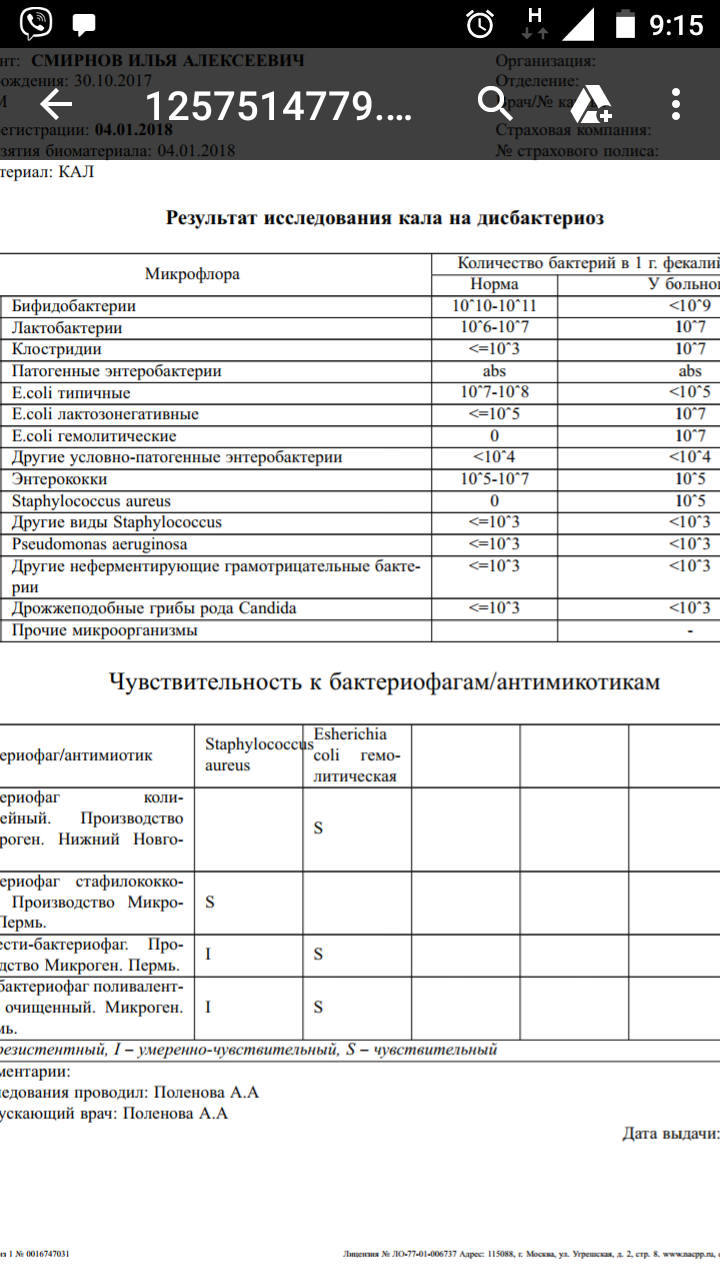 Особо опасен золотистый стафилококк для новорожденных – их неприятное знакомство происходит еще в роддоме.
Особо опасен золотистый стафилококк для новорожденных – их неприятное знакомство происходит еще в роддоме.
Причины заболевания
Новорожденные в первые дни своей жизни особо восприимчивы к различного рода бактериям. Именно поэтому в родильном помещении максимальная стерильность, жесткие карантинные меры. И если, в большинстве случаев, это срабатывает, то относительно стафилококка никакие методы не помогают, ему дезинфекция нипочем.
Знайте! Недоношенный или слабенький грудничок – потенциальная жертва микроорганизма. Иммунитет новорожденного еще не способен противостоять бактериям, поэтому может произойти инфицирование.
Стафилококк может проникнуть через грудное молоко, пуповину, носик малыша, либо же разместиться на нежной коже. Основной путь инфицирования – через маму. Вы знаете, что стафилококк есть у каждого человека, но у сильного и здорового бактерии не развивают какие-либо болезни, другое дело – незащищенный организм новорожденного. Детки постарше могут словить стафилококк на грязных руках или немытых фруктах.
О том, как вырастить ребенка здоровым, смотрите в нашем курсе: Здоровый ребенок>>>
Кто же из новорожденных в зоне риска?
- Дети, которые принимали сильные антибиотики;
- Недоношенные малыши, которые долгое время находились в барокамере и были на искусственном вскармливании;
- Инфицирование через нестерильные трубочки, маски, катетеры;
- Грипп или ветрянка в младенческом возрасте. Читайте актуальную статью Как защитить ребенка от простуды>>>;
- Слабый иммунитет, сахарный диабет;
- Контактное инфицирование от зараженной матери, в том числе через грудное молоко.
Обратите внимание, что инфицированию могут подвергаться все новорожденные, но при сильной защитной функции иммунитета, бактерия не сможет вызвать заболевание. Золотистый стафилококк – это условно-патогенный микроорганизм, который спровоцирует заболевание только при благоприятных условиях.
Симптомы заболевания
Даже если анализ показал наличие золотистого стафилококка – это еще не повод бежать в больницу или аптеку, или еще чего хуже, бросать грудное вскармливание, если бактерии нашли в молоке.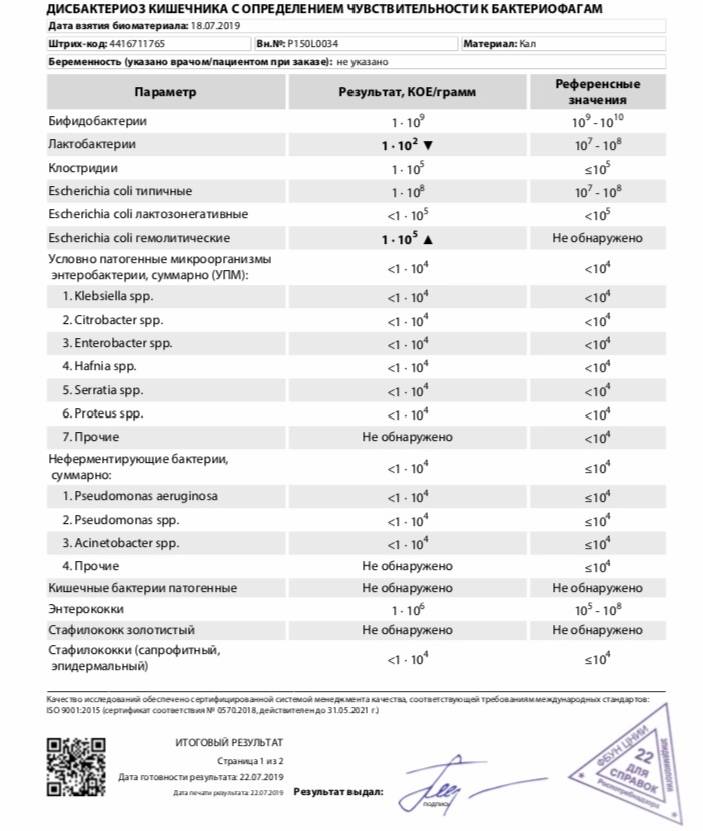 Ваш ориентир – симптоматика. Беспокоиться стоит, если к стафилококку в анализе у новорожденных добавятся следующие симптомы:
Ваш ориентир – симптоматика. Беспокоиться стоит, если к стафилококку в анализе у новорожденных добавятся следующие симптомы:
- Повышенная температура тела;
- Капризность или вялое состояние новорожденного;
- Плохой аппетит, читайте статью, чтобы узнать, почему ребенок не хочет есть>>>
- Расстройство желудка, рвота;
- Кашель;
- Насморк;
- Конъюнктивит, отёчность слизистой, важная статья о конъюнктивите у новорожденных>>>
- Кожные высыпания в виде рассеянных красных прыщей;
- Грипп с сопутствующими симптомами расстройства желудка.
Иногда заболевание проходит бессистемно, выявить патогенную бактерию помогает анализ. При этом опасность ситуации зависит от стадии заражения.
Где живет золотистый стафилококк?
Вы уже знаете, что золотистому стафилококку никакие преграды, кроме сильного иммунитета малыша, не страшны. Он может поселиться на коже, в носу или горлышке, на половых органах новорожденного или кишечнике. Посмотрим, как и где он себя проявляет.
Посмотрим, как и где он себя проявляет.
- На коже. Если вы заметили одиночные рассыпанные высыпания красного цвета у малыша или же чиряки, фурункулы и другие гнойные образования, скорее всего у новорожденного стафилококковая инфекция. Вы удивитесь, как легко вылечить кожные заболевания, вызванные золотистым стафилококком. Этот непобедимый микроорганизм боится зеленки;
При наличии трещин, ран или даже занозы, бактерии могут проникать внутрь организма. Там они умудряются путешествовать по сосудам внутри микротромбов, могут высадиться в любом органе, где станут причиной гнойного процесса. Например, у кормящей мамы через кожу стафилококк может вызвать гнойный мастит.
- В носоглотке. У каждого второго человека хотя бы один раз в жизни был обнаружен стафилококк в носу или горле. Знакомая вам с детства гнойная ангина спровоцирована в большинстве случаев как раз золотистым стафилококком. Причина гнойничков в носу – та же;
- На глазах. Вы ничего не можете поделать с конъюнктивитом или же у малыша постоянные ячмени на веке – проверьте, нет ли инфицирования золотистым стафилококком;
- В кишечнике.
 Не случайно кишечник в нашем списке оказался на последнем месте. Сюда стафилококку труднее всего пробраться, к тому же, иммунная система на этом участке самая сильная. Но есть несколько факторов, которые по одну сторону баррикад со стафилококком – это дисбактериоз. Он то и создает положительную среду для размножения и действия микроорганизма.
Не случайно кишечник в нашем списке оказался на последнем месте. Сюда стафилококку труднее всего пробраться, к тому же, иммунная система на этом участке самая сильная. Но есть несколько факторов, которые по одну сторону баррикад со стафилококком – это дисбактериоз. Он то и создает положительную среду для размножения и действия микроорганизма.
При отсутствии лечения и нужных профилактических мер, стафилококк, например, может мигрировать в другие органы: так из носоглотки он может проникнуть в легкие и стать причиной пневмонии. То есть, вы не должны пускать все на самотек, ожидая чуда от иммунной системы грудничка, но и сразу же скупать антибиотики не надо.
Как лечат стафилококковую инфекцию
- Стафилококковая инфекция довольно часто угрожает малышам в первые сутки после родов, когда организм особенно слаб. Выявленный стафилококк у новорожденных требует лечения в стационаре, в стерильной камере. Вы не должны при этом отказываться от грудного кормления, так как в молоке есть все необходимые иммунноукрепляющие компоненты;
- Если стафилококк выявлен в кишечнике, от госпитализации также не стоит отказываться;
- А вот кожные заболевания и носоглотку, при быстром реагировании, можно лечить и дома.

Золотистый стафилококк боится зеленки и хлорофиллипта, не нравятся ему и травяные отвары календулы, ромашки и зверобоя (читайте похожую статью Травы для купания новорожденного>>>). А вот аптечные препараты самостоятельно назначать новорожденному не стоит. Этого зверя голыми руками не возьмешь, прежде чем принимать лекарство, нужно сделать бактериальный посев. Зато укрепить иммунитет витаминами не только можно, но и нужно.
Профилактика – это панацея от золотистого стафилококка. В кишечнике у грудничка с сильным иммунитетом никогда не будет расстройств, да и гнойная ангина не прицепится к карапузу, которого закаляют родители. И еще, грудное вскармливание – идеальный враг инфекций. Подробнее о кормлении грудью>>>
Стафилококк у грудничка: норма и патология?
Симптомы в виде боли в области живота, пенистый кал желтоватого цвета, при выявлении стафилококка у новорожденных в кале явно свидетельствуют об инфицировании. Какую бы степень не показывал анализ, нормой считается отсутствие золотистого стафилококка у грудничка в кале. Ему там не место и быть его в кишечнике малыша не должно.
Ему там не место и быть его в кишечнике малыша не должно.
Что касается других анализов, таких как мазок из зева или носа, золотистый стафилококк 10 в 4 степени или 10 в 3 степени у малышей старше года, при общем хорошем самочувствии, не требует медицинского лечения – только иммуннокоррекция. Но у детей до года даже такой минимальный процент без внимания оставлять нельзя.
А вот золотистый стафилококк 10 в 5 степени в бакпосеве говорит о значительном росте болезнетворных микроорганизмов, пора на прием к медикам.
Итак, главное правило борьбы с золотистым стафилококком – профилактические меры в виде закаливания, грудного вскармливания и адекватного лечения в случае инфицирования. Без надобности не стоит бросаться за антибиотиками, так как в следующий раз врага этим уже не пронять.
Читайте также:
Автор: Людмила Шарова
О стафилококке и стафилококковой инфекции — Министерство здравоохранения ПМР
Стафилококки — это целый род микроорганизмов, на сегодня известно уже 27 видов, при этом 14 видов обнаружены на коже и слизистых оболочках человека. Большинство стафилококков абсолютно безвредны. Из упомянутых 14 видов, чаще всего три способны вызывать болезни: золотистый стафилококк (самый распространенный и вредоносный), эпидермальный стафилококк (также патогенный, но гораздо менее опасный, чем золотистый) и сапрофитный стафилококк – практически безвредный, тем не менее, также способный вызывать заболевания.
Большинство стафилококков абсолютно безвредны. Из упомянутых 14 видов, чаще всего три способны вызывать болезни: золотистый стафилококк (самый распространенный и вредоносный), эпидермальный стафилококк (также патогенный, но гораздо менее опасный, чем золотистый) и сапрофитный стафилококк – практически безвредный, тем не менее, также способный вызывать заболевания.
Практически все связанные со стафилококком медицинские проблемы подразумевают присутствие именно золотистого стафилококка, обладающего удивительной живучестью: не теряет активности при высушивании, 12 часов живет под воздействием прямых солнечных лучей, в течение 30 минут выдерживает температуру в 800 С, не погибает в чистом этиловом спирте, не боится перекиси водорода.
Стафилококки распространены повсеместно, их можно обнаружить практически на любом участке человеческого тела и окружающих предметах. В течение первой недели жизни у 90% новорожденных в полости носа выявляется золотистый стафилококк.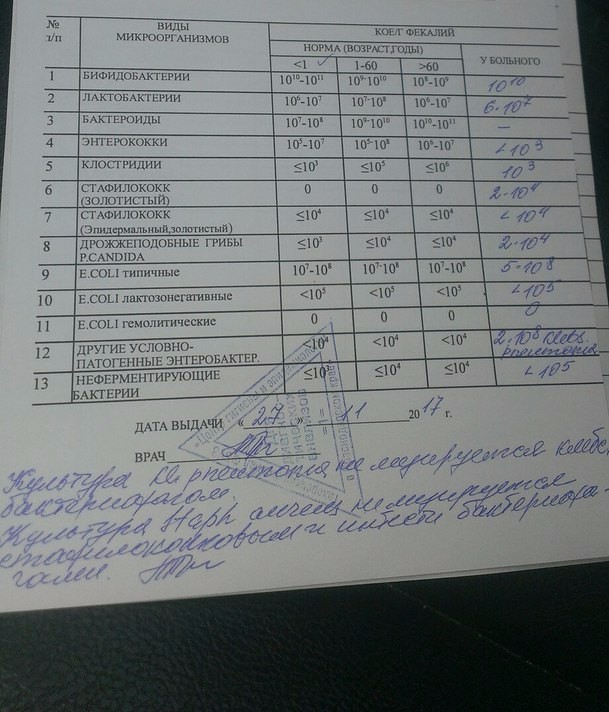 В первые два года жизни у 20% детей обнаруживаются золотистые стафилококки в полости носа, а к 4-6 годам они обнаруживаются у 30-50%, у взрослых носительство колеблется в пределах 12-50%.
В первые два года жизни у 20% детей обнаруживаются золотистые стафилококки в полости носа, а к 4-6 годам они обнаруживаются у 30-50%, у взрослых носительство колеблется в пределах 12-50%.
Важно всегда разграничивать такие понятия, как стафилококк и стафилококковая инфекция. Золотистый стафилококк является условно-патогенным микроорганизмом, представителем нормальной человеческой микрофлоры. Термин «условно-патогенный» означает, что стафилококк вызывает заболевание лишь при определенных обстоятельствах. Он может находиться в организме долгое время (хоть всю жизнь), не причиняя человеку вреда и должны создаться определенные условия, чтобы он вызвал болезнь. А именно – ослабление иммунитета. Если иммунная защита человека работает нормально, стафилококк существует в организме, не причиняя «хозяину» никакого беспокойства. Если иммунитет дает сбой, стафилококк может атаковать организм человека, что ведет к появлению самых различных болезней (более ста наименований): от относительно легких кожных гнойничковых инфекций до таких тяжелых процессов как пневмония (воспаление легких), менингит (воспаление оболочек мозга), остеомиелит (поражение костей), сепсис (воспалительный процесс во всех органах человека или «заражение крови»), токсический шок и другие.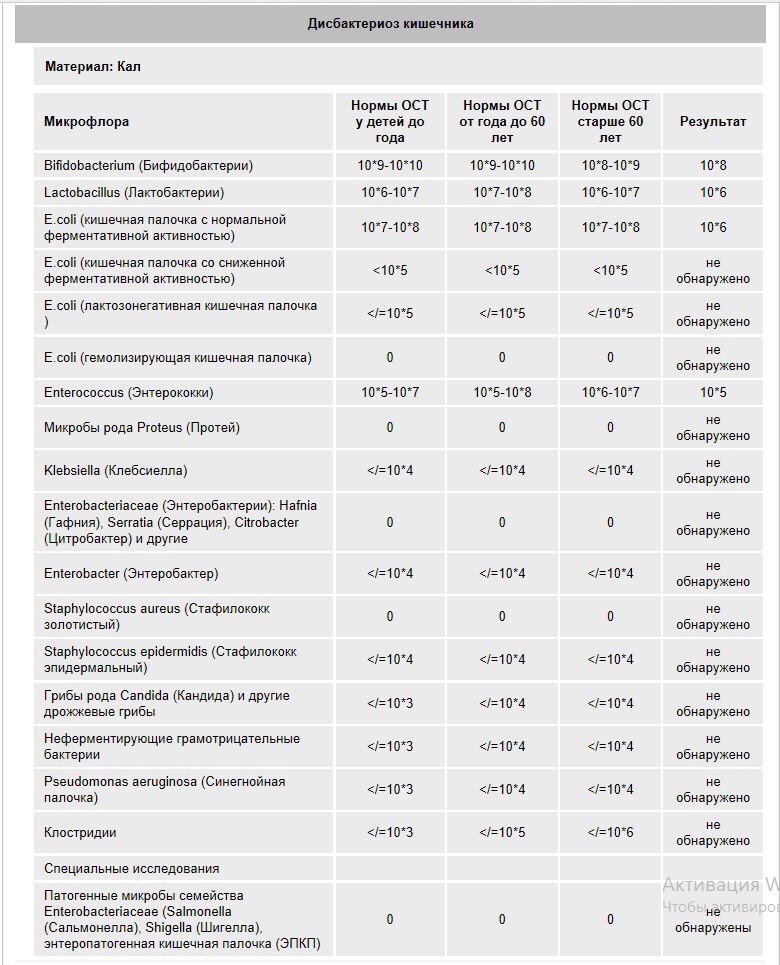 Самая распространенная токсическая стафилококковая болезнь – пищевая токсикоинфекция.
Самая распространенная токсическая стафилококковая болезнь – пищевая токсикоинфекция.
Безусловно, стафилококковые инфекции подлежат лечению. Этим занимаются врачи различных специальностей. Лечение стафилококковых болезней — удивительно сложная задача, ибо нет микроба, способного сравниться со стафилококком по способности вырабатывать устойчивость к антибиотикам и другим антибактериальным средствам. Поэтому лечение необходимо назначать только после определения чувствительности к антибактериальным средствам. С этим согласны все специалисты.
Сложнее обстоят дела при здоровом носительстве, когда микроб присутствует в организме человека (например, на слизистой носоглотки), но заболевание не развивается вследствие равновесия факторов агрессии микроба и защитных сил иммунной системы человека. Вместе с тем, носитель может представлять серьезную опасность для окружающих. Особенно опасен такой человек, если он работает в пищевой отрасли (повар, раздатчик готовых блюд), в медицине (медицинская сестра детского отделения, врач хирург или акушер-гинеколог и др.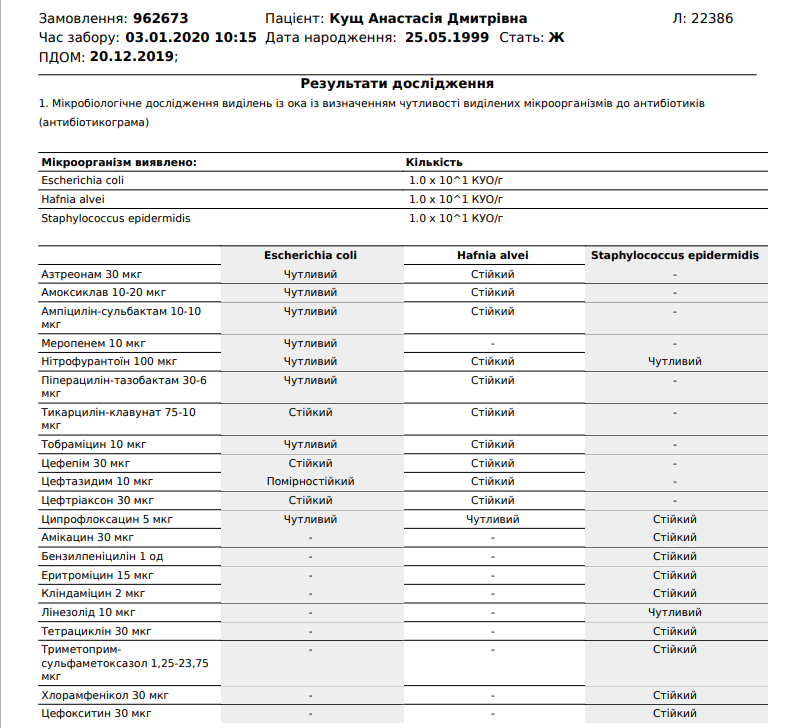 ).
).
Вопросы лечения носительства золотистого стафилококка будоражат медицинскую общественность не одно десятилетие. Когда с этой условно-патогенной бактерией нужно бороться, а когда — нет? Что делать с устойчивым штаммом? Чем его лечить?
Носительство без симптомов лечить не нужно! Ничем и никогда. Живите спокойно и забудьте об этом анализе. Если у совершенно здорового ребенка или взрослого вдруг в посеве кала (грудного молока, мазка из носоглотки, зева, влагалища и так далее) высевается золотистый стафилококк, лечить его не имеет никакого смысла.
При носительстве с симптомами нужно быть полностью уверенным, что они имеют отношение к золотистому стафилококку. Только в таком случае, после консультации врача, можно брать рецепт и идти в аптеку.
Обязательному лечению подлежат люди, которые, будучи носителями стафилококка, при исполнении своих профессиональных обязанностей могут вызвать возникновение стафилококковой инфекции у других людей. Список профессий, представители которых подлежат лечению в связи с носительством стафилококка, оговорен специальным директивным документом. Помимо медицинских работников в него входят, например, работники сферы общественного питания. Опасность стафилококконосительства в этой категории состоит еще и в том, что стафилококки могут попасть в приготавливаемую пищу и вызвать массовое заболевание пищевой токсикоинфекцией. Также имеет смысл проходить лечение здоровым носителям стафилококка, проживающим совместно с людьми, которые страдают повторными стафилококковыми инфекциями (например, фурункулезом) или тяжелыми хроническими болезнями.
Помимо медицинских работников в него входят, например, работники сферы общественного питания. Опасность стафилококконосительства в этой категории состоит еще и в том, что стафилококки могут попасть в приготавливаемую пищу и вызвать массовое заболевание пищевой токсикоинфекцией. Также имеет смысл проходить лечение здоровым носителям стафилококка, проживающим совместно с людьми, которые страдают повторными стафилококковыми инфекциями (например, фурункулезом) или тяжелыми хроническими болезнями.
Лечение носительства золотистого стафилококка антибиотиками нецелесообразно. В арсенале специалистов достаточно других средств. Лечение антибиотиками дисбактериоза с высоким содержанием стафилококка вовсе противопоказано, так как это приведет к противоположному результату – более интенсивному размножению стафилококка.
Профилактика стафилококковой инфекции включает в себя: соблюдение правил личной гигиены, отказ от вредных привычек, здоровое питание и полноценный сон. Необходимо избегать общих переохлаждений и перегревов, своевременно обрабатывать антисептиками (йод, зеленка) микротравмы кожи.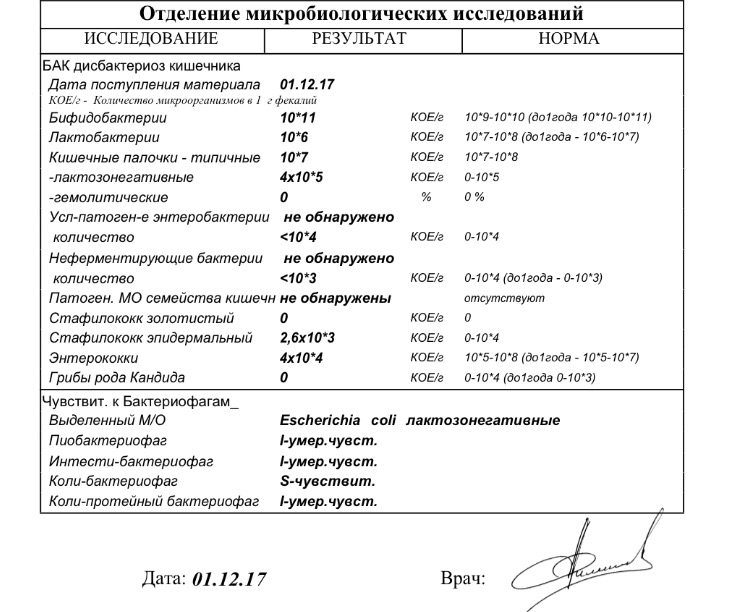 Необходимо выявлять и лечить носителей золотистого стафилококка, особенно работающих в учреждениях здравоохранения и общественного питания, на время лечения такие лица не допускаются к исполнению своих обязанностей
Необходимо выявлять и лечить носителей золотистого стафилококка, особенно работающих в учреждениях здравоохранения и общественного питания, на время лечения такие лица не допускаются к исполнению своих обязанностей
Ни в коем случае не отчаивайтесь, если у Вас обнаружен стафилококк. Победить его можно, сделать это будет легче при своевременном обращении к врачу и четком выполнении рекомендаций по лечению и профилактике, впрочем, это правило относится к любому заболеванию. Всегда согласовывайте свои действия с врачом.
Будьте здоровы.
Врач эпидемиолог С. С. Пынзарь
Дисбактериоз кишечника — Клиника Здоровье 365 г. Екатеринбург
Микробиоцеоз – это сообщество микроорганизмов, обитающих на территориально ограниченном участке с однородными условиями жизни. Бактерии нормальной кишечной флоры живут, прикрепляясь к кишечной стенке и образуя пленку, покрывающую кишечник изнутри. Через эту пленку происходит все всасывание в кишечнике. Бактерии нормальной кишечной микрофлоры обеспечивают по совокупности 50 – 80% всего пищеварения, а также выполняют защитные функции, нейтрализуют действие чужеродных и гнилостных бактерий. Бифидобактерии. Это основные представители нормальной кишечной микрофлоры, количество которых в кишечнике должно быть 95 – 99%. Бифидобактерии выполняют важную работу по расщеплению, перевариванию и всасыванию различных компонентов пищи, например, углеводов; они сами синтезируют витамины, а также способствуют усвоению их из пищи. При участии бифидобактерий происходит всасывание в кишечнике железа, кальция и других важных микроэлементов; нейтрализуют различные токсические вещества. В бланке анализа указывается титр бифидобактерий, который должен быть не меньше 107 – 108. Существенное снижение количества бифидобактерий – признак выраженного дисбактериоза.
Через эту пленку происходит все всасывание в кишечнике. Бактерии нормальной кишечной микрофлоры обеспечивают по совокупности 50 – 80% всего пищеварения, а также выполняют защитные функции, нейтрализуют действие чужеродных и гнилостных бактерий. Бифидобактерии. Это основные представители нормальной кишечной микрофлоры, количество которых в кишечнике должно быть 95 – 99%. Бифидобактерии выполняют важную работу по расщеплению, перевариванию и всасыванию различных компонентов пищи, например, углеводов; они сами синтезируют витамины, а также способствуют усвоению их из пищи. При участии бифидобактерий происходит всасывание в кишечнике железа, кальция и других важных микроэлементов; нейтрализуют различные токсические вещества. В бланке анализа указывается титр бифидобактерий, который должен быть не меньше 107 – 108. Существенное снижение количества бифидобактерий – признак выраженного дисбактериоза.
Лактобактерии (лактобациллы, молочнокислые микробы, молочнокислые стрептококки).
Второй по представительству (5% в совокупности микроорганизмов кишечника) и по значимости представитель нормальной флоры. Лактобактерии или молочнокислые микробы вырабатывают молочную кислоту – важнейший компонент для нормальной работы кишечника. В результатах исследования их количество должно быть не меньше 106 – 107. Дефицит лактобактерий может привести к развитию аллергических заболеваний, запоров, лактазной недостаточности.
Кишечная палочка с нормальной ферментативной активностью (эшерихии).
Третий представитель нормальной флоры. Количество кишечной палочки среди других бактерий не превышает 1%, но роль ее очень важна. Во-первых, кишечная палочка является главным конкурентом условно-патогенной флоры, препятствуя заселению чужеродными микробами кишечной стенки; во-вторых, кишечная палочка забирает из просвета кишечника кислород, который является ядом для бифидобактерий и лактобактерий. Снижение общего количества кишечной палочки может быть признаком присутствия в кишечнике небактериальных паразитов (глистов, простейших, которые также нуждаются в кислороде, обделяя им кишечную палочку).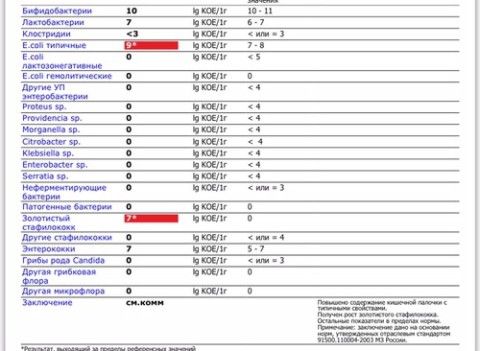 Кишечная палочка со сниженной ферментативной активностью. Это неполноценная кишечная палочка, которая не представляет никакого вреда, но при этом не выполняет своих полезных функций. Присутствие данного показателя в анализе является признаком начинающегося дисбактериоза, а также как и снижение общего количества может быть косвенным признаком присутствия в кишечнике глистов или простейших.
Кишечная палочка со сниженной ферментативной активностью. Это неполноценная кишечная палочка, которая не представляет никакого вреда, но при этом не выполняет своих полезных функций. Присутствие данного показателя в анализе является признаком начинающегося дисбактериоза, а также как и снижение общего количества может быть косвенным признаком присутствия в кишечнике глистов или простейших.
В некоторых анализах описываются бактероиды, роль которых неясна, но известно, что это – не вредные бактерии, обычно их количество не имеет практического значения. Все остальные показатели микрофлоры являются условно-патогенной флорой. Они становятся патогенными (нарушающими нормальные функции кишечника) при определенных условиях: повышение их абсолютного количества или снижении функции иммунной системы.
Условно-патогенная флора – это лактозонегативные энтеробактерии (клебсиелла, протей, цитробактеры, энтеробактеры, гафнии, серрации), гемолизирующая кишечная палочка и различные кокки (энтерококки, эпидермальные или сапрофитные стафилококки, золотистый стафилококк).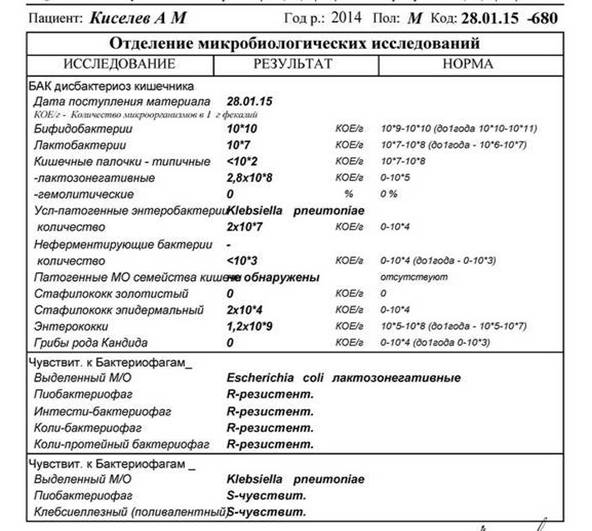 Кроме того, к условно-патогенным относятся клостридии, которые высеваются не во всех лабораториях. Условно-патогенная флора внедряется, конкурируя с полезными бактериями, в микробную пленку кишечника, заселяет кишечную стенку и вызывает нарушения работы всего желудочно-кишечного тракта. Дисбактериоз кишечника с повышенным содержанием условно-патогенной флоры может сопровождаться аллергическими кожными реакциями, нарушениями стула (запоры, поносы, зелень и слизь в кале), болями в животе, вздутиями живота, срыгиваниями, рвотами.
Кроме того, к условно-патогенным относятся клостридии, которые высеваются не во всех лабораториях. Условно-патогенная флора внедряется, конкурируя с полезными бактериями, в микробную пленку кишечника, заселяет кишечную стенку и вызывает нарушения работы всего желудочно-кишечного тракта. Дисбактериоз кишечника с повышенным содержанием условно-патогенной флоры может сопровождаться аллергическими кожными реакциями, нарушениями стула (запоры, поносы, зелень и слизь в кале), болями в животе, вздутиями живота, срыгиваниями, рвотами.
Кокковые формы в общей сумме микробов.
Самыми безобидными представителями условно-патогенной флоры являются энтерококки. Они наиболее часто встречаются в кишечнике у здоровых людей, их количество до 106 — 107 не представляет угрозы здоровью. Если количество превышает 25% (более 107), это чаще всего связано со снижением нормальной флоры. Эпидермальный (или сапрофитный) стафилококк (S. epidermidis, S. saprophyticus). Эти виды стафилококков могут вызывать нарушения, но их количество до 104 является допустимым. Золотистый стафилококк (S. aureus). Один из самых неприятных (наряду с гемолизирующей кишечной палочкой, протеем и клебсиеллой) представителей условно-патогенной флоры. Даже небольшие его количества могут вызвать выраженные клинические проявления, особенно у детей первых месяцев жизни. Поэтому обычно в нормах, приведенных в бланке анализа, указывается, что его быть не должно (на самом деле допустимы количества, не превышающие 103). Патогенность золотистого стафилококка напрямую зависит от состояния нормальной флоры: чем больше бифидобактерий, лактобактерий и нормальной кишечной палочки, тем меньше вреда от стафилококка. Гемолизирующая кишечная палочка. Является представителем лактозонегативных энтеробактерий, но выделяется отдельно в связи с распространенностью и значимостью. В норме должна отсутствовать. К данному микробу применимо практически все, сказанное про золотистый стафилококк.
saprophyticus). Эти виды стафилококков могут вызывать нарушения, но их количество до 104 является допустимым. Золотистый стафилококк (S. aureus). Один из самых неприятных (наряду с гемолизирующей кишечной палочкой, протеем и клебсиеллой) представителей условно-патогенной флоры. Даже небольшие его количества могут вызвать выраженные клинические проявления, особенно у детей первых месяцев жизни. Поэтому обычно в нормах, приведенных в бланке анализа, указывается, что его быть не должно (на самом деле допустимы количества, не превышающие 103). Патогенность золотистого стафилококка напрямую зависит от состояния нормальной флоры: чем больше бифидобактерий, лактобактерий и нормальной кишечной палочки, тем меньше вреда от стафилококка. Гемолизирующая кишечная палочка. Является представителем лактозонегативных энтеробактерий, но выделяется отдельно в связи с распространенностью и значимостью. В норме должна отсутствовать. К данному микробу применимо практически все, сказанное про золотистый стафилококк.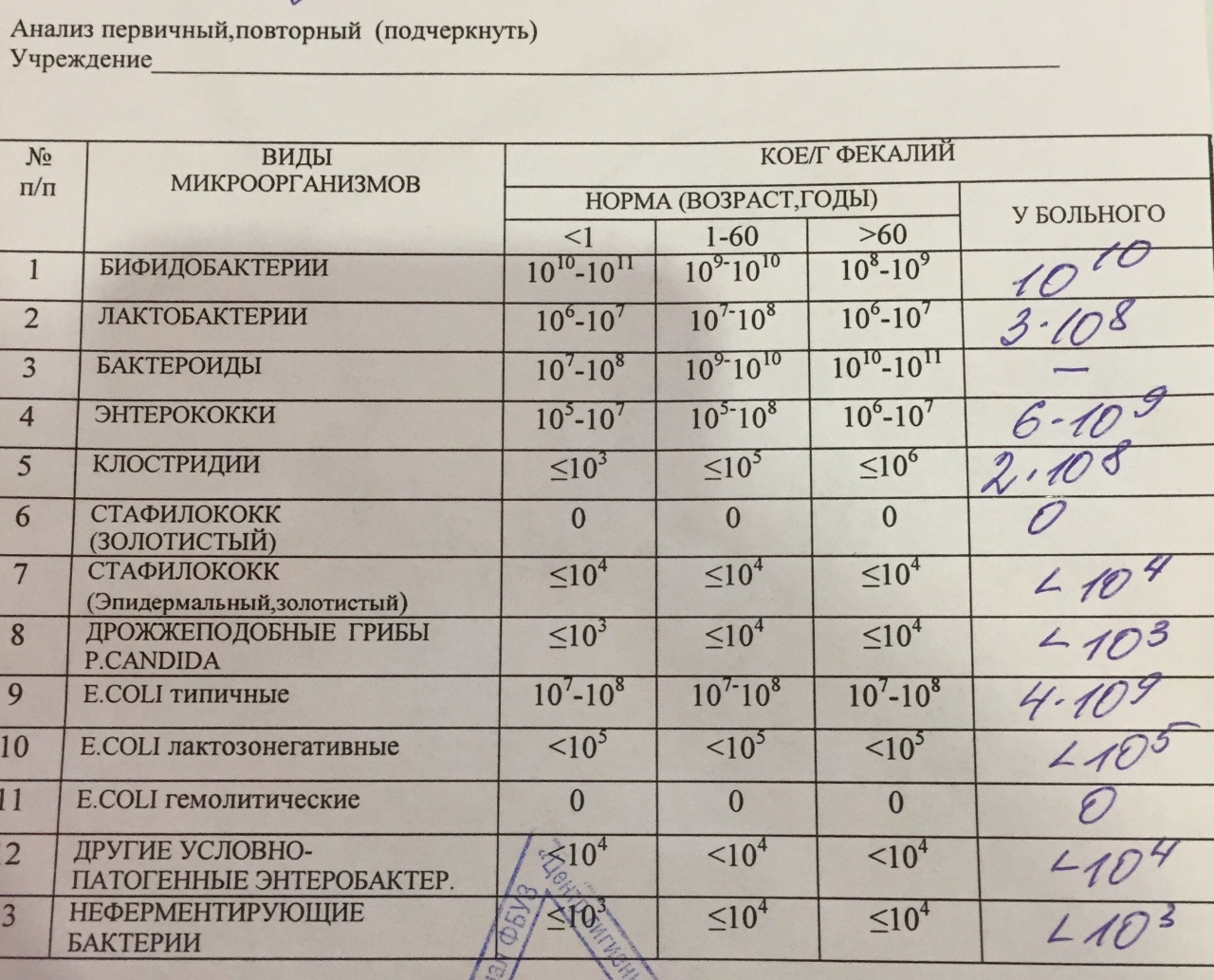 То есть, она может вызывать аллергические и кишечные проблемы, очень распространена в окружающей среде (правда, практически никогда не встречается в грудном молоке), вызывает проблемы у ослабленных детей, требует иммунокоррекции. Следует отметить, что термин “гемолизирующая” не означает, что имеется какое-то влияние на кровь. Лактозонегативные энтеробактерии. Большая группа условно-патогенных бактерий большей или меньшей степени патогенности. Их количество не должно превышать (в титрах: 103 – 106 ). Наиболее неприятными бактериями из этой группы являются протей (чаще всего с ними связаны запоры) и клебсиеллы (являются прямыми антагонистами (конкурентами) лактобактерий, что приводит к развитию аллергии и запоров, а также к проявлениям лактазной недостаточности). Часто в бланке анализа указывается общее количество лактозонегативных энтеробактерий (наиболее информативно процентное соотношение), а затем идет расшифровка: клебсиеллы, протей, хафнии, серрации, энтеробактерии и цитробактерии.
То есть, она может вызывать аллергические и кишечные проблемы, очень распространена в окружающей среде (правда, практически никогда не встречается в грудном молоке), вызывает проблемы у ослабленных детей, требует иммунокоррекции. Следует отметить, что термин “гемолизирующая” не означает, что имеется какое-то влияние на кровь. Лактозонегативные энтеробактерии. Большая группа условно-патогенных бактерий большей или меньшей степени патогенности. Их количество не должно превышать (в титрах: 103 – 106 ). Наиболее неприятными бактериями из этой группы являются протей (чаще всего с ними связаны запоры) и клебсиеллы (являются прямыми антагонистами (конкурентами) лактобактерий, что приводит к развитию аллергии и запоров, а также к проявлениям лактазной недостаточности). Часто в бланке анализа указывается общее количество лактозонегативных энтеробактерий (наиболее информативно процентное соотношение), а затем идет расшифровка: клебсиеллы, протей, хафнии, серрации, энтеробактерии и цитробактерии.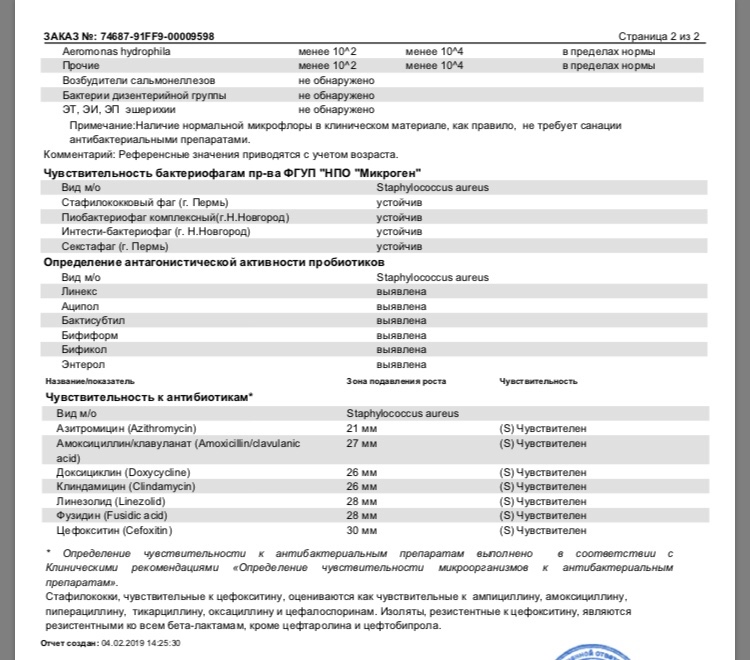 Обычно какие-то количества этих бактерий постоянно живут в кишечнике, не вызывая проблем. В нормах могут быть указаны цифры от 104 до 105, являющиеся допустимыми.
Обычно какие-то количества этих бактерий постоянно живут в кишечнике, не вызывая проблем. В нормах могут быть указаны цифры от 104 до 105, являющиеся допустимыми.
Грибы рода Candida.
Допустимо присутствие до 103. Повышение этого параметра может быть после применения антибиотиков. Если количество грибов повышено, а количество нормальной кишечной флоры резко снижено, при этом отмечается кандидоз (молочница) видимых слизистых оболочек (ротовая полость, половые органы) – это проявления системного кандидоза, то есть имеется инфицирование грибами кишечника. Если же количество грибов в анализе на дисбактериоз увеличено, но нет снижения нормальной кишечной флоры, это свидетельствует о том, что грибы живут на коже вокруг заднего прохода, а не в кишечнике, в этом случае достаточно наружной терапии с использованием противогрибковых мазей или кремов.
Клостридии. Допустимое количество до 105.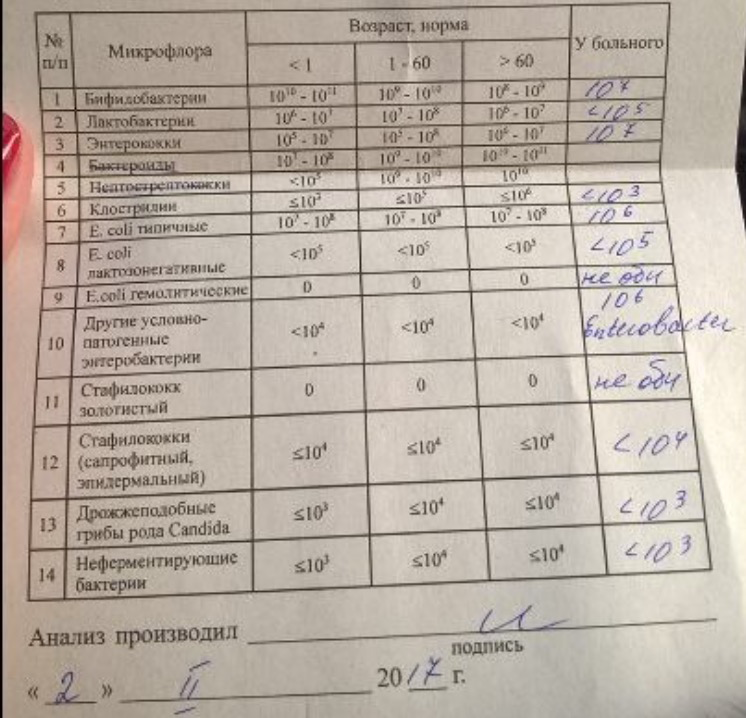 Проявляют патогенность обычно в комплексе с другой условно-патогенной флорой, редко изолированно вызывают проблемы (чаще всего – разжижение стула, понос). Их количество зависит от функции местного иммунитета кишечника.
Проявляют патогенность обычно в комплексе с другой условно-патогенной флорой, редко изолированно вызывают проблемы (чаще всего – разжижение стула, понос). Их количество зависит от функции местного иммунитета кишечника.
Прочие микроорганизмы.
В данном параметре описываются редко встречающиеся виды бактерий, самым опасным из которых является синегнойная палочка (Pseudomonas aerugenosa). Чаще всего, микроорганизмы, описанные в этой позиции, не имеют практического значения. Термин “abs” обозначает отсутствие данного микроорганизма, также употребляется “не обнаружено”.
Как сдать материал на бактериологическое исследование -Лаборатории, параклиники
Как сдать материал на бактериологическое исследованиеБактериологическая лаборатория
-пациентам: как сдать материал на бактериологическое исследование
Общие требования к сбору и транспортировке проб биологического материала для бактериологического исследования:
- Пробы необходимо собирать до начала антибактериальной терапии, при отсутствии такой возможности – посредственно перед повторным приемом (введением) препарата.

- Пробы необходимо собирать с минимальным загрязнением материала нормальной микрофлорой, т.к. её наличие приводит к ошибочной трактовке результата
- Пробы необходимо собирать в стерильную одноразовую посуду, предназначенную для бактериологических исследований. Недопустимо мыть стерильный контейнер перед использованием!
- При сборе и транспортировке пробы не загрязнять наружную поверхность посуды и сопроводительные документы (направления)
- Собранные пробы доставляют в лабораторию не позднее 2-х часов с момента сбора, в случае использования транспортной системы (стерильная пробирка с транспортной средой и тампоном, стерильно упакованным вместе с пробиркой) – в течение 48-72 часов.
ВНИМАНИЕ!
Несоблюдение правил может привести к необходимости повторной сдачи анализа или неправильной трактовке результата
Посуда, используемая для транспортировки проб в бактериологическую лабораторию
Направление в бактериологическую лабораторию ГКБ №15 им. О.М.Филатова на бактериологическое исследование (бак. посев)
О.М.Филатова на бактериологическое исследование (бак. посев)
Копия страхового полиса
Посуда, используемая для транспортировки проб в бактериологическую лабораторию
Вид исследования | Посуда |
Материал собирает пациент самостоятельно | |
бактериологическое исследование мочи с определением степени бактериурии | стерильный одноразовый контейнер |
бактериологическое исследование кала на патогенную кишечную флору | стерильный одноразовый контейнер с вмонтированной в крышку ложечкой |
бактериологическое исследование кала на дисбактериоз | стерильный одноразовый контейнер с вмонтированной в крышку ложечкой |
бактериологическое исследование мокроты | стерильный одноразовый контейнер |
бактериологическое исследование грудного молока | стерильный одноразовый контейнер |
качественное определение антигена Helicobacter pylori в фекалиях человека | Стерильный одноразовый контейнер с вмонтированной в крышку ложечкой |
качественное определение антигенов токсинов А и В Clostridium difficile в фекалиях человека | стерильный одноразовый контейнер с вмонтированной в крышку ложечкой |
Материал забирает специалист в медицинском учреждении | |
бактериологическое исследование отделяемого из различных очагов воспаления:, отиты, синуситы, отделяемое ран и др. | стерильная пробирка с транспортной средой и тампоном, стерильно упакованным вместе с пробиркой |
бактериологическое исследование пунктатов, выпотов, экссудатов | стерильный одноразовый контейнер, стерильная пробирка с транспортной средой и тампоном, стерильно упакованным вместе с пробиркой |
бактериологическое исследование отделяемого слизистой оболочки зева и носа на условно патогенную микрофлору | стерильная пробирка с транспортной средой и тампоном, стерильно упакованным вместе с пробиркой |
Бактериологическое исследование отделяемого слизистой оболочки зева и носа на золотистый стафилококк (S.aureus) | стерильная пробирка с транспортной средой и тампоном, стерильно упакованным вместе с пробиркой |
бактериологическое исследование отделяемого половых органов на условно патогенную микрофлору | стерильная пробирка с транспортной средой и тампоном, стерильно упакованным вместе с пробиркой |
бактериологическое исследование отделяемого конъюнктивы | стерильная пробирка с транспортной средой и тампоном, стерильно упакованным вместе с пробиркой |
Правила сбора биологических материалов, собираемых пациентами самостоятельно
МОЧА
- Перед сбором пробы необходимо тщательно промыть наружные половые органы и область заднего прохода теплой водой с мылом.

- Не допускается использование дезинфектантов для проведения обработки.
- Не допускается собирать мочу с постельного белья, из мочеприемника или судна.
- Для анализа следует собирать среднюю порцию утренней мочи. Начать мочеиспускание в унитаз, среднюю порцию собрать в стерильный одноразовый контейнер в количестве 10-20 мл, закончить мочеиспускание в унитаз.
- Пробу необходимо доставить в лабораторию не позднее 2 часов с момента сбора.
ФЕКАЛИИ
- Собирать фекалии для исследования следует утром.
- Дефекацию производят в сухую чистую, предварительно продезинфицированную ёмкость. Важно тщательно удалить дезинфектанты с поверхности емкости, ополоснуть кипятком и охладить до комнатной температуры.
- Перенести пробу кала 3-4 ложечки (1,5-2,0 г) в стерильный одноразовый контейнер при помощи вмонтированного в его крышку стерильного шпателя-ложечки. При наличии в испражнении патологических примесей – гной, слизь, кровь, хлопья – их необходимо включить в отбираемую пробу.
 — Если фекалии жидкие, контейнер заполняют не более чем на 1/3 объема.
— Если фекалии жидкие, контейнер заполняют не более чем на 1/3 объема. - У реанимационных больных, маленьких детей допускается собирать материал со стерильной сухой пеленки, не касаясь ткани.
- Не допускать попадания в пробу кала мочи или воды.
- Пробу доставляют в лабораторию не позднее 2-х часов с момента сбора. В случае крайней необходимости (невозможности получить утреннюю пробу), допустимо оставить материал, полученный накануне во время вечерней дефекации, в холодильнике, и доставить его в лабораторию утром.
- Внимание! При назначении анализа кала на определение антигена токсинов Clostridium difficile исследованию подлежит только жидкий стул.
МОКРОТА
- Перед сбором мокроты пациент должен почистить зубы и прополоскать рот и горло теплой кипяченой водой.
- Важно, чтобы в контейнер не попало содержимое носоглотки или слюни.
- Пробу мокроты, полученную в результате глубокого кашля, собирают в стерильный одноразовый контейнер с завинчивающейся крышкой.

- Пробу доставляют в лабораторию не позднее 2-х часов с момента сбора.
ГРУДНОЕ МОЛОКО
- При сцеживании молока женщина моет руки с мылом и тщательно обрабатывает соски и околососковую область отдельными смоченными 700 спиртом ватными тампонами.
- Молоко из правой и левой молочных желез исследуется отдельно.
- Первые 5-10 мл молока выливаются, последующие 3-4 мл сцеживаются в стерильный одноразовый контейнер.
- Пробы доставляют в лабораторию в сроки не более 3 часов до момента исследования.
- Молоко, сцеженное накануне, исследованию не подлежит.
Стерильные одноразовые контейнеры для бактериологических исследований приобретаются самостоятельно в аптеках.
В бактериологической лаборатории проводится бактериологическое исследование других биологических материалов, которые забирает специалист в медицинских учреждениях.
Время приема биологического материала на бактериологическое исследование:
понедельник-пятница
8. 30-10.00
30-10.00
Тел. 8 (495) 375-12-24
Главный корпус больницы, центральный вход, справа от справочной
При сдаче материала на исследование необходимо при себе иметь документы:
- Направление в бактериологическую лабораторию ГКБ №15 им. О.М.Филатова на бактериологическое исследование (бак. посев)
- Копия страхового полиса
как проявляется, чем лечить, как не допустить
Как только ребенок появляется на свет, его организм начинает активно взаимодействовать с различными вирусами и микроорганизмами, что часто приводит к различным заболеваниям, потому что иммунная система еще продолжает развиваться и не может бороться в должной мере. Для грудных детей большую опасность представляет стафилококковая инфекция, поэтому сегодня мы хотим подробнее поговорить о признаках стафилококка у грудничка, чем опасно заболевание, вызванное этой бактерией, и какие методы лечения применяются для детей первого года жизни.
Что такое золотистый стафилококк
Золотистый стафилококк (Staphylococcus aureus) – это штамм грамположительных бактерий, которые относятся к роду стафилококковых. Они считаются самыми патогенными, а также возбудителями гнойно-воспалительных процессов, протекающих в организме взрослых и детей, которые имеют короткий инкубационный период, не превышающий 4 часов. Он устойчив к различным воздействиям окружающей среды: высокой температуре, солнечным лучам, сухому воздуху и погибает только при температуре 150° в течение 10 минут. Также бактерии устойчивы к перекиси водорода, спирту и многим антибиотикам.
Когда он попадает в благоприятную для себя среду, он начинает активно размножаться, создавая колонии, и вызывать интоксикацию, гнойную сыпь и различные воспаления. Свое название золотистый стафилококк получил благодаря наличию золотого пигмента.
Симптомы
Признаки того, что в организм малыша попал золотистый стафилококк, различные, ведь все зависит от иммунной защиты, агрессивности микроба и места его локализации. Чаще всего золотистый стафилококк поражает ротовую полость и дыхательные пути, а также пищеварительный тракт – это связано с основными путями проникновения инфекции в организм грудничка.
Чаще всего золотистый стафилококк поражает ротовую полость и дыхательные пути, а также пищеварительный тракт – это связано с основными путями проникновения инфекции в организм грудничка.
Если бактерия поселилась в носу, будут отмечаться такие симптомы, как:
- ринит с незначительным отделяемым;
- нарушение аппетита;
- снижение веса.
Общее состояние новорождённого обычно не нарушается, температура не повышается.
В тех случаях, когда микроб попадает в ротовую полость, развивается стафилококковый ларингит, тонзиллит или ларинготрахеит.
Как происходит заражение
Нам важно понимать следующее: этот микроб живет в организме практически у каждого человека, а на коже у 100 % населения Земли. В большинстве случаев эта бактерия не вызывает никаких патогенных процессов, т. к. иммунная система организма вырабатывает специальные антитела, способные его защищать. Если у грудничка появляются заболевания, сопровождающиеся гнойными выделениями, тогда речь идет о стафилококковой инфекции, которой можно заразиться следующим образом:
к. иммунная система организма вырабатывает специальные антитела, способные его защищать. Если у грудничка появляются заболевания, сопровождающиеся гнойными выделениями, тогда речь идет о стафилококковой инфекции, которой можно заразиться следующим образом:
- При контакте с носителем бактерии.
- В результате внутрибольничной инфекции, в которой грудничок мог находиться.
Золотистым стафилококком же можно заразиться самыми разнообразными путями:
- Контактно-бытовым или при использовании посуды, одежды и других предметов быта человека, который является активным носителем. А также если у беременной есть этот микроб в организме, то ребенок, проходя через родовые пути и контактируя со слизистой, заражается им.
- Пищевым, т. е. в момент кормления ребенка грудью. Не исключением являются и дети, которые состоят на искусственном вскармливании, т. к. в процессе приготовления мама может трогать те или иные предметы, с которыми в дальнейшем будет контактировать грудничок.

- Воздушно-капельным. Носитель бактерий активно выделяет в окружающую среду огромное количество подобных бактерий.
На возникновение инфекции у грудничка могут повлиять следующие факторы:
- Если малыш родился недоношенным и слабым.
- Если в анамнезе были родовые травмы.
- Беременность матери проходила с различными осложнениями.
- В случае, если у грудничка слабый иммунитет, который не может обеспечить необходимую защиту.
youtube.com/embed/1MN3a4McJhg?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Симптоматика при локализации стафилококка в носу
Поражая носовую полость детей и взрослых стафилококк вызывает такие симптомы, как длительный, не поддающийся лечению насморк, боль в носоглотке, отек слизистой носа, из-за чего возникает затрудненное дыхание и чувство заложенности. В таких ситуациях часто можно заподозрить обычную аллергическую реакцию. Также часто повышается температура тела, увеличиваются регионарные лимфатические узлы.
Может присоединятся кашель, из-за которого стафилококковую инфекцию можно спутать с вирусной.
Часто в носовой полости образуются гнойнички, язвочки, покраснения, нарушается чувство обоняния. В детей также возможно появление на теле высыпки.
Золотистый стафилококк у новорожденных: симптомы
В организме он может проявлять себя по-разному, в зависимости от локализации:
- При поражении кожи у грудничка появляется эпидемическая пузырчатка.
 Кожа крохи краснеет и покрывается пузырями, внутри которых находится гной. Затем они лопаются и инфицируют соседние участки кожи, а на их месте остаются ранки. Это очень заразное состояние, при котором ребенок очень мучается. В некоторых случаях пузырчатка приводит к летальному исходу.
Кожа крохи краснеет и покрывается пузырями, внутри которых находится гной. Затем они лопаются и инфицируют соседние участки кожи, а на их месте остаются ранки. Это очень заразное состояние, при котором ребенок очень мучается. В некоторых случаях пузырчатка приводит к летальному исходу.
- Если он локализуется на слизистой носоглотки и дыхательных путей, это может вызвать гнойную ангину или воспаление легких. Эти состояния протекают очень тяжело и сопровождаются высокой температурой, кашлем и даже дыхательной недостаточностью. При несвоевременном оказании помощи у грудничка может возникнуть осложнение в виде эмфиземы или отека тканей легких, что может привести даже к смерти.
- При поражении бактерией слизистой глаз грудничка, возникает гнойный конъюнктивит, который может быть разной тяжести. У ребенка краснеют глазные яблоки, увеличивается слезотечение и происходит отделение гноя. Грудничку такое состояние приносит много хлопот: он трет глазки, капризничает и становится беспокойным.
 Если не оказать своевременное лечение, может возникнуть такое осложнение как кератит глазного яблока, а впоследствии частичная или полная слепота.
Если не оказать своевременное лечение, может возникнуть такое осложнение как кератит глазного яблока, а впоследствии частичная или полная слепота.
- Если бактерия попала в организм через пищу, тогда золотистый стафилококк локализуется в кишечнике у грудничка и вызывает достаточно опасные симптомы: у грудничка отсутствует аппетит, что приводит к потере в весе, нарушается всасываемость пищи, стул становится частым, пенистым, с примесью гноя и слизи. У ребенка возникают сильные боли в животе, повышается температура и происходит сильное обезвоживание всего организма.
- В некоторых случаях эта бактерия может попадать в общий кровоток и вызывать заражение крови (сепсис). Это очень опасное состояние, при котором у малыша наблюдается слабость и гиперемия. Цвет кожи становится синюшного цвета, и если не оказать своевременной помощи, возможен даже летальный исход.
Почему возникают стафилококковые инфекции
Стафилококки обитают везде, поэтому заразиться ребенок может еще в роддоме – причинами может быть как чрезмерная санитарная обработка, так и несоблюдение элементарных гигиенических норм.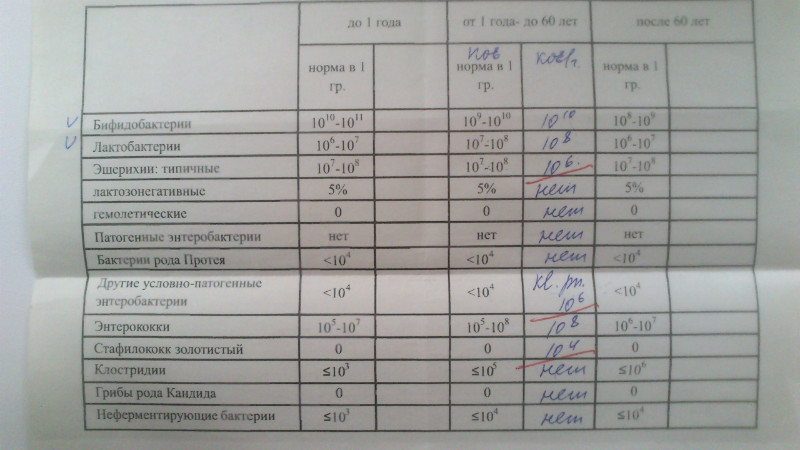
Причины развития заболеваний:
- преждевременные или тяжелые роды;
- слабый иммунитет у мамы – устойчивость к патогенным бактериям передается по наследству;
- неправильный уход за малышом;
- серьезные вирусные, бактериальные патологии во время беременности;
- гипотрофия новорожденных.
Малыш может заразиться от мамы еще в утробе, во время прохождения по родовым путям. Передаются микробы и через молоко, поцелуи. У деток постарше стафилококковые инфекции возникают при несоблюдении правил гигиены – бактерии проникают в организм через грязные руки, немытые овощи и фрукты.
Как выявить золотистый стафилококк у ребенка
Диагностировать его можно путем проведения анализа бактериального посева. В зависимости от того, где локализуется инфекция, назначают следующие обследования:
- Бактериологический анализ кала грудничка, благодаря которому определяется, есть ли данный микроб в органах ЖКТ и в каком количестве. Также берут мазки со слизистых, поверхности кожи, чтобы определить наличие этих микроорганизмов, в некоторых случаях для проведения анализ берется еще и выделяемый гной.

- Клинический анализ крови, который поможет определить общее состояние организма и понять, справляется ли иммунная система или она ослаблена, и серологический анализ, позволяющий определить наличие антител в сыворотке крови к возбудителю инфекции.
- Клинический анализ мочи, на основании которого определяют состояние мочеполовой системы.
Чем опасен стафилококк для малыша
При появлении у грудничка симптомов стафилококковых патологий, назначают общий анализ крови, бактериологическое исследование мазка из горла, носа, копрограмму, рентген и УЗИ внутренних органов, чтобы выявить тип возбудителя, степень тяжести заболевания.
Стафилококки, проникая в рот, нос, кишечник, кожу, не дают размножаться полезным бактериям, слабый иммунитет грудничка не справляется с таким количеством опасных микробов – болезни переходят в хроническую форму, что чревато частыми рецидивами и осложнениями, летальным исходом.
Кишечные инфекции приводят к обезвоживанию, у грудничка западет родничок, велика вероятность развития тяжелых неврологических патологий в будущем.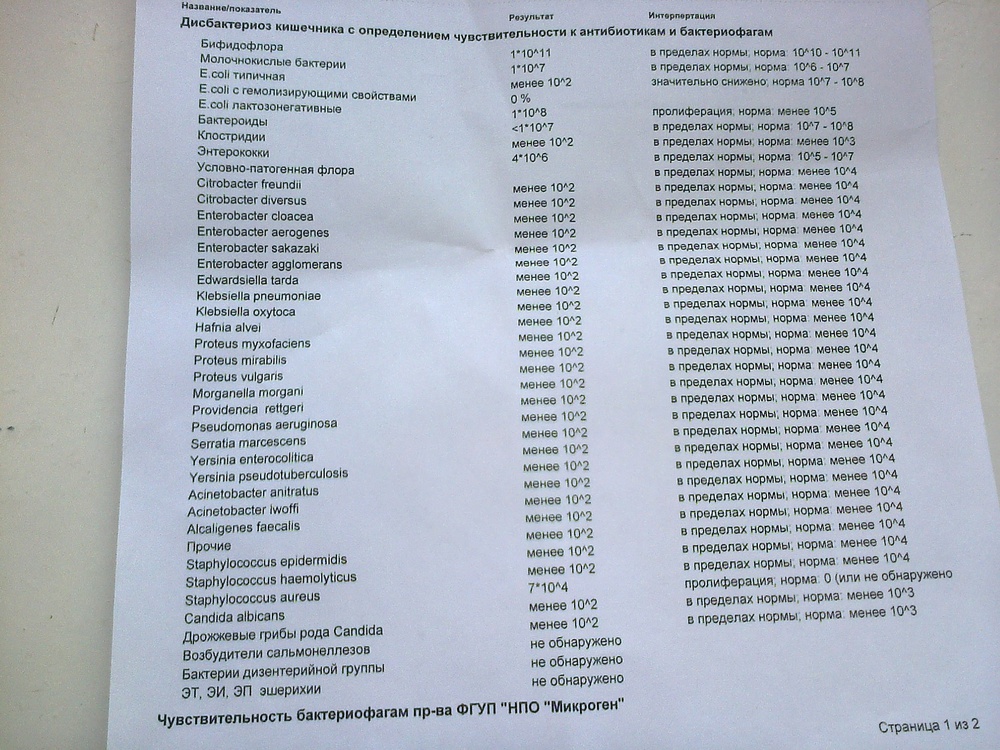 Наиболее опасные осложнения стафилококка – сепсис, менингит, инфекционно-токсический шок.
Наиболее опасные осложнения стафилококка – сепсис, менингит, инфекционно-токсический шок.
Золотистый стафилококк у грудничка: лечение
На основании проведенных анализов определяют степень заражения, которая показывает, как протекает заболевание.
- Если в кале у грудничка обнаружен золотистый стафилококк 10 в 3 степени, это значение считается безопасным и говорит о том, что организм борется с данной бактерией и не нуждается в дополнительном лечении. Однако родителям стоит заботиться о том, чтобы укреплять защитные функции организма своего крохи.
- При наличии золотистого стафилококка в кале 10 в 4 степени и отсутствии явных симптомов, назначается терапия, которая позволяет укрепить иммунитет ребенка.
- Если обнаружено 10 в 5 или 10 в 6 степени и у ребенка проявляется явная симптоматика (высыпания на коже, частый пенистый стул, диарея, боли в животе и т.д.), это свидетельствует о бурном росте бактерий и здесь нужна антибактериальная терапия. Но сложность такого лечения в том, что данные микроорганизмы очень быстро вырабатывают устойчивость к антибиотикам, поэтому такое лечение длительное, и не всегда сразу появляется желаемый эффект.
 Также такое лечение опасно для грудничков, поэтому к нему прибегают только в случаях, когда другая терапия не помогает. Доктор Комаровский считает, что если у ребенка плохие анализы, но у него хорошее самочувствие, грудничок активный, у него нормальный стул и он хорошо набирает в весе, значит, нет никакой необходимости в лечении, организм борется с микробом, и сам с ним справляется.
Также такое лечение опасно для грудничков, поэтому к нему прибегают только в случаях, когда другая терапия не помогает. Доктор Комаровский считает, что если у ребенка плохие анализы, но у него хорошее самочувствие, грудничок активный, у него нормальный стул и он хорошо набирает в весе, значит, нет никакой необходимости в лечении, организм борется с микробом, и сам с ним справляется.
- Кроме антибиотиков широкого спектра, для лечения используют бактериофаг. Это вирус, который внедряется в клетку бактерии и уничтожает ее изнутри. Однако он подходит для определенных штаммов, поэтому современная фармацевтика активно разрабатывает бактериофаги, которые обладают более широким спектром действия. Его могут принимать внутрь или закапывать им носовую и ротовую полости. Такое лечение считается наиболее эффективным и щадящим для грудничков.
- При кишечной инфекции, вызванной золотистым стафилококком, грудничкам могут назначать препараты с основным действующим веществом Нифуроксазид, например Энтерофурил, который можно применять для лечения грудным детям от 1 месяца.
 Параллельно с таким препаратом назначают еще бифидо- и лактобактерии, нормализующие микрофлору кишечника.
Параллельно с таким препаратом назначают еще бифидо- и лактобактерии, нормализующие микрофлору кишечника.
Методы диагностики
Микроскопия
Чтобы определить, является ли малыш носителем стафилококковой инфекции, можно провести микроскопическое исследование отделяемого из носовых ходов и ротовой полости, фекалий и биологических жидкостей. Результаты этого исследования можно получить практически сразу, после окраски биоматериала по Грамму. Но ставить диагноз, опираясь лишь на данный метод, не стоит. Этот способ помогает заподозрить возбудителя и определить план дальнейшего обследования малыша.
Исследование крови методами ИФА, РПГА не имеют диагностической значимости и не могут использоваться для выявления возбудителя.
Бактериологический метод
Наиболее широко распространённым и клинически значимым методом диагностики уже долгое время остаётся посев биоматериала на питательную среду. Уже через 18 – 24 часа исследователи могут обнаружить появление колоний желтоватого цвета.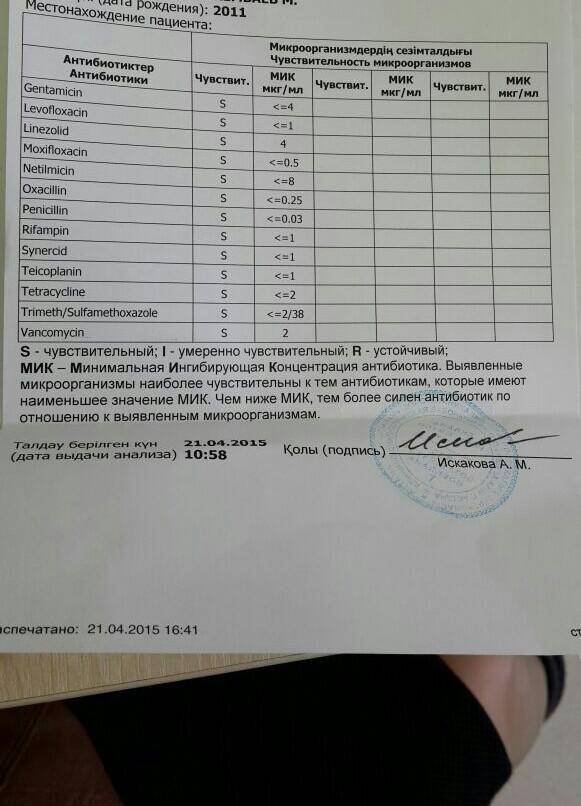 С помощью данного метода можно не только обнаружить Staphylococcus aureus, но и идентифицировать его, определить его свойства, чувствительность к антибактериальным препаратам.
С помощью данного метода можно не только обнаружить Staphylococcus aureus, но и идентифицировать его, определить его свойства, чувствительность к антибактериальным препаратам.
Особое внимание уделяется определению чувствительности микроорганизма к оксациллину. Устойчивые к этому препарату стафилококки будут невосприимчивы к часто используемым в практике β-лактамным антибиотикам, в том числе и цефалоспоринам.
Экспресс-диагностика
Для быстрого определения возбудителя можно использовать специальный тест латекс-агглютинации. Этот тест подразумевает склеивание реагента, нагруженного фибриногеном и антителами, с коагулазой и протеином А, свойственными для Staphylococcus aureus. Уже через 2 минуты после постановки теста можно обнаружить реакцию агглютинации, образование специфических комочков.
Обнаружение самой бактерии в стерильных биологических средах (моче, спинномозговой жидкости, крови, плевральном экссудате) всегда указывает на развитие стафилококковой инфекции.
Профилактика заражения золотистым стафилококком
Основная профилактика направлена на то, чтобы укреплять иммунитет грудничка. Этому способствует:
- Грудное вскармливание крохи, т. к. в мамином молоке содержатся все необходимые компоненты, которые активно формируют детский иммунитет.
- Регулярные прогулки на свежем воздухе, массаж и зарядка.
- Создание необходимых условий, чтобы избегать контакта с больными людьми или активными носителями.
- Обеспечение необходимых гигиенических норм матери и ребенка.
Полезная информация
Каждый человек сталкивается в своей жизни со множеством проблем, которые возникают в разные периоды. Не исключением является и беременность. Практически каждая женщина сталкивается с токсикозом, некоторым приходится смиряться с таким диагнозом как отслойка плаценты, а есть женщины, у которых по различным причинам возникает угроза выкидыша. Поэтому очень важно знать, как подготовиться к беременности, чтобы вовремя исключить различные патологические процессы, которые могут происходить в организме, и подготовиться к вынашиванию будущего ребенка.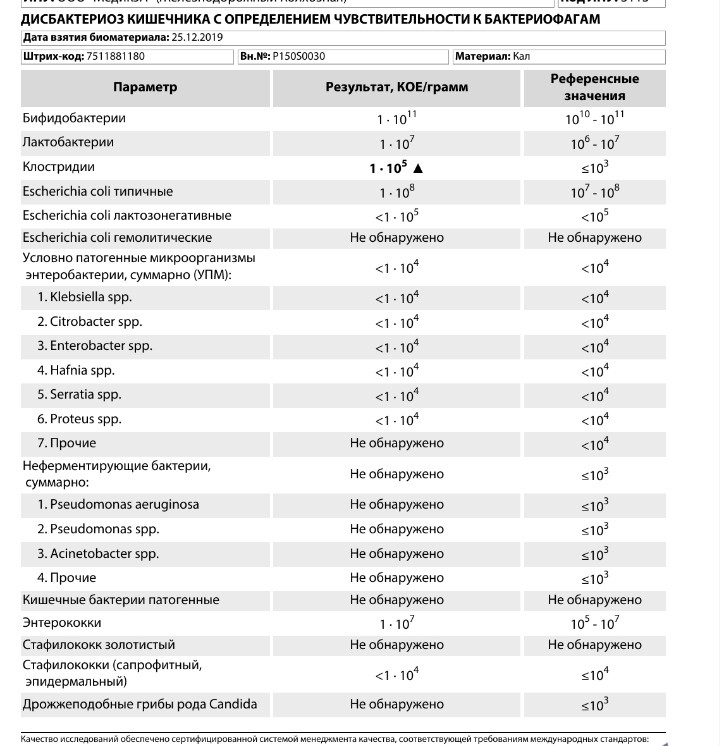
Приходилось ли вам сталкиваться с такой процедурой как анализ на золотистый стафилококк у новорожденных? На основании чего был сделан этот анализ? Какие симптомы были обнаружены у грудничка? Делитесь своими историями в комментариях и оставляйте отзывы о прочитанном.
Staphylococcus aureus Инфекции — Инфекции
Иногда хирургическое удаление инфицированной кости и/или инородного материала
Инфекции, вызванные Staphylococcus aureus , лечат антибиотиками. Врачи пытаются определить, устойчивы ли бактерии к антибиотикам, и если да, то к каким антибиотикам.
Инфекцию, полученную в больнице, лечат антибиотиками, эффективными против MRSA.К ним относятся ванкомицин, линезолид, тедизолид, хинупристин плюс далфопристин, цефтаролин, телаванцин или даптомицин. Если результаты тестирования позже показывают, что штамм чувствителен к метициллину и у человека нет аллергии на пенициллин, используется препарат, родственный метициллину, такой как нафциллин или оксациллин. В зависимости от того, насколько серьезна инфекция, антибиотики могут назначаться в течение нескольких недель.
В зависимости от того, насколько серьезна инфекция, антибиотики могут назначаться в течение нескольких недель.
Инфекция MRSA может быть получена вне медицинского учреждения. Внебольничные штаммы MRSA обычно чувствительны к другим антибиотикам, таким как триметоприм/сульфаметоксазол, клиндамицин, миноциклин или доксициклин, а также к антибиотикам, используемым для лечения инфекций MRSA, приобретенных в больнице.
Легкие кожные инфекции, вызванные MRSA, такие как фолликулит, обычно лечат мазью, например, содержащей бацитрацин, неомицин и полимиксин B (отпускается без рецепта) или мупироцин (отпускается только по рецепту). Если требуется больше, чем мазь, антибиотики, эффективные против MRSA, назначают перорально или внутривенно. Какой антибиотик использовать, зависит от тяжести инфекции и результатов тестирования на чувствительность.
Если инфекция затрагивает кость или инородный материал в организме (например, кардиостимуляторы, искусственные сердечные клапаны и суставы, трансплантаты кровеносных сосудов), к схеме антибиотикотерапии иногда добавляют рифампицин и, возможно, другой антибиотик.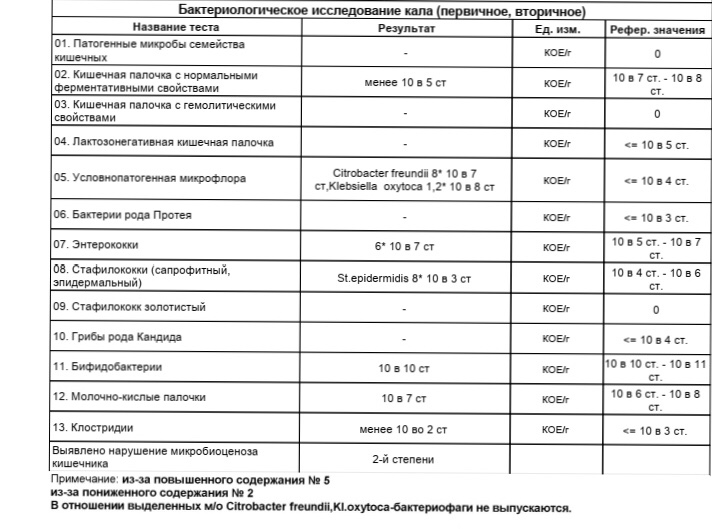 Обычно инфицированную кость и инородный материал приходится удалять хирургическим путем, чтобы вылечить инфекцию.
Обычно инфицированную кость и инородный материал приходится удалять хирургическим путем, чтобы вылечить инфекцию.
Абсцессы, если они есть, обычно дренируют.
Характеристика штаммов Staphylococcus aureus, выделенных из фекалий здоровых новорожденных, и потенциальная микробная передача от матери к ребенку при грудном вскармливании | FEMS Микробиология Экология
Двадцать одна женщина и их соответствующие одноплодные дети приняли участие в этом исследовании, внося свой вклад в образцы грудного молока и фекалий (на 7, 14 и 35 дни после рождения), соответственно, используемые для восстановления Staphylococcus aureus .Цель состояла в том, чтобы отследить носительство S. aureus в молоке и фекалиях младенцев пар мать-ребенок, а также определить генетические линии изолятов, их потенциальное клональное родство и их содержание в кластере устойчивости к противомикробным препаратам, вирулентности и уклонения от иммунного ответа. гены. Молекулярную характеристику проводили с помощью ПЦР и секвенирования. Клональное родство среди изолятов матери и ребенка определяли с помощью типирования spa , мультилокусного типирования последовательности (MLST) и гель-электрофореза в пульсирующем поле (PFGE). Staphylococcus aureus был выделен из образцов молока 6 из 21 матери (16 изолятов) и из образцов фекалий 12 из 21 младенца (25 изолятов). Из этих 41 S. aureus выздоровели, 18 были метициллин-резистентными (MRSA) и 23 метициллин-чувствительными (MSSA). Двенадцать различных типов spa и восемь типов последовательностей были обнаружены среди S. aureus . Преобладающими клональными комплексами были СС5 (43,9%) и СС30 (36,6%). Штаммы MRSA имели профиль множественной лекарственной устойчивости, 65.2% штаммов MSSA несли ген токсина tsst-1 , а 26,8% от общего числа штаммов несли ген cna . Потенциальная передача S. aureus от матери ребенку была продемонстрирована в четырех случаях с помощью типирования spa , MLST и PFGE (передача t322/ST5/CC5-PFGE-A, t136/ST34/CC30-PFGE-B и t021/ST1869/CC30-PFGE-C).
гены. Молекулярную характеристику проводили с помощью ПЦР и секвенирования. Клональное родство среди изолятов матери и ребенка определяли с помощью типирования spa , мультилокусного типирования последовательности (MLST) и гель-электрофореза в пульсирующем поле (PFGE). Staphylococcus aureus был выделен из образцов молока 6 из 21 матери (16 изолятов) и из образцов фекалий 12 из 21 младенца (25 изолятов). Из этих 41 S. aureus выздоровели, 18 были метициллин-резистентными (MRSA) и 23 метициллин-чувствительными (MSSA). Двенадцать различных типов spa и восемь типов последовательностей были обнаружены среди S. aureus . Преобладающими клональными комплексами были СС5 (43,9%) и СС30 (36,6%). Штаммы MRSA имели профиль множественной лекарственной устойчивости, 65.2% штаммов MSSA несли ген токсина tsst-1 , а 26,8% от общего числа штаммов несли ген cna . Потенциальная передача S. aureus от матери ребенку была продемонстрирована в четырех случаях с помощью типирования spa , MLST и PFGE (передача t322/ST5/CC5-PFGE-A, t136/ST34/CC30-PFGE-B и t021/ST1869/CC30-PFGE-C).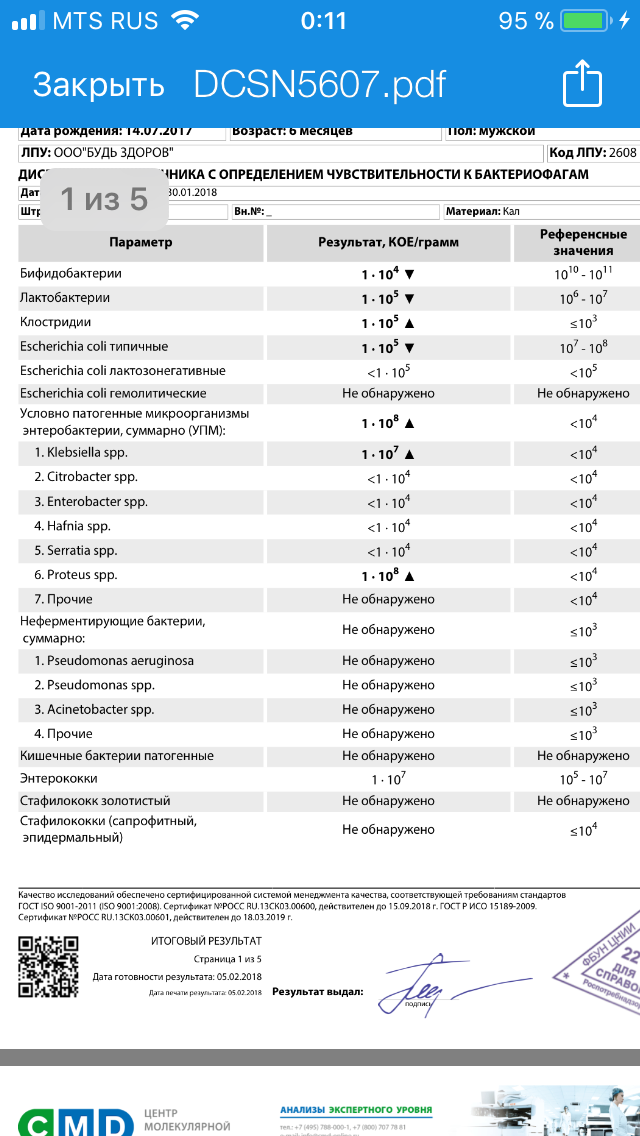 Грудное вскармливание, по-видимому, способствует ранней колонизации кишечника новорожденных S. aureus , что может повлиять на развитие иммунной системы.
Грудное вскармливание, по-видимому, способствует ранней колонизации кишечника новорожденных S. aureus , что может повлиять на развитие иммунной системы.
ВВЕДЕНИЕ
Ранний возраст, по-видимому, является решающим периодом для правильного формирования микробиоты кишечника с краткосрочными, среднесрочными и долгосрочными последствиями для здоровья хозяина (Sim et al. , 2013). На таком этапе жизни вертикальная микробная передача от матери ребенку обычно играет ключевую роль в начальной колонизации кишечника новорожденного (Cho and Blaser 2012). Хотя существует множество исследований потенциальной передачи тех бактерий, которые наиболее часто вызывают неонатальный сепсис (например,г. Streptococcus agalactiae , Escherichia coli ), данные о других бактериях, которые могут быть эпидемиологически значимыми в сообществе, таких как Staphylococcus aureus , недостаточны (Bourgeois-Nicolaos et al.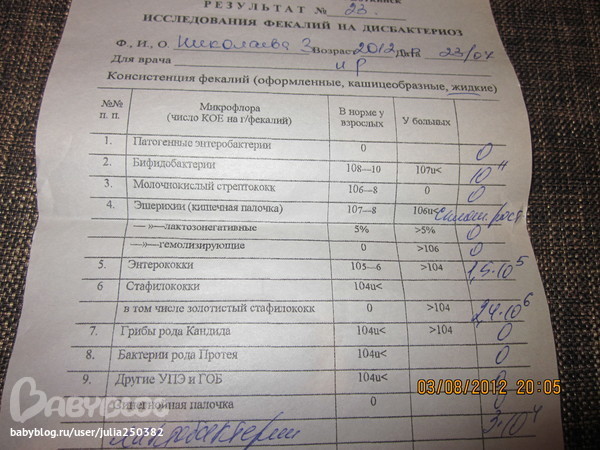 , 2010 Delgado 2010; , 2011; Хименес-Труке и др. , 2012; Лешем и др. , 2012).
, 2010 Delgado 2010; , 2011; Хименес-Труке и др. , 2012; Лешем и др. , 2012).
Staphylococcus aureus — это вид, обычно встречающийся как часть нормальной микробиоты человека, в основном в ротоглотке, носу и коже, хотя он также может быть обнаружен как часть микробиоты кишечника (Dominguez, Zarazaga and Torres 2002; Benito и другие. , 2013) как здоровых, так и госпитализированных носителей. Staphylococcus aureus — чрезвычайно универсальный условно-патогенный микроорганизм с множеством механизмов, способных вызывать заболевание и обходить иммунную защиту. Следовательно, колонизация доношенных новорожденных этим видом может увеличить риск заражения в раннем возрасте (van Belkum et al. , 2009). Тем не менее, в других исследованиях сообщается, что перинатальная колонизация S. aureus может оказывать положительное влияние на развитие иммунной системы новорожденных (Lundell et al., 2007 г.).
Staphylococcus aureus может содержать или приобретать различные детерминанты резистентности, и среди них приобретение гена mecA особенно важно, поскольку он придает устойчивость к метициллину и большинству бета-лактамов. Метициллин-резистентный S. aureus (MRSA) может поражать как госпитализированных (HA-MRSA), так и внебольничных (CA-MRSA) пациентов. С другой стороны, S. aureus может продуцировать большое разнообразие факторов вирулентности, которые могут усугубить клинический исход стафилококковых инфекций (Jarraud et al., 2002 г.). Некоторыми из наиболее важных факторов вирулентности являются лейкоцидин Пантона-Валентайна (PVL), токсин синдрома токсического шока 1 (TSST-1), различные гемолизины, эксфолиатины, энтеротоксины и другие факторы вирулентности, которые способствуют клеточной инвазии, росту бактерий и уклонению от иммунитета (Sabat и др. , 2000; Cucarella и др. , 2001; Jarraud и др. , 2002; van Wamel и др. , 2006; Witte и др. 9006;
Метициллин-резистентный S. aureus (MRSA) может поражать как госпитализированных (HA-MRSA), так и внебольничных (CA-MRSA) пациентов. С другой стороны, S. aureus может продуцировать большое разнообразие факторов вирулентности, которые могут усугубить клинический исход стафилококковых инфекций (Jarraud et al., 2002 г.). Некоторыми из наиболее важных факторов вирулентности являются лейкоцидин Пантона-Валентайна (PVL), токсин синдрома токсического шока 1 (TSST-1), различные гемолизины, эксфолиатины, энтеротоксины и другие факторы вирулентности, которые способствуют клеточной инвазии, росту бактерий и уклонению от иммунитета (Sabat и др. , 2000; Cucarella и др. , 2001; Jarraud и др. , 2002; van Wamel и др. , 2006; Witte и др. 9006;
Недавно появился особый интерес к изучению генетических линий S.aureus , которые циркулируют в разных средах, чтобы отслеживать их эволюцию в разных нишах и знать потенциальные первоисточники.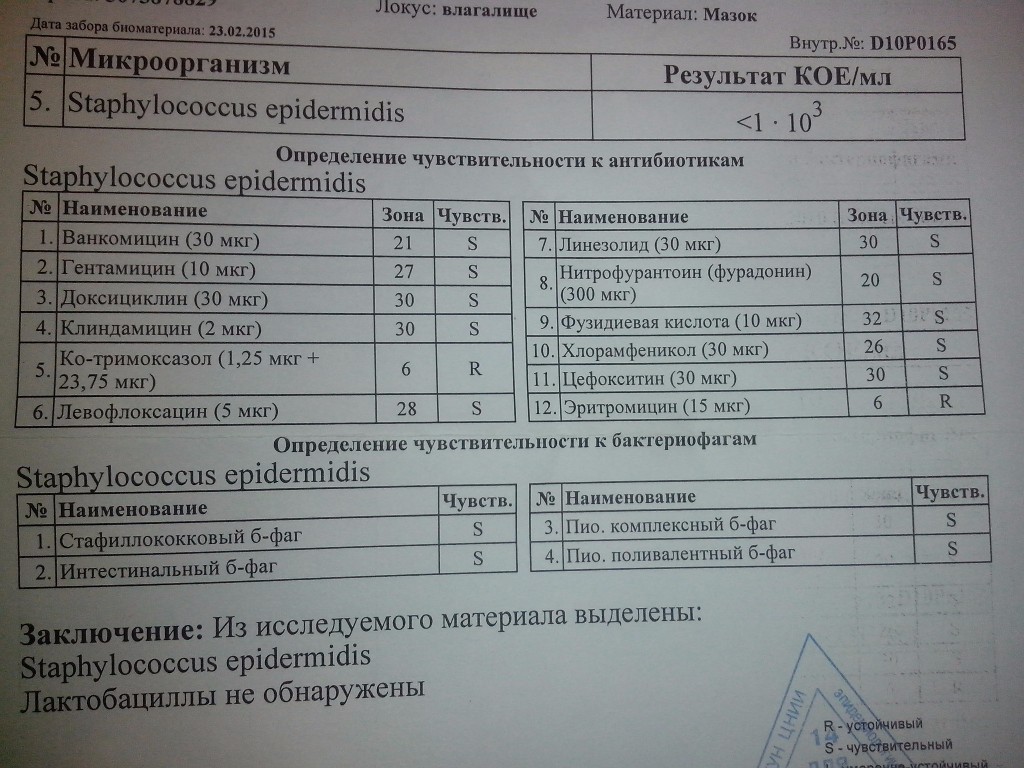 В этом смысле кластер уклонения от иммунного ответа (IEC) может быть важным маркером, позволяющим обнаружить S . aureus , чтобы избежать действия некоторых компонентов врожденной иммунной системы человека. У изолятов, адаптированных к животным-хозяевам, часто отсутствуют гены системы IEC (Benito et al. , 2013).
В этом смысле кластер уклонения от иммунного ответа (IEC) может быть важным маркером, позволяющим обнаружить S . aureus , чтобы избежать действия некоторых компонентов врожденной иммунной системы человека. У изолятов, адаптированных к животным-хозяевам, часто отсутствуют гены системы IEC (Benito et al. , 2013).
В предыдущем исследовании нашей группы оценивалось культивируемое бактериальное разнообразие молока и фекалий 16 кормящих матерей и их детей, находящихся на грудном вскармливании, соответственно (Jiménez et al., 2008 г.). Выделенные изолятов S. epidermidis и энтерококков были полностью охарактеризованы (Jiménez et al. , 2008). Кроме того, изолятов S. aureus можно было выделить из некоторых из этих пар мать-ребенок, но они не были охарактеризованы. Целью этого исследования было, во-первых, отследить носительство S. aureus в образцах молока и фекалий младенцев, предоставленных 21 парой мать-ребенок (включая 16 из предыдущего исследования и 5 дополнительных, набранных в этом исследовании), и, позднее, определить генетическое происхождение изолятов, потенциальные клональные отношения между этими изолятами, полученными в одной и той же паре мать-младенец, и их содержание в генах устойчивости к противомикробным препаратам, а также в генах вирулентности и IEC.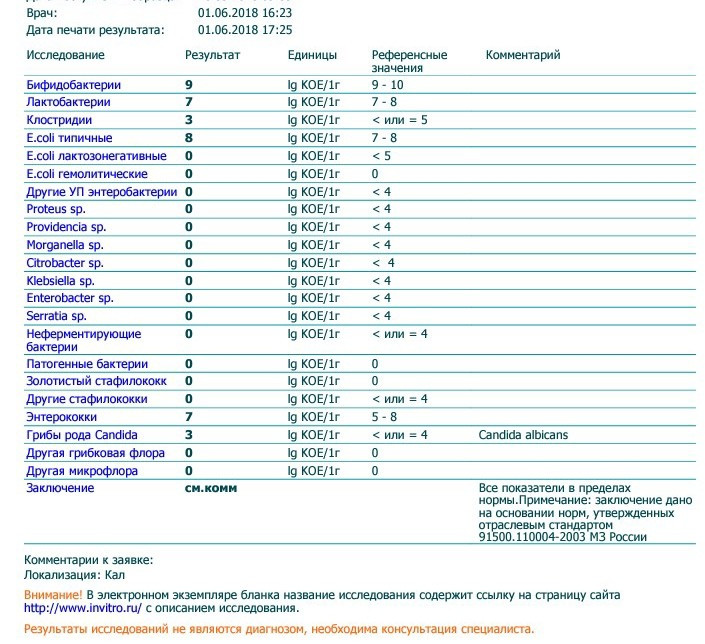
МЕТОДЫ
Сбор образцов
Всего в исследовании приняли участие 21 женщина и их соответствующие одноплодные дети, которые соответствовали следующим характеристикам: (а) здоровые женщины с нормальной доношенной беременностью; (б) вагинальные роды; (c) отсутствие перинатальных проблем у младенцев и/или матерей, включая мастит, и отсутствие использования антибиотиков во время родов; и (d) грудные дети, находящиеся исключительно на грудном вскармливании. Все добровольцы дали письменное информированное согласие с протоколом, который был одобрен комитетами по этике больницы Joan XXIII (Таррагона, Испания) и больницы Clínico San Carlos (Мадрид, Испания).Женщины и их дети сдавали образцы грудного молока и кала соответственно на 7, 14 и 35 день после рождения. Образцы молока собирали в стерильных пробирках асептически путем ручного сцеживания с использованием стерильных перчаток. Предварительно соски и ареола молочной железы очищались стерильной водой с мылом и пропитывались хлоргексидином (Cristalmina, Salvat, Барселона, Испания). Первые капли (около 500 мкл) отбрасывали. Образцы фекалий (около 5 г) собирали в индивидуальные стерильные контейнеры для фекалий.Все образцы хранились при 4ºC до доставки в лабораторию (максимум 12 ч) и немедленно обрабатывались.
Предварительно соски и ареола молочной железы очищались стерильной водой с мылом и пропитывались хлоргексидином (Cristalmina, Salvat, Барселона, Испания). Первые капли (около 500 мкл) отбрасывали. Образцы фекалий (около 5 г) собирали в индивидуальные стерильные контейнеры для фекалий.Все образцы хранились при 4ºC до доставки в лабораторию (максимум 12 ч) и немедленно обрабатывались.
Процедуры отбора проб
изолятов S. aureus Разведения образцов высевали на две селективные среды: агар Бэрда-Паркера и агар с колумбийско-налидиксовой кислотой (BioMerieux, Marcy l ′ Etoile, Франция). От 5 до 10 репрезентативных изолятов, у которых морфология колоний и другие фенотипические характеристики (форма клеток, окрашивание по Граму, активность каталазы и оксидазы) были совместимы с таковыми у стафилококков (включая, по крайней мере, одного представителя каждой морфологии колонии), были отобраны из каждой группы. культуральную среду, выращенную в бульоне BHI и хранящуюся при -80ºC в присутствии глицерина (30% по объему).Все изоляты были идентифицированы до видового уровня с помощью метода мультиплексной ПЦР на основе генов dnaJ (Jiménez et al. , 2008), а идентификация была позже подтверждена с помощью MALDI-TOF (VITEK MS, BioMerieux). Впоследствии в это исследование были включены все изоляты, которые были идентифицированы как S. aureus из образцов молока или фекалий. Наличие гена nuc также было изучено для дальнейшего подтверждения наличия изолятов S. aureus (Lozano et al., 2011 г.).
культуральную среду, выращенную в бульоне BHI и хранящуюся при -80ºC в присутствии глицерина (30% по объему).Все изоляты были идентифицированы до видового уровня с помощью метода мультиплексной ПЦР на основе генов dnaJ (Jiménez et al. , 2008), а идентификация была позже подтверждена с помощью MALDI-TOF (VITEK MS, BioMerieux). Впоследствии в это исследование были включены все изоляты, которые были идентифицированы как S. aureus из образцов молока или фекалий. Наличие гена nuc также было изучено для дальнейшего подтверждения наличия изолятов S. aureus (Lozano et al., 2011 г.).
Молекулярное типирование изолятов
Молекулярная характеристика изолятов S. aureus была выполнена различными молекулярными методами. Было проведено типирование Spa (Harmsen et al. , 2003 г.), а полученные последовательности проанализированы с использованием программного обеспечения Ridom Staph Type версии 1.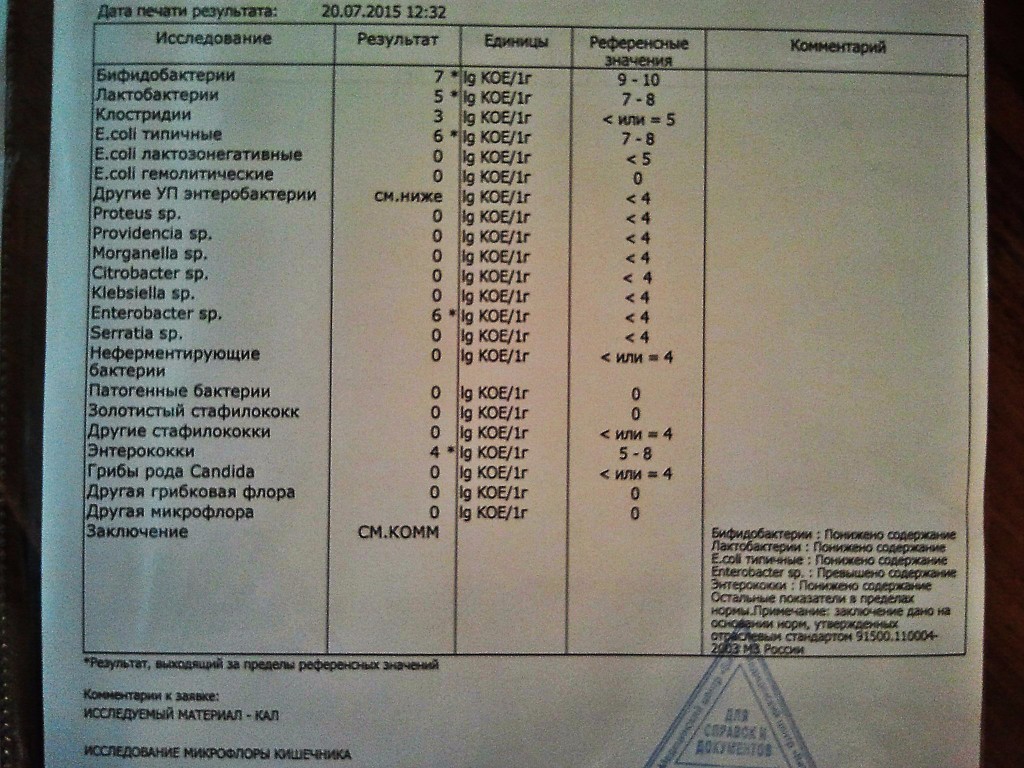 5.21 (Ridom GmbH). Определение аллотипов agr — регуляторных локусов дополнительных генов — проводили с помощью двух мультиплексных ПЦР (Shopsin et al. , 2003) для всех изолятов. Многолокусное типирование последовательностей (MLST) также выполняли для одного представителя каждого типа spa , обнаруженного в этом исследовании, для определения типа последовательности (ST) и клонального комплекса (CC) изолятов (www.saureus.mlst.net).
5.21 (Ridom GmbH). Определение аллотипов agr — регуляторных локусов дополнительных генов — проводили с помощью двух мультиплексных ПЦР (Shopsin et al. , 2003) для всех изолятов. Многолокусное типирование последовательностей (MLST) также выполняли для одного представителя каждого типа spa , обнаруженного в этом исследовании, для определения типа последовательности (ST) и клонального комплекса (CC) изолятов (www.saureus.mlst.net).
Гель-электрофорез в импульсном поле (PFGE)
Когда сходные типы spa были идентифицированы среди изолятов, полученных от данной матери и ее соответствующего ребенка (и, следовательно, предполагалась потенциальная передача от матери к ребенку), был проведен анализ клонального родства с помощью PFGE (Murchan и другие. , 2003) тотальной ДНК, расщепленной эндонуклеазой Sma I (New England Biolabs). Гель готовили на 1,8% агаре и запускали в течение 22 ч при 6 В см –1, используя время импульса от 5 до 50 с.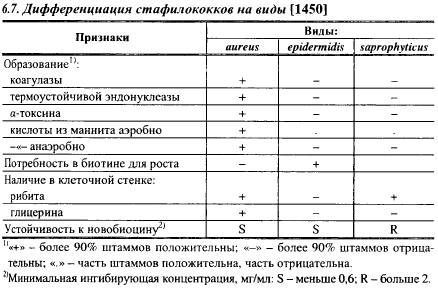 Электрофорез проводили в системе CHEF DR-II (Bio-Rad). В гель был включен стандартный ДНК-маркер (Lambda Ladder PFG Marker, New England Biolab).
Электрофорез проводили в системе CHEF DR-II (Bio-Rad). В гель был включен стандартный ДНК-маркер (Lambda Ladder PFG Marker, New England Biolab).
Тестирование чувствительности и обнаружение генов устойчивости к противомикробным препаратам
Определение чувствительности проводили методом диско-диффузионного агара к 17 противомикробным препаратам (пенициллину, оксациллину, цефокситину, эритромицину, клиндамицину, ципрофлоксацину, гентамицину, стрептомицину, канамицину, тобрамицину, тетрациклину, левомицетину, триметоприму-сульфаметоксазолу, линезолиду, ванкомицину, мупироцину фузидиевая кислота) в соответствии с рекомендациями CLSI и EUCAST (CLSI 2014; EUCAST 2014).Кроме того, был проведен D-тест для выявления индуцируемой устойчивости к клиндамицину (CLSI 2014). 25 генов устойчивости (A) , ems(B) , ems(C) , ems(F) , ems(T) , emsr(A) , emsr(2) 900 В) , лну(А) , лну(Б) , вга(А) , ант(4 ‘ )-Iа , аф(3 ‘ ‘ ‘ )9014 AAC (6 ‘) — IE-APH (2 ‘ 0 ‘) 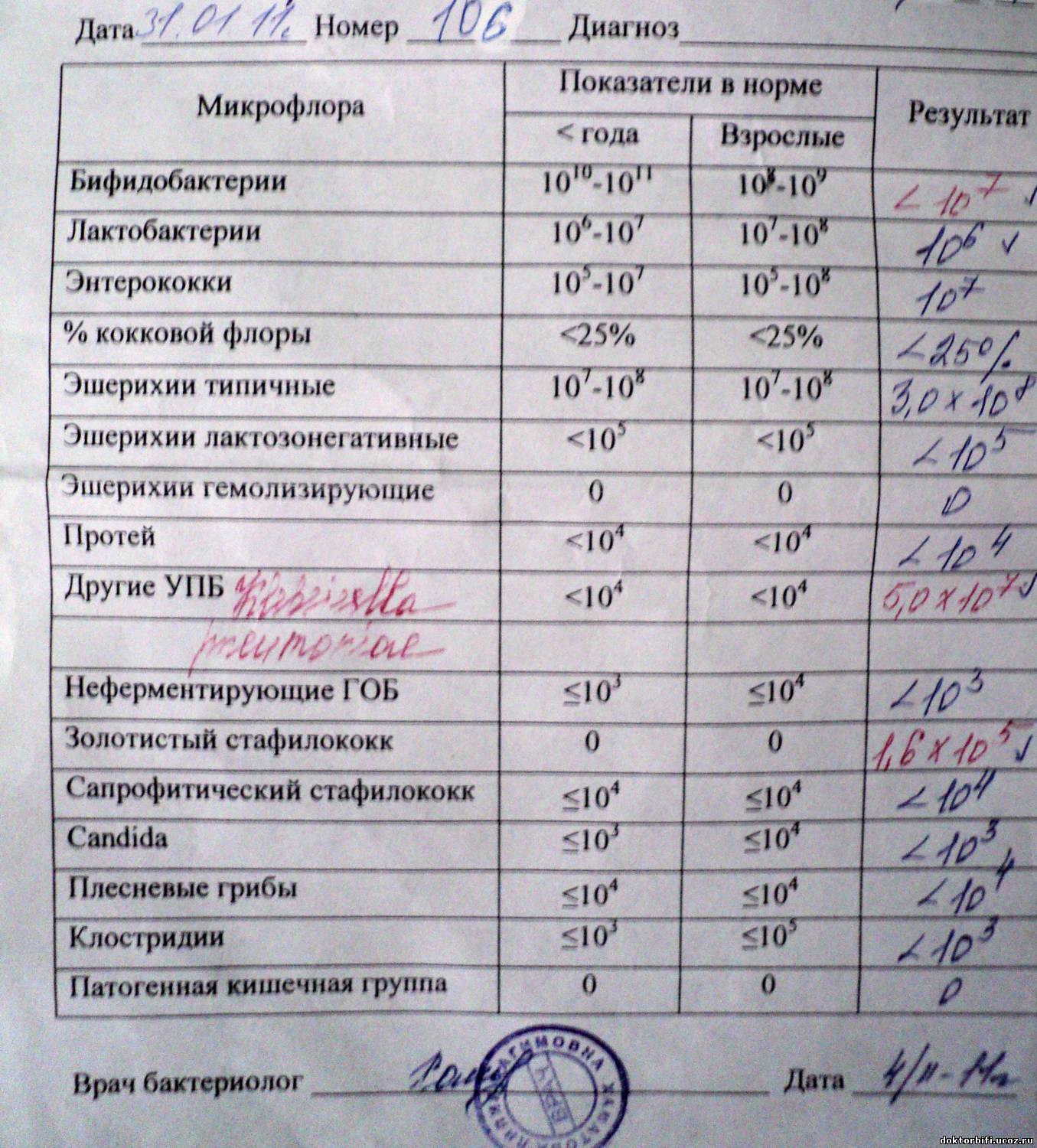 aureus изучали методом ПЦР (Udo, Al-Sweilh and Noronha 2003; Lozano et al. , 2011; Benito et al. , 2013).
aureus изучали методом ПЦР (Udo, Al-Sweilh and Noronha 2003; Lozano et al. , 2011; Benito et al. , 2013).
Выявление генов вирулентности
Анализ профиля вирулентности проводили методом ПЦР для обнаружения следующих генетических детерминант: лейкоцидина Пантона-Валентайна ( lukF/lukS- PV ) , токсина синдрома токсического шока ( tsst-1 ) и эксфолиативного токсина А ( eta ), B ( etb ) и D ( etd ).Кроме того, выявлены гены, кодирующие лейкоцидины DE ( lukD-lukE ) и M ( lukM ), ауреолизин ( aur ), белок, ассоциированный с биопленкой ( bap) и белок, связывающий коллаген ( cna ). ) также изучались с помощью ПЦР (Sabat et al. , 2000; Cucarella et al. , 2001; Witte et al. , 2007; Lozano et al. , 2011; Benito ). 2013).
Кластер уклонения от иммунитета
Пять генов, входящих в состав IEC ( scn , chp, sak и sea или sep ), были изучены методом ПЦР. В зависимости от наличия или отсутствия этих генов и их различных комбинаций все изолятов S. aureus были классифицированы по семи типам IEC в соответствии с ранее описанными моделями (van Wamel et al. , 2006).
В зависимости от наличия или отсутствия этих генов и их различных комбинаций все изолятов S. aureus были классифицированы по семи типам IEC в соответствии с ранее описанными моделями (van Wamel et al. , 2006).
РЕЗУЛЬТАТЫ
Выделение
S. aureusStaphylococcus aureus был выделен из образцов молока 6 из 21 матери (16 изолятов) и из образцов фекалий 12 из 21 ребенка (25 изолятов) (таблица 1).В частности, S. aureus был получен в образцах фекалий двух младенцев на 7-й день, трех на 14-й день и десяти на 35-й день после рождения (таблица 2). Staphylococcus aureus был обнаружен как в молоке матери, так и в кале младенца в шести изученных случаях. Было выявлено четыре потенциальных случая передачи инфекции от матери ребенку при грудном вскармливании (таблица 1).
Таблица 1.
Основные характеристики штаммов S. aureus , выделенных от матерей и младенцев в этом исследовании.
| . | . | МРЗС/ . | № . | Молекулярное типирование . | Устойчивость к противомикробным препаратам . | Факторы вирулентности . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Чемодан . | Происхождение . | МССА . | штаммы . | спа тип . | с/х . | SCC меc . | МЛСТ/СС и . | Фенотип b . | Генотип . | МЭК тип c . | Другие гены d . | ||
A. Случаи потенциал золотистого стафилококка передача от матери к младенцу Случаи потенциал золотистого стафилококка передача от матери к младенцу | |||||||||||||
| 1 Младенец | МРСА 1 | T322 | II | II | IV | IV | st5 / cc5 | ery, cli, gen, tob | ERM (C), AAC (6 ‘) -ie-aph (2 ‘ ‘), Муравей (4 ‘) —ia ) —ia ) | F | Лук-де, AUR | ||
| MRSA | 7 | T322 | II | IV | ST5 / CC5 | ERY, CLI, GEN, TOB, KAN | erm(C),lnu(A), aac(6 ′ )-Ie-aph(2 ′ ′ ), ant(4) ′ )-Ia, aph(3 ′ )-III3 | F | лук-DE, aur 901 40 2 , ETA 2 | ||||
| Матери | MSSA | 1 | t136 | III | — | ST34 / CC30 | — | — | B | Лук-де, Aur, TSST-1 | |||
| 2 | MRSA | MRSA | 5 | II | II | IV | ST5 / CC5 | ERY, CLI, GEN, TOB | ERM (C), AAC (6 ‘) -ie-aph (2 ‘ ‘), Муравей (4 ‘ ) —ia ) — | F | Лук-де-де, AUR | ||
| Мать | MRSA | 1 | T322 | II | IV | IV | ST5 / CC5 | ERY, CLI, GEN, TOB, KAN | ERM (C), LNU ( А), аас(6 ′ )-Ie-aph(2 ′ ), Муравей (4 ‘) —ia ) —ia ) — | F | Лук-де, AUR, ETA | ||
| Младенца | MSSA | 1 | T136 | III | — | ST34 / CC30 | — | — | Е | Aur, TSST-1 | |||
| 3 | Младенец | MSSA | 4 | T015 | Я | — | ST45 / CC45 | — | — | В | Aur, CNA | ||
| Младенец | MSSA | 3 | t136 | III | — | ST34 / CC30 | — | — — | E | Лук-де, ETA, AUR, TSST-1 | |||
| Мать | MSSA | 1 | 1 | 90 392 T136III | — | — | — | ST34 / CC30 | — | — | — — 1Лук-де, ETA, AUR, TSST-1 | ||
| 4 | Младенческий | MSSA | 1 | T021 | III | — | ST1869 / CC30 | — | — | — | Aur, CNA, TSST-1 | ||
| Матери | MSSA | 1 | T021 | III | — | — | ST1869 / CC30 | — | — | — | — —Aur, CNA, TSST-1 | ||
B.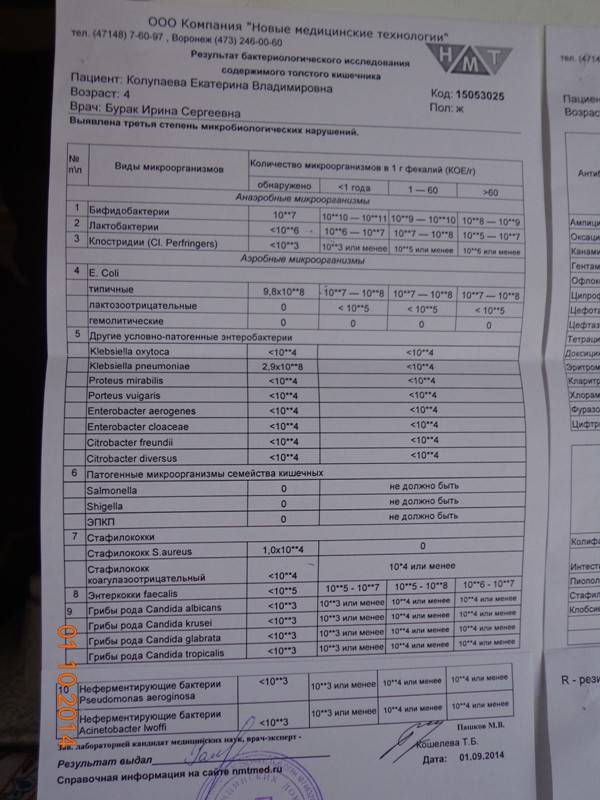 Случаи NON золотистого стафилококка передача от матери к младенцу Случаи NON золотистого стафилококка передача от матери к младенцу | |||||||||||||
| 5 Младенец | МРСА 2 | t322 II | И.В. | ST5 / CC5 ST5 / CC5 | ERY, CLI, GEN, TOB | ERM (C), AAC (6 ‘) -IE-APH (2 ‘ ‘), Муравей (4 ‘ ) -IA | F Luk-ДЕ, AUR | ||||||
| 6 Младенец | MSSA 1 | T015 я | — | ST45 / CC45 | УЛ STR | F | F | Лук-де, AUR, CNA | |||||
| Мать | MSSA | 1 | T021 | III | — | ST30 / CC30 | — | 9 0392 — —— | Aur, CNA, TSST-1 | ||||
| MRSA | MRSA | 1 | T002 | II | IV | ST5 / CC5 | ERY GEN, TOB, STR, FUS, CIP | msrA, mrsB, aac(6 ‘ )-Ie-aph(2 ‘ ‘ ), ant(4 ‘ )-Ia, str, fus (С) | Е | Luk-ДЕ, Aur | |||
| 8 | Младенец | MSSA | 1 | T012 | III | — | ST30 / CC30 | — | — | 1 | Лук-де, Aur, CNA, TSST-1 | ||
| младенца | MSSA | 1 | T5204 | II | — | ST15 / CC15 | — | – | С | Luk-ДЕ, Aur | |||
| 9 | Младенец | MSSA | 1 | T122 | III | — | ST30 / CC30 | УЛ | ул | Aur , CNA, TSST-1 | |||
| 10 | Младенец | MSSA | 1 | t10664 | Я | — | ST8 / CC8 | — | — | B | Aur , CNA | ||
| 11 | Младенец | MSSA | 1 | T148 | Я | — | ST1434 / CC72 | — | — | B | Luk-ДЕ | ||
| 12 | Младенцы | MRSA | 1 | t322 | II | ST | IV 391 | УЛ | ул | F | Luk-ДЕ, Aur | ||
| Матери | MSSA | 3 | T166 | III | — | ST34 / CC30 | — | 2 —— | — 1 | 1 | |||
| MSSA | 1 | T440 | III | — | ST30 / CC30 | — | — | 2 —B | Aur, CNA, TSST-1 | ||||
.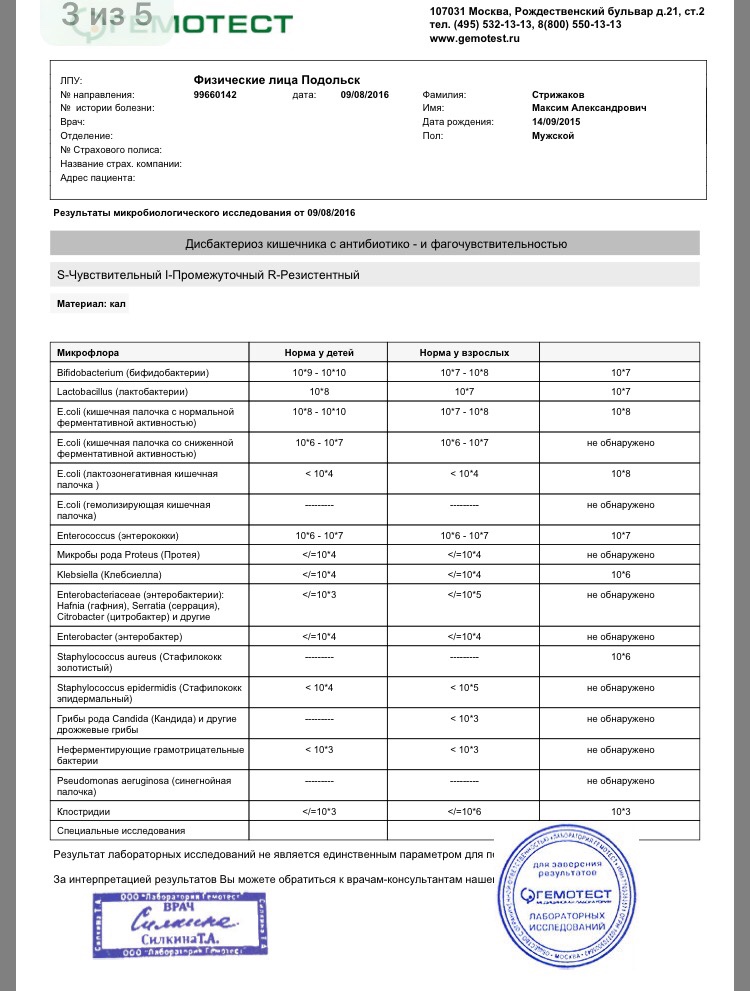 | . | МРЗС/ . | № . | Молекулярное типирование . | Устойчивость к противомикробным препаратам . | Факторы вирулентности . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Чемодан . | Происхождение . | МССА . | штаммы . | спа тип . | с/х . | SCC меc . | МЛСТ/СС и . | Фенотип b . | Генотип . | МЭК тип c . | Другие гены d . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A. Случаи потенциал золотистого стафилококка передача от матери к младенцу | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 Младенец | МРСА 1 | T322 | II | II | IV | IV | st5 / cc5 | ery, cli, gen, tob | ERM (C), AAC (6 ‘) -ie-aph (2 ‘ ‘), Муравей (4 ‘) —ia ) —ia ) | F | Лук-де, AUR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MRSA | 7 | T322 | II | IV | ST5 / CC5 | ERY, CLI, GEN, TOB, KAN | erm(C),lnu(A), aac(6 ′ )-Ie-aph(2 ′ ′ ), ant(4) ′ )-Ia, aph(3 ′ )-III3 | F | лук-DE, aur 901 40 2 , ETA 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Матери | MSSA | 1 | t136 | III | — | ST34 / CC30 | — | — | B | Лук-де, Aur, TSST-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | MRSA | MRSA | 5 | II | II | IV | ST5 / CC5 | ERY, CLI, GEN, TOB | ERM (C), AAC (6 ‘) -ie-aph (2 ‘ ‘), Муравей (4 ‘ ) —ia ) — | F | Лук-де-де, AUR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мать | MRSA | 1 | T322 | II | IV | IV | ST5 / CC5 | ERY, CLI, GEN, TOB, KAN | ERM (C), LNU ( А), аас(6 ′ )-Ie-aph(2 ′ ), Муравей (4 ‘) —ia ) —ia ) — | F | Лук-де, AUR, ETA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Младенца | MSSA | 1 | T136 | III | — | ST34 / CC30 | — | — | Е | Aur, TSST-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | Младенец | MSSA | 4 | T015 | Я | — | ST45 / CC45 | — | — | В | Aur, CNA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Младенец | MSSA | 3 | t136 | III | — | ST34 / CC30 | — | — — | E | Лук-де, ETA, AUR, TSST-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мать | MSSA | 1 | 1 | 90 392 T136III | — | — | — | ST34 / CC30 | — | — | — — 1Лук-де, ETA, AUR, TSST-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | Младенческий | MSSA | 1 | T021 | III | — | ST1869 / CC30 | — | — | — | Aur, CNA, TSST-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Матери | MSSA | 1 | T021 | III | — | — | ST1869 / CC30 | — | — | — | — —Aur, CNA, TSST-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
B. Случаи NON золотистого стафилококка передача от матери к младенцу Случаи NON золотистого стафилококка передача от матери к младенцу | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 Младенец | МРСА 2 | t322 II | И.В. | ST5 / CC5 ST5 / CC5 | ERY, CLI, GEN, TOB | ERM (C), AAC (6 ‘) -IE-APH (2 ‘ ‘), Муравей (4 ‘ ) -IA | F Luk-ДЕ, AUR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 Младенец | MSSA 1 | T015 я | — | ST45 / CC45 | УЛ STR | F | F | Лук-де, AUR, CNA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мать | MSSA | 1 | T021 | III | — | ST30 / CC30 | — | 9 0392 — —— | Aur, CNA, TSST-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MRSA | MRSA | 1 | T002 | II | IV | ST5 / CC5 | ERY GEN, TOB, STR, FUS, CIP | msrA, mrsB, aac(6 ‘ )-Ie-aph(2 ‘ ‘ ), ant(4 ‘ )-Ia, str, fus (С) | Е | Luk-ДЕ, Aur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8 | Младенец | MSSA | 1 | T012 | III | — | ST30 / CC30 | — | — | 1 | Лук-де, Aur, CNA, TSST-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| младенца | MSSA | 1 | T5204 | II | — | ST15 / CC15 | — | – | С | Luk-ДЕ, Aur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | Младенец | MSSA | 1 | T122 | III | — | ST30 / CC30 | УЛ | ул | Aur , CNA, TSST-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10 | Младенец | MSSA | 1 | t10664 | Я | — | ST8 / CC8 | — | — | B | Aur , CNA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11 | Младенец | MSSA | 1 | T148 | Я | — | ST1434 / CC72 | — | — | B | Luk-ДЕ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 | Младенцы | MRSA | 1 | t322 | II | ST | IV 391 | УЛ | ул | F | Luk-ДЕ, Aur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Матери | MSSA | 3 | T166 | III | — | ST34 / CC30 | — | 2 —— | — 1 | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MSSA | 1 | T440 | III | — | ST30/CC30 | – | – | B | aur, cna, tsst-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| . | . | МРЗС/ . | № . | Молекулярное типирование . | Устойчивость к противомикробным препаратам . | Факторы вирулентности . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Чемодан . | Происхождение . | МССА . | штаммы . | спа тип . | с/х . | SCC меc . | МЛСТ/СС и . | Фенотип b . | Генотип . | МЭК тип c . | Другие гены d . | ||
| A. Случаи потенциал золотистого стафилококка передача от матери к младенцу | |||||||||||||
| 1 Младенец | МРСА 1 | T322 | II | II | IV | IV | st5 / cc5 | ery, cli, gen, tob | ERM (C), AAC (6 ‘) -ie-aph (2 ‘ ‘), Муравей (4 ‘) —ia ) —ia ) | F | Лук-де, AUR | ||
| MRSA | 7 | T322 | II | IV | ST5 / CC5 | ERY, CLI, GEN, TOB, KAN | erm(C),lnu(A), aac(6 ′ )-Ie-aph(2 ′ ′ ), ant(4) ′ )-Ia, aph(3 ′ )-III3 | F | лук-DE, aur 901 40 2 , ETA 2 | ||||
| Матери | MSSA | 1 | t136 | III | — | ST34 / CC30 | — | — | B | Лук-де, Aur, TSST-1 | |||
| 2 | MRSA | MRSA | 5 | II | II | IV | ST5 / CC5 | ERY, CLI, GEN, TOB | ERM (C), AAC (6 ‘) -ie-aph (2 ‘ ‘), Муравей (4 ‘ ) —ia ) — | F | Лук-де-де, AUR | ||
| Мать | MRSA | 1 | T322 | II | IV | IV | ST5 / CC5 | ERY, CLI, GEN, TOB, KAN | ERM (C), LNU ( А), аас(6 ′ )-Ie-aph(2 ′ ), Муравей (4 ‘) —ia ) —ia ) — | F | Лук-де, AUR, ETA | ||
| Младенца | MSSA | 1 | T136 | III | — | ST34 / CC30 | — | — | Е | Aur, TSST-1 | |||
| 3 | Младенец | MSSA | 4 | T015 | Я | — | ST45 / CC45 | — | — | В | Aur, CNA | ||
| Младенец | MSSA | 3 | t136 | III | — | ST34 / CC30 | — | — — | E | Лук-де, ETA, AUR, TSST-1 | |||
| Мать | MSSA | 1 | 1 | 90 392 T136III | — | — | — | ST34 / CC30 | — | — | — — 1Лук-де, ETA, AUR, TSST-1 | ||
| 4 | Младенческий | MSSA | 1 | T021 | III | — | ST1869 / CC30 | — | — | — | Aur, CNA, TSST-1 | ||
| Матери | MSSA | 1 | T021 | III | — | — | ST1869 / CC30 | — | — | — | — —Aur, CNA, TSST-1 | ||
B.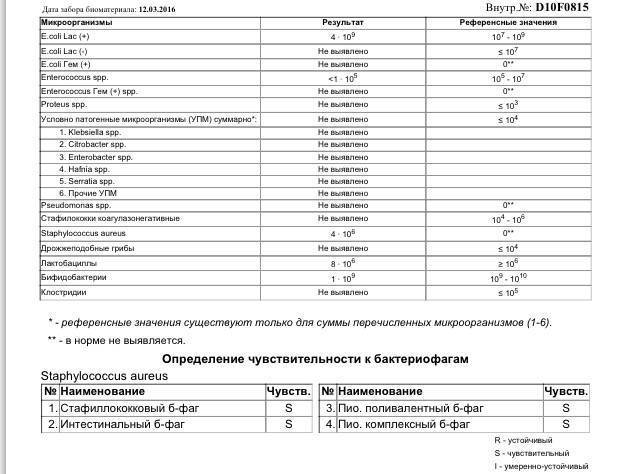 Случаи NON золотистого стафилококка передача от матери к младенцу Случаи NON золотистого стафилококка передача от матери к младенцу | |||||||||||||
| 5 Младенец | МРСА 2 | t322 II | И.В. | ST5 / CC5 ST5 / CC5 | ERY, CLI, GEN, TOB | ERM (C), AAC (6 ‘) -IE-APH (2 ‘ ‘), Муравей (4 ‘ ) -IA | F Luk-ДЕ, AUR | ||||||
| 6 Младенец | MSSA 1 | T015 я | — | ST45 / CC45 | УЛ STR | F | F | Лук-де, AUR, CNA | |||||
| Мать | MSSA | 1 | T021 | III | — | ST30 / CC30 | — | 9 0392 — —— | Aur, CNA, TSST-1 | ||||
| MRSA | MRSA | 1 | T002 | II | IV | ST5 / CC5 | ERY GEN, TOB, STR, FUS, CIP | msrA, mrsB, aac(6 ‘ )-Ie-aph(2 ‘ ‘ ), ant(4 ‘ )-Ia, str, fus (С) | Е | Luk-ДЕ, Aur | |||
| 8 | Младенец | MSSA | 1 | T012 | III | — | ST30 / CC30 | — | — | 1 | Лук-де, Aur, CNA, TSST-1 | ||
| младенца | MSSA | 1 | T5204 | II | — | ST15 / CC15 | — | – | С | Luk-ДЕ, Aur | |||
| 9 | Младенец | MSSA | 1 | T122 | III | — | ST30 / CC30 | УЛ | ул | Aur , CNA, TSST-1 | |||
| 10 | Младенец | MSSA | 1 | t10664 | Я | — | ST8 / CC8 | — | — | B | Aur , CNA | ||
| 11 | Младенец | MSSA | 1 | T148 | Я | — | ST1434 / CC72 | — | — | B | Luk-ДЕ | ||
| 12 | Младенцы | MRSA | 1 | t322 | II | ST | IV 391 | УЛ | ул | F | Luk-ДЕ, Aur | ||
| Матери | MSSA | 3 | T166 | III | — | ST34 / CC30 | — | 2 —— | — 1 | 1 | |||
| MSSA | 1 | T440 | III | — | ST30 / CC30 | — | — | 2 —B | Aur, CNA, TSST-1 | ||||
. | . | МРЗС/ . | № . | Молекулярное типирование . | Устойчивость к противомикробным препаратам . | Факторы вирулентности . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Чемодан . | Происхождение . | МССА . | штаммы . | спа тип . | с/х . | SCC меc . | МЛСТ/СС и . | Фенотип b . | Генотип . | МЭК тип c . | Другие гены d . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A. Случаи потенциал золотистого стафилококка передача от матери к младенцу | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 Младенец | МРСА 1 | T322 | II | II | IV | IV | st5 / cc5 | ery, cli, gen, tob | ERM (C), AAC (6 ‘) -ie-aph (2 ‘ ‘), Муравей (4 ‘) —ia ) —ia ) | F | Лук-де, AUR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MRSA | 7 | T322 | II | IV | ST5 / CC5 | ERY, CLI, GEN, TOB, KAN | erm(C),lnu(A), aac(6 ′ )-Ie-aph(2 ′ ′ ), ant(4) ′ )-Ia, aph(3 ′ )-III3 | F | лук-DE, aur 901 40 2 , ETA 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Матери | MSSA | 1 | t136 | III | — | ST34 / CC30 | — | — | B | Лук-де, Aur, TSST-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | MRSA | MRSA | 5 | II | II | IV | ST5 / CC5 | ERY, CLI, GEN, TOB | ERM (C), AAC (6 ‘) -ie-aph (2 ‘ ‘), Муравей (4 ‘ ) —ia ) — | F | Лук-де-де, AUR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мать | MRSA | 1 | T322 | II | IV | IV | ST5 / CC5 | ERY, CLI, GEN, TOB, KAN | ERM (C), LNU ( А), аас(6 ′ )-Ie-aph(2 ′ ), Муравей (4 ‘) —ia ) —ia ) — | F | Лук-де, AUR, ETA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Младенца | MSSA | 1 | T136 | III | — | ST34 / CC30 | — | — | Е | Aur, TSST-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | Младенец | MSSA | 4 | T015 | Я | — | ST45 / CC45 | — | — | В | Aur, CNA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Младенец | MSSA | 3 | t136 | III | — | ST34 / CC30 | — | — — | E | Лук-де, ETA, AUR, TSST-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мать | MSSA | 1 | 1 | 90 392 T136III | — | — | — | ST34 / CC30 | — | — | — — 1Лук-де, ETA, AUR, TSST-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | Младенческий | MSSA | 1 | T021 | III | — | ST1869 / CC30 | — | — | — | Aur, CNA, TSST-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Матери | MSSA | 1 | T021 | III | — | — | ST1869 / CC30 | — | — | — | — —Aur, CNA, TSST-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
B.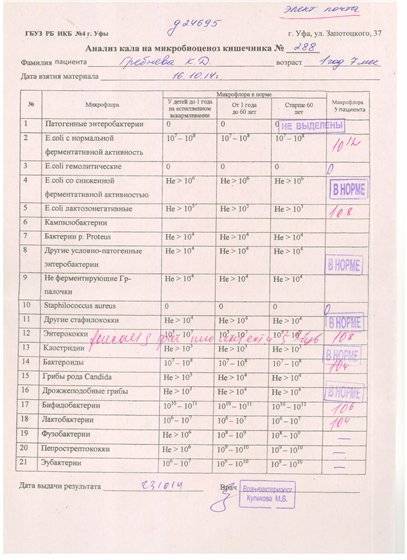 Случаи NON золотистого стафилококка передача от матери к младенцу Случаи NON золотистого стафилококка передача от матери к младенцу | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 Младенец | МРСА 2 | t322 II | И.В. | ST5 / CC5 ST5 / CC5 | ERY, CLI, GEN, TOB | ERM (C), AAC (6 ‘) -IE-APH (2 ‘ ‘), Муравей (4 ‘ ) -IA | F Luk-ДЕ, AUR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 Младенец | MSSA 1 | T015 я | — | ST45 / CC45 | УЛ STR | F | F | Лук-де, AUR, CNA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мать | MSSA | 1 | T021 | III | — | ST30 / CC30 | — | 9 0392 — —— | Aur, CNA, TSST-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MRSA | MRSA | 1 | T002 | II | IV | ST5 / CC5 | ERY GEN, TOB, STR, FUS, CIP | msrA, mrsB, aac(6 ‘ )-Ie-aph(2 ‘ ‘ ), ant(4 ‘ )-Ia, str, fus (С) | Е | Luk-ДЕ, Aur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8 | Младенец | MSSA | 1 | T012 | III | — | ST30 / CC30 | — | — | 1 | Лук-де, Aur, CNA, TSST-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| младенца | MSSA | 1 | T5204 | II | — | ST15 / CC15 | — | – | С | Luk-ДЕ, Aur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | Младенец | MSSA | 1 | T122 | III | — | ST30 / CC30 | УЛ | ул | Aur , CNA, TSST-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10 | Младенец | MSSA | 1 | t10664 | Я | — | ST8 / CC8 | — | — | B | Aur , CNA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11 | Младенец | MSSA | 1 | T148 | Я | — | ST1434 / CC72 | — | — | B | Luk-ДЕ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 | Младенцы | MRSA | 1 | t322 | II | ST | IV 391 | УЛ | ул | F | Luk-ДЕ, Aur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Матери | MSSA | 3 | T166 | III | — | ST34 / CC30 | — | 2 —— | — 1 | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MSSA | 1 | T440 | III | — | ST30/CC30 | – | – | B | aur, cna, tsst-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| . | Изоляты детских фекалий . | . | PFGE оценка сходных молекулярных линий в фекалиях и молоке . | |||||
|---|---|---|---|---|---|---|---|---|
| Чемоданы . | 7 дней . | 14 дней . | 35 дней . | Молочные изоляты . | Штаммы . | спа типа . | МЛСТ . | Шаблоны PFGE и . 90 331 |
| Случай 1 | C5515 | C6429 в C6436 | C5515, C6429, C6433, C6435 | t322 | ST5 | |||
| Случай 2 | C5522, C5523 | C5524, C5525 | C5526, C5527 | C6438 | C5522, C5524, C5526, C6438 | t322 | ST5 | |
| Случай 3 | C5518, C5519, C5520, C5521, C5535, C5536, C5537 | C6437 | C5520, C5537, C6437 | t136 | ST34 | В | ||
| Случай 4 | C5508 | C5509 | C5508, C5509 | T021 | ST1869 | C | ||
| Case 5 | C5513 | C5514 | ||||||
| Случай 6 | C5516 | C5517 | ||||||
| Случай 7 | C5507 | |||||||
| Случай 8 | C5511, C5512 | |||||||
| Корпус 9 | C5529 | |||||||
| 10 Дело | C5530 | |||||||
| 11 Дело | C5531 | 9 0391 | ||||||
| Case 12 | C5533 | C5532, C5534, C6439, C6440 | ||||||
.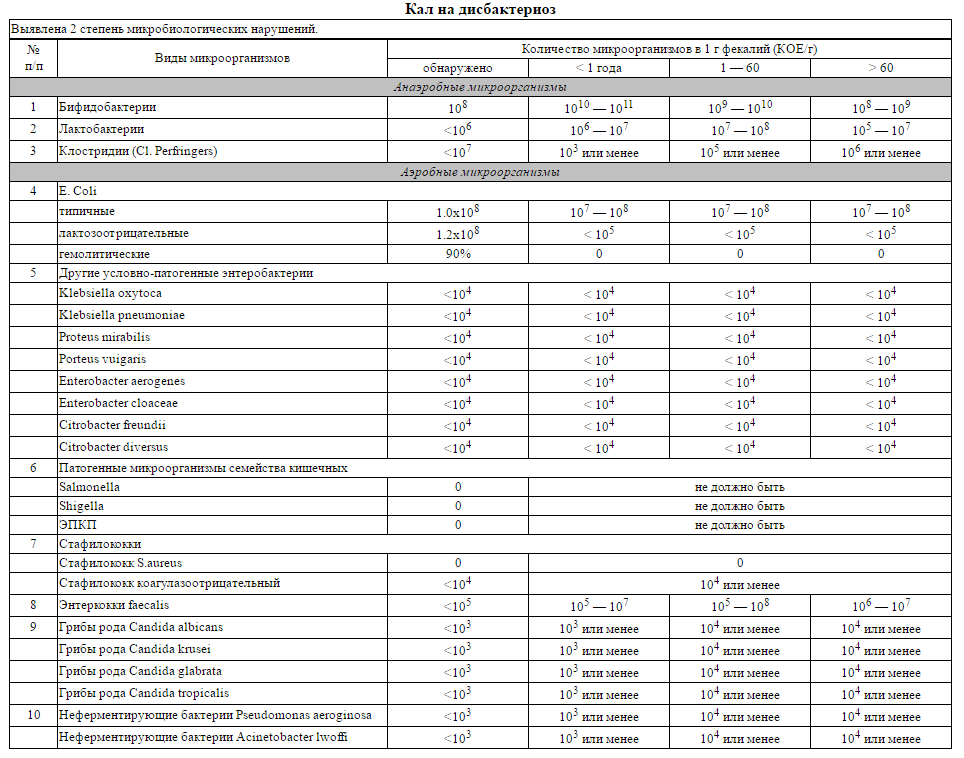 | Изоляты детских фекалий . | . | PFGE оценка сходных молекулярных линий в фекалиях и молоке . | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Чемоданы . | 7 дней . | 14 дней . | 35 дней . | Молочные изоляты . | Штаммы . | спа типа . | МЛСТ . | Шаблоны PFGE и . 90 331 | |
| Случай 1 | C5515 | C6429 в C6436 | C5515, C6429, C6433, C6435 | t322 | ST5 | ||||
| Случай 2 | C5522, C5523 | C5524, C5525 | C5526, C5527 | C6438 | C5522, C5524, C5526, C6438 | t322 | ST5 | ||
| Случай 3 | C5518, C5519, C5520, C5521, C5535, C5536, C5537 | C6437 | C5520, C5537, C6437 | t136 | ST34 | В | |||
| Случай 4 | C5508 | C5509 | C5508, C5509 | T021 | ST1869 | C | |||
| Case 5 | C5513 | C5514 | |||||||
| Случай 6 | C5516 | C5517 | |||||||
| Случай 7 | C5507 | ||||||||
| Случай 8 | C5511, C5512 | ||||||||
| Корпус 9 | C5529 | ||||||||
| 10 Дело | C5530 | ||||||||
| 11 Дело | C5531 | 9 0391 | |||||||
| Чехол 12 | C5533 | C5532, C5534, C6439, C6440 | |||||||
Штаммы Staphylococcus aureus , выделенные из 12 случаев передачи от матери ребенку, и потенциальная передача от матери ребенку в четырех случаях по оценке типирования PFGE -spa -MLST.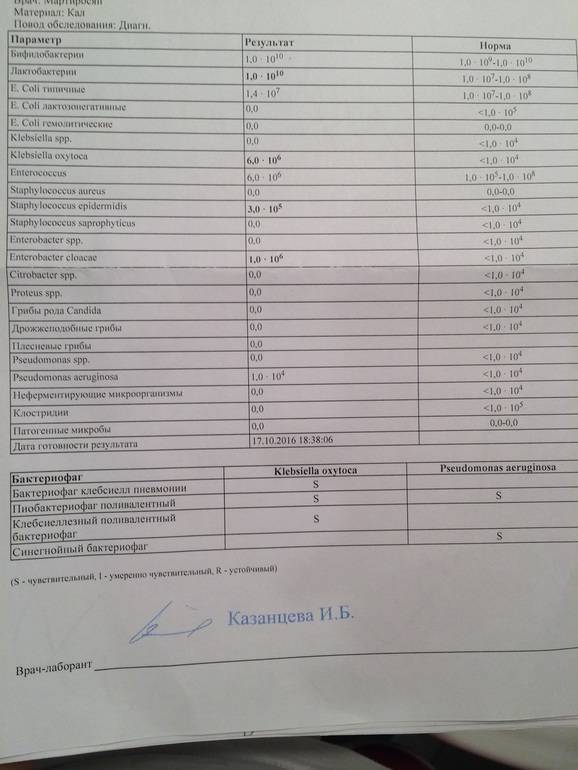
| . | Изоляты детских фекалий . | . | PFGE оценка сходных молекулярных линий в фекалиях и молоке . | |||||
|---|---|---|---|---|---|---|---|---|
| Чемоданы . | 7 дней . | 14 дней . | 35 дней . | Молочные изоляты . | Штаммы . | спа типа . | МЛСТ . | Шаблоны PFGE и . 90 331 |
| Случай 1 | C5515 | C6429 в C6436 | C5515, C6429, C6433, C6435 | t322 | ST5 | |||
| Случай 2 | C5522, C5523 | C5524, C5525 | C5526, C5527 | C6438 | C5522, C5524, C5526, C6438 | t322 | ST5 | |
| Случай 3 | C5518, C5519, C5520, C5521, C5535, C5536, C5537 | C6437 | C5520, C5537, C6437 | t136 | ST34 | В | ||
| Случай 4 | C5508 | C5509 | C5508, C5509 | T021 | ST1869 | C | ||
| Case 5 | C5513 | C5514 | ||||||
| Случай 6 | C5516 | C5517 | ||||||
| Случай 7 | C5507 | |||||||
| Случай 8 | C5511, C5512 | |||||||
| Корпус 9 | C5529 | |||||||
| 10 Дело | C5530 | |||||||
| 11 Дело | C5531 | 9 0391 | ||||||
| Case 12 | C5533 | C5532, C5534, C6439, C6440 | ||||||
. | Изоляты детских фекалий . | . | PFGE оценка сходных молекулярных линий в фекалиях и молоке . | |||||
|---|---|---|---|---|---|---|---|---|
| Чемоданы . | 7 дней . | 14 дней . | 35 дней . | Молочные изоляты . | Штаммы . | спа типа . | МЛСТ . | Шаблоны PFGE и . 90 331 |
| Случай 1 | C5515 | C6429 в C6436 | C5515, C6429, C6433, C6435 | t322 | ST5 | |||
| Случай 2 | C5522, C5523 | C5524, C5525 | C5526, C5527 | C6438 | C5522, C5524, C5526, C6438 | t322 | ST5 | |
| Случай 3 | C5518, C5519, C5520, C5521, C5535, C5536, C5537 | C6437 | C5520, C5537, C6437 | t136 | ST34 | В | ||
| Случай 4 | C5508 | C5509 | C5508, C5509 | T021 | ST1869 | C | ||
| Case 5 | C5513 | C5514 | ||||||
| Случай 6 | C5516 | C5517 | ||||||
| Случай 7 | C5507 | |||||||
| Случай 8 | C5511, C5512 | |||||||
| Корпус 9 | C5529 | |||||||
| 10 Дело | C5530 | |||||||
| 11 Дело | C5531 | 9 0391 | ||||||
| Корпус 12 | C5533 | C5532, C5534, C6439, C6440 | ||||||
Молекулярное типирование изолятов
Всего 41 S.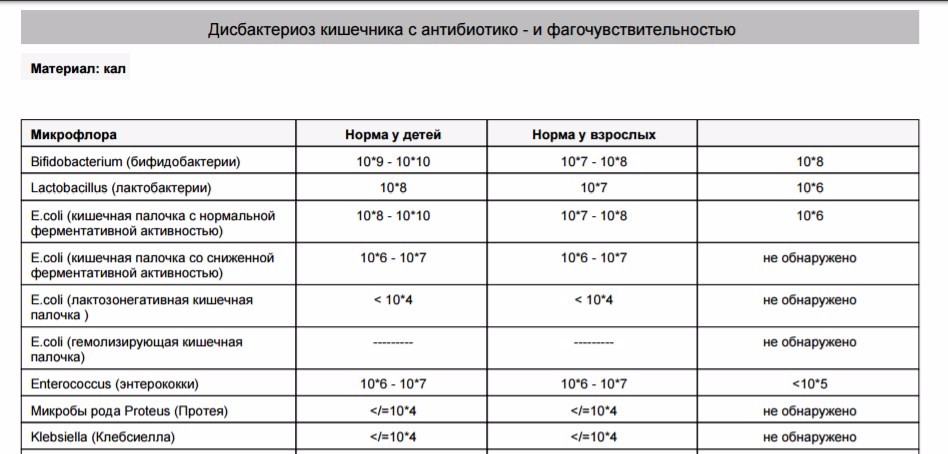 aureus были выделены в этом исследовании у матерей и младенцев, и 18 из них были признаны MRSA, поскольку они показали устойчивость к оксациллину и цефокситину и были положительными в отношении гена mec A. Эти изоляты MRSA были выделены у 2 из 21 протестированной матери (9,6%) и у 5 из 21 младенца (23,8%). Остальные 23 изолята были чувствительны к оксациллину и цефокситину, не имели гена mecA и считались MSSA.
aureus были выделены в этом исследовании у матерей и младенцев, и 18 из них были признаны MRSA, поскольку они показали устойчивость к оксациллину и цефокситину и были положительными в отношении гена mec A. Эти изоляты MRSA были выделены у 2 из 21 протестированной матери (9,6%) и у 5 из 21 младенца (23,8%). Остальные 23 изолята были чувствительны к оксациллину и цефокситину, не имели гена mecA и считались MSSA.
Результаты полной характеристики всех изолятов MRSA и MSSA, полученных в ходе этого исследования, показаны в таблице 1.Было обнаружено двенадцать различных типов spa (t002, t012, t015, t021, t122, t136, t148, t166, t322, t440, t5204 и новый тип spa , зарегистрированный как t10664 в Ridom Spa Server), и большинство частыми агр аллотипами были II и III.
Изоляты Staphylococcus aureus принадлежали к восьми различным типам последовательностей (ST5, ST8, ST15, ST30, ST34, ST45, ST1434 и ST1869), включенным в шесть различных клональных комплексов (СС5, СС8, СС15, СС30, СС45 и СС72).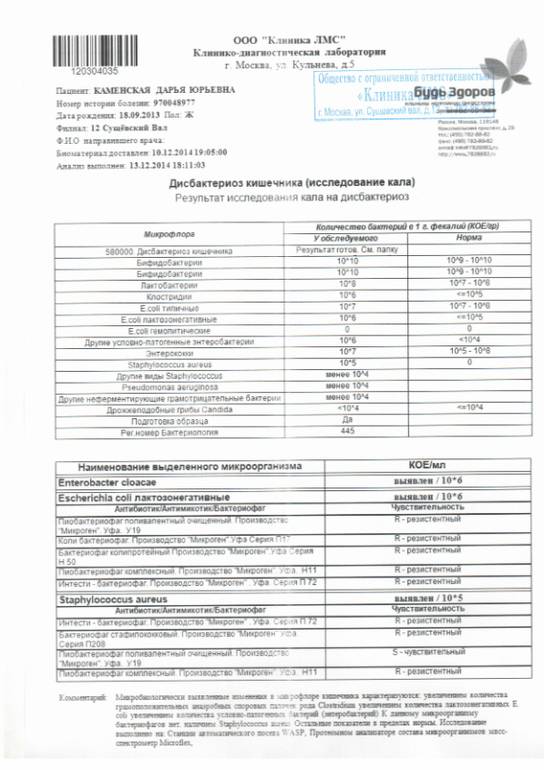 Изоляты MRSA были типизированы как ST5 ( spa -322 и spa -t002), отнесены к клональному комплексу CC5 и типизированы как SCC mec IV. Другими ST, идентифицированными среди MSSA, были (приписаны ST/CC): ST8/CC8, ST15/CC15, ST30-ST34-ST1869/CC30, ST45/CC45 и ST1434/CC72. Преобладающими клональными комплексами были CC5 и CC30, и они составляли 43,9 и 36,6% от общего количества изолятов (таблица 1).
Изоляты MRSA были типизированы как ST5 ( spa -322 и spa -t002), отнесены к клональному комплексу CC5 и типизированы как SCC mec IV. Другими ST, идентифицированными среди MSSA, были (приписаны ST/CC): ST8/CC8, ST15/CC15, ST30-ST34-ST1869/CC30, ST45/CC45 и ST1434/CC72. Преобладающими клональными комплексами были CC5 и CC30, и они составляли 43,9 и 36,6% от общего количества изолятов (таблица 1).
Анализ PFGE для проверки потенциальной передачи от матери ребенку
S. aureus передача Спа набрав S.aureus , изоляты матерей и младенцев предполагают возможную передачу от матери ребенку в четырех парах мать-ребенок (случаи 1-4). Чтобы прояснить этот вопрос, сравнивали профили PFGE изолятов с аналогичными типами spa . Было доказано совместное использование клона MRSA t322/ST5/CC5-PFGE-A между матерями и младенцами в случаях 1 и 2. Точно так же клоны MSSA t136/ST34/CC30-PFGE-B и MSSA t021/ST1869/CC30-PFGE-C были общими для случаев 3 и 4 соответственно (таблица 2, рис.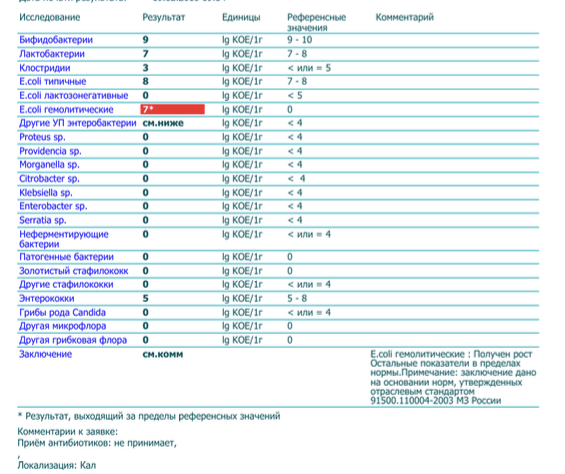 1). Сходства по типам spa среди изолятов от матерей и младенцев остальных восьми случаев не наблюдалось.
1). Сходства по типам spa среди изолятов от матерей и младенцев остальных восьми случаев не наблюдалось.
Рисунок 1.
PFGE- SmaI анализ изолятов S. aureus в случаях потенциальной передачи от матери ребенку. Строки с 1 по 8 показывают штаммы матерей и младенцев, принадлежащие к случаям 1 и 2 с профилем PFGE A. Строки 9–11: штаммы матери и ребенка, относящиеся к случаю 3 с профилем PFGE B. Строки 12 и 13: штаммы матери и младенец из случая 4 с профилем PFGE C.Сокращения. В: младенец; Мо: мать.
Рисунок 1.
PFGE- SmaI анализ изолятов S. aureus в случаях потенциальной передачи от матери ребенку. Строки с 1 по 8 показывают штаммы матерей и младенцев, принадлежащие к случаям 1 и 2 с профилем PFGE A. Строки 9–11: штаммы матери и ребенка, относящиеся к случаю 3 с профилем PFGE B. Строки 12 и 13: штаммы матери и младенец из случая 4 с профилем PFGE C. Сокращения. В: младенец; Мо: мать.
Тестирование чувствительности и обнаружение генов устойчивости к противомикробным препаратам
Изоляты MSSA показали чувствительность к большинству тестируемых противомикробных препаратов, за исключением двух изолятов, относящихся к линиям СС30 и СС45, которые проявляли устойчивость к стрептомицину и содержали ген str .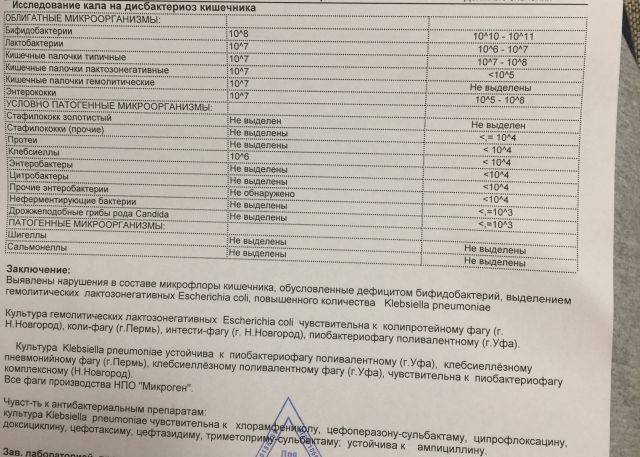 С другой стороны, изоляты MRSA-CC5-t322 продемонстрировали фенотип множественной лекарственной устойчивости с устойчивостью к эритромицину, клиндамицину, гентамицину, тобрамицину и канамицину в дополнение к устойчивости к метициллину; эти изоляты несли erm(C) , aac(6 ‘ )-Ie-aph(2 ‘ ‘ ), ant(4 ‘ )-Ia и a
С другой стороны, изоляты MRSA-CC5-t322 продемонстрировали фенотип множественной лекарственной устойчивости с устойчивостью к эритромицину, клиндамицину, гентамицину, тобрамицину и канамицину в дополнение к устойчивости к метициллину; эти изоляты несли erm(C) , aac(6 ‘ )-Ie-aph(2 ‘ ‘ ), ant(4 ‘ )-Ia и a
Гены вирулентности
Различное количество факторов вирулентности было обнаружено среди 41 изолятов S. aureus (таблица 1). Интересно, что 15 изолятов MSSA, принадлежащих к клональному комплексу CC30, содержали ген токсина tsst-1 (36. 6%), а восемь изолятов (три MRSA-CC5 и пять MSSA-CC30) содержали ген эксфолиативного токсина А ( eta ). Пятеро обследованных младенцев содержали в фекалиях TSST-продуцирующие штаммы S. aureus клонального комплекса СС30 (в двух случаях он был обнаружен и в молоке их матерей). генов lukD–lukE были обнаружены в 30 изолятах (73,2%), из них 18 MRSA и 12 MSSA. В общей сложности 35 изолятов содержали ген aur и 12 были положительными по гену cna (принадлежащие в основном к клональным комплексам СС30 и СС45).Все изоляты были отрицательными в отношении наличия генов lukF/lukS- PV, lukM, bap, etb или etd (таблица 1).
6%), а восемь изолятов (три MRSA-CC5 и пять MSSA-CC30) содержали ген эксфолиативного токсина А ( eta ). Пятеро обследованных младенцев содержали в фекалиях TSST-продуцирующие штаммы S. aureus клонального комплекса СС30 (в двух случаях он был обнаружен и в молоке их матерей). генов lukD–lukE были обнаружены в 30 изолятах (73,2%), из них 18 MRSA и 12 MSSA. В общей сложности 35 изолятов содержали ген aur и 12 были положительными по гену cna (принадлежащие в основном к клональным комплексам СС30 и СС45).Все изоляты были отрицательными в отношении наличия генов lukF/lukS- PV, lukM, bap, etb или etd (таблица 1).
Анализ генов МЭК
Только шесть изолятов S. aureus MSSA-CC30 из 41 изученного S. aureus не содержали генов IEC. Среди остальных изолятов были получены следующие типы МЭК (тип МЭК/СС): А/СС30, В/СС30-СС45-СС8-СС72, С/СС15, Е/СС30-СС5 и F/СС5-СС45.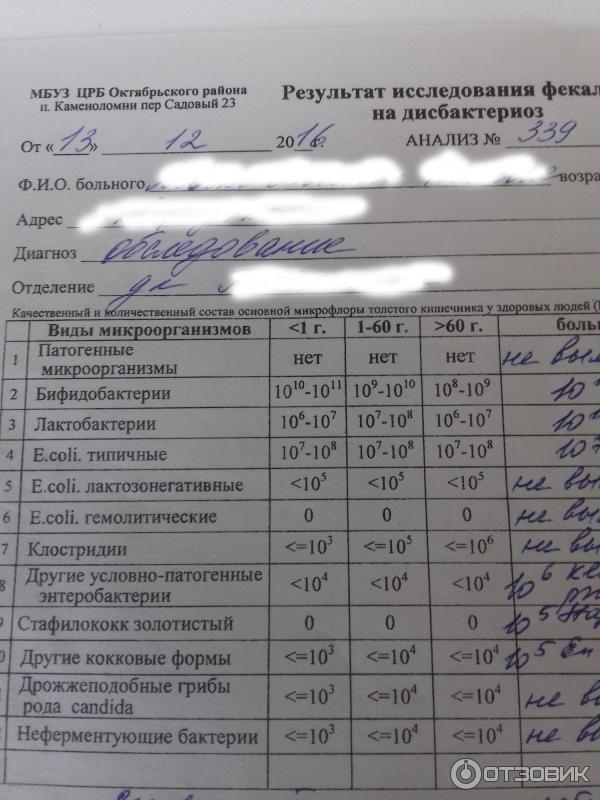 МЭК типов D и G не были обнаружены ни в одном из изолятов (таблица 1).
МЭК типов D и G не были обнаружены ни в одном из изолятов (таблица 1).
Персистенция
клонов S. aureusОдин и тот же клон S. aureus был выделен от одного и того же младенца, по крайней мере, в два разных периода времени, в случаях 2 и 5, что указывает на персистенцию клонов. У остальных детей S. aureus были выделены только в одной из трех проб фекалий, полученных на протяжении всего исследуемого периода (35 дней).
ОБСУЖДЕНИЕ
Высокая частота фекального носительства S. aureus (12 из 21 протестированного, 57%) была обнаружена среди здоровых младенцев в этом исследовании в течение первых 35 дней их жизни.Штаммы MRSA были обнаружены у 5 из этих 12 младенцев, что составляет 23,8% от общего числа протестированных младенцев. Ни у одного из MRSA-положительных младенцев, обнаруженных в этом исследовании, не развилась инфекция MRSA в течение следующих 6 лет жизни (данные не представлены).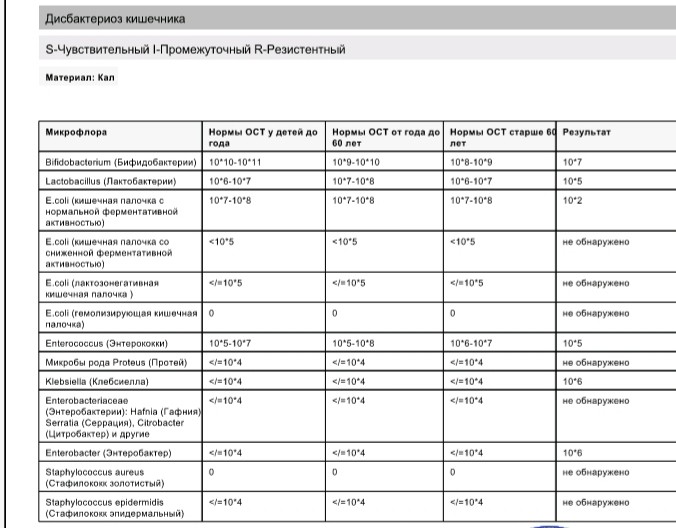 Предыдущие исследования сообщали о частоте фекального носительства S. aureus у здоровых младенцев от 6 до 65% (Björkstén et al. , 2001; Dominguez, Zarazaga and Torres 2002; Lindberg et al. 2004) и значительно более низком уровне MRSA. частота носительства у здоровых детей и у людей на момент госпитализации (0–5%) (Dominguez, Zarazaga and Torres, 2002; Jernigan et al., 2003), хотя зарегистрированный процент увеличился среди госпитализированных пациентов (24%) (Klotz et al. , 2005). Кроме того, предыдущее исследование показало, что колонизация S. aureus в кишечнике младенцев была высокой в течение первого месяца жизни, но снижалась в последующие недели (Björkstén et al. , 2001). В нашем исследовании самая высокая распространенность у младенцев была обнаружена на 35-й день после рождения. Что касается проб молока протестированных матерей, то две из 21 (9,6%) содержали MRSA, что также свидетельствует о высокой частоте носительства.
Предыдущие исследования сообщали о частоте фекального носительства S. aureus у здоровых младенцев от 6 до 65% (Björkstén et al. , 2001; Dominguez, Zarazaga and Torres 2002; Lindberg et al. 2004) и значительно более низком уровне MRSA. частота носительства у здоровых детей и у людей на момент госпитализации (0–5%) (Dominguez, Zarazaga and Torres, 2002; Jernigan et al., 2003), хотя зарегистрированный процент увеличился среди госпитализированных пациентов (24%) (Klotz et al. , 2005). Кроме того, предыдущее исследование показало, что колонизация S. aureus в кишечнике младенцев была высокой в течение первого месяца жизни, но снижалась в последующие недели (Björkstén et al. , 2001). В нашем исследовании самая высокая распространенность у младенцев была обнаружена на 35-й день после рождения. Что касается проб молока протестированных матерей, то две из 21 (9,6%) содержали MRSA, что также свидетельствует о высокой частоте носительства.
Обращает на себя внимание генетическое разнообразие spa типов, обнаруженных в нашем исследовании (12 различных spa типов, включая новый). Более одной трети штаммов показали типов spa , которые можно отнести к клональному комплексу CC30, линии, которая, по-видимому, является успешным колонизатором людей и продемонстрировала широкое повсеместное распространение (Deurenberg et al. , 2009). Этот клональный комплекс, по-видимому, связан с внебольничными инфекциями 9 . Наши штаммы MSSA CC30 показали небольшое количество генов устойчивости к противомикробным препаратам, но замечательный профиль генов вирулентности; фактически более 90% штаммов MSSA-CC30 содержали ген токсина синдрома токсического шока ( tsst-1 ).Эта связь между MSSA-CC30 и tsst-1 наблюдалась в других исследованиях (Deurenberg et al. 2009), но в более низких процентах, чем в нашем исследовании (Mégevand et al. , 2010; Lozano et al.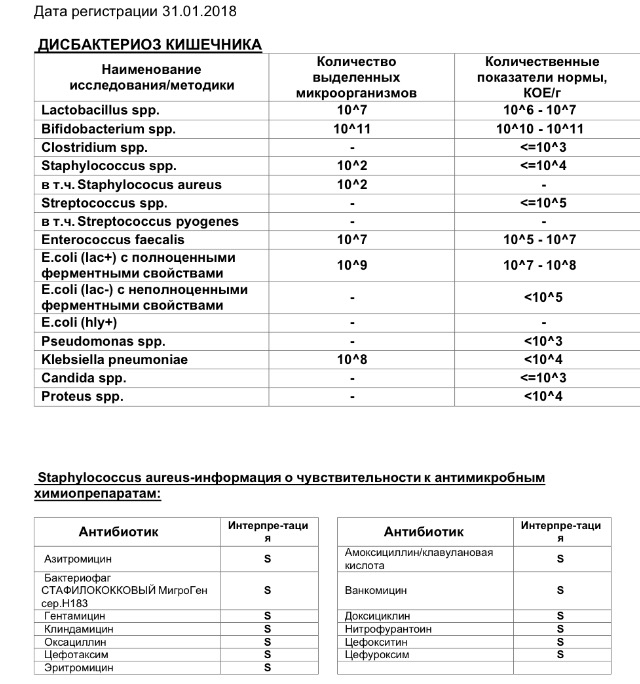 , 2011). Ранняя колонизация кишечника изолятами S. aureus , продуцирующими токсины с суперантигенной функцией, такой как (TSST-1), по-видимому, способствует системным ответам IgA у новорожденных, которые отрицательно коррелируют с развитием аллергии (Lundell et al. , 2009).
, 2011). Ранняя колонизация кишечника изолятами S. aureus , продуцирующими токсины с суперантигенной функцией, такой как (TSST-1), по-видимому, способствует системным ответам IgA у новорожденных, которые отрицательно коррелируют с развитием аллергии (Lundell et al. , 2009).
Около трети штаммов S. aureus относились к типу MRSA-t322-ST5-CC5, с agr -II и SCC mec IV. Эти штаммы показали типичный профиль HA-MRSA (Schaumburg et al. , 2012), продемонстрировали множественную лекарственную устойчивость (макролиды, линкозамины и аминоглюкозиды) и различные гены устойчивости к противомикробным препаратам, включая erm(C), aac(6 ‘) -Ie-aph(2 ′ ′ ), ant(4 ′ )-Ia и aph(3 ′ ) -III, а также lnu(A) в двух из них .Обнаружение IEC типа F или E во всех этих штаммах дополнительно подтверждает их профиль HA-MRSA (Benito et al. , 2013).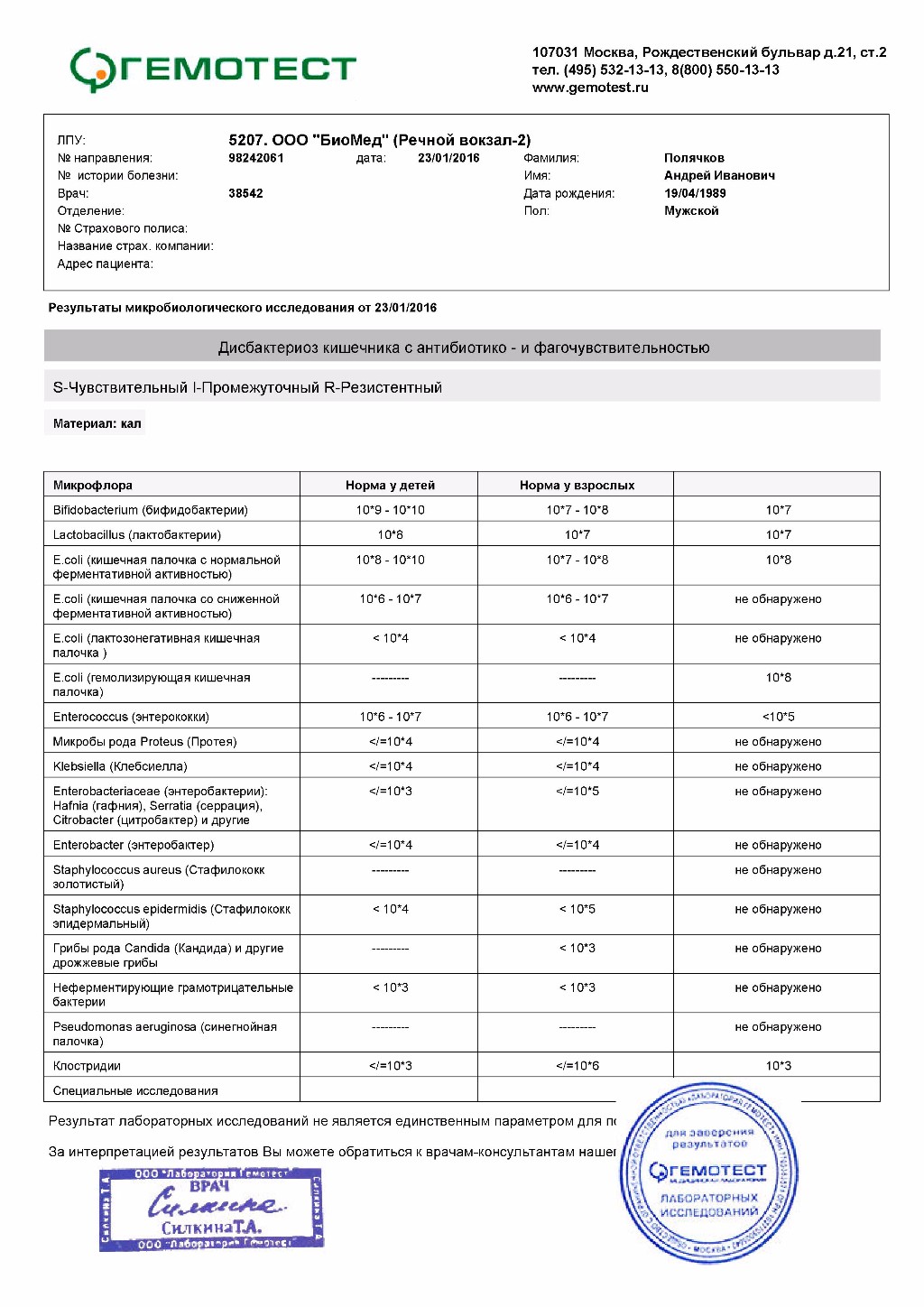
Интересно, что в одном образце фекалий был обнаружен один штамм MSSA t148/ST1434-CC72; эта клада S aureus ранее была связана со штаммами CA-MRSA, обнаруженными в азиатских странах (Harastani, Araj and Tokajian 2014), но в нашем случае у штамма CC72 отсутствовали детерминанты устойчивости к метициллину. Точно так же штамм MSSA, типизированный как t10664/ST8-CC8, не имел генов токсина PVL и, следовательно, не демонстрировал типичный профиль CA-MRSA (Uhlemann et al., 2014 г.).
Все наши штаммы S. aureus были PVL-отрицательными и luk-M отрицательными. Более того, ни у одного из них не было гена bap , кодирующего ассоциированный с биопленкой белок (Cucarella et al. , 2001). Ранее предполагалось, что распространенность гена bap среди штаммов S. aureus очень низкая (Vautor et al. , 2008). Кроме того, восемь штаммов (19,5%) несли ген eta , кодирующий эксфолиативный токсин А, и были отнесены к клональным комплексам СС5 и СС30. Сообщалось, что эти штаммы вызывают стафилококковый синдром обожженной кожи и импетиго (Masiuk et al. , 2010). Кроме того, 73,2% наших штаммов содержали генов lukD–lukE , которые кодируют лейкотоксин, более распространенный в HA-MRSA (Uhlemann et al. , 2014). Двенадцать штаммов CC8, CC30 или CC45 содержали ген cna , кодирующий белок, связывающий коллаген, в основном связанный с внебольничным MRSA или MSSA (Deurenberg et al. , 2009).
Сообщалось, что эти штаммы вызывают стафилококковый синдром обожженной кожи и импетиго (Masiuk et al. , 2010). Кроме того, 73,2% наших штаммов содержали генов lukD–lukE , которые кодируют лейкотоксин, более распространенный в HA-MRSA (Uhlemann et al. , 2014). Двенадцать штаммов CC8, CC30 или CC45 содержали ген cna , кодирующий белок, связывающий коллаген, в основном связанный с внебольничным MRSA или MSSA (Deurenberg et al. , 2009).
Анализ PFGE выявил четыре случая возможной передачи S. aureus от матери ребенку через грудное молоко (рис. 1). Интересно, что один и тот же клон использовался в образцах молока и фекалий младенцев в двух разных случаях (случаи 1 и 2). Некоторые авторы предполагают, что колонизированная кожа родителей является источником большинства S. aureus , которые колонизируют микробиоту кишечника младенцев или младенцев (Gries et al. , 2009), в то время как другие предполагают, что персонал родильного отделения может быть еще одним источником передача между младенцами и матерями (Matussek et al.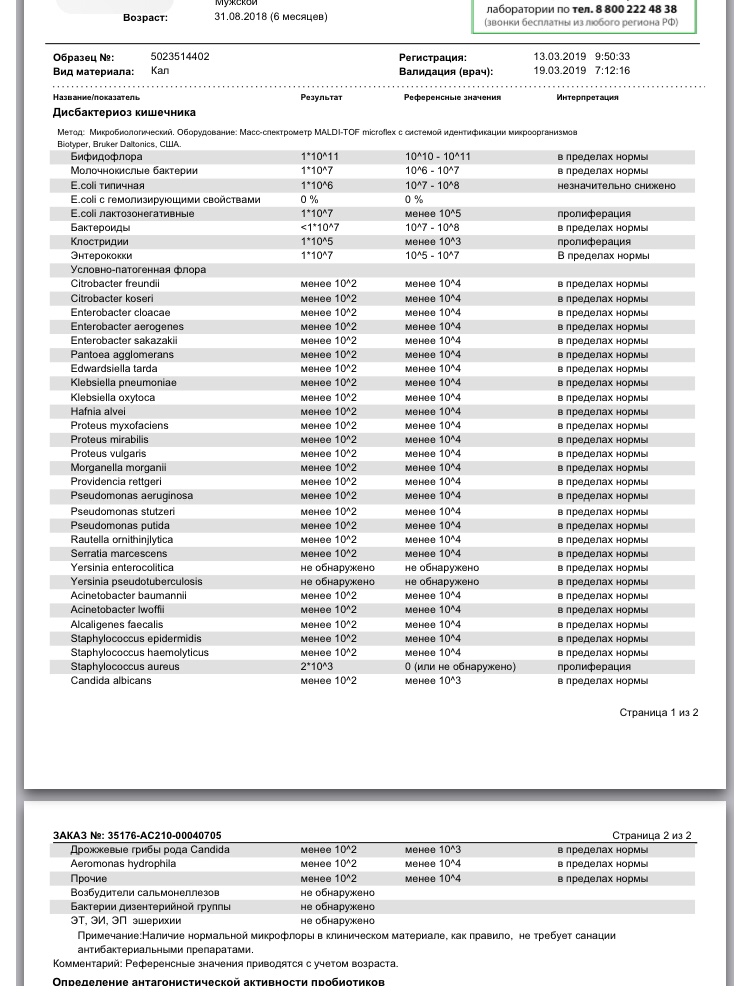 , 2007 г.). Кроме того, есть исследования, в которых постулируется, что увеличение частоты S. aureus на коже госпитализированных пациентов может быть потенциальным источником, способствующим внутрибольничной передаче (Bhalla, Aron and Donskey 2007). В нашем исследовании клон t322-CC5, который был обнаружен в двух случаях потенциальной передачи инфекции от матери ребенку, мог иметь госпитальное происхождение, поскольку он имел типичные характеристики HA-MRSA. Младенцы случаев 1 и 2 родились в одной больнице, но с разницей в 6 месяцев.
, 2007 г.). Кроме того, есть исследования, в которых постулируется, что увеличение частоты S. aureus на коже госпитализированных пациентов может быть потенциальным источником, способствующим внутрибольничной передаче (Bhalla, Aron and Donskey 2007). В нашем исследовании клон t322-CC5, который был обнаружен в двух случаях потенциальной передачи инфекции от матери ребенку, мог иметь госпитальное происхождение, поскольку он имел типичные характеристики HA-MRSA. Младенцы случаев 1 и 2 родились в одной больнице, но с разницей в 6 месяцев.
Грудное молоко представляет собой сложную видоспецифичную биологическую жидкость, приспособленную для удовлетворения пищевых потребностей быстро растущего младенца; кроме того, он обучает иммунную систему младенцев и обеспечивает определенную степень защиты от патогенов. Эти эффекты отражают синергетическое действие многих биоактивных молекул (Ballard et al. , 2013). Кроме того, недавние исследования показали, что грудное молоко является непрерывным источником бактерий для кишечника младенцев, а как культуральные, так и микробиомные исследования показали, что стафилококки, в основном ЦНС, составляют доминирующие бактерии в этой биологической жидкости (Fernández et al. ., 2013 г.). Интересно, что как S. aureus , так и S. epidermidis относятся к числу микроорганизмов с наибольшей способностью метаболизировать олигосахариды грудного молока (Hunt et al. , 2012). Различные исследования показывают, что некоторые бактерии, присутствующие в кишечнике матери, в том числе стафилококки, могут достигать молочной железы на поздних сроках беременности и в период лактации посредством механизма, включающего моноциты кишечника (Martin et al. , 2004; Pérez et al. , 2007). .Ранняя колонизация кишечника изолятами S. aureus , включая токсигенные изоляты, влияет на уровень растворимого CD14 или IgA, циркулирующих в плазме новорожденных, что влияет на развитие иммунной системы и риск развития аллергии (Lundell et al. , 2007, 2009).
., 2013 г.). Интересно, что как S. aureus , так и S. epidermidis относятся к числу микроорганизмов с наибольшей способностью метаболизировать олигосахариды грудного молока (Hunt et al. , 2012). Различные исследования показывают, что некоторые бактерии, присутствующие в кишечнике матери, в том числе стафилококки, могут достигать молочной железы на поздних сроках беременности и в период лактации посредством механизма, включающего моноциты кишечника (Martin et al. , 2004; Pérez et al. , 2007). .Ранняя колонизация кишечника изолятами S. aureus , включая токсигенные изоляты, влияет на уровень растворимого CD14 или IgA, циркулирующих в плазме новорожденных, что влияет на развитие иммунной системы и риск развития аллергии (Lundell et al. , 2007, 2009).
Присутствие S. epidermidis в кишечнике младенцев, по-видимому, является отличительной чертой фекалий младенцев, находящихся на грудном вскармливании, по сравнению с фекалиями детей, находящихся на искусственном вскармливании (Borderon et al.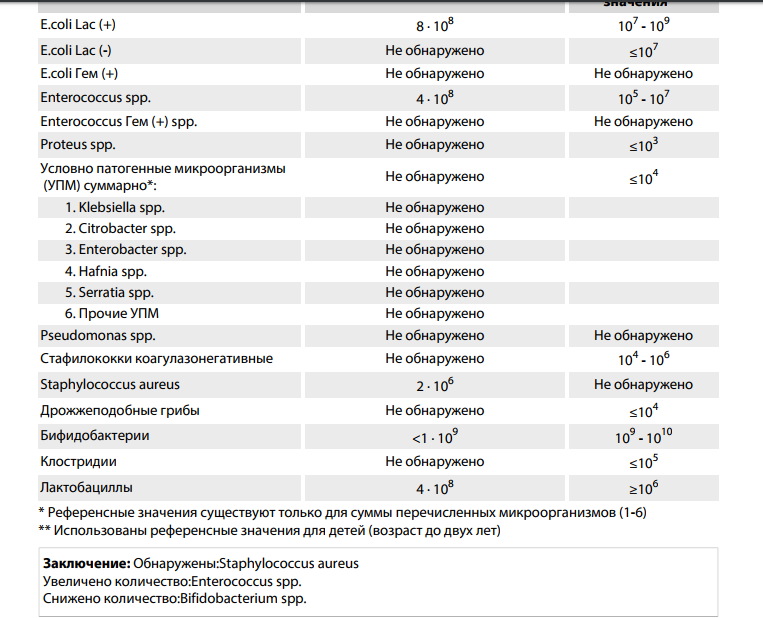 , 1996 г.; Адлерберт и др. , 2006 г.; Хименес и др. , 2008 г.). В этом контексте обильное присутствие этого вида во всех образцах молока и фекалий, протестированных в этом исследовании (данные не показаны) (Хименес и др. , 2008 г.), может объяснить, по крайней мере частично, почему все младенцы оставались здоровыми на протяжении всего периода исследования. период учебы, а также в последующие годы. Действительно, ЦНС, обеспечиваемая грудным молоком, может быть особенно полезной для уменьшения заражения нежелательными патогенами младенцев, подвергающихся воздействию больничной среды.Было высказано предположение, что S. epidermidis и другие ЦНС могут выполнять пробиотическую функцию, предотвращая колонизацию хозяина более тяжелыми патогенами, такими как S. aureus (Otto et al. , 2009). Фактически, некоторые штаммы S. epidermidis , которые ингибируют колонизацию in vivo S. aureus , постулируются в качестве будущей стратегии по уничтожению таких патогенов с поверхностей слизистых оболочек (Iwase et al.
, 1996 г.; Адлерберт и др. , 2006 г.; Хименес и др. , 2008 г.). В этом контексте обильное присутствие этого вида во всех образцах молока и фекалий, протестированных в этом исследовании (данные не показаны) (Хименес и др. , 2008 г.), может объяснить, по крайней мере частично, почему все младенцы оставались здоровыми на протяжении всего периода исследования. период учебы, а также в последующие годы. Действительно, ЦНС, обеспечиваемая грудным молоком, может быть особенно полезной для уменьшения заражения нежелательными патогенами младенцев, подвергающихся воздействию больничной среды.Было высказано предположение, что S. epidermidis и другие ЦНС могут выполнять пробиотическую функцию, предотвращая колонизацию хозяина более тяжелыми патогенами, такими как S. aureus (Otto et al. , 2009). Фактически, некоторые штаммы S. epidermidis , которые ингибируют колонизацию in vivo S. aureus , постулируются в качестве будущей стратегии по уничтожению таких патогенов с поверхностей слизистых оболочек (Iwase et al.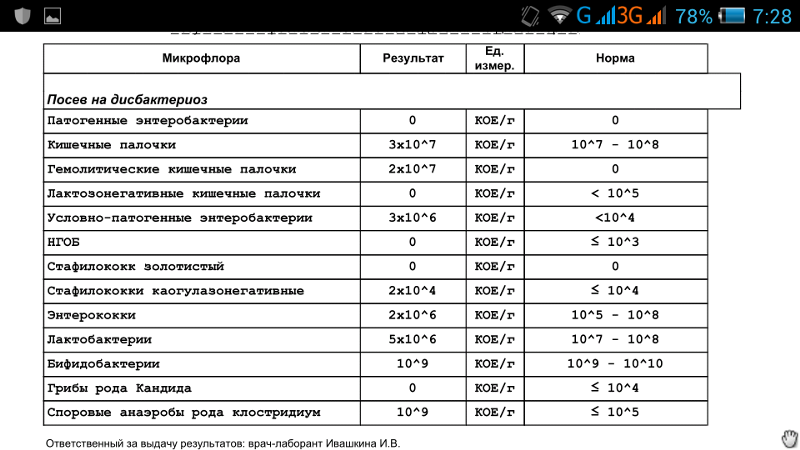 , 2010; Park, Iwase и Лю 2011).
, 2010; Park, Iwase и Лю 2011).
В заключение следует отметить, что в этом исследовании среди здоровых младенцев наблюдалась высокая частота фекального носительства S. aureus , включая штаммы MRSA. Было выявлено четыре случая передачи S. aureus от матери ребенку через грудное молоко, что подчеркивает способность этого микроорганизма передаваться этим путем и закрепляться в микробиоте кишечника младенцев. В связи с этим важно отметить, что необходимы дополнительные исследования, чтобы понять значение или возможную роль этой микробной передачи от матери ребенку.Будущие исследования должны быть сосредоточены на влиянии этой ранней колонизации кишечника младенцев S. aureus (включая колонизацию изолятами MRSA) на правильное развитие их иммунной системы, эволюцию колонизации S. aureus в течение первых лет жизни младенцев и влияние на становление других бактерий кишечного микробиома.
Мы подтверждаем правку текста, выполненную Ф. Руис-Ларреа.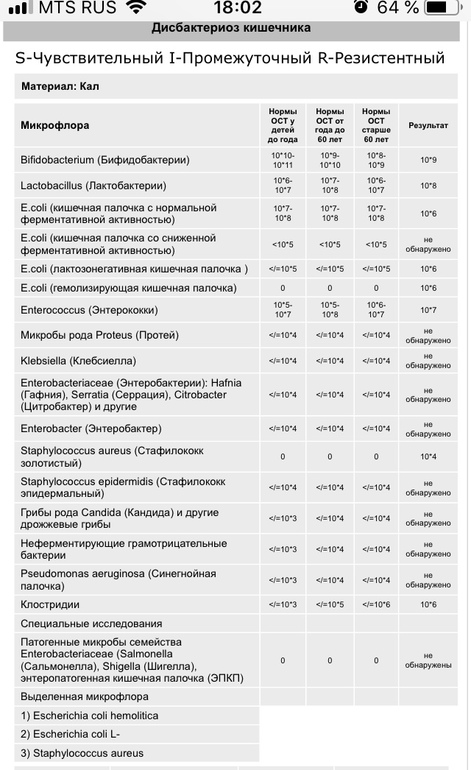
ФИНАНСИРОВАНИЕ
Эта работа была частично поддержана Проектом SAF2012–35474 Министерства экономики и конкурентоспособности Испании и Регионального фонда Desarrollo (FEDER).Даниэль Бенито имеет стипендию FPI для подготовки докторской диссертации от Министерства экономики и конкурентоспособности Испании, а К. Лосано финансируется в рамках проекта SAF2012–35474.
Конфликт интересов . Не существует в связи с этой рукописью.
ССЫЛКИ
Адлерберт
I
Линдберг
Е
Аберг
N
и др.Сниженная энтеробактериальная и повышенная стафилококковая колонизация детского кишечника: влияние гигиенического образа жизни
Педиатр Рес
2006
59
96
101
Баллард
О
Морроу
АЛ
Состав грудного молока: питательные вещества и биологически активные факторы
Pediatr Clin N Am
2013
60
49
74
Бенито
Д
Лосано
С
Гомес-Санз
E
и др.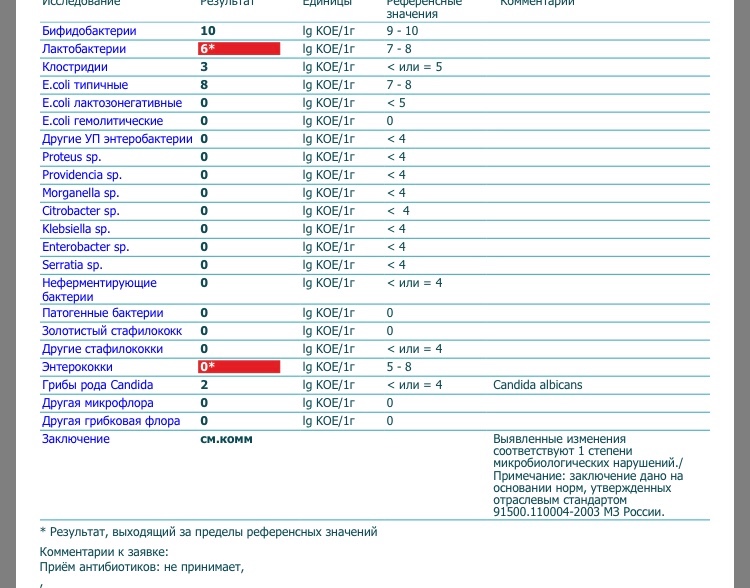
Обнаружение метициллин-чувствительных штаммов Staphylococcus aureus ST398 и ST133 в кишечной микробиоте здоровых людей в Испании
Микроб Экол
2013
66
105
11
Бхалла
А
Арон
DC
Донски
CJ
Staphylococcus aureus Колонизация кишечника связана с повышенной частотой S.aureus на коже госпитализированных пациентов
BMC Infect Dis
2007
7
105
Бьоркстен
Б
Сепп
Е
Julge
K
и др.Развитие аллергии и микрофлора кишечника в течение первого года жизни
J Аллергия Клин Иммунол
2001
108
516
20
Бордерон
JC
Лайоннет
С
Рондо
C
и др.Актуальные аспекты фекальной флоры новорожденных без антибиотикотерапии в течение первых 7 дней жизни: Enterobacteriaceae , энтерококки, стафилококки
Патол Биол
1996
44
416
22
Буржуа-Николаос
N
Люсет
JC
Добье
C
и др.
Колонизация влагалища матери штаммом Staphylococcus aureus и заражение новорожденного при родах
Педиатр Перинат Эп
2010
24
488
91
Чо
Я
Блазер
МДж
Микробиом человека: на стыке здоровья и болезни
Нат Рев Жене
2012
13
260
70
Институт клинических лабораторных стандартов
Стандарты эффективности для тестирования чувствительности к противомикробным препаратам: информационное дополнение Twenty two M100-S24
2014
Уэйн, Пенсильвания, США
КЛСИ
Кукарелла
С
Солано
С
Valle
J
и др.Bap, поверхностный белок Staphylococcus aureus , участвующий в формировании биопленки
J Бактериол
2001
183
2888
96
Дельгадо
С
Гарсия
P
Fernández
L
и др.
Характеристика штаммов Staphylococcus aureus , вызывающих мастит человека и крупного рогатого скота
FEMS Immunol Med Mic
2011
62
225
35
Деуренберг
РХ
Райндерс
МИ
Себастьян
S
и др.Staphylococcus aureus специфические для линии маркеры коллагеновый адгезин и токсин синдрома токсического шока 1 позволяют различать мультилокусные последовательности, типирующие клональные комплексы в пределах spa клональных комплексов
Диагн Микро Инфек Дис
2009
65
116
122
Домингес
E
Заразага
М
Торрес
С
Резистентность к антибиотикам Staphylococcus изолятов, полученных из образцов фекалий здоровых детей
Дж Клин Микробиол
2002
40
2638
41
Европейский комитет по определению чувствительности к противомикробным препаратам (EUCAST)
Таблицы точек останова для интерпретации значений MIC и диаметров зон Версия 4. 0 , январь 2014 г.
0 , январь 2014 г.
Европейское общество клинической микробиологии и инфекционных заболеваний (ESCMID)
Фернандес
Л
Ланга
С
Мартин
В
и др.Микробиота грудного молока: происхождение и потенциальная роль в здоровье и заболевании
Фармакол Рез
2013
69
1
10
Грис
Немецкая марка
Земзары
ТФ
Гибсон
КА
и др.Пилотное исследование для оценки частоты носительства и путей заражения Staphylococcus aureus здоровыми младенцами
Am J Борьба с инфекциями
2009
37
598
600
Харастани
ЧН
Арай
ГФ
Токаджян
СТ
Молекулярные характеристики Staphylococcus aureus , выделенного из крупной больницы в Ливане
Int J Infect Dis
2014
19
33
8
Хармсен
Д
Клаус
Н
Witte
W
и др.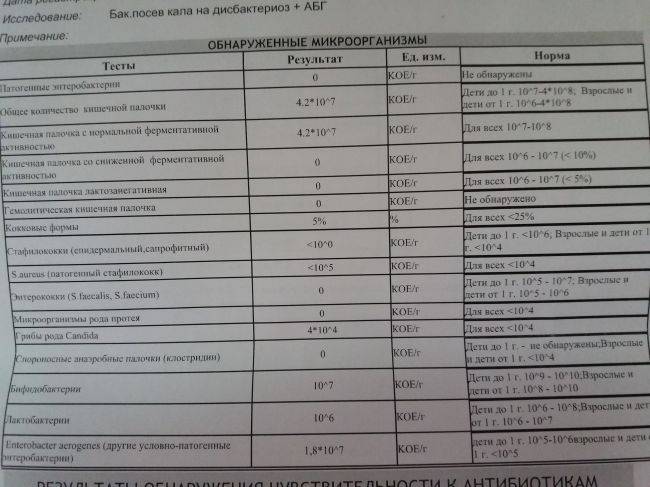
Типирование метициллин-резистентного Staphylococcus aureus в условиях университетской больницы с использованием нового программного обеспечения для spa повторное определение и управление базой данных
Дж Клин Микробиол
2003
41
5442
8
Охота
км
Преус
Дж
Nissan
C
и др.Олигосахариды грудного молока способствуют росту стафилококков
Appl Environ Microb
2012
78
4763
70
Ивасэ
Т
Уэхара
Д
Синдзи
H
и др.Staphylococcus epidermidis sp ингибирует Staphylococcus aureus образование биопленок и колонизацию носа
Природа
2010
465
346
9
Жарро
С
Мугель
С
Thioulouse
J
и др.Взаимосвязь между Staphylococcus aureus генетическими фоновыми факторами вирулентности, группами agr (аллелями) и заболеванием человека
Заразить Иммуном
2002
70
631
41
Джерниган
JA
Пуллен
АЛ
Цветы
L
и др.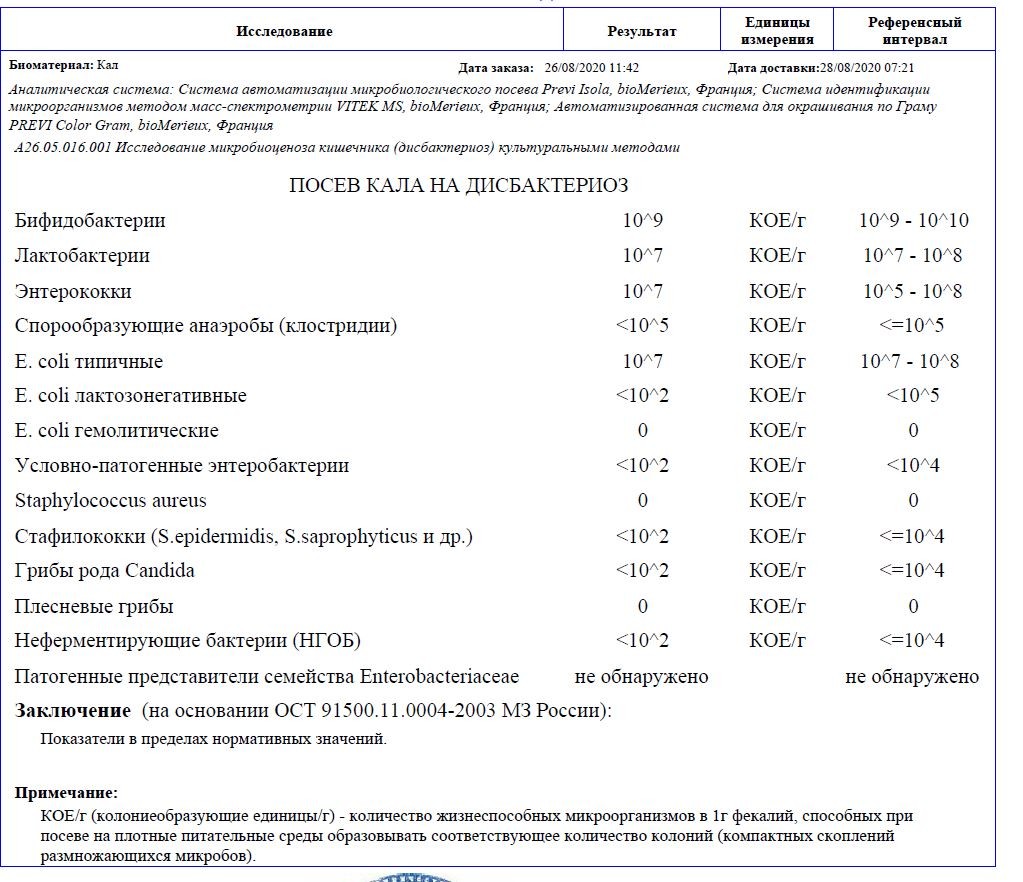
Распространенность и факторы риска колонизации метициллинрезистентным Staphylococcus aureus на момент госпитализации
Infect Cont Hosp Ep
2003
24
409
14
Хименес
E
Дельгадо
С
Мальдонадо
А
и др.Staphylococcus epidermidis : дифференциальный признак фекальной микробиоты младенцев, находящихся на грудном вскармливании
БМС Микробиол
2008
8
143
Хименес-Труке
N
Тедески
С
Saye
EJ
и др.Связь между матерью и новорожденным Staphylococcus aureus Колонизация
Педиатрия
2012
129
1252
9
Клотц
М
Циммерманн
С
Оппер
S
и др.Возможный риск повторной колонизации метициллинрезистентным штаммом Staphylococcus aureus (MRSA) при фекальной передаче
Int J Hyg Envir Heal
2005
208
401
5
Лешем
Е
Мааян-Мецгер
А
Рахав
G
и др.
Передача Staphylococcus aureus от матерей новорожденным
Педиатр Infect Dis J
2012
31
360
3
Линдберг
Е
Адлерберт
I
Hesselmar
B
и др.Высокая скорость переноса Staphylococcus aureus с кожи родителей на кишечную флору младенцев
Дж Клин Микробиол
2004
42
530
4
Лосано
С
Гомес-Санс
E
Бенито
D
и др.Staphylococcus aureus Назальное носительство, признаки вирулентности, механизмы устойчивости к антибиотикам и генетические линии у здоровых людей в Испании с обнаружением штаммов CC398 и CC97
Int J Med Microbiol
2011
301
500
5
Лунделл
AC
Адлерберт
Линдберг
E
и др.Повышенные уровни циркулирующего растворимого CD14, но не CD83, у младенцев связаны с ранней колонизацией кишечника Staphylococcus aureus
Клин Эксперт Аллергия
2007
37
62
71
Лунделл
AC
Хессельмар
Б
Nordström
I
и др.
Высокие уровни циркулирующего иммуноглобулина А у младенцев связаны с кишечной токсигенностью Staphylococcus aureus и меньшей частотой экземы
Клин Эксперт Аллергия
2009
39
662
70
Мартин
Р
Ланга
С
Reviriego
C
и др.Комменсальная микрофлора грудного молока: новые перспективы пищевой бактериотерапии и пробиотиков
Тренды Food Sci Tech
2004
15
121
7
Масюк
Х
Копрон
К
Grumann
D
и др.Ассоциация рецидивирующего фурункулеза с пантон-валентиновым лейкоцидином и генетическим фоном Staphylococcus aureus
Дж Клин Микробиол
2010
48
1527
35
Матуссек
А
Тайпаленсуу
Дж
Einemo
IM
и др.Передача Staphylococcus aureus от сотрудников родильного отделения новорожденным, выявленная при типировании spa
Am J Борьба с инфекциями
2007
35
122
5
Межеван
С
Жерве
А
Heininger
U
и др.
Молекулярная эпидемиология колонизации носа метициллин-чувствительными штаммами Staphylococcus aureus у швейцарских детей
Клин Микробиол Инфек
2010
16
1414
20
Мурчан
С
Кауфманн
ME
Deplano
A
и др.Гармонизация протоколов гель-электрофореза в пульсирующем поле для эпидемиологического типирования штаммов метициллин-резистентных штаммов Staphylococcus aureus: единый подход, разработанный на основе консенсуса в 10 европейских лабораториях, и его применение для отслеживания распространения родственных штаммов
Дж Клин Микробиол
2003
41
1574
85
Отто
М.
Staphylococcus epidermidis ; «случайный» патоген
Nat Rev Microbiol
2009
7
555
67
Парк
Б
Ивасэ
Т
Лю
ГГ
Интраназальное применение S.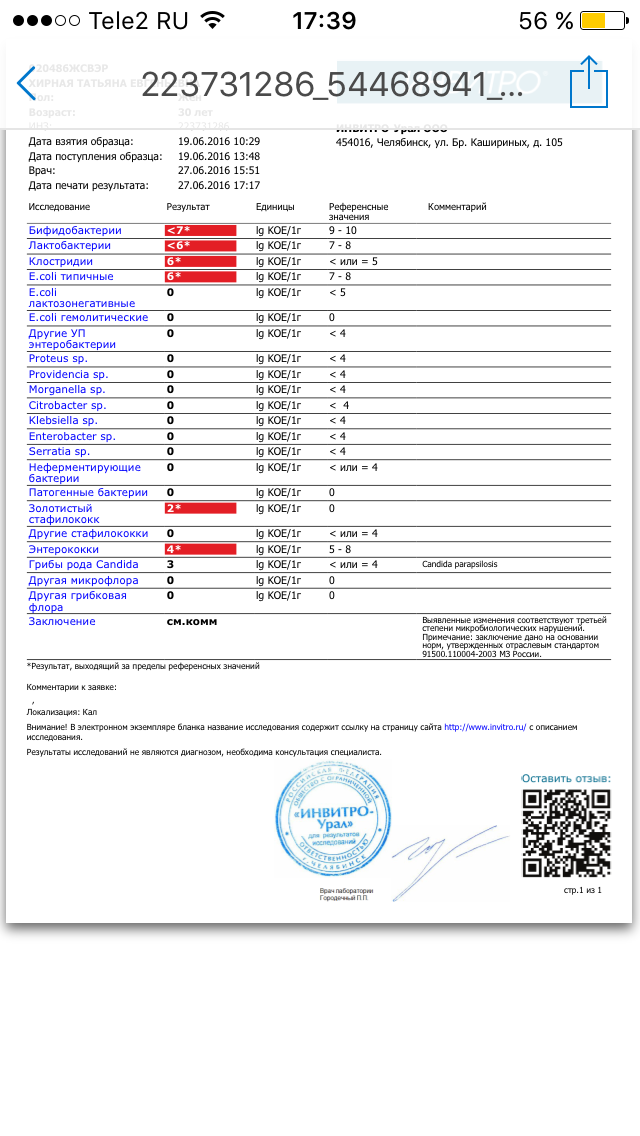 epidermidis предотвращает колонизацию метициллин-резистентным Staphylococcus aureus у мышей
epidermidis предотвращает колонизацию метициллин-резистентным Staphylococcus aureus у мышей
Плос Один
2011
6(10)
е25880
Перес
ПФ
Доре
J
Leclerc
M
и др.Бактериальный импринтинг неонатальной иммунной системы: уроки материнских клеток?
Педиатрия
2007
119
е724
32
Сабат
А
Косовска
К
Poulsen
K
и др.Две аллельные формы гена ауреолизина ( aur ) в пределах Staphylococcus aureus
Заразить Иммуном
2000
68
973
6
Шаумбург
Ф
Кёк
Р
Mellmann
A
и др.Динамика численности метициллинрезистентных изолятов Staphylococcus aureus в Германии за 6-летний период
Дж Клин Микробиол
2012
50
3186
92
Магазины
B
Матема
Б
Alcabes
P
и др.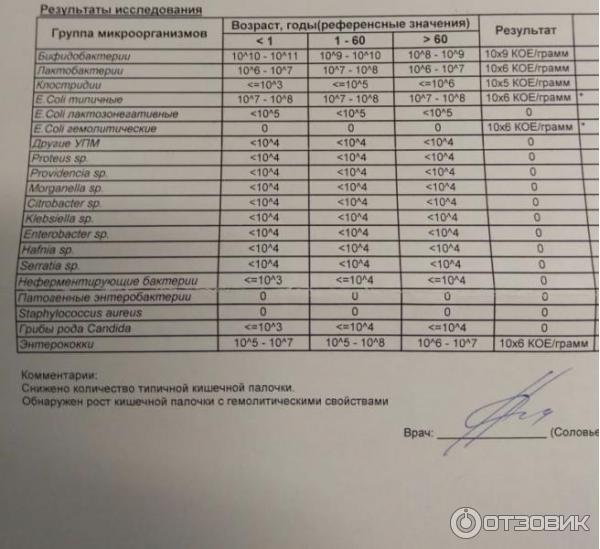
Распространенность групп специфичности agr среди штаммов Staphylococcus aureus , колонизирующих детей и их опекунов
Дж Клин Микробиол
2003
41
456
9
Сим
К
Пауэлл
Е
Shaw
AG
и др.Микробиота желудочно-кишечного тракта новорожденных: основа здоровья будущего?
Arch Dis Child-Fetal
2013
98
362
64
Удо
ЕЕ
Аль-Свейлх
N
Норонья
БК
Хромосомное расположение гена mupA в Staphylococcus aureus , экспрессирующих высокий уровень устойчивости к мупироцину
J Антимикроб Chemoth
2003
51
1283
6
Улеманн
AC
Отто
М
Lowy
FD
и др.Развитие резистентности к метициллину, связанной с населением и здравоохранением Staphylococcus aureus
Заразить Genet Evol
2014
21
563
74
Ван Белкум
А
Меллес
DC
Nouwen
J
и др.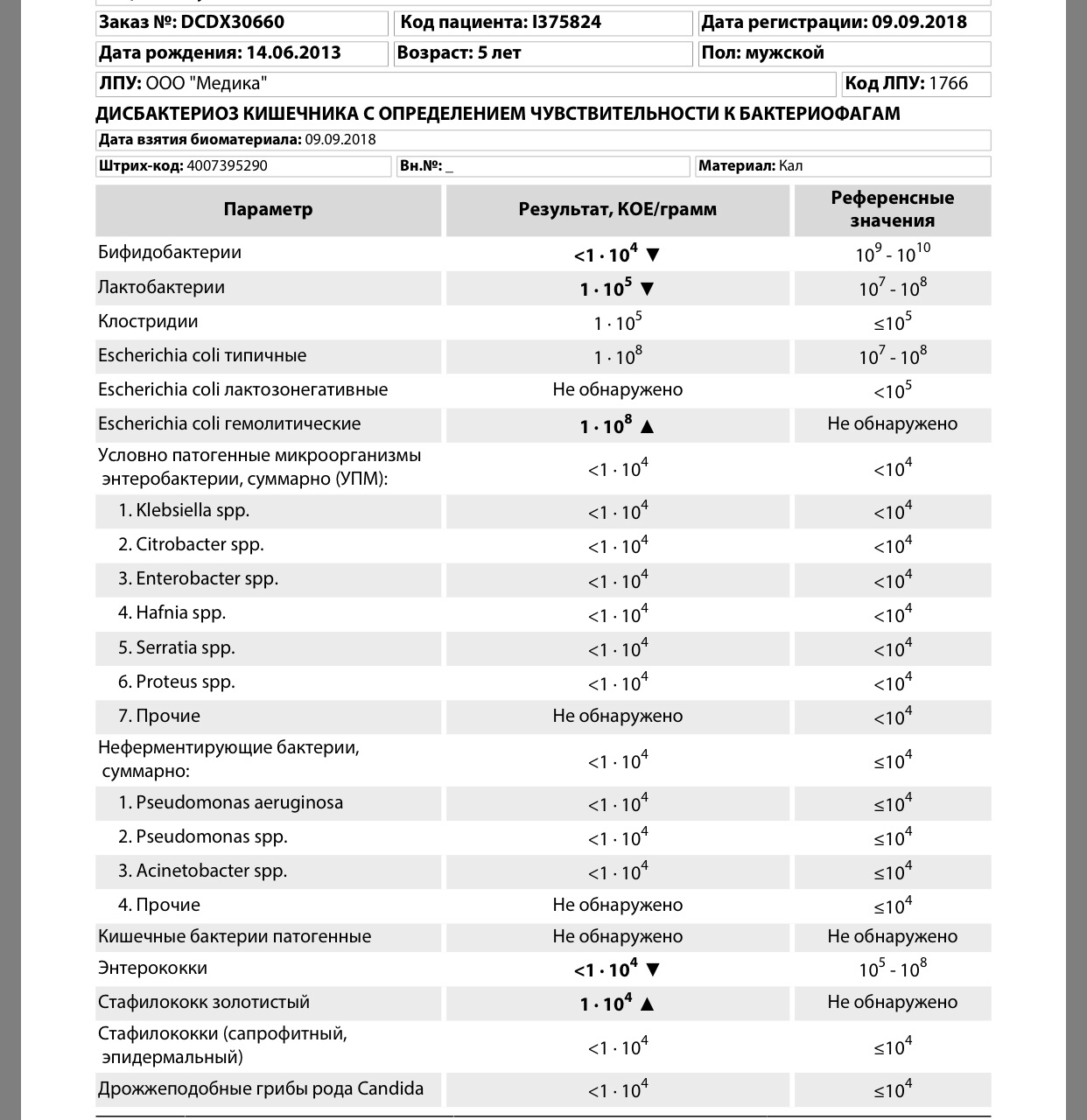
Коэволюционные аспекты колонизации человека и инфекции Staphylococcus aureus
Заразить Genet Evol
2009
9
32
47
Ван Вамель
WJ
Ройяккерс
SH
Ruyken
M
и др.Модуляторы врожденного иммунитета Стафилококковый ингибитор комплемента и белок, ингибирующий хемотаксис Staphylococcus aureus , расположены на бета-гемолизинпревращающих бактериофагах
J Бактериол
2006
188
1310
5
Ваутор
Е
Абади
Г
Pont
A
и др.Оценка наличия гена bap в изолятах Staphylococcus aureus , выделенных от человека и животных
Вет микробиол
2008
127
407
11
Витте
Вт
Стромменгер
Б
Stanek
C
и др.Метициллин-резистентный Staphylococcus aureus ST398 у людей и животных, Центральная Европа
Возникновение инфекции Dis
2007
13
255
8
Распространенность и молекулярная характеристика Staphylococcus aureus в образцах стула человека | Устойчивость к противомикробным препаратам и инфекционный контроль

Wertheim HF, Melles DC, Vos MC, van Leeuwen W, van Belkum A, Verbrugh HA, Nouwen JL.Роль назального носительства при инфекциях, вызванных золотистым стафилококком. Ланцет Infect Dis. 2005;5(12):751–62.
Артикул пабмед Google Scholar
Williams RE. Здоровое носительство золотистого стафилококка: его распространенность и значение. Bacteriol Rev. 1963; 27:56–71.
КАС пабмед ПабМед Центральный Google Scholar
Acton DS, Plat-Sinnige MJ, van Wamel W, de Groot N, van Belkum A.Кишечный носитель Staphylococcus aureus: как его частота соотносится с назальным носительством и каково его клиническое значение? Eur J Clin Microbiol Infect Dis. 2009;28(2):115–27.
КАС Статья пабмед Google Scholar
Wertheim HF, Verveer J, Boelens HA, van Belkum A, Verbrugh HA, Vos MC. Влияние лечения мупироцином на назальное, глоточное и промежностное носительство золотистого стафилококка у здоровых взрослых.Противомикробные агенты Chemother. 2005;49(4):1465–7.
Влияние лечения мупироцином на назальное, глоточное и промежностное носительство золотистого стафилококка у здоровых взрослых.Противомикробные агенты Chemother. 2005;49(4):1465–7.
КАС Статья пабмед ПабМед Центральный Google Scholar
Ридли М. Промежностное носительство Staph. Ауреус. Br Med J. 1959;1(5117):270–3.
КАС Статья пабмед ПабМед Центральный Google Scholar
Rimland D, Roberson B. Желудочно-кишечный носитель метициллин-резистентного золотистого стафилококка.Дж. Клин Микробиол. 1986; 24(1):137–8.
КАС пабмед ПабМед Центральный Google Scholar
Benito D, Lozano C, Gomez-Sanz E, Zarazaga M, Torres C. Обнаружение метициллин-чувствительных штаммов Staphylococcus aureus ST398 и ST133 в кишечной микробиоте здоровых людей в Испании. Микроб Экол. 2013;66(1):105–11.
2013;66(1):105–11.
КАС Статья пабмед Google Scholar
Герни Э.А., Ндао И.М., МакГи Дж.Э., Уорнер Б.Б., Тарр П.И., Фриц С.А., Бернхэм, Калифорния. Фекальное носительство метициллинрезистентного золотистого стафилококка и ванкомицинрезистентного энтерококка у здоровых детей. Противомикробные агенты Chemother. 2014;58(2):1261–2.
Артикул пабмед ПабМед Центральный Google Scholar
Накао А., Ито Т., Хань Х., Лу Ю.Дж., Хисата К., Цудживаки А., Мацунага Н., Комацу М., Хирамацу К., Симидзу Т. Кишечный носитель метициллин-резистентного золотистого стафилококка у носителей MRSA, госпитализированных в отделение реанимации новорожденных.Противомикробная защита от инфекций. 2014;3:14.
Артикул пабмед ПабМед Центральный Google Scholar
Бхалла А., Арон Д.С., Донски С. Дж. Колонизация кишечника золотистым стафилококком связана с повышенной частотой S. aureus на коже госпитализированных пациентов. BMC Infect Dis. 2007; 7:105.
Дж. Колонизация кишечника золотистым стафилококком связана с повышенной частотой S. aureus на коже госпитализированных пациентов. BMC Infect Dis. 2007; 7:105.
Артикул пабмед ПабМед Центральный Google Scholar
Бойс Дж. М., Хэвилл, Н. Л. Внутрибольничная антибиотикоассоциированная диарея, связанная с энтеротоксин-продуцирующими штаммами метициллин-резистентного золотистого стафилококка. Am J Гастроэнтерол. 2005; 100 (8): 1828–34.
Артикул пабмед Google Scholar
Нишикава М., Танака Т., Накашима К., Сенда К., Шибасаки М., Миура Х., Тамакоши А., Охта Т., Яги Т. Скрининг на носительство метициллин-резистентного золотистого стафилококка (MRSA) при поступлении в гериатрическую больницу .Арх Геронтол Гериатр. 2009;49(2):242–5.
Артикул пабмед Google Scholar
КЛСИ. Стандарты эффективности тестирования чувствительности к противомикробным препаратам: двадцать второе информационное приложение, том. В: 32: Институт клинических и лабораторных стандартов; 2012.
В: 32: Институт клинических и лабораторных стандартов; 2012.
Google Scholar
Босгельмез-Тиназ Г., Улусой С., Аридоган Б., Коскун-Ари Ф. Оценка различных методов определения устойчивости к оксациллину у Staphylococcus aureus и их клиническая лабораторная полезность.Eur J Clin Microbiol Infect Dis. 2006;25(6):410–2.
КАС Статья пабмед Google Scholar
Lina G, Piemont Y, Godail-Gamot F, Bes M, Peter MO, Gauduchon V, Vandenesch F, Etienne J. Участие пантон-валентин-продуцирующего лейкоцидина Staphylococcus aureus в первичных кожных инфекциях и пневмонии . Клин Инфекция Дис. 1999;29(5):1128–32.
КАС Статья пабмед Google Scholar
Гарсия-Альварес Л., Холден М.Т., Линдси Х., Уэбб К.Р., Браун Д.Ф., Карран М.Д., Уолпол Э., Брукс К., Пикард Д.Дж., Тил С. и др. Метициллин-резистентный золотистый стафилококк с новым гомологом mecA в популяциях человека и крупного рогатого скота в Великобритании и Дании: описательное исследование. Ланцет Infect Dis. 2011;11(8):595–603.
и др. Метициллин-резистентный золотистый стафилококк с новым гомологом mecA в популяциях человека и крупного рогатого скота в Великобритании и Дании: описательное исследование. Ланцет Infect Dis. 2011;11(8):595–603.
КАС Статья пабмед ПабМед Центральный Google Scholar
Lewallen S, Courtright P. Эпидемиология на практике: исследования случай-контроль.Общественное здоровье глаз. 1998;11(28):57–8.
КАС пабмед ПабМед Центральный Google Scholar
Магиоракос А.П., Шринивасан А., Кэри Р.Б., Кармели И., Фалагас М.Е., Гиске К.Г., Харбарт С., Хиндлер Дж.Ф., Калметер Г., Олссон-Лильеквист Б. и др. Бактерии с множественной лекарственной устойчивостью, широкой лекарственной устойчивостью и панлекарственной устойчивостью: предложение международного эксперта по временным стандартным определениям приобретенной устойчивости. клин. микробиол.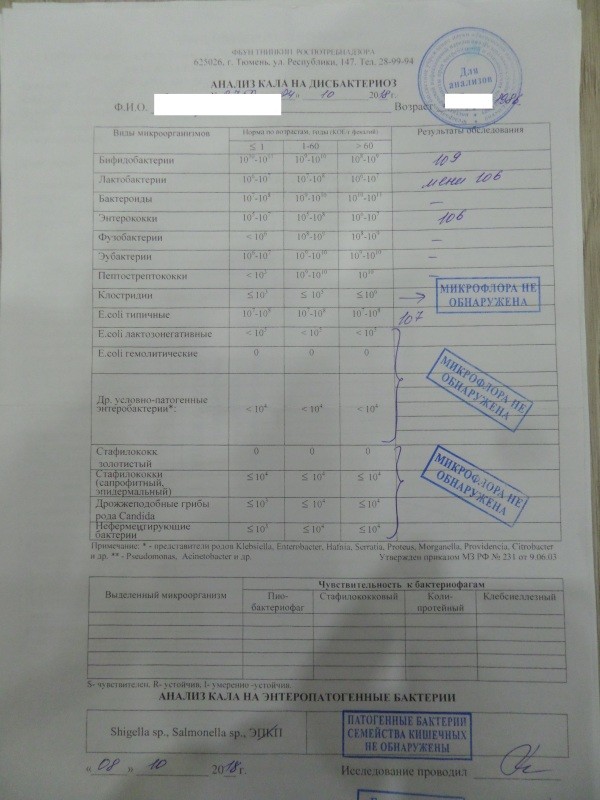 Заразить. 2012;18(3):268–81.
Заразить. 2012;18(3):268–81.
КАС Статья пабмед Google Scholar
Альтемайер В.А., Хаммель Р.П., Хаммель Р.П., Хилл Э.О. Стафилококковый энтероколит после антибактериальной терапии. Энн Сург. 1963; 157: 847–58.
КАС Статья пабмед ПабМед Центральный Google Scholar
Гриндайк Р.М., Константин Х.П., Магрудер Г.Б., Дин Д.К., Гарднер Д.Х., Морган Х.Р.Стафилококки в медицинском отделении, особенно фекальные носители. Ам Джей Клин Патол. 1958;30(4):318–22.
КАС Статья пабмед Google Scholar
Грюн Л. Исследования на кишечные стафилококки. Арч Хыг Бактериол. 1958;142(1):3–7.
КАС пабмед Google Scholar
Кавальканти С.М., Франка Э.Р., Кабрал К., Вилела М.А., Монтенегро Ф., Менезеш Д. , Медейрос А.С.Распространенность золотистого стафилококка, занесенного в отделения интенсивной терапии университетской больницы. Braz J Infect Dis. 2005;9(1):56–63.
, Медейрос А.С.Распространенность золотистого стафилококка, занесенного в отделения интенсивной терапии университетской больницы. Braz J Infect Dis. 2005;9(1):56–63.
Артикул пабмед Google Scholar
Эвейяр М., де Лассен А., Лансьен Э., Барно Г., Рикард Д.Д., Жоли-Гийу М.Л. Оценка стратегии скрининга множественных анатомических участков на наличие метициллин-резистентного золотистого стафилококка при поступлении в клиническую больницу. Infect Control Hosp Epidemiol off j Soc Hosp Epidemiol Am.2006;27(2):181–4.
Артикул Google Scholar
Roghmann MC, Gorman PH, Wallin MT, Kreisel K, Shurland S, Johnson JA. Колонизация золотистого стафилококка у людей, проживающих в сообществе, с дисфункцией спинного мозга. Arch Phys Med Rehabil. 2007;88(8):979–83.
Артикул пабмед Google Scholar
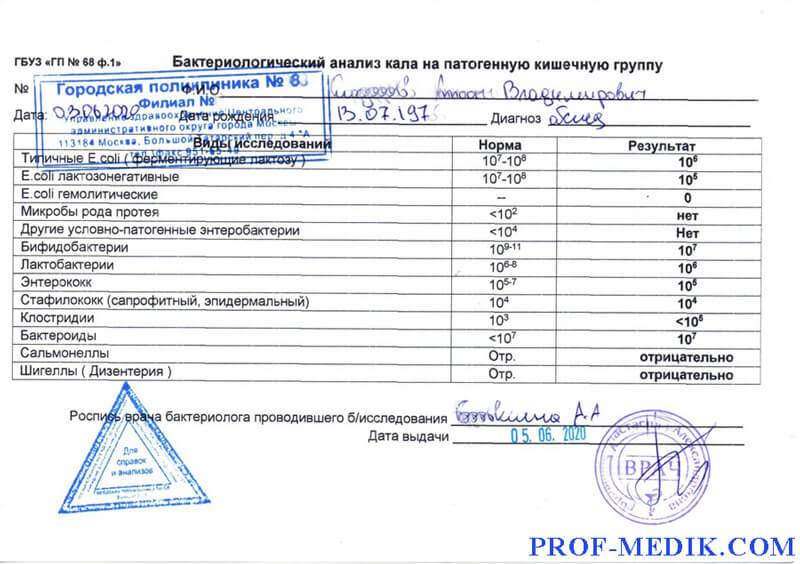
Грмек-Косник И., Ихан А., Дермота У., Ремс М., Косник М., Йорн Колмос Х.Оценка отдельных и объединенных культур мазков, различных сред, обогащения бульона и анатомических участков скрининга для обнаружения метициллин-резистентного золотистого стафилококка в клинических образцах. J hosp инфицируют. 2005;61(2):155–61.
КАС Статья пабмед Google Scholar
Vandenesch F, Naimi T, Enright MC, Lina G, Nimmo GR, Heffernan H, Liassine N, Bes M, Greenland T, Reverdy ME, et al. Внебольничный устойчивый к метициллину Staphylococcus aureus, несущий гены лейкоцидина Пантона-валентина: появление во всем мире.Эмердж Инфекция Дис. 2003;9(8):978–84.
Артикул пабмед ПабМед Центральный Google Scholar
McDougal LK, Steward CD, Killgore GE, Chaitram JM, McAllister SK, Tenover FC. Гель-электрофорез в импульсном поле для типирования устойчивых к оксациллину изолятов Staphylococcus aureus из США: создание национальной базы данных.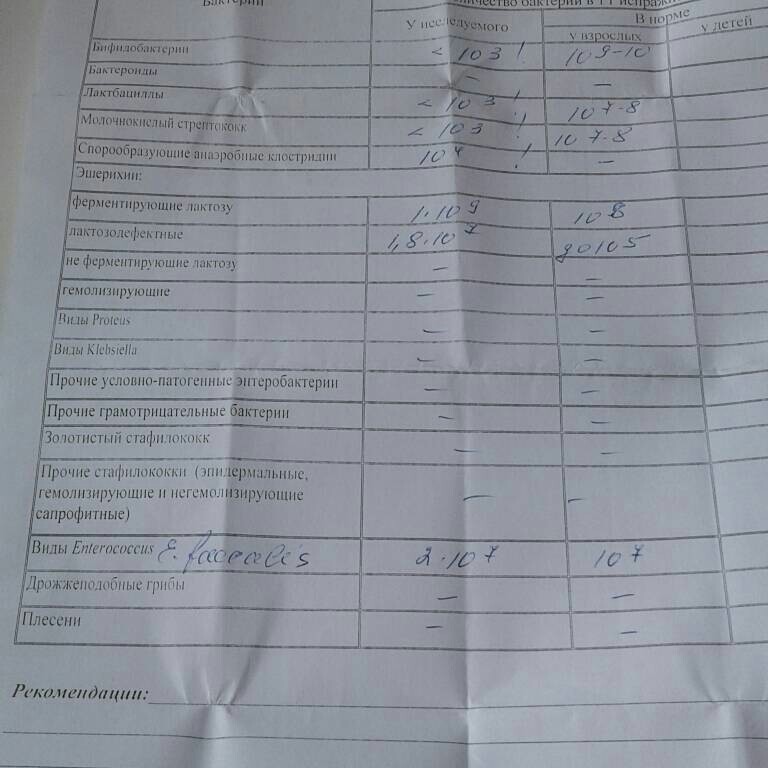 Дж. Клин Микробиол. 2003;41(11):5113–20.
Дж. Клин Микробиол. 2003;41(11):5113–20.
КАС Статья пабмед ПабМед Центральный Google Scholar
Сангвик М., Олсен Р.С., Олсен К., Симонсен Г.С., Фурберг А.С., Соллид Ю.Ю. Связанные с возрастом и полом типы Staphylococcus aureus spa, обнаруженные среди назальных носителей в общей популяции: исследование стафилококка и кожи Тромсо. Дж. Клин Микробиол. 2011;49(12):4213–8.
Артикул пабмед ПабМед Центральный Google Scholar
Кроссли К., Соллидей Дж. Сравнение ректальных мазков и посевов кала для выявления желудочно-кишечного носительства золотистого стафилококка.Дж. Клин Микробиол. 1980;11(4):433–4.
КАС пабмед ПабМед Центральный Google Scholar
Таллох Л.Г., Олдер В.Г., Гиллеспи В.А. Лечение хронического фурункулеза. Br Med J. 1960;2(5195):354–6.
КАС Статья пабмед ПабМед Центральный Google Scholar

Сквайер С., Риз Д.Д., Риса К.Дж., Санимени А., Вагенер М.М., Стаут Дж., Мудер Р.Р., Сингх Н.Ректальное носительство золотистого стафилококка и его ассоциация с инфекциями у больных хирургического отделения интенсивной терапии и отделения трансплантации печени. Infect control hosp epidemiol off j Soc Hosp Epidemiol Am. 2002;23(9):495–501.
Артикул Google Scholar
Solberg CO. Исследование носителей Staphylococcus aureus с особым вниманием к количественным бактериальным оценкам. Приложение Acta Medica Scand. 1965; 436:1–96.
КАС Google Scholar
Моди Л., Кауфман К.А., Донабедян С., Зервос М.Дж., Брэдли С.Ф. Эпидемиология колонизации Staphylococcus aureus у обитателей домов престарелых. Clin Infect Dis Off publ Заразить Dis Soc Am. 2008;46(9):1368–73.
Артикул Google Scholar
Simor AE, Ofner-Agostini M, Paton S, McGeer A, Loeb M, Bryce E, Mulvey M. Клинико-эпидемиологические особенности метициллин-резистентного золотистого стафилококка у пожилых госпитализированных пациентов.Infect control hosp epidemiol off j Soc Hosp Epidemiol Am. 2005;26(10):838–41.
Клинико-эпидемиологические особенности метициллин-резистентного золотистого стафилококка у пожилых госпитализированных пациентов.Infect control hosp epidemiol off j Soc Hosp Epidemiol Am. 2005;26(10):838–41.
Артикул Google Scholar
McKinnell JA, Huang SS, Eells SJ, Cui E, Miller LG. Количественная оценка влияния экстраназального тестирования участков тела на колонизацию метициллин-резистентным золотистым стафилококком во время госпитализации или поступления в отделение интенсивной терапии. Infect control hosp epidemiol off j Soc Hosp Epidemiol Am. 2013;34(2):161–70.
Артикул Google Scholar
Ли Д.С., Барлас Д., Райан Дж.Г., Уорд М.Ф., Сама А.Е., Фарбер Б.Ф. Метициллин-резистентный золотистый стафилококк и ванкомицин-резистентный энтерококк: распространенность и предикторы колонизации у пациентов, поступающих в отделение неотложной помощи из домов престарелых. J Am Geriatr Soc. 2002;50(8):1463–5.
J Am Geriatr Soc. 2002;50(8):1463–5.
Артикул пабмед Google Scholar
Trick WE, Weinstein RA, DeMarais PL, Kuehnert MJ, Tomaska W, Nathan C, Rice TW, McAllister SK, Carson LA, Jarvis WR.Колонизация резидентов лечебно-профилактических учреждений устойчивыми к противомикробным препаратам возбудителями. J Am Geriatr Soc. 2001;49(3):270–6.
КАС Статья пабмед Google Scholar
Hogardt M, Proba P, Mischler D, Cuny C, Kempf VA, Heuddorf U. Текущая распространенность полирезистентных микроорганизмов в учреждениях длительного ухода в округе Рейн-Майн, Германия, 2013. Euro Surveill . 2015;20(26).
Пападимитриу-Оливгерис М., Спилиопулу И., Христофиду М., Логотетис Д., Манолопулу П., Доду В., Флигу Ф., Марангос М., Анастассиу Э.Д.Совместная колонизация полирезистентными бактериями в двух греческих отделениях интенсивной терапии. Euro j clin microb infect dis off publ Euro Soc Clin Microbiol. 2015;34(10):1947–55.
Euro j clin microb infect dis off publ Euro Soc Clin Microbiol. 2015;34(10):1947–55.
КАС Статья Google Scholar
Золотистый стафилококк: проблема, возникающая при слишком долгом отсутствии пищи
Золотистый стафилококк является частой причиной болезней пищевого происхождения. Эта бактерия, которую обычно называют «золотистым стафилококком», вырабатывает яд/токсин, вызывающий заболевание.Staph aureus существует в воздухе, пыли, сточных водах, воде, молоке и продуктах питания или на пищевом оборудовании, поверхностях окружающей среды, людях и животных. Люди и животные являются основным путем переноса бактерий через окружающую среду. Staph aureus присутствует в носовых ходах, горле, на волосах и коже у 50% и более здоровых людей. Эта заболеваемость еще выше среди тех, кто находится рядом с больными людьми, например, среди медицинских работников, работающих в больницах. Хотя работники пищевой промышленности обычно являются основным источником заражения пищевых продуктов во время вспышек пищевых отравлений, оборудование и поверхности окружающей среды также могут быть источниками заражения золотистым стафилококком.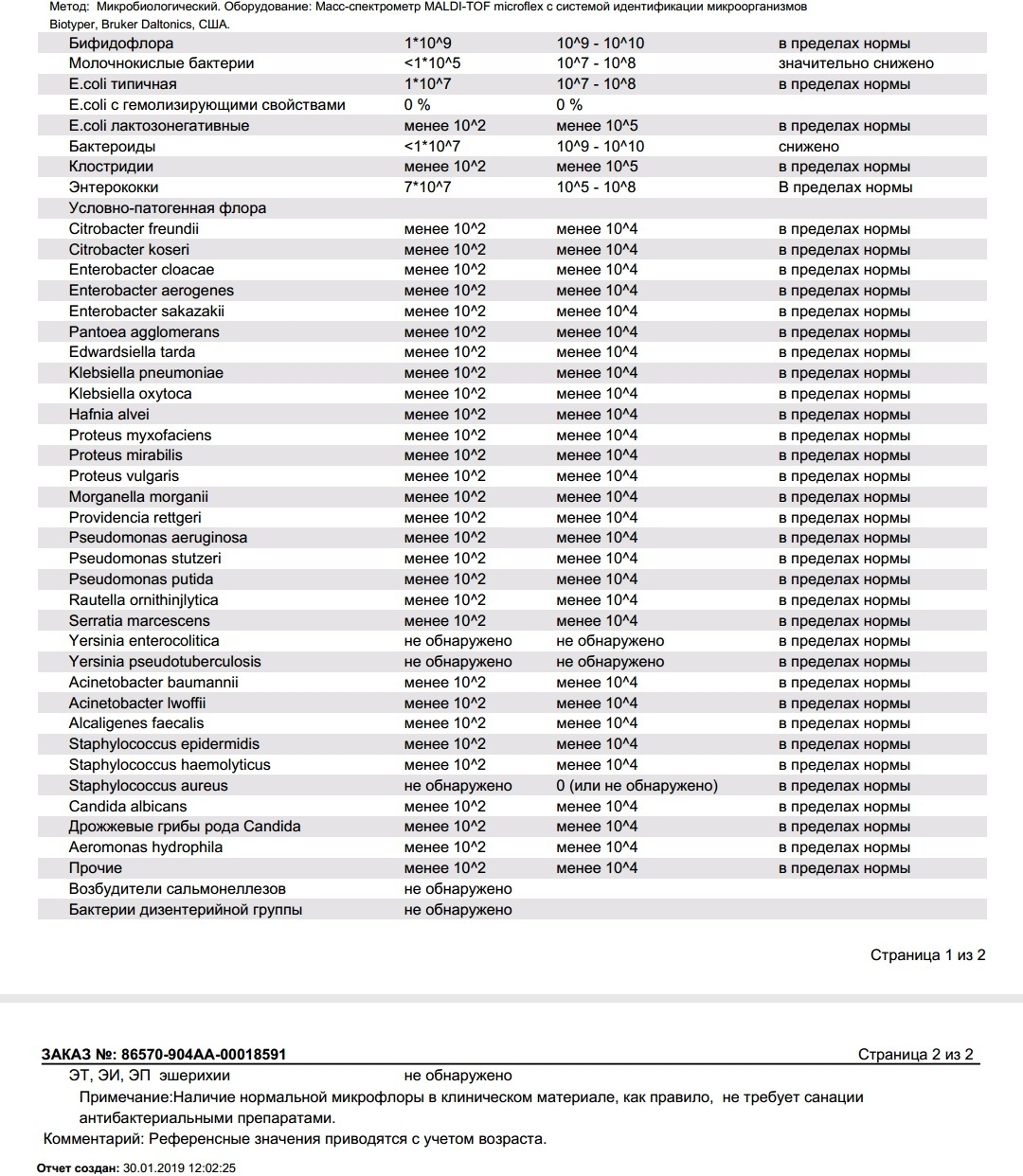
Люди могут заразиться болезнью, употребляя пищу, зараженную золотистым стафилококком, обычно из-за того, что пища не хранилась достаточно горячей или достаточно холодной. Бактерии стафилококка растут и размножаются при температуре от 50 до 120 градусов по Фаренгейту, причем наиболее быстрый рост происходит при температуре тела (около 98 градусов по Фаренгейту). Токсин, вырабатываемый стафилококковыми бактериями, очень термостабилен — его нелегко разрушить при нагревании при нормальной температуре приготовления. Сами бактерии могут погибнуть, но токсин останется.Повторное нагревание продуктов, загрязненных токсинами, даже при высоких температурах, НЕ сделает их безопасными для употребления! Вот почему важно избегать загрязнения продуктов питания во время приготовления и хранить продукты в холодильнике. Это особенно важно в отношении продуктов, оставшихся после одного приема пищи и планируемых к повторному использованию во время следующего приема пищи. Быстрое охлаждение и замораживание или выдерживание при температуре 140 градусов по Фаренгейту или выше, чтобы предотвратить рост бактерий, может помочь предотвратить образование токсина.
Симптомы стафилококкового пищевого отравления обычно проявляются в течение нескольких часов после употребления зараженной пищи. Заболевание, которое он вызывает, может быть серьезным, в зависимости от индивидуальной реакции на токсин, количества съеденной зараженной пищи, количества токсина в съеденной пище и общего состояния здоровья пострадавшего. Наиболее распространенными симптомами являются тошнота, рвота, спазмы в животе и прострация. Некоторые люди могут не всегда демонстрировать все симптомы, связанные с болезнью.В более тяжелых случаях могут возникать головная боль, мышечные спазмы, изменения артериального давления и частоты пульса. Восстановление обычно занимает два дня. Полное выздоровление нередко занимает три дня, а иногда и больше. Целью лечения является восполнение потерь жидкости, солей и минералов при рвоте или диарее.
Последствия для здоровья населения Точное число случаев золотистого стафилококка, которые происходят каждый год, трудно определить, потому что многие люди связывают свое заболевание с вирусом или гриппом. Местный департамент здравоохранения и Центры по контролю и профилактике заболеваний (CDC) не могут точно регистрировать количество случаев, если больной не обращается за медицинской помощью, что необычно для легких случаев. CDC подсчитал оценку числа случаев золотистого стафилококка на основе поправок на занижение данных, ошибочный диагноз и количество случаев, не вызванных зараженной пищей. По оценкам CDC, в этой стране ежегодно регистрируется более 240 000 случаев золотистого стафилококка, и что 100% случаев вызваны употреблением пищи, зараженной токсином, вырабатываемым бактериями.Около 1000 случаев будут достаточно серьезными, чтобы потребовать госпитализации; Каждый год возможно 6 смертей. Любой человек может заболеть, съев пищу, которая хранилась ненадлежащим образом. У некоторых будут более серьезные симптомы в зависимости от дозы токсина, которую они потребляют.
Местный департамент здравоохранения и Центры по контролю и профилактике заболеваний (CDC) не могут точно регистрировать количество случаев, если больной не обращается за медицинской помощью, что необычно для легких случаев. CDC подсчитал оценку числа случаев золотистого стафилококка на основе поправок на занижение данных, ошибочный диагноз и количество случаев, не вызванных зараженной пищей. По оценкам CDC, в этой стране ежегодно регистрируется более 240 000 случаев золотистого стафилококка, и что 100% случаев вызваны употреблением пищи, зараженной токсином, вырабатываемым бактериями.Около 1000 случаев будут достаточно серьезными, чтобы потребовать госпитализации; Каждый год возможно 6 смертей. Любой человек может заболеть, съев пищу, которая хранилась ненадлежащим образом. У некоторых будут более серьезные симптомы в зависимости от дозы токсина, которую они потребляют.
Золотистый стафилококк встречается в организме человека, и любой, кто прикасается к еде во время приготовления, может перенести некоторые бактерии в пищу. Если эта пища «скоропортящаяся» — то есть пища, которую следует хранить в холодильнике, чтобы предотвратить размножение бактерий при комнатной температуре, — тогда возможно пищевое отравление, если пища «неправильно переохлаждена».«Если зараженную пищу оставить более чем на два часа при комнатной температуре, золотистый стафилококк начнет расти и начнет вырабатывать токсин. Чем больше токсина в пище, тем тяжелее будет человек, который ест пищу, подвергшуюся воздействию температуры.
Если эта пища «скоропортящаяся» — то есть пища, которую следует хранить в холодильнике, чтобы предотвратить размножение бактерий при комнатной температуре, — тогда возможно пищевое отравление, если пища «неправильно переохлаждена».«Если зараженную пищу оставить более чем на два часа при комнатной температуре, золотистый стафилококк начнет расти и начнет вырабатывать токсин. Чем больше токсина в пище, тем тяжелее будет человек, который ест пищу, подвергшуюся воздействию температуры.
Пищевые продукты, которые часто вызывают стафилококковое пищевое отравление, включают мясо и мясные продукты; продукты из птицы и яиц; салаты, такие как яйцо, тунец, курица, картофель и макароны; хлебобулочные изделия, такие как пирожные с кремовой начинкой, кремовые пироги и шоколадные эклеры; начинки для сэндвичей; и молоко и молочные продукты.Staph aureus также может присутствовать в сыром молоке и сырых молочных продуктах. Стафилококк может вызывать мастит у молочных коров и другие инфекции у мясных животных.
1. Сохраняйте холодные блюда холодными, а горячие – горячими.
а. Держите продукты вне холодильника не более 2 часов, чтобы предотвратить рост золотистого стафилококка.
б. Проверьте температуру в холодильнике с помощью термометра, чтобы убедиться, что она находится в диапазоне от 35 до 40 градусов по Фаренгейту и достаточно холодна, чтобы продукты оставались безопасными.
в. Охладите продукты в неглубоких контейнерах в течение 2 часов после приготовления.
д. Размораживайте продукты в холодильнике, в микроволновой печи или под холодной проточной водой.
эл. Положите размораживающееся мясо или курицу в тарелку, чтобы сок не вытекал на еду внизу.
ф. Храните горячую пищу при температуре выше 135 градусов по Фаренгейту.
г. Берите только те продукты, которые можно хранить при безопасной температуре на пикнике, а не скоропортящиеся продукты, такие как пирожные с кремом.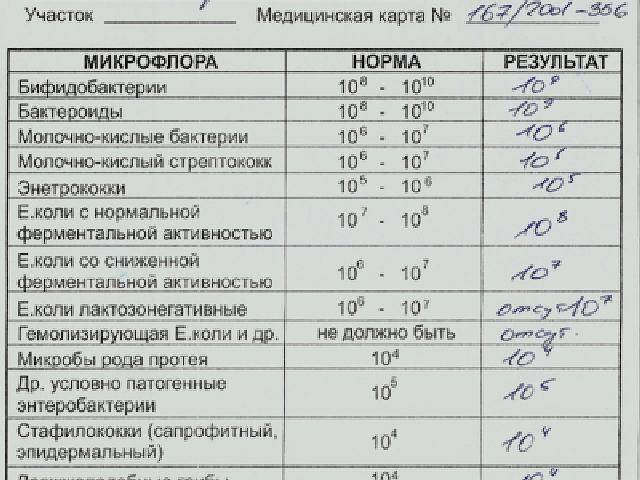
2. Мойте руки теплой водой с мылом до и после контакта с сырыми продуктами.
а. Сначала намочите руки.
б. Добавьте мыло на руки.
в. Трите обе стороны не менее 20 секунд.
д. Тщательно промойте.
эл. Высушите на воздухе или вытрите руки чистым полотенцем или бумажным полотенцем.
ф. Всегда мойте руки после посещения туалета, после смены подгузника ребенку, после прикосновения к домашним или другим животным, а также после чихания или кашля.
г. Надлежащим образом одевайте порезы и ожоги на руках в перчатках, прежде чем прикасаться к еде.
Каталожные номераЦентры по контролю и профилактике заболеваний. Стафилококковое пищевое отравление. cdc.gov/ncidod/dbmd/diseaseinfo/staphylococcus_food_g.htm. Доступ: 22 августа 2011 г.
Hillers, V.N., Medeiros, L.C., Kendall, P., Chen, G., & DiMascola, S. Поведение потребителей при обращении с пищевыми продуктами связано с профилактикой 13 болезней пищевого происхождения.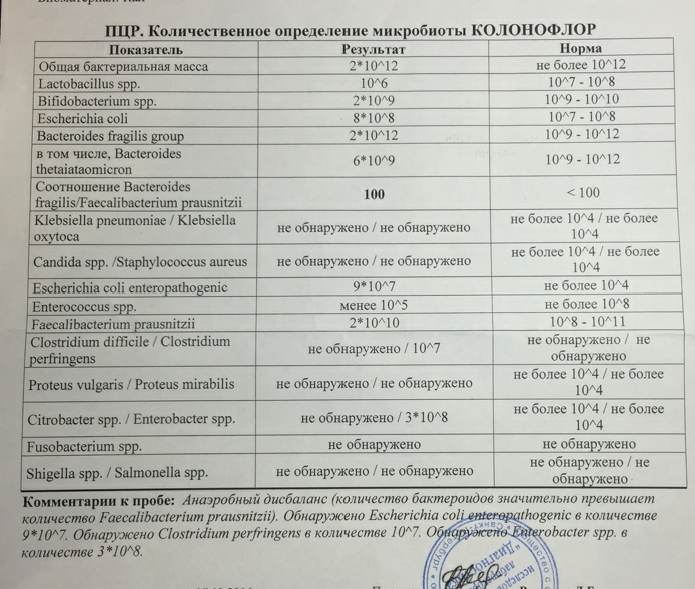 Журнал по защите пищевых продуктов 2003 г.; 66: 1893–1899.
Журнал по защите пищевых продуктов 2003 г.; 66: 1893–1899.
Скаллан, Э., Хекстра, Р.М., Ангуло, Ф.Дж., Такс, Р.В., Уиддоусон, М.А., Рой, С.Л., Джонс, Дж.Л., и Гриффин, П.М. Болезни пищевого происхождения, приобретенные в Соединенных Штатах, — основные патогены. Emerging Infectious Diseases 2011; 17:7–15.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Золотистый стафилококк . Книга о плохих ошибках. www.fda.gov/food/foodborneillnesscontaminants/causesofillnessbadbugbook/ucm070015.htm. Доступ: 22 августа 2011 г.
Для получения дополнительной информации о безопасности пищевых продуктов посетите сайт Foodsafety.osu.edu.
Бактериальное разнообразие мекония недоношенных новорожденных и эволюция их фекальной микробиоты в течение первого месяца жизни
Abstract
Формирование и смена бактериальных сообществ у младенцев может оказать глубокое влияние на их здоровье, но информации о составе микробиоты мекония и ее эволюции у госпитализированных недоношенных новорожденных недостаточно.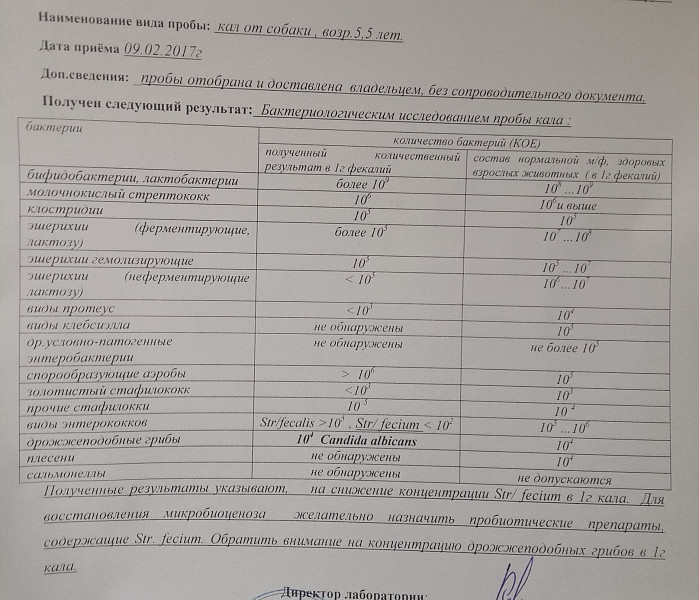 В этом контексте цель данной работы состояла в том, чтобы охарактеризовать микробиоту образцов мекония и фекалий, полученных в течение первых 3 недель жизни от 14 доноров, с использованием культуральных и молекулярных методов, включая DGGE и анализ чипа кишечного тракта человека (HITChip) 16S. ампликоны рРНК. Методы культивирования предлагают количественную оценку культивируемых бактерий и позволяют проводить дальнейшее изучение изолята, в то время как молекулярные методы предоставляют более подробную информацию о бактериальном разнообразии. Результаты культивирования и HITChip были очень похожи, но первые показали более низкую чувствительность.В профилях микробиоты были обнаружены межиндивидуальные различия, хотя микробиота мекония была своеобразной и отличной от таковой в образцах фекалий. Bacilli и другие Firmicutes были основными группами бактерий, обнаруженными в меконии, в то время как Proteobacteria преобладали в образцах фекалий. Культуральный метод показал, что Staphylococcus преобладали в меконии, а Enterococcus, вместе с грамотрицательными бактериями, такими как Escherichia coli , Escherichia fergusonii, Klebsiella pneumoniae и Serratia marces Кроме того, результаты Hitchip показали распространенность бактерий, связанные с Lactobacillus Plantarum и STREPTOCILLUS MITE в образцах Meconium, тогда как те, которые связаны с Enterococcus , Escherichia Coli , Klebsiella Pneumoniae и Yersinia , преобладающие в 3 рд неделя кал.
В этом контексте цель данной работы состояла в том, чтобы охарактеризовать микробиоту образцов мекония и фекалий, полученных в течение первых 3 недель жизни от 14 доноров, с использованием культуральных и молекулярных методов, включая DGGE и анализ чипа кишечного тракта человека (HITChip) 16S. ампликоны рРНК. Методы культивирования предлагают количественную оценку культивируемых бактерий и позволяют проводить дальнейшее изучение изолята, в то время как молекулярные методы предоставляют более подробную информацию о бактериальном разнообразии. Результаты культивирования и HITChip были очень похожи, но первые показали более низкую чувствительность.В профилях микробиоты были обнаружены межиндивидуальные различия, хотя микробиота мекония была своеобразной и отличной от таковой в образцах фекалий. Bacilli и другие Firmicutes были основными группами бактерий, обнаруженными в меконии, в то время как Proteobacteria преобладали в образцах фекалий. Культуральный метод показал, что Staphylococcus преобладали в меконии, а Enterococcus, вместе с грамотрицательными бактериями, такими как Escherichia coli , Escherichia fergusonii, Klebsiella pneumoniae и Serratia marces Кроме того, результаты Hitchip показали распространенность бактерий, связанные с Lactobacillus Plantarum и STREPTOCILLUS MITE в образцах Meconium, тогда как те, которые связаны с Enterococcus , Escherichia Coli , Klebsiella Pneumoniae и Yersinia , преобладающие в 3 рд неделя кал. Это исследование подчеркивает, что спонтанно выделяющийся меконий недоношенных новорожденных содержит специфическую микробиоту, которая отличается от таковой в фекалиях, полученных после первой недели жизни.Наши результаты показывают, что присутствие Serratia было тесно связано с более высокой степенью незрелости и другими параметрами, связанными с больницей, включая антибиотикотерапию и искусственную вентиляцию легких.
Это исследование подчеркивает, что спонтанно выделяющийся меконий недоношенных новорожденных содержит специфическую микробиоту, которая отличается от таковой в фекалиях, полученных после первой недели жизни.Наши результаты показывают, что присутствие Serratia было тесно связано с более высокой степенью незрелости и другими параметрами, связанными с больницей, включая антибиотикотерапию и искусственную вентиляцию легких.
Образец цитирования: Молес Л., Гомес М., Хейлиг Х., Бустос Г., Фуэнтес С., де Вос В. и др. (2013) Бактериальное разнообразие мекония недоношенных новорожденных и эволюция их фекальной микробиоты в течение первого месяца жизни. ПЛОС ОДИН 8(6): е66986. https://дои.org/10.1371/journal.pone.0066986
Редактор: Yolanda Sanz, Институт агрохимии и пищевых технологий, Испания
Поступила в редакцию: 5 декабря 2012 г.; Принято: 27 апреля 2013 г. ; Опубликовано: 28 июня 2013 г.
; Опубликовано: 28 июня 2013 г.
Авторское право: © 2013 Moles et al. Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Работа выполнена при поддержке проектов CSD2007-00063 (FUN-C-FOOD, Consolider-Ingenio 2010) и AGL2010-15420 Министерства науки и инноваций (Испания), проекта FIS PS09/00040 (Ministerio de Sanidad y Consumo, Испания) и неограниченная премия Спинозы WMdV Нидерландского фонда научных исследований. EJ получил исследовательскую стипендию FEMS для проведения анализа HITChip. Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Микробная колонизация желудочно-кишечного тракта младенцев является важным процессом в жизненном цикле человека, поскольку взаимодействие, установленное между микробиотой и хозяином, имеет важные последствия для здоровья и болезней человека [1]. Таким образом, приобретение и разнообразие кишечной микробиоты у доношенных новорожденных было предметом нескольких исследований [2], [3], [4], [5], [6], [7].Различные факторы, такие как способ родоразрешения, антибиотикотерапия, диета или окружающая среда, влияют на колонизацию кишечника младенцев [8], [9], хотя их реальный вклад в формирование микробиоты младенцев остается неясным. Кроме того, сильное влияние на этот процесс оказывают также гестационный возраст и масса тела при рождении. Предыдущие исследования по мониторингу бактериальных сообществ у недоношенных детей показали, что фекальная микробиота недоношенных детей отличается от таковой у доношенных детей [10], [11], [12], [13], [14], [15], [ 16], [17].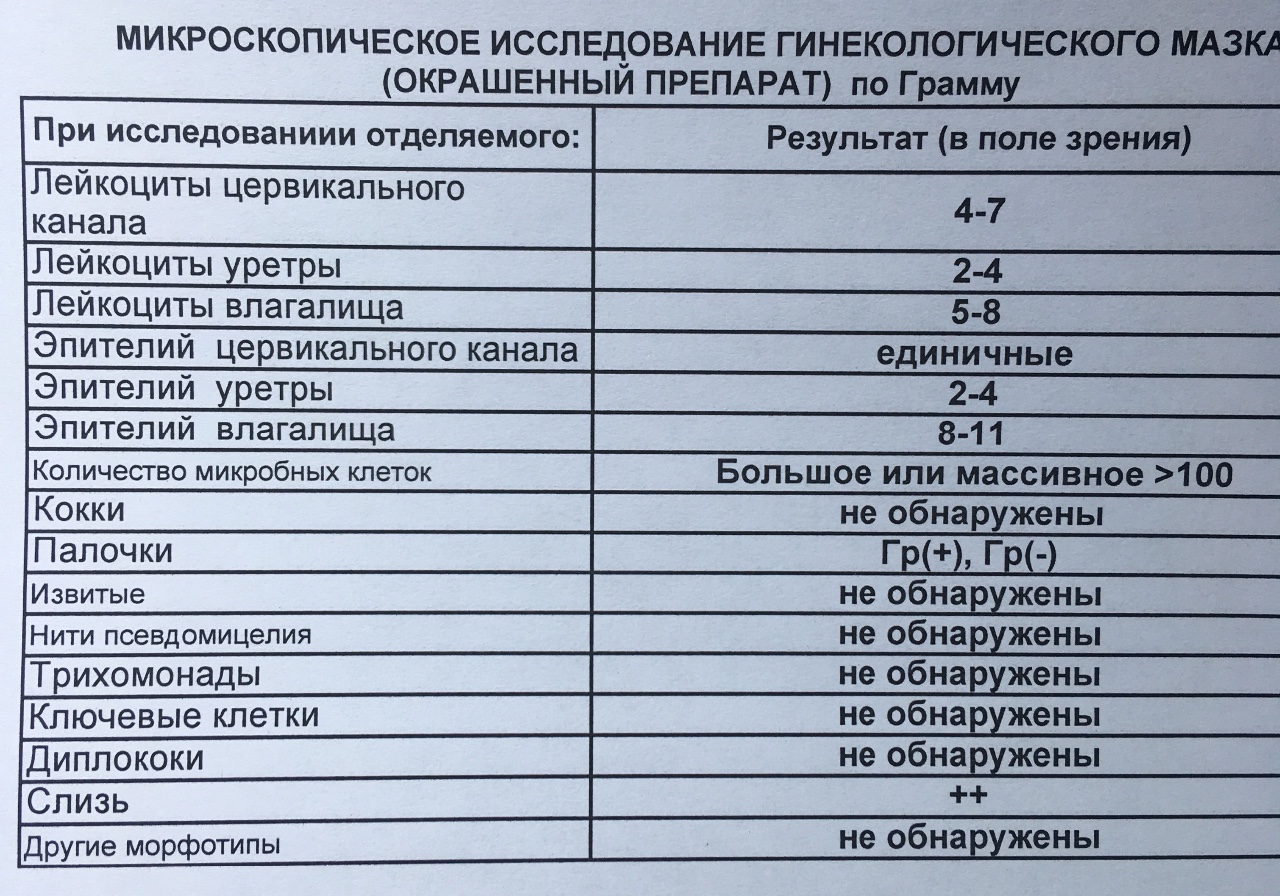 Фактически, картина колонизации кишечника недоношенных детей была описана как отсроченная и аберрантная [18]. Аномальная кишечная колонизация в течение первых недель жизни может изменить барьерные, пищевые и иммунологические функции микробиоты хозяина [19], [20] и, как следствие, повысить восприимчивость к заболеваниям [21], [22]. Недавнее исследование бактериального разнообразия мекония у шести недоношенных детей показало связь между низким бактериальным разнообразием мекония и высоким риском развития сепсиса [23].В целом исследования микробиоты кишечника недоношенных и доношенных детей были сосредоточены на фекалиях; напротив, информация об изменении бактериального состава с мекония на кал в течение первых недель жизни скудна, особенно в отношении недоношенных детей [12], [14]. Традиционно считалось, что кишечный тракт при рождении был стерильным и быстро заселялся микроорганизмами матери и окружающей среды. Однако некоторые исследования показывают, что на самом деле меконий здоровых хозяев не является стерильным и что колонизация кишечника может начаться еще до рождения [4], [14], [24], [25], [26], [27], [4].
Фактически, картина колонизации кишечника недоношенных детей была описана как отсроченная и аберрантная [18]. Аномальная кишечная колонизация в течение первых недель жизни может изменить барьерные, пищевые и иммунологические функции микробиоты хозяина [19], [20] и, как следствие, повысить восприимчивость к заболеваниям [21], [22]. Недавнее исследование бактериального разнообразия мекония у шести недоношенных детей показало связь между низким бактериальным разнообразием мекония и высоким риском развития сепсиса [23].В целом исследования микробиоты кишечника недоношенных и доношенных детей были сосредоточены на фекалиях; напротив, информация об изменении бактериального состава с мекония на кал в течение первых недель жизни скудна, особенно в отношении недоношенных детей [12], [14]. Традиционно считалось, что кишечный тракт при рождении был стерильным и быстро заселялся микроорганизмами матери и окружающей среды. Однако некоторые исследования показывают, что на самом деле меконий здоровых хозяев не является стерильным и что колонизация кишечника может начаться еще до рождения [4], [14], [24], [25], [26], [27], [4].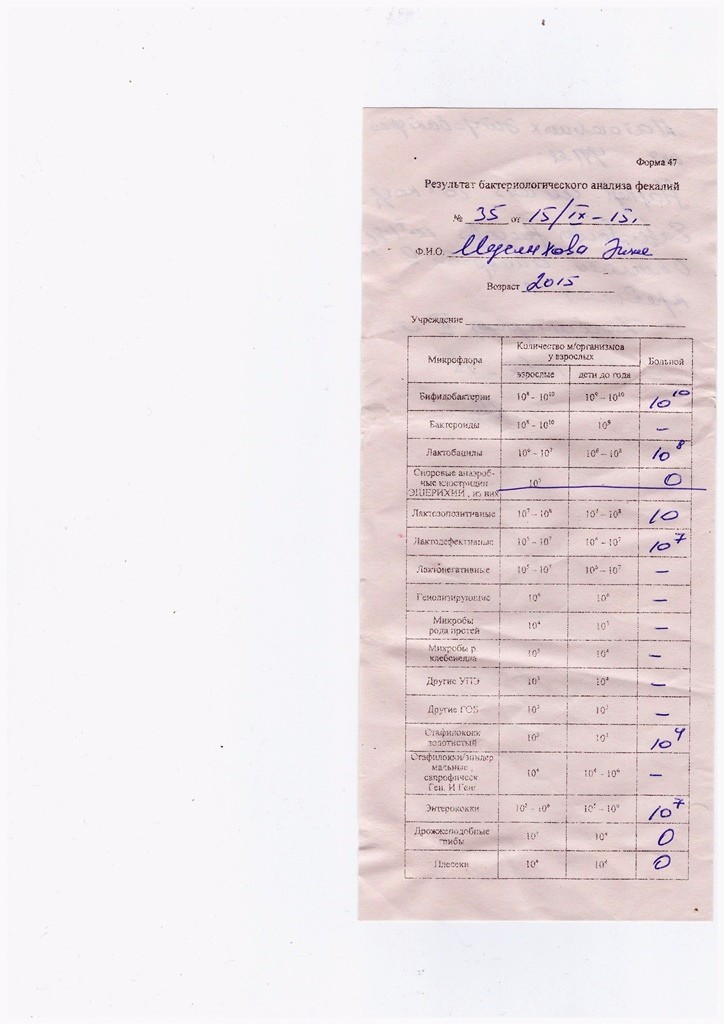 28].Таким образом, исследования бактериального разнообразия мекония могут дать новые сведения о первых колонизаторах кишечника и их потенциальной роли в здоровье и заболеваниях младенцев. В предыдущей работе нашей группы [27] культуральными методами был изучен микробный состав образцов мекония доношенных здоровых детей, рожденных в больнице Universitario 12 de Octubre. Идентификация изолятов из различных питательных сред показала, что преобладающими родами были энтерококки, за которыми следовали стафилококки, Escherichia coli и Enterobacter spp.Эта микробиота была заменена облигатными анаэробами, такими как бифидобактерии, которые стали преобладать в течение первой недели жизни (неопубликованные данные). В связи с этим целью настоящей работы был анализ бактериального разнообразия в меконии и фекалиях недоношенных детей первого месяца жизни. Для этой цели использовались культурально-зависимые и культурально-независимые методы, поскольку они часто обеспечивают взаимодополняющие представления о микробном разнообразии биологических образцов.
28].Таким образом, исследования бактериального разнообразия мекония могут дать новые сведения о первых колонизаторах кишечника и их потенциальной роли в здоровье и заболеваниях младенцев. В предыдущей работе нашей группы [27] культуральными методами был изучен микробный состав образцов мекония доношенных здоровых детей, рожденных в больнице Universitario 12 de Octubre. Идентификация изолятов из различных питательных сред показала, что преобладающими родами были энтерококки, за которыми следовали стафилококки, Escherichia coli и Enterobacter spp.Эта микробиота была заменена облигатными анаэробами, такими как бифидобактерии, которые стали преобладать в течение первой недели жизни (неопубликованные данные). В связи с этим целью настоящей работы был анализ бактериального разнообразия в меконии и фекалиях недоношенных детей первого месяца жизни. Для этой цели использовались культурально-зависимые и культурально-независимые методы, поскольку они часто обеспечивают взаимодополняющие представления о микробном разнообразии биологических образцов.
Материалы и методы
Пациенты и отбор проб
В проспективное исследование были включены 14 недоношенных детей, рожденных в больнице Universitario 12 de Octubre, Мадрид (Испания) (таблица 1).Перед включением каждого недоношенного ребенка было получено письменное информированное согласие родителей. Чтобы иметь право на участие, недоношенные должны родиться в гестационном возрасте ≤ 32 недель и/или с массой тела при рождении ≤ 1200 г и без пороков развития или метаболических заболеваний. Соответствующие клинические данные, зарегистрированные для каждого младенца, такие как продолжительность антибиотикотерапии, парентеральное питание, назогастральное кормление, механическая вентиляция легких, пребывание в больнице и тип вскармливания, описаны в таблице 2. Всех младенцев кормили грудным молоком (донорским молоком и/или их молоком). молоко собственной матери) и, иногда, смесью для недоношенных.
Медицинским персоналом отделения неонатологии стационара впервые собраны образцы спонтанно эвакуированного мекония и кала.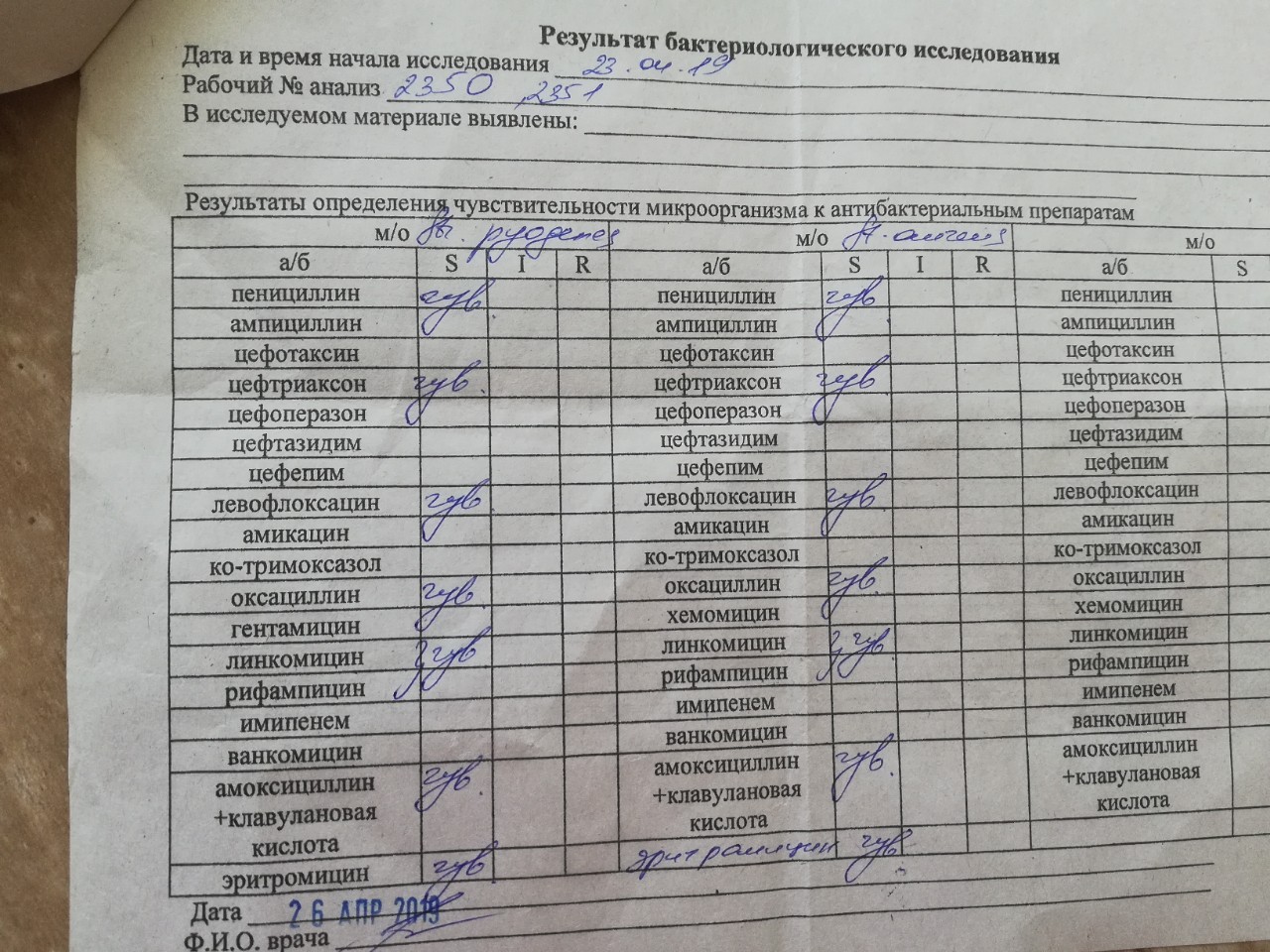 Образцы кала собирали еженедельно с подгузников младенцев во время их пребывания в отделении интенсивной терапии новорожденных (ОИТН). Все образцы хранились при температуре -20°С до проведения анализа. Неиспользованный подгузник помещали внутрь одного из инкубаторов для использования в качестве контроля.
Образцы кала собирали еженедельно с подгузников младенцев во время их пребывания в отделении интенсивной терапии новорожденных (ОИТН). Все образцы хранились при температуре -20°С до проведения анализа. Неиспользованный подгузник помещали внутрь одного из инкубаторов для использования в качестве контроля.
Заявление об этике
Комитет по этике клинических исследований клиники Сан-Карлос в Мадриде одобрил все протоколы исследований (10/017-E).Образцы и клиническая информация были получены после информированного письменного согласия законных опекунов младенцев, участвующих в исследовании.
Культуральный анализ образцов
Адекватные разведения образцов мекония и стула были нанесены на Man, Rogosa и Sharpe (MRS; Oxoid, Бейзингсток, Великобритания) и MRS с добавлением L-цистеина (0,5 г/л) (Sigma, Сент-Луис, США) (MRScys). для выделения молочнокислых бактерий, MacConkey (MCK; BioMérieux, Marcy l’Etoile, France) для выделения Enterobacteriaceae , Baird Parker (BP, BioMérieux) для выделения стафилококков, Sabouraud Dextrose Chloramphenicol (SDC, BioMérieux) для выделения дрожжи и Brain Heart Infusion (BHI, Oxoid), Wilkins-Chalgren (WC, Oxoid) и колумбийский агар с надиликсовой кислотой (CNA, BioMérieux) в качестве общих сред для выделения других групп бактерий. Планшеты инкубировали в аэробных условиях при 37°C в течение до 48 ч, за исключением планшетов SDC, которые инкубировали при 32°C в течение 96 ч, и планшетов WC и MRScys, которые инкубировали в анаэробных условиях (85% азота, 10% водорода, 5% углекислого газа) на анаэробной рабочей станции (Mini-MACS Don Whitley Scientific Limited, Шипли, Великобритания) при 37°C в течение 48 часов. Количество бактерий регистрировали как колониеобразующие единицы (КОЕ)/г мекония или фекалий и преобразовывали в значения log 10 перед статистическим анализом.
Планшеты инкубировали в аэробных условиях при 37°C в течение до 48 ч, за исключением планшетов SDC, которые инкубировали при 32°C в течение 96 ч, и планшетов WC и MRScys, которые инкубировали в анаэробных условиях (85% азота, 10% водорода, 5% углекислого газа) на анаэробной рабочей станции (Mini-MACS Don Whitley Scientific Limited, Шипли, Великобритания) при 37°C в течение 48 часов. Количество бактерий регистрировали как колониеобразующие единицы (КОЕ)/г мекония или фекалий и преобразовывали в значения log 10 перед статистическим анализом.
Генотипирование и идентификация бактерий
После подсчета бактерий было отобрано около 670 изолятов, в том числе по крайней мере по одному представителю каждого морфологического типа колоний. Эти изоляты выращивали в бульоне BHI или MRS и хранили при -80°C в присутствии глицерина (30% по объему). Изоляты анализировали с помощью оптической микроскопии для определения морфологии клеток и реакции окрашивания по Граму, а также тестировали на активность оксидазы, каталазы и коагулазы. Впоследствии они были отправлены на анализ полимеразной цепной реакции (ПЦР) случайной амплификации полиморфной ДНК (RAPD) для удаления дубликатов изолятов из одного и того же образца.Профили RAPD получали с использованием праймера OPL5 (5′-ACGCAGGCAC-3′) [29]. Компьютерный анализ выполняли с помощью программного обеспечения InfoQuest FP (Bio-Rad Laboratories, Inc., Hercules, CA). Кластерный анализ профилей RAPD-паттернов проводили с использованием метода UPGMA, основанного на коэффициенте сходства Дайса.
Впоследствии они были отправлены на анализ полимеразной цепной реакции (ПЦР) случайной амплификации полиморфной ДНК (RAPD) для удаления дубликатов изолятов из одного и того же образца.Профили RAPD получали с использованием праймера OPL5 (5′-ACGCAGGCAC-3′) [29]. Компьютерный анализ выполняли с помощью программного обеспечения InfoQuest FP (Bio-Rad Laboratories, Inc., Hercules, CA). Кластерный анализ профилей RAPD-паттернов проводили с использованием метода UPGMA, основанного на коэффициенте сходства Дайса.
Те изоляты, которые демонстрировали идентичный профиль RAPD и были получены из одного и того же образца, были идентифицированы с помощью видоспецифичной ПЦР или ПЦР-секвенирования 16S рРНК. Первоначально изоляты, которые на основании предварительных тестов, казалось, принадлежали к роду Staphylococcus , были идентифицированы как Staphylococcus epidermidis , Staphylococcus aureus или Staphylococcus hominis с помощью метода мультиплексной ПЦР, основанного на ДНК dna.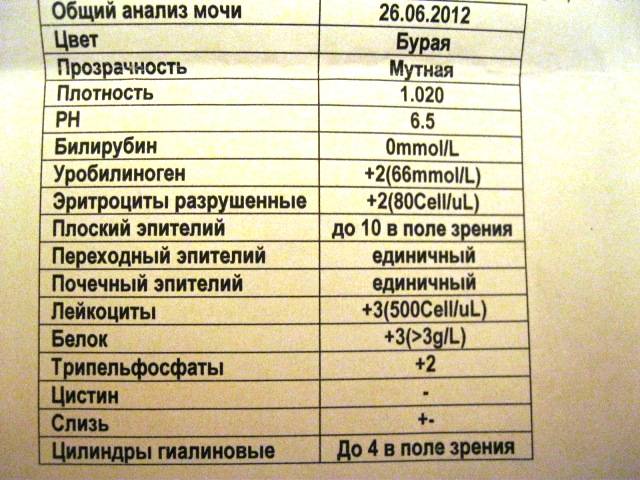 гены с праймерами J-StGen (5′-TGGCCAAAAGAGACTATTATGA-3′), J-StEpi (5′-CCACCAAAGCCTTGACTT-3′), JStAur (5′-GGATCTCTTTGTCTGCCG-3′) и JStHom (5′-TTGACCACTACCCTCACAC-3′) [30].
гены с праймерами J-StGen (5′-TGGCCAAAAGAGACTATTATGA-3′), J-StEpi (5′-CCACCAAAGCCTTGACTT-3′), JStAur (5′-GGATCTCTTTGTCTGCCG-3′) и JStHom (5′-TTGACCACTACCCTCACAC-3′) [30].
С другой стороны, большинство изолятов, которые, по-видимому, принадлежали к роду Enterococcus , были идентифицированы с помощью ПЦР видоспецифического обнаружения генов энтерококков ddl , кодирующих D-аланин: D-аланинлигазы, в соответствии с описанным протоколом. Дутка-Мален и соавт. [31]. Для этого использовали четыре праймера: E1 (5′-TCAAGTACAGTTAGTCTT-3′), E2 (5′-ACGATTCAAAGCTAACTG-3′), F1 (5′-GCAAGGCTTCTTAGAGA-3′) и F2 (5′-CATCGTGTAAGCTAACTTC-3). ′). Первая пара (E1 и E2) специфически выявляет штаммов Enterococcus faecium , тогда как вторая (F1 и F2) специфична для Enterococcus faecalis .
Идентификацию других видов бактерий проводили с помощью ПЦР-секвенирования 16S рРНК (ABI Prism 3730, Applied Biosystems) с использованием праймеров plb16 (5′-AGAGTTTGATCCTGGCTCAG-3′) и mlb16 (5′-GGCTGCTGGCACGTAGTTAG-3′) [32]. Полученные последовательности со средним размером примерно 550 п.н. использовали для поиска последовательностей, депонированных в базе данных EMBL, с использованием алгоритма BLAST, и идентичность изолятов определяли на основе наивысших баллов (>98%).
Полученные последовательности со средним размером примерно 550 п.н. использовали для поиска последовательностей, депонированных в базе данных EMBL, с использованием алгоритма BLAST, и идентичность изолятов определяли на основе наивысших баллов (>98%).
Экстракция ДНК из мекония и фекалий
Образцы размораживали при комнатной температуре и экстрагировали ДНК из 0.1 г мекония или фекалий, предварительно ресуспендированных в 0,5 мл буфера для экстракции (200 мМ Трис-HCl, pH 7,5, 0,5% SDS, 25 мМ ЭДТА, 250 мМ NaCl, 20 мг/мл лизоцима, 5 мкг/мл лизостафина) и 0,3 мл 3 М ацетата натрия. Затем был проведен механический лизис путем трехкратного биения шариками циркония/кремнезема диаметром 0,1 мм (Sigma) с использованием разрушителя FastPrep (QBioGene, Ирвин, Калифорния, США) при скорости 6,0 м/с в течение 30 с. Раствор лизата обрабатывали 0,1 мг/мл протеиназы К (Sigma) и инкубировали 30 мин при 37°С.После инкубации к лизату добавляли 0,1 мл 1,5 М NaCl и перемешивали. После инкубации в течение 5 мин при комнатной температуре смесь центрифугировали при 16 000 × g для осаждения нерастворимого клеточного дебриса. Супернатант переносили в новую пробирку и дважды экстрагировали равным объемом смеси фенол/хлороформ/изоамиловый спирт (25∶24:1) (Sigma). ДНК осаждали добавлением 0,6 объема изопропанола (Sigma) и инкубацией при -20°С в течение 1 часа. ДНК осаждали, промывали 70% этанолом, сушили на воздухе и, наконец, ресуспендировали в ТЕ-буфере.Выход ДНК измеряли с использованием УФ-спектрофотометра NanoDrop® ND-1000 (Nano-Drop Technologies, Wilmington, DE).
Супернатант переносили в новую пробирку и дважды экстрагировали равным объемом смеси фенол/хлороформ/изоамиловый спирт (25∶24:1) (Sigma). ДНК осаждали добавлением 0,6 объема изопропанола (Sigma) и инкубацией при -20°С в течение 1 часа. ДНК осаждали, промывали 70% этанолом, сушили на воздухе и, наконец, ресуспендировали в ТЕ-буфере.Выход ДНК измеряли с использованием УФ-спектрофотометра NanoDrop® ND-1000 (Nano-Drop Technologies, Wilmington, DE).
ПЦР-амплификация и денатурирующий градиентный гель-электрофорез (PCR-DGGE)
DGGE ПЦР-амплифицированных фрагментов гена 16 s рРНК использовали для первоначального сравнения общего бактериального разнообразия в меконии и фекалиях (3 рд неделя) у 5 младенцев. С этой целью праймеры U968-GC-f (5′-CGCCCGGGGCGCGCCCCGGGCGGGGCGGGGGCACGGGGGGAACGCGAAGAACCTTAC-3′) и L1401-r (5′-CGGTGTGTACAAGACCC-3′) [33], [34] использовали для амплификации областей V6-V8 Ген 16S рРНК.Затем ампликоны разделяли методом DGGE [35] с использованием системы DCode (Bio-Rad Laboratories).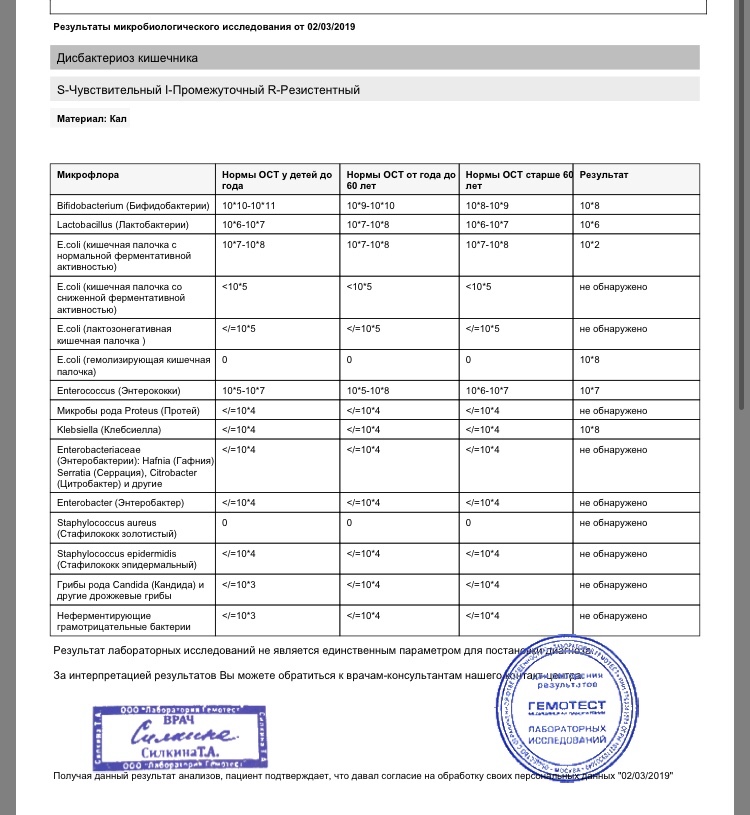 Профили DGGE были нормализованы в цифровом виде путем сравнения со стандартным образцом с использованием программного обеспечения InfoQuest FP (Bio-Rad Laboratories). Кластерный анализ профилей DGGE был выполнен с использованием метода Neighbor Joining на основе коэффициента сходства DICE.
Профили DGGE были нормализованы в цифровом виде путем сравнения со стандартным образцом с использованием программного обеспечения InfoQuest FP (Bio-Rad Laboratories). Кластерный анализ профилей DGGE был выполнен с использованием метода Neighbor Joining на основе коэффициента сходства DICE.
Анализ чипа желудочно-кишечного тракта человека (HITChip)
Микроматрица HITChip состоит из более чем 4800 олигонуклеотидных зондов, нацеленных на гипервариабельные области V1 и V6 гена 16S рРНК из 1132 филотипов, нанесенных дупло на специальные матрицы формата 8×15 К (Agilent Technologies, Пало-Альто, Калифорния, США).Зонды массива были организованы на основе их последовательностей 16S рРНК на трех уровнях филогенеза, как описано ранее [36]. Интенсивность сигнала HITChip была проанализирована с использованием следующих уровней филогенетического назначения: 1) уровень типа со спецификацией от Firmicutes до кластеров Clostridium и других классов, в результате чего всего было создано 23 группы; 2) родоподобный уровень, включающий 131 группу последовательностей с ≥90% идентичностью последовательностей, и 3) филотипический (видоподобный) уровень с 1038 различными филотипами с ≥98% сходством последовательностей с культивируемыми видами или клонами, соответствующими некультивируемым микроорганизмам. .Таксоны на уровне рода с идентичностью последовательностей ≥90%, распределенные по нескольким родам, обозначаются как « et rel ».
.Таксоны на уровне рода с идентичностью последовательностей ≥90%, распределенные по нескольким родам, обозначаются как « et rel ».
Все этапы анализа микрочипов HITChip, включая ПЦР-амплификацию генов 16S рРНК, продукцию и мечение РНК, гибридизацию и извлечение данных, выполняли в основном так, как описано Rajilic-Stojanovic et al. [34]. Вкратце, полноразмерный ген 16S рРНК амплифицировали с использованием праймеров T7prom-Bact-27-for (5′-TGAATTGTAATACGACTCACTATAGGGGTTTGATCCTGGCTCAG-3′) и Uni-1492-rev (5′-CGGCTACCTTGTTACGAC-3′), что обеспечивает введение Последовательность промотора Т7 на 5′-конце ампликона гена рРНК.Затем продукты ПЦР очищали с использованием набора High Pure PCR Product Purification (Roche, Мангейм, Германия) в соответствии с инструкциями производителя. In vitro транскрипцию генов 16S рРНК, несущих промотор Т7, выполняли с использованием системы Riboprobe (Promega, Мэдисон, Висконсин, США), в то время как аминоаллилмодифицированные нуклеотиды связывали с CyDye с использованием реактивного красителя после мечения (Amersham Biosciences).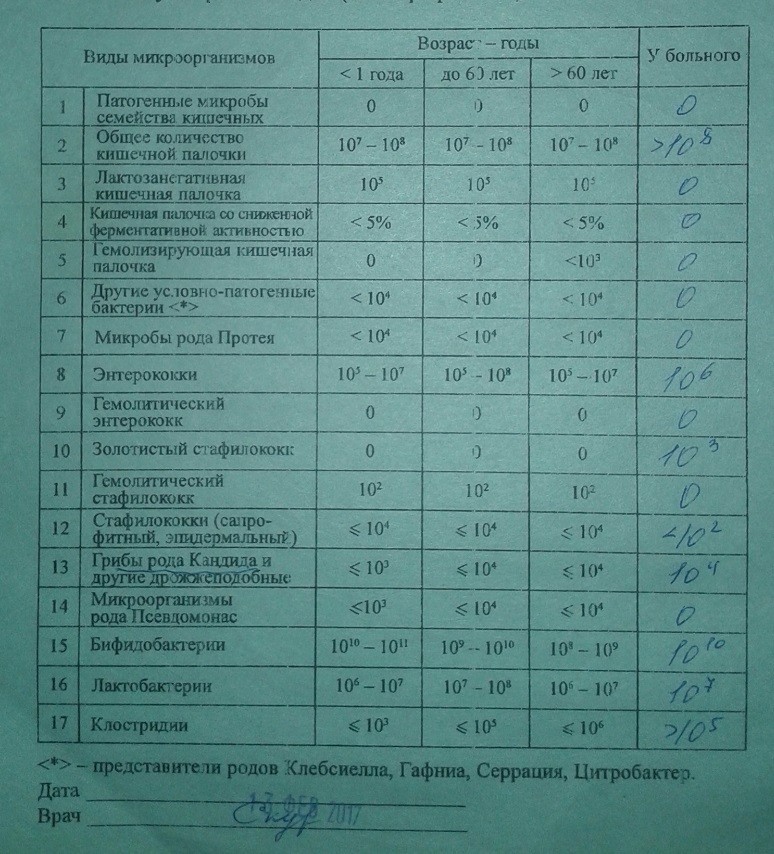 , Литтл Чалфонт, Великобритания).
, Литтл Чалфонт, Великобритания).
Данные были извлечены из изображений микрочипов с использованием программного обеспечения Agilent Feature Extraction, версия 9.1 (http://www.agilent.com), впоследствии нормализованной и подвергнутой дальнейшему анализу с использованием набора сценариев на основе R (http://r-project.org) в сочетании со специально разработанной реляционной базой данных, работающей под система управления базами данных MySQL (http://www.mysql.com; [34]). Иерархическая кластеризация профилей зондов проводилась с использованием расстояния Пирсона и метода минимальной дисперсии Уорда. Нормализованные сигналы гибридизации для 23 групп уровня 1 и 131 группы уровня 2 доступны в таблице S1 и таблице S2 соответственно.
Статистический анализ
Количественные данные выражали как среднее значение и 95% доверительный интервал (ДИ) среднего или, если они не были нормально распределены, как медиану и межквартильный размах (IQR). Богатство и разнообразие мекониальной и фекальной микробиоты недоношенных детей определяли путем расчета индекса разнообразия Шеннона-Уивера, учитывающего количество и равномерность видового состава бактерий.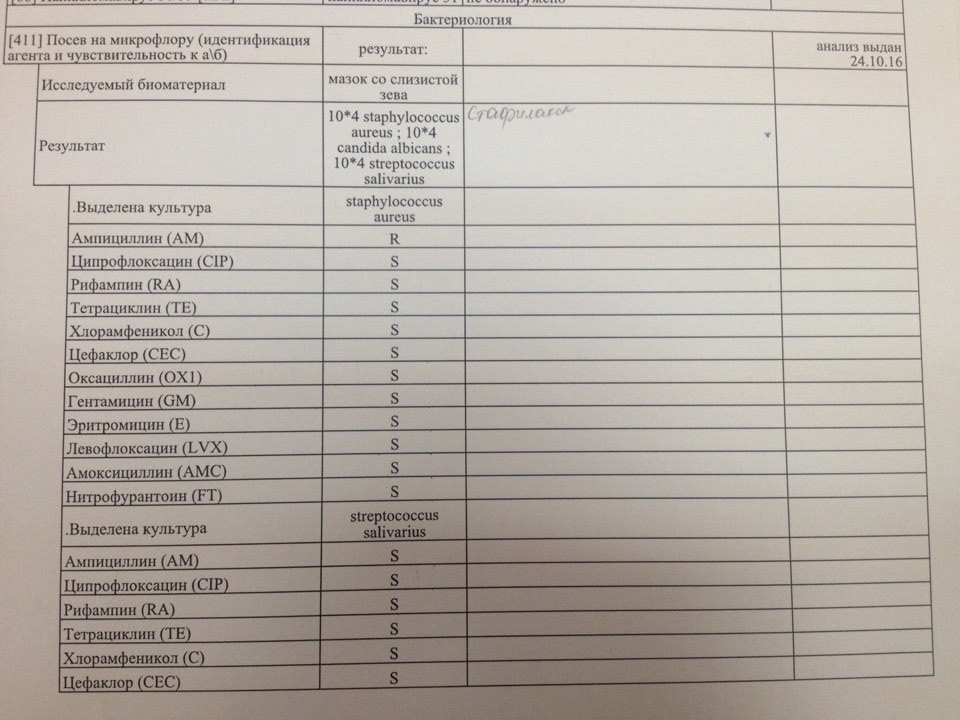 Для сравнения пропорций использовались точный критерий Фишера и расширение Фримана-Халтона точного вероятностного критерия Фишера для таблиц непредвиденных обстоятельств 2 × 3.Сравнения непараметрических повторных измерений Фридмана и тесты на парных образцах t применялись для определения различий между количеством бактерий каждой идентифицированной микробной группы или интенсивностью сигнала гибридизации родоподобных бактериальных групп во времени. Анализ основных компонентов (PCA) был применен к набору данных, собирающему микробиологический профиль всех образцов мекония и фекалий, полученных после культуральных методов, для группировки образцов в соответствии с их характеристиками.Различия считали достоверными при P <0,05. Программное обеспечение Statgraphics Centurion XVI версии 16.1.15 (Statpoint Technologies Inc., Вирджиния, США) и R 2.13.2 (проект R, Statistical Software) использовали для проведения анализов, упомянутых выше.
Для сравнения пропорций использовались точный критерий Фишера и расширение Фримана-Халтона точного вероятностного критерия Фишера для таблиц непредвиденных обстоятельств 2 × 3.Сравнения непараметрических повторных измерений Фридмана и тесты на парных образцах t применялись для определения различий между количеством бактерий каждой идентифицированной микробной группы или интенсивностью сигнала гибридизации родоподобных бактериальных групп во времени. Анализ основных компонентов (PCA) был применен к набору данных, собирающему микробиологический профиль всех образцов мекония и фекалий, полученных после культуральных методов, для группировки образцов в соответствии с их характеристиками.Различия считали достоверными при P <0,05. Программное обеспечение Statgraphics Centurion XVI версии 16.1.15 (Statpoint Technologies Inc., Вирджиния, США) и R 2.13.2 (проект R, Statistical Software) использовали для проведения анализов, упомянутых выше.
Результаты
Характеристики младенцев
14 новорожденных, включенных в это исследование, имели средний гестационный возраст 28 недель (от 24 до 32 недель) и средний вес при рождении 1288 г (от 600 до 2190 г) (таблица 1).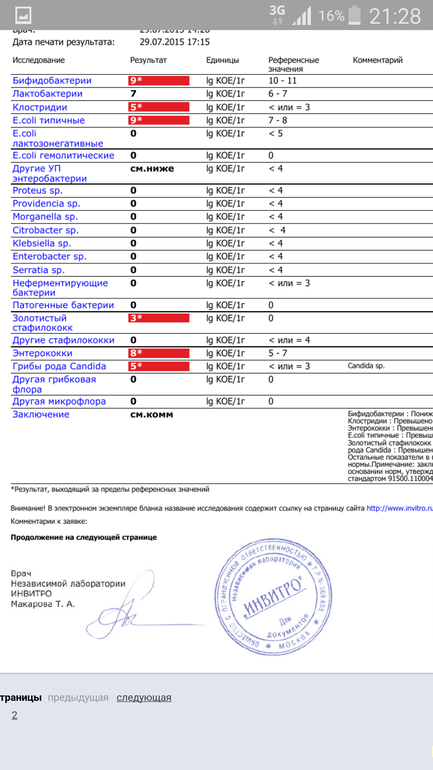 Половина детей (n = 7) рождены путем кесарева сечения, все они, кроме одного, получали антибактериальную профилактику как минимум в течение первых 3 дней жизни, половина из них нуждалась в ИВЛ (табл. 2). Младенцы получали грудное молоко собственной матери, донорское молоко и/или смесь для недоношенных детей через назогастральный зонд в течение как минимум 18 дней после родов. Время, необходимое для самопроизвольного выделения первого мекония, колебалось от первых минут до 5-го дня после рождения.Основные характеристики новорожденных представлены в таблицах 1 и 2.
Половина детей (n = 7) рождены путем кесарева сечения, все они, кроме одного, получали антибактериальную профилактику как минимум в течение первых 3 дней жизни, половина из них нуждалась в ИВЛ (табл. 2). Младенцы получали грудное молоко собственной матери, донорское молоко и/или смесь для недоношенных детей через назогастральный зонд в течение как минимум 18 дней после родов. Время, необходимое для самопроизвольного выделения первого мекония, колебалось от первых минут до 5-го дня после рождения.Основные характеристики новорожденных представлены в таблицах 1 и 2.
Культуральный анализ образцов мекония и кала
В течение первых трех недель жизни еженедельно собирали 14 образцов мекония и 39 образцов кала; в среднем было проанализировано 3,8 образца на ребенка (таблица 1). В целом инокуляция подходящих разведений всех образцов привела к росту бактерий на протестированных питательных средах, за исключением трех образцов мекония (младенцы 1, 2 и 9) (рис. 1).
Рис.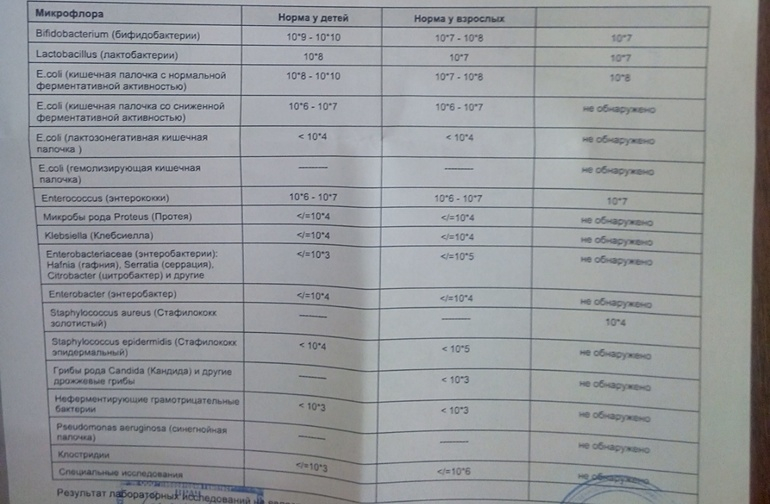 1. Количество микробных видов, выделенных и идентифицированных с помощью видоспецифичной ПЦР или ПЦР секвенирования 16S рРНК.
1. Количество микробных видов, выделенных и идентифицированных с помощью видоспецифичной ПЦР или ПЦР секвенирования 16S рРНК.
Сорок четыре различных вида были выделены и идентифицированы в некоторых или во всех проанализированных образцах (меконий (·), 1 st неделя (··), 2 nd неделя (···) и 3 rd неделя (····) образцы фекалий). Концентрации идентифицированных видов представлены в серой шкале от не обнаруженных (nd) белым цветом до 8–10 log 10 КОЕ/мл черным цветом.
https://doi.org/10.1371/journal.pone.0066986.g001
Идентификация изолятов, полученных из различных питательных сред, показала, что наиболее многочисленными во всех протестированных образцах были роды Staphylococcus и Enterococcus , которые были обнаружены в 77% и 64% образцов соответственно. Однако распределение этих двух родов по времени отбора проб было разным (рис. 2). Стафилококки преобладали в меконии и пробах кала 1 st недели, присутствуя в 50% и 100% проб соответственно, при S. epidermidis и S. aureus как наиболее распространенный вид. Другие виды стафилококков, такие как Staphylococcus caprae , S. hominis и Staphylococcus pasteuri , иногда выделяли из мекония или образцов фекалий 1 на неделе (рис. 1). Напротив, Enterococcus был преобладающим бактериальным родом в образцах фекалий 2 и и 3 rd (100% и 93% соответственно) (рис. 2). Э.faecalis и E. faecium удалось выделить из 13 и 7 образцов фекалий соответственно (рис. 1).
epidermidis и S. aureus как наиболее распространенный вид. Другие виды стафилококков, такие как Staphylococcus caprae , S. hominis и Staphylococcus pasteuri , иногда выделяли из мекония или образцов фекалий 1 на неделе (рис. 1). Напротив, Enterococcus был преобладающим бактериальным родом в образцах фекалий 2 и и 3 rd (100% и 93% соответственно) (рис. 2). Э.faecalis и E. faecium удалось выделить из 13 и 7 образцов фекалий соответственно (рис. 1).
Рисунок 2. Культивируемые бактерии в образцах мекония и фекалий, проанализированных в этом исследовании.
Частота встречаемости – это процент образцов, в которых определенный род бактерий был обнаружен в каждый момент отбора проб (меконий, 1 неделя, 2 неделя и 3 неделя кал). Общее количество еженедельно анализируемых проб указано под каждым временем отбора проб.Результаты точного вероятностного теста Фишера (расширение Фримена-Халтона для таблицы непредвиденных обстоятельств 2 × 4) показаны звездочками.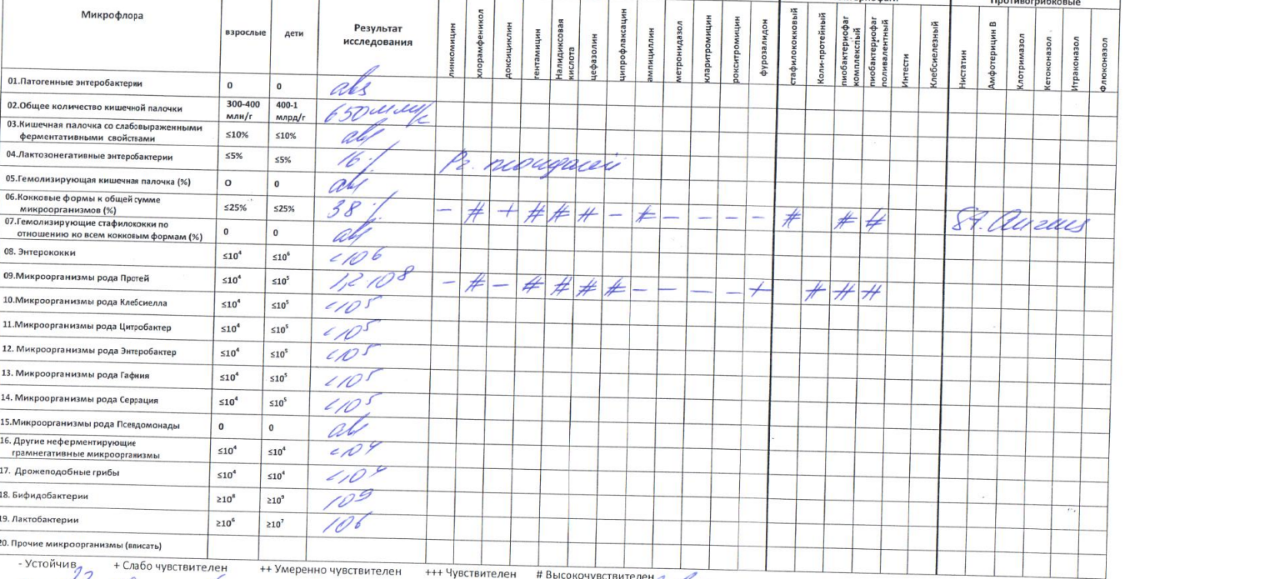 * = P <0,05; ** = P <0,01; *** = P <0,001.
* = P <0,05; ** = P <0,01; *** = P <0,001.
https://doi.org/10.1371/journal.pone.0066986.g002
Интересно, что виды Streptococcus, такие как Streptococcus anginosus, Streptococcus mitis, Streptococcus parasanguinis, Streptococcus pneumoniae, Streptococcus sanguinis и Streptococcus thermophilus, в основном были выделены из образцов мекония. (Рисунок 1).Присутствие лактобацилл и бифидобактерий было незначительным среди изолятов, полученных на чашках с агаром MRScys. Lactobacillus fermentum был выделен из 6 образцов, в то время как Lactobacillus gasseri, Lactobacillus salivarius, Bifidobacterium breve и Bifidobacterium longum удалось выделить только из фекалий одного ребенка (рис. 1). В отличие от стрептококков, грамотрицательные бактерии, такие как E. coli, Escherichia fergusonii, Klebsiella pneumoniae и Serratia marcescens, были выделены исключительно из образцов фекалий 1 st , 2 nd и/или 3 rd недели (рис. 1).
1).
Изредка, другие граммоположительные (принадлежащие к рождам Corynebacterium , Micrococcus и ROTHIA ), а также грамотрицательные бактерии (принадлежащие к рождам CITROBACTER , Enterobacter , Erwinia , Morganella , Pantoea , Proteus , Pseudomonas , Shigella и Stenotrophomonas ), а также некоторые дрожжевые грибки были также выделены из образцов мекония и фекалий, проанализированных в этом исследовании (таблица 3, рисунок 1).
Потенциальные связи между демографическими и клиническими параметрами и изоляцией различных родов в течение как минимум двух недель в образцах фекалий оценивались с использованием тестов Фишера. На изоляцию родов Serratia , по-видимому, сильно повлияли демографические или клинические переменные, связанные с недоношенностью. Фактически присутствие Serratia было значительно более частым, когда гестационный возраст был <30 недель (P = 0,020), при более длительном пребывании в стационаре (>35 дней; P = 0). 027) и при длительном лечении антибиотиками (>3 дней; P = 0,002). Точно так же образцы от младенцев, которым требовалась искусственная вентиляция легких, показали более высокую частоту Serratia (P = 0,050). На изоляцию других родов или бактериальных групп никакая качественная переменная не влияла (таблица S3).
027) и при длительном лечении антибиотиками (>3 дней; P = 0,002). Точно так же образцы от младенцев, которым требовалась искусственная вентиляция легких, показали более высокую частоту Serratia (P = 0,050). На изоляцию других родов или бактериальных групп никакая качественная переменная не влияла (таблица S3).
Общее количество бактерий, обнаруженное при культивировании образцов мекония в обычных средах, таких как BHI и WC, варьировалось от 3,65 до 9,85 log 10 КОЕ/г, тогда как в образцах фекалий колебалось между 6.70 и 10.09 log 10 КОЕ/г. Среднее количество Staphylococcus в образцах фекалий было примерно на 1 log 10 КОЕ/г выше, чем в образцах с меконием, в то время как количество бактерий других родов, таких как Enterococcus , Streptococcus , Lactobacillus 900si или 90si по меньшей мере на 2 log КОЕ/г выше в фекалиях, чем в меконии; однако различия были статистически значимыми только для родов Staphylococcus , Enterococcus, Klebsiella, Serratia и E.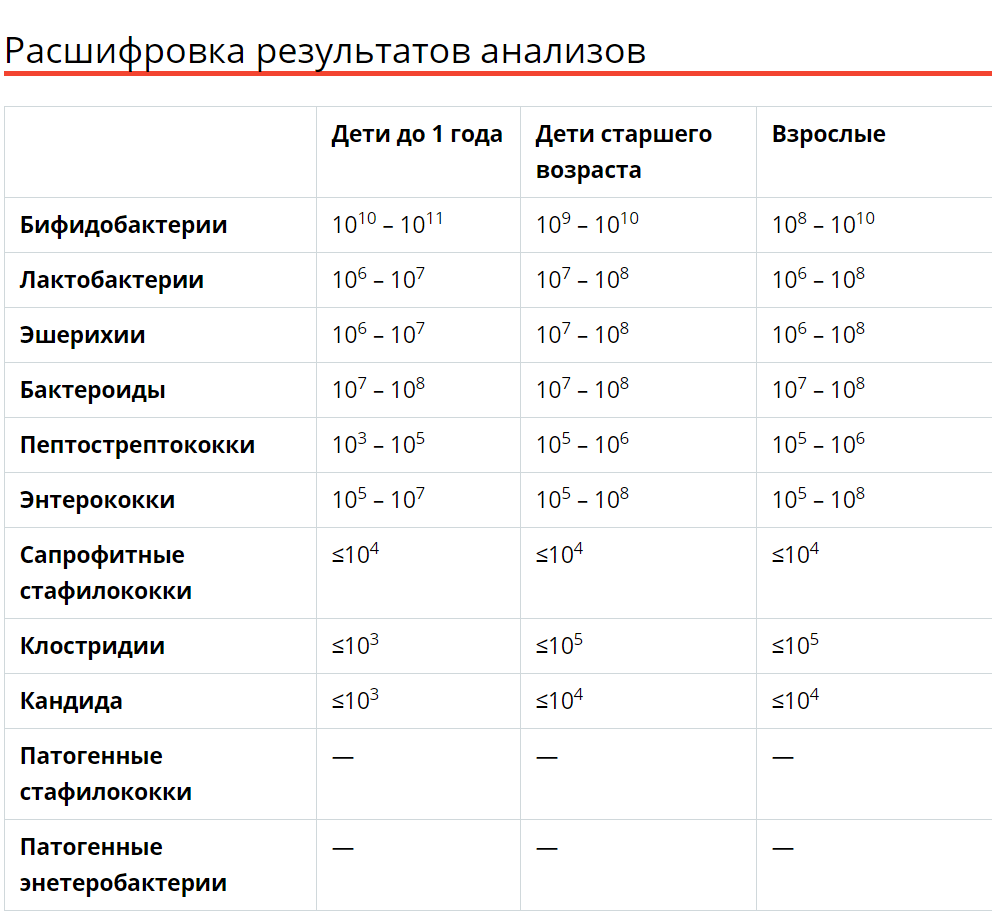 coli (табл. 3).
coli (табл. 3).
Чтобы визуализировать различия в микробиологических профилях образцов мекония и фекалий, проанализированных в этом исследовании, ко всему набору данных подсчета бактерий был применен анализ основных компонентов (PCA). На графике баллов, содержащем первый и второй ПК, на долю которых приходится 36% общей дисперсии, было замечено, что образцы мекония сгруппированы отдельно от образцов кала, особенно по размеру ПК1 (рис. 3).
Рисунок 3. Анализ основных компонентов (АПК) микробиологических профилей культивируемых бактерий.
PCA выполняли на основе подсчета культивируемых бактерий, обнаруженных в каждый момент отбора проб: мекония, 1 st , 2 nd и 3 rd недельного кала.
https://doi.org/10.1371/journal.pone.0066986.g003
Анализ ПЦР-ДГГЭ
мекония и 3 rd образцов кала от 5 младенцев были отправлены на профилирование PCR-DGGE. Количество основных полос у отдельных младенцев колебалось от 3 до 8 доминирующих полос. Визуальное сравнение паттернов DGGE выявило отчетливые различия между образцами мекония и фекалий, причем разнообразие выше среди образцов фекалий. Профили DGGE были проанализированы методом Neighbor Joining на основе коэффициента подобия Dice. В глобальном масштабе профили сгруппированы в две группы, одна из которых включает те, которые соответствуют образцам мекония, а вторая включает профили, полученные из фекалий 3 rd неделя. Единственным исключением был образец мекония, взятый у младенца 5, который слился с образцами фекалий.Анализ DGGE также выявил высокую степень индивидуальной изменчивости образцов; на самом деле значения сходства были низкими, в диапазоне от 50% до 75% (рис. 4).
Визуальное сравнение паттернов DGGE выявило отчетливые различия между образцами мекония и фекалий, причем разнообразие выше среди образцов фекалий. Профили DGGE были проанализированы методом Neighbor Joining на основе коэффициента подобия Dice. В глобальном масштабе профили сгруппированы в две группы, одна из которых включает те, которые соответствуют образцам мекония, а вторая включает профили, полученные из фекалий 3 rd неделя. Единственным исключением был образец мекония, взятый у младенца 5, который слился с образцами фекалий.Анализ DGGE также выявил высокую степень индивидуальной изменчивости образцов; на самом деле значения сходства были низкими, в диапазоне от 50% до 75% (рис. 4).
Рисунок 4. Кластерный анализ профилей DGGE.
Анализ проводился с использованием метода Neighbor Joining на основе коэффициента сходства Дайса в меконии и 3 rd фекалиях младенцев 2, 3, 4, 5 и 10 недель.
https://doi.org/10.1371/journal.pone. 0066986.g004
0066986.g004
Анализ HITChip
Наборы данных микрочипа 11 образцов мекония и 13 образцов кала, собранных в 3 году 90 141 недели, были собраны и иерархически сгруппированы на тепловой карте на основе интенсивности сигнала 3699 различных олигонуклеотидных зондов HITChip (рис. 5).Образцы мекония (за исключением тех, которые относятся к младенцам 5 и 12 лет) и образцы кала 3 rd недели были значительно сгруппированы в соответствии с типом образца (меконий против фекалий).
Рисунок 5. Филогенетические отпечатки мекония и фекальной микробиоты 3 rd неделя 14 недоношенных детей.
Самый высокий филогенетический уровень специфичности зондов описан в правой части рисунка. Яркость пятна соответствует обилию бактерий в образце.Использовали корреляцию Пирсона и метод кластеризации Уорда.
https://doi.org/10.1371/journal.pone.0066986.g005
Относительный вклад основных типов был оценен путем расчета процентного содержания таксонов типа/отряда в меконии и фекальной микробиоте 3 rd неделя. Во всем мире Firmicutes был наиболее распространенным типом в образцах мекония, на долю которого приходилось примерно 63,4% (95% ДИ: 42,2–84,6%) сигналов, за которым следовали Proteobacteria (27.7%; 95% ДИ: 7,61–47,7%) и Actinobacteria (3,5%; IQR: 0,63–10,3) (рис. 6). Напротив, Proteobacteria был доминирующим типом в образцах кала 3 rd неделя (57,6%; 95% ДИ %: 42,8–72,5), за которым следовали Firmicutes (28,4%; 95% ДИ: 13,8%–43,0). %) и Actinobacteria (12,2%; 95% ДИ: 2,2–22,2%). Относительная частота трех указанных типов значительно различалась в образцах мекония и кала (критерий хи-квадрат; P = 0.021, P = 0,052 и P≤0,001 для Firmicutes , Proteobacteria и Actinobacteria соответственно). Bacteroidetes представлял примерно 1% (IQR: 0,1–0,68%) сигналов в обоих типах образцов (рис. 5 и 7).
Во всем мире Firmicutes был наиболее распространенным типом в образцах мекония, на долю которого приходилось примерно 63,4% (95% ДИ: 42,2–84,6%) сигналов, за которым следовали Proteobacteria (27.7%; 95% ДИ: 7,61–47,7%) и Actinobacteria (3,5%; IQR: 0,63–10,3) (рис. 6). Напротив, Proteobacteria был доминирующим типом в образцах кала 3 rd неделя (57,6%; 95% ДИ %: 42,8–72,5), за которым следовали Firmicutes (28,4%; 95% ДИ: 13,8%–43,0). %) и Actinobacteria (12,2%; 95% ДИ: 2,2–22,2%). Относительная частота трех указанных типов значительно различалась в образцах мекония и кала (критерий хи-квадрат; P = 0.021, P = 0,052 и P≤0,001 для Firmicutes , Proteobacteria и Actinobacteria соответственно). Bacteroidetes представлял примерно 1% (IQR: 0,1–0,68%) сигналов в обоих типах образцов (рис. 5 и 7).
Рисунок 6. Типы микробиоты мекония и фекалий, проанализированные с помощью HITChip и культуральных методов.
Показан относительный вклад типов в микробиоту мекония и 3 rd недельных образцов фекалий четырнадцати младенцев, обнаруженных культуральными методами.На рисунке сравниваются данные для этих типов, полученные HITChip.
https://doi.org/10.1371/journal.pone.0066986.g006
Рисунок 7. Относительный вклад филюмов/отрядоподобных филогрупп в микробиоту исследуемых младенцев, оцененный с помощью HITChip.
Филогруппы типа/отряда, обнаруженные в меконии и 3 образцах кала на неделю с помощью HITChip. Показаны только филогруппы, подобные типу / отряду, которые внесли не менее 0,5% в данный профиль.
https://doi.org/10.1371/journal.pone.0066986.g007
Среди Firmicutes те, которые принадлежат к классу Bacilli , были наиболее распространены как в меконии (59,8%; 95% ДИ: 38,4%– 81,1%) и 3 rd неделя кала (15,4%; 95% ДИ: 4,5%–26,3%). Однако разнообразие Firmicutes было больше в образцах фекалий, поскольку другие группы также были обнаружены в относительно высоком проценте, включая Clostridium кластер I (5. 0%; 95% ДИ: 0,3–9,7%), Clostridium , кластер XIVa (4,9%; IQR: 0,3–1,3%), и Clostridium , кластер IX (2,0%; IQR: 0,0–1,6%) (рис. 7). ). Образцы кала от детей 3 и 13 лет показали другой микробный профиль с более высокой численностью кластеров Clostridium и Actinobacteria соответственно (рис. 7).
0%; 95% ДИ: 0,3–9,7%), Clostridium , кластер XIVa (4,9%; IQR: 0,3–1,3%), и Clostridium , кластер IX (2,0%; IQR: 0,0–1,6%) (рис. 7). ). Образцы кала от детей 3 и 13 лет показали другой микробный профиль с более высокой численностью кластеров Clostridium и Actinobacteria соответственно (рис. 7).
На более низком таксономическом уровне сравнение 131 сигнала гибридизации, соответствующих родоподобным бактериальным группам (уровень 2), полученных из образцов мекония и фекалий, показало, что 38 филогенетических групп значительно различались между обоими типами образцов.Среди них 20 филогенетических групп вносили не менее 0,5% вклада в микробный профиль каждого образца (табл. 4). Наличие родоподобных групп, таких как Propionibacterium , Lactobacillus plantarum et rel , Streptococcus intermedius et rel . и ул. mitis et rel . значительно снизился от мекония к фекальным образцам. С другой стороны, наблюдалось значительное увеличение численности таких групп, как Bacteroides splachnicus et rel . , Enterococcus , CloseTridia , Veellonella , Coldtridium Difficile Et Rel ., E.coli et el ., K. pneumoniae et rel ., pseudomonas , Serratia и Yersinia et отн . группы из мекония в образцы кала (таблица 4). Среди филогенетических групп, дающих ≥0,1% фекальных профилей, Enterobacter aerogenes et rel. , Enterococcus , E. coli и отн. ., Haemophilus , K. pneumoniae et rel., Pseudomonas, Serratia, Vibrio и Yersinia et rel. были обнаружены во всех образцах фекалий, что составляет примерно 55% от общего числа сигналов гибридизации в десяти из них. Напротив, только две группы филотипов, L. plantarum et rel. и ул. mitis et rel . сформировали основной микробиом в образцах мекония, в то время как для остальных филотипов наблюдалась большая межиндивидуальная изменчивость (данные не показаны).
, Enterococcus , CloseTridia , Veellonella , Coldtridium Difficile Et Rel ., E.coli et el ., K. pneumoniae et rel ., pseudomonas , Serratia и Yersinia et отн . группы из мекония в образцы кала (таблица 4). Среди филогенетических групп, дающих ≥0,1% фекальных профилей, Enterobacter aerogenes et rel. , Enterococcus , E. coli и отн. ., Haemophilus , K. pneumoniae et rel., Pseudomonas, Serratia, Vibrio и Yersinia et rel. были обнаружены во всех образцах фекалий, что составляет примерно 55% от общего числа сигналов гибридизации в десяти из них. Напротив, только две группы филотипов, L. plantarum et rel. и ул. mitis et rel . сформировали основной микробиом в образцах мекония, в то время как для остальных филотипов наблюдалась большая межиндивидуальная изменчивость (данные не показаны).
Детальный анализ интенсивности сигналов видоподобных таксонов (уровень 3) показал в среднем 441 филотипоподобный таксон в образцах мекония и 406 из них в образцах фекалий, что составляет 42% и 39% от общего числа филотипоподобные таксоны, находящиеся выше порога сигнала, соответственно. Интенсивность сигналов гибридизации, полученных с олигонуклеотидными зондами, соответствующими L. fermentum , Lactobacillus reuteri , S. epidermidis , Streptococcus viridans и некультивируемому Streptococcus sp.NB4D2 был особенно сильным среди образцов мекония, в то время как зонды филотипа, соответствующие Enterobacter cloacae , E. faecalis , E. coli , Hafnia alvei , K. pneumoniae subsp. ozaenae , Serratia liquefaciens и Shigella dysenteriae приводили к более интенсивной гибридизации среди фекальных (таблица S4). Протеобактериальные филотипоподобные таксоны были в основном обнаружены в образцах фекалий, а также в образцах мекония, полученных от детей 5 и 12 лет (таблица S5).Что касается филотипоподобных таксонов Lactobacillus и Lactococcus , было обнаружено в общей сложности 15 различных филотипов, при этом меконий, полученный от младенцев 1, 2, 4 и 11, показал наибольшее разнообразие (таблица S6).
Интенсивность сигналов гибридизации, полученных с олигонуклеотидными зондами, соответствующими L. fermentum , Lactobacillus reuteri , S. epidermidis , Streptococcus viridans и некультивируемому Streptococcus sp.NB4D2 был особенно сильным среди образцов мекония, в то время как зонды филотипа, соответствующие Enterobacter cloacae , E. faecalis , E. coli , Hafnia alvei , K. pneumoniae subsp. ozaenae , Serratia liquefaciens и Shigella dysenteriae приводили к более интенсивной гибридизации среди фекальных (таблица S4). Протеобактериальные филотипоподобные таксоны были в основном обнаружены в образцах фекалий, а также в образцах мекония, полученных от детей 5 и 12 лет (таблица S5).Что касается филотипоподобных таксонов Lactobacillus и Lactococcus , было обнаружено в общей сложности 15 различных филотипов, при этом меконий, полученный от младенцев 1, 2, 4 и 11, показал наибольшее разнообразие (таблица S6).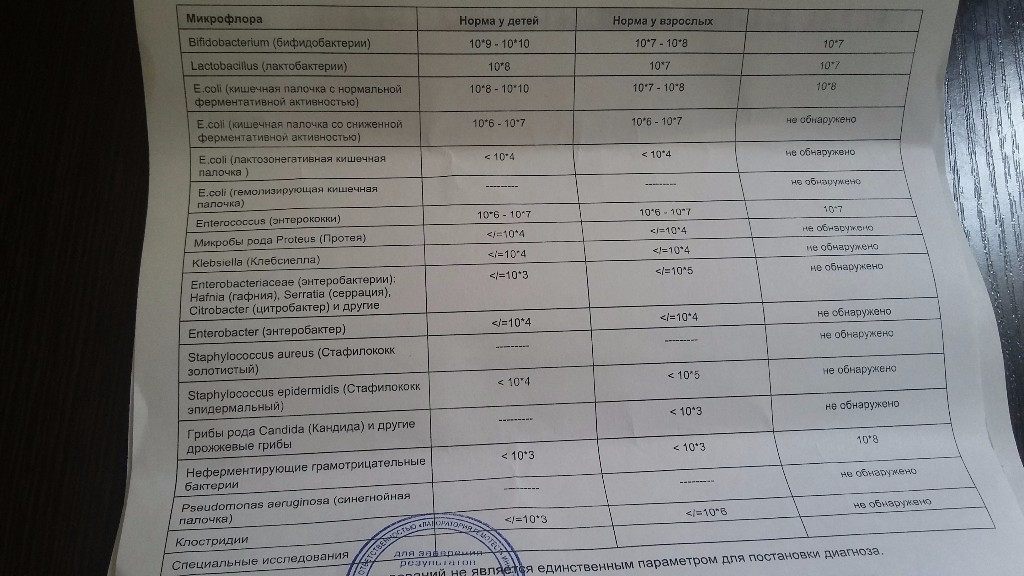 . В меконии младенца 2 таксоны Lactobacillus , подобные филотипу, представляли 82% от общего числа сигналов гибридизации, в то время как таксоны L. reuteri и Lactobacillus vaginalis вносили вклад в 45% и 27% от общего числа сигналов гибридизации соответственно (таблица). С6).Бифидобактериальные филотипоподобные таксоны были в основном обнаружены в одном меконии (младенцы 5) и пяти образцах фекалий (младенцы 1, 4, 5, 9 и 13) (таблица S7). Среди 12 филотипоподобных таксонов бифидобактерий, обнаруженных в этом исследовании, наиболее многочисленными были таксоны B. breve , Bifidobacterium catenolatum и Bifidobacterium infantis . В образце фекалий младенца 13 44% сигналов гибридизации соответствовали видам бифидобактерий, в то время как в остальных образцах фекалий, где они присутствовали, они представляли от 19 до 27% интенсивности сигналов (таблица S7).Филотипоподобные таксоны, принадлежащие к Clostridium spp. были нечастыми ни в образцах мекония, ни в образцах кала, за исключением образца кала младенца 13, где они представляли 17% от общего сигнала гибридизации (данные не показаны).
. В меконии младенца 2 таксоны Lactobacillus , подобные филотипу, представляли 82% от общего числа сигналов гибридизации, в то время как таксоны L. reuteri и Lactobacillus vaginalis вносили вклад в 45% и 27% от общего числа сигналов гибридизации соответственно (таблица). С6).Бифидобактериальные филотипоподобные таксоны были в основном обнаружены в одном меконии (младенцы 5) и пяти образцах фекалий (младенцы 1, 4, 5, 9 и 13) (таблица S7). Среди 12 филотипоподобных таксонов бифидобактерий, обнаруженных в этом исследовании, наиболее многочисленными были таксоны B. breve , Bifidobacterium catenolatum и Bifidobacterium infantis . В образце фекалий младенца 13 44% сигналов гибридизации соответствовали видам бифидобактерий, в то время как в остальных образцах фекалий, где они присутствовали, они представляли от 19 до 27% интенсивности сигналов (таблица S7).Филотипоподобные таксоны, принадлежащие к Clostridium spp. были нечастыми ни в образцах мекония, ни в образцах кала, за исключением образца кала младенца 13, где они представляли 17% от общего сигнала гибридизации (данные не показаны).
Сравнение результатов, полученных с помощью культур и HITChip
В глобальном масштабе наблюдалась хорошая корреляция между основными типами/отрядами, обнаруженными в образцах с помощью культивирования и молекулярного подхода (рис. 6). В целом класс Bacilli был преобладающей бактериальной группой среди образцов мекония, тогда как Proteobacteria был основным типом, наблюдаемым среди фекальных.
Принимая во внимание родоподобный уровень таксономии, методы культивирования и HITChip показали, что Enterococcus является релевантной группой в меконии и/или фекалиях недоношенных детей. Другие роды, такие как Bifidobacterium, Lactobacillus или Streptococcus , можно было обнаружить обоими методами, но частота обнаружения была ниже при использовании культурального подхода (таблицы 3 и 4). Кроме того, метод HITChip позволял обнаруживать другие роды бактерий, такие как Lactococcus или Clostridium , которые не могли быть выделены в культурах соответствующих образцов.
Наконец, также оценивалось разнообразие микробных сообществ, полученных путем культивирования или использования HITChip. Индексы Шеннона-Уивера, полученные с помощью культуральных методов, были ниже, чем полученные с помощью микрочипа, что указывает на более высокую чувствительность молекулярного метода (рис. 8). В любом случае, оба метода выявили более высокое бактериальное разнообразие в образцах фекалий, чем в образцах мекония (парный t-критерий; P = 0,016 и P = 0,011, для методов HITChip и культивирования соответственно).Индекс разнообразия Шеннона показал большую изменчивость среди образцов мекония (в диапазоне от 0,00 до 1,38 при использовании методов культивирования и от 2,09 до 4,28 при использовании микрочипов), чем среди фекальных образцов (в диапазоне от 1,07 до 1,60 при использовании методов культивирования и от 3,50 до 4,43). с микроматрицами).
Рис. 8. Индексы разнообразия Шеннона-Уивера по культуре и результатам HITChip.
Синие прямоугольники представляют индекс разнообразия Шеннона-Уивера, полученный с помощью методов культивирования в меконии (0 неделя), 1 st , 2 nd и 3 rd неделя фекалий. Зеленые прямоугольники представляют собой индекс разнообразия Шеннона-Уивера, полученный с помощью HITChip в меконии (0 неделя) и фекалиях 3 rd неделя.
Зеленые прямоугольники представляют собой индекс разнообразия Шеннона-Уивера, полученный с помощью HITChip в меконии (0 неделя) и фекалиях 3 rd неделя.
https://doi.org/10.1371/journal.pone.0066986.g008
Обсуждение
В настоящем исследовании последовательность видов бактерий в меконии и кале недоношенных детей в первые 3 недели жизни оценивалась с помощью культуральных методов, PCR-DGGE и микрочипа HITChip. Сочетание анализа культуры и независимых от культуры методов обеспечило очень дополняющие друг друга представления о микробиоте, присутствующей в проанализированных образцах.Результаты, полученные с помощью обоих подходов, показали хорошую корреляцию, хотя метод HITChip был наиболее чувствительным и привел к обнаружению более высокого бактериального разнообразия, вероятно, из-за различного восстановления/выживания после оттаивания образцов и сложных потребностей в питании некоторых видов при использовании методов культивирования.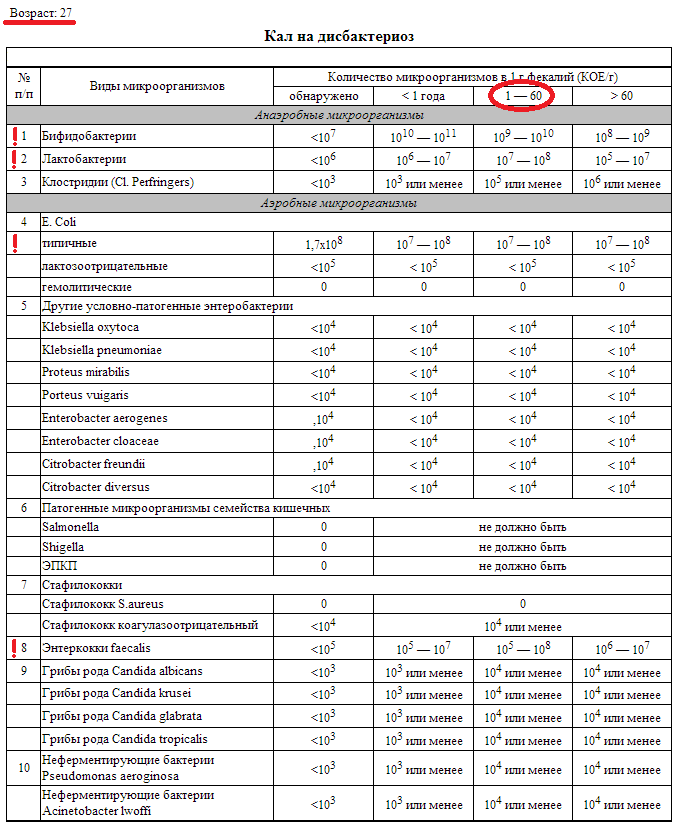 Другие различия между культуральными и молекулярными методами могут быть связаны со смещением ПЦР, перекрестной гибридизацией и сложностью обнаружения, если виды присутствуют в малых количествах, что согласуется с предыдущими исследованиями [18].В целом анализ мекония и кала недоношенных детей выявил низкое видовое разнообразие и высокую межиндивидуальную изменчивость, как описано ранее [13], [14], [37], [38]. Бактериальное разнообразие в образцах мекония было ниже, чем в фекалиях, хотя индексы разнообразия, полученные в обоих типах образцов при анализе HITChip, были выше, чем в предыдущих исследованиях [13], [14], [16]. Bacilli и другие Firmicutes доминировали в меконии, а Proteobacteria – в образцах фекалий.На уровне рода, Staphylococcus, streptococcus , энтерококка и лактобациллус и , преобладающих в образцах Meconium, в то время как члены семейства Enterobacteriaceae, такие как Escherichia , Klebsiella или Serratia, , быстро стали доминирующими в фекалии факт, о котором неоднократно сообщалось [11], [12], [13], [14], [15], [16], [38], [39].
Другие различия между культуральными и молекулярными методами могут быть связаны со смещением ПЦР, перекрестной гибридизацией и сложностью обнаружения, если виды присутствуют в малых количествах, что согласуется с предыдущими исследованиями [18].В целом анализ мекония и кала недоношенных детей выявил низкое видовое разнообразие и высокую межиндивидуальную изменчивость, как описано ранее [13], [14], [37], [38]. Бактериальное разнообразие в образцах мекония было ниже, чем в фекалиях, хотя индексы разнообразия, полученные в обоих типах образцов при анализе HITChip, были выше, чем в предыдущих исследованиях [13], [14], [16]. Bacilli и другие Firmicutes доминировали в меконии, а Proteobacteria – в образцах фекалий.На уровне рода, Staphylococcus, streptococcus , энтерококка и лактобациллус и , преобладающих в образцах Meconium, в то время как члены семейства Enterobacteriaceae, такие как Escherichia , Klebsiella или Serratia, , быстро стали доминирующими в фекалии факт, о котором неоднократно сообщалось [11], [12], [13], [14], [15], [16], [38], [39]. В предыдущей работе [27], где анализировались образцы мекония от доношенных здоровых детей, рожденных в той же больнице, E.coli и Leuconostoc sp. были обнаружены культуральными методами, как это было недавно описано Госальбесом и др. [7] с помощью молекулярных методов. Напротив, в этой работе эти виды не были выделены методами культивирования, хотя низкая интенсивность сигнала E. coli была обнаружена с помощью HITChip в образцах мекония недоношенных детей. Следует принимать во внимание, что замораживание может внести микробиологические отклонения в культуральные методы, как указано выше.
В предыдущей работе [27], где анализировались образцы мекония от доношенных здоровых детей, рожденных в той же больнице, E.coli и Leuconostoc sp. были обнаружены культуральными методами, как это было недавно описано Госальбесом и др. [7] с помощью молекулярных методов. Напротив, в этой работе эти виды не были выделены методами культивирования, хотя низкая интенсивность сигнала E. coli была обнаружена с помощью HITChip в образцах мекония недоношенных детей. Следует принимать во внимание, что замораживание может внести микробиологические отклонения в культуральные методы, как указано выше.
Преждевременные роды обычно приводят к отсроченной и аномальной качественной картине колонизации кишечника, которая часто описывается как аберрантная по сравнению со здоровыми доношенными [5], [6].Этот факт, по-видимому, влияет на здоровье младенцев и является фактором риска развития желудочно-кишечных инфекций, таких как некротизирующий энтероколит [21], [40].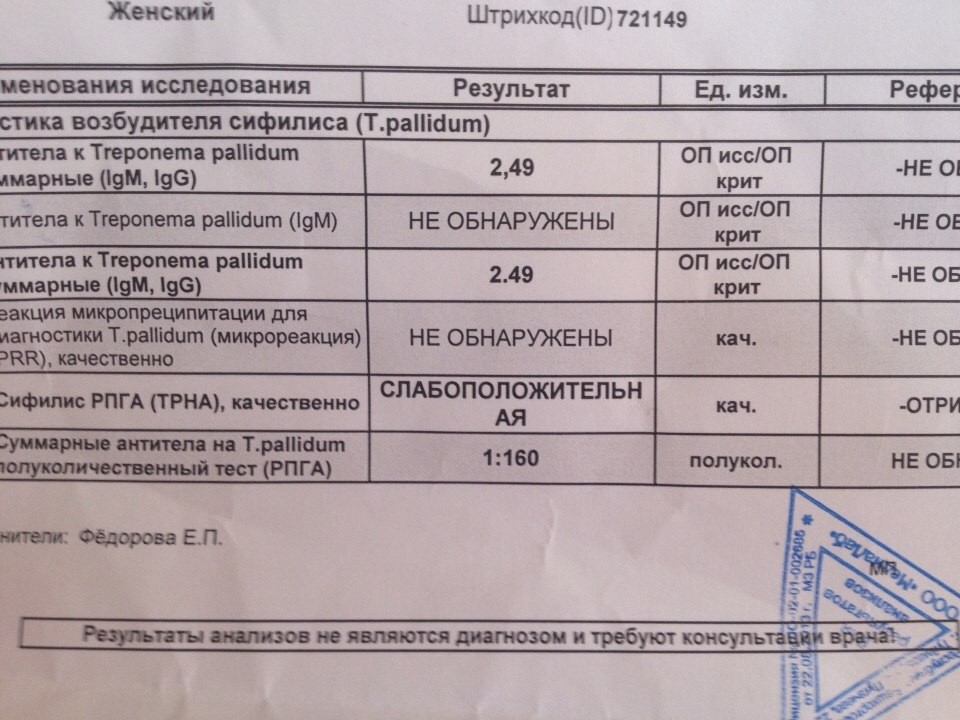 В недавнем исследовании, в котором образцы мекония и кала от 6 недоношенных детей были проанализированы с помощью высокопроизводительного пиросеквенирования 16S рРНК, было обнаружено, что колонизация кишечника, по-видимому, следует определенным закономерностям [23]. У субъектов, у которых развился сепсис, преобладали Proteobacteria и Firmicutes ( Staphylococcus ).Примечательно, что у здоровых субъектов, получавших антибиотики в ограниченном количестве (всего <3 дней) и у которых в конечном итоге не развился сепсис, наблюдалось увеличение относительной численности анаэробов, аналогично более «зрелым» микробным сообществам, включая Clostridium , Klebsiella и . Вейлонелла [23]. В фекальной микробиоте недоношенных детей обычно преобладают культивируемые бактерии, которые преобладают в больничных условиях, богатых антибиотиками, таких как отделения интенсивной терапии новорожденных. В этом исследовании присутствие Serratia было тесно связано с несколькими параметрами, связанными с больницей, включая антибактериальную терапию и искусственную вентиляцию легких.
В недавнем исследовании, в котором образцы мекония и кала от 6 недоношенных детей были проанализированы с помощью высокопроизводительного пиросеквенирования 16S рРНК, было обнаружено, что колонизация кишечника, по-видимому, следует определенным закономерностям [23]. У субъектов, у которых развился сепсис, преобладали Proteobacteria и Firmicutes ( Staphylococcus ).Примечательно, что у здоровых субъектов, получавших антибиотики в ограниченном количестве (всего <3 дней) и у которых в конечном итоге не развился сепсис, наблюдалось увеличение относительной численности анаэробов, аналогично более «зрелым» микробным сообществам, включая Clostridium , Klebsiella и . Вейлонелла [23]. В фекальной микробиоте недоношенных детей обычно преобладают культивируемые бактерии, которые преобладают в больничных условиях, богатых антибиотиками, таких как отделения интенсивной терапии новорожденных. В этом исследовании присутствие Serratia было тесно связано с несколькими параметрами, связанными с больницей, включая антибактериальную терапию и искусственную вентиляцию легких.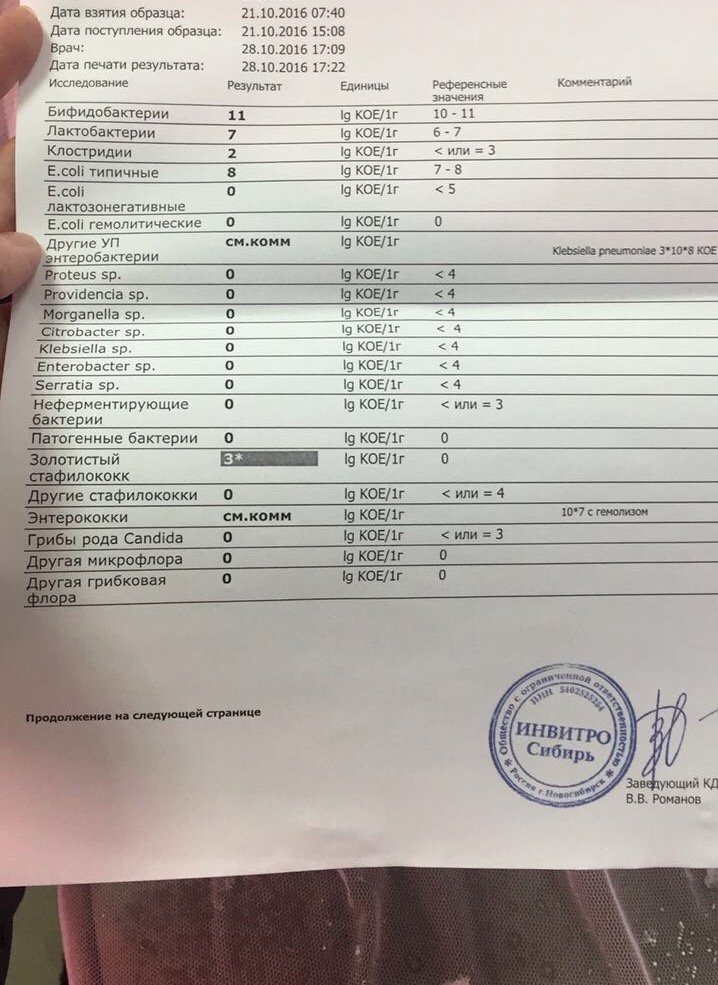 Страх инфекций часто приводит к раннему и широкому использованию антибиотиков широкого спектра действия в отделениях интенсивной терапии интенсивной терапии, стратегия, которая увеличивает риск колонизации резистентными бактериальными штаммами [41]. Высокое влияние окружающей среды согласуется с предыдущими исследованиями, в которых отмечалась тенденция к однородности бактериальных сообществ недоношенных детей во время их пребывания в отделении интенсивной терапии [16]. Точно так же недавно было показано, что отделение интенсивной терапии является основным фактором, влияющим на колонизацию клостридиями недоношенных детей, и что курс антибиотиков влияет на уровни колонизации [42].В недавнем углубленном пиросеквенированном исследовании был изучен кишечный микробиом 11 младенцев с экстремально низкой массой тела при рождении в первый месяц после рождения. Это исследование подтвердило, что Enterobacteriales, Staphylococcus и Enterococcus были одними из самых распространенных бактериальных таксонов в бактериальном сообществе с низким разнообразием, в котором преобладали типы бактерий, вызывающие инвазивные заболевания у этих младенцев [12].
Страх инфекций часто приводит к раннему и широкому использованию антибиотиков широкого спектра действия в отделениях интенсивной терапии интенсивной терапии, стратегия, которая увеличивает риск колонизации резистентными бактериальными штаммами [41]. Высокое влияние окружающей среды согласуется с предыдущими исследованиями, в которых отмечалась тенденция к однородности бактериальных сообществ недоношенных детей во время их пребывания в отделении интенсивной терапии [16]. Точно так же недавно было показано, что отделение интенсивной терапии является основным фактором, влияющим на колонизацию клостридиями недоношенных детей, и что курс антибиотиков влияет на уровни колонизации [42].В недавнем углубленном пиросеквенированном исследовании был изучен кишечный микробиом 11 младенцев с экстремально низкой массой тела при рождении в первый месяц после рождения. Это исследование подтвердило, что Enterobacteriales, Staphylococcus и Enterococcus были одними из самых распространенных бактериальных таксонов в бактериальном сообществе с низким разнообразием, в котором преобладали типы бактерий, вызывающие инвазивные заболевания у этих младенцев [12].
У недоношенных новорожденных колонизация строгими анаэробами особенно задерживается [13].Колонизация Clostridia сильно различается от ребенка к ребенку по времени их первого появления, в то время как Bacteroides и бифидобактерии редко выделяются из фекалий этих детей [38], [43], [44]. В этом исследовании удалось выделить и обнаружить бифидобактерии и ДНК бифидобактерий, хотя и с низкой частотой. Предыдущее исследование показало, что гестационный возраст при рождении оказал значительное влияние на колонизацию младенцев бифидобактериями, которая всегда происходила у детей, рожденных при гестационном возрасте более 33 недель [10].Фактически, некоторые исследования свидетельствуют об относительно низкой частоте и обилии бифидобактерий в фекальной микробиоте в любом возрасте от рождения до взрослой жизни [6]. Эти авторы предположили, что акцент на бифидобактериях в исследованиях и обзорах желудочно-кишечной микробиоты младенцев может быть непропорционален ее распространенности, изобилию и значимости для здоровья. Этот аспект следует рассмотреть в дальнейшей работе.
Этот аспект следует рассмотреть в дальнейшей работе.
В глобальном масштабе наши результаты показывают, что спонтанно выделяющийся меконий недоношенных новорожденных содержит специфическую микробиоту, отличную от микробиоты фекалий, полученных после первой недели жизни.Предыдущие исследования показали наличие аналогичной культивируемой микробиоты в пуповинной крови и меконии, собранном гигиеническим путем у доношенных и недоношенных детей, что позволяет предположить, что кишечник плода может быть нестерильным до родов и, следовательно, по крайней мере часть бактерий, обнаруженных в меконий не имеет постнатального происхождения [14], [26], [27].
Вероятно, такие бактерии могли попасть в кишечник плода через внутриутробное заглатывание амниотической жидкости. Культурально-зависимые и независимые исследования показали, что в амниотической жидкости человека есть бактерии без разрыва плодных оболочек [24].Ранее нами было показано, что пероральное введение штамма энтерококка беременным мышам приводило к их наличию в амниотической жидкости и меконии, полученном при кесаревом сечении [26]; этот факт неудивителен, так как сообщалось, что бактерии пищеварительного тракта могут достигать амниотической жидкости через кровоток [45]. Другое исследование, проведенное на беременных женщинах, было сосредоточено на влиянии состава их оральной микробиоты на исход беременности и показало, что некоторые бактерии, такие как Actinomyces naselundii , были связаны с более низкой массой тела при рождении и более ранними родами, в то время как другие, такие как лактобациллы, были связаны с более высокой массой тела при рождении и более поздними сроками родов.Результаты такого исследования показали, что бактерии полости рта могут проникать в среду матки через кровоток и влиять на процесс родов [46]. Стрептококки и стафилококки, по-видимому, были среди доминирующих бактерий в образцах мекония, и, что интересно, их присутствие в образцах хориоамниона здоровых матерей, перенесших кесарево сечение, было описано ранее [47]. Потенциальное существование начальной колонизации кишечника на стадии плода заслуживает будущих исследований, поскольку это может иметь важные последствия для здоровья; например, его модуляция во время беременности может помочь избежать преждевременных родов.
Другое исследование, проведенное на беременных женщинах, было сосредоточено на влиянии состава их оральной микробиоты на исход беременности и показало, что некоторые бактерии, такие как Actinomyces naselundii , были связаны с более низкой массой тела при рождении и более ранними родами, в то время как другие, такие как лактобациллы, были связаны с более высокой массой тела при рождении и более поздними сроками родов.Результаты такого исследования показали, что бактерии полости рта могут проникать в среду матки через кровоток и влиять на процесс родов [46]. Стрептококки и стафилококки, по-видимому, были среди доминирующих бактерий в образцах мекония, и, что интересно, их присутствие в образцах хориоамниона здоровых матерей, перенесших кесарево сечение, было описано ранее [47]. Потенциальное существование начальной колонизации кишечника на стадии плода заслуживает будущих исследований, поскольку это может иметь важные последствия для здоровья; например, его модуляция во время беременности может помочь избежать преждевременных родов.
Благодарности
Мы хотели бы поблагодарить все семьи, принявшие участие в этом исследовании.
Вклад авторов
Задумал и разработал эксперименты: LM MG GB JMR EJ. Выполнял эксперименты: LM MG HH EJ. Проанализированы данные: LM MG SF LF EJ. Предоставленные реагенты/материалы/инструменты анализа: WdV JMR. Написал статью: LM MG HH GB SF WdV LF JMR EJ. Набор добровольцев и сбор образцов: Великобритания.
Каталожные номера
- 1.Blaut M, Clavel T (2007)Метаболическое разнообразие кишечной микробиоты: последствия для здоровья и болезней. J Nutr 137 (3 Suppl 2) 751S–755S.
- 2. Детлефсен Л., Экбург П. Б., Бик Э. М., Релман Д. А. (2006) Сборка микробиоты кишечника человека. Тенденции Ecol Evol 21: 517–523.
- 3. Favier CF, de Vos WM, Akkermans AD (2003)Развитие бактериальных и бифидобактериальных сообществ в фекалиях новорожденных. Анаэроб 9: 219–229.
- 4.Hong PY, Lee BW, Aw M, Shek LP, Yap GC и др.
 (2010) Сравнительный анализ фекальной микробиоты у детей раннего возраста с экземой и без нее. ПЛОС ОДИН 5: e9964.
(2010) Сравнительный анализ фекальной микробиоты у детей раннего возраста с экземой и без нее. ПЛОС ОДИН 5: e9964. - 5. Koenig JE, Spor A, Scalfone N, Fricker AD, Stombaugh J, et al. (2011)Последовательность микробных консорциумов в развивающемся кишечном микробиоме младенцев. Proc Natl Acad Sci USA 108 Suppl 14578–4585.
- 6. Палмер С., Бик Э.М., ДиДжиулио Д.Б., Релман Д.А., Браун П.О. (2007)Развитие кишечной микробиоты младенцев человека.PLoS Биол 5: e177.
- 7. Госальбес М.Дж., Ллоп С., Валлес Ю., Мойя А., Баллестер Ф. и др. (2013) Типы микробиоты мекония, в которых преобладают молочнокислые или кишечные бактерии, по-разному связаны с материнской экземой и респираторными проблемами у младенцев. Clin Exp Allergy 43 (2): 198–211.
- 8. Fanaro S, Chierici R, Guerrini P, Vigi V (2003)Кишечная микрофлора в раннем детстве: состав и развитие. Acta Paediatr Suppl 91: 48–55.
- 9.
Пендерс Дж.
 , Тайс С., Винк С., Стельма Ф.Ф., Снейдерс Б. и др.(2006) Факторы, влияющие на состав кишечной микробиоты в раннем младенчестве. Педиатрия 118: 511–521.
, Тайс С., Винк С., Стельма Ф.Ф., Снейдерс Б. и др.(2006) Факторы, влияющие на состав кишечной микробиоты в раннем младенчестве. Педиатрия 118: 511–521. - 10. Бутел М.Дж., Суау А., Кампеотто Ф., Магне Ф., Айрес Дж. и др. (2007) Условия колонизации бифидобактериями у недоношенных детей: проспективный анализ. J Pediatr Gastroenterol Nutr 44: 577–582.
- 11. Gewolb IH, Schwalbe RS, Taciak VL, Harrison TS, Panigrahi P (1999)Микрофлора стула у младенцев с экстремально низкой массой тела при рождении. Arch Dis Child Fetal Neonatal Ed 80: F167–173.
- 12. LaTuga MS, Ellis JC, Cotton CM, Goldberg RN, Wynn JL, et al. (2011) Помимо бактерий: исследование кишечного микробного консорциума у младенцев с экстремально низкой массой тела при рождении. PLoS One 6: e27858.
- 13. Магне Ф., Абели М., Бойер Ф., Морвиль П., Почарт П. и др. (2006) Низкое видовое разнообразие и высокая межиндивидуальная изменчивость в фекалиях недоношенных детей, выявленные последовательностями генов 16S рРНК и профилями гель-электрофореза в ПЦР-временном градиенте температуры.FEMS Microbiol Ecol 57: 128–38.
- 14. Мшвилдадзе М., Ной Дж., Шустер Дж., Териак Д., Ли Н. и др. (2010)Кишечная микробная экология у недоношенных детей, оцененная с помощью методов, не основанных на культуре. Дж. Педиатр 156: 20–25.
- 15. Sakata H, Yoshioka H, Fujita K (1985)Развитие кишечной флоры у младенцев с очень низкой массой тела при рождении по сравнению с нормальными доношенными новорожденными. Eur J Pediatr 144: 186–190.
- 16. Швирц А., Груль Б., Лёбниц М., Мишель П., Радке М. и др.(2003) Развитие кишечного бактериального состава у госпитализированных недоношенных детей по сравнению с доношенными детьми, находящимися на грудном вскармливании. Педиатр Рез. 54: 393–399.
- 17. Ван И, Хёниг Дж. Д., Малин К. Дж., Камар С., Петроф Е. О. и др. (2009) Анализ фекальной микробиоты недоношенных детей с некротизирующим энтероколитом и без него на основе гена 16S рРНК. ИСМЕ J 3: 944–954.
- 18. Руже С., Гольденберг О., Феррарис Л., Бергер Б., Роша Ф. и др. (2010) Исследование микробиоты кишечника у недоношенных детей различными методами.Анаэроб 16: 362–370.
- 19. Хупер Л.В., Гордон Дж.И. (2001)Комменсальные отношения между хозяином и бактериями в кишечнике. Наука 292: 1115–1118.
- 20. Ley RE, Turnbaugh PJ, Klein S, Gordon JI (2006) Микробная экология: микробы кишечника человека, связанные с ожирением. Природа 444: 1022–1023.
- 21. Claud EC, Walker WA (2001) Гипотеза: неправильная колонизация недоношенного кишечника может вызвать неонатальный некротизирующий энтероколит. FASEB J 15: 1398–1403.
- 22. де ла Кошетьер М.Ф., Пилоке Х., де Робер С., Дарман Д., Гальмиш Дж. и др. (2004)Ранняя кишечная бактериальная колонизация и некротизирующий энтероколит у недоношенных детей: предполагаемая роль Clostridium . Педиатр Рез. 56: 366–370.
- 23. Мадан Дж. К., Салари Р. С., Саксена Д., Дэвидсон Л., О’Тул Г. А. и др. (2012)Микробная колонизация кишечника у недоношенных новорожденных предсказывает неонатальный сепсис. Arch Dis Child Fetal Neonatal Ed 97 (6): F456–462.
- 24. Ди Джулио Д.Б., Ромеро Р., Амоган Х.П., Кусанович Дж.П., Бик Э.М. и др. (2008) Распространенность, разнообразие и изобилие микробов в амниотической жидкости во время преждевременных родов: молекулярное и культуральное исследование. ПЛОС ОДИН 3: e3056.
- 25. Hufnagel M, Liese C, Loescher C, Kunze M, Proempeler H, et al. (2007) Энтерококковая колонизация младенцев в отделении интенсивной терапии новорожденных: связанные предикторы, факторы риска и сезонные модели. BMC Infect Dis 7: 107.
- 26. Хименес Э., Фернандес Л., Марин М.Л., Мартин Р., Одриосола Дж.М. и др. (2005)Выделение комменсальных бактерий из пуповинной крови здоровых новорожденных, рожденных путем кесарева сечения. Curr Microbiol 51: 270–274.
- 27. Хименес Э., Марин М.Л., Мартин Р., Одриосола Дж.М., Оливарес М. и др. (2008) Действительно ли меконий здоровых новорожденных стерилен? Res Microbiol 159: 187–193.
- 28. Satokari R, Gronroos T, Laitinen K, Salminen S, Isolauri E (2009) Bifidobacterium и Lactobacillus ДНК в плаценте человека.Lett Appl Microbiol 48: 8–12.
- 29. Руис-Барба Дж. Л., Мальдонадо А., Хименес-Диас Р. (2005) Мелкомасштабное выделение тотальной ДНК из бактерий и дрожжей для применения ПЦР. Анальный биохим 347: 333–335.
- 30. Хименес Э., Дельгадо С., Мальдонадо А., Арройо Р., Альбухар М. и др. (2008) Staphylococcus epidermidis : дифференциальный признак фекальной микробиоты младенцев, находящихся на грудном вскармливании. БМС Микробиол 8: 143.
- 31. Dutka-Malen S, Evers S, Courvalin P (1995)Обнаружение генотипов устойчивости к гликопептидам и идентификация до уровня вида клинически значимых энтерококков с помощью ПЦР.J Clin Microbiol 33: 24–27.
- 32. Kullen MJ, Sanozky-Dawes RB, Crowell DC, Klaenhammer TR (2000)Использование последовательности ДНК вариабельных областей гена 16S рРНК для быстрой и точной идентификации бактерий в комплексе Lactobacillus acidophilus . J Appl Microbiol 89: 511–516.
- 33. Felske A, Akkermans ADL, de Vos WM (1998)Количественная оценка 16S рРНК в сложных бактериальных сообществах с помощью множественной конкурентной обратной транскрипции-ПЦР в гель-электрофорезе в температурном градиенте.Appl Environ Microbiol 64: 4581e–4587e.
- 34. Nubel U, García-Pichel F, Muyzer G (1997) Праймеры для ПЦР для амплификации генов 16S рРНК цианобактерий. Appl Environ Microbiol 63: 3327–3332.
- 35. Muyzer G, de Waal EC, Uitterlinden GA (1993) Профилирование сложных популяций с помощью анализа денатурирующего градиентного гель-электрофореза генов, амплифицированных полимеразной цепной реакцией, кодирующих 16S рРНК. Appl Environ Microbiol 59: 695–700.
- 36. Райлич-Стоянович М., Хейлиг Х.Г., Моленаар Д., Каяндер К., Суракка А. и др.(2009)Разработка и применение чипа кишечного тракта человека, филогенетического микрочипа: анализ универсально консервативных филотипов в обильной микробиоте молодых и пожилых людей. Environ Microbiol 11: 1736–1751.
- 37. Favier CF, Vaughan EE, de Vos WM, Akkermans ADL (2002)Молекулярный мониторинг последовательности бактериальных сообществ у новорожденных. Appl Environ Microbiol 68: 219–226.
- 38. Жако А., Неве Д., Ожула Ф., Мерсье Г., Маршандин Х. и др.(2011)Динамика и клиническая эволюция бактериальной микрофлоры кишечника у крайне недоношенных пациентов. J Pediatr 158: 390–396.
- 39. Блейки Дж. Л., Любиц Л., Барнс Г. Л., Бишоп Р. Ф., Кэмпбелл Н. Т. и другие. (1982)Развитие колонизации кишечника у недоношенных новорожденных. J Med Microbiol 15: 519–529.
- 40. Siggers RH, Siggers J, Thymann T, Boye M, Sangild PT (2011) Пищевая модуляция микробиоты кишечника и иммунной системы у недоношенных новорожденных. J Nutr Biochem 22: 511–521.
- 41. de Man P, Verhoeven BA, Verbrugh HA, Vos MC, van den Anker JN (2000) Антибиотическая политика для предотвращения появления резистентных бацилл. Ланцет 355: 973–978.
- 42. Феррарис Л., Бутел М.Дж., Кампеотто Ф., Водовар М., Розе Дж.С. и др. (2012)Клостридии в кишечнике недоношенных новорожденных: заболеваемость, чувствительность к антибиотикам и перинатальные детерминанты, влияющие на колонизацию. PLoS One 7: e30594.
- 43. Руже С., Пилоке Х., Бутель М.Дж., Бергер Б., Роша Ф. и др.(2009) Пероральное добавление пробиотиков у недоношенных детей с очень низкой массой тела при рождении: рандомизированное двойное слепое плацебо-контролируемое исследование. Ам Дж. Клин Нутр 89: 1828–1835.
- 44. Кампеотто Ф., Суау А., Капель Н., Магне Ф., Виаллон В. и др. (2011)Ферментированная смесь у недоношенных детей: клиническая переносимость, микробиота кишечника, снижение фекального кальпротектина и повышение уровня фекального секреторного IgA. Бр Дж. Нутр 105: 1843–1851.
- 45. Kornman KS, Loesche WJ (1980) Поддесневая микробная флора во время беременности.J Periodont Res 15: 111–122.
- 46. Dasanayake AP, Li Y, Wiener H, Ruby JD, Lee MJ (2005)Уровни слюны Actinomyces naeslundii геновидов 2 и Lactobacillus casei предсказывают исходы беременности. J Периодонтол 76: 171–177.
- 47. Bearfield C, Davenport ES, Sivapathasundaram V, Allaker RP (2002)Возможная связь между инфекцией микроорганизмами амниотической жидкости и микрофлорой во рту. Br J Obstet Gynaecol 109: 527–533.
Диарея путешественников — Американский семейный врач
1. фон Зонненбург Ф., Торнипорт Н, Ваяки П, Лоу Б, Перуски Л.Ф. младший, Дюпон ХЛ, и другие. Риск и этиология диареи в различных туристических направлениях. Ланцет . 2000;356:133–4….
2. Кастелли Ф., Пеццоли С, Томасони Л. Эпидемиология диареи путешественников. J Travel Med .2001; 8 (прил. 2): S26–S30.
3. Хилл Др. Возникновение и самолечение диареи в большой когорте американцев, путешествующих в развивающиеся страны. Am J Trop Med Hyg . 2000; 62: 585–9.
4. Штеффен Р., Сак Р.Б. Эпидемиология. В: Ericsson CD, DuPont HL, Steffen R, eds. Диарея путешественников. Гамильтон, Онтарио: BC Decker, 2003: 112–23.
5. Цзян З.Д., Охуйсен ПК, Го округ Колумбия, Ей, Кинг ТМ, Дюпон ХЛ, и другие.Генетическая предрасположенность к энтероагрегационной диарее Escherichia coli: полиморфизм в промоторной области интерлейкина-8. J Заразить Dis . 2003; 188: 506–11.
6. Хоге CW, Шлим ДР, Эчеверрия П, Раджа Р, Херрманн Дж. Э., Кросс Дж. Х. Эпидемиология диареи среди иностранных жителей, живущих в высокоэндемичной среде JAMA . 1996; 275: 533–8.
7. Харди Р.М., Стена ПГ, Готт П, Бардан М, Бартлет ЛР.Инфекционная диарея у туристов, проживающих в пансионате. Внезапное заражение Dis . 1999; 5: 168–71.
8. Дэниелс Н.А., Нейманн Дж, Карпаты А, Парашар УД, Грин КД, Уэллс Дж. Г., и другие. Диарея путешественников в море: три вспышки переносимой через воду энтеротоксигенной кишечной палочки на круизных лайнерах. J Заразить Dis . 2000; 181:1491–5.
9. Ансделл В.Е., диск Эрикссон. Профилактика и эмпирическое лечение диареи путешественников. Med Clin North Am . 1999;83:945–73vi
10. Менса П., Йебоа-Ману Д, Овусу-Дарко К., Аблордей А. Уличная еда в Аккре, Гана: насколько она безопасна? Bull World Health Organ . 2002; 80: 546–54.
11. Адачи Дж.А., Мэтьюсон Дж.Дж., Цзян ЗД, компакт-диск Эрикссон, Дюпон ХЛ. Кишечные патогены в мексиканских соусах популярных ресторанов в Гвадалахаре, Мексика, и Хьюстоне, Техас. Энн Интерн Мед .2002; 136: 884–7.
12. Цзян З.Д., Лоу Б, Веренкар депутат, Эшли Д, Стеффен Р, Торнипорт Н, и другие. Распространенность кишечных патогенов среди международных путешественников с диареей, приобретенной в Кении (Момбаса), Индии (Гоа) или Ямайке (Монтего-Бей). J Заразить Dis . 2002; 185:497–502.
13. Адачи Дж.А., Цзян ЗД, Мэтьюсон Дж.Дж., Веренкар депутат, Томпсон С, Мартинес-Сандовал Ф, и другие.Энтероагрегатная кишечная палочка как основной этиологический агент диареи путешественников в 3 регионах мира. Клин Infect Dis . 2001; 32:1706–9.
14. Тейлор Д.Н., Хьюстон Р, Шлим ДР, Бхаибулая М, Унгар БЛ, Эчеверрия П. Этиология диареи у путешественников и иностранных жителей Непала. ДЖАМА . 1988; 260:1245–8.
15. Кушнер Р.А., Трофа АФ, Томас Р.Дж., Хоге CW, Питаранги С, Амато С, и другие.Использование азитромицина для лечения кампилобактериозного энтерита у путешественников, прибывающих в Таиланд, где преобладает устойчивость к ципрофлоксацину. Клин Infect Dis . 1995; 21: 536–41.
16. Хоге CW, Гамбель Дж. М., Шриджан А, Питаранги С, Эчеверрия П. Тенденции устойчивости к антибиотикам среди возбудителей диареи, выделенных в Таиланде, за 15 лет. Клин Infect Dis . 1998; 26: 341–5.
17. Сандерс Дж.В., Изенбаргер Д.В., Вальс СЭ, Панг Л.В., Скотт Д.А., Тамминга С, и другие.Обсервационное клиническое исследование диарейных заболеваний у военнослужащих США, дислоцированных в Таиланде: проявление и исход инфекции Campylobacter. Am J Trop Med Hyg . 2002; 67: 533–8.
18. Tauxe RV, Swerdlow DL, Hughes JM. Болезнь пищевого происхождения. В: Манделл Г.Л., Дуглас Р.Г., Беннетт Дж.Е., Долин Р., ред. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета. 5-е изд. Филадельфия: Черчилль Ливингстон, 2000: 1150–65.
19.Барбье ХМ, Диас Дж. Х. Профилактика и лечение токсикоинфекций морепродуктов у путешественников. J Travel Med . 2003; 10: 29–37.
20. Козицкий М, Стеффен Р, Шар М. «Вскипятить, сварить, очистить или забыть»: предотвращает ли это правило диарею путешественников? Int J Epidemiol . 1985; 14: 169–72.
21. Маттила Л., Сиитонен А, Кайронсеппа Х, Симула II, Пелтола Х. Рискованное поведение в отношении диареи путешественников среди финских путешественников. J Travel Med . 1995; 2: 77–84.
22. Бакер Х. Дезинфекция воды для международных путешественников и путешественников. Клин Infect Dis . 2002; 34: 355–64.
23. РендиВагнер П., Колларич Х. Медикаментозная профилактика диареи путешественников. Клин Infect Dis . 2002; 34: 628–33.
24. Штеффен Р., Хойссер Р, Дюпон ХЛ. Профилактика диареи путешественников неантибиотическими препаратами. Rev Infect Dis .1986; 8 (дополнение 2): S151–9.
25. Оксанен П.Я., Салминен С, Сакселин М, Хамалайнен П, Ихантола-Вормисто А, Муурасниеми-Исовиита Л, и другие. Профилактика диареи путешественников с помощью Lactobacillus GG. Энн Мед . 1990; 22:53–6.
26. Хилтон Э, Колаковский П, певица С, Смит М. Эффективность Lactobacillus GG в качестве профилактики диареи у путешественников. J Travel Med .1997; 4:41–3.
27. Всемирная организация здравоохранения. Некачественные и поддельные лекарства. Информационный бюллетень №. 275, ноябрь 2003 г. Доступ онлайн 6 апреля 2005 г. по адресу: http://www.who.int/mediacentre/factsheets/2003/fs275.
28. Де Брюйн Г., Хан С, Борвик А. Лечение антибиотиками диареи путешественников. Кокрановская система базы данных, версия . 2005;(1):CD002242.
29. Шлим ДР. Самодиагностика и лечение диареи путешественников. В: Keystone JS, Kozarsky PE, Freedman DO, Nothdurft HD, Connor BA, eds.Медицина путешествий. Сент-Луис: Мосби, 2003: 201–4.
30. Компакт-диск Ericsson. Диарея путешественников: эпидемиология, профилактика и самолечение. Заразить Dis Clin North Am . 1998; 12: 285–303.
31. Салам I, Кателарис П, Ли-Смит С., Фартинг МДж. Рандомизированное исследование однократной дозы ципрофлоксацина при диарее путешественников. Ланцет . 1994; 344:1537–9.
32. Адачи Дж.А., компакт-диск Эрикссон, Цзян ЗД, Дюпон МВ, Мартинес-Сандовал Ф, Книрш С, и другие.Было обнаружено, что азитромицин сравним с левофлоксацином при лечении путешественников из США с острой диареей, приобретенной в Мексике. Клин Infect Dis . 2003; 37: 1165–71.
33. DuPont HL, Mattila L. Противомикробное лечение: алгоритмический подход. В: Ericsson CD, DuPont HL, Steffen R, eds. Диарея путешественников. Гамильтон, Онтарио: BC Decker, 2003: 227–37.
34. Адачи Дж.А., Остроски Цейхнер Л, Дюпон ХЛ, диск Эрикссон. Эмпирическая антимикробная терапия диареи путешественников. Клин Infect Dis . 2000;31:1079–83.
35. Дюпон HL, Цзян ЗД, компакт-диск Эрикссон, Адачи Дж.А., Мэтьюсон Дж.Дж., Дюпон МВ, и другие. Рифаксимин в сравнении с ципрофлоксацином для лечения диареи путешественников: рандомизированное двойное слепое клиническое исследование. Клин Infect Dis . 2001; 33: 1807–15.
36. Штеффен Р., Мешок Д.А., Риопель Л, Цзян ЗД, Штурхлер М, компакт-диск Эрикссон, и другие.Терапия диареи путешественников рифаксимином на разных континентах. Am J Гастроэнтерол . 2003;98:1073-8.
37. Штауффер В.М., Коноп Р.Ж., Камат Д. Путешествие с младенцами и маленькими детьми. Часть III: диарея путешественников. J Travel Med . 2002; 9: 141–50.
38. Мерфи Г.С., Бодхидатта Л, Эчеверрия П, Тансупасвадикул С., Хоге CW, Имларп С, и другие. Ципрофлоксацин и лоперамид в лечении бациллярной дизентерии. Энн Интерн Мед . 1993; 118: 582–6.
39. Тейлор Д.Н., Санчес Дж.Л., Кэндлер В, Торнтон С, Маккуин С, Эчеверрия П. Лечение диареи путешественников: ципрофлоксацин плюс лоперамид по сравнению с монотерапией ципрофлоксацином. Плацебо-контролируемое рандомизированное исследование. Энн Интерн Мед . 1991; 114:731–4.
40. Каэйро Дж. П., Дюпон ХЛ, Альбрехт Х, диск Эрикссон. Пероральная регидратационная терапия плюс лоперамид по сравнению с одним лоперамидом при лечении диареи путешественников. Клин Infect Dis . 1999; 28:1286–9.
41. Питцингер Б, Стеффен Р, Чопп А. Заболеваемость и клинические особенности диареи путешественников у младенцев и детей. Pediatr Infect Dis J . 1991; 10: 719–23.
42. Самуэль БУ, Барри М. Беременная путешественница. Заразить Dis Clin North Am . 1998; 12: 325–54.
43. Лекарства от паразитарных инфекций. Med Lett Drugs Ther .2004; 46:1–12.
Послеродовой метициллин-резистентный золотистый стафилококк Синдром токсического шока, вызванный инфекцией промежности
Хотя синдром токсического шока (СТШ) встречается редко, полиорганная недостаточность может возникнуть без раннего выявления и соответствующей терапии. В частности, сообщалось о нескольких случаях послеродового СТШ, вызванного устойчивым к метициллину Staphylococcus aureus (MRSA). Здесь мы описываем редкий случай, когда у 32-летней японки был СТШ из-за MRSA, вызванного инфекцией промежности после нормальных вагинальных родов.Через 12 дней после рождения здорового ребенка она была повторно госпитализирована в нашу больницу из-за 2-дневной лихорадки и болей в промежности без болезненности матки. В ночь госпитализации у нее развилась рвота и водянистая диарея. На второй день над туловищем появилась разлитая кожная пятнистая сыпь. Лабораторные данные выявили ухудшение функции почек и тромбоцитопению. Ее анамнез и клинические результаты были совместимы с типичным течением СТШ. Назначение цефтриаксона и клиндамицина было начато сразу после поступления и было эффективным.Пациент стабильно выздоравливал в течение следующей недели с шелушением кожи. MRSA был выделен из ее вагинальных выделений, и было обнаружено, что он продуцирует токсин 1 TSS (TSST-1). Кроме того, поскольку MRSA не был обнаружен в носовой и вагинальной полости во время беременности, можно предположить, что вагинальная колонизация может происходить и после родов и быть источником заболевания у матерей. Поэтому инфекции MRSA следует учитывать при лечении послеродового СТШ.
1. Введение
Синдром токсического шока (СТШ) характеризуется высокой температурой, эритематозной сыпью с последующим шелушением кожи, шоком и поражением многих органов. Впервые о нем сообщили Todd et al.в 1978 г. [1]. Хотя СТШ встречается преимущественно у менструирующих женщин, доля случаев, не связанных с менструацией, неуклонно растет с 1980 г. [2]. Устранение с рынка тампонов с высокой впитывающей способностью резко снизило частоту менструального СТШ. В результате примерно половина всех зарегистрированных случаев СТШ в настоящее время не имеют менструального цикла. Неменструальный СТШ может возникать из-за использования барьерных контрацептивов, вагинальных родов и кесарева сечения, хирургических и послеродовых раневых инфекций, мастита, септоринопластики (особенно при использовании назального тампона), синусита, артрита, ожогов, кожных и подкожных поражений (включая абсцессы, язвы). и целлюлит), респираторные инфекции после гриппа и энтероколиты.В большинстве случаев СТШ, связанный с хирургической или раневой инфекцией, может возникать при отсутствии каких-либо признаков явной инфекции [3].
Хотя известно, что СТШ связан со стафилококковыми инфекциями практически в любых местах и в различных условиях, сообщения о СТШ, вызванном метициллин-резистентным штаммом Staphylococcus aureus (MRSA), редки. Поиск в MEDLINE с 1966 по 2017 год выявил только два случая (мастит и эндометрит; таблица 1) послеродового СТШ, вызванного MRSA; однако нет сообщений о послеродовом MRSA-TSS, вызванном разрывами промежности [4, 5].Здесь мы сообщаем о редком случае послеродового MRSA-TSS, обнаруженного в крошечном разрыве промежности.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.Презентация случая
32-летняя японка (беременность 4, пункт 3) без истории болезни поступила в нашу больницу для срочных родов. У нее были нормальные вагинальные роды здорового ребенка на 39 неделе беременности, и ей был наложен шов первой степени разрыва промежности на левой стороне наружного отверстия уретры. После родов она использовала промежностную прокладку и не использовала интравагинальные тампоны. Кроме того, во время госпитализации у нее не было лихорадки и боли в ране. Она чувствовала себя хорошо и была выписана на пятый день.
Через 12 дней после родов у нее в анамнезе 2-дневная лихорадка 40oC и очаговая боль в промежности. При физикальном обследовании пациент был в сознании, но у него были артериальная гипотензия (88/56 мм рт. ст.), тахикардия (144 удара в минуту) и тахипноэ (23 вдоха в минуту). Температура ее тела была 40,2°С. Результаты абдоминального исследования были нормальными, а тазовое исследование показало, что матка и влагалище не болезненны. Хотя наружные половые органы вокруг рваной раны сопровождались болью и лихорадкой, покраснение и припухлость отсутствовали.Лабораторные данные выявили аномальные результаты; у нее был нейтрофильный лейкоцитоз (лейкоциты были 19 600/мм 3 с 96,1% нейтрофилов, 1,2% лимфоцитов и 2,4% моноцитов), гипопротеинемия (6,6 г/дл) и гипоальбуминемия (3,6 г/дл). Кроме того, концентрация электролитов в сыворотке была ненормальной: натрий 136 мэкв/л; калий 3,2 мэкв/л; хлорид, 97 мэкв/л; кальций, 8,2 мг/дл; фосфат 3,7 мг/дл; магний, 1,5 мг/дл.
Ей проводилась агрессивная инфузионная терапия внутривенным введением жидкости и антимикробная терапия внутривенным введением цефтриаксона (2 г каждые 12 часов).При поступлении перед назначением антибиотиков выполняли посев влагалища, мочи, кала и крови. В ночь госпитализации у нее развилась рвота и водянистая диарея. На второй день госпитализации над туловищем появилась диффузная кожная пятнистая сыпь. Лабораторные показатели указывали на легкое нарушение функции почек (АМК 19,5 мг/дл, креатинин 0,93 мг/дл и рСКФ 57,40), а также у нее был лейкоцитоз (лейкоциты 13 400/ µ л), тромбоцитопения (тромбоциты 124 000/ µ л), гипербилирубинемия (общий билирубин 3.01 мг/дл) и повышенный уровень креатинкиназы (319 МЕ/л). Поскольку эти симптомы и результаты были совместимы с типичным течением СТШ, к антибактериальной терапии был также добавлен клиндамицин. На 4-й день госпитализации шелушение на ладонях и пальцах убедительно свидетельствовало о диагнозе СТШ. Кроме того, бактериологические результаты показали, что TSS был вызван устойчивым к метициллину Staphylococcus aureus. Хотя посев мочи, стула и крови был отрицательным, посев из влагалища показал значительный рост MRSA с резким сокращением генитальной флоры, устойчивой к цефтриаксону, но чувствительной к клиндамицину.Мы регулярно тестируем носовые и вагинальные культуры во время беременности, но никаких бактерий, включая MRSA, не обнаружено.
Исход лечения благоприятный. На 5-й день госпитализации показатели жизнедеятельности нормализовались, исчезла эритематозная кожная сыпь, разрешились биологические аномалии. Выписана по окончании 11-дневного курса антибиотикотерапии (цефтриаксон 7 дней, клиндамицин 11 дней). После выписки были получены результаты анализа на токсины TSS. MRSA был выделен из вагинального секрета, и было обнаружено, что он продуцирует токсин-1 TSS (TSST-1).Через месяц после выписки рецидивов не было, ребенок чувствует себя хорошо, инфекционных заболеваний нет.
3. Обсуждение
СТШ является острым жизнеугрожающим заболеванием, и его раннее выявление важно для обеспечения соответствующего лечения. Текущие диагностические критерии СТШ публикуются Центрами по контролю и профилактике заболеваний (CDC). Существует пять клинических критериев для диагностики СТШ без оценки на стрептококковые инфекции: лихорадка более 38.9°C, сыпь, шелушение кожи, артериальная гипотензия и поражение трех или более систем органов, включая желудочно-кишечный тракт, мышечную систему, слизистые оболочки, почки, печень, гематологическую и центральную нервно-неврологическую системы. Кроме того, СТШ может быть подтвержден следующими лабораторными критериями: отрицательные результаты на пятнистую лихорадку Скалистых гор, корь или лептоспироз в культурах крови, горла и спинномозговой жидкости (культуры крови могут быть положительными на S. aureus ) [6]. В данном случае пациент почти соответствовал клиническим критериям СТШ, за исключением шелушения кожи при поступлении; у нее была лихорадка, сыпь, гипотензия и поражение как минимум трех систем органов (рвота, диарея, повышение уровня креатинкиназы, острая почечная недостаточность и тромбоцитопения).Шелушение ладоней и пальцев на 4-й день госпитализации сделало диагноз СТШ определенным.
В большинстве случаев СТШ, связанного с хирургическим вмешательством или раневыми инфекциями, в месте репликации S. aureus практически отсутствуют признаки воспаления. Поэтому требуется тщательное обследование, поскольку отсроченная диагностика СТШ связана с повышенной заболеваемостью и смертностью [4]. У этой пациентки не было признаков предшествующей внутриутробной инфекции и использования послеродовых тампонов в анамнезе.Кроме того, у нее отсутствовали клинические симптомы внутриутробных инфекций, такие как боль и болезненность в области матки или аномальные лохии.
Послеродовой MRSA-TSS встречается редко, и, насколько нам известно, в англоязычной литературе сообщалось только о 2 случаях послеродового MRSA-TSS (таблица 1) [4, 5]. В нашем случае вагинальная колонизация MRSA или крошечная рана на малых половых губах считалась причиной TSS, поскольку при гинекологическом осмотре было мало признаков инфекции, за исключением наличия боли.Хотя послеродовой MRSA-TSS встречается редко, необходимо провести тщательное обследование, поскольку он может быть вызван вагинальной колонизацией MRSA или только крошечной раной.
S. aureus , включая MRSA, часто колонизируют передние отделы носа человека. Недавние данные национального исследования, проведенного в период с 2001 по 2004 год в Соединенных Штатах, показали, что распространенность колонизации носа MRSA увеличивается (с 0,8% до 1,5% населения), несмотря на общее снижение колонизации носа S. aureus .Факторы риска колонизации носа MRSA среди населения в целом включают мужской пол, ограниченное обращение за медицинской помощью, возраст 60 лет и старше, диабет и бедность [7]. В двух недавних исследованиях распространенности, проведенных в Соединенных Штатах, сообщалось о частоте ректовагинальной колонизации MRSA 0,5–3,5% во время беременности [8, 9]. однако MRSA не был обнаружен в носовой и вагинальной полости нашей пациентки во время беременности. Нельзя исключать возникновение инфекции во время ее пребывания в больнице после родов.Таким образом, мы должны учитывать факторы риска заражения MRSA в медицинских учреждениях. Передача токсин-продуцирующего MRSA в родильных отделениях среди женщин и/или новорожденных описана при неонатальных СТШ-подобных экзантематозных заболеваниях [10-12]. Руководящие принципы CDC рекомендуют использовать контактные меры предосторожности, такие как использование халатов и перчаток при прямом контакте с пациентами и их окружением, для пациентов, которые являются носителями MRSA или инфицированы MRSA [13].
Раннее выявление СТШ важно для обеспечения соответствующего лечения.Эта терапия должна включать быстрое дренирование пораженного участка для контроля текущей продукции токсина, использование противомикробной терапии, нацеленной на S. aureus (например, клиндамицин для ингибирования синтеза белка и дальнейшей продукции токсина и ванкомицин, если возбудителем является MRSA), и поддерживающая терапия, включая инфузионную реанимацию и прессорную поддержку, если это необходимо.


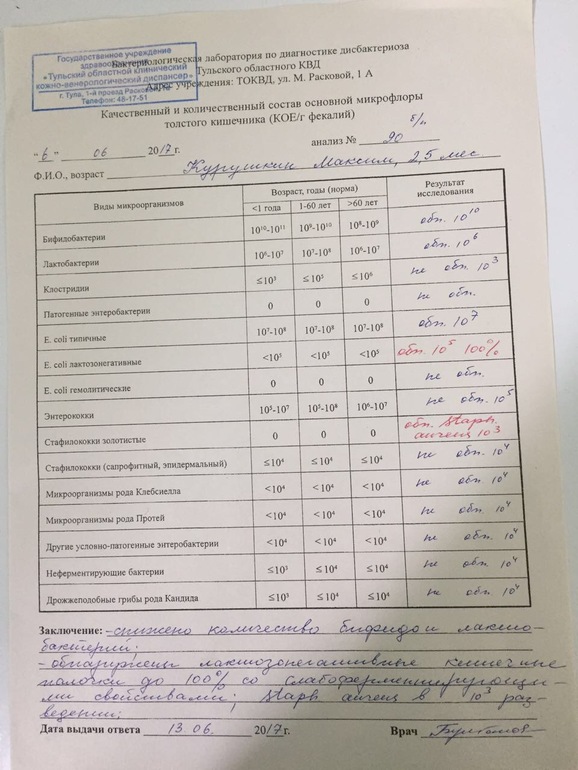
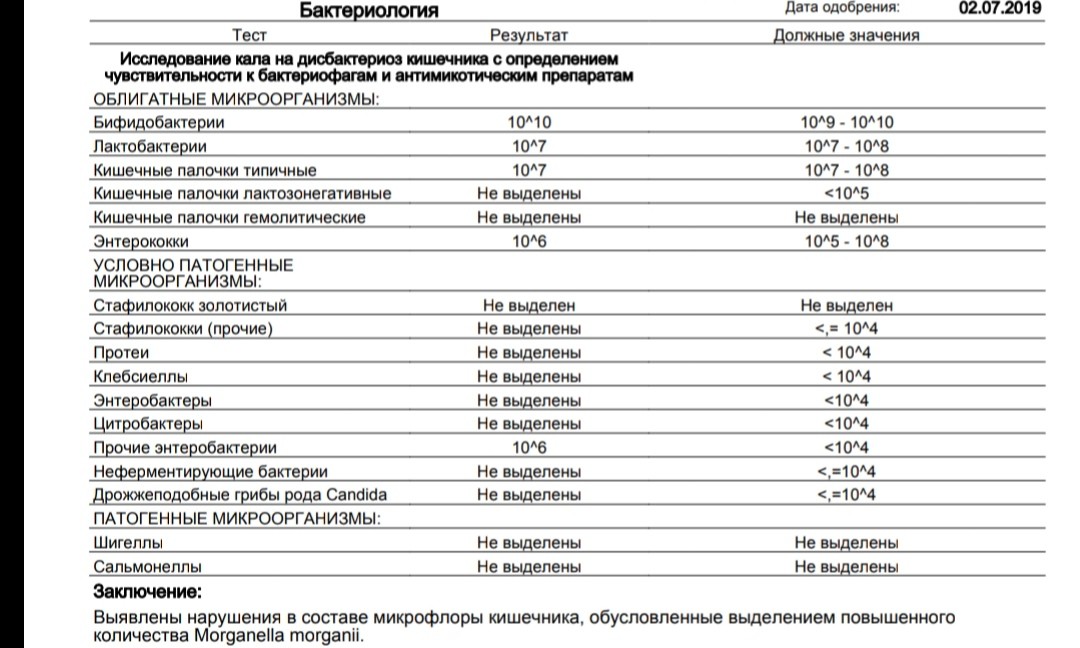 Не случайно кишечник в нашем списке оказался на последнем месте. Сюда стафилококку труднее всего пробраться, к тому же, иммунная система на этом участке самая сильная. Но есть несколько факторов, которые по одну сторону баррикад со стафилококком – это дисбактериоз. Он то и создает положительную среду для размножения и действия микроорганизма.
Не случайно кишечник в нашем списке оказался на последнем месте. Сюда стафилококку труднее всего пробраться, к тому же, иммунная система на этом участке самая сильная. Но есть несколько факторов, которые по одну сторону баррикад со стафилококком – это дисбактериоз. Он то и создает положительную среду для размножения и действия микроорганизма.
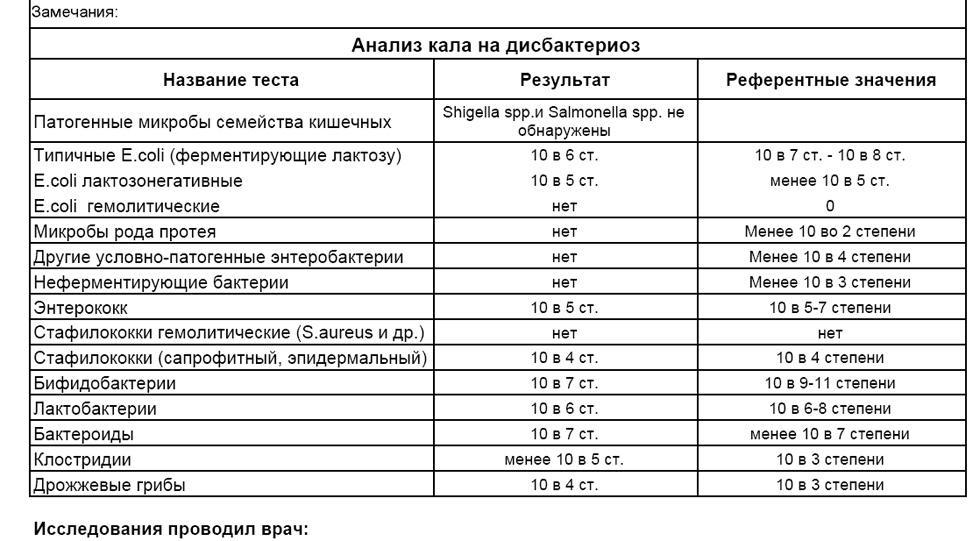
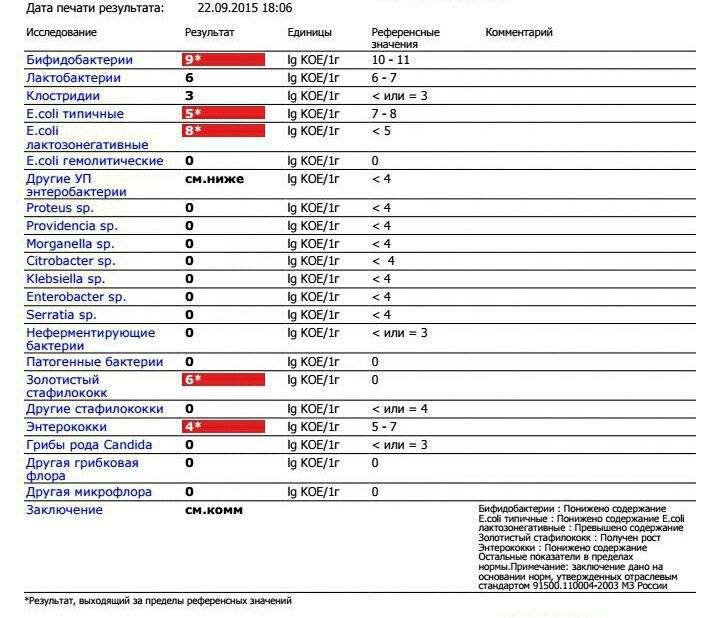
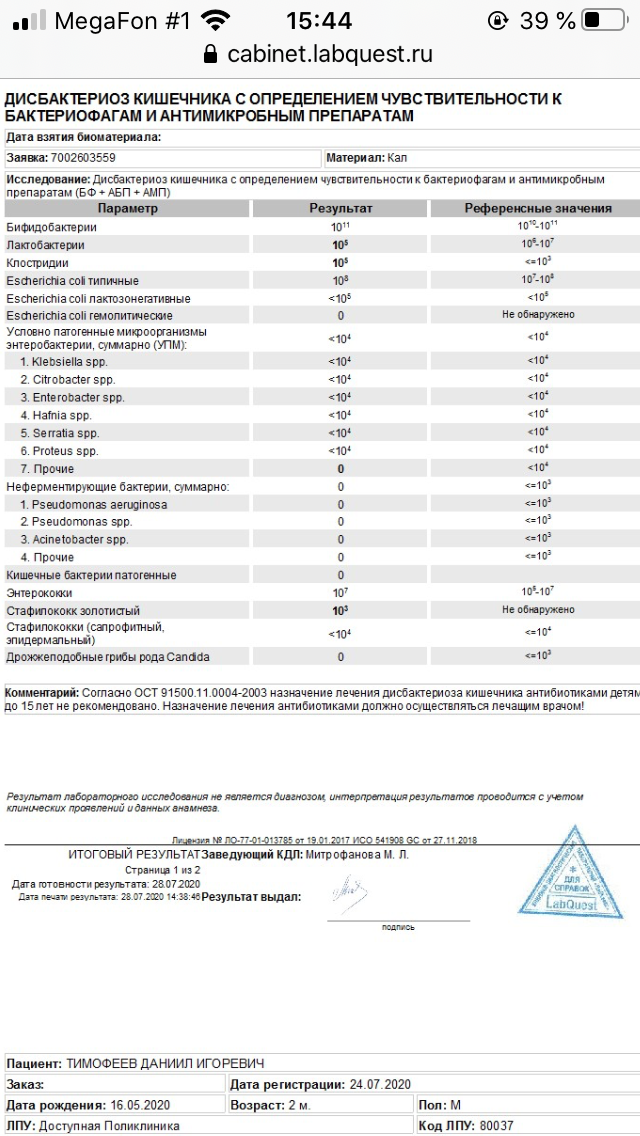
 — Если фекалии жидкие, контейнер заполняют не более чем на 1/3 объема.
— Если фекалии жидкие, контейнер заполняют не более чем на 1/3 объема.

 Кожа крохи краснеет и покрывается пузырями, внутри которых находится гной. Затем они лопаются и инфицируют соседние участки кожи, а на их месте остаются ранки. Это очень заразное состояние, при котором ребенок очень мучается. В некоторых случаях пузырчатка приводит к летальному исходу.
Кожа крохи краснеет и покрывается пузырями, внутри которых находится гной. Затем они лопаются и инфицируют соседние участки кожи, а на их месте остаются ранки. Это очень заразное состояние, при котором ребенок очень мучается. В некоторых случаях пузырчатка приводит к летальному исходу.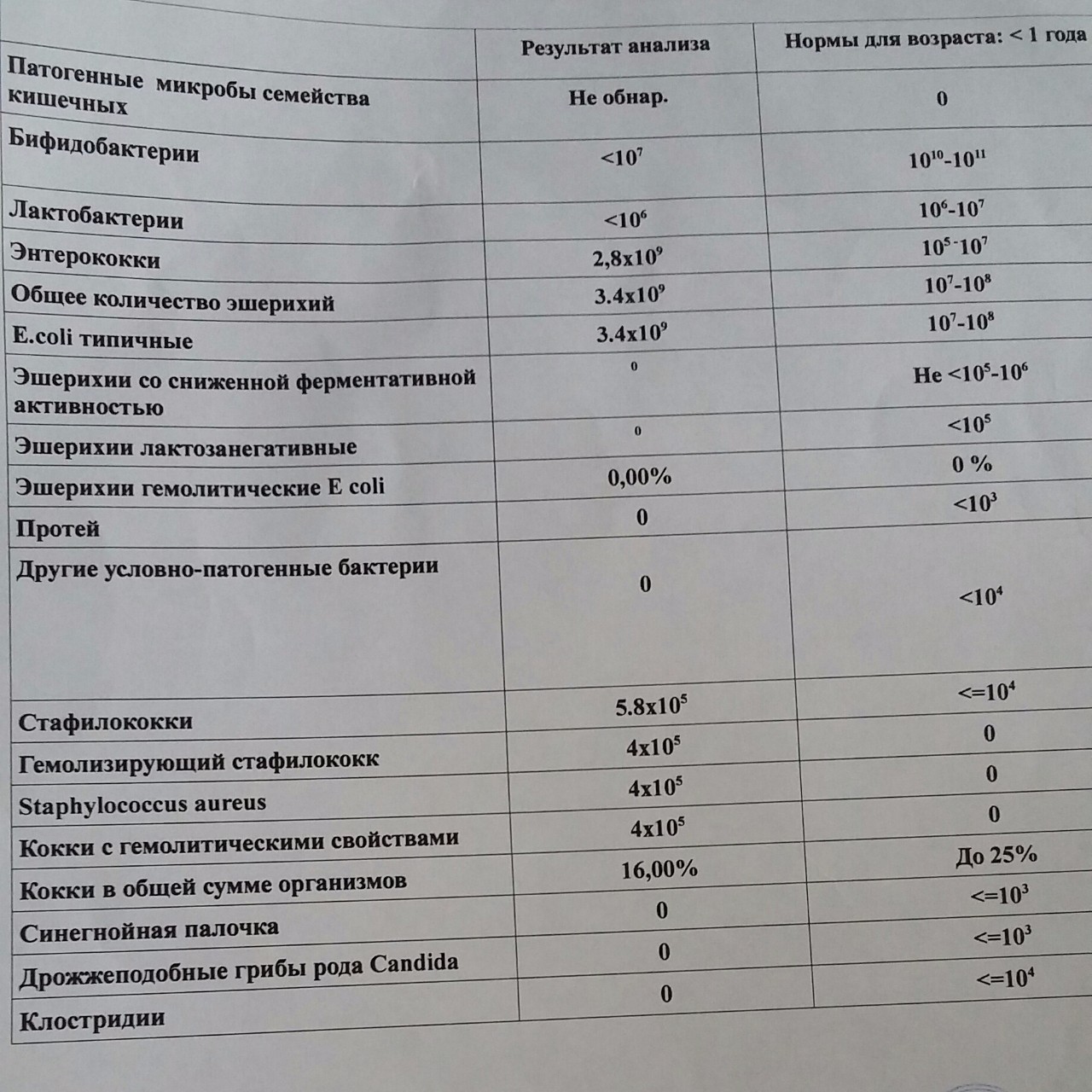 Если не оказать своевременное лечение, может возникнуть такое осложнение как кератит глазного яблока, а впоследствии частичная или полная слепота.
Если не оказать своевременное лечение, может возникнуть такое осложнение как кератит глазного яблока, а впоследствии частичная или полная слепота.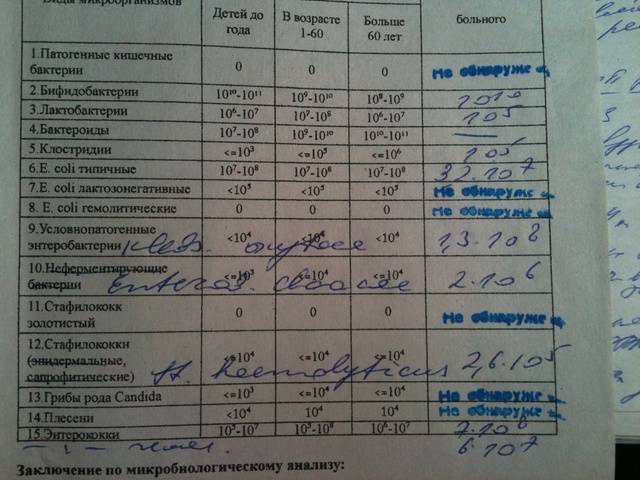
 Также такое лечение опасно для грудничков, поэтому к нему прибегают только в случаях, когда другая терапия не помогает. Доктор Комаровский считает, что если у ребенка плохие анализы, но у него хорошее самочувствие, грудничок активный, у него нормальный стул и он хорошо набирает в весе, значит, нет никакой необходимости в лечении, организм борется с микробом, и сам с ним справляется.
Также такое лечение опасно для грудничков, поэтому к нему прибегают только в случаях, когда другая терапия не помогает. Доктор Комаровский считает, что если у ребенка плохие анализы, но у него хорошее самочувствие, грудничок активный, у него нормальный стул и он хорошо набирает в весе, значит, нет никакой необходимости в лечении, организм борется с микробом, и сам с ним справляется.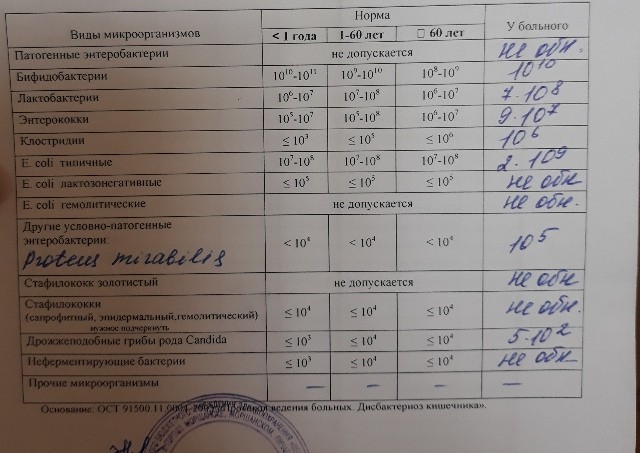 Параллельно с таким препаратом назначают еще бифидо- и лактобактерии, нормализующие микрофлору кишечника.
Параллельно с таким препаратом назначают еще бифидо- и лактобактерии, нормализующие микрофлору кишечника.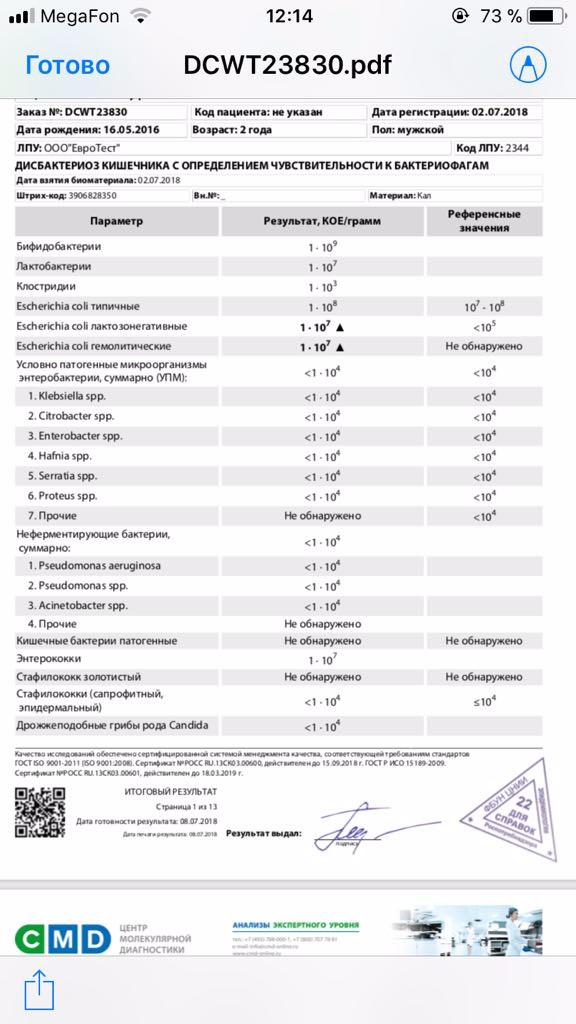 aureus , выделенных от матерей и младенцев в этом исследовании.
aureus , выделенных от матерей и младенцев в этом исследовании..jpg)
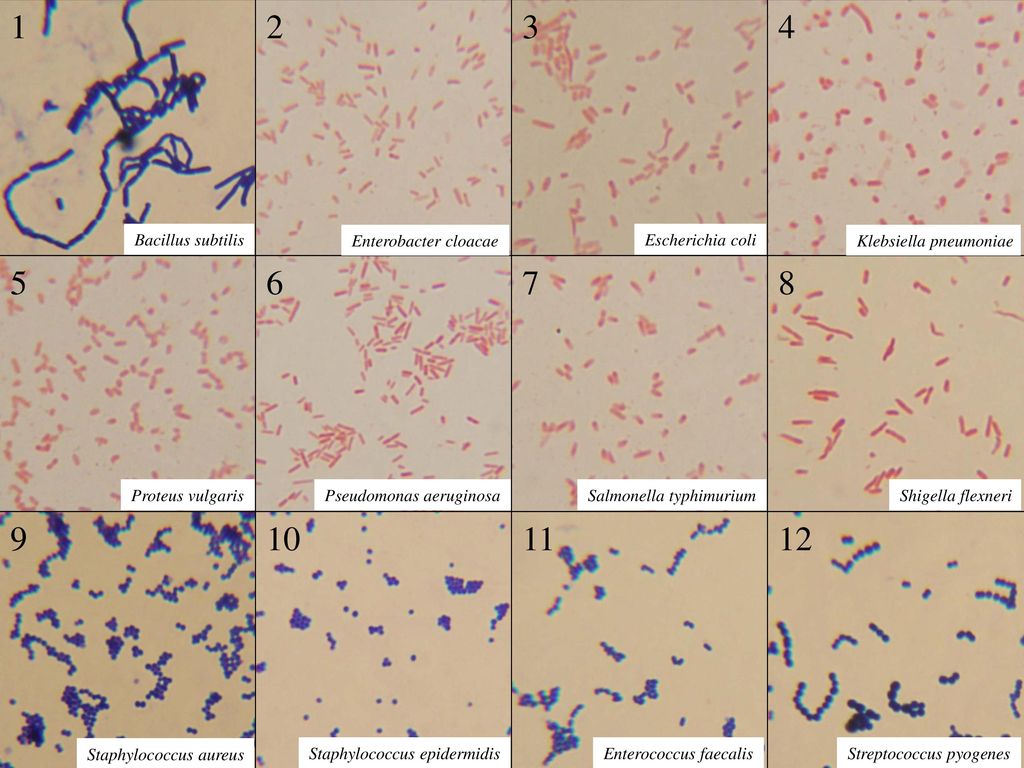 (2010) Сравнительный анализ фекальной микробиоты у детей раннего возраста с экземой и без нее. ПЛОС ОДИН 5: e9964.
(2010) Сравнительный анализ фекальной микробиоты у детей раннего возраста с экземой и без нее. ПЛОС ОДИН 5: e9964. , Тайс С., Винк С., Стельма Ф.Ф., Снейдерс Б. и др.(2006) Факторы, влияющие на состав кишечной микробиоты в раннем младенчестве. Педиатрия 118: 511–521.
, Тайс С., Винк С., Стельма Ф.Ф., Снейдерс Б. и др.(2006) Факторы, влияющие на состав кишечной микробиоты в раннем младенчестве. Педиатрия 118: 511–521.