Золотистый стафилококк в кале у маленького ребенка
Уставшие родители уже сбились с ног в поисках причины постоянных болезней своего малыша. То горло, то кашель, то бронхит снова диагностировали. А закончилось пневмонией со всеми вытекающими последствиями.
Почему же так тяжело вылечить ребенка? Как справиться со скачками температуры, постоянным расстройством кишечника и рвотными позывами?
Он же еще совсем малыш, а в больнице бывает чаще, чем дома… Может, все-таки, причину недомогания ищут совсем не там, где нужно?
Последняя надежда – дополнительные анализы на патогенные бактерии и микроорганизмы в кале и крови ребенка. Именно эти анализы и раскроют полную картину состояния здоровья крохи и помогут составить алгоритм эффективного лечения. Лечения против…золотистого стафилококка.
Мнение эксперта
Ковалева Елена Анатольевна
Врач-Лаборант. Опыт работы в клинико-диагностической службе 14 лет.
Задать вопрос экспертуДа, именно эта бактерия продолжительное время подрывала иммунитет малыша и угрожала его жизни. Но откуда он взялся? Почему не диагностировали сразу? И как вылечить эту гадость?
Золотистый стафилококк — что же это такое?
Золотистый стафилококк – это патогенный микроорганизм, бактерия, которая может быть обнаружена даже у новорожденного.
Особая опасность заболевания состоит в том, что поражает оно самые разные органы и системы организма, активизируется там и, практически, ничем не отличается от известных болезней (бронхита, ОРВИ, отравления и, даже, пневмонии).
Кроме того, бактерия имеет несколько стадий инфицирования, от которых также зависит постановка правильного диагноза:
- Ранняя стадия: симптомы проявляются в течение 3-4 часов после того, как микроорганизм активизируется. Сопровождается данная форма высокой температурой, диареей, рвотой, общей слабостью и отсутствием аппетита.
- Поздняя стадия: признаки инфицирования проявляются лишь через несколько дней, но заражение организма гораздо обширнее (кровь, внутренние органы, кожа).
Главные симптомы появления микроорганизмов
Характерное отличие данной бактерии от других известных состоит в том, что она, либо очень бурно активизируется, либо вообще бессимптомно.
То есть, ребенок может быть инфицирован, даже переносить этот вредоносный микроорганизм, но внешне выглядеть абсолютно здоровым.
Исключением может стать небольшое высыпание на коже
Если же бактерия поразила внутренние органы, следует обратить особенное внимание на следующие признаки:
- рвотные позывы;
- понос;
- температура;
- слабость;
- иногда кашель и утрудненное дыхание.
Причины появления вируса в организме
Многие доктора утверждают, что золотистый стафилококк можно обнаружить в кале любого человека, тем более ребенка.
Но, при этом является важным его количество. Ведь, минимальные показатели – это совсем не повод для паники и приема антибиотиков.
Следует еще учитывать общее состояние больного, то есть, подходит ли оно под основную симптоматику.
Ребенок рвет, температурит, совершенно обессилен, а анализы кала зашкаливают от концентрации в нем стафилококковой инфекции? Реагировать стоит мгновенно и лучше в условиях стационара.
Если же кроху ничего не беспокоит, то лучше заняться его иммунитетом. Ведь именно от последнего зависят дальнейшие действия бактерии. И, конечно же, особое внимание принадлежит личной гигиене.
Стафилококк 10 в 3 степени
Стафилококк 10 в 3 степени – довольно частое явление у маленьких детей. И на свой вопрос «что же делать?», молодые родители могут получить странный ответ «ничего».
Это объясняется безопасностью данной степени, которая довольна относительна.
Мнение эксперта
Ковалева Елена Анатольевна
Врач-Лаборант. Опыт работы в клинико-диагностической службе 14 лет.
Задать вопрос экспертуДа, у ребенка, могут быть поражены слизистая, кожа, кишечник, носовые пазухи, другие органы и ткани. Но при резком снижении иммунитета опасность будет более чем серьезной.
Именно об этом следует помнить и незамедлительно заняться пополнением витаминных резервов организма.
Что означает 10 в 4 степени?
Часто приравнивается к 10 в 3 степени. Отличие состоит лишь в том, что протекает она часто бессимптомно, провоцируя лишь высыпания на коже, незначительные воспаления дыхательных путей и глаз.
Если вовремя не обнаружить заболевание, то следующими могут быть поражены сердце и опорно-двигательный аппарат.
Методика лечения такая же, как 10 в 3 степени: укрепляем иммунитет, не допускаем активизации бактерии и тщательно следим за симптоматикой и результатами анализов.
10 в 5 степени — как расшифровывается?
Такая степень наличия золотистого стафилококка в кале заставляет задуматься об эффективном лечении ребенка. Но и в этом случае огромную роль играет видимая симптоматика.
У грудничков это боли в животике, зеленый пенистый стул, кожные высыпания (атопический дерматит) и метеоризм. У деток немного постарше может наблюдаться утрудненный и редкий стул, прыщи, фурункулы.
В качестве лечения, скорее всего, будут назначены пробиотики, витаминные комплексы и препараты для укрепления иммунитета.
Если содержание микроорганизмов 10 в 6 степени?
Казалось бы, такая степень требовала бы уже немедленной терапии. Но и в этом случае врачи не рекомендуют спешить с антибиотиками и другими сильными препаратами.
Лучшей тактикой будет укрепление иммунитета с помощью дополнительных источников витаминов и полезных микроэлементов.
А, также, попутно устранять «побочные эффекты» активизации золотистого стафилококка: высыпание, кашель, воспаление слизистой, диарея, тошнота и воспаление толстого кишечника. Только после такой
Лечение непростого недуга
Основным требованием к лечению золотистого стафилококка является постоянное наблюдение врача. И четкое следование его рекомендациям:
- Антибиотики в данном случае неэффективны, так как бактерии золотистого стафилококка к ним устойчивы.
- Более всего восприимчив патогенный микроорганизм к антисептическим средствам, если поражены слизистые оболочки. Положительный результат дадут также зеленка, фукорцин и раствор хлорофиллипта.
- Бактериофаги же помогут окончательно «изгнать» стафилококк.
Не следует забывать и о диете, а именно ограничить потребление глюкозы, которое является катализатором размножения патогенных бактерий.
Каковы последствия — чем это может обернуться?
В первую очередь, от инфицирования стафилококком страдает весь организм, так как провоцирует он очень серьезные заболевания.
Мнение эксперта
Ковалева Елена Анатольевна
Врач-Лаборант. Опыт работы в клинико-диагностической службе 14 лет.
Задать вопрос экспертуСамым же опасным считается стафилококковый сепсис, который часто заканчивается летальным исходом.
Автор статьи
Врач-Лаборант. Опыт работы в клинико-диагностической службе 14 лет.
Написано статей
61
Отличная статья 1
Страшная сказка о стуле и стафиллококке у ребенка — 30 ответов на Babyblog
Модераторы,извините, если отнесла не в ту категорию! Очень интересная статья о детском стуле,дисбактериозе и стафилококке.
Страшная сказка о стафилококке. Возвращаясь к той же теме.
Сколько бы я ни отвечала, сколько бы ни говорила о том, что наличие стафилококка и клиника стафилококковой инфекции — это не одно и тоже, поток вопросов не становится меньше. Многие наши участковые врачи толи от нежелания искать истинную причину, толи от незнания понятий о микробиологии — списывают сыпи, аллергии, дерматиты, жидкие и(ли) зеленые стулы, запоры, поносы, икоты, рвоты, нарушение сна, аппетита, поведения, развития (нужное из представленного подчеркнуть) — загадочным и в тоже время всеобъемлющим диагнозом «ДИСБАКТЕРИОЗ». И начинают пичкать несчастные маленькие создания тоннами препаратов начиная от пробиотиков кончая кишечными антисептиками. В лучшем случае — толку нет, в худшем прибавляются новые напасти. И о боже!!!! В стуле высеян стафилококк!!!
Тут же строчатся в форум вопросы: «У нас стафиллококк в носу, в зеве, в попе (выберите нужное сами)! что же нам делать!?». И мамы делают круглые глаза и крутят у виска, когда я им говорю — «ну и что? Ничего не делать». Вы спросите почему? Да потому что сам по себе стафилококк никакой опасности для вашего малыша не представляет. Особенно это касается тех детей, которых мамы кормят грудью. Объясню популярно.
В период внутриутробного развития желудочно-кишечный тракт (ЖКТ) плода стерилен. Там нет никаких бактерий и других микроорганизмов. Когда ребенок рождается, ЖКТ заселяется, или колонизируется, бактериями, которые попадают ему в рот во время прохождения через родовые пути матери. Бактерии могут также попасть ребенку из материнского стула во время родов. Именно так создается нормальная и здоровая микрофлора кишечника. После рождения ЖКТ ребенка заселяется бактериями, которые находятся в окружающей среде, во рту и на коже матери. Это происходит во время кормления грудью, при поцелуях и прикосновениях к ребенку.
Стафилококки являются очень распространенными микробами, и мы знакомимся с ними буквально с рождения. Стафилококки (особенно S. epidermidis) представляют собой представителей нормальной микрофлоры кожного покрова человека, дыхательных путей и тракта пищеварения; их также регулярно находят в воздухе и окружающей среде.
Здоровая мама — здоровый малыш. При появлении на свет бактерии начинают проникать в организм новорожденного: в кишечник, желудок, на кожу, это нормальный процесс — происходит адаптация малыша к окружающей среде. Если сама мама здорова, беременность и роды прошли гладко, значит, у ребенка флора будет в норме. Соответственно — при первом же контакте ребенка с окружающей средой его организм (в том числе и кишечник с носоглоткой — откуда и высевают их потом особо желающие лечиться товарищи) начинает знакомство с этим микробом. Соответственно иммунная система вырабатывает антитела, препятствующие размножению стафилококка и сдерживает его активацию. А если ребенок грудничок, тогда он защищен вдвойне, потому как на помощь собственным антителам спешат антитела, которые выработала мама и передает малышку со своим молочком. Отсюда какой напрашивается вывод, а??? Самое лучшее средство борьбы и профилактика стафилококковой инфекции это грудное вскармливание. В принципе и искусственники могут спокойно сосуществовать с стафилококками, при условии правильно организованного питания и ухода. Потому кА иммунная система ребенка начинает работать с самого его рождения и борьбу со всеми условно-патогенными микробами ведет постоянно.
Так и живут они мирно и дружно — стафилококк и организм — и будут жить и далее, если им не мешать своими якобы лечебными мерами и ковыряниями в какашках абсолютно нормального ребенка.
Лечат стафилококковую инфекцию, а не стафилококк (в частности). Очень (!) важно — всегда следует разграничивать такие понятия, как стафилококк и стафилококковая инфекция (о ней речь пойдет в конце моего повествования). Обнаружение стафилококка при отсутствии реальных симптомов болезни — вовсе не повод к незамедлительному глотанию лекарств.
Дорогие мои родители — стафилококковая инфекция очень отличается по клинике от того, что лечите вы. Наличие бумажки с написанными в ней стафилококками в какой-то степени и зеленые каки в памперсе малыша не повод к активным боевым действиям. Факторов влияющих на стул малыша и на его изменение много.
Многие микроорганизмы (в том числе и золотистый стафилококк) в норме живут на различных участках тела человека (включая и маленького ребенка). Это кишечник, кожа, рот, нос, глотка, уши, слизистая глаз. И инфекции не вызывают. Их и называют — нормальная микрофлора. Но попав в несоответствующие условия, они могут вызвать заболевание. Стафилококк, попадая например в рану, может вызвать нагноение. Поэтому эти микроорганизмы названы условно-патогенными. Эти микробы не приносят в норме вреда, так как живут в сообществе других микроорганизмов и там все друг друга взаимно сдерживают.
Стафилококк в кале? Не паниковать!
Стафилококк в кишечнике — это нормально, если нет клинических тревожных (температура, гнойники на коже, стул с кровью) проявлений. Ребенок прекрасно сосет грудь, у него нормальный стул, он хорошо прибавляет в весе, в таком случае вмешиваться в естественный процесс не надо! Индивидуальный уровень флоры желудочно-кишечного тракта у каждого человека свой.
Носительство стафилококка — совершенно обычное явление и не является показанием для какого-либо лечения. Посевы со слизистой оболочки носа и зева с последующим определением чувствительности микрофлоры к антибиотикам чаще всего влекут за собой необоснованное назначение антибиотиков и прочих препаратов. Санация при носительстве золотистого стафилококка не показана.
Носительство стафилококка на слизистых не может быть причиной ни температуры, ни головных болей, ни тошноты и рвоты, ни запора, ни вздутия живота и колик, а соответственно и плача ребенка. Следовательно, нужно искать причину, а не лечить несчастный, ни в чем не повинный стафилококк.
А что же тогда считать нормальным стулом? Там же в памперсе такие ужасы!!!
Вот и разберем ваши основные ужасы (хотя нормам стула я уже посвятила целую статью «Стул у ребенка». Но видно не все ее прочитали.
Итак объясняю популярно.
Ребенок на ГВ имеет право на любой стул. Это означает, что цвет какашек должен волновать маму в последнюю очередь, если малыш спокоен, весел, развивается и растет нормально, прибавляет в весе более 500 г в первые месяцы.
Кстати стул грудного ребенка очень сильно меняться в первые месяцы жизни (обратите внимание, что речь идет пока только о стуле ребенка который находится полностью на ГВ. На СВ, и тем более на ИВ все иначе, потому как даже допаивание водой может повлиять на стул).
С рождения до 2-3 дней выделяется меконий (первородный кал), густой, черно-зеленый, от 2 до 4 раз в сутки. Но обычно это бывает в роддоме и мамы по этому поводу не переживают — им пока еще не до копания в какашках малыша, пока еще не прошла эйфория от родов и встречи с долгожданным чадушкой (ну по крайней мере так было у меня!).
В первые три дня после рождения число опорожнений кишечника должно соответствовать возрасту ребенка — в первые сутки ребенок должен опорожнить кишечник один раз, на вторые сутки — два, на третьи — три. После прихода молока грудной ребенок опорожняет кишечник минимум 3-4 раза в сутки, и количество стула довольно значительное. Большинство грудных детей опорожняют кишечник намного чаще, нередко после каждого кормления. Даже неопытная мама без труда распознает радостный залп похода в туалет у грудничка — его невозможно не услышать и пропустить.
С 2-3 дней до 4-6 недель ребенок может ходить больше 4 раз в сутки, каждый раз — чуть более ложечки, обычно консистенция мягкая или жидкая, цвет горчичный, запах обычно сладкий, молочный, но может быть кислый, возможны вкрапления свернутого молока, что говорит о том, что малыш получает достаточно молока. И даже с избытком, который и выводится виде створоженных крошек. Допускаются пропукивания с водичкой, неоднородность в самих какашках.
По мере взросления, в районе 6 недель от рождения или чуть раньше, многие грудные дети переходят на более редкий режим дефекации — от раза в несколько дней до раза в неделю или даже реже. При этом отсутствуют признаки запора (то есть сухой, твердый стул) — стул ребенка по прежнему неоформленный, пюреобразный. Поэтому не нужно лезть к ребенку с клизмами и прочими средствами «помощи».
Характерно, что у новорожденных и детей грудного возраста с калом выделяется неизмененный билирубин, в связи с чем испражнения имеют характерный зеленоватый цвет. Обычно цвет меняется при соприкосновении билирубина с воздухом. То есть малыш покакал, а вы сменили памперс не сразу, а спустя немного времени — тогда как раз и получите романтично-зеленые (которые и приводят многих мам в ужас) какашки. Если ребенка они не беспокоят — а чаще всего именно так и есть, спокойно выкиньте памперс и забудьте о нем.
Реакция на билирубин остается положительной до 4-5-месячного возраста, затем параллельно с билирубином начинает определяться стеркобилин (он то и придает фекалиям их цвет) в результате восстанавливающего действия нормальной бактериальной флоры толстой кишки. К 6-8 месячному возрасту в кале определяется только стеркобилин — поэтому к этому времени обычно и зелень с якобы имеющимися в ней стафилококками проходит. И, о чудо, мама ликует — мы вылечили дисбактериоз, а его и не было, это просто возрастные нормы.
Зеленый стул с пеной или слизью — может быть связан с переменой погоды, активным заселением флоры кишечника в первые недели жизни, болезнью мамы, диетой мамы. Не всегда это патология и не стоит сразу бежать на анализы.
А пенистый стул, оказывается, свидетельствует о бродильной дисперсии, связанная с чрезмерным употреблением в пищу углеводов (сахара, меда, мучных продуктов, фруктов, винограда, гороха, бобов, капусты и т. д.), но грудничок ведь грудное молоко только пьет, а значит пенистый стул связан с питанием мамы и маме нужно убрать из своего рациона именно эти продукты.
Второй вариант пенистого стула — это дисбаланс переднего и заднего молока. Если малыш получает только переднее молоко, богатое лактозой, то его стул может пениться. Возникает это потому, что в первые недели жизни имеется относительный недостаток фермента лактазы, которая расщепляет эту самую лактозу (молочный сахар). При избытке молочного сахара(при питании передним молоком) лактазы для расщепления не хватает, и сахар попадает в толстый кишечник, где его расщепляют кишечные бактерии с образованием избытка газиков — поэтому получается пена. И стафилококки с клебсиеллами тут не причем.
После установления у мамы активной лактации у младенца появляется «зрелый» стул, который сохранится до введения прикорма или докорма. Он представляет собой однородную желтую кашицу консистенции негустой сметаны с запахом кислого молока. Такой стул свидетельствует о хорошем переваривании материнского молока. Что касается нормальной частоты стула, большинство новорожденных опорожняют кишечник чуть ли не после каждого кормления, то есть число дефекаций в сутки может достигать 5-8, а иногда даже 10.
Как вариант нормы, рассматривается состояние, когда материнское молоко настолько полностью переваривается, что практически ничего в кишечнике не остается, и опорожнение кишечника может происходить 1 раз в несколько дней, иногда даже 1 раз в неделю. Нормой подобное состояние может считаться на фоне полностью грудного вскармливания (исключительно, даже вода не дается, и плантексы, травки-муравки тоже) и при условии хорошего самочувствия малыша (нормальном поведении, отсутствии болей в животе и значительного натуживания при дефекации). Как правило, такая особенность развивается у некоторых грудничков не ранее 3 месяцев жизни.
Кстати, тужиться, сучить ножками, кряхтеть, краснеть и даже плакать при акте дефекации малыш вполне может и это не патология (ну если конечно стул у него не как орехи или козьи какашки). Просто акт дефекации для малыша — это тоже труд, на него он затрачивает усилия. Чтобы покакать малышку нужно создать в просвете прямой кишки определенное давление. И только это будет способствовать расслаблению мышц ануса и победному залпу! И не нужно при натуживании малыша хватать его вместе с какашками и нестись их сдавать. Это нормальное поведение!
Прикорм. Введение любой другой пищи помимо грудного молока приведет к изменению консистенции, цвета и запаха стула у грудного ребенка. Если вы начали вводить прикорм, стул начнет становиться более оформленным, в стуле можно будет заметить кусочки пищи, которую вы даете ребенку. И кстати цвет тоже зависит от того, какую пищу ест ребенок — в принципе, что съели, то и вышло. До полного переваривания пищи у малыша пока говорить еще рано. Так что введенное мамой пюре может и выйти почти неизменной кучкой, и это не страшно.
Кстати, нормы детей на грудном вскармливании значительно отличаются от показателей и детей на смешанном и искусственном вскармливании. Например, флора кишечника младенца на искусственном вскармливании уже в 2 недели почти не отличается от взрослого человека. У детей на искусственном вскармливании более редкая дефекация, а также более оформленный стул с заметным типичным запахом.
При искусственном вскармливании стул может быть таким же, как и при естественном, или иметь более густую консистенцию и более темную, коричневатую, окраску. Дефекация обязательно должна происходить не реже 1 раза в сутки (ну максимум раз в двое суток), все прочее считается запором. Число испражнений в течение первого полугодия обычно 3-4 раза в день, а во втором полугодии — 1-2 раза в день. Количество кала 30-40 г в сутки. При искусственном и смешанном вскармливании в связи с преобладанием процессов гниения в кале много кишечной палочки, бродильная флора (бифидофлора, молочнокислые палочки) имеется в меньшем количестве. Небольшому количеству слизи не стоит придавать значения, как и небольшим белесоватым крошкам, показывающим только, что молоко содержит излишек жира, который ребенок не успевает переварить.
Содержимое подгузника, на которое следует обратить внимание.
Отклонения от нормы частоты и внешнего вида стула не всегда означает, что ребенок обязательно чем-то болен. Однако, стул ребенка может быть полезным признаком достаточности питания или симптомом аллергии. В таких случаях изменение способа кормления или устранения аллергена — все что требуется для решения проблемы.
Частый, водянистый, зеленый и/или пенистый стул, примесь слизи может быть признаком недоедания. Нередко такой стул бывает в сочетании с медленным набором веса. Иногда такое состояние называют дисбаланс переднего и заднего молока. Ребенок высасывает много переднего молока с низким содержанием жира, которое проходит через пищеварительную систему слишком быстро и вызывает вышеуказанные симптомы. Обычно это легко разрешается изменением поведения во время кормлений, а именно увеличение продолжительности сосания у одной груди. Это позволяет малышу дососаться до жирного заднего молока, которое переваривается медленнее.
Если у малыша постоянно зеленый и водянистый стул, это может быть признаком аллергии. Помимо этого у ребенка может быть рвота, слизь или кровь в стуле, а также раздражительность, высыпания на коже. В этом случае особенно важно продолжать кормить грудью, т.к. отлучение от груди сопряжено с повышением риска аллергий.
Если ваш малыш пачкает более 12-16 подгузников в сутки, и стул плохо пахнет и водянистый — это понос. Обычно понос у грудных детей быстро проходит сам по себе и без всяких осложнений. Причиной поноса может стать инфекция, лечение антибиотиками, введение прикорма, чрезмерное потребление фруктовых соков. В случае острого поноса или поноса при приеме антибиотиков ребенка обязательно нужно как можно больше кормить грудью. В грудном молоке содержится все необходимое для предотвращения обезвоживания, а также антитела, которые помогают ребенку справится с инфекцией, и также факторы, которые позволяют восстановить нормальную флору кишечника. Если же причиной поноса стало введение прикорма или соки, возможно нужно отложить введение прикорма на некоторое время.
Ну и вновь возвращаюсь к нашей любимой теме — дисбактериоз! Знакомое слово? Российский родитель, который не слышал его от своего педиатра, может прислать свой портрет на конкурс «Самый счастливый родитель года». Страшный недуг, поразивший всех наших детей, подобравшийся к взрослым, мучительный и неприличный, но легко излечимый регулярной едой чего-либо, выпиванием чего-то по утрам, в общем регулярным переводом денег на чей то счет, пришел в наш мир.
Столкнувшись с самым грандиозным обманом современной педиатрии, считаю своим долгом поставить точки над i, чтобы не повторять бесчисленно в каждой второй теме форумов одно и тоже.
Обозначить симптомы дисбактериоза трудно, а точнее сказать невозможно, так как это состояние не является заболеванием согласно «Международной статистической классификации болезней и проблем, связанных со здоровьем» Десятого пересмотра (МКБ-10) — документу Всемирной организации здравоохранения, который является общепринятой международной диагностической классификацией в здравоохранении. То есть, в мире, да и в России кстати тоже (мы же, врачи-педиатры, пользуемся МКБ-10 в постановке диагнозов как и все врачи в мире) такого состояния не существует. Но почему же тогда его упорно лечат. Как можно лечить то, чего нет?
Обычно, показанием к анализу на дисбактериоз является непроходящий в течение двух или трех суток понос. У взрослых людей и детей на искусственном вскармливании понос определяется как частый и жидкий стул. Как уже было сказано выше, для грудных детей частый, неоформленный жидкий стул является нормой, поэтому не может являться показанием для анализов. Среди других симптомов, которые служат поводом для лабораторных исследований на дисбактериоз могут быть зеленоватый стул, стул со слизью, запор (редкий стул у грудных детей часто ошибочно принимают за запор), пенистый стул, частички непереваренной пищи. Все эти симптомы в старшем возрасте действительно сопровождают поносы, которые часто вызваны патогенными бактериями и требуют лечения антибиотиками. У детей до года же каждый из перечисленных признаков может являться разновидностью нормы.
Итак, что нужно знать о дисбактериозе кишечника:
1. Главное — дисбактериоза… не существует! Нет ни такого заболевания, ни состояния, которое могло бы иметь отношение к понятию, ни необходимости его искать, ни необходимости его лечить. Подробнее…
2. Просвет кишечной трубки у родившегося ребенка стерилен (как стерилен и сам ребенок). В течение короткого промежутка времени он, как сообщающийся с внешней средой, колонизируется микроорганизмами, которые живут в нем всю жизнь человека.
3. Эти микроорганизмы могут быть полезными, принимающими участие в процессе пищеварения; нейтральными, коих большинство (живут и живут — должен же кто-нибудь жить в просвете кишечника) и вредными, вызывающими кишечные заболевания.
4. Количество микроорганизмов в кишечнике, а также их соотношение у каждого человека разное и зависит от бесчисленного множества факторов — от того в городе или в деревне живет человек, что он ест, насколько тщательно соблюдает правила гигиены, здоров он или болен в данный момент и т.д. Нет единых норм содержания микробов в просвете кишечника. Это первое что нужно понять. Человек имеет право на индивидуальную микрофлору.
5. Отсутствие норм, масштабных исследований в этом направлении связано, в первую очередь с тем, что исследования такие не нужны клинической медицине и не несут никакой смысловой нагрузки! От количества и состава микробных колоний ничего не зависит. И это второй вывод нашей беседы.
6. Далее, следует различать содержание микроорганизмов в каловых массах — в просвете кишечника (которые так активно исследуют иные доктора) и содержание их же собственно в кишечнике, т.е. на кишечной стенке — там, где они могут иметь хоть какое-то гипотетическое значение. Нет никаких убедительных данных, что количество микроорганизмов в кале хоть каким-то образом соответствует соотношению их в кишке. Таким образом, что мы определяем абсолютно непонятно. Запоминаем третье правило «Нет, не было и не может быть анализа на дисбактериоз» Любое исследование, которое Вам предлагают пройти в этой связи — бессмысленно, неинформативно и направлено только на имитацию лечения.
Так почему же этот самый дисбактериоз не лечит только ленивый?!!!
А вот на этот вопрос ответа нет. Отчасти потому что проще всего лечить несуществующую болезнь — то, чего не было, обязательно пройдет. Отчасти потому, что прочитать рекламную брошюрку очередных производителей для некоторых коллег легче, чем серьезный учебник (он же еще и денег стоит, да и написан чаще на английском)… В некоторых случаях потому, что проще списать непонятные симптомы на некую мифическую, но общеизвестную проблему — ведь то, что мы пишем сегодня, не исключает существования множества заболеваний желудочно-кишечного тракта, каждое из которых имеет свою клинику, свой набор анализов и свое лечение. Но это болезни. Здоровых детей лечить не надо.
Степень обмана дошла до того, что помимо бессмысленных лекарств для лечения несуществующей болезни нам предлагают покупать даже продукты!!! «Покупайте у нас постоянно и у Вас не будет дисбактериоза!!!». Мы надеемся, что прочитав эти слова, Вы всегда будете скептически относиться к подобной рекламе, насколько бы убедительна она не была.
А как же антибиотики? Почему же тогда при их приеме нередко «расстраивается желудок».
Рутинной ошибкой, впрочем, и распространенным добросовестным заблуждением является мнение, что при назначении антибиотиков обязательно происходит нарушение микробного равновесия в толстом кишечнике Как правило, и в большинстве случаев, применение антибиотиков не влечет за собой каких-либо расстройств и не требует дополнительной коррекции микробного баланса.
Но. Для ряда препаратов, временная диарея является побочным эффектом применения. Например популярный антибиотик амоксиклав вызывает диарею примерно в 7-10% случаев. Таким образом, временное учащение и разжижение стула надо рассматривать не как самостоятельную проблему, требующую коррекции, а как одно из действий препарата.
Так как же поддержать организм ребенка? Какие действия предпринять? Может среди сотен товаров, которые нам предлагают, есть что-то действительно полезное?.. Что бы в кишечнике моего ребенка жили только полезные микробы???
Ничего, абсолютно ничего экстраординарного делать не надо. Кормите детей вкусно и разнообразно. Приучите их мыть фрукты и руки перед едой. Обучите элементарным правилам гигиены и считайте, что на этом Ваша миссия выполнена.
Насколько показательны анализы на дисбактериоз у здоровых грудных детей? Изучение состава кишечной флоры у здорового грудного ребенка, то есть ребенка без видимых симптомов заболевания, в данном случае поноса, представляет интерес для ученых, но не для родителей или практикующих врачей. Многочисленные исследования показали, что грудное молоко защищает детей от заболеваний, даже если кишечник колонизирован патогенными микроорганизмами. Например, в грудном молоке содержатся антитела и факторы против кишечной палочки, холерного вибриона, сальмонеллы, стафиллококов, клебсиелл, шигеллы, ротавируса и лямблии. Это значит, что в стуле может высеваться патологический микроорганизм, но ребенок при этом не проявляет никаких симптомов заболевания.
И вновь вернусь к стафилококку. Мы разобрались, когда его лечить не нужно. Когда есть анализ (бумажка с каким-то числом микробных КОЕ 10 в какой-нибудь степени) и никаких жалоб не предъявляющий ребенок.
Другое дело — стафилококковая инфекция. И о ней тоже нужно знать.
Патогенный стафилококк — проблема родильных домов испокон веков. В роддомах строгий санэпидрежим, практически все регулярно протирается дезинфицирующими средствами, убивая на поверхностях всю микрофлору (патогенную и непатогенную, без разбора). Первым, кто быстро занимает «освободившуюся квартиру» — золотистый стафилококк (разносясь с кожи и слизистых людей). И так как ему там нет конкуренции (все же убиты) — начинает неконтролируемо размножаться и, затем, через воздух или руки попадает и к женщинам, и к новорожденным детям.
Новорожденные дети, не успев колонизироваться нормальной человеческой микрофлорой кожи матери, в том числе и её золотистым стафилококком в компании других микроорганизмов (что обеспечивается ранним прикладыванием и совместным пребыванием), поражаются больничным золотистым стафилококком, который вызывает различные заболевания (в основном кожные, но бывает и что посерьезнее). Они же еще не успели выработать на него антитела. А мама не успела передать их с молочком.
Женщина же при наличии кровоточащей после родов матки и грудного молока (это прекрасная среда для размножения микробов) тоже имеет риск получить больничную инфекцию.
Такое случается во всем мире.
СТАФИЛОКОККОВАЯ ИНФЕКЦИЯ. Стафилококковые заболевания поражают преимущественно детей младшего возраста или детей, ослабленных другими заболеваниями.
Клиническое течение стафилококковой инфекции характеризуется многообразием — от тяжелейших, генерализованных форм до легких: сепсис, пневмония, менингит, абсцессы внутренних органов, энтероколит, эндокардит, гинекологические заболевания, стафилококковая инфекция со скарлатиноподобным синдромом, гнойно-воспалительные заболевания кожи и мягких тканей и др. Причем отметьте про зеленый стул с пропуками, запор и прочие проблемы обращений — тут не слова. Стафилококковая инфекция если она есть — заболевание тяжелое. И чаще всего лечится стационарно массивно антибиотиками, а не бактериофагами, клизмочками и всякими биопрепаратами препаратами.
Основные мероприятия, которые проводятся в мире для снижения риска:
— роддома не должны быть излишне закрыты от посетителей и излишне дезинфицировать поверхности, чтобы там сохранялась нормальная микрофлора окружающего мира, а не больничный стафилококк.
— ранее прикладывание и совместное с матерью пребывание.
— короткий срок пребывания матери и ребенка в роддоме после обычных родов (пару дней — и домой, в обычную микрофлору), чтобы было меньше риска обсеменения больничной микрофлорой.
— стандартные мероприятия инфекционного контроля.
Ваш ребенок имеет в кишечнике, как и все другие люди на земле, золотистый стафилококк. В кишечнике у людей вообще много кто живет в норме. Бывает что и возбудитель столбняка. И это тоже норма.
Стафилококк у грудничка: симптомы и лечение
Когда ребенок заболевает, для родителей это маленькая катастрофа, что неудивительно. Иногда причины плохого самочувствия малыша понять сложно, вследствие чего приходится неоднократно обращаться к врачу. Очень распространенная детская инфекция — стафилококк у грудничка, симптомы которого проявляются в виде постоянного кашля и насморка, иногда наблюдается нарушенный стул. Лечение этого недуга несложное — главное, вовремя его диагностировать.
Основные факторы риска
Золотистый стафилококк 10 в 6 степени – это один из самых частых недугов, который образуется при наличии у матери внутриутробной инфекции. Важно знать, что если ребенок заболел им один раз, есть риск повторного заражения, потому что иммунитет к болезни не вырабатывается.


Основные факторы риска:
- беременность в первые недели протекает с осложнениями;
- роды прошли с патологией;
- ребенок родился недоношенным;
- во время беременности у матери был диагностирован гестоз;
- будущая мать не соблюдала правила личной гигиены.
Самый важный период для нормального развития плода — первые недели. Если в это время женщина подвергает свой организм опасности, то есть вероятность, что у ребенка при рождении будет обнаружен золотистый стафилококк 10 в 6 степени.
Причины заражения
Стафилококк 10 в 6 степени — это микроорганизм, имеющий патогенный характер. Его можно выявить через анализ кала практически у каждого человека. Живет он на лице (кожном покрове) и в слизистых оболочках.
У молодых родителей часто возникают вопросы, откуда у их чада появились признаки наличия недуга, почему стул содержит слизь и как это все лечить. В основном заражение возникает в том случае, если за ребенком не был обеспечен должный уход, в результате чего у него снизился иммунитет.


У грудничков не все органы хорошо развиты. Особенно они подвержены негативному воздействию окружающей среды в первые дни после появления на свет ребенка.
Есть и другие причины заражения:
- Маленький ребенок в первый год своей жизни познает мир, тянет в рот все, что попадается ему на пути. Если родители плохо следят за чистотой в доме, золотистый стафилококк 10 в 6 степени очень скоро даст о себе знать. Конечно, не надо зарываться с головой в стерильность, но элементарные правила гигиены соблюдать следует. Особенно это касается первых месяцев после рождения малыша, когда у него только развивается иммунитет.
- Бактерию ребенок может подцепить и в роддоме. При появлении на свет он контактирует с большим количеством микроорганизмов и предметов, которые не всегда были обработаны должным образом.
- Когда малыш рождается раньше положенного срока, он очень слаб и подвержен воздействию бактерий. Несвоевременное лечение приведет к распространению инфекции.


Основные симптомы
Все родители задаются вопросом, как проявляется стафилококк у новорожденных. Лечить инфекцию намного легче, если ее заметили еще в начальной степени развития (в первые 7 дней).
Бактерия проживает на слизистых оболочках и коже лица, поэтому болезнь проявляется различными способами.
Симптомы заболевания:
- на коже у ребенка в большом количестве появляются угри;
- сепсис;
- нарушен стул, в кале есть слизистые образования;
- пневмония;
- если на коже есть раны, они начинают гноиться.
Признаки наличия инфекции у новорожденных в первые дни жизни выявляются в кале (10*6), иногда образуется конъюнктивит. Организм слабеет, поэтому все это может сопровождаться простудой. Если родители увидели, что стул малыша не такой, как раньше, а в кале есть примеси слизи, стоит сдать анализ на выявление инфекции.
При подтверждении диагноза врачом назначается индивидуальная дозировка лекарства Энтерофурил. Это средство широкого спектра применения с минимальным количеством побочных эффектов.
Энтерофурил состоит из натуральных компонентов, безопасных для детского организма.
Своевременная диагностика
При подозрении на инфекцию у грудничка анализ необходимо сдать не только ребенку, но и его матери. Материал для посева матери — это грудное молоко, ребенка — в зависимости от того, какие проявляются признаки. Чем быстрее будет сдан анализ, тем быстрее можно будет начать лечить золотистый стафилококк.
При ОРВИ у грудничка берется из носа на проверку мазок. Если у малыша в кале слизь (бактерия 10 в 6) и нарушен стул, для проверки на инфекцию используется именно этот материал.


В случае когда причины возникновения инфекции удалось определить через грудное молоко матери, лечение проводят совместное. Самый безопасный препарат — это, опять же, Энтерофурил. Он разрешается при грудном вскармливании и не вызывает у детей аллергической реакции.
Как лечить
Если анализ подтвердил признаки наличия инфекции, лечение нужно начинать как можно быстрее.
Основные этапы лечения следующие:
- Независимо от степени развития болезни родители должны задуматься о гигиене малыша. Причины проявления инфекции могут быть скрыты именно в несоблюдении элементарных правил ухода за ребенком.
- Если нарушен стул, сдается анализ и определяется, какой именно у ребенка золотистый стафилококк. Тяжелой считается стадия 10*6 степени.
- Лечат детей чаще всего препаратом Энтерофурил. Также в зависимости от индивидуальных особенностей ребенка назначаются и другие процедуры. Лечить грудничка медикаментозным способом самостоятельно нельзя — только под наблюдением врача!
Золотистый стафилококк не реагирует на антибиотики, и лечение таким способом может только усугубить ситуацию.


Преимущества препарата Энтерофурил:
- характеризуется широким спектром действия;
- благоприятно воздействует на организм в целом;
- Энтерофурил безопасен, поэтому лечение сиропом назначается грудничкам и кормящим матерям;
- Энтерофурил не вызывает аллергической реакции.
Вылечить золотистый стафилококк у маленького ребенка будет легче и быстрее, если диагностировать его на начальной стадии. Главное — сразу обратиться к врачу, сдать анализы и начать пить Энтерофурил. Не забывайте постоянно проверять стул грудничка, чтобы он был регулярным и без слизи. Помните, что лечить самостоятельно стафилококк нельзя, так как интенсивность терапии зависит от степени развития болезни.
Стафилококк в кале у ребенка причины лечение комаровский
Золотистый стафилококк – опасная для человеческого организма бактерия. Она выделяет сильный токсин, который поражает важные жизненные органы и системы. У маленького ребенка штамм aureus может поселиться в носу, кишечнике, ротовой полости и где угодно. Избавиться от него сложно. К тому же, перенесение инфекции не гарантирует того, что малыш не заразится повторно. Иммунитет на стафилококковую инфекцию не формируется.
Пути заражения кишечника
В кишечном тракте у ребенка бактерия оказывается по причине контактов крохи с взрослыми зараженными или детьми, а также носителями штамма. Заражение грудничка объясняется заболеванием матери – инфицирование происходит как во время внутриутробного развития, так и после появления на свет, когда зараженная женщина ухаживает за новорожденным и кормит его грудью.
Золотистый стафилококк оказывается в кале грудничка по разным причинам:
- пренебрежение матерью правилами гигиены;
- гипотрофия и недоношенность плода;
- внутрибольничное инфицирование;
- длительное безводие при родах;
- тяжелые или преждевременные роды;
- слабость детского организма вследствие патологий беременности.
Путей передачи штамма несколько. Стафилококк у новорожденного внедряется в пупочную ранку и разносится кровью по всему организму. При наличии трещин на сосках заражение ребенка происходит во время кормления. Питание из нестерильной бутылочки, сосание необработанных пустышек, использование разных предметов обихода повышает риск подхватить инфекцию.
Как распознать поражение кишечного тракта
Клинические симптомы разрастания колонизаций штамма aureus сходны с признаками дисбактериоза, ОРВИ, острых кишечных инфекций. Наблюдается учащение стула ребенка, продукты дефекации выделяются кашицеобразные и водянистые. В кале просматривается слизь. Нестерпимые кишечные колики вынуждают малыша плакать.
К признакам патогенной деятельности золотистого стафилококка у грудничка и старших деток относятся:
- рвота;
- боли в животе;
- плохой аппетит;
- вялое состояние;
- жалобы на слабость.
Любые симптомы стафилококковой инфекции требуют обращения к врачу, но особенно родители должны поспешить в клинику при выделении ребенком зеленоватого или пенистого кала.
На инкубационный период развития болезни приходится от нескольких часов до 4-х суток. Длительность процесса зависит от силы иммунитета, точного возраста маленького пациента и формы инфекции. Поскольку указанные признаки присущи многим патологиям, важно проанализировать кал на стафилококк, энтеробактерии, наличие цитробактера и разной условно-патогенной флоры и определить степень заражения.
Диагностика стафилококковой инфекции
Если у вашего малыша в процессе исследования кишечного содержимого обнаружили стафилококк, поводом для беспокойства послужат только высокие показатели. Если штамма aureus анализы не показали вообще, это идеально. Но если лаборант написал «стафилококк четвертой степени», волноваться также не стоит, ведь это значение считается нормой в кале у ребенка. Родители получают рекомендации по гигиене и укреплению детского иммунитета.
Допустимое количество стафилококка в кале и численность паразитов группы «энтеробактерии» являются спорными вопросами. Всё зависит от поведения штамма. Если он вызывает расстройства пищеварения и признаки интоксикации, значит, организм страдает от стафилококковой инфекции и ребенка нужно срочно лечить.
Если же присутствие энтеробактерии и возбудителя aureus не причиняет вреда, доктор Комаровский предлагает ограничиться мероприятиями по усилению защитных функций детского организма.
Как избавиться от золотистого стафилококка
Терапия стафилококковой инфекции, обнаруженной в кале, направляется на устранение причин патологии. Учитывая высокую устойчивость штамма aureus к воздействию многих антибиотиков, в ходе работы с биоматериалом лаборанты определяют чувствительность роста колоний к медикаментам. По результатам исследования доктор назначает подходящие средства.
Лечить грудничка можно пенициллинами и цефалоспоринами. Для поражения бактериальных клеток детям назначают специальные бактериофаги. Их применение обосновано при выявлении штаммов, наиболее устойчивых к антибиотикам.
Завышенные показатели золотистого стафилококка в кале требуют дополнительного лечения пробиотиками. Основная терапия, направленная на ликвидацию возбудителя, занимает 5 – 7 дней. Но пострадавшая микрофлора кишечника нуждается в восстановлении, иначе у грудничка или старшего крохи разовьется дисбактериоз.
Минеральные препараты, иммуномодуляторы, пищевые добавки и витамины детям прописывают для поддержания иммунной системы и нормализации обмена веществ. Лечением стафилококка в домашних условиях не занимаются. Ребенка помещают в стационарные условия.
Профилактическая защита от стафилококка
Оградить детский организм от золотистого стафилококка или энтеробактерии родителям помогут простые меры профилактики. Доктора напоминают о важности поддержания чистоты в доме и выполнения элементарных правил гигиены. При отсутствии противопоказаний к естественному вскармливанию грудничка не отрывают от матери максимально долго.
Разрастание колонизаций стафилококка у новорожденного предупреждают путем стерилизации его посуды и всех принадлежностей. Прежде чем обслуживать кроху и играть с ним, взрослые всегда должны мыть руки.
Также важны любые мероприятия, направленные на усиление иммунитета. Это лечебная физкультура, употребление качественной и витаминизированной пищи, прогулки на свежем воздухе, достаточное количество часов сна. Определенная роль в лечении многих болезней отводится настроению малыша. Страхи, переживания и неблагоприятная обстановка в семье угнетают нервную систему и подрывают здоровье.
В том, что золотистый стафилококк опасен, сомневаться не стоит. Присутствие бактерии в организме способствует разным осложнениям:
- происходит заражение крови;
- обостряются врожденные и хронические заболевания;
- усиленно размножаются энтеробактерии и прочие условно-патогенные микроорганизмы;
- при неблагоприятном течении болезни ребенок погибает.
Комментирует наш специалист
- Помните, что группу риска по заражению стафилококком возглавляют дети со слабым иммунитетом. Усиливайте защиту организма любыми способами, ведь риски инфицирования и развития опасных болезней у детей остаются высокими до школьного возраста.
- Золотистый стафилококк поражает не только кишечник. Местом локализации возбудитель также избирает слизистые оболочки, выстилающие ротоглотку и носовые ходы. Штамм вызывает насморк и ангину.
Разговор с врачом о стафилококке
Стафилококковая инфекция относится к одной из наиболее распространенных. Вызывается она бактериями, которые могут находиться как на поверхности кожи, так и на слизистых оболочках внутри тела. Микроорганизм может спокойно существовать в организме, не проявляя себя, пока не происходит сбой в работе иммунной системы. Находясь в ослабленном состоянии, организм бессилен перед золотистым стафилококком (Staphylococcus aureus). Наиболее тяжело инфекционное заболевание протекает в детском возрасте. Что означает если найден золотистый стафилококк у ребенка в кале?
Чем опасен стафилококк?
Наличие золотистого стафилококка в кале у малыша говорит о том, что началось распространение микроорганизма в кишечнике. Бактерия поражает любые органы, вызывая гнойно-воспалительные заболевания. Для детей наиболее опасны штаммы (колонии) возбудителей, которые поселяются в кишечнике, нарушая нормальную работу ЖКТ.
При крепком иммунитете рост бактерий сдерживается клетками-фагоцитами (захватывают бактерии) и иммуноглобулинами — антителами (белками, которые уничтожают чужеродные клетки).
Золотистый стафилококк присутствует в организме малышей, но в небольших количествах он не опасен. Если ребенок болен, ослаблен, кормление происходит без соблюдения гигиенических правил (или недостаточное кормление), то штаммы стафилококка растут в геометрической прогрессии.
Поскольку микроб питается, то в процессе жизнедеятельности он выделяет опасный яд – экзотоксин, который вызывает интоксикацию (отравление) организма. Итогом может стать инфекционно-токсический шок, который является реальной угрозой для жизни человека. По данным ВОЗ из числа заболевших золотистым стафилококком детей в год умирает 25%.
К сведению: Экзотоксины — это БАДы белковой природы, способные повреждать клетку организма, вызывая ее гибель. На их «совести» блокада белкового синтеза, увеличение проницаемости клеточной стенки, благодаря чему внутрь могут попасть вредные соединения, нарушение связи между клетками.
Действие бактериального яда ведет к серьезным последствиям:
- несвоевременное лечение грозит летальным исходом;
- происходит сепсис – заражение крови, когда микробы по кровеносному руслу разносятся по телу, вызывая образование новых очагов инфекции;
- у ребенка болезнь протекает крайне тяжело.
Опасность заражения данным видом состоит в том, что он постоянно видоизменяется и приспосабливается к новым лекарствам (чаще всего антибиотикам). Появление нового препарата вызывает со временем и рост новых колоний (штаммов), устойчивых к нему. Это осложняет лечение. Кроме того, даже если болезнь прошла, ничто не может оградить ребенка от ее повторного проявления, кроме крепкого иммунитета.
Staphylococcus aureus не просто выживает во внешней среде, он способен выдержать экстремальные условия. Например, кипячение в течение 10 мин его не погубит. Поэтому если хирургические инструменты обработаны недостаточно, бактерию легко занести в рану. Она переносит замораживание, «равнодушна» к обработке спиртом и перекисью водорода и другими антисептическими растворами.
Ферменты, расположенные на поверхности оболочки клетки бактерии, помогают ей разрушать клетки тканей и беспрепятственно попадать внутрь. Проникнуть через кожный эпидермис или потовые канальцы для стафилококка не представляется сложным.
Причины инфицирования
Путь передачи микроба этого вида самый распространенный – воздушно капельный. Именно поэтому Staphylococcus aureus обитает практически в каждом организме, в том числе и детском. Заражение происходит и через пищу.
При ее неправильном хранении размножение бактерий происходит наиболее активно. Самые любимые продукты стафилококка – мясо, рыба, яйца, молочные продукты и кондитерские изделия.
Группа риска – это недоношенные или ослабленные дети. Инфекция может попасть от матери к ребенку при родах, во время грудного вскармливания, раны или царапины (микротрещины).
К причинам заражения относятся:
- дисбаланс (нарушение) микрофлоры кишечника;
- ослабленные защитные силы организма;
- аутоинфекции – перенос возбудителя из одной части организма в другой;
- несоблюдение правил личной гигиены;
- передача от другого носителя инфекции.
Особенно важно соблюдение чистоты. Не стерильных условий, поскольку в организм должны попадать микробы, а соблюдение простых правил: ребенок должен мыть руки перед едой и получать продукты, термически обработанные. Маленький ребенок тянет в рот «все подряд» и за ним трудно уследить. Но по возможности это делать необходимо. Постепенно он будет привыкать к гигиеническим процедурам.
Носителем-передатчиком опасной бактерии чаще всего становится работник медучреждения или пищеблока. Стафилококк может передаваться при укусе насекомого, поэтому ранку после укуса нужно обработать антисептиками.
Важно: Дети – группа риска. Именно они заболевают этой инфекцией чаще всего в любом возрасте, начиная с младенчества. Она тяжело протекает, плохо лечится и вызывает серьезные последствия для неокрепшего растущего организма.
Симптомы заражения
Различают раннюю стадию, когда с момента заражения произошло несколько часов и болезнь только начинает прогрессировать. На поздней стадии, которая развивается уже через 3-5 дней, происходит заражение крови и ребенка бывает трудно спасти.
На ранней стадии наблюдаются:
- значительное повышение температуры;
- диарея;
- тошнота и позывы к рвоте;
- слабость и вялость;
- отсутствие аппетита;
- метеоризм.
Малыш кряхтит, тужится и плачет, что говорит о расстройстве работы ЖКТ. Характерен жидкий стул с зеленым оттенком и белыми комочками. Затем может наступить запор, который заметен по вздутию живота. Все это ослабляет организм, и ребенок становится вялым и плаксивым.
Поздняя стадия характеризуется:
- переносом бактерий кровяным руслом по всему телу;
- гнойно-воспалительными процессами, протекающими на коже и слизистых;
- инфицированием внутренних органов.
Важно: Болезнь может не проявляться, а ее носитель распространять инфекцию, выделяя бактерии в окружающую среду. Это называется носительством золотистого стафилококка, которое можно выявить при анализе в кале у ребенка. Носительство не лечится ни одним из известных антибиотиков.
При первых симптомах следует проконсультироваться с педиатром и сдать анализы на наличие патогенной микрофлоры. Определить болезнь только по внешним признакам сложно, так как ее симптомы напоминают и другие заболевания.
При положительной пробе госпитализируют мать и ребенка, которым назначают лечение. Это важно, чтобы избежать более тяжелых последствий инфицирования и ее рецидивов (возврата).
Методы диагностики
Первую диагностику проводят сразу после родов, чтобы исключить наличие столь опасной инфекции. Иногда она выявляется уже в роддоме.
Берутся мазки и определяют стафилококк в разных бакпосевах:
- Если золотистый стафилококк у ребенка в кале, можно ждать возникновения кишечных расстройств, сопровождающихся рвотой, диареей, запорами.
- При его обнаружении в горле или носу возможно развитие бронхита или пневмонии.
- Если возбудитель инфекции находится в крови, то возможен сепсис (повторное заражение), последствия которого очень серьезные.
Существуют нормы по содержанию бактерий, когда можно говорить о том, опасны они или нет. Полное отсутствие опасной бактерии у детей разных возрастных групп – это норма.
Если микроорганизм присутствует в количестве 10 в 4 степени – это нормальный показатель после годовалого возраста. Для «грудничков» такой показатель великоват и нуждается в коррекции (лечении).
Обильный рост колоний при бакпосевах и высокий показатель микроорганизмов говорит о росте инфекции или повторном заражении. Незначительное размножение не должно настораживать, поскольку при небольшом количестве бактерий состояние ребенка считается удовлетворительным.
Важно: При наличии микроорганизмов выше нормы трудно предсказать течение болезни. Для кого-то этот показатель не вызывает никаких последствий, у других детей заболевание может протекать тяжело. Все зависит от индивидуальных особенностей организма и силы иммунитета.
Лечение инфекции
После обнаружения золотистого стафилококка в кале у ребенка начинают медикаментозную терапию. Но если даже по результатам исследования бактерий много, а малыш чувствует себя хорошо, лечение обычно не назначают. Родители должны обратить внимание на укрепление иммунитета маленького человека.
Сложность лечения состоит в том, что бактерия выделяет фермент пенициллиназу, благодаря которой становится защищена от антибиотиков. Малыша с мамой помещают в стерильный бокс. Грудное кормления не только разрешено, но и поощряется, так как дает организму защитные силы против инфекции.
Видео об эффекте резистентности к антибиотикам:
Лечение лекарственными препаратами направлено на восстановление обменных процессов в организме и уничтожение болезнетворной бактерии.
Оно включает:
- препараты иммуностимулирующего свойства;
- витаминные комплексы;
- антибактериальные средства;
- переливание крови (в случае крайней необходимости).
Антибиотики назначаются в случае быстрого развития болезни и сильных ее проявлениях. Проводится проба на восприимчивость данной бактерии к ряду антибиотиков. Выбирают тот, который обладает наиболее сильным действием.
Важно: Нет необходимости поить малыша большим количеством лекарств. Организм еще слаб, а бактерия невосприимчива ко многим препаратам. Вспомогательными средствами служат отвары трав: зверобоя, календулы, ромашки.
Нужно понимать, что обнаружение стафилококка и стафилококковая инфекция – не одно и то же. Простое инфицирование не нуждается в лечении, но при развитии инфекции без терапевтического воздействия не обойтись.
Больше о лечении стафилококка антибиотиками в статье Как помочь малышу в домашних условиях?
Со второй недели до полугода у «грудничка» достаточно часто возникают проблемы с ЖКТ, поскольку идет активное заселение кишечника бактериями. Нет необходимости кормить малыша таблетками и микстурами, нужно помочь нормализовать пищеварительную деятельность, не нанося вреда другим органам.
При возникновении проблем с животиком помогают:
- Настой семян льна, отвар ромашки аптечной или плодов фенхеля.
- Готовая смесь масел растительного происхождения (Бейби Калм, Плантекс). В их состав входят анисовое, укропное и мятное масло. Они помогают выделению желудочного сока, улучшают пищеварение и повышают моторику кишечника.
- Положение «грудничка» на животе. Так лучше выходят газы при обильном газообразовании и вздутии.
- Массаж животика и упражнение «Велосипед».
- При необходимости ставят клизму, вводят в анальное отверстие глицериновые свечи или дают препарат Микролакс для полного очищения кишечника при запорах. Но без лишней необходимости чистить кишечник не нужно.
К сведению: При грудном вскармливании существует специальный перечень продуктов, который нельзя употреблять маме, поскольку они вызывают метеоризм и вздутие. Из рациона нужно исключить рис, капусту, бобы, виноград, чернику. Мама должна следить за чистотой посуды и выполнять гигиенические процедуры ребенку.
Важно не упустить момент начала инфицирования, поскольку инкубационный период у стафилококка очень короткий. А поскольку интоксикация (отравление) организма малыша протекает быстро и бурно, то самолечение и отказ от медицинской помощи может привести к трагическим последствиям.
Видео от доктора Комаровского о стафилококке и последствиях заражения:
Маленькие дети со слабой иммунной системой, инфекционными заболеваниями чаще всего имеют стафилококки в большом количестве. Бактерии поселяются в детском организме с дисбактериозом, наличием сальмонеллы, кишечной палочки.
Микроорганизмы способствуют образованию и развитию патологических процессов, имеющих неожиданно неприятные результаты. Этот факт влияет на быстрое выздоровление малыша. Несвоевременное лечение может привести к заболеванию гнойно-септического характера.
Причины заболевания у детей
Основной причиной образования недуга выступает нарушенное функционирование местного иммунитета. Особенности стафилококка в том, что он устойчив к ряду антибактериальных средств и окружающей среде.
Доктор Комаровский стафилококк определяет как патогенное влияние на клетки детского организма бактерий семейства Staphylococcus.
Своим определением он не только фокусирует внимание на легкой степени патологического процесса, но и на сложно лечащиеся инфекционные процессы. Стафилококки опасны по той причине, что в ходе их активностей вырабатываются токсины и ферменты в огромном количестве.
Поражению поддаются кожные покровы, клетчатка под кожей, соединительные ткани.
В редких случаях стафилококки провоцируют опасные болезни:
- токсический шок;
- пневмония;
- сепсис;
- острая интоксикация всего организма;
- расстройства ЦНС.
Инфицирование малыша проходит по ряду причин, которые условно делят на три группы.
Слабая иммунная система. Ослабленная защитная система способствует проникновению в организм болезнетворных бактерий, активное их размножении за короткий период времени.
Дети со слабым иммунитетом входят в основную группу зоны риска. Малыши с сильным иммунитетом могут иметь стафилококки в организме, который самостоятельно ведет борьбу с инфекцией без дополнительной терапии.
Несоблюдение правил личной гигиены. Грязь является комфортной средой для образования и распространения вредных микроорганизмов. Часто детей с трудом заставляют мыть руки после прогулки, посещения туалета, перед едой.
Ребята познают мир, все ощупывая на ощупь, вкус, что приводит к поселению инфекции в детских органах. Золотистый стафилококк в горле у ребенка Комаровский считает вполне объяснимым явлением.
Задача взрослых следить за состоянием малыша, определяя, борется ли организм с микробами самостоятельно, что зависит от состояния иммунной системы. При необходимости своевременно начинать лечение.
Третья группа включает в себя контакты с инфицированными людьми. Поврежденные ранее слизистые оболочки и участки кожи принимают удар стафилококков мгновенно.
Рискуют заразиться дети, посещающие детские дошкольные и школьные учреждения, которые питаются в общей столовой, пользуясь приборами.
Работники общепита могут быть носителями инфекции, даже не подозревая этого.
Большое количество детей заражаются патогенной бактерией, пребывая в медицинском учреждении, особенно во время лечения в стационарных отделениях.
Носителями стафилококков могут быть насекомые, которые передают инфекцию при укусе. Поэтому пораженные укусами места незамедлительно следует обработать раствором из соды, перекисью водорода, зеленкой.
Когда стафилококк не опасен
Комаровский про золотистый стафилококк имеет личное мнение. Он считает, что бактерия выступает составляющей частью микрофлоры на коже и слизистых оболочках. Бактерии, располагающиеся на полости носоглотки, кожных участках, волосах, ногтях, в паху и промежностях.
Агрессивность инфекция проявляет при ослаблении иммунной системы. Только при обширном или местном заражении с серьезной симптоматикой проводятся терапевтические процедуры.
Если в результате исследований мазка обнаружен золотистый стафилококк в горле 10 в 4 степени (нормы показателей), врач Комаровский не видит причин для паники.
Антибактериального вмешательства не требуется, но профилактические меры взрослыми малышу должны быть проведены. Лечение назначается только при остром протекании болезни, при определенном виде микроорганизмов.
Места гнойных воспалительных процессов в глотке, ухе, носу обрабатывают соответствующими препаратами, чтобы инфекция не мигрировала по всему организму.
Современная медицина для маленьких пациентов с хроническими инфекционными заболеваниями предлагает вакцинацию против стафилококка.
Лечение заболевания по Комаровскому
Когда обнаружен стафилококк золотистый у детей, Комаровский лечение предлагает в зависимости от места расположения, степени, формы патогенной бактерии. Также учитывается возрастная категория ребенка, состояние иммунной системы, общее состояние здоровья.
Доктор отмечает, что лечить следует стафилококковую инфекцию, а не отдельно стафилококк.
Терапия инфекции достаточно сложный период и для доктора, и для крошечного пациента, и для его родителей.
Микроорганизм устойчив к ряду антибиотиков, что сказывается в период лечения на бесполезности многих препаратов.
Группа пенициллиновых антибактериальных средств являлась наиболее эффективной при борьбе с патогенным микроорганизмом, по мнению доктора Комаровского, ранее.
В современной фармакологии синтезируются новые антибиотики, которые не всегда эффективны в применении.
Например, лечение золотистого стафилококка Комаровский не всегда назначает антибиотиками.
Бывают случаи, когда без этих вредных для детского организма средств можно вполне обойтись.
После пищевого отравления, Комаровский не исключает золотистый стафилококк у грудничка в кале. И это нормальный фактор, который не требует антибактериального вмешательства.
По словам Комаровского терапия стафилококковых патологий сложная задача, путь которой долгий и дорогой, но всегда при правильном использовании медикаментов положительно результативен. Стафилококк не может быть устойчивым ко всем антибиотикам.
Главная задача бактериологическими способами определить не только причину болезни, но и выявить чувствительность к препаратам. Только после этого лечение будет радовать своей эффективностью.
Когда находится стафилококк в носу у ребенка, лечение Комаровский направляет на укрепление иммунной системы. Только при сильном иммунитете стафилококк бессилен и его нахождение в органах малыша безвредны, не провоцируют патологических процессов разных направлений.
Дети обречены быть соседями стафилококков.
Хотя данное соседство не доставляет восторга, но оно достаточно терпимое при правильном отношении взрослых к явлению.
Важно поддерживать здоровье малыша на требуемом уровне, не допускать снижения защитной системы, не провоцировать воспалительные процессы, инфекционные болезни.
Профилактика
Специалисты утверждают, что любой патологический процесс легче предотвратить, нежели лечить. Профилактические меры стафилококкового микроорганизма напрямую зависят от защитных функций организма.
Имея крепкое здоровье, малышу стафилококк не доставляет неудобств и опасности. Организм самостоятельно может побороть бактерию.
Главная задача взрослых помочь ребенку не допустить провоцирующих факторов для усугубления проблемы:
- питание малыша должно быть сбалансированным, содержащим все нужные вещества;
- следует исключить в больших количествах употребление ребенком сладостей, жирной и жареной пищи, копченостей, колбасных изделий;
- ребенок должен вести активный образ жизни, занятие спортом, пешие или велосипедные прогулки свежим воздухом полезны для здоровья;
- времяпровождение перед компьютером и телевизором должно быть минимальным;
- правила личной гигиены должны соблюдаться малышом в полной мере.
Стафилококк легко попадает в организм крохи, но при всех профилактических мерах его распространение в большом количестве практически невозможно.
Следует обследовать ребенка на наличие патогенных микробов раз в шесть месяцев, чтобы вовремя выявить проблему и найти пути ее решения.
Инвазивные инфекции золотистого стафилококка у госпитализированных младенцев — ScienceDaily
Инвазивные метициллин-чувствительные стафилококки. aureus (S. aureus) (MSSA) вызвала больше инфекций и больше смертей у госпитализированных младенцев, чем инвазивная метициллин-резистентная инфекция S. aureus (MRSA), что предполагает, что меры по предотвращению инфекций S. aureus должны включать MSSA в дополнение к MRSA, согласно к статье, опубликованной на сайте JAMA Pediatrics.
стр.Брайан Смит, доктор медицины, магистр здравоохранения, MHS из Медицинской школы Университета Дьюка, Дарем, Северная Каролина, и соавторы сравнили демографические данные и смертность младенцев с MRSA и MSSA в 348 отделениях интенсивной терапии новорожденных (NICU) в Соединенных Штатах, чтобы определить ежегодный доля инфекций S. aureus, которые были инфицированы MRSA, и для сравнения риска смерти после инвазивных инфекций MRSA и MSSA.
Авторы идентифицировали 3 888 из 887 910 младенцев (0,4 процента) с 3 978 инвазивными инфекциями S. aureus.Инфекции чаще вызывались MSSA (2 868 из 3978 или 72,1 процента), чем MRSA (1 110 из 3978 или 27,9 процента).
В целом, согласно результатам, инвазивная инфекция S. aureus составляла 44,8 случаев на 10 000 младенцев. Ежегодная заболеваемость инвазивной инфекцией S. aureus увеличивалась с 1997 по 2006 год, а затем несколько снизилась с 2007 по 2012 год.
Исследование показывает, что инвазивные инфекции S. aureus чаще встречались у младенцев, родившихся с массой тела менее 1500 граммов (3061 из 136 797 или 223.8 на 10 000 младенцев), чем у младенцев, родившихся с массой тела 1500 г и выше (915 из 748 715 или 12,2 на 10 000 младенцев).
Больше младенцев с инвазивными инфекциями MSSA (n = 237) умерло до выписки из больницы, чем младенцев с инвазивными инфекциями MRSA (n = 110). Тем не менее, доли младенцев, умерших после инвазивных инфекций MSSA и MRSA, были одинаковыми: 237 из 2474 (9,6 процента) и 110 из 926 (11,9 процента). Результаты показывают, что скорректированный риск смерти перед выпиской из больницы и риск смерти через семь и 30 дней после инвазивной инфекции были одинаковыми для младенцев с инвазивной инфекцией MSSA и инвазивной инфекцией MRSA.
«Абсолютное количество инфекций и смертей из-за MSSA превышает количество случаев из-за MRSA. Следует рассмотреть возможность расширения усилий по борьбе с инфекциями в больницах, направленных на MRSA, с целью включения MSSA. Будут проведены будущие исследования для более точного определения взаимосвязи между колонизацией MSSA и последующим инфицированием помогают прояснить важность таких вмешательств для предотвращения болезни MSSA », — заключает исследование.
От редакции: Распространение преимуществ профилактики инфекций в отделении интенсивной терапии
В соответствующей редакционной статье Пабло Дж.Санчес, доктор медицинских наук, из Национальной детской больницы Университета штата Огайо, Колумбус, и соавторы пишут: «В заключение, ключом к минимизации заболеваемости и смертности от любого организма (включая S. aureus) должно быть предотвращение горизонтальной передачи, которая может привести к Вспышки ОИТН. Мы знаем, что горизонтальная передача инфекции происходит через руки медицинских работников, поэтому гигиена рук как часть стандартных мер предосторожности и мер предосторожности, основанных на передаче инфекции, остается основой профилактики. Гигиена рук экономична и проста в выполнении…. Общей целью должно оставаться предотвращение передачи, и наиболее эффективная стратегия профилактики уже в наших руках ».
История Источник:
Материалы предоставлены The JAMA Network Journals . Примечание. Содержимое можно редактировать по стилю и длине.
,границ | Исследование транскриптомики биопленки Staphylococcus aureus при низкой концентрации ампициллина
Введение
Спрос на животный белок для потребления человеком во всем мире растет. Суточное потребление животного белка в Азии увеличилось с 7 граммов на душу населения в день в 1960 году до 25 граммов на душу населения в день в 2013 году (Guo et al., 2000). Чтобы удовлетворить это требование, антибиотики широко применяются в животноводстве для поддержания здоровья и продуктивности животных, тем самым способствуя распространению устойчивых к противомикробным препаратам животных и патогенов человека, и имеют серьезные последствия для общественного здравоохранения (Van Boeckel et al., 2015). Среднее годовое потребление антибиотиков во всем мире составило 172 мг / кг, 148 мг / кг и 45 мг / кг для свиней, кур и крупного рогатого скота, соответственно (Van Boeckel et al., 2015). По оценкам, в Соединенных Штатах на использование противомикробных препаратов для пищевых животных приходится примерно 80% годового потребления противомикробных препаратов в стране (Food and Drug Administration, 2010). В 2010 году Китай был крупнейшим потребителем противомикробных препаратов для домашнего скота, а потребление антибиотиков в Китае оценивалось в 162000 тонн в 2013 году, из которых 52% применялись для животных (Van Boeckel et al., 2015; Zhang et al., 2015). Такое широкое использование антибиотиков в животноводстве способствует появлению устойчивых к противомикробным препаратам патогенных бактерий и создает серьезные угрозы здоровью населения. Повторяющееся воздействие низких доз антимикробных агентов создает оптимальные условия для появления и распространения устойчивых к противомикробным препаратам бактерий у животных (You and Silbergeld, 2014; Lin et al., 2018). Бактерии, устойчивые к противомикробным препаратам животного происхождения, могут передаваться сельскохозяйственным рабочим при прямом контакте, а другим людям через продукты питания и окружающую среду (Price et al., 2005; Graham et al., 2009; Смит и др., 2013; Xu et al., 2017).
Staphylococcus aureus — один из наиболее распространенных патогенов человека и животных и один из первых штаммов, устойчивых к противомикробным препаратам. Пенициллин впервые был использован в животноводстве в конце 1940-х годов, а S. aureus с устойчивостью к пенициллину наблюдались в 1948 году (Huttner et al., 2013). В настоящее время большинство из штаммов S. aureus проявляют устойчивость к пенициллину, продуцируя бета-лактамы.В последнее десятилетие более широкое признание получили биопленок S. aureus , которые являются основной причиной беспокойства при множественных инфекциях и связаны с хроническими инфекциями (Conlon, 2014). Исследования in vitro и in vivo показали, что биопленки создают проблемы для медицины и промышленности из-за их повышенной толерантности к противомикробным и дезинфицирующим средствам (Bjarnsholt et al., 2013; Neopane et al., 2018). Развитие биопленки было разделено на три стадии: начальное прикрепление, созревание биопленки и распространение, а позднее было предложено включить пять стадий: прикрепление, размножение, исход, созревание и распространение (O’Toole et al., 2000; Moormeier et al., 2014; Miao et al., 2017). Рост биопленок играет важную роль во время бактериальной инфекции благодаря защите от нескольких механизмов очистки (Stewart and Costerton, 2001). Формирование биопленок S. aureus также связано с железами, факторами вирулентности, поверхностными белками и системой контроля кворума регулятора дополнительных генов (agr), экспрессия которой зависит от условий окружающей среды (Cucarella et al., 2001; Yarwood et al., 2004 ; Poupel et al., 2018; Swarupa et al., 2018).Кроме того, клетки биопленки демонстрируют повышенную устойчивость к антибиотикам (de la Fuente-Nunez et al., 2013; Lin et al., 2018). Сообщалось, что S. aureus , выделенные от госпитализированных пациентов, обладают высокой способностью к формированию биопленок с высокой тенденцией к проявлению устойчивости к противомикробным препаратам, множественной лекарственной устойчивости и устойчивости к метициллину (Neopane et al., 2018). Было показано, что субингибирующая концентрация метициллина приводит к резкому увеличению образования биопленок до S.aureus , который зависел от активности автолиза, связанной с atl (Kaplan et al., 2012; Ranieri et al., 2018).
Однако влияние низких концентраций давления ампициллина в пищевых продуктах на образование биопленок S. aureus , а также механизм остается неясным. В этом исследовании механизм регуляции низкой концентрации ампициллина в качестве распространенного антибиотика, применяемого в животноводстве на биопленках S. aureus , был выяснен с помощью анализа транскриптомики.
Материалы и методы
Бактериальные штаммы и условия роста
Штамм Staphylococcus aureus FAHGMU10071 был выделен от пациента в Первой аффилированной больнице Медицинского университета Гуанчжоу в Гуанчжоу, Китай, и хранился как запас глицерина при -80 ° C. Небольшое количество исходного материала наносили на триптон-соевый агар (TSA) и инкубировали при 37 ° C в течение 24 часов для получения изолированных колоний. Единственную колонию переносили в 2 мл триптон-соевого бульона (TSB) и инкубировали при 37 ° C со встряхиванием при 200 об / мин в течение ночи перед дальнейшими экспериментами.Минимальную ингибирующую концентрацию (МИК) измеряли методом микроразбавления бульона.
Сбор образцов биопленок
40 мл ночной культуры S. aureus инокулировали в 2 мл свежего TSB и инкубировали при 37 ° C со встряхиванием при 200 об / мин в течение 3 ч для достижения логарифмической фазы роста. Затем культуру логарифмического роста дважды промывали стерильным PBS и разбавляли до 10 7 клеток / мл в TSB. 5 мл культуры добавляли в плоскодонный 6-луночный планшет (Trasadingen, Швейцария) и инкубировали при 37 ° C с легким встряхиванием (10–20 об / мин) в течение 8 ч для образования биопленки.Жизнеспособность биопленок и биомасса определялись с помощью анализов XTT и Crystal Violet Staining соответственно (Christensen et al., 1985; Silva et al., 2008). Эксперимент проводили в трех повторностях, и образцы биопленок собирали через 8 часов, чтобы они стали контрольными группами (C1, C2 и C3). Для групп, индуцированных ампициллином (A1, A2 и A3), в группу добавляли 1/4 МИК ампициллина. тем временем плоскодонный 6-луночный планшет и образцы биопленки собирали через 8 часов.
Выделение РНК, построение библиотеки и секвенирование
Суммарная РНК из S.Образцы биопленок aureus (A1, A2, A3, C1, C2 и C3) экстрагировали с использованием реагента TRizol (Sigma-Aldrich, США) и набора для экстракции бактериальной тотальной РНК (Sigma-Aldrich, США) на основе рекомендаций производителя. инструкция (Liu et al., 2016a, b). Качество и количество образцов РНК определяли на спектрофотометре Ultramicro K5500 (Beijing Kaiao Technology Development Co., Ltd., Китай) и Agilent 2200 TapStation (Agilent Technologies, США). Для удаления следов ДНК и рибосомных РНК используют ДНКазу I, не содержащую РНКаз (Ambion Inc., США) и набор MICROBExpressTM (Ambion Inc., США) соответственно (Liu et al., 2016a). МРНК фрагментировали ультразвуком, а затем обратно транскрибировали в кДНК (Liu et al., 2016a). Конструирование библиотек RNA-seq и секвенирование РНК было выполнено в трех биологических повторностях компанией RIBOBIO Biotechnology Company (Гуанчжоу, Китай) с использованием набора Illumina Paired End Sample Prep и платформы Illumina Hiseq 2500 соответственно (Liu et al., 2016a).
Идентификация и аннотации дифференциально экспрессируемых генов
необработанных считываний было сгенерировано из данных изображения и сохранено в формате FASTQ.Необработанные данные были отфильтрованы для удаления загрязненных адаптеров и последовательностей низкого качества и получения чистых считываний. Качество чистых считываний проверяли с помощью FastQC v.0.10.1 и сравнивали с эталонным геномом S. aureus NCTC 8325 (эталонная последовательность NCBI: NC_007795) с использованием TopHat (Trapnell et al., 2009). В выравнивании допускалось не более 2 несоответствий оснований и разрыв чтения. Покрытие генов рассчитывали по проценту генов, охваченных считыванием, а функциональную аннотацию генов выполняли с помощью ANNOVAR (Wang et al., 2010). Дифференциально экспрессируемые гены (DEG) были идентифицированы с использованием DEGseq panormalage (Anders, 2010; Anders and Huber, 2012) на основе отрицательного биномиального распределения. Уровень экспрессии генов был измерен на основе значений числа считываний на килобазу транскрипта на миллион отображенных считываний (RPKM) и значений P , скорректированных с использованием панормалажа edgeR (Mortazavi et al., 2008; Robinson et al., 2010). | Гены с скорректированным | log 2 (кратное изменение) | > 1 и P -значение <0,05 были идентифицированы как DEG.Киотская энциклопедия генов и геномов (KEGG) и аннотация генов онтологии (GO) для DEG выполнялись кобами на основе базы данных KEGG (Kanehisa and Goto, 2000) и базы данных GO (Ashburner et al., 2000), соответственно. Значительно обогащенные пути KEGG и термины GO были идентифицированы с помощью P -значение <0,05 в точном тесте Фишера и P -значение <0,01 в гипергеометрическом распределении, соответственно, и скорректированных с учетом коэффициентов ложного обнаружения (FDR) (Storey, 2002; Rivals et al., 2007).
Валидация ОТ-ПЦР
Для подтверждения данных РНК-seq была проведена ОТ-ПЦР для количественной оценки транскриптов мРНК 10 выбранных DEG с использованием Light Cylcler 480 (Roche, Швейцария) в соответствии с инструкциями производителя. Каждую реакцию ОТ-ПЦР проводили в конечном объеме 25 мкл. Профиль термоциклирования был следующим: 42 ° C в течение 60 минут и 72 ° C в течение 10 минут; 40 циклов 95 ° C в течение 15 секунд, 60 ° C в течение 30 секунд, 72 ° C в течение 30 секунд и конечное расширение 68 ° C в течение 10 минут.Также были включены образцы отрицательного контроля, содержащие стерильную воду. Пороговые значения цикла (C T ) были определены, и относительные кратные различия были рассчитаны методом 2 -ΔΔCT 54 с использованием 16S рРНК в качестве контрольного гена. Три независимых эксперимента проводили в трех повторностях.
Результаты и обсуждение
Общие характеристики профиля транскриптома
При обработке 1/4 МПК ампициллина в течение 8 ч биопленка S.aureus FAHGMU10071 продемонстрировал резкое увеличение биомассы и жизнеспособности по сравнению с контролем без обработки (Рисунок 1; Xu et al., 2018). Чтобы получить более полное представление о механизме регуляции образования биопленки S. aureus антибиотиком низкой концентрации, был проведен анализ последовательности РНК на трех биологических повторностях биопленки S. aureus , выращенной при 37 ° C в течение 8 ч с (A1, A2 и A3) и без (C1, C2 и C3) 1/4 МПК ампициллина. Библиотеки кДНК 6 S.Были сконструированы, секвенированы и сгенерированы образцы биопленок aureus с общим количеством от 29 684 588 до 40 756 932 прочтений, которые были сопоставлены с эталонным геномом S. aureus NCTC 8325 (эталонная последовательность NCBI: NC_007795) (дополнительная таблица S1). Общие уровни экспрессии генов трех биологических повторов каждой группы показали высокое сходство друг с другом, что свидетельствует о том, что данные RNA-seq были доступны для анализа транскриптома (номер доступа NCBI SRA: SRP154796).Уровни экспрессии генов, определенные по средним значениям RPKM, продемонстрировали, что всего 2840 генов были экспрессированы в индуцированной ампициллином и контрольной группах.

РИСУНОК 1. Биомасса (A) и жизнеспособность (B) ампициллина индуцировали биопленку S. aureus .
Дифференциально экспрессируемый ген (DEG)
Идентифицировано по скорректированному | протоколу 2 (кратное изменение) | > 1 и P -значение <0,05 (рисунок 2; Tan et al., 2015), было получено 530 DEG с 167 и 363 генами, показывающими повышающую и понижающую регуляцию, соответственно (дополнительный рисунок S1 и дополнительная таблица S2). Учитывая наиболее дифференциально экспрессируемые гены, 6 из значительно активированных генов показали | log 2 (изменение в раз) | > 2 и 10 из значительно подавленных генов показали | log 2 (кратное изменение) | > 4. 6 активированных генов кодируют АТФазу семейства катионных транспортеров E1-E2, аргининосукцинатсинтазу, 6-фосфо-бета-галактозидазу, аргининосукцинатлиазу, субъединицу IIBC-специфичного транспортера лактозы системы PTS и белок биосинтеза рибофлавина соответственно.10 генов с пониженной регуляцией кодируют карбаматкиназу, аргинин / орнитиновый антипортер, 2-изопропилмалатсинтазу, орнитинкарбамоилтрансферазу, белок фаговой головки, 23S рибосомную РНК и 4 гипотетических белка, соответственно.
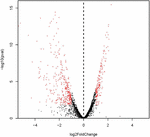
РИСУНОК 2. Дифференциальный уровень экспрессии ампициллин-индуцированной (A1, A2 и A3) и контрольной (C1, C2 и C3) групп, идентифицированных как | журнал 2 (изменение кратности) | > 1 и отрегулируйте P -значение <0,05.
С учетом S.aureus , DEGs в биопленке, индуцированной ампициллином, включают некоторые ключевые гены, кодирующие поверхностные белки, факторы вирулентности, адгезины, протеазы и капсульные полисахаридные белки (Wang and Wood, 2011). Гены cap5B и cap5C , опосредующие биосинтез капсульного полисахарида, были значительно активированы. Штамм S. sureus FAHGMU10071 может способствовать образованию биопленок путем синтеза капсульных полисахаридов при низкой концентрации ампициллина.Однако экспрессия генов, кодирующих протеазы ClpB и ClpC, которые необходимы для устойчивости к стрессу, внутриклеточной репликации и образования биопленок (Frees et al., 2004), а также генов, кодирующих адгезины SdrD и Fib, значительно снизились. Недавно сообщенный фактор вирулентности, spdC, который контролирует активность гистидинкиназы, и главный регулятор метаболизма цистеина, cymR, который играет роль в формировании биопленок у S. aureus , не показал значительной дифференциальной экспрессии (Soutourina et al., 2009; Poupel et al., 2018).
GO Анализ функционального обогащения
Для дальнейшего понимания функции DEG, лежащей в основе эффекта низкой концентрации ампициллина на биопленку S. aureus , был проведен анализ обогащения GO с 530 °. На основании гомологии последовательностей DEG были отнесены к одному или нескольким GO-терминам и разделены на 535, 536 и 277 GO-терминов вторичного уровня в трех основных категориях (биологический процесс, молекулярная функция и клеточный компонент) функции GO, соответственно.После функционального обогащения ГО было идентифицировано 183, 252 и 21 конкретный термин ГО в биологическом процессе, молекулярной функции и клеточном компоненте, соответственно (дополнительная таблица S3). Существенно обогащенные термины GO, состоящие из трех конкретных категорий, были проиллюстрированы на рисунке 3. Девять терминов GO были обогащены в категории биологического процесса, включая «трансляцию», «регулирование транскрипции, ДНК-шаблон», «процесс биосинтеза треонина», « деление клеток »,« углеводный трансмембранный транспорт »,« углеводный метаболический процесс »,« система передачи фосфорелейного сигнала »,« фосфоенолпируват-зависимая сахарная фосфотрансферазная система »и« процесс биосинтеза лизина с помощью диаминопимелата ».В категории молекулярной функции «связывание ДНК», «связывание рРНК», «структурная составляющая рибосомы», «связывание РНК», «связывание АТФ», «связывание катиона никеля» и «связывание ионов металла» были значительно обогащены. Только 2 термина ГО «составной компонент мембраны» и «внеклеточная область» обогатились в категорию клеточного компонента.
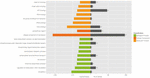
РИСУНОК 3. Значительно обогащенные GO термины дифференциально экспрессируемых генов.
Обогащение пути KEGG
Чтобы идентифицировать вовлеченные пути, DEG картировали в базе данных KEGG с последующим анализом обогащения пути KEGG (дополнительная таблица S4).Пути KEGG «Метаболизм глицина, серина и треонина», «Система фосфотрансфераз (PTS)», «Биосинтез аргинина», «Микробный метаболизм в различных средах», « Staphylococcus aureus, инфекция», «Биосинтез монобактама», «Метаболизм азота», и «Биосинтез лизина» были значительно обогащены (Рисунок 4).

РИСУНОК 4. Значительно обогащенные пути KEGG дифференциально экспрессируемых генов.
Треонин, незаменимая аминокислота, не синтезируемая животными, образуется из аспартата в бактериях и растениях.В пути метаболизма глицина, серина и треонина (рис. 5) аспартаткиназа (EC: 2.7.2.4), полуальдегиддегидрогеназа аспартата (EC: 1.2.1.11), гомосериндегидрогеназа (EC: 1.1.1.3), гомосеринкиназа (EC: 1.1.1.3) EC: 2.7.1.39) и треонинсинтаза (EC: 4.2.3.1) функциональны во время биосинтеза треонина (аспартат — гомосерин — треонин) (Rees and Hay, 1995; Gaupp et al., 2010). L-аспартат фосфорилируется аспартаткиназой с образованием L-4-аспартилфосфата, который восстанавливается до L-аспартат-4-полуальдегида с помощью аспартат-полуальдегиддегидрогеназы.Полуальдегид дополнительно восстанавливается гомосериндегидрогеназой до небелковой аминокислоты гомосерина. Гомосеринкиназа фосфорилирует гомосерин с образованием O-фосфо-L-гомосерина, который превращается в треонин под действием треонинсинтазы (Rees and Hay, 1995). Все гены, кодирующие ключевые функциональные ферменты в процессе биосинтеза треонина, показали значительное подавление в индуцированной ампициллином биопленке, что указывает на ослабленную активацию пути биосинтеза треонина во время образования S.биопленка aureus , обработанная антибиотиками. Функциональные ферменты, включая холиндегидрогеназу (EC: 1.1.99.1) и бетаинальдегиддегидрогеназу (EC: 1.2.1.8) во время биосинтеза бетаина (холин-бетаин) в пути «метаболизм глицина, серина и треонина» (Рисунок 5), также были значительно подавляется в биопленке, индуцированной ампициллином.
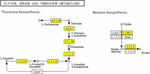
РИСУНОК 5. Значительно обогащенный путь KEGG «метаболизм глицина, серина и треонина» (желтые светлые участки обозначают подавление регуляции, а зеленые светлые участки обозначают повышение) (Kanehisa and Goto, 2000; Kanehisa et al., 2017).
СТВ был охарактеризован как основной бактериальный механизм поглощения углеводов, особенно гексоз, гекситов и дисахаридов, которые относят к углеводам СТВ (Kotrba et al., 2001). Поглощение углеводов и их превращение катализируются СТВ в соответствующие фосфоэфиры во время процесса транспорта (Tchieu et al., 2001). Четыре последовательных переноса фосфорила появляются в PTS (Tchieu et al., 2001). При использовании фосфоенолпирувата (PEP) в качестве субстрата за начальным аутофосфорилированием фермента I (EI) следует перенос фосфорильной группы с EI на гистидинфосфонесущий белок (HPr) (Tchieu et al., 2001). Самофосфорильный перенос от HPr, после которого фосфорильная группа переносится на гистидиновые или цистеиновые остатки EIIB, катализируется ферментом II (EII) A (Tchieu et al., 2001). Специфический сахарид транспортируется через мембраносвязанный EIIC и фосфорилируется соответствующим сахарид-специфическим EIIB (Tchieu et al., 2001). В семействе L-аскорбатов гены, кодирующие EIIABC (UlaA, UlaB и UlaC), которые катализируют, транспортируют и фосфорилируют L-аскорбат до L-арсорбат-6-фосфата, значительно подавляются.Это предполагает более низкое поглощение L-аскорбата в биопленке, индуцированной ампициллином (рис. 6). Повышающая регуляция генов, кодирующих EIIABC в семействе лактозы (LacE и LacF) и семействе фруктозы (MtlA, FruA и FruB), выявила снижение поглощения лактозы и фруктозы в биопленке, индуцированной ампициллином (рис. 6).
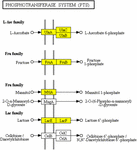
РИСУНОК 6. Значительно обогащенный путь KEGG «Фосфотрансферазная система (PTS)» (желтые светлые участки обозначают подавление регуляции, а зеленые светлые участки — повышающую регуляцию) (Kanehisa and Goto, 2000; Kanehisa et al., 2017).
В цикле мочевины пути «биосинтеза аргинина» гены, кодирующие основные ферменты, включая орнитинкарбамоилтрансферазу (EC: 2.1.3.3), аргининосукцинатсинтазу (EC: 6.3.4.5), аргининосукцинатлиазу (EC: 4.3.2.1), аргиназу (EC : 3.5.3.1), а аргининдезиминаза (EC: 3.5.3.6) продемонстрировала значительное подавление (рис. 7). Однако гены, кодирующие бифункциональную орнитинацетилтрансферазу / N-ацетилглутаматсинтазу argJ (EC: 2.3.1.1) ацетилглутаматкиназу (EC: 1.2.1.38), и N-ацетил-гамма-глутамилфосфатредуктаза argC (EC: 2.7.2.8), которые катализируют глутамат до полуальдегида N-ацетилглутамата, были значительно повышены (фигура 7A). Путь диаминопимелиновой кислоты (DAP) в пути «биосинтеза лизина» связан с метаболизмом аргинина (Velasco et al., 2002). Подобно генам, участвующим в пути «биосинтеза аргинина», гены, кодирующие ферменты [гомосериндегидрогеназа (EC: 1.1.1.3), аспартаткиназа (EC: 2.7.2.4, EC: 2.7.2.4), аспартат-полуальдегиддегидрогеназа (EC: 1.2.1.11), 4-гидрокситетрагидродипиколинатсинтаза (EC: 4.3.3.7) и 4-гидрокситетрагидродипиколинатредуктаза (EC: 1.17.1.8)], участвующие в DAP, были значительно ниже. регулируется (Рисунок 7B).
РИСУНОК 7. Значительно обогащенные пути KEGG «Биосинтез аргинина» (A) и «Биосинтез лизина» (B) (желтые участки обозначают подавление регуляции, а зеленые участки обозначают повышение) (Kanehisa and Goto, 2000 ; Канехиса и др., 2017).
Основной цикл азота в пути метаболизма азота включает четыре пути восстановления и два пути окисления. В биопленке S. aureus , индуцированной ампициллином, 6 генов, кодирующих нитратредуктазу NarGHIJ, NirBD и NxrAB, участвующих в диссимиляционном восстановлении нитратов, денитрификации и нитрификации, были значительно подавлены (рис. 8). Сообщалось, что метаболизм азота участвует в устойчивости к антибиотикам (Borriello et al., 2004; Yan et al., 2013). Таким образом, значительное обогащение пути «метаболизма азота» в группе биопленок, индуцированных ампицилином, указывает на ответ биопленок S. aureus на ампициллин. Кроме того, в общей сложности 44 гена, участвующих в «микробном метаболизме в различных средах», были значительно активированы или подавлены, что демонстрирует ответ биопленок S. aureus на ампициллин.
DEGs вовлечены в инфекцию « Staphylococcus aureus » Путь
Инфекции, включая поверхностные кожные инфекции, пищевые отравления и опасные для жизни инфекции, могут быть вызваны S.aureus , который снижает эффективность иммунной системы несколькими способами: модулирование чувствительности к катионным антимикробным пептидам путем увеличения положительного чистого заряда цитоплазматической мембраны, экспрессия суперантигенов, которые предотвращают развитие общего иммунного ответа или вызывают рвотный ответ при приеме внутрь, и секретирование иммуномодулирующих белков которые ингибируют активацию комплемента и хемотаксис или лизис нейтрофилов (Foster, 2009; Kanehisa et al., 2017). Способность S. aureus колонизировать хозяина и образовывать биопленку, вероятно, частично определяется его способностью к адгезии (Foulston et al., 2014; Scherr et al., 2014). Сообщалось, что поверхностные белки, включая фактор комкования B (ClfB), регулируемую железом поверхностную детерминанту (IsdA), SdrC, SdrD и поверхностный белок S. aureus (SasG), могут способствовать адгезии in vitro (Foster, 2009). Сообщалось, что экспрессирующие SasG штаммы S. aureus образуют биопленку независимо от полисахаридного межклеточного адгезина (PIA) (Corrigan et al., 2007). SasG способен маскировать микробных поверхностных компонентов S. aureus , распознающих связывание молекул адгезивной матрицы (MSCRAMM) со своими лигандами, и улучшать образование биопленок (Corrigan et al., 2007). Повышенная регуляция генов, кодирующих поверхностные белки ClfB, IsdA и SasG, которые способствуют адгезии S. aureus в биопленке, индуцированной ампициллином, объясняет повышенную жизнеспособность и биомассу биопленок (рис. 9). Фактор слипания A (ClfA), который является основным связывающим фибриноген белком на поверхности клеток из стационарной фазы роста, как сообщается, действует как защитный антиген и детерминанта вирулентности (Josefsson et al., 2001). Повышающая регуляция гена clfA подразумевает защиту S.aureus , столкнувшись с антибиотическим стрессом из-за ClfA (рис.9). Очевидно, что значительно активированные гены, кодирующие белки VraF, VraG, Dlt, Aur, обладающие активностью устойчивости к противомикробным препаратам, указывают на положительный ответ S. aureus на ампициллин (рис. 9; Foster, 2009).
РИСУНОК 9. Значительно обогащенный путь KEGG «Инфекция Staphylococcus aureus » (желтые участки обозначают подавление регуляции, а зеленые участки обозначают повышенную регуляцию) (Kanehisa and Goto, 2000; Kanehisa et al., 2017).
Что касается токсинов, участвующих в этом пути, гены, кодирующие цитолитические токсины Hlg / Luc и иммуномодулирующий модуль Spa, показали значительное подавление регуляции, в то время как гены, кодирующие суперантигены, энтеротоксин и эксфолиативный токсин Eta, значительно активировались во время индуцированного ампициллином образования биопленки (Рисунок 9). , Гены, кодирующие токсин-1 синдрома суперантигенного токсического шока (TSST-1), не показали значительной дифференциальной экспрессии.
DEGs, участвующие в путях «биосинтеза монобактама» и «устойчивости к бета-лактамам»
Монобактамы — это бета-лактамные антибиотики, содержащие моноциклическое бета-лактамное ядро, которое отличается от основных структур пенициллина и цефалоспорина с другим слитым кольцом (Hamed et al., 2013). Гены, кодирующие аспартаткиназу (EC: 2.7.2.4), полуальдегиддегидрогеназу аспартата (EC: 1.2.1.11), 4-гидрокситетрагидродипиколинатсинтазу (EC: 4.3.3.7) и 4-гидрокситетрагидродипиколинатредуктазу (EC: 1.17. 1.8), которые вовлечены в часть пути «биосинтеза монобактама», показали значительное подавление (фиг. 10A).
РИСУНОК 10. Значительно обогащенные пути KEGG «Биосинтез монобактама» (A) и «резистентность к бета-лактаму» (B) (желтые участки обозначают подавление регуляции, а зеленые участки обозначают повышение) (Канехиса и Гото , 2000; Канехиса и др., 2017).
Кроме того, 5 из 9 DEG участвовали в пути «устойчивости к бета-лактамам» и показали значительную повышенную регуляцию в группе, индуцированной ампициллином, по сравнению с контрольной группой (фигура 10B). Повышение регуляции генов, связанных с «резистентностью к бета-лактамам», указывает на то, что штамм является ответом на стресс, связанный с бета-лактамом (ампициллин). Бета-лактамные антибиотики усиливают свое действие на стенки бактериальных клеток, препятствуя структурному сшиванию пептидогликанов. Бактериальная устойчивость к бета-лактамным антибиотикам может быть приобретена с помощью стратегий, включающих производство инактивированных бета-лактамаз, изменение мишеней бета-лактама для пенициллин-связывающих белков (PBP), снижение транспорта бета-лактамов в периплазматическое пространство за счет изменений порина, и исключение бета-лактамов с помощью откачивающих насосов (Zapun et al., 2008; Канехиса и др., 2017). В биопленке, индуцированной ампициллином, гены, кодирующие эффлюксную помпу с множественной лекарственной устойчивостью AbcA и пенициллин-связывающие белки PBP1, PBP1a / 2 и PBP3, были значительно активированы. Механизм устойчивости штамма S. aureus FAHGMU10071 к ампициллину низкой концентрации может заключаться в активации оттока AbcA насоса с множественной лекарственной устойчивостью и связывающих пенициллин белков PBP1, PBP2 и PBP3. PBP, которые являются ферментами, участвующими в последних стадиях биосинтеза пептидогликана, были интенсивно изучены, особенно с учетом роли некоторых важных патогенов, включая S.sureus по устойчивости к бета-лактамам. Четыре нативных PBP (PBP1 — PBP4) и устойчивый к метициллину S. aureus (MRSA) специфический PBP2a были идентифицированы в S. aureus . PBP 1, 2 и 3 из S. aureus необходимы для жизнеспособности и являются мишенями для бета-лактамных антибиотиков (Waxman and Strominger, 1983). PBP1 из S. aureus , как сообщается, также важен для роста и деления клеток (Pereira et al., 2007).
Валидация ОТ-ПЦР
Десять генов с разными профилями экспрессии были отобраны для проверки результатов RNA-seq.10 генов были отобраны на основании трех критериев: (i) Функция гена. Десять генов были DEG из различных значительно обогащенных терминов GO, категорий COG и путей KEGG. (ii) Уровень экспрессии. Среди 10 генов 5 были активированы, а остальные — подавлены. (iii) Положение гена в геноме. Отобранные 10 генов располагались в разных положениях генома. Уровни мРНК 10 выбранных генов, определенные с помощью qRT-PCR, соответствовали уровням из анализа RNA-Seq.
Заключение
В данном исследовании рассматривается регуляторный механизм низкой концентрации ампициллина на S.aureus было выявлено образование биопленок. Жизнеспособность и биомасса биопленки, индуцированной ампициллином, резко увеличились по сравнению с биопленкой, не индуцированной ампициллином. Всего 530 DEG с 167 и 363 генами, показывающими повышающую и понижающую регуляцию, соответственно, были получены путем секвенирования РНК. После функционального обогащения ГО было идентифицировано 183, 252 и 21 специфический термин ГО в биологическом процессе, молекулярной функции и клеточном компоненте, соответственно. Было значительно обогащено восемь путей KEGG, включая «Микробный метаболизм в различных средах», « Staphylococcus aureus » и «Биосинтез монобактама».Кроме того, путь «устойчивости к бета-лактамам» также был сильно обогащен. В биопленке, индуцированной ампициллином, значительная повышающая регуляция генов, кодирующих эффлюксный насос множественной лекарственной устойчивости AbcA, пенициллин-связывающих белков PBP1, PBP1a / 2 и PBP3, а также белков устойчивости к противомикробным препаратам VraF, VraG, Dlt и Aur указывает на положительный ответ . S. aureus к ампициллину. Повышение регуляции генов, кодирующих поверхностные белки ClfB, IsdA и SasG, а также генов ( cap5B и cap5C ), которые способствуют адгезии S.aureus в биопленке, индуцированной ампициллином, может объяснить повышенную жизнеспособность биопленки и биомассу.
Авторские взносы
ZX и AW разработали исследование, участвовали в его разработке и координации. YH, LY и DC проводили сбор штаммов и подготовку образцов. LL и BL провели экстракцию РНК, конструирование библиотеки и последовательность РНК. JL и BP выполнили идентификацию и аннотацию DEG. JS, TS, JH и MS провели биоинформатический анализ. JL, BZ и YL провели анализ путей.Все авторы просмотрели и одобрили окончательную рукопись.
Финансирование
Эта работа была поддержана Национальной программой ключевых исследований и разработок Китая (2016YFD04012021), Научно-технологической программой города Гуанчжоу (201510010241), Специальной программой поддержки Гуандун (2016TQ03N682), программой Pearl River S&T Nova в Гуанчжоу (201710010061), Проект планирования науки и технологий провинции Гуандун (2017A050501007), Национальное финансирование выдающихся докторских диссертаций (201459), Фонды фундаментальных исследований для центральных университетов (2017ZD092), Проект 111 (B17018) и Фонд естественных наук провинции Гуандун (№№ ,2018A030310170 и 2018A030313279).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmicb.2018.02413/full#supplementary-material
РИСУНОК S1 | Уровень экспрессии дифференциально экспрессируемых генов.
ТАБЛИЦА S1 | Обзор статистики RNA-seq.
ТАБЛИЦА S2 | Дифференциально экспрессируемые гены индуцированной ампициллином (A1, A2 и A3) и контрольной (C1, C2 и C3) групп.
ТАБЛИЦА S3 | Обогащенный анализ GO (биологический процесс) дифференциально экспрессируемых генов в группе, индуцированной ампициллином (A1, A2 и A3), по сравнению с контролем (C1, C2 и C3).
ТАБЛИЦА S4 | Анализ обогащения пути KEGG дифференциально экспрессируемых генов в группе, индуцированной ампициллином (A1, A2 и A3), по сравнению с контрольной группой (C1, C2 и C3).
Сноски
- faostat.fao.org
- http://www.bioinformatics.babraham.ac.uk/projects/fastqc/
Список литературы
Андерс, С., Хубер, В. (2012). Дифференциальная экспрессия данных РНК-Seq на уровне гена — пакет DESeq. Гейдельберг: EMBL.
Google Scholar
Эшбернер, М., Болл, К. А., Блейк, Дж. А., Ботштейн, Д., Батлер, Х., Черри, Дж. М. и др. (2000). Генная онтология: инструмент для объединения биологии.Консорциум генных онтологий. Нац. Жене. 25, 25–29. DOI: 10.1038 / 75556
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bjarnsholt, T., Alhede, M., Alhede, M., Eickhardt-Sørensen, S.R., Moser, C., Kühl, M., et al. (2013). Биопленка in vivo. Trends Microbiol. 21, 466–474. DOI: 10.1016 / j.tim.2013.06.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Борриелло, Г., Вернер, Э., Роу, Ф., Ким, А. М., Эрлих, Г.Д. и Стюарт П. С. (2004). Ограничение кислорода способствует устойчивости к антибиотикам Pseudomonas aeruginosa в биопленках. Антимикробный. Агенты Chemother. 48, 2659–2664. DOI: 10.1128 / AAC.48.7.2659-2664.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кристенсен, Г. Д., Симпсон, В. А., Янгер, Дж. Дж., Баддур, Л. М., Барретт, Ф. Ф., Мелтон, Д. М. и др. (1985). Прилипание коагулазонегативных стафилококков к пластиковым пластинам для культур тканей: количественная модель прилипания стафилококков к медицинским устройствам. J. Clin. Microbiol. 22, 996–1006.
PubMed Аннотация | Google Scholar
Конлон, Б. П. (2014). Staphylococcus aureus хронические и рецидивирующие инфекции: доказательства роли клеток-персистеров: исследование клеток-персистеров, их образование и их роль в болезни S. aureus . Bioessays 36, 991–996. DOI: 10.1002 / bies.201400080
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корриган, Р.М., Ригби, Д., Хэндли, П., и Фостер, Т. Дж. (2007). Роль поверхностного белка SasG Staphylococcus aureus в адгезии и формировании биопленок. Микробиология 153, 2435–2446. DOI: 10.1099 / mic.0.2007 / 006676-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cucarella, C., Solano, C., Valle, J., Amorena, B., Lasa, I., and Penadés, J. R. (2001). Bap, поверхностный белок Staphylococcus aureus , участвующий в образовании биопленок. Дж.Bacteriol. 183, 2888–2896. DOI: 10.1128 / JB.183.9.2888-2896.2001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
de la Fuente-Nunez, C., Reffuveille, F., Fernandez, L., and Hancock, R.E. (2013). Развитие бактериальной биопленки как межклеточная адаптация: устойчивость к антибиотикам и новые терапевтические стратегии. Curr. ОПИН. Microbiol. 16, 580–589. DOI: 10.1016 / j.mib.2013.06.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фостер, Т.J. (2009). Колонизация и заражение человека-хозяина стафилококками: адгезия, выживание и уклонение от иммунитета. Вет. Dermatol. 20, 456–470. DOI: 10.1111 / j.1365-3164.2009.00825.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фоулстон, Л., Эльсхольц, А. К., Де Франческо, А. С., и Лосик, Р. (2014). Внеклеточный матрикс биопленок Staphylococcus aureus содержит цитоплазматические белки, которые связываются с поверхностью клетки в ответ на снижение pH. мБио 5: e01667-14. DOI: 10.1128 / mBio.01667-14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фрис, Д., Частанет, А., Кази, С., Соренсен, К., Хилл, П., Мсадек, Т. и др. (2004). Clp-АТФазы необходимы для устойчивости к стрессу, внутриклеточной репликации и образования биопленок у Staphylococcus aureus . Мол. Microbiol. 54, 1445–1462. DOI: 10.1111 / j.1365-2958.2004.04368.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаупп, Р., Шлаг, С., Либеке, М., Лалк, М., и Гетц, Ф. (2010). Преимущество активации сукцинатдегидрогеназы в биопленках Staphylococcus aureus . J. Bacteriol. 12010, 2385–2394. DOI: 10.1128 / JB.01472-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грэм, Дж. П., Эванс, С. Л., Прайс, Л. Б., и Силбергельд, Э. К. (2009). Судьба устойчивых к противомикробным препаратам энтерококков и стафилококков и детерминанты устойчивости в хранящемся подстилке домашней птицы. Environ. Местожительство 109, 682–689. DOI: 10.1016 / j.envres.2009.05.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гуо, X., Мроз, Т.А., Попкин, Б.М., и Чжай, Ф. (2000). Структурные изменения влияния дохода на потребление продуктов питания в Китае, 1989–1993 гг. Экон. Девиация Культ. Обмен 48, 737–760. DOI: 10.1086 / 452475
CrossRef Полный текст | Google Scholar
Хамед, Р. Б., Гомес-Кастелланос, Дж. Р., Генри, Л., Дучо, К., МакДонаф, М.А., Скофилд К. Дж. (2013). Ферменты биосинтеза бета-лактамов. Нац. Prod. Реп. 30, 21–107. DOI: 10.1039 / C2NP20065A
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Huttner, A., Harbarth, S., Carlet, J., Cosgrove, S., Goossens, H., Holmes, A., et al. (2013). Устойчивость к противомикробным препаратам: глобальный взгляд на Всемирном форуме по инфекциям, связанным со здравоохранением, 2013 г. Антимикробный. Оказывать сопротивление. Infect. Контроль 2:31. DOI: 10.1186 / 2047-2994-2-31
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йозефссон, Э., Хартфорд, О., О’Брайен, Л., Патти, Дж. М., и Фостер, Т. (2001). Защита от экспериментального артрита Staphylococcus aureus путем вакцинации фактором комкования А, новой детерминантой вирулентности. J. Infect. Дис. 184, 1572–1580. DOI: 10.1086 / 324430
PubMed Аннотация | CrossRef Полный текст |
.Золотистый стафилококк — Viquipèdia, l’enciclopèdia lliure
Staphylococcus aureus és un eubacteri grampositiu aerobi i anaerobi facultatiu en forma de coc индивидуальные размеры от 0,5 до 1,5 мкм диаметром 0,5–1,5 мкм, что делится на единицу площади донанта, находящуюся в единой форме. (d’ací la seva arrel “ Staphylo” , raïm en grec antic i modern) в родовых цветах. Creix per processos de la fermentació làctica o de la respració aeròbica.La majoria d’espècies tenen un Requeriment de нутриентный комплекс, però generalment neediten una font orgànica de азота que poden trobar en diversos aminoàcids essencials, com són l’arginina, valina i en la vitamina B, incloent la tiamina i la nicotinamida. Нет Formen espores i no Presenta ni mobilitat ni forma càpsula. Устойчивые к крексеру концентраты altes de clorur de sodi (плавники до 10%) при температурах от 18 ° C до 40 ° C. Dóna negatiu en el test de la oxidasa i positiu en el test de la catalasa i de la coagulasa.En aquest últim només S. aureus и S. Intermedius són positius dins del gènere de Staphylococcus , la resta d’espècies són coagulasa negatiu. Актуальность эс конейксен 32 особи и 8 подвидов дин-дель-генер д ‘ стафилококка, -ла-большая часть, как предпочтительная колония, эль кос человека. Les més caracteritzades i estudiades són S. aureus i S. epidermidis . [1] [2] [3]
Аппроксимация 30% глобального заражения бактериями.Pot causar una gran varietat d’infeccions en definitiondes. Poden ser инфекций menors de la pell (furóncols i pústules) i abscessos cutanis, o malalties més greus com pneumònia, менингит, остеомиелит, эндокардит, синдром токсического поражения (SST) и воспаления. Nosocomials un patogen important en les инфекций и недугов, nosocomials i is perillós degut a la resistència que представляют различные антибиотики, com la meticil·lina, β-lactàmics, penicil·lina, tetraciclina и т. Д. El seu reservori às l’hum. i aus, on el trobem com a sapròfit de la pell i de la mucosa, i en aliment i aigua, i té una dosi influenctiva mínima (DIM) de 100.000 унитат. La seva transmissió és mitjançant la ingesta de la enterotoxina que produeix o del propi microorganisme en l’aliment, per contacte direct Entre Individual i per la contaminació de ferides. [4]
Staphylococcus aureus es caracteritza per ser comensal i un patogen oportunista. Els people són un reservori natural, послал переносчиков в носовую микробиоту, и фактически на 30% в глобальном масштабе. Lescolonitzacions asimptomàtiques son més freqüents que les инфекций, però en persones immmunodeprimides o que es trobin en condicions desfhibiteds pot resultar un Risk, i is per això que hi ha un augment en el risc d’infecció en pacients hospitalitzats, sobretosen per pacients hospitalitzats, sobretosen per os per una operació quirúrgica.És per aquest motiu que aquestes influences són més comunes en hospital. La manera d’eliminar la colonització d’aquest microorganisme is mitjançant l’administració d’antibiòtics, desinfectants, o fins i to soques atenuades del propi microorganisme.
La penicil·lina va ser el primer antibiòtic beta-lactàmic trobat el 1928, que va resultar ser efectiu contra influenzae provocades на S. aureus . Durant els 1940-х годов, quan ja s’havia Introduction Aquest Antibiòtic en l’àmbit clínic, van començar a aparèixer soques de S.aureus сопротивляется а-ля пеницил · лина. Aquestes soques produirien unes lactamases, anomendes penicil·linases, que farien que l’antibiòtic es tornés inactiu, i que per tingués cap efecte sobre el patogen. Durant la dècada següent només es van aïllar soques resistents en àmbits hospitalaris, però ja a finals dels anys 60 и 80% de les soques aïllades, tant d’àmbit hospitalari com a l’exterior, Presentaven la resistència a la penicil·lina, perquè el gen blaZ que proporcionava la resistència es trobava en un плазмиды, которые можно передавать.
Com aquest antibiòtic començava a ser inefectiu, es van buscar altres antibiòtics i es va descobrir la meticil·lina, un altre beta-lactàmic del grup de les penicil·lines. Так же вы познакомитесь с клинической моделью 1961 года, в которой используются устройства, поддерживающие сопротивление (MRSA), и переносной кассетный хромосом mecA (SCC mecA ). Durant les pròximes dècades van aparéixer линяет случаи провокации инфекций для soques resistents a la meticil·lina, totes en больниц.En dades recollides en Национальный эпидемиологический надзор за внутрибольничными инфекциями (NNIS) поддерживает центры по контролю за заболеваниями и другие учебные материалы, относящиеся к MRSA, в 1980-е годы, а также в больничных центрах с уплатой налогов в размере 5-10%. Налоги в больницах снижаются на 5%. Durant els 1990-е взимает налоги van pujar и 20% в больницах, петит и финках 40% в центрах Hospitalaris grans. Aquestes dades van anar pujant завершил работу на 50% в 1998 году.
Лица, подверженные заражению, не оставляют никаких ископаемых пациентов, они ищут людей в окружающем госпитале или в контакте с окружающей средой.Més endavant, al 1999, es va veure un cas de quatre nens a Chicago que van morir a causa d’unafecció per soques MRSA. Fent l’estudi es va veure que eren soques, восприимчивые к разным антибиотикам для бетаалактических препаратов, является определяющим фактором, который определил, что soques estaven relacionades entre elles però que Diferien de les típiques soques aïllades en Infection nosocomials. Això demostra que aquestes заражение ja no només són un проблема nivell intrahospitalari sinó que també està començant a general problems en persones que no estan relacionades amb els больниц. [5] [6]
S.aureus compta amb un repertori extraordinari de factor de virulència que li permeten sobreviure en condicions extremes en l’hoste humà. A tots ells es deu el seu èxit com a patogen i la seva capacity per causar una varietat d’infeccions.
| Определитель патогеницита | Пропиетац |
|---|---|
| Клеточные компоненты 1) Пептидоглика 2) Àcids teïcoics 3) Протейна А 4) Капсула | 1) Activació del комплемент 2) Activitat antifagocítica 3) Activitat antifagocítica 4) Adherència |
| Энзимов 1) Коагуласа 2) Estafiloquinasa 3) Хиалуронидаса 4) Липаша | 1) Formació d’abscès 2) Destrucció del coàgul 3) Invasió hística 4) Colonització |
| Токсины 1) Гемолизины 2) Leucocidina 3) Токсина эксфолиатина 4) Токсина дель хок токсик 5) Энтеротоксины | 1) Руптура мембраны клетчатки 2) Alteració de la permeabilitat cel·lular de fagòcits 3) Эпидермолиз 4) Xoc 5) Intoxicació alimentària |
Клеточные компоненты [модиф.]
La paret Cellular està constituïda de peptidoglicans, les cadenes laterals dels quals estan unides mitjançant pontapeptídics de pentaglicina i àcids teïcoics.
Peptidoglicà [modifica]
Proporciona install osmòtica, desencadena la influenació per activació del комплемент, es capaç d’atraure leucòcits polimorfonuclears (PMN), Estimula la producció d’anticossos opsonitzats i té activitat similar a les эндотоксины де грамм-токсина.
Àcids teïcoics [изменение]
Constitueixen el voltant del 40% del pes de la paret. Aquests àcids són polymers de ribitol fosfat i estan units de forma covalent al peptidglicà.Важные компоненты Són для лечения а-ля фибронектина; Assessment la producció de pirogen endògens.
Капсула [изменение]
La presència de la càpsula és variable, però es important a nivell patogènic, ja que te propietats antifagocítiques. Les soques que tenen càpsula són més virulentes на моделях животных. Es coneix que l’adherència del patogen a les vàlvules cardíaques i cossos estranys esta mediada, en part, per els рецепторы фибронектина и seva superfície. Les soques que tenen grans Quantitats de Receptors per aquesta glicoproteïna, solen ser mes invasius i mes hàbils per adherir-se.A més, impedeix la quimiotaxis i la proliferació de cèl·lules mononuclears.
Proteïna A [изменение]
Реабилитация организма а-ля порцио Fc de les molècules d’Immunoglobulina G (IgG), который действует, как фактор вирулентности, ja que interfereix en la opsonització i la ingestió dels microorganismes per les PMN , активант комплемента и донант lloc немедленной реакции гиперсенсибилитата. Aquesta proteïna és immmunogènica i es troben anticossos contra ella en pacients ambfection greus de S.aureus .
Enzims [изменение]
Totes les soques de S.aureus produeixen una sèrie d’enzims, com DNAses, proteases i fosfatases, que col·laboren en el procés Infocciós i en la producció de lesions.
Coagulasa [modifica]
Acuta cobrint a la cèl·lula de fibrina, ja que la convertteix des del fibrinogen, i per tant fent-la més resistent a la opsonització i fagocitosi.
Estafiloquinasa [модиф.]
Degrada la fibrina i contribueix a la invasió dels teixits veïns.
Hialuronidasa [изменение]
Hidrolitza la matriu intracellular de mucopolisacàrids del teixits, i per tant contribueix a la distributionació dels teixits adjacents.
Lipasa [изменение]
Ajuden al microorganisme a Distemar-se per els teixits cutanis i subcutanis.
Токсины [изменение]
Una de les característiques importants de S.aureus és la Capacitat de secretar toxines que danyen lesmbranes de les cèl·lules del hoste, ja que formen porus que provoquen l’alliberació del contingut i la mort cel …lular.
α гемолизина [модификация]
Es troba codificada per el gen hla . Té efecte letal sobre una varietat dembranes cel ·lulars eucarites, incloent les PMN d’humans, així comp els eritròcits de different espècies humanes. És dermonecròtica si s’injecta de forma subcutània является летальным для животных si s’administra de forma intravenosa. Это ответственность за зону гемолизи, наблюдающую за колебаниями колоний S.aureus , ja que forma un porus, el qual és el responsable de la lisis cel·lular.
β гемолизина [модиф.]
És una esfingomielinasa activa sobre differents cèl·lules: лейкоциты, эритроциты, фибробласты …
δ гемолизина [модификация]
Es troba en algunes soques i lisen una varietat de cèl·lules different.
Leucocidina [modifica]
Экзотоксина, окружающая токсичное прямое воздействие на мембраны людей с PMN, вызывающая дегрануляцию цитоплазмы, воспаление клеток и слизистую оболочку. El mode d’acció d’aquesta toxina compren la formació de porus que alteren la permeabilitat cel · lular per el Potassi i altres катионы.Una injecció d’aquesta toxina en models animals produeix una disminució del nombre de leucòcits.
Exfoliatina [модификация]
Són produ perdes per algunes soques i consisteixen en dues proteïnes, bioquímica и иммунологические препараты, аналогичные биологические функции. La exfoliatina — это unroducte de gens cromosòmics, термоустойчивый, инактивируется для EDTA; Средство отшелушивания B és de origen Plasmídic, es inacivada per calori estable en front l’EDTA. Ambdues tenen activitat proteolítica, acten com a superantígens, i dissolen la matriu mucopolisacàrida de l’epidermis, в результате чего amb la separació intraepitelial de les union en l’estrat granulòs.
Энтеротоксин [модиф.]
Es tracta de molècul·les termoestables responsables de la intoxicació alimentària produïda per algunes soques. El mode d’acció d’aquestes toxines no està gaire conegut, però sap que augmenta el peristaltisme.
Toxina del xoc tèrmic (TSST) [изменение]
També denominat com a enterotoxina F. Està implat en la patogènia del síndrome del xoc tèrmic. Tot i que el seu rol és poc clear, té una gran Quantitat d’activitats biològiques.
Les últimes tres toxines mencionades, acten com a superantígens, el que importanta que poden activar limfòcits T directament (alta afinitat per el complex de histocompatibilitat typeus II), sense la mediació de cèl·lules presentadores d’antigen, результирующий de la lib. citoquines. Això горшок, определяющий важные важные эффекты sistèmics com febre, hipotensió, поражения a la pell, xoc, fallada multiorgànica, i la mort. [8] [9]
Tot i que S. aureus sol актуар com a bacteri comensal, колонизатор asimptomàticament un 30% de la població, de vegades potactar com a pathogen, вызывающий инфекционные процессы, которые вызывают дезинфекцию, сокращает смертельные заболевания. [2]
Infeccions de la pell [modifica]
Staphylococcus aureus és la causa gairebé universal dels furóncols i abscessos de la pell i a nivell mundial és l’agent que més freqüentment es relaciona amb инфекция cutànies i de teixits tous. Les инфекций de la pell i teixit tou de S. aureus comencen sovint amb ferides o abscessos menors i poden прогрессирующая серьезная инфекция, которая подразумевает оссос и poden acabar diffonent-se als pulmons или les vàlvules cardíaques. [10]
Энтеикситные поверхностные инфекции [изменение]
Лечебные инфекции, вызываемые водными бактериями, часто линяют в соленой тени, аспектированной гранулометрии или фуронколе; a més, acostumen a ser d’un color vermellós, sovint acompanyat de pus i supuracions.
Un instance seria l’impetigen, una infcció cutània localitzada i caracteritzada per la presència de pústules sobre la base eritematosa que acaba donant lloc a crosss. Destaca també l’ectima, una afecció cutània, похожий на l’impetigen una més profund i d’evolució més lenta.D’altra banda la fol·liculitis — это воспаление, вызванное поверхностной фолликулярной подушечкой и апокринами. [11]
Infeccions en teixits profunds [изменение]
Com a afeccions cutànies més greus destaca la furoncolosi; Aquesta es tracta d’un procés воспаления més profund que la fol·liculitis, en el qual es pot veure afectat el greix subcutani i la glàndula sebàcia associada. Нормализация нормального состояния в одном фолликуле, в том, что касается вегетарианских растений, в различных условиях.
L’endocarditis — это главное осложнение бактерий в горшке, которое вызывает причинение вреда здоровью, а также заражения и сердечных заболеваний. Destaca també l’osteomielitis, unafecció que resulta en una influenació, destrucció i necrosi òssia que afecta majorità la metàfisi dels ossos llargs dels nens i la columna vertebral d’adults. [2]
Нозокомиальные больницы [изменение]
Actualment S. aureus — это значимые основные агенты, вызывающие инфекцию, нозокомиальные препараты, вызывающие инфекцию, уязвимые лица, входящие в состав es troben aquelles que presenten sistemesmunitaris debilitats.Aquest tipus d’infecció també es pot veure afavorida pel fet que aquesta espècie Habita tant en les mucoses com en la pell dels human, permetent que a través de ferides quirúrgiques o cremades pugui Pencilrar al torrent sanguini del pacient per contactec direct el o indire Personal sanitari, amb un objecte contaminat o inclús amb un altre pacient. [12]
Síndrome de xoc tòxic [изменение]
Staphylococcus aureus pot expressar dos tipus differents de toxines amb activitat superantigènica.Les enterotoxines, de les quals trobem sis serotips (A, B, C, D, E i G) i la toxina de la síndrome de xoc tòxic (TSST-1). Les primeres causen diarrea i vòmits quan s’ingereixen i són responsables de la intxicació alimentària estafilocòccica. Quan s’expressen sistèmicament, les enterotoxines poden causar la síndrome del xoc tòxic (TSS), de fet, les энтеротоксины B i C вызывают у 50% синдромов отсутствие менструального цикла. TSST-1 относится к энтеротоксинам и не активен. Ответственность за 75% TSS.La síndrome del xoc tòxic pot produir-se com una seqüela de qualsevol influencció estafilocòccica si es produeix una enterotoxina o TSST-1 que s’allibera sistemàticament i l’hoste manca d’anticossos нейтралитзанты. [1] La síndrome del xoc tòxic es caracteritza per provocar febre, эритематозные высыпания, baixa tensió arterial, pelat de pell и т. Д.
Intoxicació alimentària [модиф.]
Напряжение 25% от людей и присутствующих животных Staphylococcus aureus a la pell i al nas.В целом, no causa malaltia en persones sanes, però pot contaminar aliments i sintetitzar toxines que poden arribar a causar intxicacions alimentàries.
Els bacteris poden ser устраняет quan es cuina l’aliment però les seves toxines no són destruïdes i seran els основные агенты, вызывающие заболевания. Els símptomes solen desenvolupar-se en un termini d’entre 30 minuts i 8 hores després de menjar o beure algun aliment que conté la toxina i no dura més d’un dia. Rarament provoca malalties greus. [13]
Инфекции, вызывающие заражение, вызывающие заболевание, вызывающие заражение, предназначены для других типов инфекций, вызываемых жидкими инфекциями (LCR, …).
Les инфекций estafilocòccies cutànies se solen Diagnosticar per el seu aspecte. Альтернативные инфекции, необходимые для использования с культурой [14] i veure el creixement de bacteris. Лечебный анализ, определяемый как диагностические, так и антибиотики, содержащие пятнышки, дает возможность устранить бактерии (тест на сенсибилизацию / резистентность).
За идентификацию S. aureus в качестве средства диагностики, es solen fer servir 3 метода: Microscòpia, cultius i proves bioquímiques. За 3 часа до приема гостей по мосту.
Obtenció de la mostra [изменение]
Les mostres es poden obtenir del pus (exsudat), de la sang, d’un aspirat traqueal o fins i tot del líquid cefalorraquidi. La localització de la presa de mostres depèn de la ubicació del procés Infcciós i les intuïcions del metge seguint els patrons del microorganisme i la history clínica del pacient.
- Localització més адекватный заместитель в горшке для exsudat faríngic.
- Exsudat cutani de la zona perirectal o промежности. Aquesta zona té una alta sensibilitat i molta contració en microorganismes però no s’aconsella com a mostra única.
- Mostres de secrecions respratòries en pacients ambació mecànica.
- Urocultiu en pacients amb sonda vesical.
Tècniques [изменение]
Cultius [изменение]
Primer se sol fer un Diagnostic Provider, basant-se en els símptomes dels pacients i la història clínica.Согласно диагностическому определению заражения по S. aureus però, необходимо получить все необходимые средства в культуре зараженных микроорганизмов.
El medi de cultiu ha de proporcionar una font de Carboni i Nitrogen així com d’energia. Обычная среда для S. aureus conté sang i lactosa. També s’utilitza Манитол-солевой агар, окр. 7-9% NaCl; actant com a medi selectiu. Incubació при 37ºC. Наблюдайте за цветными пигментами. Partir d’aquestes es poden realitzar totes les demés tècniques для подтверждения диагностики.
Si el metge sospita una oseteomielitis es poden dur a terme les següents tècniques: Tomografia computaritzada, ressonància magnètica ядерная и другие альтернативы, которые служат для того, чтобы найти локализацию данных и определить сева серьезность.
Подтверждает биохимические методы [изменение]
S’utilitzen en connected les proves bioquímiques (coagulasa, catalasa) и les demés per tal determinar si S. aureus és causant de lafecció i què suposa aquesta infcció. По определению si es tracta de S.aureus es fan servir vàries доказывает различие между различными микроорганизмами Micrococcus, Macrococcus, Streptococcus и другими Staphylococcus .
Sónoxidasa negativa i positius en el test de la catalasa i de la coagulasa.
Подтверждает молекулярные [модиф.]
Идентификация токсинов [изменение]
Importants sobretot en intxicacions alimentàries. S. aureus produeix diverses токсины així com enterotoxines A-D, les quals es poden identifyar mitjançant tests d’aglutinació.
Сенсибилитат антибиотик [изменение]
Detecció de MRSA [15] ( S. aureus , устойчивый a la meticilina) против MSSA ( S.aureus sensibles a meticilina). S’utilitzen antibiogrames i altres tècniques.
Al llarg de la història clínica de S. aureus ha sigut capaç de desenvolupar resistència antibiòtics, destacant la meticilina. Per això s’utilitza el terme MRSA per referir-se a aquelles soques resistents a la meticilina i altres antibiòtics com Clindamicina o Daptomicina.Aquesta infcció sol ser nosocomial encara que també es pot adquirir fora dels sanitaris. Actualment s’utilitzen medis selectius on MRSA s’identifica ràpidament. Els més utilitzats són amb agar cromogènic, normalment els que estan suplementats amb oxalicina que actua com a agent selectiu imedint el creixement de les soques no MRSA. Aquests medis s’han de conservar entre 2 i 8ºC y Requereixen un control de qualitat rigorós.
Les инфекций на S. aureus es tracten básicament amb antibiòtics, però també es pot fer una extirpació quirúrgica de l’òs, òrgan o teixit infectat.Creixent tassa de resistència a la meticilina per part dels S. aureus (MRSA) [16] durant els anys 90 va provocar que la incrementació d’estudis d’altres antibiòtics. Gràcies a això, van sorgir многочисленные эффективные антибиотики против MRSA que s’han comercialitzat durant els úlhibited anys. Els més submitatius són: Betalactàmics, Clindamicina, Cotrimoxazol, Daptomicina i Fosfomicina. La influencció для S.aureus sensible a la meticil·lina (SAMS) es segueix tractant amb betalactàmics en especial meticil·lina.Tot i així, els avenços en el coneixement de la patogènia для инфекций estafilocòccies junt amb les Experiencies clíniques del últim anys suggereixen que els betalactàmics no semper són la millor opció terapèutica, sinó que oò de la dapètica, sinó que oò de la dapresa de la antificina monoteràpia.
| Дозировка инфекционных заболеваний, вызываемых различными антибиотиками, передняя инфекция по S.aureus | ||
|---|---|---|
| Антибиотик | Dosi устно | Dosi через внутривенно |
| Цефазолина | — | 1-2 г / 8 ч (вливание прерывистое, лента или продолжение) |
| Clindamicina | 300-450 мг / 8 ч | 600 мг / 6-8 часов или 900 мг / 8 часов (infusió intermitent lenta) |
| Котримоксазол | 160-800 мг / 8-12 ч | 320-1600 мг / 8-12 ч |
| Daptomicina | — | 6-10 мг / кг4 / день |
| Фосфомицина | — | 100-300 мг / кг2 / день (максимум 400 мг / кг2 / день) в 3-4 дозах (infusió intermitent lenta o infusió contina) |
| Гентамицина | — | 3 мг / кг ^ 2 / диам 1-3 дозы (настаивается в течение 30 минут) |
| Линезолид | 600 мг / 12 ч | 600 мг / 12 ч (вливание прерывистое, лента или продолжение) |
Betalactàmics [изменение]
Constitueixen la família més nombrosa dins els antimicrobians i is la més utilitzada en casos clínics.Són antibiòtics d’acció lenta. El seu mecanisme d’acció consisteix en la ignició de la última etapa de la síntesi de la paret cel ·lular, провокация смерти микроорганизма. L’activitat dels betalactàmics és menor front fenotips sèssils (bio pel·lícules) и сокращает колонии. La majoria de soques de S. aureus produeixen betalactamases que inactiven la penicilina. S’han идентифицирует 4 подпункта Betalactamases designades A, B, C и D. Les més comunes són la i la C. La progressiva aparició de resistències limita el seu ús empíric i eficàcia.La resistència a la meticilina ja s’ha creuat amb la majoria de betalactàmics que s’han utilitzat per controlar les poblacions de S. aureus. Концентрации субингибиториев (més baixes que la CMI) вызывают индукцию различных бактериальных токсинов.
Clindamicina [модиф.]
La clindamicina té un efecte bacteriostàtic, аналогичный клорамфениколу и эритромицину. S’uneix a la subunitat 50S del ribosoma bacterià i interfereix en la síntesi de proteïnes. S’utilitza lint per tractar les инфекционные заболевания (остеомиелит) de causades на S.aureus , també és eficaç front l’agné. També s’inclou com a возможная альтернатива терапии enfront de les инфекций a la pell i частей toves de gravetat lleu o moderada, produïdes sobretot SARM. Com a efecte secundari pot produir desordres gastrointestinals.
Котримоксазол [модиф.]
Это формат для комбинации антибиотиков, действующих на синергические бактерициды: сульфаметоксазол и триметоприм. Bloqueja l’enzim responsable de la síntesi de tetrahidrofolat. Els bacteris no són capaços d’extreure-la del medi, depenen completament de la seva síntesi, això acaba generant un dèficit metabòlic a la cèl·lula impedint la воспроизводится и облегчает смерть.
No provoca efectes secundaris importants. Представьте непревзойденный антимикробный антибиотик, содержащий MRSA.
Daptomicina [modifica]
La Daptomicina — это натуральный липопептид, который действует против бактерий gram positius. El seu mecanisme d’acció cursa amb la unió a lambrana bacteriana de les cèl·lules, tant en fase de creixement com estacionaria. Això causa una despolarització, ignició de la síntesi d’algunes proteïnes, ADN и ARN и conqüentment la mort.S’acostuma утилитарная инфекция усложняет нормальную педиатрию для лечения пациентов. També s’usa en bacterièmies. La resistència a daptomicina s’ha observat després de vàries setmanes de tractament, sobretot en pacients que han patit Recentment alguna altra influencció latest. Aquesta resistència es deu a l’existència de vàries mutacions d’un sol нуклеотидные продукты последовательности в различных генах. (mprF, yycG, rpoB и rpoC).
Fosfomicina [modifica]
La fosfomicina igneix l’enzim fosfoinolpiruvato sintetasa, [18] que intervé en la fase inicial de síntesi del peptidoglicà, fent la paret del bacteri unplerta.S’utilitza sobretot en incions urinàries. Это лекарство толерантно к рекламным объявлениям. La resistència a fosfomicina pot ser causada per mutacions cromosòmiques que afecten a l’activitat dels sistemes de transport cap a l’interior del bacteri или l’adquisició de certs plàsmids.
- ↑ 1,0 1,1 Фостер, Тимоти. Стафилококк . Четвёртый. Галвестон (Техас): Медицинский филиал Техасского университета в Галвестоне, 1996. ISBN 0963117211.
- ↑ 2,0 2,1 2,2 Тонг, Стивен Ю.К .; Дэвис, Джошуа С .; Эйхенбергер, Эмили; Голландия, Thomas L .; Фаулер, Вэнс Дж. «Инфекции, вызванные Staphylococcus aureus: эпидемиология, патофизиология, клинические проявления и лечение». Обзоры клинической микробиологии , 28, 3, 2015-7, pàg. 603-661. DOI: 10.1128 / CMR.00134-14. ISSN: 0893-8512. PMC: PMC4451395. PMID: 26016486.
- ↑ Harris, L.G .; Фостер, С.Дж .; Ричардс, Р. «Введение в Staphylococcus aureus, а также методы выявления и количественного определения S.Адгезины Aureus в отношении адгезии к биоматериалам: обзор ». AO Research Institute, Clavadelerstrasse, CH 7270 Davos, Switzerland; 2 Кафедра молекулярной биологии и Биотехнология, Университет Шеффилда, Ферт-Корт, Шеффилд, S10 2TN, UK , 2002, pàg. 39.
- ↑ Taylor, Tracey A .; Unakal, Chandrashekhar G. Staphylococcus Aureus . Остров сокровищ (Флорида): StatPearls Publishing, 2018.
- ↑ Чемберс, Х. Ф. «Изменяющаяся эпидемиология Staphylococcus aureus? — Том 7, номер 2 — апрель 2001 г. — Журнал Emerging Infectious Diseases — CDC »(en anglès). Журнал новых инфекционных заболеваний . DOI: 10.3201 / eid0702.700178.
- ↑ Павел- Сатьясила, Маниш; Харихаран, Периасами; Гнанамани, Арумугам «Staphylococcus aureus: Обзор бактериологии, клинических заболеваний, эпидемиологии, устойчивости к антибиотикам и терапевтических подходов» (en anglès). Frontiers in Staphylococcus aureus , 08-03-2017. DOI: 10.5772 / 67338.
- ↑ «Microbiología médica» (en castellà). Mc Graw Hill. [Consulta: 11 декабря 2018 г.].
- ↑ «Патогенез молекулярный стафилококк золотистый» (en castellà).[Consulta: 13 декабря 2018 г.].
- ↑ «Microbiología general de Staphylococcus aureus: Generalidades, patogenicidad y métodos deidentificación». [Consulta: 13 декабря 2018 г.].
- ↑ McCaig, Linda F .; Макдональд, Л. Клиффорд; Мандал, Санджай; Джерниган, Дэниел Б. «Инфекции кожи и мягких тканей, связанные со Staphylococcus aureus, в амбулаторной помощи». Новые инфекционные заболевания , 12, 11, 2006-11, стр. 1715-1723. DOI: 10.3201 / eid1211.060190. ISSN: 1080-6040. PMC: PMC3372331.PMID: 17283622.
- ↑ «Síntomas y causas — Mayo Clinic» (en castellà). [Consulta: 3 декабря 2018 г.].
- ↑ «Infecciones por estafilococos — Síntomas y causas — Mayo Clinic». [Consulta: 7 декабря 2018 г.].
- ↑ CDC. «Стафилококковое пищевое отравление» (en anglès), 08.09.2018. [Consulta: 9 декабря 2018 г.].
- ↑ Л., Коленди, Чарльз. Метициллин-резистентный золотистый стафилококк (MRSA): этиология, группы риска и лечение . Издательство Nova Science, 2010.ISBN 9781614702436.
- ↑ «Метициллин-устойчивый золотистый стафилококк (MRSA)». [Consulta: 10 декабря 2018 г.].
- ↑ Альберто., Пахисса Берга ,. Infecciones producidas por Staphylococcus aureus . ISBN 9788492442768.
- ↑ «Guía de tratamiento antimicrobiano de la Инфекция пор Staphylococcus aureus». [Consulta: 9 декабря 2018 г.].
- ↑ Grif, K .; Dierich, M. P .; Pfaller, K .; Miglioli, P.A .; Аллербергер Ф. «Активность фосфомицина in vitro в сочетании с различными антистафилококковыми веществами». Журнал антимикробной химиотерапии , 48, 2, 2001-8, стр. 209-217. ISSN: 0305-7453. PMID: 11481290.
Staphylococcus aureus — Википедия, живая энциклопедия
Происхождение: Википедия, живая энциклопедия.
Staphylococcus aureus é uma bactéria esférica, do grupo dos cocos gram-positivos, частота encontrada na pele e nas fossas nasais de pessoas saudáveis [1] . Entretanto pode provocar doenças, que vão desde uma simples influenção (acnes, furúnculos e celulites) на могилах инфекций (пневмония, менингит, эндокардит, síndrome do choque tóxico, sepse e outras).
As toxinas são proteínas produzidas e secretadas ou expostas à superfície pela bactéria cuja atividade é destrutiva para as células humanas. Para outras toxinas que o S. aureus Possui Em comum com outros estafilococos, veja nessa página.
- Капсула: Dificultam a fagocitose
- Proteína A: presente na parede celular do S. aureus . Ela prende антикорпусные циркулирующие из класса IgG, pela sua região constante Fc), нейтрализуют и другие функции.Impedindo a adesão de imunoglobulinas, Não deixando assim à ativação do complemento.
- Toxina alfa: forma poros nambrana das células destruindo-as. Часто посещаю как células de músculo liso vasculares, mas ataca qualquer tipo de célula, como eritrócitos.
- Токсина бета или эсфингомиелаза C: гидролиза (деграда) детерминадос липидос, комо эсфингомиелина и лизофосфатидилколина, клеточная мембрана целлюлоз. Destrói desta forma muitos tipos de células.
- Toxinas esfoliativas: presentes nas estirpes (5-10%) que causam síndromes esfoliativas da pele.Há duas formas ETA и ETB (токсины esfoliativas A и B). São proteases de serina que destroydes desmossomas que unem as células da pele umas às outras, resultando em perda da camada superior da pele (esfoliação).
- Энтеротоксины, устойчивые к воздействию желудочно-кишечного тракта, устойчивые к воздействию 30-50% веществ S. aureus . Provocam ativação imprópria do sistema imune, levando à produção de citocinas, causando danos aos tecidos. Гастроэнтерит является причиной употребления пищи, загрязненной на S.aureus .
- Toxina da síndrome de choque: é um superantígeno ou seja ativa de forma não específica os linfócitos, gerando reações imunitárias despropositadas e danosas para o indivíduo.
- Síndrome de choque tóxico: devido à produção de toxinas de choque tóxico. Ocorre especialmente em mulheres que usam Absorventes internos que utilizam fibras sintéticas e produtos químicos que aumentam abbras durante a menstruação. Esta doença Potencialmente Mortal (5% dos casos resultam em morte), inicia-se abruptamente, com hipotensão, febre, eritemas diffusos.Pode haver choque séptico e perda de sociência, seguida de insuficiência de múltiplos órgãos. O tratamento com antibiótico é única cura e deve ser administrado de Emergência.
- Gastroenterite estafilocócica: devido à presença de enterotoxinas na comida ingerida, e não a umafecção. Comum em presunto e outras carnes com sal, que não apresentam nenhum sinal ou gosto diferente. Caracteriza-se por aparecimento súbito (após 4h) de vómitos, diarreia aquosa, dores abdominais.
- Síndrome de pele escaldada estafilocócica: devido a S.aureus produtor da toxina esfoliativa. Caracteriza-se por aparecimento súbito de eritemas (zonas vermelhas dolorosas) que começam em redor da boca e se espalham para o resto do corpo. Formam-se bolhas de Liquido Claro, e pequenos toques chegam para remover a pele. As zonas esfoliadas (sem pele) podem dar oportunidade a outros invasores. Se não houver осложнения desse tipo resolve-se em uma semana.
- Impetigo é uma influencção da pele, que toma a forma de uma mácula (pequena mancha vermelha) e progride para pústula cheia de pus.Комбинезон Esta pode, e espalhar-se para outras regiões.
- Foliculite é uma Infcção com pus de um folículo piloso. Pode progredir para furúnculo com nódulo grande e vermelho e depois para carbúnculo e estender-se para o tecido cutâneo.
- Em feridas pode causar influencções se houver material estranho onde esteja em reserva alimentando-se do sangue da hemorragia.
- Эндокардит: инфекционная инфекция, вызванная циркуляцией крови (бактериемия). Mortalidade de 50%. Febre, dores no tórax.
- Остеомиелит: инфекция из внутренних источников.
- Пневмония: pode ocorrer por aspiração de comida semi-digerida (vômito, por exemplo).

