Клиника Genesis Dnepr
— Девочки, завтра иду сдаваться в роддом!!! т.к. уже перенашиваю 10 дней. Скорей всего завтра или послезавтра мне вызовут роды. Так вот, возникли такие вопросы…
1. А правда ли, что при стимуляции и вызове родов схватки больней и интервал между ними с самого начала короче по сравнению с родами, которые начались естественным путём??
2. Есть ли среди вас те, кому роды вызывали с помощью таблетки CYTOTEC. Как долго пришлось ждать схваток?»
Вопрос на форуме deti.mail.ru
К сожалению, большинство женщин не знает и никогда не узнает, что подобное агрессивное ведение родов, так называемая, медикаментозная стимуляция и раннее вскрытие амниотического пузыря часто приводит к отдаленным негативным неврологическим последствиям у детей.
Дело в том, что окситоцин, простагландин и другие средства вызывают искусственно вызванный патологический родовой процесс, при котором меняются нормальные показатели кровообращения матки в родах со всеми вытекающими последствиями для плода: острая гипоксия, нарушение мозгового кровообращения, ишемия, отек и разной степени повреждение ЦНС.
Это означает, что спустя год и даже годы перенесенная гипоксия во время родов у ребенка может вызвать синдром нарушенного внимания, гипервозбудимость, постоянные головные боли, плохую обучаемость, а в особо тяжелых случаях — ДЦП и аутизм.
Почему же подобные агрессивные схемы стимуляции родовой деятельности так широко внедрены в практику родовспоможения?!
Я выскажу свое мнение…
Во-первых, долгое время существовала советская школа акушерства, в которой была принята так называемая практика «активного ведения родов». Сегодня времена изменились, существуют другие протоколы и предписания, но ведь изменить стереотип врачебного поведения достаточно сложно.
Одна из причин — недостаточная квалификация врача акушера-гинеколога (несовершенство системы обучения врачей), не умеющего правильно и грамотно проводить естественные роды.
Вторая причина — это врачебная перегруженность и усталость, когда персонал не может или не хочет в силу разных причин заниматься только этой женщиной: например, если одновременно рожает еще несколько женщин и их нужно просто развести по времени.
Третья причина — это банальное желание врача закончить роды до наступления ночи, чтобы поспать пару часов, иногда — это нежелание задержаться на работе …
…что еще?!
желание не пропустить конференцию
желание вовремя уйти на выходные и в отпуск…
Вам в это слабо верится?!
Но это действительно так и от этого будет зависеть здоровье вашего ребенка на всю жизнь!!!
Ненормированность рабочего времени врача приводит часто к решениям не в пользу пациентки. В данном случае сам врач является жертвой и по закону самосохранения выбирает свое собственное здоровье.
Также одна из частых причин — несвоевременное проведение операции кесарево сечение по показаниям, когда внутриутробная гипоксия плода уже развилась.
В клинике Генезис-Днепр естественные роды проводятся без стимуляции в присутствии двух врачей акушеров-гинекологов и двух детских врачей, один из которых реаниматолог, способный быстро вывести ребенка из состояния гипоксии и предупредить все возможные осложнения. Врач находится при пациентке столько, сколько нужно — занимается только одной женщиной!
Врач находится при пациентке столько, сколько нужно — занимается только одной женщиной!
Также всегда готова операционная и врачебная бригада в случае необходимости, не теряя драгоценного времени, проведет экстренное кесарево сечение.
ЕСЛИ БЫ АНГЕЛЫ МОГЛИ ГОВОРИТЬ…
они бы, как свидетели происходящего, на многое открыли бы Вам глаза. Рассказали бы Вам о причинах будущих страданий Ваших и Вашего ребенка. И молили бы Вас: не нарушайте естественный процесс родов, не вмешивайтесь грубо в физиологию женщины, не перечьте божественным предписаниям!! Просто дайте ей возможность родить здорового ребенка!!!
Стоит также знать, что все простимулированные роды приводят к разрывам и травмам у женщин, делая ее дальнейшую сексуальную жизнь проблематичной.
Ниже хочу привести выдержки из доклада врача-невролога Михаила Головача, озвученного в Амстердаме на международной конференции «Midwifery Today».
Информация может быть полезной не только для врачей, но и для пациентов.
«Представления о том, что в родах матка «работает как обычная гидравлическая машина», сформировались еще на рубеже IXX-XX веков. Согласно этим представлениям во время сокращения матки повышается внутриматочное давление, от этого плод движется по родовому каналу и раскрывает шейку матки. Эти представления, как непреложная истина, прописаны и в современной медицинской учебно-методической литературе. Но, как оказалось, силы родовой схватки совершенно недостаточно, чтобы (чисто механически) продвинуть предлежащую часть плода в глубь малого таза и раскрыть шейку матки. И нет прямой зависимости между величиной внутриматочного давления и силой давления плода на шейку матки: «… при стимулированных окситоцином схватках внутриматочное давление высокое, а сила давления головки плода на шейку матки очень низкая»
Каждая нормальная родовая схватка приводит к депонированию (накапливанию) крови в матке, что увеличивает внутренний объём матки и обеспечивает продвижение плода. Причём плод вытесняется из матки плавно по мере раскрытия родового канала.
:))))
Молодая семья долго не могла иметь детей. Один мудрец посоветовал им поехать в Рим и поставить свечку в Соборе св. Петра. Прошло много лет, и старый мудрец решил навестить эту семью. На пороге его встретила целая ватага детей разного возраста.
— Где ваши родители? — спросил мудрец.
— Мама в роддоме, а папа полетел в Рим погасить какую-то свечу, — ответили дети.
:))))
– Не волнуйтесь, – успокаивает врач молодую женщину, у которой только что принял роды в поезде, – я вот слышал год назад одна женщина вообще на автобусной остановке родила!
– Это была я, доктор…
И сейчас официальное акушерство рекомендует рассматривать родовой процесс на основании гипотез о: «контракции-ретракции-дистракции», «нисходящего тройного градиента» и «автоматического водителя ритма» при сокращении миометрия.
Человечество активно росло в численности, прежде всего за счёт многодетных семей. Вряд ли бы это произошло, если бы роды в прошедшие века несли выраженную опасность роженицам и их детям. Да, детская смертность до 1 года жизни была высокой из-за гибели детей после рождения от заболеваний дыхательных путей и желудочно-кишечных инфекций (гигиена была низкой, и не было антибиотиков).
У наших акушеров появились мощные по действию на матку и её шейку препараты: с середины 60-х годов XX века синтетический окситоцин, с 70-х синтетические простагландины, с 80-х антипрогестагены, ламинарии и др. Причём сразу отметим, что естественные простагландины групп Е и F, естественный гипоталамо-гипофизарный гормон окситоцин взаимодействуют и регулируются множеством других биологически активных веществ и гормонов в организме беременной и плода. То есть синтетические простагландины, антигестагены и окситоцин не могут вызывать роды и схватки, соответствующие физиологическим (нормальным) родам и схваткам, так как эти синтетические препараты не являются копиями натуральных простагландинов и окситоцина. Эти препараты вызывают искусственный, патологический родовой процесс, при котором меняются нормальные показатели кровообращения матки в родах со всеми вытекающими от этого последствиями, в первую очередь, для плода (гипоксия, нарушение кровообращения, повреждение ЦНС).
Причём сразу отметим, что естественные простагландины групп Е и F, естественный гипоталамо-гипофизарный гормон окситоцин взаимодействуют и регулируются множеством других биологически активных веществ и гормонов в организме беременной и плода. То есть синтетические простагландины, антигестагены и окситоцин не могут вызывать роды и схватки, соответствующие физиологическим (нормальным) родам и схваткам, так как эти синтетические препараты не являются копиями натуральных простагландинов и окситоцина. Эти препараты вызывают искусственный, патологический родовой процесс, при котором меняются нормальные показатели кровообращения матки в родах со всеми вытекающими от этого последствиями, в первую очередь, для плода (гипоксия, нарушение кровообращения, повреждение ЦНС).
Эти средства, нарушая маточно-плацентарное кровообращение, вызывают острую гипоксию (дистресс) плода, что приводит к срыву ауторегуляции церебрального кровообращения и острой перинатальной энцефалопатии: отёку, ишемии, кровоизлиянию.
 Что ведёт к замедлению развития и усложнения движений, нарушениям формирования нормального (заложенного в генах) опорно-двигательного аппарата, нарушениям развития речи и социального поведения.
Что ведёт к замедлению развития и усложнения движений, нарушениям формирования нормального (заложенного в генах) опорно-двигательного аппарата, нарушениям развития речи и социального поведения.При применении этих препаратов часто происходит преждевременное излитие околоплодных вод без готовой к родам шейке матки, развивается первичная и вторичная слабость родовой деятельности. Но в большинстве случаев индуцирование родов с искусственной (простагландинами, антипрогестагенами, ламинариями и др.) подготовкой шейки матки приводит к стремительным и быстрым родам, с силовым преодолением родовых путей, со «штурмовыми» характеристиками прохождения предлежащей части плода по родовому каналу, глубокими разрывами шейки матки. Плод при этом нередко травмируется. Голова плода при искусственно вызванных или ускоренных схватках не успевает подготовиться для прохождения костей малого таза. Кости черепа и швы между ними у плода хрящевые и могут менять свою конфигурацию при прохождении родового канала.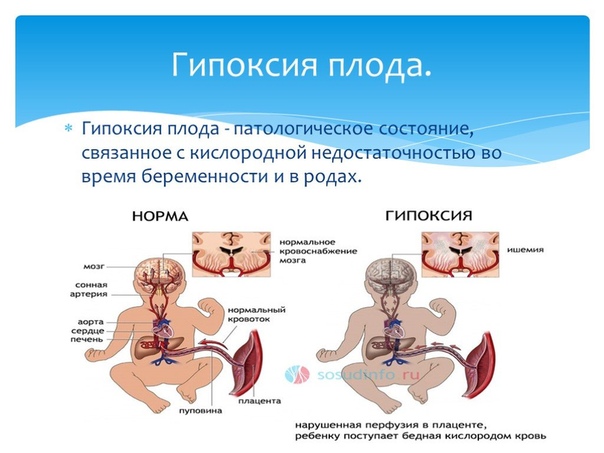 При стимуляции родов голова плода сдавливается так быстро, что резко повышается внутричерепное давление, нарушается венозный отток и артериальный приток крови в головном мозге, возникают участки отёка головного мозга, ишемии и кровоизлияния.
При стимуляции родов голова плода сдавливается так быстро, что резко повышается внутричерепное давление, нарушается венозный отток и артериальный приток крови в головном мозге, возникают участки отёка головного мозга, ишемии и кровоизлияния.
Жизненный опыт показывает, что у 90 % из опрошенных матерей, имеющих детей с ДЦП, искусственно вызывали и ускоряли роды или делали экстренное кесарево, когда на фоне стимуляции развивалась угроза жизни для плода.
В современной медицине бытует миф, что прежде всего из-за плохого здоровья беременных родятся больные, с поражением ЦНС дети. Но женщины военных и послевоенных 40-х и 50-х годов, бараков, теплушек-вагончиков, «общаг» и коммуналок, тяжело трудящиеся на производстве и в деревнях, при разгуле половых инфекций, абортов, отсутствии антибиотиков (и отсутствии ультразвуковой диагностики), разве могли иметь показатели здоровья лучше современных женщин?
Но зато не было еще в то время средств медикаментозной стимуляции родов, акушеры использовали в работе опыт, накопленный веками, и женщины 40-х -50-х годов народили целые поколения наших соотечественников, проложивших дорогу к атому и в космос, на спортивные олимпийские пьедесталы.
Так, в работе сотрудников кафедры Радзинского в 2006 г. установлено, что тяжёлому состоянию доношенных детей при рождении, потребовавшему ИВЛ, способствуют не столько нарушения фетоплацентарной системы, выявленные во время беременности, сколько элементы акушерской агрессии в родах. Экстренное кесарево сечение составило 33,6 % родов, после которых доношенные дети попали на ИВЛ (сразу после операции). В большинстве случаев кесарево сечение было запоздалым и производилось при выраженном страдании (гипоксии) плода. То есть такое экстренное кесарево сечение не спасало детей от повреждений ЦНС. В анализируемых случаях рождения доношенных детей, попавших в реанимацию на ИВЛ, большинство их матерей во время беременности имели низкую степень перинатального риска. Таким образом, материалы этой работы акушерской кафедры Радзинского, еще раз подтверждают, что детская инвалидность и заболеваемость ЦНС возросла у нас из-за того, что реанимируются прежде всего доношенные дети, которые при правильной тактике ведения родов должны были родиться здоровыми.
Представитель официального акушерства проф. И.С.Сидорова в своём руководстве для врачей-акушеров рекомендует при раскрытии шейки матки до 6-8 см обязательно производить искусственную амниотомию. Хотя дальше пишет, что амниотомия может спровоцировать гипертоническую дисфункцию матки, и вызывает кратковременное снижение маточно-плацентарного кровотока с изменением частоты сердцебиения плода – нередко брадикардии, что отражает выраженную гипоксию плода. Для преодоления этих опасных для здоровья плода последствий амниотомии Сидорова рекомендует вводить но-шпу, баралгин, которые являются токолитиками (подавляют схватки матки), и глюкозу с витамином С и кокарбоксилазой, что по мнению Сидоровой поддержит энергетический уровень и оксигенацию плода (стр. 87–88). Доказательств эффективности таких мер для сохранения здоровья плода после амниотомии Сидорова не приводит.
Проф. В.А.Потапов в методическом руководстве пишет: «На сегодняшний день доказана неэффективность следующих вмешательств при дистрессе (гипоксии) плода (уровень доказательности А): постельный режим, аспирин и дипиридамол, эстрогены, кислород, глюкоза, витамины, метаболиты, токолитики, блокаторы кальциевых каналов, увеличение объема циркулирующей крови, эссенциале, актовегин».
Медикаментозное лечение неэффективно при дистрессе плода, что доказано по любому препарату. Например, глюкоза – вызывает тяжёлый метаболический ацидоз, бета-адреномиметики (основные токолитики) вызывают синдром «обкрадывания плода», улучшая экстраплацентарный кровоток и обедняя плацентарное русло. Что касается кислорода, то он вызывает спазм плацентарных сосудов, а не расширение. Сегодня уже всем хорошо известно, что кислородным обеспечением на периферии управляют не тонус сосудов, не объём кровообращения, а метаболизм в тканях…
Зачем же прокалывать пузырь, если последствия этого вмешательства для дальнейшего протекания процесса родов и для здоровья ребёнка непредсказуемы и не поддаются профилактическому лечению?!
В иностранных руководствах не так категоричны с советами: «Хотя амниотомию широко применяют в современном акушерстве, важно учитывать риск осложнений данной процедуры: кроме возможности выпадения пуповины, что опасно развитием острой гипоксии у плода и экстренным КС, при амниотомии у плода развивается преходящий ацидоз и гипоксия, увеличивается частота вариабельных децелераций на КТГ, повышается риск сдавления предлежащей части головки плода, хотя в дальнейшем роды могут протекать как и при самостоятельном разрыве плодного пузыря.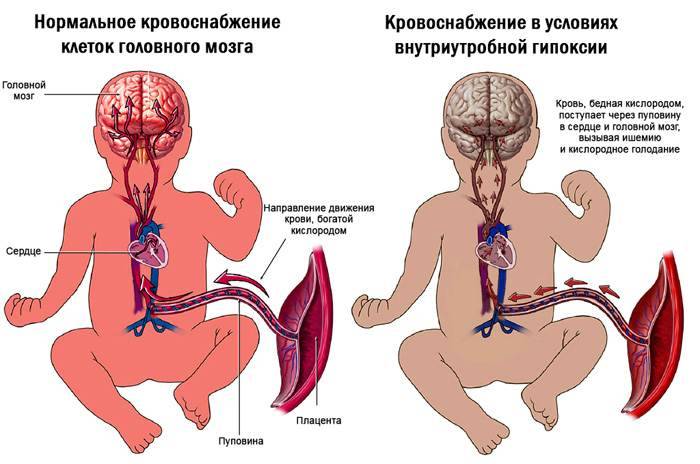 При назначении амниотомии с целью родостимуляции следует помнить, что преимущества ускорения родов перед их обычным течением не были подтверждены ни одним из крупных проспективных исследований»
При назначении амниотомии с целью родостимуляции следует помнить, что преимущества ускорения родов перед их обычным течением не были подтверждены ни одним из крупных проспективных исследований»
Так зачем прокалывать пузырь? Чтоб повредить ЦНС плода?
Гипоксия, повреждающая ЦНС, но возникающая в период вмешательства в роды индукцией и стимуляцией, остаётся с момента рождения не выявленной. Новорожденный при высоких баллах по шкале Апгар 7-10 не осматривается в динамике с описанием полного неврологического статуса, ведь асфиксии у него при рождении нет. В итоге, неврологические нарушения находят и фиксируют детские неврологи, когда с 1 месяца и далее к ним приносят на приём таких детей с различными нарушениями развития ЦНС.
ВЫВОДЫ:
Для снижения заболеваемости ДЦП и других нарушений развития ЦНС у детей акушеры обязаны ограничить использование для индукции (созревания шейки матки) и стимуляции родов и схваток искусственно созданные средства: окситоцин, простагландины, антипрогестагены и др. , осмотические дилятаторы (ламинарии и др.), так как при действии этих препаратов происходит развитие патологических (неестественных, ненатуральных) родов. Начавшийся же естественным образом процесс родов, под воздействием этих препаратов переходит в патологический процесс. Такое искусственно вызванное патологическое течение родового процесса опасно, прежде всего, нарушениями кровообращения и родовой травмой плода, что ведёт к повреждению ЦНС плода.
, осмотические дилятаторы (ламинарии и др.), так как при действии этих препаратов происходит развитие патологических (неестественных, ненатуральных) родов. Начавшийся же естественным образом процесс родов, под воздействием этих препаратов переходит в патологический процесс. Такое искусственно вызванное патологическое течение родового процесса опасно, прежде всего, нарушениями кровообращения и родовой травмой плода, что ведёт к повреждению ЦНС плода.
Врачебная акушерская индукция и стимуляция родов – основная причина повреждений ЦНС рождающегося ребенка.
«В настоящее время не существует ни одного эффективного метода медикаментозного или немедикаментозного лечения гипоксии (дистресса) плода, как во время беременности, так и в родах. Медикаментозная терапия дистресса плода (гипоксии плода) во всех врачебных протоколах мира отсутствует! Согласно разработанного протокола («Дистресс плода при беременности и во время родов» Клинический протокол акушерской помощи утверждён МЗ Украины приказом № 900 от 27. 12.2006г) сегодня гипоксию плода не лечат! В одних случаях есть беременные, которые требуют срочного родоразрешения (экстренное Кесарево сечение) вследствие состояния плода, с целью предоставления реанимационных мер новорожденному. Во всех других случаях просто наблюдаем состояние плода. Если дистресс (гипоксия) плода продолжается, необходимо безотлагательное родоразрешение.Так зачем вмешиваться в роды лекарствами и приёмами, которые могут вызвать дистресс (гипоксию) плода?
12.2006г) сегодня гипоксию плода не лечат! В одних случаях есть беременные, которые требуют срочного родоразрешения (экстренное Кесарево сечение) вследствие состояния плода, с целью предоставления реанимационных мер новорожденному. Во всех других случаях просто наблюдаем состояние плода. Если дистресс (гипоксия) плода продолжается, необходимо безотлагательное родоразрешение.Так зачем вмешиваться в роды лекарствами и приёмами, которые могут вызвать дистресс (гипоксию) плода?
Последствия дистресса (гипоксии) плода в родах в первые часы и дни жизни новорожденных неврологами и неонатологами практически не исследуются и не фиксируются, так как по принятой классификации перинатальных повреждений ЦНС, под контроль попадают только новорожденные с признаками асфиксии при рождении.
Для желающих прочесть доклад целиком см. ссылку http://www.domrebenok.ru/blog/prichina-dcp-i-drugix-povrezhdenij-cns-v-indukcii-i-stimulyacii-rodov/
Перелыгин И.В.
…
причины, симптомы, лечение и профилактика
Когда плод находится в животе матери, он не может дышать самостоятельно. Легкие ребенка еще находятся в нерасправленном состоянии и наполнены жидкостью, поэтому воздух не может попадать в них и активно циркулировать. Но для жизни плода необходим кислород. Все необходимые компоненты плод получает через кровь матери, важнейшим элементом этого является плацента. Если процесс питания плода всеми необходимыми веществами нарушается, то происходит голодание. Если плод не потребляет достаточно кислорода, то возникает гипоксия. Гипоксию плода могут вызвать различные причины. Гипоксия плода может произойти в период протекания беременности, а также может возникнуть непосредственно во время родов.
Легкие ребенка еще находятся в нерасправленном состоянии и наполнены жидкостью, поэтому воздух не может попадать в них и активно циркулировать. Но для жизни плода необходим кислород. Все необходимые компоненты плод получает через кровь матери, важнейшим элементом этого является плацента. Если процесс питания плода всеми необходимыми веществами нарушается, то происходит голодание. Если плод не потребляет достаточно кислорода, то возникает гипоксия. Гипоксию плода могут вызвать различные причины. Гипоксия плода может произойти в период протекания беременности, а также может возникнуть непосредственно во время родов.
Классификация гипоксии плода
Гипоксию плода разделяют по двум степеням тяжести: гипоксия плода умеренной тяжести и гипоксия плода тяжелой формы.
В зависимости от причин возникновения и скорости развития болезни различают острую и хроническую гипоксию плода.
Острая гипоксия
Острая гипоксия обычно развивается во время родов. При острой гипоксии развиваются нарушения жизненно важных органов. Диагноз острой гипоксии могут поставить только медицинские специалисты на основании нарушений сердцебиения и зафиксированной чрезмерной или ослабленной двигательной активности малыша. Диагноз подтверждают исследованиями специальной медицинской аппаратурой.
При острой гипоксии развиваются нарушения жизненно важных органов. Диагноз острой гипоксии могут поставить только медицинские специалисты на основании нарушений сердцебиения и зафиксированной чрезмерной или ослабленной двигательной активности малыша. Диагноз подтверждают исследованиями специальной медицинской аппаратурой.
Хроническая
Хроническая гипоксия развивается при перенашивании и инфицировании плода, при токсикозах женщины и экстрагенитальных болезнях, а также при конфликте резус-фактора крови мамы и ребенка. Хроническая гипоксия развивается медленно и пошагово, ребенок привыкает и приспосабливается к недостатку кислорода. Диагностировать хроническую гипоксию врачи могут, проводя исследования особыми методами и функциональными пробами.
В 1952 году на Конгрессе анестезиологов был принят документ, по которому оценивают степень тяжести гипоксии плода. В нем описана шкала Вирджинии Апгар (Virginia Apgar), в которой указывается 5 факторов, по которым необходимо оценивать состояние плода. Каждый фактор оценивают от одного до трех баллов. Оценивают ребенка по шкале Вирджинии Апгар два раза: как только он родился и через пять минут после.
Каждый фактор оценивают от одного до трех баллов. Оценивают ребенка по шкале Вирджинии Апгар два раза: как только он родился и через пять минут после.
Как происходит оценка
Первый фактор — активность дыхания. Необходимо понять характер дыхания (медленное, активное, нормальное или крик).
Второй фактор — наличие рефлексов. Необходимо проверить ответную реакцию на катетер в носовой полости (плачь, кашель, чихание, недовольство, нет реакции).
Третий фактор — состояние тонуса мышц. Необходимо согнуть руки и ноги малыша, выяснить характер движения конечностей (активные, нормальные, слабые).
Четвертый фактор — состояние кожи. Необходимо проверить цвет кожи тела и конечностей ребенка (розовое, белое, синюшное).
Пятый фактор — активность сердцебиения. Необходимо измерить сердцебиение (больше ста ударов в минуту, меньше ста ударов в минуту, сердцебиение отсутствует).
Здоровый, активный ребенок обычно получает 8-10 баллов. Но основная масса детей оценена в 7-8 баллов из-за синюшности конечностей и неактивного мышечного тонуса. Во время второго исследования, через пять минут, при хорошей адаптации ребенка, баллы повышаются до 8-10. Умеренная гипоксия диагностируется при 4-7 баллах. А если у ребенка по шкале Вирджинии Апгар только 0-3 балла, то это тяжелая гипоксия или асфиксия.
Осложнения гипоксии плода
Если женщина сбалансированно питалась, вела здоровый образ жизни, наблюдалась у врача и следовала всем рекомендациям, то осложнений заболевания гипоксии быть не должно. Но в тех случаях, когда гипоксия плода выражается в тяжелой степени, это представляет опасность для дальнейшего умственного и физического развития ребенка. Последствия гипоксии плода могут вызвать множественные заболевания ребенка. При тяжелых формах гипоксии развивается ацидоз и изменяются окислительно-восстановительные реакции. В результате таких осложнений ткани не принимают кислород, а впитывают только углекислый газ. При серьезных осложнениях гипоксии внутриутробный плод может начать дышать, в результате чего околоплодные воды и кровь попадают в легкие малыша.
В результате таких осложнений ткани не принимают кислород, а впитывают только углекислый газ. При серьезных осложнениях гипоксии внутриутробный плод может начать дышать, в результате чего околоплодные воды и кровь попадают в легкие малыша.
Профилактика гипоксии плода
Чтобы предотвратить развитие гипоксии плода, будущая мама задолго до беременности должна отказаться от всех вредных привычек. Беременным нужно много времени проводить на свежем воздухе, сбалансированно питаться и делать специальную гимнастику. Беременной женщине нельзя нервничать, переживать, напрягаться и переутомляться. Особое внимание стоит уделить профилактике железодефицитной анемии, потому что именно она является основной причиной нарушений кислородной недостаточности.
Плановое обследование у квалифицированного врача и проведение всех необходимых диагностических исследований позволяют предупредить заболевание и не допустить развития тяжелой формы гипоксии. Нужно всегда помнить, что любые эмоции и ощущения беременной непременно передаются малышу. Здоровый образ жизни женщины полезен не только ей самой, а и ее будущему потомству.
Здоровый образ жизни женщины полезен не только ей самой, а и ее будущему потомству.
Симптомы гипоксии плода
На первых неделях беременности диагностировать гипоксию плода очень сложно. Можно лишь спрогнозировать ее развитие, если у беременной есть болезни или развита анемия.
На двадцатой неделе, когда плод начинает активную деятельность в утробе, беременная может заметить уменьшенную активность, что является признаком гипоксии плода. Если внутриутробный плод стал меньше двигаться, то стоит обратиться к врачу для полного диагностического исследования.
Развитие гипоксии плода характеризуется активным, учащенным сердцебиением. На завершающем этапе беременности, наоборот — при гипоксии сердцебиение происходит замедленно. Тоны сердца при гипоксии приглушены. В околоплодных водах может появиться первородный кал плода или меконий. Легкая форма гипоксии провоцирует активное внутриутробное движение плода. При тяжелой форме движения плода становятся нечастыми и трудноразличимыми.
При тяжелой форме движения плода становятся нечастыми и трудноразличимыми.
По цвету отошедших вод беременной также можно выявить гипоксию плода. Если околоплодные воды прозрачны, то малыш здоров с нормальным кровообращением. Если же воды мутные, темные, с зеленым отливом или в них присутствует первородный кал, то это говорит о признаках гипоксии плода.
Обнаружили симптомы данного заболевания?Звоните
Наши специалисты проконсультируют Вас!
Диагностика гипоксии плода
Чтобы выявить нарушения кислородной недостаточности, необходимо провести исследования несколькими методами, потому что только комплексное исследование может точно диагностировать гипоксию плода.
- При медикаментозном аппаратном обследовании можно выявить различные признаки гипоксии.
- При ультразвуковой диагностике (УЗИ) можно исследовать размеры и вес внутриутробного плода: если они не соответствуют норме, то это главные признаки задержки развития малыша.

- Во время допплеровского исследования проверяют характер и степень всевозможных нарушений в кровообращении беременной и ее ребенка. Можно измерить частоту сердцебиения плода и выявить достаточно ли получает плод через плаценту питательных веществ. Во время допплерометрии можно выявить степень тяжести гипоксии плода и предположить дальнейшее развитие болезни.
- В результате кардиотокографии (КТГ) можно диагностировать гипоксию плода. Часто результат зависит от настроения и общего состояния беременной, что может провоцировать неправильные результаты относительно развития гипоксии плода. Аппарат выдает сердечные сокращения, записанные на бумажной ленте, только медицинский специалист может расшифровать данные или назначить повторное обследование.
- Чтобы диагностировать развитие хронической гипоксии проводят нестрессовый тест (НТС) при котором исследуют ускоренное развитие плода.
В сложных ситуациях врачи назначают другие методы диагностики, при которых во время родов берут кровь из кожи головы ребенка или назначают амниоскопию.
Электрокардиографию (ЭКГ) используют тогда, когда необходимо провести клиническое исследование крови матери. Биохимическими и гормональными методами можно определить наличие важных ферментов, жиров, продуктов окисления в крови беременной.
Лечение гипоксии плода
Только медицинские специалисты могут назначать методы лечения гипоксии. Не существует единой панацеи, так как все люди разные и им необходимы различные подходы в лечении. Лечение гипоксии плода зависит от причин нарушений и степени тяжести болезни.
При гипоксии плода необходимым условием для беременной является полный покой. Во время лечения женщине зачастую назначают постельный режим и специальные медицинские препараты, главной задачей которых является снизить вязкость крови, а также улучшить кровоснабжение плаценты и нормализовать обмен питательными веществами между беременной и плодом.
Иногда причина развития гипоксии плода неясна. Тогда избавиться от кислородных нарушений затруднительно и в таких случаях внимательно следят за активностью плода. В подобных ситуациях медики часто исследуют кровоток в пуповине и частоту сердцебиения плода.
Если гипоксия начинает нарастать и лечение не приносит положительных результатов, то назначают проведение операции кесарева сечения. Но это актуально только тогда, когда срок беременности превысил 28 недель.
Если беременной все же поставлен диагноз хронической внутриутробной гипоксии плода, то во время родов, чтобы предотвратить негативные последствия гипоксии, обязательно проводят кардиомоторное наблюдение за состоянием ребенка.
Лечение антиоксидантами во время беременности может защитить ребенка от проблем с памятью в более позднем возрасте.
Недавно опубликованное исследование обнаружило прямую связь между низким содержанием кислорода в матке и ухудшением памяти во взрослом возрасте, но также показало, что антиоксидантные добавки во время беременности могут защитить здоровье мозга ребенка.

Исследование, проведенное профессором Дино Джуссани из отдела физиологии, развития и неврологии Кембриджский университет, указывает, что низкий уровень кислорода в матке во время беременности вызывает окислительный стресс в плаценте, может повлиять на развитие мозга плода и вызвать проблемы с памятью во взрослой жизни.
Снижение поступления кислорода в кровь (гипоксия плода) в критические периоды развития центральной нервной системы ребенка «влияет на количество нервных связей и клеток, которые образуются в головном мозге, из-за чего во взрослой жизни они страдают проблемами памяти. и более раннее снижение когнитивных функций », — говорит доктор Эмили Камм, первый автор исследования, опубликованного в журнале FASEB.
«Очень интересно думать, что мы можем защитить здоровье мозга плода с помощью простого лечения, которое может быть назначено матери во время беременности», — сказал руководитель исследования профессор Дино Джуссани.
ПРОФИЛАКТИЧЕСКАЯ МЕДИЦИНА ВО ВРЕМЯ БЕРЕМЕННОСТИНедостаток кислорода в матке, известный как хроническая гипоксия плода и вызываемый рядом состояний, таких как гестационный диабет, материнское ожирение, инфекция плаценты или преэклампсия, является одним из наиболее распространенных осложнений во время беременности и родов. можно поставить диагноз УЗИ показывая, что ребенок не растет должным образом «Это исследование показывает, что мы можем использовать профилактическую медицину еще до рождения, чтобы надолго защитить здоровье мозга», — сказал профессор Джуссани.
можно поставить диагноз УЗИ показывая, что ребенок не растет должным образом «Это исследование показывает, что мы можем использовать профилактическую медицину еще до рождения, чтобы надолго защитить здоровье мозга», — сказал профессор Джуссани.
ЖЕНСКИЙ КОМПАКТНЫЙ ДИСК
Команда женского CD, состоящая из гинекологов, акушерок, физиотерапевтов и диетологов, состоит из высококвалифицированных специалистов во всех областях, связанных с беременностью, родами и послеродовым периодом.
С первого посещения ваш гинеколог и его команда будут тщательно контролировать вашу беременность и оказывать вам индивидуальное внимание до момента родов.
Наблюдение за беременностью включает посещение гинеколога, УЗИ и медицинские тесты, которые гарантируют контроль состояния плода и безопасную беременность.
Восстановление детей после гипоксии в центре ДокторНейро
Гипоксия у новорожденных – это очень часто встречающийся термин в педиатрической практике. Простыми словами, он обозначает нехватку малышу кислорода во время беременности или в родах.
Простыми словами, он обозначает нехватку малышу кислорода во время беременности или в родах.
Причины гипоксии у новорожденных
Причины для этого могут быть самые разнообразные: различные заболевания мамы, резус-конфликт, преждевременное старение плаценты, обвитие пуповины, курение, неблагоприятная экология. При таком разнообразии причин, не удивительно, что гипоксия новорожденного встречается у огромного количества малышей, особенно в крупных городах. Лечение гипоксии начинается непосредственно в роддоме и зависит от ее степени выраженности (о выраженном состоянии можно говорить при выставлении оценки по шкале Апгар 6 и менее баллов), длительности нехватки кислорода, а также того, какие системы пострадали в наибольшей степени.
Наблюдение
Стоит помнить о том, что компенсаторные возможности новорожденных очень велики, а уровень развития современной медицины высок, поэтому чаще всего с серьезными последствиями гипоксии можно справиться. Однако это не отменяет отдаленных последствий в виде повышенной возбудимости, утомляемости, гиперактивности, нарушений внимания, задержки речевого развития, дизартрии, нарушений формирования школьных навыков и много другого. Поэтому начиная с раннего возраста и до момента начала школьного обучения (а лучше и в начальных классах школы) детям с последствиями гипоксии новорожденных стоит наблюдаться врачами и специалистами психолого-педагогического профиля с целью предотвращения или своевременной коррекции особенностей в развитии.
Поэтому начиная с раннего возраста и до момента начала школьного обучения (а лучше и в начальных классах школы) детям с последствиями гипоксии новорожденных стоит наблюдаться врачами и специалистами психолого-педагогического профиля с целью предотвращения или своевременной коррекции особенностей в развитии.
Лечение
Специалисты нашего центра: неврологи, логопеды, дефектологи, психологи, нейропсихологи, нейрореабилитологи – помогут вам оценить развитие вашего ребенка, предоставят информацию о его трудностях и компенсаторных возможностях, составят индивидуальную программу комплексного сопровождения, проведут курс занятий при необходимости.
Гипоксия плода — причины, симптомы, диагностика и лечение
Гипоксия плода – внутриутробный синдром, характеризующийся комплексом изменений со стороны плода, обусловленных недостаточным поступлением кислорода к его тканям и органам. Гипоксия плода характеризуется нарушениями со стороны жизненно-важных органов, в первую очередь, ЦНС. Диагностика гипоксии плода включает проведение кардиотокографии, допплерометрии маточно-плацентарного кровообращения, акушерского УЗИ, амниоскопии. Лечение гипоксии плода направлено на нормализацию маточно-плацентарного кровотока, улучшение реологии крови; иногда данное состояние требует досрочного родоразрешения женщины.
Диагностика гипоксии плода включает проведение кардиотокографии, допплерометрии маточно-плацентарного кровообращения, акушерского УЗИ, амниоскопии. Лечение гипоксии плода направлено на нормализацию маточно-плацентарного кровотока, улучшение реологии крови; иногда данное состояние требует досрочного родоразрешения женщины.
Общие сведения
Гипоксия плода регистрируется в 10,5% случаев от общего числа беременностей и родов. Гипоксия плода может развиваться в различные сроки внутриутробного развития, характеризоваться различной степенью кислородной недостаточности и последствиями для организма ребенка. Гипоксия плода, развившаяся в ранние сроки гестации, вызывает пороки и замедление развития эмбриона. На поздних сроках беременности гипоксия сопровождается задержкой роста плода, поражением ЦНС, снижением адаптационных возможностей новорожденного.
Гипоксия плода
Причины гипоксии плода
Гипоксия плода может являться следствием широкого круга неблагоприятных процессов, происходящих в организме ребенка, матери или в плаценте. Вероятность развития гипоксии у плода повышается при заболеваниях материнского организма – анемии, сердечно-сосудистой патологии (пороках сердца, гипертонии), заболеваниях почек, дыхательной системы (хроническом бронхите, бронхиальной астме и др.), сахарном диабете, токсикозах беременности, многоплодной беременности, ИППП. Негативно на снабжении плода кислородом отражается алкоголизм, никотиновая, наркотическая и другие виды зависимости матери.
Вероятность развития гипоксии у плода повышается при заболеваниях материнского организма – анемии, сердечно-сосудистой патологии (пороках сердца, гипертонии), заболеваниях почек, дыхательной системы (хроническом бронхите, бронхиальной астме и др.), сахарном диабете, токсикозах беременности, многоплодной беременности, ИППП. Негативно на снабжении плода кислородом отражается алкоголизм, никотиновая, наркотическая и другие виды зависимости матери.
Опасность гипоксии плода возрастает при нарушениях плодово-плацентарного кровообращения, обусловленных угрозой выкидыша, перенашиванием беременности, патологией пуповины, фетоплацентарной недостаточностью, аномалиями родовой деятельности и других осложнениях беременности и родового процесса. К факторам риска в развитии интранатальной гипоксии относят гемолитическую болезнь плода, врожденные аномалии развития, внутриутробное инфицирование (герпетическая инфекция, токсоплазмоз, хламидиоз, микоплазмоз и др.), многократное и тугое обвитие пуповины вокруг шейки ребенка, длительная по времени компрессия головки в процессе родов.
В ответ на гипоксию у плода, прежде всего, страдает нервная система, поскольку нервная ткань наиболее чувствительная к дефициту кислорода. Начиная с 6-11 недели развития эмбриона, недостаток кислорода вызывает задержку созревания головного мозга, нарушения в строении и функционировании сосудов, замедление созревания гематоэнцефалического барьера. Также гипоксию испытывают ткани почек, сердца, кишечника плода.
Незначительная гипоксия плода может не вызывать клинически значимых повреждений ЦНС. При тяжелой гипоксии плода развиваются ишемия и некрозы в различных органах. После рождения у ребенка, развивавшегося в условиях гипоксии, может наблюдаться широкий диапазон нарушений – от неврологических расстройств до задержки психического развития и тяжелых соматических отклонений.
Классификация гипоксии плода
По времени течения и скорости возникновения выделяют острую и хронически развивающуюся гипоксию плода.
Возникновение острой гипоксии плода обычно связано с аномалиями и осложнениями родового акта – стремительными или затяжными родами, прижатием или выпадением пуповины, длительным сдавлением головки в родовых путях. Иногда острая гипоксия плода может развиться в ходе беременности: например, в случае разрыва матки или преждевременной отслойки плаценты. При острой гипоксии стремительно нарастают нарушения функций жизненно важных органов плода. Острая гипоксия характеризуется учащением сердцебиения плода (более 160 уд. в мин.) или его урежением (менее 120 уд. в мин.), аритмией, глухостью тонов; усилением или ослаблением двигательной активности и т. д. Нередко на фоне острой гипоксии развивается асфиксия плода.
Иногда острая гипоксия плода может развиться в ходе беременности: например, в случае разрыва матки или преждевременной отслойки плаценты. При острой гипоксии стремительно нарастают нарушения функций жизненно важных органов плода. Острая гипоксия характеризуется учащением сердцебиения плода (более 160 уд. в мин.) или его урежением (менее 120 уд. в мин.), аритмией, глухостью тонов; усилением или ослаблением двигательной активности и т. д. Нередко на фоне острой гипоксии развивается асфиксия плода.
К хронической гипоксии приводит длительный умеренный дефицит кислорода, в условиях которого развивается плод. При хроническом дефиците кислорода возникает внутриутробная гипотрофия; в случае истощения компенсаторных возможностей плода развиваются те же нарушения, что и при остром варианте течения. Гипоксия плода может развиваться в ходе беременности или родов; отдельно рассматривается гипоксия, возникшая у ребенка после рождения вследствие болезни гиалиновых мембран, внутриутробной пневмонии и т. д.
д.
С учетом компенсаторно-адаптационных возможностей плода гипоксия может приобретать компенсированные, субкомпенсированные и декомпенсированные формы. Поскольку при неблагоприятных условиях плод испытывает не только гипоксию, но и целый комплекс сложных нарушений обмена, в мировой практике данное состояние определяется как «дистресс-синдром», который подразделяется на дородовый, развившийся в родах и респираторный.
Проявления гипоксии плода
Выраженность изменений, развивающихся у плода под воздействием гипоксии, определяется интенсивностью и длительностью испытываемой кислородной недостаточности. Начальные проявления гипоксии вызывают у плода учащение сердцебиения, затем — его замедление и приглушенность тонов сердца. В околоплодных водах может появиться меконий. При гипоксии легкой степени увеличивается двигательная активность плода, при тяжелой – движения урежаются и замедляются.
При выраженной гипоксии у плода развиваются нарушения кровообращения: отмечается кратковременный тахикардия и подъем АД, сменяющиеся брадикардией и спадом АД. Реологические нарушения проявляются сгущением крови и выходом плазмы из сосудистого русла, что сопровождается внутриклеточным и тканевым отеком. В результате повышенной ломкости и проницаемости сосудистых стенок возникают кровоизлияния. Снижение тонуса сосудов и замедление кровообращение приводит к ишемизации органов. При гипоксии в организме плода развивается ацидоз, изменяется баланс электролитов, нарушается тканевое дыхание. Изменения в жизненно важных органах плода может вызывать его внутриутробную гибель, асфиксию, внутричерепные родовые травмы.
Реологические нарушения проявляются сгущением крови и выходом плазмы из сосудистого русла, что сопровождается внутриклеточным и тканевым отеком. В результате повышенной ломкости и проницаемости сосудистых стенок возникают кровоизлияния. Снижение тонуса сосудов и замедление кровообращение приводит к ишемизации органов. При гипоксии в организме плода развивается ацидоз, изменяется баланс электролитов, нарушается тканевое дыхание. Изменения в жизненно важных органах плода может вызывать его внутриутробную гибель, асфиксию, внутричерепные родовые травмы.
Диагностика гипоксии плода
Подозрение на то, что плод испытывает гипоксию, могут возникнуть при изменении его двигательной активности – беспокойном поведении, усилении и учащении шевелений. Длительная или прогрессирующая гипоксия приводит к ослаблению шевелений плода. Если женщина замечает такие изменения, ей следует немедленно обратиться к гинекологу, осуществляющему ведение беременности. При прослушивании сердцебиения плода акушерским стетоскопом врач оценивает частоту, звучность и ритм сердечных тонов, наличие шумов. Для выявления гипоксии плода современная гинекология использует проведение кардиотокографии, фонокардиографии плода, допплерометрии, УЗИ, амниоскопии и амниоцентеза, лабораторных исследований.
Для выявления гипоксии плода современная гинекология использует проведение кардиотокографии, фонокардиографии плода, допплерометрии, УЗИ, амниоскопии и амниоцентеза, лабораторных исследований.
В ходе кардиотокографии удается отследить ЧСС плода и его двигательную активность. По изменению сердцебиения в зависимости от покоя и активности плода судят о его состоянии. Кардиотокография, наряду с фонокардиографией, широко применяется в родах. При допплерографии маточно-плацентарного кровотокаизучается скорость и характер кровотока в сосудах пуповины и плаценты, нарушение которого приводит к гипоксии плода. Кордоцентез под контролем УЗИ проводится для забора пуповинной крови и исследования кислотно-щелочного равновесия. Эхоскопическим признаком гипоксии плода может служить выявляемая задержка его роста. Кроме того, в процессе акушерского УЗИ оценивается состав, объем и цвет околоплодных вод. Выраженное многоводие или маловодие могут сигнализировать о неблагополучии.
Проведение амниоскопии и амниоцентеза через канал шейки матки позволяет визуально оценить прозрачность, цвет, количество околоплодной жидкости, наличие в ней включений (хлопьев, мекония), провести биохимические пробы (измерение рН, исследование содержания гормонов, ферментов, концентрации CO2). Амниоскопия противопоказана при предлежании плаценты, кольпите, цервиците, угрозе прерывания беременности. Непосредственная оценка амниотической жидкости осуществляется после ее излития в I периоде родов. В пользу гипоксии плода свидетельствует примесь в околоплодных водах мекония и их зеленоватый цвет.
Амниоскопия противопоказана при предлежании плаценты, кольпите, цервиците, угрозе прерывания беременности. Непосредственная оценка амниотической жидкости осуществляется после ее излития в I периоде родов. В пользу гипоксии плода свидетельствует примесь в околоплодных водах мекония и их зеленоватый цвет.
Лечение гипоксии плода
В случае выявления гипоксии плода беременная госпитализируется в акушерско-гинекологический стационар. Наличие гипоксии плода требует коррекции имеющейся акушерской и экстрагенитальной патологии матери и нормализации фетоплацентарного кровообращения. Беременной показан строгий покой, оксигенотерапия. Проводится терапия, направленная на снижение тонуса матки (папаверин, дротаверин, эуфиллин, гексопреналин, тербуталин), уменьшение внутрисосудистой свертываемости (дипиридамол, декстран , гемодериват крови телят, пентоксифиллин).
Хроническая гипоксия плода требует введения препаратов, улучшающих клеточную проницаемость для кислорода и метаболизм (эссенциальных фосфолипидов, витаминов Е, С, В6, глутаминовой кислоты, глюкозы), антигипоксантов, нейропротекторов. При улучшении состояния беременной и уменьшении явлений гипоксии плода беременной может быть рекомендована дыхательная гимнастика, аквагимнастика, УФО, индуктотермия. При неэффективности комплексных мер и сохранении признаков гипоксии плода на сроке свыше 28 недель показано родоразрешение в экстренном порядке (экстренное кесарево сечение).
При улучшении состояния беременной и уменьшении явлений гипоксии плода беременной может быть рекомендована дыхательная гимнастика, аквагимнастика, УФО, индуктотермия. При неэффективности комплексных мер и сохранении признаков гипоксии плода на сроке свыше 28 недель показано родоразрешение в экстренном порядке (экстренное кесарево сечение).
Роды при хронической гипоксии плода ведутся с использованием кардиомниторинга, позволяющего своевременно применять дополнительные меры. При острой гипоксии, развившейся в родах, ребенку требуется реанимационная помощь. Своевременная коррекция гипоксии плода, рациональное ведение беременности и родов позволяют избежать развития грубых нарушений у ребенка. В дальнейшем все дети, развивавшиеся в условиях гипоксии, наблюдаются у невролога; нередко им требуется помощь психолога и логопеда.
Осложнения гипоксии плода
Профилактика гипоксии плода
Предупреждение развития гипоксии плода требует от женщины ответственной подготовки к беременности: лечения экстрагенитальной патологии и заболеваний органов репродуктивной системы, отказ от нездоровых привычек, рациональное питание. Ведение беременности должно осуществляться с учетом факторов риска и своевременным контролем за состоянием плода и женщины. Недопущение развития острой гипоксии плода заключается в правильном выборе способа родоразрешения, профилактике родовых травм.
Ведение беременности должно осуществляться с учетом факторов риска и своевременным контролем за состоянием плода и женщины. Недопущение развития острой гипоксии плода заключается в правильном выборе способа родоразрешения, профилактике родовых травм.
Курение или беременность – выбирай — ГАУЗ ГКБ 2
Ни для кого не секрет, что курение – это вредная привычка. Благо человек сам принимает решение касательно того, курить ему или нет. Детей же, находящихся в утробе матери, об этом выборе не спрашивают. А потому некоторые нерадивые мамаши отравляют организм своих детей против воли.
Специалисты пропагандируют отказ от курения в первые дни беременности, а ещё лучше – перед зачатием. Это, предотвращает развитие врождённых пороков сердца у плода. По результатам исследований, у матерей, курящих в первом триместре, риск рождения ребёнка с пороком сердца составляет более 20%. Более того, беременная мать с каждой выкуренной сигаретой увеличивает риск преждевременных родов младенца. Так что быть вашему ребёнку здоровым или нет – решать вам.
Так что быть вашему ребёнку здоровым или нет – решать вам.
Пагубную привычку приобрести гораздо легче, чем бороться с её негативными последствиями. Если в юности сигарета помогла зарекомендовать себя, выделиться среди подобных себе людей с сигаретой в зубах и миллионом комплексов за плечами, то с возрастом она берёт слишком дорогую плату за юношескую раскрепощённость. Курящий младенец. Если Вы не хотите отказаться от курения в период беременности (именно «не хотите»), Вы заранее обрекаете своё чадо на ряд патологий. В акушерской практике симптомокомплекс, вызываемый неблагоприятным действием табака, называется «фетальный табачный синдром». Осложнения могут развиться как у самой женщины, так и у плода, нередко патология проявляется после рождения ребёнка и прогрессирует с возрастом. Никотин и токсические продукты горения (угарный газ) попадают в кровь матери, а оттуда в плаценту и отравляют плод. Сам по себе никотин сокращает сосуды, что уменьшает поступление кислорода и питательных продуктов. Это может привести к гипоксии плода, недоношенности или незрелости плода (маленький вес при доношенной беременности). Самое страшное, что следствием курения может быть внутриутробная гибель плода. Это не запугивание, а научно-обоснованный факт.
Это может привести к гипоксии плода, недоношенности или незрелости плода (маленький вес при доношенной беременности). Самое страшное, что следствием курения может быть внутриутробная гибель плода. Это не запугивание, а научно-обоснованный факт.
Курение удваивает шанс рождения мёртвого младенца. Риск спонтанного аборта у курящих вовремя беременности женщин на 30-70% выше, чем у некурящих, а риск развития выкидыша, по некоторым данным, достигает 96%. Никотин вызывает спазм (сокращение) сосудов, приводит к увеличению вязкости крови почти на 30%, следствием чего является тромбоз сосудов плаценты и прерывание беременности. Угарный газ, поступающий в кровь при курении, может быть опаснее самого никотина, так как, поступая в кровь младенца, он накапливается в кровяных тельцах (образуя неактивный карбоксигемоглобин взамен активного гемоглобина), делая их неспособными транспортировать кислород в ткани. Мало того, концентрация карбоксигемоглобина в крови плода обычно на 10-15% выше, чем в крови матери. Страдают при этом самые чувствительные к кислородному голоданию органы плода (мозг, почки, сердце). Курение неблагоприятно влияет на процесс закладки и развития нервной трубки у плода, ведёт к рождению анэнцефалов, младенцев с врождёнными аномалиями умственного развития, с волчьей пастью и заячьей губой.
Страдают при этом самые чувствительные к кислородному голоданию органы плода (мозг, почки, сердце). Курение неблагоприятно влияет на процесс закладки и развития нервной трубки у плода, ведёт к рождению анэнцефалов, младенцев с врождёнными аномалиями умственного развития, с волчьей пастью и заячьей губой.
У курящих женщин чаще, чем у некурящих, рождаются дети с пороками сердца и дефектами развития носоглотки, паховой грыжей, косоглазием. Позднее винить в том, что «курящий» в утробе малыш отстает в учёбе, раздражителен, неуправляем, а также страдает от астмы, Вы можете только себя. Если он не умрёт во сне в младенчестве (а такое встречается нередко), то уж поверьте, когда он вырастет, скорее всего, станет заядлым курильщиком. Те же симптомы ждут будущего младенца, если женщина находится постоянно рядом с курящим членом семьи. Хочу родить здорового ребенка! Помочь курящей женщине можно, но только если она сама этого захочет.
При наличии желания можно бросить курить при любом количестве выкуриваемых в день сигарет. Но все специалисты бессильны, если беременная женщина не хочет бросать. Есть женщины, которые пытаются свести к минимуму количество выкуриваемых в день сигарет в период беременности. Это бессмысленно, так как не даёт нужного результата. Если Вы родите больного и слабого ребёнка, выкуривая всего две сигареты в день, кого Вы будете винить в имеющейся патологии? Естественно, только себя. Необратимые последствия может иметь даже одна сигарета. Когда нужно бросить курить? При планировании семьи нужно избавиться от пагубной привычки ещё до зачатия или сразу после. Если же Вы курите и только что обнаружили свою беременность, то Вы должны прекратить курение до срока 14 недели. В этом случае шанс родить здорового ребёнка почти не отличается от такового здоровой, некурящей беременной женщины.
Но все специалисты бессильны, если беременная женщина не хочет бросать. Есть женщины, которые пытаются свести к минимуму количество выкуриваемых в день сигарет в период беременности. Это бессмысленно, так как не даёт нужного результата. Если Вы родите больного и слабого ребёнка, выкуривая всего две сигареты в день, кого Вы будете винить в имеющейся патологии? Естественно, только себя. Необратимые последствия может иметь даже одна сигарета. Когда нужно бросить курить? При планировании семьи нужно избавиться от пагубной привычки ещё до зачатия или сразу после. Если же Вы курите и только что обнаружили свою беременность, то Вы должны прекратить курение до срока 14 недели. В этом случае шанс родить здорового ребёнка почти не отличается от такового здоровой, некурящей беременной женщины.
Курение после родов. Возобновить курение без вреда для здоровья ребёнка можно только после окончания периода кормления грудью, так как никотин проникает в грудное молоко. Помимо известных симптомов отравления никотином, у ребёнка может пострадать иммунная система.
Диагностика патологии плода в период беременности. Оценить состояние плода курящей женщины помогает тщательный опрос и ультразвуковое исследование. Лечение патологии беременности и отказ от курения. Несомненно, бросить курить нелегко. Вам может потребоваться помощь психотерапевта.
Курение во время беременности – это всегда риск, всегда отягчающий фактор, а для чего вам это? Гораздо полезнее просто отказаться от сигарет, чем гадать, повредят или не повредят они вашему будущему ребенку. Беременность – прекрасный повод бросить курить, ведь вы в ответе не только за свое здоровье, но и за здоровье вашего еще не рожденного малыша!
КТГ плода, сроки проведения КТГ при беременности, расшифровка – МЕДСИ
Оглавление
Кардиотокография при беременности (КТГ плода) является популярным методом пренатальной диагностики. Ее широкому распространению способствуют простота проведения, безопасность для ребенка и матери, а также стабильность получаемой информации и высокая информативность.
В основу метода положен принцип Доплера, а все изменения улавливаются специальным ультразвуковым датчиком. В рамках КТГ удается определить ЧСС (частоту сердечных сокращений) плода в покое и при движении, в ответ на сокращения матки и воздействия различных факторов окружающей среды.
Необходимость проведения
Кардиотокография при беременности в соответствии с приказом Минздрава проводится в третьем триместре не менее 3 раз. Кроме того, обязательной диагностика является во время родов.
КТГ назначается с целью:
- Определения ЧСС плода и частоты сокращений матки
- Проведения дистресса и решения вопросов родоразрешения
- Контроля состояния плода до родов и во время родовой деятельности (в схватках и между ними)
Выделяют и дополнительные показания к диагностике.
К ним относят:
- Гестоз
- Малокровие женщины
- Наличие у пациентки артериальной гипертензии (гипертонии, повышенного артериального давления)
- Задержку развития плода
- Мало- и многоводие
- Угрозы преждевременных родов и перенашивания
- Резус-конфликтную беременность
- Многоплодие
- Тяжелые патологии у матери
Также диагностика назначается с целью оценки эффективности терапии фетоплацентарной недостаточности и гипоксии, для контроля ранее полученных неудовлетворительных результатов исследования и при задержке развития.
Сроки проведения КТГ при беременности
Кардиотокография плода проводится с 32 недели. При необходимости возможно выполнение исследования и на более раннем сроке, но до 28 недель методика неинформативна, так как не позволяет получить точные результаты. Это обусловлено тем, что только к этому времени сердце плода начинает регулироваться вегетативной нервной системой, а частота его сокращений реагирует на совершаемые им движения. К 32 неделе формируется цикличность периодов бодрствования и сна малыша.
Важно! Если беременность протекает без осложнений, то делать КТГ рекомендуют обычно 1 раз в 10 дней. При наличии осложнений процедуру могут повторять с периодичностью в 5-7 дней. Если у плода отмечается гипоксия, диагностику назначают ежедневно или через день до нормализации состояния или родоразрешения.
Во время родов КТГ рекомендуют делать каждые 3 часа. При наличии осложнений – чаще. Период схваток сопровождается постоянным контролем важных параметров сокращения сердца плода и матки.
Подготовка к выполнению обследования
Специальная подготовка перед КТГ не проводится. Диагностика выполняется через 15,2-2 часа после приема пищи (не натощак и не сразу после еды). Перед процедурой следует посетить туалет, так как исследование займет 20-40 минут. Если пациентка курит, обязательно надо воздержаться от сигарет хотя бы на 2-3 часа. Непосредственно во время исследования женщине следует сохранять неподвижность.
Важно! Процедура является безопасной и безболезненной.
Методы проведения
Кардиотокография может быть:
- Прямой (внутренней)
- Непрямой (наружной)
Наружная КТГ проводится чаще. Она выполняется, когда пациентка лежит на левом боку либо полусидит (положения позволяют предотвратить синдром сдавления нижней полой вены). Регистрирующий частоту сердечных сокращений датчик предварительно обрабатывается специальным гелем, обеспечивающим максимальный контакт с кожей, и размещается на передней брюшной стенке. Конкретное место его расположения определяется врачом с учетом максимальной слышимости работы сердца плода. Датчик, регистрирующий сокращения матки, располагается в районе ее правого угла. Предварительно он не смазывается гелем! Пациентка получает специальное устройство, позволяющее самостоятельно регистрировать шевеления плода. Регистрация ритма сердца проводится не менее 20 минут. Очень важно зафиксировать не менее двух шевелений ребенка длительностью не менее 15 секунд. Именно в это время сердечный ритм ускоряется.
Конкретное место его расположения определяется врачом с учетом максимальной слышимости работы сердца плода. Датчик, регистрирующий сокращения матки, располагается в районе ее правого угла. Предварительно он не смазывается гелем! Пациентка получает специальное устройство, позволяющее самостоятельно регистрировать шевеления плода. Регистрация ритма сердца проводится не менее 20 минут. Очень важно зафиксировать не менее двух шевелений ребенка длительностью не менее 15 секунд. Именно в это время сердечный ритм ускоряется.
Сделать внутреннюю КТГ можно только в родах и при таких условиях, как открытие маточного зева не менее чем на 2 сантиметра, излитие вод и вскрытый плодный пузырь. Для проведения такой диагностики применяют специальный спиралевидный электрод. Он накладывается на кожу плода. Маточные сокращения при этом фиксируются стандартно, через переднюю брюшную стенку или путем введения в организм пациентки специального катетера.
Расшифровка результатов
КТГ плода при беременности и в родах – обследование, которое позволяет оценить целый ряд показателей, в числе которых:
- Базальный ритм частоты сердечных сокращений плода (среднее значение ЧСС между мгновенными показателями, в перерыве между схватками или в 10-минутном промежутке)
- Базальные изменения.
 Данный показатель определяет колебания частоты сердечных сокращений плода, которые не зависят от маточных сокращений
Данный показатель определяет колебания частоты сердечных сокращений плода, которые не зависят от маточных сокращений - Периодические изменения. Этот показатель позволяет определить изменения ЧСС, происходящие в ответ на маточные сокращения
- Время восстановления. Этот показатель свидетельствует о временном отрезке, следующим за окончанием сокращения матки и возврату к базальному ритму
- Амплитуда. Параметр представляет собой разницу в значениях сердечных сокращений между базальным ритмом и периодическими и базальными изменениями
- Децелерации. Этот параметр представляет собой урежение сокращений на 30 и более и имеет продолжительность не менее 30 секунд
- Акцелерации. Этот параметр представляет возрастание сокращений на 15-25 в минуту. Он считается благоприятным признаком, свидетельствующим об удовлетворительном состоянии плода
Нормальными считаются следующие показатели:
- Базальный ритм: 120-160 в минуту
- Амплитуда: 10-25 в минуту
- Децелерации: отсутствуют
- Акцелерации: 2 и более за 10 минут
Кардиотокограмма может быть сомнительной и патологической. В этих случаях она нередко проводится повторно, чтобы врач мог убедиться в наличии определенной патологии и принять адекватное решение о дальнейших действиях.
В этих случаях она нередко проводится повторно, чтобы врач мог убедиться в наличии определенной патологии и принять адекватное решение о дальнейших действиях.
Преимущества проведения в МЕДСИ
- Опытные врачи. Специалисты МЕДСИ постоянно проходят обучение и повышают квалификацию. Это расширяет их возможности в сфере диагностики, профилактики и устранения различных патологий
- Новейшие методы диагностики. В МЕДСИ обследования проводятся с применением современного высокоточного оборудования экспертного класса. Это позволяет получить точные результаты в кратчайшие сроки
- Безопасность и безболезненность диагностики. КТГ не наносит вреда беременной женщине и ребенку. При этом она не занимает много времени и может выполняться так часто, как это необходимо
- Отсутствие очередей. Мы позаботились о том, чтобы любая пациентка могла пройти обследование в удобное для нее время и без какого-либо дискомфорта
- Возможности для быстрой записи к акушеру-гинекологу.
 При необходимости пациентка может сразу же после прохождения обследования посетить лечащего врача, чтобы получить от него необходимые рекомендации
При необходимости пациентка может сразу же после прохождения обследования посетить лечащего врача, чтобы получить от него необходимые рекомендации
Если вы планируете пройти кардиотокографию плода в МЕДСИ в Санкт-Петербурге, уточнить цену обследования или стоимость приема гинеколога, позвоните по номеру по номеру +7 (812) 336-33-33. Специалисты ответят на все вопросы и предложат удобное время для посещения врача.
Гипоксия плода – обзор
Асфиксия новорожденных
Хроническая внутриутробная асфиксия влияет на плацентарный кровоток, а инфаркт плаценты отрицательно влияет на рост плода. В случаях хронической внутриутробной асфиксии роды могут плохо переноситься и может потребоваться неонатальная реанимация. Когда требуется неонатальная реанимация, первичные или вторичные последствия асфиксии, включая ацидоз, судороги, транзиторную сердечную дисфункцию (например, кардиомиопатию или трикуспидальную недостаточность), легочную гипертензию, почечную недостаточность (например,например, острый канальцевый некроз), желудочно-кишечные/печеночные поражения (например, некротизирующий энтероколит [НЭК]) или нарушения свертывания крови .
Послеродовая асфиксия часто является результатом целого ряда внутриутробных событий, но также может быть вызвана событиями, происходящими во время родов. Незрелые механизмы контроля дыхания могут предрасполагать новорожденных, особенно недоношенных, к опасным для жизни реакциям на асфиксию. Например, реакция на гипоксию в течение первых 3—4 нед жизни может быть парадоксальной, поскольку гипоксия вызывает короткий период гиперпноэ, за которым следует брадипноэ (Cross, Oppe, 1952; Brady, Ceruti, 1966).Гипотермия и гиперкапноэ притупляют начальное гиперпноэ (Ceruti, 1966; Rigatto et al., 1975). Вентиляционная реакция на углекислый газ увеличивается как с постнатальным, так и с гестационным возрастом (см. главу 3 «Физиология дыхания у младенцев и детей») (Rigatto et al., 1975).
Хотя гипоксия может иметь долгосрочные последствия для плода и новорожденного, гипероксия также может вызывать серьезные осложнения, особенно у недоношенных детей. Например, гипероксия подвергает недоношенных детей, особенно тех, кто родился до 32 недель’. беременности, к значительному риску ретинопатии недоношенных (РН; см. ниже) и, в некоторых случаях, к слепоте (см. главу 27, Анестезия при офтальмологической хирургии) (Sylvester, 2008).Нормальное Pao 2 плода составляет от 20 до 30 мм рт.ст. После рождения Pao 2 при 60 мм рт. ст., вероятно, является гипероксическим для младенцев, рожденных в возрасте от 24 до 36 недель’. беременность. Чтобы избежать последствий оксидативного стресса у новорожденных, насыщение кислородом у недоношенных детей обычно поддерживается на уровне от 88% до 93% (Pao 2 от 45 до 60 мм рт. ст.) в отделении интенсивной терапии и аналогичные уровни Sao 2 уместно в операционной. Непрерывное измерение Sao 2 облегчает поддержание желаемого насыщения кислородом.Следует отметить одного недоношенного ребенка, у которого никогда не было повышенного PaO 2 , кроме как в операционной, но у которого развилась РН после операции (Betts et al., 1977).
беременности, к значительному риску ретинопатии недоношенных (РН; см. ниже) и, в некоторых случаях, к слепоте (см. главу 27, Анестезия при офтальмологической хирургии) (Sylvester, 2008).Нормальное Pao 2 плода составляет от 20 до 30 мм рт.ст. После рождения Pao 2 при 60 мм рт. ст., вероятно, является гипероксическим для младенцев, рожденных в возрасте от 24 до 36 недель’. беременность. Чтобы избежать последствий оксидативного стресса у новорожденных, насыщение кислородом у недоношенных детей обычно поддерживается на уровне от 88% до 93% (Pao 2 от 45 до 60 мм рт. ст.) в отделении интенсивной терапии и аналогичные уровни Sao 2 уместно в операционной. Непрерывное измерение Sao 2 облегчает поддержание желаемого насыщения кислородом.Следует отметить одного недоношенного ребенка, у которого никогда не было повышенного PaO 2 , кроме как в операционной, но у которого развилась РН после операции (Betts et al., 1977).
Недостаток кислорода у плода | Адвокат по родовым травмам в Де-Мойне
Когда плод не получает достаточного количества кислорода в матке во время роста, это состояние называется внутриутробной гипоксией. Непосредственно перед или во время родов и родоразрешения кислородное голодание плода называется гипоксией плода или интранатальной гипоксией.Все три термина относятся к состоянию, при котором ткани ребенка получают недостаточное количество кислорода, что может привести к тяжелым осложнениям, включая гипоксические повреждения головного мозга. Неонатальная асфиксия используется для описания ребенка сразу после рождения, который не начинает дышать или чье дыхание не обеспечивает достаточное количество кислорода в организме. Если головной мозг лишен значительного количества кислорода в любой период беременности или после рождения, возможны стойкие повреждения головного мозга (внутрижелудочковое кровоизлияние, перивентрикулярная лейкомаляция и др.).) и/или могут возникнуть другие осложнения.
Непосредственно перед или во время родов и родоразрешения кислородное голодание плода называется гипоксией плода или интранатальной гипоксией.Все три термина относятся к состоянию, при котором ткани ребенка получают недостаточное количество кислорода, что может привести к тяжелым осложнениям, включая гипоксические повреждения головного мозга. Неонатальная асфиксия используется для описания ребенка сразу после рождения, который не начинает дышать или чье дыхание не обеспечивает достаточное количество кислорода в организме. Если головной мозг лишен значительного количества кислорода в любой период беременности или после рождения, возможны стойкие повреждения головного мозга (внутрижелудочковое кровоизлияние, перивентрикулярная лейкомаляция и др.).) и/или могут возникнуть другие осложнения.
Симптомы
До рождения можно заподозрить гипоксию плода, если есть признаки дистресса плода. Во время родов у будущей матери будут прикреплены внешние и, возможно, внутренние мониторы к ней и/или ее ребенку, чтобы контролировать ее схватки (силу и частоту), а также частоту сердечных сокращений ее ребенка. Информация с этих мониторов передается на полоску монитора плода, которую может использовать акушер, медсестра-акушерка или акушерская сестра, чтобы увидеть, как ребенок реагирует на каждую схватку и на роды в целом.Низкая частота сердечных сокращений плода (брадикардия) или необычные замедления частоты сердечных сокращений ребенка (поздние замедления) могут быть признаком дистресса плода. Кроме того, необычная картина вариабельности частоты сердечных сокращений плода может указывать на травму головного мозга или надвигающуюся травму головного мозга или центральной нервной системы ребенка. Если есть признаки дистресса плода и роды достаточно продвинулись, врач или медсестра-акушерка могут взять образец рН с головы ребенка, чтобы увидеть, происходит ли кислородное голодание.
Информация с этих мониторов передается на полоску монитора плода, которую может использовать акушер, медсестра-акушерка или акушерская сестра, чтобы увидеть, как ребенок реагирует на каждую схватку и на роды в целом.Низкая частота сердечных сокращений плода (брадикардия) или необычные замедления частоты сердечных сокращений ребенка (поздние замедления) могут быть признаком дистресса плода. Кроме того, необычная картина вариабельности частоты сердечных сокращений плода может указывать на травму головного мозга или надвигающуюся травму головного мозга или центральной нервной системы ребенка. Если есть признаки дистресса плода и роды достаточно продвинулись, врач или медсестра-акушерка могут взять образец рН с головы ребенка, чтобы увидеть, происходит ли кислородное голодание.
У ребенка, лишенного кислорода до рождения, может быть затрудненное дыхание после рождения, повышенное содержание кислоты в биологических жидкостях, повреждение или расстройство головного мозга или повреждение органов. Если кислородное голодание имело место на протяжении всего процесса родоразрешения, ребенок может быть синюшным при рождении, у него может отсутствовать дыхание, плач, плохой мышечный тонус или низкая частота сердечных сокращений. Оценка по шкале Апгар у ребенка может быть низкой, а анализ газов артериальной крови может показать низкий рН (т.е.: <7,1) или повышенный избыток оснований. Образец крови из пуповины может быть взят для документирования рН и щелочного избытка ребенка во время рождения.Низкий рН может означать, что ребенок страдает от метаболического ацидоза (низкого содержания кислорода) в результате негативных последствий родов.
Если кислородное голодание имело место на протяжении всего процесса родоразрешения, ребенок может быть синюшным при рождении, у него может отсутствовать дыхание, плач, плохой мышечный тонус или низкая частота сердечных сокращений. Оценка по шкале Апгар у ребенка может быть низкой, а анализ газов артериальной крови может показать низкий рН (т.е.: <7,1) или повышенный избыток оснований. Образец крови из пуповины может быть взят для документирования рН и щелочного избытка ребенка во время рождения.Низкий рН может означать, что ребенок страдает от метаболического ацидоза (низкого содержания кислорода) в результате негативных последствий родов.
После рождения у ребенка (чаще у недоношенных) может развиться респираторный дистресс-синдром (РДС). Сразу после рождения ребенок может быть розовым, с хорошим криком, хорошим мышечным тонусом и нормальным сердечным ритмом. Однако в течение нескольких минут после рождения у ребенка может развиться РДС с признаками кряхтения, одышки или затрудненного дыхания. У недоношенных детей это может происходить из-за того, что легкие плода еще не созрели.В этом случае ребенку может потребоваться дополнительная подача кислорода через маску или может потребоваться интубация эндотрахеальной трубкой для механической вентиляции, чтобы помочь ребенку дышать. Восстановление доставки кислорода называется «реанимацией» ребенка. Если реанимация не проводится, у ребенка может развиться респираторный ацидоз, о чем свидетельствует высокий уровень СО2 в крови ребенка. Этот респираторный ацидоз увеличивает риск развития у ребенка кровоизлияния в мозг, также известного как внутрижелудочковое кровоизлияние (ВЖК).IVH может привести к сопутствующим проблемам, таким как церебральный паралич. Если реанимация не обеспечивает ребенка достаточным количеством кислорода, у ребенка также может развиться метаболический ацидоз, о чем свидетельствует низкий уровень pH в крови ребенка. Низкий уровень кислорода может вызвать аноксические или гипоксические повреждения головного мозга ребенка, приводящие к перивентрикулярной лейкомаляции (ПВЛ) и церебральному параличу (ДЦП).
У недоношенных детей это может происходить из-за того, что легкие плода еще не созрели.В этом случае ребенку может потребоваться дополнительная подача кислорода через маску или может потребоваться интубация эндотрахеальной трубкой для механической вентиляции, чтобы помочь ребенку дышать. Восстановление доставки кислорода называется «реанимацией» ребенка. Если реанимация не проводится, у ребенка может развиться респираторный ацидоз, о чем свидетельствует высокий уровень СО2 в крови ребенка. Этот респираторный ацидоз увеличивает риск развития у ребенка кровоизлияния в мозг, также известного как внутрижелудочковое кровоизлияние (ВЖК).IVH может привести к сопутствующим проблемам, таким как церебральный паралич. Если реанимация не обеспечивает ребенка достаточным количеством кислорода, у ребенка также может развиться метаболический ацидоз, о чем свидетельствует низкий уровень pH в крови ребенка. Низкий уровень кислорода может вызвать аноксические или гипоксические повреждения головного мозга ребенка, приводящие к перивентрикулярной лейкомаляции (ПВЛ) и церебральному параличу (ДЦП).
Независимо от того, возникают ли признаки кислородной недостаточности внутриутробно или после рождения, необходимо своевременное вмешательство и реанимационные процедуры, чтобы обеспечить адекватное снабжение ребенка кислородом и предотвратить гипоксию, повреждение головного мозга или смерть.
Некоторые факторы риска гипоксии плода во время гестационного периода включают
- Крупный для гестационного периода плод/дети с высокой массой тела при рождении (макросомные)
- Матка содержит слишком много амниотической жидкости
- Таз матери слишком мал для родов (головно-тазовая диспропорция)
- Выделение мекония
- Многоплодие (двойня, тройня и т. д.)
- Проблемы при беременности – отслойка плаценты, предлежание плаценты, разрыв матки, обильное кровотечение
- Осложнения резус-фактора матери и плода
Младенцы подвергаются большему риску асфиксии во время родов и родоразрешения, когда мать находится под воздействием любых лекарств, особенно анестетиков или седативных средств, поскольку до момента рождения мать делится с плодом любыми веществами, которые находятся в ее крови ручей. Например, наркотические обезболивающие, вводимые женщине во время родов, могут оказывать респираторное воздействие на ребенка при рождении. Таким образом, поставщики медицинских услуг должны знать, что такие лекарства могут вызвать угнетение дыхания у ребенка и недостаточное потребление кислорода, если их не откорректировать.
Например, наркотические обезболивающие, вводимые женщине во время родов, могут оказывать респираторное воздействие на ребенка при рождении. Таким образом, поставщики медицинских услуг должны знать, что такие лекарства могут вызвать угнетение дыхания у ребенка и недостаточное потребление кислорода, если их не откорректировать.
Младенцы, рожденные недоношенными, могут не иметь полностью развитой дыхательной системы, которая могла бы обеспечить их организм достаточным количеством кислорода. Таким образом, если преждевременные роды неизбежны, медицинские работники должны знать о необходимости введения стероидов (например, бетаметазона) для созревания легких плода.Кроме того, медицинскому персоналу необходимо знать о возможной потребности в сурфактанте у недоношенных детей.
Продолжительные или проблематичные роды и роды могут подвергнуть плод риску таких состояний, как выпадение или повреждение пуповины, которые лишают плод адекватного снабжения кислородом. Затяжные роды также могут израсходовать запасы кислорода у ребенка, в результате чего ребенок становится более восприимчивым к гипоксии на заключительном этапе родов.
Роды, в которых используются акушерские инструменты, такие как вакуум-экстрактор или щипцы, сопряжены с более высоким риском травмирования ребенка и могут привести к состояниям, ограничивающим поступление кислорода к мозгу и другим органам.Переношенные плоды более склонны к выделению мекония до рождения и подвержены риску аспирации липкого вещества, которое может блокировать дыхательные пути. У младенцев также может развиться пневмония после контакта с организмом Strep-B, который некоторые женщины несут в родовых путях. Любое другое состояние, при котором ребенок рождается с «тяжелой дыхательной недостаточностью», может привести к гипоксии, если дыхание не восстановится достаточно быстро.
Поскольку естественные роды и родоразрешение помогают плоду изгнать жидкость, которая находилась в легких во время беременности, у детей, родившихся с помощью кесарева сечения, могут возникнуть трудности с адаптацией к дыханию вне матки.
Осложнения
Дефицит кислорода может привести к гипоксии, когда ткани тела повреждаются из-за нехватки кислорода. Все органы тела подвержены повреждению из-за недостаточного снабжения кислородом, но когда мозг получает повреждение (гипоксическая ишемическая энцефалопатия, также известная как ГИЭ), могут возникнуть серьезные последствия. Ущерб от дефицита кислорода может привести к параличу, умственной отсталости, повреждению нервов, порокам сердца, нарушениям свертываемости крови, коме и даже смерти. Документально подтверждено, что 23% смертей новорожденных вызваны асфиксией или кислородным голоданием.
Все органы тела подвержены повреждению из-за недостаточного снабжения кислородом, но когда мозг получает повреждение (гипоксическая ишемическая энцефалопатия, также известная как ГИЭ), могут возникнуть серьезные последствия. Ущерб от дефицита кислорода может привести к параличу, умственной отсталости, повреждению нервов, порокам сердца, нарушениям свертываемости крови, коме и даже смерти. Документально подтверждено, что 23% смертей новорожденных вызваны асфиксией или кислородным голоданием.
Профилактика
Многие причины внутриутробного дефицита кислорода практически невозможно обнаружить, а доступные методы лечения некоторых обнаруживаемых причин не доказали свою эффективность. Во время беременности, если есть какие-либо аномалии органов, которые обнаруживаются на УЗИ или сонограмме, могут быть проведены дополнительные тесты для изучения частоты сердечных сокращений плода и общего состояния здоровья ребенка. Женщинам с семейным анамнезом врожденных дефектов, страдающим диабетом или подвергшимся воздействию токсинов (включая лекарства и лекарства), может быть рекомендовано пройти обследование на вероятность наличия у плода определенных хромосомных или генетических дефектов. Болезни матери и болезни во время беременности, которые лечатся соответствующим образом, могут снизить опасность неблагоприятного воздействия на растущий плод. Адекватный дородовой уход играет важную роль в снижении риска осложнений для здоровья как матери, так и ребенка.
Болезни матери и болезни во время беременности, которые лечатся соответствующим образом, могут снизить опасность неблагоприятного воздействия на растущий плод. Адекватный дородовой уход играет важную роль в снижении риска осложнений для здоровья как матери, так и ребенка.
Лечение
До 20% детей, рожденных с тяжелой церебральной гипоксией, не выживают, а 20-25% становятся инвалидами. Для младенцев, рожденных с тяжелой гипоксически-ишемической энцефалопатией (ГИЭ), новые методы лечения, включающие охлаждающую терапию или гипотермию головы или тела, оказались успешными в уменьшении стойкого неврологического повреждения и предотвращении смерти от недостатка кислорода в мозге у ряда пациентов.Диагностика и лечение основных причин кислородного голодания играют важную роль в предотвращении дальнейшего повреждения. После рождения тщательное медицинское обследование и тщательное наблюдение в первые несколько дней жизни могут выявить любые проблемы, требующие немедленного лечения, чтобы предотвратить серьезные осложнения. Правильное информирование родителей о предупредительных признаках гипоксии, таких как цианоз, и точное описание симптомов, а также подробный семейный анамнез и записи дородового ухода могут привести к правильной диагностике причины гипоксии у младенца.
Правильное информирование родителей о предупредительных признаках гипоксии, таких как цианоз, и точное описание симптомов, а также подробный семейный анамнез и записи дородового ухода могут привести к правильной диагностике причины гипоксии у младенца.
Если у вашего ребенка диагностирован церебральный паралич, гипоксически-ишемическая энцефалопатия, перивентрикулярная лейкомаляция или внутрижелудочковое кровоизлияние, вы должны собрать свои медицинские записи, а также медицинские записи вашего ребенка и предоставить их для рассмотрения адвокату, имеющему опыт ведения дел о врачебной халатности, связанных с гипоксические травмы или кислородное голодание.
Пренатальная гипоксия повышает предрасположенность к повреждению почек
Abstract
Пренатальная гипоксия является гестационным стрессором, который может привести к аномалиям развития или физиологическому перепрограммированию и часто снижает клеточную способность противостоять вторичному стрессу. Когда развивающийся плод подвергается гипоксии, кровоток предпочтительно перенаправляется на жизненно важные органы, включая мозг и сердце, а не на другие органы, включая почки. Повреждение, вызванное гипоксией, может привести к структурным порокам развития почек; однако даже при отсутствии структурных повреждений гипоксия может физиологически перепрограммировать почки, что приводит к снижению функции или повышению восприимчивости к травмам. Наше исследование на мышах показывает, что, хотя пренатальная гипоксия не влияет на нормальное развитие почек, она делает почки более восприимчивыми к повреждению почек в более позднем возрасте.Мы обнаружили, что у нашей модели не развиваются структурные аномалии при пренатальном воздействии умеренного 12% O 2 , о чем свидетельствуют нормальные гистологические характеристики и анализ экспрессии генов. Кроме того, структура и функция почек у взрослых сравнимы с мышами, подвергающимися воздействию кислорода окружающей среды на протяжении всего нефрогенеза.
Когда развивающийся плод подвергается гипоксии, кровоток предпочтительно перенаправляется на жизненно важные органы, включая мозг и сердце, а не на другие органы, включая почки. Повреждение, вызванное гипоксией, может привести к структурным порокам развития почек; однако даже при отсутствии структурных повреждений гипоксия может физиологически перепрограммировать почки, что приводит к снижению функции или повышению восприимчивости к травмам. Наше исследование на мышах показывает, что, хотя пренатальная гипоксия не влияет на нормальное развитие почек, она делает почки более восприимчивыми к повреждению почек в более позднем возрасте.Мы обнаружили, что у нашей модели не развиваются структурные аномалии при пренатальном воздействии умеренного 12% O 2 , о чем свидетельствуют нормальные гистологические характеристики и анализ экспрессии генов. Кроме того, структура и функция почек у взрослых сравнимы с мышами, подвергающимися воздействию кислорода окружающей среды на протяжении всего нефрогенеза. Однако после индукции повреждения почек нефротоксином (цисплатином) у потомства мышей, содержащихся в условиях гипоксии, наблюдается значительное снижение почечной функции и повреждение проксимальных канальцев после повреждения.Мы пришли к выводу, что пренатальная гипоксия внутриутробно физиологически перепрограммирует почки, что приводит к повышенной восприимчивости к травмам в более позднем возрасте.
Однако после индукции повреждения почек нефротоксином (цисплатином) у потомства мышей, содержащихся в условиях гипоксии, наблюдается значительное снижение почечной функции и повреждение проксимальных канальцев после повреждения.Мы пришли к выводу, что пренатальная гипоксия внутриутробно физиологически перепрограммирует почки, что приводит к повышенной восприимчивости к травмам в более позднем возрасте.
Образец цитирования: Cargill KR, Chiba T, Murali A, Mukherjee E, Crinzi E, Sims-Lucas S (2020) Пренатальная гипоксия повышает восприимчивость к повреждению почек. ПЛОС ОДИН 15(2): e0229618. https://doi.org/10.1371/journal.pone.0229618
Редактор: Partha Mukhopadhyay, Национальный институт здравоохранения, США
Получено: 9 октября 2019 г.; Принято: 10 февраля 2020 г .; Опубликовано: 21 февраля 2020 г.
Авторское право: © 2020 Cargill et al.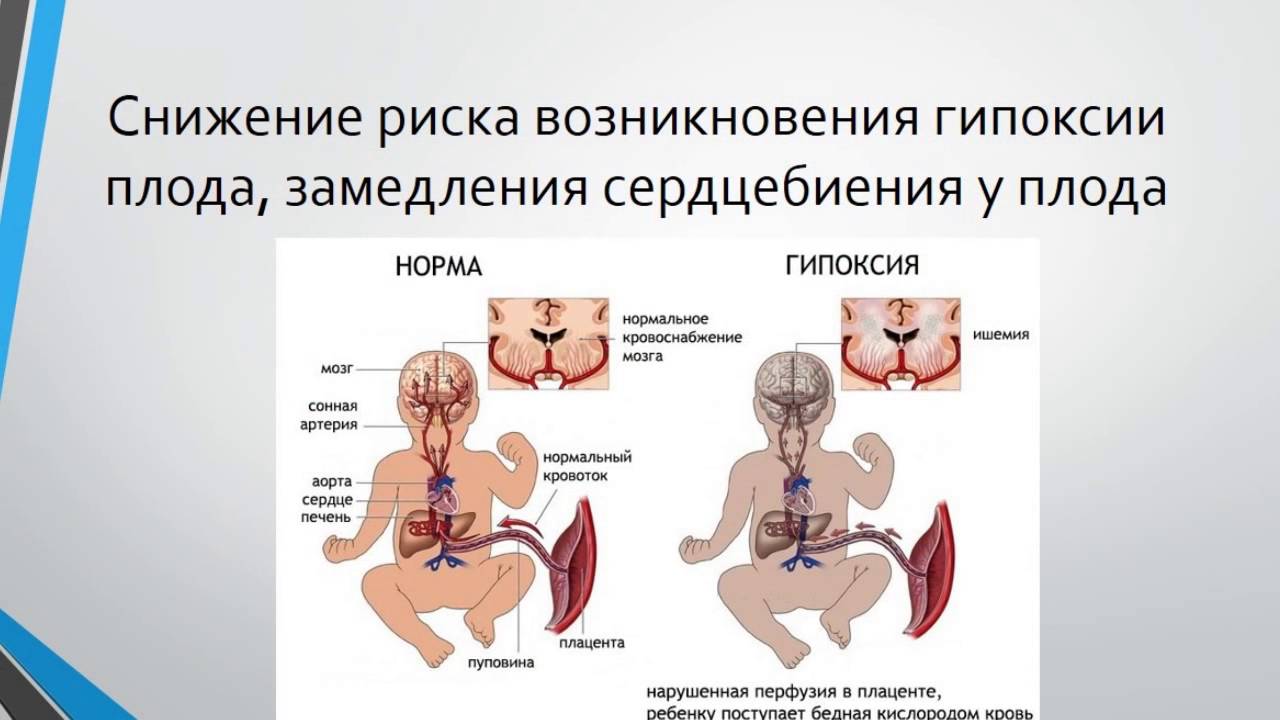 Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные содержатся в рукописи и файлах вспомогательной информации.
Финансирование: Dr. Cargill (KRC) получил поддержку Национального института здравоохранения NIDDK (DK116370) и Исследовательского консультативного комитета Детской больницы UPMC в Питтсбурге.Доктор Чиба (TC) был поддержан Американской кардиологической ассоциацией (17POST33670685) и Институтом педиатрических исследований Ричарда Кинга Меллона. Доктор Симс-Лукас (SSL) получил поддержку Национального института здравоохранения NIDDK K01 (DK096996) и R03 (DK110503). Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.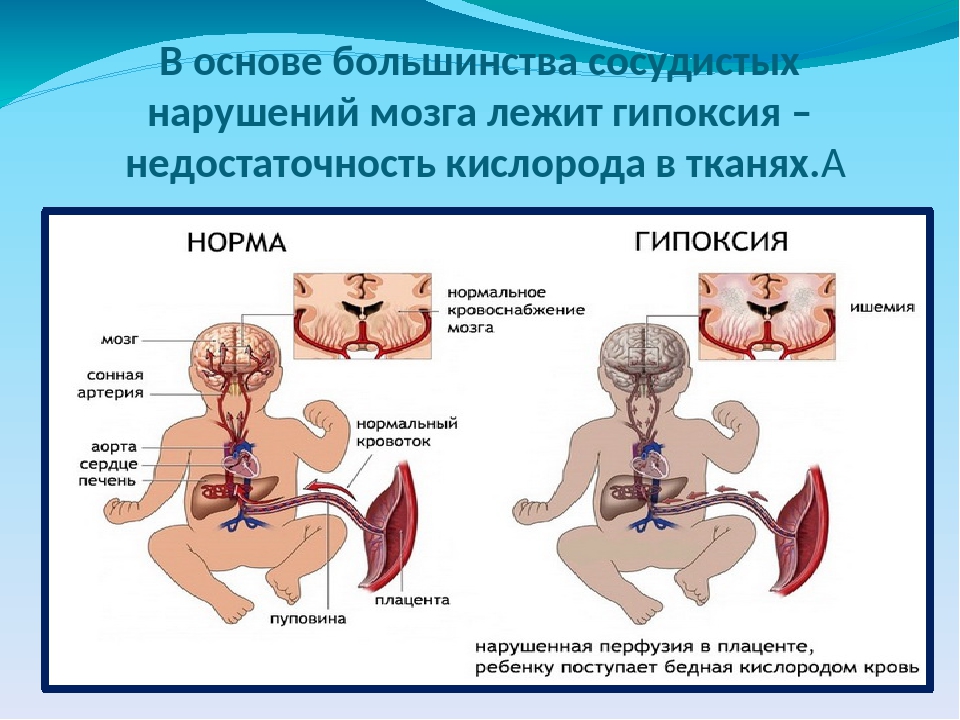
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Внутриутробная гипоксия, ведущая к пренатальной гипоксии плода, является распространенным гестационным стрессором, который может привести к ряду аномалий развития [1–4].Когда возникает пренатальная гипоксия, развивающийся плод демонстрирует предпочтительное перенаправление кровотока, включая поступление кислорода и питательных веществ, к мозгу и сердцу по сравнению с менее важными органами, такими как почки [5, 6]. Предыдущие исследования на моделях пренатальной гипоксии на мышах и крысах часто использовали устройство для гипоксии с камерами, где беременные самки содержались при 12% O 2 [7, 8]. Эти исследования показывают, что воздействие умеренной гипоксии в утробе матери может ухудшить пре- и постнатальное развитие [9] и вызвать эпигенетические модификации [10].Хотя как структурные, так и неструктурные аномалии могут возникать в результате пренатального воздействия гипоксии, долгосрочный эффект этого стрессора на почки до сих пор в значительной степени неизвестен.
Почки являются фильтрующими единицами организма, а нефрон является функциональной единицей почек, ответственной за фильтрацию крови, удаление токсических отходов и регуляцию ряда важных физиологических функций [11–13]. Развитие почек у мышей происходит с эмбрионального дня 10,5 (E10.5) до постнатального дня 3 (P3), что приблизительно соответствует гестационным неделям с 5 по 35 у людей [14].В это время популяция самообновляющихся клеток, называемых предшественниками нефрона, быстро пролиферирует, затем подвергается дифференцировке, давая начало гломерулярному эпителию и эпителию почечных канальцев зрелого нефрона [15]. Этот процесс развития нефрона происходит при физиологической гипоксии (~1-9% O 2 ) [7], и хотя временные изменения напряжения кислорода являются нормальными, хроническая гипоксия может быть вредной [16].
Пренатальная гипоксия является многофакторным состоянием и может быть вызвана различными факторами, включая плацентарную недостаточность, преэклампсию, недоедание и даже проживание на большой высоте во время беременности [8, 17]. Пренатальная гипоксия приводит к снижению поступления крови и питательных веществ к плоду, что приводит к снижению доступности кислорода в почках [5, 6]. Как следствие, любое осложнение, приводящее к внутриутробной гипоксии плода, может вызвать изменения в росте плода или функциональности органов, тем самым увеличивая риск заболеваний в более позднем возрасте [17]. Было показано, что хроническая пренатальная гипоксия матери с содержанием кислорода менее 10% приводит к физическим и структурным аномалиям [1, 6, 18, 19]. В одном исследовании беременные самки с фоном CD1 содержали 12% O 2 из E14.5 до P1 обнаружили, что потомство женского пола не пострадало, однако потомство мужского пола показало снижение массы тела, снижение массы почек и изменения в развитии канальцев и кортикомедуллярном соотношении [3]. Насколько нам известно, в нескольких исследованиях использовались условия 12% O 2 , и настоящее исследование является первым, в котором охарактеризован фенотип вторичного повреждения.
Пренатальная гипоксия приводит к снижению поступления крови и питательных веществ к плоду, что приводит к снижению доступности кислорода в почках [5, 6]. Как следствие, любое осложнение, приводящее к внутриутробной гипоксии плода, может вызвать изменения в росте плода или функциональности органов, тем самым увеличивая риск заболеваний в более позднем возрасте [17]. Было показано, что хроническая пренатальная гипоксия матери с содержанием кислорода менее 10% приводит к физическим и структурным аномалиям [1, 6, 18, 19]. В одном исследовании беременные самки с фоном CD1 содержали 12% O 2 из E14.5 до P1 обнаружили, что потомство женского пола не пострадало, однако потомство мужского пола показало снижение массы тела, снижение массы почек и изменения в развитии канальцев и кортикомедуллярном соотношении [3]. Насколько нам известно, в нескольких исследованиях использовались условия 12% O 2 , и настоящее исследование является первым, в котором охарактеризован фенотип вторичного повреждения. Скромная концентрация O 2 в 12% соответствует жизни на большой высоте (> 2500 метров над уровнем моря), где в настоящее время проживает более 140 миллионов человек.Хотя концентрация кислорода на высоте 2500 метров над уровнем моря составляет примерно 15%, люди могут жить на высоте примерно до 4500 метров над уровнем моря, что обеспечивает их примерно 12% O 2 . Влияние гестационного низкого содержания кислорода на развитие почек и долгосрочную функцию почек в настоящее время неизвестно. Хотя ранее было показано, что структурные аномалии возникают из-за воздействия 8-10% кислорода, мы предполагаем, что даже при отсутствии структурных пороков развития почки более восприимчивы к заболеваниям в более позднем возрасте в результате физиологического перепрограммирования, явления, которое снижает клеточная функциональность почек становится более восприимчивой к травмам в более позднем возрасте.
Скромная концентрация O 2 в 12% соответствует жизни на большой высоте (> 2500 метров над уровнем моря), где в настоящее время проживает более 140 миллионов человек.Хотя концентрация кислорода на высоте 2500 метров над уровнем моря составляет примерно 15%, люди могут жить на высоте примерно до 4500 метров над уровнем моря, что обеспечивает их примерно 12% O 2 . Влияние гестационного низкого содержания кислорода на развитие почек и долгосрочную функцию почек в настоящее время неизвестно. Хотя ранее было показано, что структурные аномалии возникают из-за воздействия 8-10% кислорода, мы предполагаем, что даже при отсутствии структурных пороков развития почки более восприимчивы к заболеваниям в более позднем возрасте в результате физиологического перепрограммирования, явления, которое снижает клеточная функциональность почек становится более восприимчивой к травмам в более позднем возрасте.
Одной из таких травм, поражающих как детей, так и взрослых пациентов, является острая почечная недостаточность (ОПН).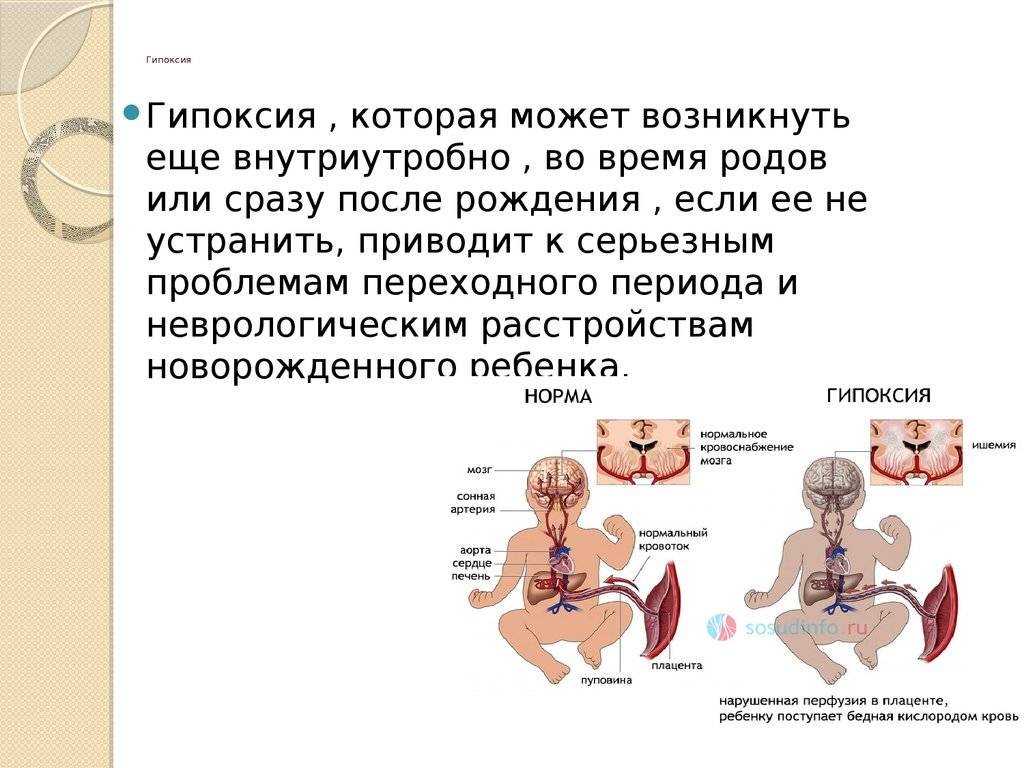 ОПП представляет собой внезапную потерю функции почек, характеризующуюся значительным снижением клубочковой фильтрации, а также повышением уровня креатинина в сыворотке крови и азота мочевины в крови (АМК), что приводит к высокой заболеваемости и смертности [20, 21]. Это также является фактором риска прогрессирования хронической болезни почек (ХБП) и, в конечном итоге, терминальной стадии почечной недостаточности (ТХПН) [22]. Известно, что ОПП является многофакторным и вызывается различными повреждениями, включая ишемию, нефротоксины и сепсис [23].Цисплатин является широко используемым цитотоксическим химиотерапевтическим агентом и известным нефротоксином, вызывающим острое и хроническое повреждение почек [24, 25]. Основным осложнением лечения цисплатином является ОПП, которое возникает у 30% пациентов [24]. Цисплатин нацелен как на ядерную, так и на митохондриальную ДНК и по этой причине в первую очередь влияет на метаболически активные проксимальные канальцы [25, 26]. Хотя множественные состояния, такие как старение и ХБП, также предрасполагают к ОПП [27, 28], мало что известно о влиянии пренатальной гипоксии на предрасположенность к ОПП.
ОПП представляет собой внезапную потерю функции почек, характеризующуюся значительным снижением клубочковой фильтрации, а также повышением уровня креатинина в сыворотке крови и азота мочевины в крови (АМК), что приводит к высокой заболеваемости и смертности [20, 21]. Это также является фактором риска прогрессирования хронической болезни почек (ХБП) и, в конечном итоге, терминальной стадии почечной недостаточности (ТХПН) [22]. Известно, что ОПП является многофакторным и вызывается различными повреждениями, включая ишемию, нефротоксины и сепсис [23].Цисплатин является широко используемым цитотоксическим химиотерапевтическим агентом и известным нефротоксином, вызывающим острое и хроническое повреждение почек [24, 25]. Основным осложнением лечения цисплатином является ОПП, которое возникает у 30% пациентов [24]. Цисплатин нацелен как на ядерную, так и на митохондриальную ДНК и по этой причине в первую очередь влияет на метаболически активные проксимальные канальцы [25, 26]. Хотя множественные состояния, такие как старение и ХБП, также предрасполагают к ОПП [27, 28], мало что известно о влиянии пренатальной гипоксии на предрасположенность к ОПП.
Здесь мы создали мышиную модель пренатальной гипоксии и выявили субпатологическую роль гипоксии как медиатора предрасположенности к повреждению почек. Наше исследование показывает, что у мышей, подвергшихся пренатальной гипоксии во время нефрогенеза, во взрослом возрасте наблюдается обострение индуцированного цисплатином ОПП. Хотя мы не наблюдали каких-либо пороков развития или аномалий в развивающихся или даже постнатальных почках, вторичный инсульт приводил к снижению почечной функции и более тяжелому повреждению. Наше исследование подчеркивает важность строгой регуляции оксигенации в развивающейся почке и предполагает, что пренатальная гипоксия может физиологически перепрограммировать нефроны, делая их более восприимчивыми к повреждениям.
Методы
Пренатальная гипоксия у мышей
Шесть спаренных во времени самок дикого типа C57BL/6 (гестационный возраст E10.5; Charles River) помещали в камеру гипоксии. Камера была оборудована шлюзовой системой продувки, контрольными индикаторами СО 2 и О 2 , а также системами контроля влажности и газа, предназначенными для экспериментов на живых животных. Воздействие 12% гипоксии начинали на 10,5-й день эмбрионального развития (Е10.5), что совпадает с индукцией нефрогенеза.Воздействие гипоксии прекращалось на 3-и сутки постнатального периода (П3), что совпадает с завершением нефрогенеза. Шесть контрольных мышей содержали в условиях окружающей среды при 21% O 2 (контроль с нормоксией). Для оценки состояния почек эмбриона две беременные самки были умерщвлены в условиях нормоксии и гипоксии на E16.5 (детеныши с нормоксией N = 4; детеныши с гипоксией N = 4) и две на E18.5 (детеныши с нормоксией N = 3; детеныши с гипоксией N = 7). ) при вдыхании CO 2 с последующим смещением шейного отдела позвоночника. Для постнатальной оценки состояния почек щенков от двух разных самок в зависимости от состояния переводили в окружающую среду O 2 на P3 и умерщвляли в возрасте 7 недель с помощью ингаляции CO 2 с последующим смещением шейки матки (щенки с нормоксией N = 6; щенки с гипоксией). N = 8).Ткань почки немедленно собирали и сохраняли для анализа.
Воздействие 12% гипоксии начинали на 10,5-й день эмбрионального развития (Е10.5), что совпадает с индукцией нефрогенеза.Воздействие гипоксии прекращалось на 3-и сутки постнатального периода (П3), что совпадает с завершением нефрогенеза. Шесть контрольных мышей содержали в условиях окружающей среды при 21% O 2 (контроль с нормоксией). Для оценки состояния почек эмбриона две беременные самки были умерщвлены в условиях нормоксии и гипоксии на E16.5 (детеныши с нормоксией N = 4; детеныши с гипоксией N = 4) и две на E18.5 (детеныши с нормоксией N = 3; детеныши с гипоксией N = 7). ) при вдыхании CO 2 с последующим смещением шейного отдела позвоночника. Для постнатальной оценки состояния почек щенков от двух разных самок в зависимости от состояния переводили в окружающую среду O 2 на P3 и умерщвляли в возрасте 7 недель с помощью ингаляции CO 2 с последующим смещением шейки матки (щенки с нормоксией N = 6; щенки с гипоксией). N = 8).Ткань почки немедленно собирали и сохраняли для анализа. Комитет по институциональному уходу и использованию животных Университета Питтсбурга одобрил все эксперименты (разрешение № 16088935).
Комитет по институциональному уходу и использованию животных Университета Питтсбурга одобрил все эксперименты (разрешение № 16088935).
Цисплатин-индуцированное ОПП у мышей
Для модели вторичного стрессора использовали другую когорту из шести самок мышей C57BL/6 дикого типа, спаривавшихся во времени, в возрасте гестации E10.5 после тех же условий нормоксии и гипоксии, как указано выше, от E10.5 до P3. Мышей, подвергшихся внутриутробной гипоксии или нормоксии, содержали в обычных условиях вивария с 21% O 2 до 7-недельного возраста.В возрасте 7 недель самцов мышей лечили цисплатином (APP NDC 63323-103-64, 20 мг/кг массы тела, внутрибрюшинно) в обычном солевом растворе или с нормальным солевым раствором в качестве контроля — эффективность этой дозы и время повреждения цисплатином были подтверждено ранее [29]. Мышей умерщвляли на пике повреждения через 72 часа после лечения цисплатином путем смещения шейных позвонков после анестезии изофлураном. Кровь и ткань почек немедленно собирали и сохраняли для анализа. (мыши с нормоксией N = 6; мыши с гипоксией N = 4).
(мыши с нормоксией N = 6; мыши с гипоксией N = 4).
Сбор тканей и гистологическая оценка
Ткань была собрана на E16.5 и 7 недель и немедленно мгновенно замораживают в жидком азоте или фиксируют в 4% параформальдегиде (PFA). Фиксированную ткань обрабатывали и заливали в парафин. Вложенную ткань делали срезы толщиной 4 мкм и окрашивали гематоксилином и эозином (H&E) для гистологического исследования. Патология почечных канальцев оценивалась полуколичественно (от 0: отсутствие повреждений до 5: тяжелое повреждение) с точки зрения дилатации канальцев и образования белковых цилиндров. Гистологическую оценку проводили слепым методом при 40-кратном увеличении кортикомедуллярных областей срезов ткани N = 4 животных.Восемь срезов оценивали на наличие повреждений на образец. Образцы визуализировали с использованием микроскопа Leica DM 2500 (Leica) и программного обеспечения LAS X (Leica). Количественную оценку клубочков проводили вслепую с использованием поля низкой мощности. Ручной подсчет проводили на кортикомедуллярных участках срезов ткани от N = 4 животных. Количественное определение корпускул и клубочков проводилось с использованием программного обеспечения ImageJ с использованием N = 4 животных и измерялось в трех экземплярах и усреднялось по клубочкам или корпускулам. Отношение клубочков к тельцам рассчитывали путем деления средней длины на клубочек на среднюю длину тельца на соответствующее тельце.
Ручной подсчет проводили на кортикомедуллярных участках срезов ткани от N = 4 животных. Количественное определение корпускул и клубочков проводилось с использованием программного обеспечения ImageJ с использованием N = 4 животных и измерялось в трех экземплярах и усреднялось по клубочкам или корпускулам. Отношение клубочков к тельцам рассчитывали путем деления средней длины на клубочек на среднюю длину тельца на соответствующее тельце.
Иммунофлуоресцентное окрашивание и количественный анализ
Иммунофлуоресцентное окрашивание проводили на образцах, залитых парафином, приготовленных, как описано выше. Образцы исследовали с использованием первичных антител или лектинов (1:100) против: молекулы адгезии нервных клеток (Ncam; Sigma-Aldrich), гомолога 2 гомеобокса sine oculis (Six2; Proteintech), фосфогистона h4 (pHh4; Cell Marque), эндомуцина. (Santa Cruz Biotechnology), опухоль Вильмса 1 (WT1; Santa Cruz Biotechnology), лотос тетрагонолобус (LTL; Vector Laboratories), переносчик органических анионов 1 (OAT1; Alpha Diagnostic International), агглютинин долихоса бифлоруса (DBA; Vector Laboratories), повреждение почек молекула 1 (Kim1; R&D Systems) и набор для мечения ник-концов терминальной дезоксинуклеотидилтрансферазой dUTP (TUNEL; EDM Millipore), все они совместно окрашивались DAPI (Thermo Fisher Scientific).Образцы визуализировали с использованием микроскопа Leica (Leica Microsystems) и программного обеспечения LAS X (Leica Microsystems). Количественную оценку расширения проксимальных канальцев проводили с помощью программного обеспечения ImageJ. Количественную оценку проводили в трех повторностях, исходя из среднего значения пяти проксимальных канальцев на животное (N = 3 животных). Количественную оценку интенсивности Kim 1 проводили с использованием программного обеспечения ImageJ.
Количественная полимеразная цепная реакция в режиме реального времени (RT-qPCR)
РНКэкстрагировали из быстрозамороженной ткани почки с использованием набора RNeasy Mini Kit (Qiagen).Набор кДНК Superscript First Strand (Invitrogen, CA) использовали для синтеза кДНК. кДНК из этих образцов анализировали с использованием термоциклера C1000 (Bio-Rad, Hercules, CA) для определения уровней мРНК в ткани. С помощью этого метода были проанализированы следующие гены: Cited1 , Wnt4 , Lhx1 и Pax2 . Экспрессию гена нормализовали до Rn18s . Последовательности праймеров перечислены в таблице S1.
Анализ сыворотки
В возрасте 7 недель или после инъекции цисплатина животных подвергали пункции сердца перед умерщвлением для сбора крови.Затем кровь центрифугировали и собирали сыворотку. Сыворотку анализировали на содержание азота мочевины и креатинина в Ветеринарной диагностической лаборатории штата Канзас.
Статистический анализ
Для каждого описанного эксперимента использовалось три или более биологических повторов. При сравнении двух выборочных групп статистическую значимость определяли с помощью двустороннего критерия Стьюдента t (α = 0,05). Данные представлены в виде стандартной ошибки среднего (SEM). Гистологические и иммунофлуоресцентные изображения были созданы с использованием Photoshop и количественно оценены с помощью ImageJ.Графики строились с помощью GraphPad Prism.
Результаты
Пренатальная гипоксия не влияет на развитие почек эмбриона
Чтобы исследовать влияние гипоксии на развитие почек, самок мышей линии C57B/6, спаренных по времени, помещали в гипоксические камеры с 12% кислородом, начиная с 10,5 дня эмбрионального развития (E10.5; начало нефрогенеза), и содержали в условиях гипоксии до завершения нефрогенез на 3-й постнатальный день (P3) (рис. 1А). Беременные контрольные самки содержались в кислороде окружающей среды (нормоксия) на время их беременности.Размеры помета у самок, содержащихся в условиях нормоксии и гипоксии, были одинаковыми (P = 0,67). Почки, подвергшиеся воздействию гипоксии E16.5 (средняя точка нефрогенеза), по-видимому, претерпевают нормальные процессы развития, и гистологическое исследование не выявило каких-либо значительных отклонений (рис. 1B–1E). Когорта детенышей, подвергшихся пренатальной гипоксии, была переведена в нормоксию на P3, и в возрасте 7 недель у этих мышей также не было обнаружено каких-либо значительных изменений в почечной гистологии (рис. 1F-1I). Для дальнейшего изучения наличия каких-либо дефектов развития мы провели иммунофлуоресцентное окрашивание E16.5 почек для оценки развития почек с использованием маркеров самообновления предшественников нефрона (гомолог 2 гомеобокса Sine oculis; Six2) и развивающихся структур (молекула адгезии нервных клеток; Ncam). Ни Six2, ни иммуноокрашивание Ncam не выявили структурных пороков развития или изменений числа нефронов. Пролиферацию предшественников нефрона оценивали с помощью иммунного окрашивания против фосфогистона h4 (pHh4), которое, по-видимому, происходило с сопоставимой скоростью как в почках, подвергшихся нормоксии, так и в почках, подвергшихся гипоксии.Анализ апоптоза с помощью иммунного окрашивания TUNEL показал, что гибель клеток была ограничена почечной стромой [30] и оказалась сопоставимой между почками, подвергшимися нормоксии и гипоксии (рис. 2A–2F). Кроме того, уровни мРНК предшественников нефрона ( Cited1 и Pax2 ) и дифференцировка нефрона ( Wnt4 и Lhx1 ) не изменились между двумя когортами (рис. 2G). Аналогичным образом мы выполнили иммунное окрашивание, чтобы наблюдать за развитием проксимальных канальцев и разветвлением мочеточников, ни одно из которых не выявило каких-либо аномалий (рис. 2H-2O).В совокупности это свидетельствует о том, что пренатальное воздействие 12% кислорода у фонового штамма C57B/6 не приводит к структурным изменениям в развитии почек к середине нефрогенеза.
Рис. 1. Пренатальная гипоксия не изменяет гистологическую структуру почек.
( A ) Схематическое изображение пренатального воздействия гипоксии на мышах во время развития почек. ( BE ) Окрашивание H&E из пренатальной нормоксии и гипоксии E16.5, подвергшихся воздействию почек. ( F-I ) Окрашивание H&E у 7-недельных мышей, подвергшихся внутриутробной нормоксии и гипоксии.
https://doi.org/10.1371/journal.pone.0229618.g001
Рис. 2. Пренатальная гипоксия не влияет на нормальное развитие почек на E16.5.
( AB ) Иммунофлуоресцентное окрашивание с антителами против Six2 (красный) и Ncam (зеленый), чтобы показать предшественники нефронов и формирующиеся нефроны из пренатальной нормоксии (вверху) по сравнению с гипоксией (внизу) почек на E16.5. ( C-D ) Иммунофлуоресцентное окрашивание антителами против pHh4 (красный) и Ncam (зеленый) в E16.5 почек, подвергшихся пренатальной нормоксии (вверху) по сравнению с гипоксией (внизу) для определения количества митотических клеток. ( E-F ) TUNEL (зеленый) окрашивание почек E16.5 в пренатальных нормоксических (вверху) и гипоксических клетках (внизу), демонстрирующее репрезентативные апоптотические клетки. ( G ) RT-qPCR анализ генов, связанных с предшественниками нефрона ( Cited1 , Pax2 ) и дифференциация ( Wnt4 и Lhx1 ) между пренатальной нормоксией- (черный) и гипоксией- (серый) .5 почек. N = 4. Столбики ошибок указаны как SEM. ( H-K ) Иммунофлуоресцентное окрашивание с помощью LTL для мониторинга развития проксимальных канальцев на E16.5 между пренатально подвергшимися воздействию нормоксии (вверху) и гипоксии (внизу) почек. ( L-O ) Иммунофлуоресцентное окрашивание против DBA для мониторинга ветвления и дифференцировки зачатка мочеточника на E16.5 в почках, подвергшихся воздействию нормоксии (вверху) и гипоксии (внизу).
https://doi.org/10.1371/journal.pone.0229618.g002
Затем мы оценили прогрессирование развития почек на E18.5 — поздняя стадия развития почки. Точно так же мы проводили иммуноокрашивание предшественников нефрона (Six2, Ncam), дифференцированных структур (Ncam), пролиферации (pHh4) и апоптоза (TUNEL) и не наблюдали каких-либо аномалий на этой стадии развития (рис. 3A–3F). Экспрессия гена предшественника нефрона ( Cited1 , Pax2) и маркеры дифференцировки ( Wnt4 и Lhx1) также оставались неизменными между двумя группами (рис. 3G). Наконец, мы количественно определили длину почки и длину тела E18.5 животных и не выявили каких-либо различий в размерах почек или органов потомства, подвергшихся гипоксии (фиг.3Н и 3И). Соотношение длины почек и тела также оставалось постоянным (рис. 3J). Таким образом, мы не выявили каких-либо структурных различий в развитии почек у мышей, подвергшихся внутриутробной гипоксии.
Рис. 3. Пренатальная гипоксия не влияет на нормальное развитие почек на E18.5.
(A-B) Иммунофлуоресцентное окрашивание антителами против Six2 (красный) и Ncam (зеленый) для маркировки предшественников нефронов и формирующихся нефронов в почках, подвергшихся пренатальной нормоксии (вверху) по сравнению с гипоксией (внизу) на E18.5. (C-D) Иммунофлуоресцентное окрашивание антителами против pHh4 (красный) и Ncam (зеленый) для контроля пролиферации в почках, подвергшихся воздействию нормоксии (вверху) и гипоксии (внизу), на E18.5. (E-F) TUNEL (зеленый) окрашивание, показывающее репрезентативный апоптоз в пренатально подвергнутых нормоксии (вверху) и гипоксических клетках (внизу) из почек E18.5. (G) RT-qPCR анализ генов, связанных с предшественниками нефрона ( Cited1 , Pax2 ) и дифференциация ( Wnt4 и Lhx1 ) между пренатальной нормоксией- (черный) и гипоксией-серый) .5 почек. N = 3. Столбики ошибок указаны как SEM. (H-J) Количественное определение длины почки, длины тела и отношения длины почки к длине тела у эмбрионов E18.5. Нормоксия N = 3; Гипоксия N = 6–7. Столбики погрешностей обозначены как SEM.
https://doi.org/10.1371/journal.pone.0229618.g003
Пренатальная гипоксия сама по себе не влияет на функцию почек у взрослых
Затем мы оценили структуру и функцию почек в возрасте 7 недель, этот возраст был выбран, поскольку нефрогенез завершен, но в почках дикого типа в это время не должно наблюдаться повреждений.Иммунофлюоресцентное окрашивание с использованием LTL и Oat1 (маркеры щеточных краев проксимальных канальцев и эпителиальных клеток проксимальных канальцев соответственно) не выявило развития структурных аномалий к 7-недельному возрасту (рис. 4А и 4В). Также не было значительных различий в структуре клубочков (рис. 4C и 4D) или васкуляризации (рис. 4E и 4F) у 7-недельных мышей, подвергшихся пренатальной гипоксии, по сравнению с контрольной группой, подвергшейся нормоксии. Показатели BUN также существенно не изменились у мышей, подвергшихся пренатальной гипоксии (рис. 4G).Все уровни креатинина были ниже обнаруживаемой концентрации 0,5 мг/дл. Таким образом, пренатальная гипоксия, по-видимому, не влияет на функцию почек к 7-недельному возрасту. Чтобы подтвердить, что нефрогенез происходит нормально, мы количественно определили количество клубочков, используя беспристрастный ручной подход к подсчету клубочковых структур. Обе когорты мышей имели одинаковое количество сформированных клубочков (фиг. 4H). Чтобы подтвердить, что развитие проксимальных канальцев и последующая функция казались нормальными, мы количественно оценили экспрессию гена внешней митохондриальной мембраны Tomm20 .Никаких различий в экспрессии Tomm20 не наблюдалось между двумя условиями (S1 Fig). Кроме того, мы количественно определили размер тельца и клубочка, как показано соотношением клубочков к тельцам, что снова не выявило каких-либо различий в развитии нефрона (рис. 4I). Наконец, вес животных не отличался между группами воздействия (рис. 4J). Таким образом, легкая пренатальная гипоксия сама по себе не приводит к изменениям почечной структуры или функции в почках взрослых мышей линии C57B/6.
Рис. 4. Пренатальная гипоксия не изменяет структуру или функцию 7-недельных почек.
( AB ) Иммунофлуоресцентное окрашивание антителами против Oat1 (красный) и LTL (зеленый), обозначающее проксимальные канальцы почек, подвергшихся пренатальной гипоксии (внизу), по сравнению с почками, подвергшимися нормоксии (вверху) через 7 недель. ( C-D ) Иммунофлуоресцентное окрашивание антителами против Wt1 (красный) и LTL (зеленый), показывающее, что подоциты представляют гломерулярную структуру через 7 недель в почках, подвергшихся нормоксии и гипоксии. ( E-F ) Иммунофлуоресцентное окрашивание антителами против эндомуцина (Эндо; зеленый), указывающее на уровень васкуляризации в почках животных, подвергшихся нормоксии или гипоксии.( G ) Количественное определение почечной функции путем измерения азота мочевины крови (АМК) у животных, подвергавшихся 7-недельной нормоксии и гипоксии; Нормоксия N = 6; Гипоксия N = 7; Столбики погрешностей обозначены как SEM. ( H ) Количественное определение клубочкового числа, указывающее количество нефронов в почках с нормоксией и гипоксией через 7 недель. N = 4. Столбики ошибок указаны как SEM. ( I ) Количественное определение размера клубочков и телец животных, подвергшихся пренатальной гипоксии, по сравнению с контролем, на что указывает отношение размера клубочков к размеру телец; Нормоксия N = 7; Гипоксия N = 4; Столбики погрешностей обозначены как SEM.( J ) Количественное определение массы тела животных, подвергшихся внутриутробной гипоксии, по сравнению с контрольной группой; Нормоксия N = 10; Гипоксия N = 7; Столбики погрешностей обозначены как SEM.
https://doi.org/10.1371/journal.pone.0229618.g004
Пренатальная гипоксия повышает восприимчивость к цисплатин-индуцированному ОПП
Затем мы стремились определить, приводит ли пренатальная гипоксия при отсутствии структурных аномалий к повышенной восприимчивости к повреждению почек. Другой группе мышей, подвергшихся пренатальной гипоксии, сделали однократную инъекцию нефротоксина цисплатина (20 мг/кг массы тела, внутрибрюшинно) и умерщвили через 3 дня после травмы (3 dpi) (рис. 5А).Пренатальная гипоксия почек проявляла усугубление индуцированного цисплатином повреждения. Травма включала повышенное образование белковых цилиндров и сильное расширение проксимальных канальцев (рис. 5B–5E) по сравнению с почками, подвергшимися нормоксии. Гистопатологическая оценка выявила значительно более высокий уровень тяжести травмы (P = 0,038; рис. 5F). Почки, подвергшиеся пренатальной гипоксии, также имели сниженную экспрессию Tomm20, о чем свидетельствует иммунофлуоресцентное окрашивание, указывающее на усиленное повреждение канальцев (рис. S1).Сопровождая повреждение канальцев, у этих мышей наблюдалось значительное повышение уровня азота мочевины в крови (АМК) и креатинина в сыворотке, что указывает на снижение функции почек (рис. 5G и 5H). Кроме того, в почках, подвергшихся пренатальной гипоксии, иммунофлуоресцентное окрашивание с помощью LTL и Oat1 выявило повышенную частоту отторжения и дилатации эпителия в проксимальных канальцах (рис. 6А и 6В). Дилатация проксимальных канальцев была количественно оценена и показала, что почки, подвергшиеся пренатальной гипоксии, обработанные цисплатином, имели значительно увеличенную дилатацию по сравнению как с нелеченными 7-недельной гипоксией, так и с почками, подвергнутыми нормоксии, обработанными цисплатином (рис. 6C).Почки, подвергшиеся гипоксии, обработанные цисплатином, также имели значительно повышенную экспрессию маркера повреждения почек 1 (Kim1) (рис. 6D–6H). С учетом тяжести травмы и возможности физиологического перепрограммирования мы оценили экспрессию генов-мишеней известного фактора, индуцируемого гипоксией (Hifs), включая NADPH-оксидазу 4 (Nox4) , BCL2-взаимодействующий белок 3 (Bnip3) , и глицеральдегид-3. -фосфатдегидрогеназа (Gapdh) . Мы обнаружили, что, хотя эти гены были относительно неизменны во время развития и через 7 недель, после повреждения цисплатином экспрессия генов, связанных с Hif, значительно увеличилась (рис. S2), что указывает на то, что воздействие гипоксии в утробе матери , вероятно, играет роль в повышении восприимчивости к вторичному оскорбление, такое как цисплатин в более позднем возрасте.
Рис. 5. Воздействие пренатальной гипоксии снижает функцию почек после индуцированного цисплатином ОПП.
( A ) Схематическое изображение мышиной модели пренатальной гипоксии в сочетании с индуцированным цисплатином ОПП у взрослых мышей, подвергшихся нормоксии или гипоксии во время развития. ( BE ) Окрашивание H&E почек, подвергшихся пренатальной гипоксии и обработанных цисплатином через 7 недель (нижние панели), изображающее образование белковых цилиндров (стрелки) и расширение проксимальных канальцев в почках, подвергшихся пренатальной нормоксии с почками, обработанными цисплатином (вверху). панели).( F ) Количественная оценка тяжести повреждения почек мышей, подвергшихся внутриутробной нормоксии или гипоксии; P<0,05, N = 4. ( G ) Количественная оценка почечной функции путем измерения азота мочевины в крови у мышей, подвергшихся внутриутробной нормоксии или гипоксии и получавших цисплатин через 7 недель; *Р<0,05; Нормоксия N = 7 Гипоксия N = 4. Столбики ошибок указаны как SEM. ( H ) Количественная оценка почечной функции путем измерения креатинина у мышей, подвергшихся внутриутробной нормоксии или гипоксии и получавших цисплатин через 7 недель; **Р<0.01; N = 4. Столбики ошибок указаны как SEM.
https://doi.org/10.1371/journal.pone.0229618.g005
Рис. 6. Пренатальное воздействие гипоксии увеличивает повреждение проксимальных канальцев после индуцированного цисплатином ОПП.
( AB ) Иммунофлуоресцентное окрашивание антителами против Oat1 (красный) и LTL (зеленый) после 3 dpi указывает на здоровье проксимальных канальцев у мышей, подвергшихся пренатальной гипоксии после лечения цисплатином. ( C ) Количественная оценка расширения проксимальных канальцев у мышей, которые не получали лечения и 3 dpi; *Р<0.05, Р<0,01; Н = 4; Столбики погрешностей обозначены как SEM. ( D-G ) Иммуноокрашивание антителами против Kim1 (красный) и LTL (зеленый) через 7 недель для мониторинга повреждения почек (стрелки) в пренатальной нормоксии и подверженных гипоксии почках (внизу), получавших цисплатин. ( H ) Количественное определение Kim1-позитивной области в почках, подвергшихся пренатальной нормоксии и гипоксии; **P<0,01, нормоксия N = 3; Гипоксия N = 4. Столбики ошибок указаны как SEM.
https://doi.org/10.1371/журнал.pone.0229618.g006
Обсуждение
Наше исследование не выявило каких-либо структурных дефектов развития почек у потомков самок, подвергшихся гипоксии. Как при 12% O 2 , так и при кислороде окружающей среды (~ 21% O 2 ) почки демонстрировали сопоставимую степень дифференцировки, пролиферации и апоптоза предшественников нефронов E16.5 и E18.5 независимо от обработки кислородом. Хотя это открытие немного отличается от предыдущих исследований с использованием аналогичных (8–10% O 2 ) условий гипоксии [4, 31, 32], мы предполагаем, что отсутствие дефекта развития может быть объяснено разницей в фактической концентрации кислорода и штамм мыши, использованный в предыдущих исследованиях.В нашем исследовании использовалась модель умеренной гипоксии с концентрацией кислорода 12% O 2 , чтобы максимизировать выживаемость за счет лечения и имитировать жизнь на большой высоте. Другие исследования часто используют более серьезные концентрации кислорода. Одно исследование с использованием 12% O 2 и мышей с фоном CD-1 показало, что 12% O 2 было достаточно для опосредования структурных аномалий во время развития, однако в нашем исследовании использовались мыши с фоном C57B/6. Линия мышей CD-1 также демонстрирует более высокую смертность в ответ на гипоксию [33] за счет активации неадекватного ответа на гипоксию посредством повышающей регуляции Hif-1α [34].Следовательно, это правдоподобная причина отсутствия структурных аномалий в нашей модели, что позволяет исследовать физиологическое перепрограммирование при отсутствии структурных аномалий.
В настоящее время меньше известно о субпатологической роли пренатальной гипоксии в повреждении органов в более позднем возрасте. Ранее было показано, что пренатальная гипоксия снижает адаптационный потенциал мозга и впоследствии повышает риск нейродегенеративных заболеваний, таких как болезнь Паркинсона, в позднем взрослом возрасте [35, 36].Кроме того, было показано, что сердце подвергается физиологическому перепрограммированию в связи с внутриутробной гипоксией, приводящей к восприимчивости к травмам в более позднем возрасте [37–39]. Однако пренатальная гипоксия при отсутствии структурных дефектов недостаточно изучена на моделях повреждения почек.
Чтобы точно проанализировать влияние пренатальной гипоксии на предрасположенность к заболеванию почек в более позднем возрасте, мы заразили потомство мышей, подвергшихся пренатальной гипоксии, с острой нефротоксичностью посредством лечения высокой дозой цисплатина.Мыши, подвергшиеся пренатальной гипоксии, проявляли повышенную восприимчивость к цисплатиновому повреждению, несмотря на отсутствие явных дефектов развития. Цисплатин вызывает клеточные повреждения в сегменте S3 эпителиальных клеток проксимальных канальцев почек у мышей [40]. Наши данные показали, что лечение цисплатином увеличивало экспрессию специфического маркера повреждения проксимальных канальцев, Kim-1, в группе, подвергшейся пренатальной гипоксии, а также повышало маркеры почечной функции, креатинин и мочевину мочевины. Это исследование действует как доказательство принципа, ясно показывая, что строгая регуляция оксигенации в процессе развития имеет решающее значение для долгосрочной функции почек.Хотя пренатальное воздействие гипоксии приводит к усугублению повреждения почек, механизм, приводящий к этому открытию, до сих пор неясен, но будущие исследования многих влиятельных путей будут полезны для этой области.
Настоящее исследование имеет ограничения и поднимает ряд вопросов. Ранее предполагалось, что возраст и пол играют роль в патологии артериальной гипертензии после внутриутробной гипоксии [2]. По этой причине будет важно оценить роль возраста и пола в восприимчивости к цисплатиновому повреждению потомства после пренатальной гипоксии.Кроме того, настоящий механизм обострения травмы неизвестен. Мы изучили несколько потенциальных путей, чтобы объяснить повышенную восприимчивость к травмам у животных, подвергшихся пренатальному воздействию, включая экспрессию провоспалительного цитокина фактора некроза опухоли альфа ( Tnf ), который существенно не изменился между почками, подвергшимися нормоксии и гипоксии, которые лечили цисплатин (S4 фиг.1). Мы также оценили экспрессию генов, регулируемых Hifs, включая митохондриальные Bnip3 , гликолитические Gapdh и активные формы кислорода (АФК), ассоциированные Nox4 .Ранее было показано, что Nox4 , в частности, способствует индуцированному цисплатином ОПП за счет увеличения АФК [41]. Кроме того, АФК-опосредованный стресс в целом связан с тяжестью цисплатин-индуцированного повреждения почек. Поэтому вполне возможно, что пренатальное воздействие гипоксии могло сделать почки более уязвимыми к травмам в более позднем возрасте. Исследования передачи сигналов Hifs и ROS сложны, и в современной литературе неясно, способствует ли ROS выживанию клеток во время повреждения или приводит к ухудшению результатов [42-45].Поскольку наши данные не указывают на то, что экспрессия Hif значительно увеличивалась во время развития (время воздействия гипоксии), физиологическое перепрограммирование также может быть частично связано с эпигенетической регуляцией Hif-индуцированными посттрансляционными модификациями и может быть будущим направлением развития. учиться. Другие механизмы, такие как индукция Kim-1 ERK/MAPK/STAT3 и нарушение регуляции ренин-ангиотензиновой системы (RAS), также могут быть интересными путями-кандидатами для будущих исследований. Будущие исследования влияния гипоксии развития на долгосрочную почечную функцию должны быть направлены на обеспечение понимания механизма, которое могло бы улучшить профилактическую медицину у жителей высокогорья.
В заключение мы показываем, что воздействие эмбриональной гипоксии предрасполагает мышей к усиленному повреждению почек после лечения цисплатином во взрослом возрасте даже при отсутствии начальных структурных аномалий. Это исследование предполагает, что субпатологически низкие концентрации кислорода во время развития плода могут играть критическую роль в физиологическом программировании нефрона при отсутствии структурных аномалий и могут использоваться в качестве прогностического показателя предрасположенности к заболеваниям почек у взрослых.
Вспомогательная информация
S1 Рис. Плотность митохондрий снижается после повреждения цисплатином.
A) Экспрессия гена Tomm20 в почках E18.5 не изменяется у животных, подвергшихся пренатальной нормоксии или гипоксии; Р = 0,41; Н = 4х4. Б) Экспрессия гена Tomm20 в 7-недельных почках достоверно не отличается у животных, подвергшихся внутриутробной нормоксии или гипоксии (P = 0,32; N = 3v3). C-H) Иммунофлуоресцентное окрашивание снова Tomm20 (красный), LTL (зеленый) и DAPI (синий) в 7-недельных почках, получавших цисплатин, выявляет снижение экспрессии Tomm20 у животных, подвергшихся пренатальной гипоксии.
https://doi.org/10.1371/journal.pone.0229618.s002
(TIF)
S2 Рис. Гены-мишени Hif активируются после повреждения цисплатином.
A) Nox4 (P = 0,57), Bnip3 (P = 0,72) и Gapdh (P = 0,12) экспрессия гена в почках E18.5 не изменилась между животными, подвергшимися пренатальной нормоксии или гипоксии; Н = 4х4. Б) экспрессия генов Nox4 (P = 0,81), Bnip3 (P = 0,52) и Gapdh (P = 0,64) в 7-недельных почках достоверно не различается у животных, подвергшихся пренатальной нормоксии или гипоксии; Н = 3 на 3.C) экспрессия генов Nox4 (P = 0,067), Bnip3 (P = 0,004) и Gapdh (P = 0,0008) после лечения цисплатином увеличивается у мышей, подвергшихся пренатальной гипоксии; Н = 3 на 4.
https://doi.org/10.1371/journal.pone.0229618.s003
(TIF)
S3 Рис. Нет изменений воспалительной реакции после лечения цисплатином.
A) Tnf (P = 0,72) экспрессия гена в 7-недельных почках после лечения цисплатином не изменилась у животных, подвергшихся пренатальной нормоксии или гипоксии; Н = 3 на 4.
https://doi.org/10.1371/journal.pone.0229618.s004
(TIF)
Благодарности
Авторы выражают благодарность Центру гипоксии, расположенному в Институте сосудистой медицины Университета Питтсбурга, за использование гипоксических камер. Кроме того, мы хотели бы выразить особую благодарность лаборатории Гончаровой за их консультацию по использованию камер гипоксии для экспериментов.
Каталожные номера
- 1. Томпсон Л., Кримминс С., Телугу Б. и Туран С., Внутриутробная гипоксия: клинические последствия и терапевтические перспективы. Исследования и отчеты в неонатологии, 2015: с. 79.
- 2. Уолтон С.Л., Билефельдт-Оманн Х., Сингх Р.Р., Ли Дж., Паравичини Т.М., Литтл М.Х. и др. Пренатальная гипоксия приводит к гипертонии, активации почечной ренин-ангиотензиновой системы и усугубляет индуцированную солью патологию в зависимости от пола. . науч. респ., 2017. 7(1): с. 8241. pmid:28811528
- 3. Уолтон С.Л., Сингх Р.Р., Литтл М.Х., Боулз Дж., Ли Дж. и Мориц К.М. Продолжительная пренатальная гипоксия избирательно нарушает паттерн собирательных трубочек и постнатальную функцию у потомства самцов мышей. J Physiol, 2018. 596(23): с. 5873–5889. пмид:29676801
- 4. Xia S., Lv J., Gao Q., Li L., Chen N., Wei X. и др. Пренатальное воздействие гипоксии индуцирует опосредованную передачей сигнала Beclin 1 почечную аутофагию и изменяет развитие почек у плодов крыс. Reprod Sci, 2015. 22(2): с. 156–64. пмид:24872334
- 5.Battista M.C., Oligny L.L., St-Louis J. и Brochu M., Ограничение внутриутробного развития у крыс связано с гипертонией и почечной дисфункцией во взрослом возрасте. Am J Physiol Endocrinol Metab, 2002. 283: с. Е124–Е131. пмид:12067852
- 6. Косми Э., Фанелли Т., Висентин С., Тревизануто Д. и Занардо В. Последствия задержки внутриутробного развития у младенцев. J Беременность, 2011. 2011: с. 364381. pmid:21547088
- 7. Хемкер С.Л., Симс-Лукас С. и Хо Дж., Роль гипоксии во время нефрогенеза. Педиатр Нефрол, 2016. 31(10): с. 1571–157 гг. пмид:26872484
- 8. Паттерсон А.Дж. и Чжан Л., Гипоксия и развитие сердца плода. Curr Mol Med, 2010. 10(7): с. 653–666. пмид:20712587
- 9. Peyronnet J., Roux JC, Geloen A., Tang LQ, Pequignot JM, Lagercrantz H. и др. Пренатальная гипоксия нарушает постнатальное развитие нервных и функциональных химиоафферентных путей у крыс. Журнал физиологии, 2000.524(2): с. 525–537.
- 10. Паттерсон А.Дж., Чен М., Сюэ К., Сяо Д. и Чжан Л., Хроническая пренатальная гипоксия индуцирует эпигенетическое программирование репрессии гена PKC{эпсилон} в сердцах крыс. Circ Res, 2010. 107(3): с. 365–73. пмид:20538683
- 11. Маленький М.Х. и МакМахон А.П., Развитие почек млекопитающих: принципы, прогресс и прогнозы. Cold Spring Harb Perspect Biol, 2012. 4(5).
- 12. Такасато М. и Литтл М.Х., Происхождение почки млекопитающих: значение для воссоздания почки in vitro.Развитие, 2015. 142(11): с. 1937–47. пмид:26015537
- 13. О’Брайен Л.Л. и МакМахон А.П., Индукция и формирование паттерна метанефрического нефрона. Semin Cell Dev Biol, 2014. 36: с. 31–8. пмид:25194660
- 14. Bagby S.P., Причины развития почечной недостаточности: следует ли начинать защиту нефрона с рождения? Clin J Am Soc Nephrol, 2009. 4(1): с. 10–3. пмид:19129313
- 15. Нишинакамура Р., Стволовые клетки и развитие почек в 2015 г.: достижения в создании и поддержании предшественников нефронов.Nat Rev Nephrol, 2016. 12(2): с. 67–8. пмид:26685916
- 16. Дженсен Г.М. и Мур Л.Г. Влияние большой высоты и других факторов риска на массу тела при рождении: независимые или интерактивные эффекты? Am J Public Health, 1997. 87(6): с. 1003–1007. пмид:9224184
- 17. Дюксей К.А., Гоял Р., Пирс В.Дж., Уилсон С., Ху В.К. и Чжан Л., Гипоксия беременных и пластичность развития. Физиол Рев, 2018. 98: с. 1241–1334 гг. пмид:29717932
- 18. Бубред Ф., Daniel L., Buffat C., Tsimaratos M., Oliver C., Lelievre-Pegorier M., et al. Величина уменьшения количества нефронов опосредует долгосрочное хроническое заболевание почек у крыс, вызванное ограничением внутриутробного роста. Сравнительное исследование на двух экспериментальных моделях. J Transl Med, 2016. 14(1): с. 331. пмид:27899104
- 19. Ньюсом А.Д., Дэвис Г.К. и Александр Б.Т., Программы ограничения внутриутробного развития повышают восприимчивость к хроническому повреждению почек у самцов и самок старых крыс.Журнал FASEB, 2017. 31(1).
- 20. Озкок А. и Эдельштейн С.Л., Патофизиология острого повреждения почек, вызванного цисплатином. Биомед Рез Инт, 2014. 2014: с. 967826. pmid:25165721
- 21. Базиль Д.П., Андерсон М.Д. и Саттон Т.А., Патофизиология острого повреждения почек. Комплексная физиология, 2012. 2(2): с. 1303–1353 гг. пмид:23798302
- 22. Хсу Р.К. и Хсу С.Ю., Роль острого повреждения почек при хроническом заболевании почек. Семин Нефрол, 2016.36(4): с. 283–292. пмид:27475659
- 23. Остерманн М. и Лю К., Патофизиология ОПП. Best Pract Res Clin Anaesthesiol, 2017. 31(3): с. 305–314. пмид:29248138
- 24. Миллер Р.П., Тадагавади Р.К., Рамеш Г. и Ривз В.Б., Механизмы нефротоксичности цисплатина. Токсины (Базель), 2010. 2(11): с. 2490–518.
- 25. Барнетт Л.М.А. и Каммингс Б.С., Нефротоксичность и почечная патофизиология: современная перспектива. Токсикологи, 2018.164(2): с. 379–390. пмид:29939355
- 26. О Г.С., Ким Х.Дж., Шен А., Ли С.Б., Хадка Д., Пандит А. и др., Цисплатин-индуцированная дисфункция почек и перспективы улучшения стратегий лечения . Electrolyte Blood Press, 2014. 12(2): с. 55–65.
- 27. Кока С.Г., Острое повреждение почек у пожилых людей. Am J Kidney Dis, 2010. 56(1): с. 122–131. пмид:20346560
- 28. Хэ Л., Вэй К., Лю Дж., Йи М., Лю Ю., Лю Х. и др., ОПП при ХБП: усиленное повреждение, подавленное восстановление и лежащие в его основе механизмы. Kidney Int, 2017. 92(5): с. 1071–1083. пмид:288
- 29. Нодзири Т., Хосода Х., Кимура Т., Токудоме Т., Миура К., Такабатаке Х. и др., Защитное действие грелина на цисплатин-индуцированную нефротоксичность у мышей. Пептиды, 2016. 82 с. 85–91. пмид:27298204
- 30. Хо Дж., Регуляция апоптоза в развитии почек: влияние на количество и структуру нефронов? Фронт Педиатр, 2014.2: с. 128. пмид:25478553
- 31. Гонсалес-Родригес П. Младший, Тонг В., Сюэ К., Ли Ю., Ху С. и Чжан Л., Гипоксия плода приводит к программированию аберрантных моделей экспрессии рецепторов ангиотензина II и развитию почек. Int J Med Sci, 2013. 10(5): с. 532–8. пмид:23532764
- 32. Уилкинсон Л.Дж., Нил К.С., Сингх Р.Р., Спарроу Д.Б., Курниаван Н.Д., Джу А. и др., Дефекты развития почек, возникающие в результате внутриутробной гипоксии, связаны с подавлением передачи сигналов бета-катенина по мочеточникам.Kidney Int, 2015. 87(5): с. 975–83. пмид:25587709
- 33. Цвемер К.Ф., Сонг М.Ю., Карелло К.А. и Д’Алеси Л.Г., Различия штаммов в ответ на острую гипоксию: мыши CD-1 по сравнению с мышами C57BL/6J. J Appl Physiol, 2007. 102(1): с. 286–293. пмид:16916919
- 34. Ли К., Лю Дж., Мишо М., Шварц М.Л. и Мадри Дж.А., Различия штаммов в поведенческих и клеточных реакциях на перинатальную гипоксию и взаимосвязь с выживанием и самообновлением нервных стволовых клеток: моделирование нейроваскулярной ниши.Am J Pathol, 2009. 175(5): с. 2133–46. пмид:19815710
- 35. Голан Х. и Хулейхель М. Влияние пренатальной гипоксии на развитие мозга: краткосрочные и долгосрочные последствия, продемонстрированные на моделях грызунов. Наука о развитии, 2006. 9(4): с. 338–349. пмид:16764607
- 36. Наливаева Н.Н., Тернер А.Дж., Журавин И.А. Роль пренатальной гипоксии в развитии мозга, когнитивных функциях и нейродегенерации. Front Neurosci, 2018. 12: с. 825. pmid:30510498
- 37.Сюэ К. и Чжан Л., Пренатальная гипоксия вызывает зависящее от пола повышение восприимчивости сердца к ишемии и реперфузионному повреждению у взрослых потомков мужского пола: роль протеинкиназы C эпсилон. J Pharmacol Exp Ther, 2009. 330(2): с. 624–32. пмид:19470841
- 38. Xu Y., Williams S.J., O’Brien D., and Davidge S.T. Гипоксия или ограничение питательных веществ во время беременности у крыс приводит к прогрессирующему ремоделированию сердца и ухудшает постишемическое восстановление у взрослых потомков мужского пола. Журнал ФАСЭБ, 2006.20(8): с. 1251–1253 гг. пмид:16632594
- 39. Ли Г., Сяо Ю., Эстрелла Дж. Л., Дуксай К. А., Гилберт Р. Д. и Чжан Л., Влияние гипоксии плода на восприимчивость сердца к ишемии и реперфузионному повреждению у взрослых крыс. J Soc Gynecol Investig, 2003. 10(5): с. 265–274. пмид:12853087
- 40. Хейман С.Н., Розен С. и Розенбергер С., Модели почечной дисфункции на животных: острая почечная недостаточность. Экспертное заключение об обнаружении наркотиков, 2009. 4(6): с. 629–641. пмид:23489156
- 41.Meng X.M., Ren GL, Gao L., Yang Q., Li HD, Wu WF и др., НАДФН-оксидаза 4 способствует индуцированному цисплатином острому повреждению почек посредством АФК-опосредованной запрограммированной гибели клеток и воспаления. Лаб Инвест, 2018. 98(1): с. 63–78. пмид:29106395
- 42. Ратлифф Б.Б., Абдулмахди В., Паваре Р. и Волин М.С., Окислительные механизмы при повреждении и заболевании почек. Антиоксиданты и передача сигналов окислительно-восстановительного потенциала, 2016. 25 .
- 43. Бод Л. и Ардайоу Р., Реакционные виды кислорода: производство и роль в почках.Американский журнал физиологии Renal Physiology, 1986. 251(5): с. Ф765–Ф776.
- 44. Ли Х.С., Чжоу Ю.Н., Ли Л., Ли С.Ф., Чен С.Л., Чжан Дж.Б. и др., HIF-1α защищает от окислительного стресса, непосредственно воздействуя на митохондрии. Редокс-биология, 2019. 25.
- 45. Хаген Т., Кислород против реактивного кислорода в регуляции HIF-1α: Советы по балансу. Международные исследования биохимии, 2012.
Гестационный диабет матери является независимым фактором риска гипоксии плода во время родов
В Финляндии у каждой пятой матери был диагностирован гестационный диабет в 2019 году.Состояние увеличивает риск развития у матери диабета 2 типа в будущем. Однако наиболее значительным последствием гестационного диабета является макросомия плода, или чрезмерный рост плода. Макросомия увеличивает родовой травматизм как у ребенка, так и у матери, вызывает гипоксию плода, то есть недостаток кислорода у плода, увеличивает родовые осложнения у новорожденного.
Исследовательская группа, работающая в Университете Хельсинки и Университетской больнице Хельсинки, продемонстрировала, что гестационный диабет матери является независимым фактором, повышающим риск гипоксии плода во время родов.Рецензируемое исследование было опубликовано в Acta Diabetologica .
Другим открытием было то, что гестационный диабет повышал восприимчивость плода к внутриутробной гипоксии, независимо от размера плода.
Риск гипоксии и связанного с этим риска ухудшения состояния новорожденных был почти в семь раз выше у плодов матерей с гестационным диабетом по сравнению с плодами матерей, не страдающих диабетом».
Микко Тарвонен, исследователь
Согласно полученным данным, риск необходимости проведения реанимационных мероприятий у новорожденного был десятикратным.
Гипоксия оказывает краткосрочное и долгосрочное воздействие на плод и новорожденного ребенка и в худшем случае может привести к повреждению головного мозга и гибели плода.
«Повреждения, вызванные гипоксией, являются источником страданий для ребенка и его семьи. Кроме того, стоимость лечения травм, связанных с гипоксией, чрезвычайно высока для общества», — говорит Тарвонен.
Мониторинг частоты сердечных сокращений плода повышает риск гипоксии
Недостаток кислорода у плода можно выявить, записав частоту сердечных сокращений плода во время родов.Зигзагообразная картина, означающая повышенную вариабельность ЧСС плода, указывает на начало гипоксии как при нормальной беременности, так и при осложненной гестационным диабетом.
Кардиотокография (КТГ), или электронный мониторинг частоты сердечных сокращений плода и сокращений матки, является обычной мерой предосторожности, проводимой во время родов при всех родах в больнице в Финляндии. В настоящее время гестационный диабет, леченный диетой, не является показанием для постоянного мониторирования КТГ во время родов.
«Исходя из наших выводов, усиленный мониторинг КТГ во время родов хорошо показан женщинам с гестационным диабетом. Это позволит на раннем этапе выявить зигзагообразную форму, обеспечив безопасность родов и родов», — говорит Тарвонен.
При наблюдении за частотой сердечных сокращений плода во время родов необходимо также учитывать пожелания и опыт матери.
«Контроль КТГ несколько снижает способность матери двигаться во время родов.Основываясь на наших выводах, мониторинг плода в будущем может быть более четко нацелен на плод, который выиграет от более тщательного наблюдения», — отмечает Тарвонен.
«Лечение и мониторинг гестационного диабета — это многопрофильное сотрудничество, в котором основное внимание уделяется матери, плоду и ребенку. Надеемся, что новые результаты повысят безопасность родов — как с точки зрения предотвращения гипоксии плода, так и с точки зрения улучшения состояния матери». ощущение безопасности», — добавляет он.
Здоровый образ жизни помогает предотвратить гестационный диабет
Избыточный вес, недостаточная физическая активность и нездоровое питание являются значительными факторами риска, связанными с гестационным диабетом.Предыдущие исследования показали, что такие риски можно значительно снизить во время беременности, если вести здоровый образ жизни и поддерживать хороший уровень глюкозы в крови.
«Среди женщин с гестационным диабетом есть и женщины с нормальным весом, у которых, вероятно, есть генетическая предрасположенность. Тем не менее, они тоже получают пользу от достаточной физической активности и здорового образа жизни», — добавляет Тарвонен.
Источник:
Ссылка на журнал:
Tarvonen, M., et al. (2021) Интрапартальные кардиотокографические паттерны и перинатальные исходы, связанные с гипоксией, при беременности, осложненной гестационным сахарным диабетом. Диабетологический акт. doi.org/10.1007/s00592-021-01756-0.
Гипоксия плода — Дуган, Бабий, Толли и Колер
Во время беременности поступление кислорода и питательных веществ к ребенку и удаление углекислого газа и других отработанных газов из организма ребенка осуществляется через плаценту.
Плацента является чрезвычайно сложным органом, который состоит из систем кровообращения как матери, так и плода.
Адекватный приток крови к плаценте и от нее, а также кровообращение как матери, так и плода необходим для того, чтобы ребенок получал достаточно кислорода и мог выводить углекислый газ и другие отработанные газы.Любое изменение функции плаценты может привести к снижению доставки кислорода к ребенку, состоянию, известному как гипоксия плода.
Поскольку гипоксия плода может быть результатом многих заболеваний или состояний матери или плода, которые снижают функцию плаценты, осторожные и осторожные акушеры будут тщательно оценивать своих пациенток, подверженных риску развития гипоксии плода.
Гипертонические расстройства у матери во время беременности, включая преэклампсию и HELLP-синдром, если их не диагностировать или плохо лечить, могут напрямую привести к нарушению функции плаценты и последующей гипоксии плода.
Кровоизлияния у матери, включая геморрагическое предлежание плаценты или отслойку плаценты, при которых плацента преждевременно отрывается от матки, могут непосредственно и остро привести к гипоксии плода.
Плохо управляемый сахарный диабет также связан со значительно повышенным риском маточно-плацентарной недостаточности, которая может непосредственно привести к гипоксии плода.
Снижение уровня амниотической жидкости, также известное как олигогидрамнион, может привести к защемлению или выпадению пуповины ребенка, тем самым напрямую перекрывая поток насыщенной кислородом крови от плаценты к ребенку, что приводит к гипоксии плода.
Если гипоксия или нехватка кислорода легкая или преходящая, ребенок, как правило, может компенсировать ее без каких-либо необратимых повреждений.
Однако длительная или тяжелая гипоксия может привести к асфиксии плода.В таких случаях компенсаторные механизмы ребенка выходят из строя или иным образом перегружаются, что напрямую ведет к риску необратимого повреждения головного мозга и состоянию, известному как гипоксически-ишемическая энцефалопатия.
У тех пациенток, которые признаны подверженными риску гипоксии плода, безопасный и осторожный акушер инициирует режим наблюдения за плодом для рутинной оценки состояния ребенка.
Такие тесты наблюдения за плодом, как правило, включают нестрессовые тесты, так называемые стресс-тесты, также известные как тесты с нагрузкой окситоцином и тестирование биофизического профиля.
Давно известно, что колебания частоты сердечных сокращений плода, определяемые с помощью непрерывного электронного мониторинга сердца плода, могут отражать как гипоксию плода, так и наличие у ребенка ацидоза, т. е. накопление кислот в крови как в результате нарушения газообмена.
Таким образом, у детей с риском развития гипоксии плода безопасные и осторожные акушеры изучат вариабельность частоты сердечных сокращений плода и оценят, есть ли какие-либо замедления частоты сердечных сокращений плода по сравнению с ее нормальным исходным уровнем.
Минимальная или «отсутствующая» вариабельность и/или наличие «поздних» децелераций во время родов многие осторожные и осторожные акушеры считают зловещими признаками потенциальной гипоксии плода.
Осторожные и осторожные акушеры и акушерские медсестры незамедлительно реагируют на любые признаки гипоксии плода.
Во многих случаях обнаружение гипоксии плода требует оперативного родоразрешения путем кесарева сечения.
К сожалению, во многих случаях, когда гипоксия плода не диагностируется или роды путем кесарева сечения неоправданно откладываются, длительная гипоксия плода приводит к необратимому и необратимому повреждению головного мозга, также известному как гипоксически-ишемическая энцефалопатия.
Таким образом, своевременная оценка гипоксии плода и родоразрешение путем кесарева сечения во многих случаях будет единственным способом предотвратить получение ребенком потенциально разрушительных травм, таких как повреждение головного мозга и церебральный паралич.
Во время беременности поступление кислорода и питательных веществ к ребенку и удаление углекислого газа и других отработанных газов из организма ребенка осуществляется через плаценту.
Плацента является чрезвычайно сложным органом, который состоит из систем кровообращения как матери, так и плода.
Адекватный приток крови к плаценте и от плаценты, а также кровообращение как матери, так и плода необходим для того, чтобы ребенок получал достаточно кислорода и мог выводить углекислый газ и другие отработанные газы.
Любое изменение функции плаценты может привести к снижению доставки кислорода к ребенку, состоянию, известному как гипоксия плода.
Поскольку гипоксия плода может быть результатом многих заболеваний или состояний матери или плода, которые снижают функцию плаценты, осторожные и осторожные акушеры будут тщательно оценивать своих пациенток, подверженных риску развития гипоксии плода.
Гипертонические расстройства у матери во время беременности, включая преэклампсию и HELLP-синдром, если их не диагностировать или плохо лечить, могут напрямую привести к нарушению функции плаценты и последующей гипоксии плода.
Кровоизлияния у матери, включая геморрагическое предлежание плаценты или отслойку плаценты, при которых плацента преждевременно отрывается от матки, могут непосредственно и остро привести к гипоксии плода.
Плохо управляемый сахарный диабет также связан со значительно повышенным риском маточно-плацентарной недостаточности, которая может непосредственно привести к гипоксии плода.
Снижение уровня амниотической жидкости, также известное как олигогидрамнион, может привести к защемлению или выпадению пуповины ребенка, тем самым напрямую перекрывая поток насыщенной кислородом крови от плаценты к ребенку, что приводит к гипоксии плода.
Если гипоксия или нехватка кислорода легкая или преходящая, ребенок, как правило, может компенсировать ее без каких-либо необратимых повреждений.
Однако длительная или тяжелая гипоксия может привести к асфиксии плода.В таких случаях компенсаторные механизмы ребенка выходят из строя или иным образом перегружаются, что напрямую ведет к риску необратимого повреждения головного мозга и состоянию, известному как гипоксически-ишемическая энцефалопатия.
У тех пациенток, которые признаны подверженными риску гипоксии плода, безопасный и осторожный акушер инициирует режим наблюдения за плодом для рутинной оценки состояния ребенка.
Такие тесты наблюдения за плодом, как правило, включают нестрессовые тесты, так называемые стресс-тесты, также известные как тесты с нагрузкой окситоцином и тестирование биофизического профиля.
Давно известно, что колебания частоты сердечных сокращений плода, определяемые с помощью непрерывного электронного мониторинга сердца плода, могут отражать как гипоксию плода, так и наличие у ребенка ацидоза, т. е. накопление кислот в крови как в результате нарушения газообмена.
Таким образом, у детей с риском развития гипоксии плода безопасные и осторожные акушеры изучат вариабельность частоты сердечных сокращений плода и оценят, есть ли какие-либо замедления частоты сердечных сокращений плода по сравнению с ее нормальным исходным уровнем.
Минимальная или «отсутствующая» вариабельность и/или наличие «поздних» децелераций во время родов многие осторожные и осторожные акушеры считают зловещими признаками потенциальной гипоксии плода.
Осторожные и осторожные акушеры и акушерские медсестры незамедлительно реагируют на любые признаки гипоксии плода.
Во многих случаях обнаружение гипоксии плода требует оперативного родоразрешения путем кесарева сечения.
К сожалению, во многих случаях, когда гипоксия плода не диагностируется или роды путем кесарева сечения неоправданно откладываются, длительная гипоксия плода приводит к необратимому и необратимому повреждению головного мозга, также известному как гипоксически-ишемическая энцефалопатия.
Таким образом, своевременная оценка гипоксии плода и родоразрешение путем кесарева сечения во многих случаях будет единственным способом предотвратить получение ребенком потенциально разрушительных травм, таких как повреждение головного мозга и церебральный паралич.
Плаценты адаптируются, когда у матерей плохое питание или низкий уровень кислорода во время беременности — ScienceDaily
Исследователи из Кембриджа обнаружили, что плацента регулирует количество кислорода и питательных веществ, которые она транспортирует детям во время сложных беременностей, в исследовании с использованием мышей для моделирования условий в утробе матери.
Плацента является наименее изученным органом, и, как известно, ее трудно изучать у беременных женщин. Но его способность функционировать должным образом жизненно важна, так как от него зависят исходы беременности и здоровье матери и ребенка на протяжении всей жизни.
Плацента развивается во время беременности и соединяет развивающегося ребенка с матерью. Он служит легкими, почками, кишечником и печенью для растущих детей и переносит кислород и питательные вещества к плоду, одновременно выделяя гормоны и выбрасывая отходы.
Доктор Аманда Н. Сферруцци-Перри, научный сотрудник колледжа Святого Иоанна Кембриджского университета, является ведущим автором нового исследования, которое было опубликовано в журнале Proceedings of the National Academy of Sciences (PNAS) .
Исследование было сосредоточено на анализе небольших частей плацентарных клеток, называемых митохондриями. Митохондрии — это энергетические электростанции, обнаруженные в большинстве клеток организма и использующие кислород для преобразования сахара и жира в энергию.
Доктор Сферруцци-Перри сказал: «Исследование проанализировало, как митохондрии в плаценте могут изменить свою функцию, чтобы удовлетворить потребности как плаценты, так и быстро растущего плода во время здоровой беременности, а также когда мать сталкивается с менее благоприятной средой.
«Мы обнаружили, что в плаценте митохондрии обладают замечательной способностью адаптироваться и компенсировать воздействие окружающей среды, например, когда женщины живут в районах с низким содержанием кислорода на большой высоте и не едят достаточно здоровой пищи во время беременности».
Изменение образа жизни в обществе, когда женщины во время беременности потребляют неполноценную пищу, может вызвать осложнения во время беременности, а проживание на высоте более 2500 м в таких местах, как Боливия, Перу, Тибет и Эфиопия, ограничивает уровень кислорода.По оценкам, около двух процентов населения Земли — 140 миллионов человек — живут в районах с низким содержанием кислорода.
В этих условиях плацента не всегда функционирует должным образом и может вызвать выкидыш, преэклампсию и задержку роста плода. Около 10% детей рождаются с задержкой роста плода, когда ребенок не растет должным образом, и это может оставить неизгладимый след на их здоровье.
Задержка роста плода является сильным признаком потенциальных проблем с ребенком, включая мертворождение, смерть в первые недели жизни, повышенный риск рождения с церебральным параличом, проблемы с поведением и развитием, неврологические расстройства и хронические заболевания в более позднем возрасте, такие как как болезни сердца, ожирение и диабет.
Группа ученых представила испытания, известные как гипоксические состояния, в лаборатории. Они использовали мышь в качестве модели, так как ее плацента развивается и функционирует подобно людям, наблюдая за тем, как реагировали плацента и их митохондрии и какое влияние это оказывало на рост плода.
Доктор Сферруцци-Перри объяснил: «Митохондрии в плаценте определяют, как наиболее эффективно использовать кислород и питательные вещества, чтобы их было достаточно для передачи плоду даже при сложной беременности.Когда плацента не может компенсировать проблемы, это может привести к таким осложнениям, как задержка роста плода».
«Мы знаем, что это оказывает длительное влияние на здоровье детей, рожденных с задержкой роста плода, потому что такие органы и ткани, как сердце, поджелудочная железа, мышцы и печень, очень чувствительны, когда они развиваются в утробе матери. Если эти органы не не растут должным образом, у них больше шансов выйти из строя в более позднем возрасте».
Цель исследования — первого в своем роде — состояла в том, чтобы понять, что требуется для того, чтобы здоровая плацента выполняла свои жизненно важные функции во время беременности.
Д-р Sferruzzi-Perri добавил: «Наши результаты показывают, что митохондрии являются действительно важными детерминантами плацентарной функции и поддержки роста плода. Следующим шагом будет нацеливание на митохондрии в плаценте, чтобы изменить их функцию и улучшить беременность у женщин, где мы знаем, исход может быть плохим».
Когда дети рождаются с задержкой роста плода, команда ранее обнаружила, что буферный механизм плаценты во время беременности недостаточен.
Есть надежда, что новые выводы могут привести к тестам, чтобы определить, функционирует ли плацента должным образом, и в конечном итоге обеспечить лечение, при котором можно восстановить плацентарную функцию до нужного уровня для здорового исхода беременности.
Каковы первые признаки гипоксии у новорожденных?
Гипоксия, асфиксия при рождении и гипоксически-ишемическая энцефалопатия (ГИЭ) — все это термины, обозначающие недостаток кислорода у ребенка до, во время или после рождения. Недостаток кислорода может привести к серьезным родовым травмам. К счастью, родовые травмы часто можно предотвратить, если медицинские работники следуют стандарту медицинской помощи, наблюдая за первыми признаками гипоксии.
Эта информация была собрана из государственных источников, образовательных некоммерческих организаций и медицинских экспертов.
Чтобы узнать больше о первых признаках гипоксических поражений головного мозга при рождении, продолжайте читать.
Четыре типа гипоксии
Существует четыре типа гипоксии плода:
- Острая гипоксия
- Подострая гипоксия
- Развивающаяся гипоксия
- Хроническая гипоксия
Типы гипоксии описывают тяжесть и продолжительность состояния.
Получение помощи ребенку с ГИЭ или церебральным параличом
может иметь большое значение
Поскольку раннее вмешательство часто является ключом к улучшению благополучия ребенка, важно действовать быстро.В Brown Trial Firm наши адвокаты по родовым травмам в Хьюстоне могут помочь вам расследовать ваше дело, найти ответы на ваши вопросы и определить, имеете ли вы право на компенсацию. Мы предлагаем рассмотрение дел бесплатно и без каких-либо обязательств. Многие родовые травмы, вызывающие церебральный паралич, можно было бы предотвратить.
Не ждите. Получите помощь сегодня.
Позвоните (866) 393-2611 или запишитесь на бесплатную консультацию
Общие признаки гипоксии у новорожденных
Поскольку гипоксия может привести к серьезным и необратимым родовым травмам, медицинские работники должны всегда внимательно следить за признаками недостатка кислорода у ребенка.Это включает в себя наблюдение за признаками до, во время и после рождения ребенка.
Что является первым признаком гипоксии у новорожденных?
Одним из первых признаков того, что у ребенка затруднено дыхание, является неустойчивый или нерегулярный сердечный ритм. Врачи должны внимательно следить за частотой сердечных сокращений плода как во время, так и после родов, чтобы убедиться, что новорожденный получает достаточное количество кислорода.
Другие распространенные признаки гипоксии (или недостатка кислорода) у ребенка включают:
- Отсутствие движений плода
(детская вялость или утомляемость) - Голубоватый или бледный оттенок кожи
- Плохой/слабый мышечный тонус
- Плохие рефлексы
- Слабый / не плачь
Медицинские работники могут наблюдать за частотой сердечных сокращений ребенка в утробе матери с помощью кардиомонитора плода.
Мониторинг сердца плода
Существует два способа проведения мониторинга сердца плода: внутренний и внешний.
Внешний мониторинг можно проводить с помощью ультразвукового доплеровского устройства. Для постоянного наблюдения медицинский работник может прикрепить к животу матери ультразвуковой датчик (называемый «преобразователем»). Этот датчик отправляет звуки сердца ребенка на компьютер, где частота и характер пульса отображаются на экране или распечатываются на бумаге.
Внутренний мониторинг можно проводить, прикрепив тонкую проволоку (электрод) к коже головы ребенка.Провод идет от ребенка, через шейку матки матери, а затем к монитору. Этот метод дает более надежные показания, чем внешний мониторинг, но его можно использовать только после разрыва амниотического мешка и раскрытия шейки матки.
Независимо от того, измеряется ли он внутренне или внешне, частота сердечных сокращений ребенка предоставляет медицинским работникам ценную информацию о том, получает ли ребенок достаточно кислорода. Следует внимательно следить за аномальным сердечным ритмом и оценивать варианты лечения.Медицинские работники могут заказать экстренное кесарево сечение, если ребенку угрожает травма из-за гипоксии.
Общие факторы, вызывающие гипоксию
Существует множество причин, по которым ребенок может не получать достаточного количества кислорода до, во время или после рождения. Общие факторы могут включать:
- Отслойка плаценты
- Разрыв матки
- Сдавление пуповины
- Узлы пуповины
- Выпадение пуповины
- Низкое артериальное давление у матери
- Низкий уровень кислорода у матери
Лечение гипоксии у новорожденных
Младенцы, испытывающие недостаток кислорода во время родов, могут пройти несколько процедур, чтобы свести к минимуму повреждение развивающегося мозга ребенка.
Терапевтическая гипотермия, или терапия охлаждением мозга, является одним из наиболее распространенных методов лечения гипоксии. Этот тип терапии помогает улучшить результаты за счет снижения температуры мозга и тела младенца, тем самым изменяя химические процессы в мозге и снижая риск необратимого повреждения головного мозга у младенца.
Другие методы лечения гипоксических поражений головного мозга при рождении могут включать назначение лекарств от артериального давления, искусственную вентиляцию легких, диализ, использование сердечных насосов, дыхательных ванн и препаратов, препятствующих судорогам.
Конечно, как говорится, «лучшее лечение — профилактика». Если медицинский работник не может предотвратить необратимое повреждение головного мозга, вызванное недостатком кислорода во время родов, он может нести ответственность за ущерб в соответствии с законами о врачебной халатности.
Поговорите с опытным адвокатом по родовым травмам, чтобы узнать больше о ваших юридических возможностях.
Сводка:
Первым признаком гипоксии часто является нерегулярное сердцебиение. Неустойчивый удар или замедление сердечного ритма могут быть признаком кислородного голодания.Отсутствие движения также может быть признаком гипоксии. Медицинские работники должны всегда внимательно следить за потенциальными признаками гипоксии, потому что недостаток кислорода может вызвать серьезные и необратимые родовые травмы, включая ГИЭ и церебральный паралич.
Источники
Гипоксически-ишемическая энцефалопатия Клиническая картина: анамнез, физикальное обследование.


 Данный показатель определяет колебания частоты сердечных сокращений плода, которые не зависят от маточных сокращений
Данный показатель определяет колебания частоты сердечных сокращений плода, которые не зависят от маточных сокращений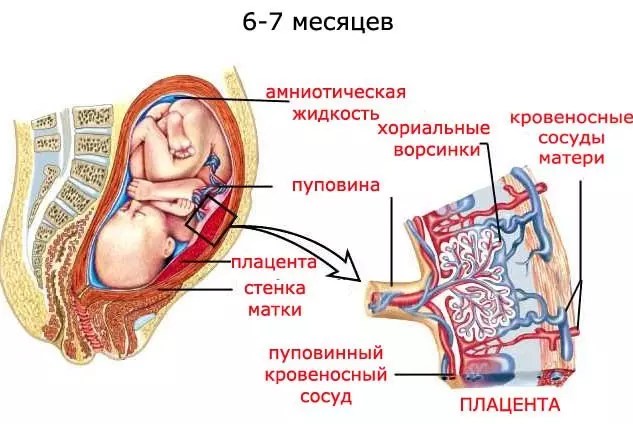 При необходимости пациентка может сразу же после прохождения обследования посетить лечащего врача, чтобы получить от него необходимые рекомендации
При необходимости пациентка может сразу же после прохождения обследования посетить лечащего врача, чтобы получить от него необходимые рекомендации