К какому врачу идти при микоплазмозе у детей — все симптомы, диагностика, врачи
Инфекционисты Москвы — отзывы
Врач оперативно приехала, посмотрела ребёнка, всё мне объяснила, лечение расписала и оставила свой контактный номер и в случае вопросов, разрешила с ней связаться.
Мария
Приём был нужен срочно, это ближайшее время на которое мы смогли записаться, мы пришли, доктор смогла принять раньше.
Антон
Первое, когда я ехала в клинику, встретила свою знакомую, она узнала что еду в эту клинику, она сказала что там замечательные врачи и она тоже пользуется там услугами. Второе, безусловно, Александр Анатольевич, произвёл на меня очень хорошее впечатление, кроме того что он был внимательный, приветливый, он мне всё правильно объяснил и ответил на все мои вопросы.
Татьяна
Лилия
Прием в целом прошел достаточно хорошо. Врач мне понравился. Он позитивный. К себе располагает. Меня все устроило.
Врач мне понравился. Он позитивный. К себе располагает. Меня все устроило.
Татьяна
Михаил
Был на первичном приеме у этого специалиста.
Александр
Инга
Внимательный доктор.
Борис
Хорошая и проницательная врач. Она отнеслась к нам неравнодушно и все правильно разъяснила. Мы сдали анализы и обязательно вернемся еще к доктору!
Еще одна половая инфекция, которая может стать супербактерией
Автор фото, Getty Images
Малоизвестная инфекция, передающаяся половым путем, может превратиться в устойчивую к антибиотикам супербактерию, если не начать ее правильно диагностировать и лечить, предостерегают ученые.
Урогенитальный микоплазмоз часто проходит бессимптомно, особенно у женщин, однако может вызвать воспаление половых органов и даже бесплодие.
Его легко спутать с другой инфекцией, например хламидиозом, а кроме того, эти бактерии могут вырабатывать устойчивость к некоторым антибиотикам.
В связи с этим Британская ассоциация сексуального здоровья и ВИЧ обнародовала новые рекомендации для врачей и пациентов о том, как определить и лечить микоплазмоз.
Что такое микоплазмоз?
Урогенитальный микоплазмоз (Mycoplasma genitalium) передается половым путем через незащищенный секс.
У мужчин эта бактерия вызывает воспаление уретры, неприятные выделения из пениса, боль при мочеиспускании.
У женщин микоплазмоз вызывает воспаление репродуктивных органов (матки и фаллопиевых труб), вызывая боль, лихорадку и иногда кровотечение. Если заболевание не лечить, оно может даже привести к бесплодию.
Однако микоплазмоз не всегда протекает с симптомами и даже не всегда нуждается в лечении. В то же время его легко не заметить или спутать с другим заболеванием. И именно это вызывает беспокойство британских экспертов.
В группе риска — те, кто имел более четырех партнеров за последний год, говорят эксперты.
Презервативы могут предотвратить передачу этой инфекции.
Почему микоплазмоз так опасен?
Точный тест на микоплазмоз существует — однако он доступен не во всех клиниках даже в Британии.
Поэтому эксперты просят британское правительство увеличить финансирование в этой области — чтобы «предотвратить чрезвычайную ситуацию в области общественного здравоохранения, которая вот-вот произойдет и уже выходит из-под контроля».
Эксперты также призывают граждан не пренебрегать презервативами во время секса с новыми или нерегулярными партнерами.
«Пришло время, чтобы общественность узнала об урогенитальном микоплазмозе», — заявил представитель Британской ассоциации сексуального здоровья и ВИЧ доктор Питер Гринхауз.
По всему миру падает эффективность лечения микоплазмоза группой антибиотиков под названием макролиды. В Британии стойкость к макролидам достигает 40%, утверждают эксперты.
В то же время эффективность в большинстве случаев демонстрирует другой антибиотик — азитромицин.
Врачам британские эксперты советуют использовать тесты на микоплазмоз, если симптомы у пациентов могут указывать на это заболевание, подбирать правильные антибиотики и следить за состоянием пациентов до полного выздоровления.
Пневмония у детей: как родителям распознать симптомы и что нужно делать
https://ria.ru/20201230/pnevmoniya-1591588986.html
Пневмония у детей: как родителям распознать симптомы и что нужно делать
Пневмония у детей: как родителям распознать симптомы и что нужно делать — РИА Новости, 24.01.2022
Пневмония у детей: как родителям распознать симптомы и что нужно делать
Пневмония — это острое респираторное заболевание, поражающее легкие. Как распознать признаки заболевания у ребенка и как его лечить — в материале РИА Новости. РИА Новости, 24.01.2022
Как распознать признаки заболевания у ребенка и как его лечить — в материале РИА Новости. РИА Новости, 24.01.2022
2020-12-30T15:11
2020-12-30T15:11
2022-01-24T22:49
общество
грипп
здоровье
орви
медицина
россия
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/97521/90/975219076_0:104:2000:1229_1920x0_80_0_0_ae6c7417565eb68b12060416c1de5344.jpg
МОСКВА, 30 дек – РИА Новости. Пневмония — это острое респираторное заболевание, поражающее легкие. Как распознать признаки заболевания у ребенка и как его лечить — в материале РИА Новости.Симптомы пневмонииПневмония — это острое респираторное заболевание нижних дыхательных путей, которое также называют воспалением легких. У несовершеннолетних иммунитет еще недостаточно развит, и для малышей до 5 лет патология может быть особенно опасна. Наиболее характерные симптомы пневмонии у детей:Иногда симптомы могут быть не столь яркими — субфебрильная температура и несильный кашель. Для грудничков характерны отказ от груди или смеси, понос, малыш часто срыгивает. Режим дня нарушается — ребенок или постоянно спит, или, наоборот, отказываться от сна, капризничает.Специалист решит, можно лечить воспаление легких дома или необходимо положить ребенка в больницу. Показания для госпитализации: Причины и возбудители пневмонииПо причине возникновения выделяют два типа пневмонии. Первичная — вызванная непосредственно контактом с микроорганизмами или вирусами-возбудителями. Вторичная — развившаяся на фоне тех или иных врожденных и хронических заболеваний — патологии бронхов, деформации грудной клетки и т.д. Окончательный диагноз при симптомах пневмонии у ребенка можно установить только по рентгеновскому снимку легких. Общий анализ крови позволит определить тип возбудителя, вирус это или бактерия.При бактериальном воспалении легких доктор назначает антибиотики. Если конкретный препарат не подействовал в течение 2-3 дней (при лечении пневмонии у ребенка симптомы не облегчаются, температура тела не снижается), его могут заменить на другой, но в каждом конкретном случае решается индивидуально.
Для грудничков характерны отказ от груди или смеси, понос, малыш часто срыгивает. Режим дня нарушается — ребенок или постоянно спит, или, наоборот, отказываться от сна, капризничает.Специалист решит, можно лечить воспаление легких дома или необходимо положить ребенка в больницу. Показания для госпитализации: Причины и возбудители пневмонииПо причине возникновения выделяют два типа пневмонии. Первичная — вызванная непосредственно контактом с микроорганизмами или вирусами-возбудителями. Вторичная — развившаяся на фоне тех или иных врожденных и хронических заболеваний — патологии бронхов, деформации грудной клетки и т.д. Окончательный диагноз при симптомах пневмонии у ребенка можно установить только по рентгеновскому снимку легких. Общий анализ крови позволит определить тип возбудителя, вирус это или бактерия.При бактериальном воспалении легких доктор назначает антибиотики. Если конкретный препарат не подействовал в течение 2-3 дней (при лечении пневмонии у ребенка симптомы не облегчаются, температура тела не снижается), его могут заменить на другой, но в каждом конкретном случае решается индивидуально. Курс антибиотиков обычно длится 7 — 10 дней.Вирусная пневмония характеризуется слабыми проявлениями симптомов. Ее возбудители — вирусы гриппа, парагриппа, аденовирусы, риновирусы, вирусы кори и ветряной оспы. Педиатр-пульмонолог детской клиники «РебенОК» Мария Маслова пояснила РИА Новости, что антибиотики применяются и при вирусных пневмониях, т.к. в чистом виде этот тип заболевания встречаются редко. При высокой температуре для ее снижения показан прием жаропонижающих средств, для разжижения мокроты и более легкого ее отделения — отхаркивающие и муколитические препараты, помогающие бронхам очищаться от накопившейся слизи. При воспалении легких человек сильно потеет, поэтому необходимо восполнять потерю жидкости обильным питьем.При пневмония ребенок не должен постоянно лежать, отмечает Мария Маслова. Осложнения при пневмонииНесвоевременное обращение к врачу или неправильно назначенный курс лечения чреват осложнениями. Среди них: плеврит – скопление жидкости в легких; легочный абсцесс – застой гноя в дыхательной системе; сепсис — заражение крови; заболевания сердца; анемия.
Курс антибиотиков обычно длится 7 — 10 дней.Вирусная пневмония характеризуется слабыми проявлениями симптомов. Ее возбудители — вирусы гриппа, парагриппа, аденовирусы, риновирусы, вирусы кори и ветряной оспы. Педиатр-пульмонолог детской клиники «РебенОК» Мария Маслова пояснила РИА Новости, что антибиотики применяются и при вирусных пневмониях, т.к. в чистом виде этот тип заболевания встречаются редко. При высокой температуре для ее снижения показан прием жаропонижающих средств, для разжижения мокроты и более легкого ее отделения — отхаркивающие и муколитические препараты, помогающие бронхам очищаться от накопившейся слизи. При воспалении легких человек сильно потеет, поэтому необходимо восполнять потерю жидкости обильным питьем.При пневмония ребенок не должен постоянно лежать, отмечает Мария Маслова. Осложнения при пневмонииНесвоевременное обращение к врачу или неправильно назначенный курс лечения чреват осложнениями. Среди них: плеврит – скопление жидкости в легких; легочный абсцесс – застой гноя в дыхательной системе; сепсис — заражение крови; заболевания сердца; анемия. Рассказы о течении пневмония у ребенка на форумах в Интернете содержат и такие истории.Профилактика пневмонииДля снижения риска развития патологии нужно проводить закаливание, рацион должен включать необходимые витамины и микроэлементы. Следует своевременно лечить респираторные и вирусные заболевания, избегать переохлаждения в холодное время года и одеваться по погоде, важно соблюдать режим проветривания и уборки помещений. Для профилактика пневмонии у детей во время подъема заболеваемости следует избегать контакта с больными и носить маску, а также соблюдать гигиену рук. При первых признаках заболевания нужно незамедлительно обратиться к врачу.Также ребенку стоит сделать все необходимые прививки. Компьютерная томография органов грудной полостиОбычно при подозрении на воспаление легких пациенту выполняют рентгенограмму. Если на флюорографии обнаруживаются при пневмонии у детей признаки болезни, которые требуют дальнейшего изучения, следующим этапом обследования служит КТ грудной клетки.
Рассказы о течении пневмония у ребенка на форумах в Интернете содержат и такие истории.Профилактика пневмонииДля снижения риска развития патологии нужно проводить закаливание, рацион должен включать необходимые витамины и микроэлементы. Следует своевременно лечить респираторные и вирусные заболевания, избегать переохлаждения в холодное время года и одеваться по погоде, важно соблюдать режим проветривания и уборки помещений. Для профилактика пневмонии у детей во время подъема заболеваемости следует избегать контакта с больными и носить маску, а также соблюдать гигиену рук. При первых признаках заболевания нужно незамедлительно обратиться к врачу.Также ребенку стоит сделать все необходимые прививки. Компьютерная томография органов грудной полостиОбычно при подозрении на воспаление легких пациенту выполняют рентгенограмму. Если на флюорографии обнаруживаются при пневмонии у детей признаки болезни, которые требуют дальнейшего изучения, следующим этапом обследования служит КТ грудной клетки. Компьютерную томографию назначают, чтобы выявить осложнения и для выбора дальнейшей тактики лечения. Этот метод более информативен и позволяет точнее визуализировать очаги поражения и патологические процессы, происходящие в легких. Врач может направить пациента на КТ, если лечение не дает результата и болезнь приобретает затяжной характер.Неправильное лечение при ОРВИ По некоторым данным, до 90% воспаления легких у детей возникают как осложнение какой-либо вирусной инфекции (ОРВИ, грипп и т. д.). Иногда, когда ребенок болеет ОРВИ, родители «выпрашивают» антибиотики для профилактики воспаления легких. Врач и телеведущий Евгений Комаровский предостерегает от приема антибиотиков при вирусной инфекции ради избежания осложнений — это может привести к обратному эффекту.
Компьютерную томографию назначают, чтобы выявить осложнения и для выбора дальнейшей тактики лечения. Этот метод более информативен и позволяет точнее визуализировать очаги поражения и патологические процессы, происходящие в легких. Врач может направить пациента на КТ, если лечение не дает результата и болезнь приобретает затяжной характер.Неправильное лечение при ОРВИ По некоторым данным, до 90% воспаления легких у детей возникают как осложнение какой-либо вирусной инфекции (ОРВИ, грипп и т. д.). Иногда, когда ребенок болеет ОРВИ, родители «выпрашивают» антибиотики для профилактики воспаления легких. Врач и телеведущий Евгений Комаровский предостерегает от приема антибиотиков при вирусной инфекции ради избежания осложнений — это может привести к обратному эффекту.
https://ria.ru/20201112/pnevmoniya-1584223658.html
https://ria.ru/20201113/pnevmoniya-1584517465.html
https://ria.ru/20201109/pneumonia-1583825956.html
https://ria.ru/20200424/1570493622.html
https://ria. ru/20201215/pnevmoniya-1589255097.html
ru/20201215/pnevmoniya-1589255097.html
россия
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/97521/90/975219076_113:0:1888:1331_1920x0_80_0_0_345d592eb95aeaa91f1d89467336f863.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
internet-group@rian.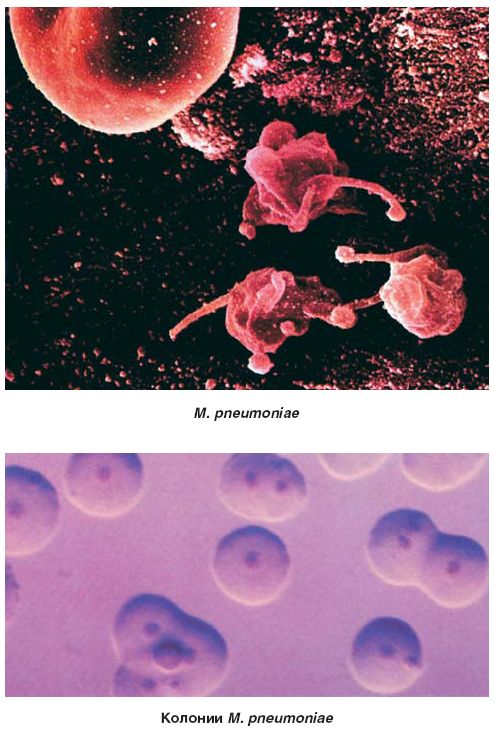 ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
общество, грипп, здоровье, орви, медицина, россия
МОСКВА, 30 дек – РИА Новости. Пневмония — это острое респираторное заболевание, поражающее легкие. Как распознать признаки заболевания у ребенка и как его лечить — в материале РИА Новости.
Симптомы пневмонии
Пневмония — это острое респираторное заболевание нижних дыхательных путей, которое также называют воспалением легких. У несовершеннолетних иммунитет еще недостаточно развит, и для малышей до 5 лет патология может быть особенно опасна.
12 ноября 2020, 09:45
Роспотребнадзор перечислил наиболее подверженные пневмонии группы россиянНаиболее характерные симптомы пневмонии у детей:
—
температура повышается до 39°;—
хрипы в легких;—
кожные покровы бледные;—
одышка;—
дети старшего возраста могут отплевывать мокроту, которая иногда имеет «ржавый» оттенок;—
потливость;—
при пневмонии у детей симптомы дополняются признаками интоксикации — слабостью, вялостью, апатичностью, отсутствием аппетита, головной болью, тошнотой.
—
в тяжелых случаях признаки пневмонии у ребенка включают кашель, сопровождающийся болезненными ощущениями в груди.
Иногда симптомы могут быть не столь яркими — субфебрильная температура и несильный кашель. Для грудничков характерны отказ от груди или смеси, понос, малыш часто срыгивает.
Режим дня нарушается — ребенок или постоянно спит, или, наоборот, отказываться от сна, капризничает.
При проявлении симптомов нужно обратиться в поликлинику, а при высокой температуре тела — вызвать доктора на дом. Признаки пневмонии у детей может точно распознать только врач, так как болезнь способна «маскироваться» под «обычные» ОРВИ, ОРЗ.Специалист решит, можно лечить воспаление легких дома или необходимо положить ребенка в больницу. Показания для госпитализации:
—
возраст до 1 года;—
тяжелая форма патологии;—
осложнения;—
поражение большого участка легкого.
Причины и возбудители пневмонии
По причине возникновения выделяют два типа пневмонии. Первичная — вызванная непосредственно контактом с микроорганизмами или вирусами-возбудителями. Вторичная — развившаяся на фоне тех или иных врожденных и хронических заболеваний — патологии бронхов, деформации грудной клетки и т.д.
Первичная — вызванная непосредственно контактом с микроорганизмами или вирусами-возбудителями. Вторичная — развившаяся на фоне тех или иных врожденных и хронических заболеваний — патологии бронхов, деформации грудной клетки и т.д.
Окончательный диагноз при симптомах пневмонии у ребенка можно установить только по рентгеновскому снимку легких. Общий анализ крови позволит определить тип возбудителя, вирус это или бактерия.
13 ноября 2020, 17:04Распространение коронавирусаМясников рассказал, как снизить риск возникновения пневмонииПри бактериальном воспалении легких доктор назначает антибиотики. Если конкретный препарат не подействовал в течение 2-3 дней (при лечении пневмонии у ребенка симптомы не облегчаются, температура тела не снижается), его могут заменить на другой, но в каждом конкретном случае решается индивидуально. Курс антибиотиков обычно длится 7 — 10 дней.
Вирусная пневмония характеризуется слабыми проявлениями симптомов. Ее возбудители — вирусы гриппа, парагриппа, аденовирусы, риновирусы, вирусы кори и ветряной оспы.
Педиатр-пульмонолог детской клиники «РебенОК» Мария Маслова пояснила РИА Новости, что антибиотики применяются и при вирусных пневмониях, т.к. в чистом виде этот тип заболевания встречаются редко.
9 ноября 2020, 20:53Распространение коронавирусаДоктор Комаровский развеял мифы о пневмонииПри высокой температуре для ее снижения показан прием жаропонижающих средств, для разжижения мокроты и более легкого ее отделения — отхаркивающие и муколитические препараты, помогающие бронхам очищаться от накопившейся слизи. При воспалении легких человек сильно потеет, поэтому необходимо восполнять потерю жидкости обильным питьем.При пневмония ребенок не должен постоянно лежать, отмечает Мария Маслова.
— Это ухудшает «вентилируемость» в легких. Если плохо, следует больше отдыхать, на этапе выздоровления можно и гулять. Пневмония — это заболевание, передающееся воздушно-капельным путем, через предметы заразиться очень трудно. Соответственно, показаны изоляция больного, проветривание, использование ультрафиолетовых облучателей-рециркуляторов, — пояснила эксперт.
Осложнения при пневмонии
Несвоевременное обращение к врачу или неправильно назначенный курс лечения чреват осложнениями. Среди них: плеврит – скопление жидкости в легких; легочный абсцесс – застой гноя в дыхательной системе; сепсис — заражение крови; заболевания сердца; анемия. Рассказы о течении пневмония у ребенка на форумах в Интернете содержат и такие истории.
24 апреля 2020, 03:15Распространение коронавирусаВ Минздраве рассказали о необычном течении пневмонии при коронавирусеПрофилактика пневмонии
Для снижения риска развития патологии нужно проводить закаливание, рацион должен включать необходимые витамины и микроэлементы. Следует своевременно лечить респираторные и вирусные заболевания, избегать переохлаждения в холодное время года и одеваться по погоде, важно соблюдать режим проветривания и уборки помещений.
Для профилактика пневмонии у детей во время подъема заболеваемости следует избегать контакта с больными и носить маску, а также соблюдать гигиену рук.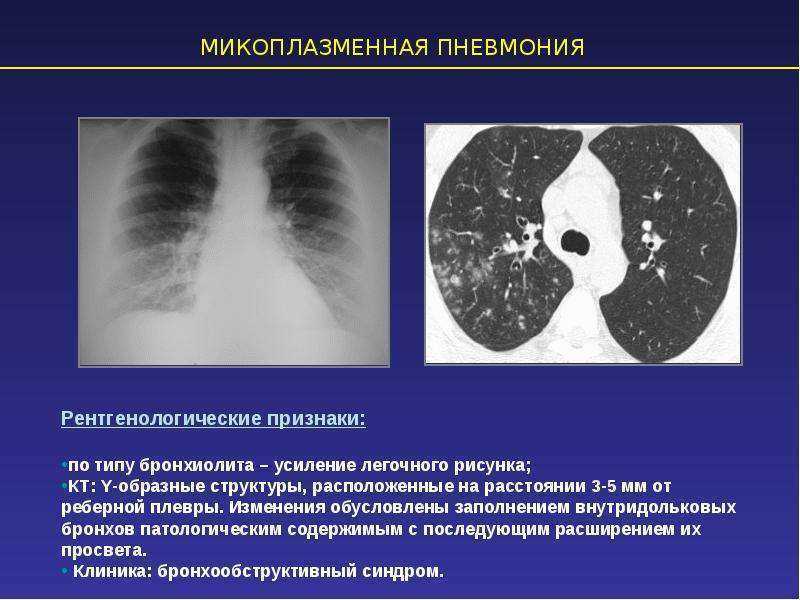 При первых признаках заболевания нужно незамедлительно обратиться к врачу.
При первых признаках заболевания нужно незамедлительно обратиться к врачу.
Также ребенку стоит сделать все необходимые прививки.
Компьютерная томография органов грудной полости
Обычно при подозрении на воспаление легких пациенту выполняют рентгенограмму. Если на флюорографии обнаруживаются при пневмонии у детей признаки болезни, которые требуют дальнейшего изучения, следующим этапом обследования служит КТ грудной клетки.
Компьютерную томографию назначают, чтобы выявить осложнения и для выбора дальнейшей тактики лечения. Этот метод более информативен и позволяет точнее визуализировать очаги поражения и патологические процессы, происходящие в легких.
Врач может направить пациента на КТ, если лечение не дает результата и болезнь приобретает затяжной характер.
15 декабря 2020, 09:11
Москва открыла сервис оценки тяжести пневмонии по анализу кровиНеправильное лечение при ОРВИ
По некоторым данным, до 90% воспаления легких у детей возникают как осложнение какой-либо вирусной инфекции (ОРВИ, грипп и т. д.). Иногда, когда ребенок болеет ОРВИ, родители «выпрашивают» антибиотики для профилактики воспаления легких. Врач и телеведущий Евгений Комаровский предостерегает от приема антибиотиков при вирусной инфекции ради избежания осложнений — это может привести к обратному эффекту.Уреаплазмоз и микоплазмоз у женщин и мужчин — симптомы и лечение, причины, признаки заболевания
Лечение уреаплазмы назначается при начале воспалительного процесса, спровоцированного этими патогенными микроорганизмами. Они паразитируют в органах мочеполовой системы и дыхательных путях. Чаще всего заражение происходит при незащищенном половом контакте. Как правило, инфицирование происходит после незащищенного секса, однако в медицинской практике иногда встречаются случаи, когда симптомы уреоплазмоза проявляются без очевидных причин, то есть бытовое заражение также возможно.
В женском организме возбудитель размножается на слизистой оболочке внутренних и наружных половых органов. Основными очагами патологии, требующими лечения уреаплазмы, становятся бартолиновые железы, влагалище и мочеиспускательный канал.
Возможные рискиПри несвоевременном лечении уреаплазмы у женщин наблюдается постепенное распространение инфекции и возникновение риска бесплодия. У беременных присутствует вероятность септического аборта на фоне воспалительных процессов в органах мочеполовой системы, а также развития различных патологий у плода.
Диагностика и лечение уреаплазмы у женщин затрудняется отсутствием симптомов до появления осложнений в запущенных стадиях. Скрытое течение наблюдается в большинстве клинических случаев, что приводит к поздним обращениям за профильной медицинской помощью. Провоцирующим фактором для появления очевидных признаков, которые указывают на потребность в лечении уреаплазмы, может стать сильный стресс, смена климата и др.
Скрытое течение наблюдается в большинстве клинических случаев, что приводит к поздним обращениям за профильной медицинской помощью. Провоцирующим фактором для появления очевидных признаков, которые указывают на потребность в лечении уреаплазмы, может стать сильный стресс, смена климата и др.
Необходимо сдать анализы на возбудителя заболевания и при постановке на учет по беременности. Своевременное лечение уреаплазмы у женщин, находящихся на раннем сроке, устраняет риск внутриутробных патологий, поражений дыхательных органов и низкого веса у новорожденных.
Микоплазмоз:Диагностика,Симптомы,Диагностика | doc.ua
Известно более 16-ти различных видов микоплазмы, для которых организм человека – нормальная среда обитания. Десять из них находятся в ротовой полости, а шесть – на слизистых половых органов и мочевыводящей системе. Некоторые из них:
- Мycoplasma hominis, Мycoplasma genitalium – это наиболее изученный вид бактерий;
- Ureaplasma urealyticum – возбудители уреаплазмоза;
- Mycoplasma pneumoniae, Mycoplasma fermentans, Mycoplasma penetrans, Mycoplasma pirum, Mycoplasma amphoriforme;
- Mycoplasma primatum, Mycoplasma spermatophilum – любопытны лишь с научной точки зрения.
 На данный момент слабо изучены.
На данный момент слабо изучены.
Перечисленные возбудители вызывают заболевание микоплазмоз, причины которого заключаются в активном развитии и размножении бактерий.
Обычно более агрессивное поведение микоплазм происходит при неблагоприятном воздействии внешней среды, которое приводит к ослаблению защитных функций иммунной системы.
Диагностика
Диагностика микоплазмоза включает себя несколько стадий. Это зависит от того, какой именно возбудитель вызвал заболевание. При заражении Ureaplasma urealyticum может возникнуть урогенитальный микоплазмоз, лечением которого должен заниматься врач – уролог или венеролог. При заражении бактерией Mycoplasma pneumoniae – возможно ОРЗ или воспаление легких. Соответственно, специалист, который будет проводить диагностику и лечение микоплазмоза – фтизиатр или терапевт.
Тем не менее, есть ряд необходимых методов диагностики, которые целесообразно использовать при заболевании любым из видов микоплазмоза.
Для начала необходимо составить анамнез и клиническую картину, исходя из оценки жалоб, образа жизни, причин, связанных с проявлением заболевания.
Лабораторные исследования должны включать в себя анализ ПЦР (полимеразная цепная реакция). Исследуемый материал – мокрота или мазок с пораженного участка (органа).
Также для диагностики микоплазмоза используют иммуноферментный анализ и прямую иммунофлюоресценцию. Точность при таком исследовании колеблется от 50 % до 70 %.
Микоплазмоз, симптомы которого могут быть различны в связи с разнообразием видов данной бактерии, невозможно идентифицировать без лабораторной диагностики.
Осложнения
Признаки микоплазмоза чаще всего себя никак не проявляют и абсолютно не влияют на качество жизни носителя. Но при определенных воздействиях может возникнуть целый ряд заболеваний, лечить которые будет необходимо. В зависимости от вида микоплазмы могут возникнуть различные заболевания. К их числу можно отнести:
- уретрит;
- пиелонефрит;
- эндометрит;
- простатит;
- аднексит;
- хирургические раневые инфекции;
- ОРЗ;
- бактериемия;
- пневмония;
- менингит;
- инфекционный артрит и т.
 д.
д.
Именно поэтому своевременная диагностика необходима при подозрении на возможность инфицирования микоплазмой.
Симптомы
Микоплазмоз у мужчин и женщин находится в инкубационном периоде от нескольких дней до двух месяцев. Может долгий промежуток времени не проявлять никаких симптомов. Один из основных, на что необходимо обратить внимание – появление прозрачных выделений из уретры, дискомфорта, а возможно, и болезненных ощущений во время полового акта и при мочеиспускании, наружный мочеиспускательный канал приобретает красноватый цвет. Возможно появление зуда. Если отсутствует адекватное лечение, то возникают осложнения, которые выражаются болевыми ощущениями в мошонке и промежности, в поясничном отделе и в прямой кишке. Возможны высыпания на коже. Микоплазма у мужчин может привести к воспалению мочеиспускательного канала и развитию уретрита, в дальнейшем – к острому или хроническому пиелонефриту. Нарушается работа всей мочеполовой системы, что может повлиять на репродуктивные функции организма.
Микоплазмоз у женщин, также, как и у мужчин, длительное время может себя никак не проявлять. Характерно то, что статистика утверждает о наиболее частом проявлении заболевания у женщин, по сравнению с мужчинами. Возможность заражения, в основном, во время полового акта. Но есть возможность заразиться через полотенца, постельное белье, гинекологический инструмент и пр. Именно этим объясняются случаи заражения девушек бактерией Mycoplasma hominis, которые никогда не имели половой контакт. По статистике, таких случаев от 8 до 17 %.
Если бактерия микоплазмы поразила только наружные гениталии, то, как правило, никаких ощущений не возникает. Разве что иногда легкий зуд наружных половых органов и незначительные бесцветные выделения. Соответственно, пациент не обращается к гинекологу. Микоплазмоз, при благоприятных для бактерий условиях, перейдет в хроническую форму течения заболевания и неопределенное время может не проявлять никаких симптомов. Но во время снижения иммунитета обостряются и хронические заболевания. Зуд наружных половых органов переходит в жжение, количество выделений значительно увеличивается. Как правило, именно тогда, женщина обращается к специалисту.
Зуд наружных половых органов переходит в жжение, количество выделений значительно увеличивается. Как правило, именно тогда, женщина обращается к специалисту.
В случае, когда бактерии микоплазмы поразили внутренние половые органы, женщина испытывает жжение и зуд во время мочеиспускания, непривычные выделения в достаточно большом объеме, часто регулярные тянущие боли внизу живота или поясничного отдела спины. Это сопровождается нарушением менструального цикла, слабостью, возможно повышение температуры тела.
Респираторный микоплазмоз или первичная атипичная пневмония – инфекционное заболевание органов дыхания. Это инфекция, передающаяся воздушно-капельным путем, в которой возбудителем является Mycoplasma pneumoniae. Чаще всего это заболевание встречается у детей старше пятилетнего возраста. Инкубационный период заболевания варьируется от пяти дней до месяца. Симптомы идентичны ОРЗ с возможными осложнениями. К ним относят повышение температуры тела, насморк, кашель (часто сухой, изнуряющий), боль или першение в горле, боль в суставах, расстройство функционирования ЖКТ. В легких определяется жесткое дыхание с неспецифическими хрипами. Выявить возбудителя возможно исключительно с помощью лабораторной диагностики. Для этого применяют анализ мокроты в содержимом носоглотки методом ПЦР. Также рекомендована консультация пульмонолога и инфекциониста.
В легких определяется жесткое дыхание с неспецифическими хрипами. Выявить возбудителя возможно исключительно с помощью лабораторной диагностики. Для этого применяют анализ мокроты в содержимом носоглотки методом ПЦР. Также рекомендована консультация пульмонолога и инфекциониста.
Причины
Как правило, заболевание передается половым путем. Бытовое заражение микоплазмой фактически невозможно.
Инкубационный период может длиться, в среднем, от нескольких дней до двух месяцев.
Особая опасность заболевания кроется в длительном бессимптомном течении. Возможна передача заболевания от носителя половым путем. Осложнение может проявить себя в нарушении детородных функций организма женщины. Именно поэтому заболевание часто обнаруживают при обследовании, которое вызвано проблемой бесплодия или после безрезультатных попыток выносить плод.
Микоплазмоз при беременности очень опасен. Его последствиями могут стать выкидыши, преждевременные роды, раннее отхождение околоплодных вод. Во время родов может заразиться сам ребенок, а у роженицы может начаться лихорадка. Несмотря на то, что урогенитальный микоплазмоз передается половым путем, ребенок может заразиться в утробе матери или во время родов, в случае, когда мать является носителем заболевания. Тогда необходимо пройти курс терапии матери и ребенка.
Во время родов может заразиться сам ребенок, а у роженицы может начаться лихорадка. Несмотря на то, что урогенитальный микоплазмоз передается половым путем, ребенок может заразиться в утробе матери или во время родов, в случае, когда мать является носителем заболевания. Тогда необходимо пройти курс терапии матери и ребенка.
Лечение микоплазмоза у детей чаще всего симптоматическое. В случаях, если ребенок слаб или повышена вероятность рецидивирования, рекомендуется пройти курс соответствующей терапии, с использованием антибиотиков, к которым чувствительны бактерии.
В аптеках Киева цены на препараты для лечения заболевания могут отличаться в цене. Чтобы узнать отличия и найти аптеку рядом, где есть нужные товары, можно воспользоваться нашим сайтом поиска лекарств.
Профилактика внебольничной пневмонии
Внебольничная пневмония (воспаление легких) – это острое инфекционное заболевание, при котором в воспалительный процесс
вовлекаются легкие. Внебольничная пневмония является достаточно распространенным заболеванием в нашей стране. За последние
2 года наблюдается рост количества заболеваний во всех регионах России.
За последние
2 года наблюдается рост количества заболеваний во всех регионах России.
Обычно внебольничные пневмонии развиваются в период подъема заболеваемости ОРВИ и гриппом, но заболеваемость может регистрироваться в любое время года, даже летом.
Основная группа микроорганизмов, способных вызвать внебольничные пневмонии: пневмококк, легочные микоплазмы, гемофильная палочка, клебсиелла, легочные хламидофилы, легионелла, респираторные вирусы.
Некоторые возбудители имеют свои особенности в плане источников заражения или течения заболевания. Часто пневмонию вызывают два и более возбудителя (например, пневмококк, легочная микоплазма и респираторный вирус).
Источником инфекции является больной человек с признаками инфекции дыхательных путей, а так
же люди с бессимптомным течением инфекции, без клинических симптомов заболевания.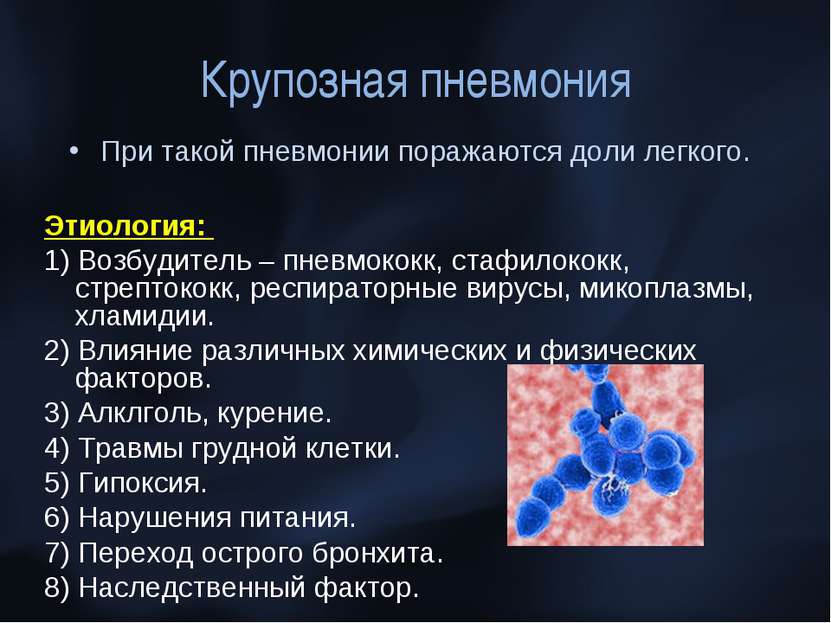
Основной путь передачи – воздушно-капельный (при чихании, кашле, разговоре, дыхании). Источником заражения при хламидийной пневмонии может быть птица (попугаи, куры, утки). Легионелла может «проживать» в кондиционерах при неправильном уходе за ними. Микоплазмоз дыхательных путей – частое инфекционное заболевание, вызывающееся микробом, распространяющимся в коллективах при тесном контакте с больным человеком. Нередко микоплазма вызывает пневмонию, сходную по течению с гриппом, но не переходящую в тяжелые формы болезни. При респираторной микоплазменной инфекции длительно беспокоит сухой кашель, могут возникать повышение температуры, одышка.
В типичных случаях внебольничная пневмония проявляется следующими симптомами: повышение температуры тела, озноб, кашель,
который сначала может быть сухим, а потом стать влажным с отделением мокроты, одышка – ощущение затруднения при дыхании,
боли в грудной клетке. Также больного могут беспокоить общие симптомы, особенно при тяжелых случаях: резкая слабость, отсутствие
аппетита.
Также больного могут беспокоить общие симптомы, особенно при тяжелых случаях: резкая слабость, отсутствие
аппетита.
К сожалению, из-за особенностей самих микроорганизмов, а также и по причине неправильного бесконтрольного применения антибиотиков, например, при острых вирусных респираторных заболеваниях (ОРВИ или ОРЗ), многие бактерии приобретают устойчивость к ряду антибиотиков. Лечение пневмонии назначает только врач!
При пневмонии, вызванной «атипичным возбудителем» (легочной микоплазмой, легочными хламидофилами) может отсутствовать лихорадка, общее состояние может быть нетяжелым, но проявления легочной недостаточности – одышка, усиление сердцебиения, слабость, снижение аппетита должны насторожить заболевшего.
Для профилактики пневмонии важно проводить мероприятия по предупреждению респираторных вирусных инфекций:
1. Соблюдайте гигиену рук. Мойте руки водой с мылом как можно чаще, особенно после
кашля или чихания, перед едой и по возвращению домой из детского сада, школы, с работы. При невозможности вымыть руки эффективными
являются средства для обработки рук на основе спирта (салфетки, спреи).
Соблюдайте гигиену рук. Мойте руки водой с мылом как можно чаще, особенно после
кашля или чихания, перед едой и по возвращению домой из детского сада, школы, с работы. При невозможности вымыть руки эффективными
являются средства для обработки рук на основе спирта (салфетки, спреи).
2. Прикрывайте рот и нос бумажной салфеткой во время кашля или чихания, а не руками.
3. Ведите здоровый образ жизни: занимайтесь физкультурой и спортом, совершайте частые прогулки на свежем воздухе. Не курите в помещении, где могут находиться люди: пассивное курение пагубно сказывается на функции бронхов и иммунитете.
4. Питание должно быть здоровым и полноценным, с достаточным содержанием белков, микроэлементов и витаминов (ежедневно в рационе должны быть свежие овощи, фрукты, мясо, рыба, молоко и молочные продукты).
5. До наступления
холодов и подъема заболеваемости респираторными инфекциями сделайте прививку против гриппа, поскольку пневмония часто является
осложнением гриппа.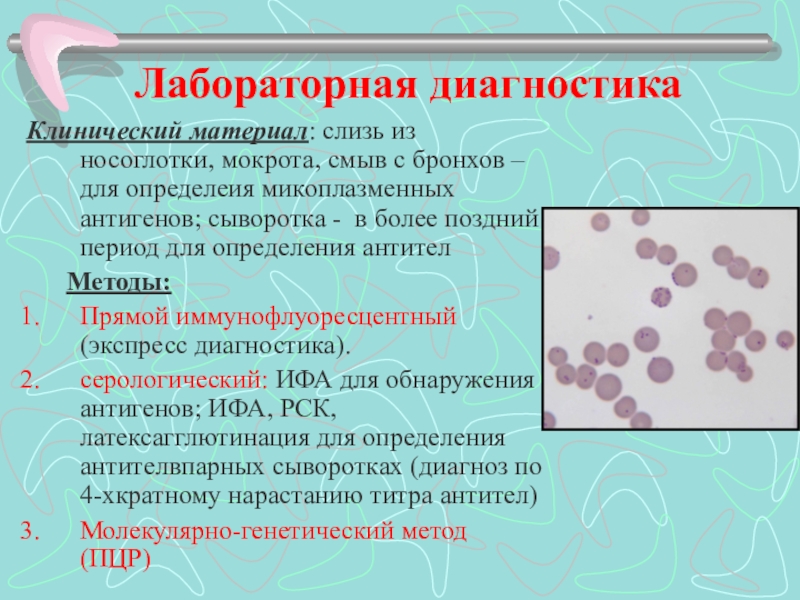 Помните, что привитые люди тоже могут болеть пневмонией, но заболевание у них протекает легче, чем у не
привитых.
Помните, что привитые люди тоже могут болеть пневмонией, но заболевание у них протекает легче, чем у не
привитых.
6. В холодное время года одевайтесь по погоде, избегайте переохлаждения, сквозняков.
7. Соблюдайте режимы проветривания и влажной уборки в помещениях.
8. В период подъема респираторной заболеваемости избегайте контакта с больными людьми, используйте маску для защиты органов дыхания, воздержитесь от посещения мест с большим скоплением людей.
9. Возможен прием укрепляющих иммунитет препаратов, однако назначить их должен врач.
10. Помните, что часто родители являются источником инфекции для ребенка, особенно при тех заболеваниях, которые передаются при тесном контакте (микоплазменная респираторная инфекция, золотистый стафилококк, многие вирусные инфекции).
11. Если у вас дома или в учреждении, где
Вы пребываете длительное время, есть кондиционер, следите за его чистотой.
ВАЖНО:
Если заболели Вы или
Ваш ребенок, необходимо не вести ребенка в сад, школу, а обратиться к врачу!
При плохом самочувствии заболевшего, при
повышении температуры вызывайте врача на дом!
При тяжелом состоянии заболевшего необходимо вызвать скорую медицинскую
помощь.
Ни в коем случае не занимайтесь самолечением.
Здоровья Вам и Вашим близким!
Микоплазменная инфекция у детей
Ежегодно в осенне-зимний период отмечается повышение заболеваемости острыми респираторными заболеваниями (ОРЗ). В России ежегодно регистрируют от 27,3 до 41,2 млн заболевших гриппом и другими ОРВИ. Наиболее часто от инфекций страдают дети, особенно в возрасте от 3 до 14 лет. Несмотря на то, что большинство детей способны справиться с инфекцией с помощью защитных сил собственного организма, они болеют чаще, чем взрослые, и имеют высокую вероятность развития осложнений.
Наиболее тяжелым проявлением ОРЗ является пневмония. В 2016 г. в Российской Федерации зарегистрировано на 23,8% больше случаев внебольничных пневмоний (ВП), чем в 2015 г. Средний по стране показатель заболеваемости составил 418,3 на 100 тыс. населения против 337,8 в 2015 г.
Высокая распространенность пневмоний сочетается с высокой смертностью детей от этого заболевания во всем мире. Так, по данным ВОЗ, в 2015 г. от пневмонии умерли 920 136 детей в возрасте до 5 лет, что составляет 15% всех случаев смерти детей этого возраста. Причин такой неблагополучной статистики немало. Среди них можно выделить факторы, непосредственно определяющие тяжесть инфекционного процесса, и факторы, косвенно влияющие на течение заболевания. Так, особенности возбудителя, поздняя диагностика, повторные нерациональные курсы антимикробной терапии, состояние иммунной системы пациентов во многом определяют течение заболевания, в то время как воздействие внешних факторов (экологических, социальных) может способствовать возникновению рекуррентных инфекций и персистенции микроорганизмов.
Этиология
Большое внимание в настоящее время уделяется изучению значения различных микроорганизмов при респираторных заболеваниях. Понимание их этиологической и патогенетической роли в возникновении патологических симптомов очень важно для своевременной диагностики и рациональной терапии ОРЗ.
Особенно важно понимание вклада атипичных патогенов в структуру ОРЗ. К этой группе чаще всего относятся Mycoplasma pneumoniae, Legionella spp. (прежде всего Legionella pneumophila), Chiamydophila (Chlamydia), Coxieila burnetti (возбудитель Q-лихорадки), респираторные вирусы (вирусы гриппа А и В, респираторный синцитиальный вирус), а также более редко встречающиеся микроорганизмы: возбудители туляремии (Francisella tularensis), лептоспироза (Leptospira spp.), хантавирусы, хламидиеподобный «возбудитель I». В современной медицинской литературе более распространена лаконичная трактовка термина «атипичные возбудители», включающая только М. pneumoniae, Chiamydophila pneumoniae и Legionella spp.
pneumoniae, Chiamydophila pneumoniae и Legionella spp.
Наибольшее значение при ОРЗ у детей из данной группы патогенов имеет М. pneumoniae. Данный микроорганизм может вызывать воспаление как верхних, так и нижних дыхательных путей. В человеческой популяции респираторный микоплазмоз составляет 10-16% всех случаев ОРЗ. Эти цифры в период эпидемических вспышек могут достигать 30 40%. Согласно данным литературы, М. pneumoniae вызывает до 40% ВП у детей и около 18% инфекций у пациентов, нуждающихся в госпитализации. Необходимо отметить возрастные особенности распространенности данного патогена у детей. Наиболее часто М. pneumoniae выявляется у детей старше 5-летнего возраста. В ходе эпидемиологического исследования, проведенного в США в 2010-2012 гг. с целью определения этиологического фактора ВП у 2222 детей, М. pneumoniae была выявлена у 19% детей в возрасте старше 5 лет и у 3% детей младше 5 лет.
Таким образом, М. pneumoniae имеет большое значение в генезе ОРЗ и ВП в детском возрасте. Однако этиологическая диагностика, имеющая решающее значение для выбора рациональной терапии данной инфекции, является сложной задачей для практического здравоохранения и часто запаздывает на длительное время. Обусловлено это особенностями строения и жизнедеятельности микроорганизма, которые определяют своеобразную клиническую картину, течение заболевания и иммунный ответ пациента на данную инфекцию.
Однако этиологическая диагностика, имеющая решающее значение для выбора рациональной терапии данной инфекции, является сложной задачей для практического здравоохранения и часто запаздывает на длительное время. Обусловлено это особенностями строения и жизнедеятельности микроорганизма, которые определяют своеобразную клиническую картину, течение заболевания и иммунный ответ пациента на данную инфекцию.
Особенности Mycoplasma pneumoniae
Первые сведения о микоплазмах были опубликованы Nocard и Roux в 1898 г. Они выделили контагиозную культуру плевропневмонии крупного рогатого скота и стали изучать эту группу патогенов, объединенных однотипными биологическими свойствами, назвав их «плевропневмониеподобные микроорганизмы». В 1929 г. Novae предложил назвать эту группу микроорганизмов «микоплазмой». С 1956 г. было установлено, что данные микроорганизмы являются фильтрующимися, не имеющими клеточной стенки.
Изучение микоплазм как патогенов человеческого организма началось с 1942 г. Тогда из мокроты больного атипичной пневмонией человека M.D. Eaton впервые выделил возбудитель, который был отнесен к вирусам и длительное время назывался по имени исследователя – «агент Eaton». Главными особенностями этого агента были малые размеры, он свободно проходил через фильтры и был не способен расти на стандартных биологических средах. Изначально его рассматривали как вирус. Однако вирусная природа его была опровергнута в связи с губительным действием на него антибактериальных препаратов – хлортетрациклина и стрептомицина. Только в 1963 г. были окончательно определены свойства данного микроорганизма, и он был назван Mycoplasma pneumoniae.
Тогда из мокроты больного атипичной пневмонией человека M.D. Eaton впервые выделил возбудитель, который был отнесен к вирусам и длительное время назывался по имени исследователя – «агент Eaton». Главными особенностями этого агента были малые размеры, он свободно проходил через фильтры и был не способен расти на стандартных биологических средах. Изначально его рассматривали как вирус. Однако вирусная природа его была опровергнута в связи с губительным действием на него антибактериальных препаратов – хлортетрациклина и стрептомицина. Только в 1963 г. были окончательно определены свойства данного микроорганизма, и он был назван Mycoplasma pneumoniae.
Согласно современной номенклатуре, микроорганизм М. pneumoniae относится к роду Mycoplasma, семейству Mycoplasmataceae, порядку Mycoplasmatales, классу Mollicutes. Среди семейства Mycoplasmataceae в патогенезе инфекций человека общепризнанной является роль 4-х основных видов микоплазм. К ним относятся М. pneumoniae, которая является частым возбудителем респираторных инфекций, М. genitalium, М. hominis и U. urealyticum вызывают инфекции мочеполового тракта. Последние два возбудителя также могут быть причиной инфекций у новорожденных.
genitalium, М. hominis и U. urealyticum вызывают инфекции мочеполового тракта. Последние два возбудителя также могут быть причиной инфекций у новорожденных.
Согласно результатам ряда исследований, развитие и распространение микоплазменной инфекции носят эпидемический характер. Вспышки возникают с интервалами от 3 до 7 лет и продолжаются в течение 1 -3 лет с пиками заболеваемости в осенний и зимний период. Предположительно этот факт обусловлен наличием как минимум 2-х основных подтипов М. pneumoniae, которые часто выделяют при клинических исследованиях. Вместе с этим в последние годы все больше внимания уделяется внешним факторам (климатическим изменениям), влияющим на сезонность циркуляции М. pneumoniae в естественных условиях в различных географических зонах.
Многочисленными исследованиями установлено, что микоплазмы по своим структурным свойствам находятся как бы между вирусами и бактериями. С одной стороны, возможность расти на бесклеточной среде и чувствительность к некоторым антибиотикам приближают их к бактериям. С другой стороны, по размерам генома и склонности к внутриклеточному паразитизму они похожи на вирусы. Малые размеры данного микроорганизма позволяют ему широко распространяться воздушно-капельным путем. Хорошо известна способность этих патогенов преодолевать слизистые барьеры дыхательных путей, сливаться с клетками хозяина и выживать внутриклеточно. Нередко даже после лечения антибактериальными препаратами М. pneumoniae способны синтезировать собственную ДНК и размножаться, что приводит к латентному, хроническому течению микоплазменной инфекции.
С другой стороны, по размерам генома и склонности к внутриклеточному паразитизму они похожи на вирусы. Малые размеры данного микроорганизма позволяют ему широко распространяться воздушно-капельным путем. Хорошо известна способность этих патогенов преодолевать слизистые барьеры дыхательных путей, сливаться с клетками хозяина и выживать внутриклеточно. Нередко даже после лечения антибактериальными препаратами М. pneumoniae способны синтезировать собственную ДНК и размножаться, что приводит к латентному, хроническому течению микоплазменной инфекции.
Точный механизм внутриклеточной жизнедеятельности данного патогена до настоящего времени неизвестен, однако потенциал для цитоплазматической секвестрации объясняет трудность полного устранения М. pneumoniae. Согласно данным литературы, некоторые пациенты могут оставаться заразными в течение длительного времени, несмотря на исчезновение многих симптомов.
Характерной особенностью М. pneumoniae является отсутствие клеточной стенки, т. к. они не способны синтезировать жесткие пептидогликаны. Клетки микоплазмы окружены мембраной, покрытой снаружи капсулоподобным слоем. Мембрана содержит видоспецифический антиген. Отсутствием ригидной клеточной стенки обусловлена природная устойчивость М. pneumoniae к антибиотикам, действующим на мембрану бактериальной клетки. Эти микроорганизмы устойчивы ко всем бета-лактамным антибиотикам (пенициллинам, цефалоспоринам, карбапенемам) и гликопептидам (ванкомицину), полимиксину, рифампицину, сульфаниламидам, триметоприму и налидиксовой кислоте.
к. они не способны синтезировать жесткие пептидогликаны. Клетки микоплазмы окружены мембраной, покрытой снаружи капсулоподобным слоем. Мембрана содержит видоспецифический антиген. Отсутствием ригидной клеточной стенки обусловлена природная устойчивость М. pneumoniae к антибиотикам, действующим на мембрану бактериальной клетки. Эти микроорганизмы устойчивы ко всем бета-лактамным антибиотикам (пенициллинам, цефалоспоринам, карбапенемам) и гликопептидам (ванкомицину), полимиксину, рифампицину, сульфаниламидам, триметоприму и налидиксовой кислоте.
Отсутствием клеточной стенки обусловлены невысокая выживаемость М. pneumoniae вне организма-хозяина и повышенная чувствительность к факторам внешней среды. В силу нестойкости в окружающей среде инфицирование происходит лишь при тесном контакте между людьми. Поэтому часто очаги респираторного микоплазмоза бывают в семьях и организованных коллективах.
Таким образом, М. pneumoniae в силу своих структурных особенностей является мембранным паразитом. Промежуточное положение между вирусами и бактериями, способность паразитировать на мембране респираторного тракта, возможность саморепликации и длительной персистенции определяют патогенность М. pneumoniae для респираторного тракта человека и клиническую картину инфекции.
Промежуточное положение между вирусами и бактериями, способность паразитировать на мембране респираторного тракта, возможность саморепликации и длительной персистенции определяют патогенность М. pneumoniae для респираторного тракта человека и клиническую картину инфекции.
Заболевание начинается с попадания М. pneumoniae на слизистую респираторного тракта. Наиболее часто это происходит воздушно-капельным путем, через дыхательные пути. Уже через 24 ч после заражения начинается прилипание М. pneumoniae к эпителию респираторного тракта при помощи белка Р1 (антиген с молекулярной массой 169 кДа), который играет также большую роль в формировании иммунного ответа на патоген. Существование множественных вариаций белка PI М. pneumoniae объясняет кратковременность постинфекционного иммунитета при данной инфекции.
Как было указано ранее, М. pneumoniae является мембранным паразитом. После прикрепления к рецепторам и мембране эпителиоцитов дыхательных путей липидные компоненты мембраны микоплазмы диффундируют в клеточную мембрану хозяина, а стеролы клетки хозяина поступают в мембрану микоплазмы. В момент прикрепления клетка вытягивается и располагается между ресничками эпителиальных клеток, что позволяет микоплазмам колебаться вместе с ресничками и не выноситься с отгоняемой ресничками слизью. Расположение микоплазмы в инвагинатах клеточной мембраны и окружение ресничками эпителия защищают микоплазму от действия антител хозяина. После проникновения в клетки реснитчатого эпителия микоплазма размножается в их цитоплазме, образуя микроколонии. В фагоцитирующих клетках микоплазма может длительное время персистировать и заноситься в разные органы.
В момент прикрепления клетка вытягивается и располагается между ресничками эпителиальных клеток, что позволяет микоплазмам колебаться вместе с ресничками и не выноситься с отгоняемой ресничками слизью. Расположение микоплазмы в инвагинатах клеточной мембраны и окружение ресничками эпителия защищают микоплазму от действия антител хозяина. После проникновения в клетки реснитчатого эпителия микоплазма размножается в их цитоплазме, образуя микроколонии. В фагоцитирующих клетках микоплазма может длительное время персистировать и заноситься в разные органы.
Перекись водорода и супероксид, вырабатываемые М. pneumoniae, повреждают эпителий и приводят к воспалению. В последнее десятилетие исследования по изучению патогенности М. pneumoniae позволили выделить уникальный для микроорганизмов, специфический CARDS-токсин (community acquired respiratory distress syndrome toxin), который вызывает вакуолизацию клеток бронхиального эпителия и снижает двигательную активность ресничек. CARDS-токсин обладает прямым цитотоксическим действием на эпителий слизистой оболочки респираторного тракта и вызывает обширные зоны перибронхиального и периваскулярного воспаления. Была выявлена прямая зависимость между количеством CARDS-токсина, выделяемого М. pneumoniae, и тяжестью поражения легочной ткани. Анализ структуры указывает на то, что CARDS-токсин обладает сходством аминокислотной последовательности с экзотоксином Bordetella коклюша (коклюшный токсин). Цитотоксическое действие М. pneumoniae проявляется клинически сухостью в носу, першением в горле и сухим, отрывистым кашлем, которые обычно ассоциируются с ранней микоплазменной инфекцией.
Была выявлена прямая зависимость между количеством CARDS-токсина, выделяемого М. pneumoniae, и тяжестью поражения легочной ткани. Анализ структуры указывает на то, что CARDS-токсин обладает сходством аминокислотной последовательности с экзотоксином Bordetella коклюша (коклюшный токсин). Цитотоксическое действие М. pneumoniae проявляется клинически сухостью в носу, першением в горле и сухим, отрывистым кашлем, которые обычно ассоциируются с ранней микоплазменной инфекцией.
В ходе многих исследований было установлено, что воспалительный ответ при микоплазменной инфекции характеризуется низкой степенью инфильтрации нейтрофилов, что, вероятно, определяет хронический, а не острый характер заболевания, как при инфицировании легкого патогенами других видов. Клинические симптомы: першение в горле, хрипы в легких, затрудненное дыхание развиваются постепенно и являются следствием медленного отмирания эпителия. Микоплазменную инфекцию нижних дыхательных путей – пневмонию называют «walkingpneumonia», что можно условно перевести с английского языка как «никуда не торопящаяся».
Однако тяжесть поражения легких, вызванного М. pneumoniae, зависит не только от биологических свойств возбудителя, но и от индивидуальных особенностей иммунного ответа макроорганизма на воздействие инфекционного агента. Так, в поздние сроки микоплазменной инфекции цитолиз эпителиальных клеток в нижних дыхательных путях может быть причиной развития гиалиновых мембран у детей раннего возраста. Отмечено, что в результате тяжелого респираторного микоплазмоза может развиться хронический интерстициальный легочный фиброз. Описаны случаи молниеносного течения микоплазменной инфекции с развитием тяжелой дыхательной недостаточности и респираторного дистресс-синдрома у маленьких детей и пожилых людей, которые ассоциируют с действием CARDS- токсина, продуцируемого М. pneumoniae.
Все чаще обсуждается роль М. pneumoniae в патогенезе хронической бронхолегочной патологии. Особое внимание уделяется значению М. pneumoniae в патогенезе бронхиальной астмы (БА). Так, в экспериментах было показано, что рекомбинантный CARDS-токсин способствует развитию мощного аллергического воспаления в легких, продукции цитокинов и выраженной гиперреактивности дыхательных путей. Также установлено, что взаимодействие между клетками респираторного эпителия и поверхностных липопротеидов М. pneumoniae может индуцировать через 7М-подобный рецептор макроорганизма (TLR) -2 или TLR-4 синтез внутриклеточной молекулы адгезии (1САМ) рецепторов.
Также установлено, что взаимодействие между клетками респираторного эпителия и поверхностных липопротеидов М. pneumoniae может индуцировать через 7М-подобный рецептор макроорганизма (TLR) -2 или TLR-4 синтез внутриклеточной молекулы адгезии (1САМ) рецепторов.
Таким образом, установлено, что М. pneumoniae в течение длительного времени может быть причиной обострения БА. Более того, в некоторых исследованиях были выделены бактерии с более высокой распространенностью среди пациентов с БА. Другие исследования указывают на вероятность участия М. pneumoniae в развитии БА.
Несмотря на то, что многочисленными исследованиями подтверждена связь М. pneumoniae с пневмонией и БА, механизм развития болезни остается изученным не до конца. Рассматриваются теории воспаления в дыхательных путях, связанного с Ненаправленным ответом иммунной системы. Так, установлено, что при респираторной инфекции, ассоциированной с М. pneumoniae, увеличивается высвобождение цитокинов 2-го типа, включая интерлейкины (IL) -4 и -5. Эти цитокины, в свою очередь, способствуют гиперпродукции иммуноглобулина (Ig) Е, играющего основную роль в патогенезе БА у детей.
Эти цитокины, в свою очередь, способствуют гиперпродукции иммуноглобулина (Ig) Е, играющего основную роль в патогенезе БА у детей.
Таким образом, морфологические и физиологические особенности М. pneumoniae определяют клиническую картину микоплазменной инфекции. Внутриклеточная локализация возбудителя защищает его от иммунного ответа хозяина и позволяет длительно персистировать в его организме. Специфика патогенного действия микроорганизма на клетки реснитчатого эпителия определяет соответствующую клиническую картину заболевания, которая чаще не имеет манифестного начала и характеризуется длительным рецидивированием таких симптомов, как кашель. В то же время М. pneumoniae усугубляет течение неспецифической хронической бронхолегочной патологии, нередко являясь триггером обострения заболевания.
Клиника
Выраженность клинических проявлений микоплазменной инфекции весьма вариабельна и может характеризоваться как субклиническим, так и манифестным течением. М. pneumoniae может поражать как верхние, так и нижние дыхательные пути. Инкубационный период при микоплазменной инфекции составляет около 2-3 нед.
М. pneumoniae может поражать как верхние, так и нижние дыхательные пути. Инкубационный период при микоплазменной инфекции составляет около 2-3 нед.
Поражение верхних дыхательных путей при микоплазменной инфекции может проявляться различными синдромами. Чаще ведущим клиническим вариантом инфекции является фарингит. Реже развиваются микоплазменные ринит, синусит, средний отит, мирингит (воспаление барабанной перегородки), который может быть буллезным, и ларингит. Следует отметить, что симптоматика поражения верхних дыхательных путей при микоплазменной инфекции имеет мало специфических черт и практически не отличается от таковой аналогичных заболеваний иной этиологии.
В педиатрической практике чаще наблюдается постепенное начало заболевания. В первые дни появляются жалобы на вялость, сонливость ребенка при нормальных цифрах температуры тела. Отмечаются катаральные явления: боль при глотании, заложенность носа и слизистое отделяемое из носа. Ребенка могут беспокоить болезненные ощущения в мышцах и области поясницы. Однако наиболее ярким клиническим симптомом при микоплазменной инфекции является сухой, приступообразный, интенсивный кашель. Нередко больные жалуются на боль за грудиной во время кашля и рвоту в конце приступа. Такое проявление респираторного микоплазмоза по типу острой респираторной инфекции может продолжаться 2-4 нед., а иногда и дольше.
Однако наиболее ярким клиническим симптомом при микоплазменной инфекции является сухой, приступообразный, интенсивный кашель. Нередко больные жалуются на боль за грудиной во время кашля и рвоту в конце приступа. Такое проявление респираторного микоплазмоза по типу острой респираторной инфекции может продолжаться 2-4 нед., а иногда и дольше.
При манифестной форме микоплазменной инфекции респираторного тракта инфекция начинается остро, с подъема температуры тела до фебрильных цифр. В ряде случаев отмечаются головная боль и другие симптомы интоксикации. Возникают першение и боли в горле, чувство заложенности носа. Реже отмечаются насморк, боль в ушах и проявления конъюнктивита (чаще – «сухого»). Лихорадка, как правило, купируется в течение 3-5 дней, но субфебрилитет может сохраняться еще на протяжении 1-2 нед. Катаральные симптомы заболевания в подавляющем большинстве случаев регрессируют в течение 7-10 дней, однако выделение возбудителя с носоглоточным секретом может отмечаться еще длительное время – до нескольких недель.
Согласно некоторым исследованиям, М. pneumoniae часто обнаруживается у детей школьного возраста с постоянным кашлем, особенно во время активных эпидемий, или одновременно с Вог- detellapertussis. В некоторых исследованиях сообщается об обнаружении М. pneumoniae у здоровых людей. В исследовании Н.М. Foy культуры М. pneumoniae были выявлены у пациентов даже через 4 мес. после болезни. Эти пациенты могут выступать в качестве резервуара возбудителя инфекции.
Поражение нижних отделов респираторного тракта может протекать по типу бронхита или пневмонии. При этом наиболее частой клинической формой заболевания является бронхит. Однако при эпидемическом подъеме заболеваемости частота развития микоплазменных пневмоний значительно возрастает. Как уже отмечалось, в этот период до 40-60% всех пневмоний у детей школьного возраста имеют микоплазменную этиологию.
Для клинической картины микоплазменной пневмонии характерен «инфлюенцеподобный» синдром с выраженной и длительной лихорадкой, ознобом, сильной болью в горле и кашлем. Может развиться бронхообструктивный синдром. При этом симптомы интоксикации обычно не выражены, что является одним из немногих специфических признаков микоплазменной пневмонии. Кашель навязчивый, непродуктивный, без лечения может продолжаться несколько недель, иногда – месяцев. Возможны рецидивы кашля после выздоровления. В 20-30% случаев воспалительный процесс охватывает сразу оба легких. Пневмония чаще нетяжелая, хотя описаны случаи развития плеврита. В легких при этом могут выслушиваться рассеянные сухие и разнокалиберные влажные хрипы.
Может развиться бронхообструктивный синдром. При этом симптомы интоксикации обычно не выражены, что является одним из немногих специфических признаков микоплазменной пневмонии. Кашель навязчивый, непродуктивный, без лечения может продолжаться несколько недель, иногда – месяцев. Возможны рецидивы кашля после выздоровления. В 20-30% случаев воспалительный процесс охватывает сразу оба легких. Пневмония чаще нетяжелая, хотя описаны случаи развития плеврита. В легких при этом могут выслушиваться рассеянные сухие и разнокалиберные влажные хрипы.
Примерно у 10% детей с микоплазменной пневмонией отмечают преходящую макулопапулезную сыпь. В подавляющем большинстве случаев заболевание протекает нетяжело, характеризуется гладким течением и отсутствием дыхательной недостаточности или слабой ее выраженностью. В то же время у детей с иммунодефицитами, серповидно-клеточной анемией, тяжелыми сердечно-легочными заболеваниями, а также у пациентов с синдромом Дауна имеется риск развития осложненных форм микоплазменной пневмонии.
Диагностика
Рентгенологически в легких выявляются очаги негомогенной инфильтрации, более плотные у корня, с неровными краями, часто тяжистые, «мохнатые». Эти изменения двусторонние, несимметричные и чаще наблюдаются в нижних отделах легких. У ряда пациентов изменения сегментарные. Плевральная реакция и плевриты с необильным экссудатом наблюдаются у 1 /4-1 /3 больных, реакция часто ограничивается междолевой плеврой.
В случаях тяжелой пневмонии могут наблюдаться типичные инфильтративные изменения в легочной ткани. Однако это встречается редко и, по данным литературы, обусловлено коинфекцией Streptococcus pneumoniae или Chlamydophila pneumoniae. Гематологические сдвиги при микоплазменной инфекции могут помочь в диагностике микоплазменной этиологии пневмонии – число лейкоцитов обычно нормальное, может быть умеренный лейкоцитоз. Однако общее количество лейкоцитов не превышает 15 000/мкл.
Микоплазменная инфекция может быть ассоциирована, помимо респираторных, с другими проявлениями. Описаны случаи мультиформной эритемы или синдрома Стивенса – Джонса, поражения ЦНС (психозы, менингиты, менингеальные синдромы, менингоэнцефалиты, трансверзальные миелиты, синдром Гийена – Барре), поражения кожи и слизистых оболочек, крови (гемолитическая анемия, коагулопатия, тромбоэмболический феномен), поражения сердца (миокардиты, фокальные некрозы миокарда, перикардиты), функциональные нарушения органов пищеварения, поражения печени (гепатиты, фокальные некрозы), почек (нефрит), полиартрит.
Описаны случаи мультиформной эритемы или синдрома Стивенса – Джонса, поражения ЦНС (психозы, менингиты, менингеальные синдромы, менингоэнцефалиты, трансверзальные миелиты, синдром Гийена – Барре), поражения кожи и слизистых оболочек, крови (гемолитическая анемия, коагулопатия, тромбоэмболический феномен), поражения сердца (миокардиты, фокальные некрозы миокарда, перикардиты), функциональные нарушения органов пищеварения, поражения печени (гепатиты, фокальные некрозы), почек (нефрит), полиартрит.
Таким образом, клиническая картина микоплазменной инфекции верхних и нижних дыхательных путей не имеет строго специфических признаков, на основании которых можно с высокой степенью достоверности диагностировать ее у постели больного. Однако наличие выраженной сухости слизистых в начале заболевания, приступообразный навязчивый кашель до рвоты, отсутствие явлений интоксикации и выраженных гематологических изменений могут свидетельствовать в пользу микоплазменной инфекции. Данные рентгенологического обследования при ВП могут также помочь в диагностике атипичных пневмоний.
С учетом отсутствия четких клинических, рентгенологических и гематологических критериев диагностики микоплазменной инфекции верификация диагноза может быть проведена только на основании лабораторных тестов. К методам выявления и идентификации М. pneumoniae относят культуральное исследование, иммунологические методы (выявление антигенов и специфических антител) и методы амплификации нуклеиновых кислот (МАНК).
Классические микробиологические методы малопригодны для выявления М. pneumoniae в силу их низкой чувствительности (световая микроскопия), что связано с очень малыми размерами возбудителя, или значительной продолжительности исследования – от 1 до 3-6 нед. (посев и культивирование на специально обогащенных средах), что не подходит для использования при диагностике острых форм заболевания.
Наиболее распространенным методом идентификации М. pneumoniae является серологический метод. Среди серологических (иммунологических) методов диагностики наиболее часто на современном этапе используется иммуноферментный анализ (ИФА). Для диагностики во время острой инфекции определяют IgM или IgA. IgM-антитела появляются в 1-ю нед. болезни и достигают своих самых высоких титров в течение 3-й нед. IgA-антитела также продуцируются на ранних стадиях заболевания. Поэтому выявление IgM-антител к М. pneumoniae в ИФА свидетельствует о текущей или недавно перенесенной инфекции. Наличие специфического инфекционного процесса подтверждается также 4-кратным и более нарастанием концентрации IgG-антител к М. pneumoniae при исследовании парных сывороток пациента, собранных с интервалом не менее 2-3 нед. При отсутствии парных сывороток, которые трудно получить у детей раннего возраста, признаком острой микоплазменной инфекции является диагностический титр специфических IgM-антител в значениях, указанных фирмой-производителем.
Для диагностики во время острой инфекции определяют IgM или IgA. IgM-антитела появляются в 1-ю нед. болезни и достигают своих самых высоких титров в течение 3-й нед. IgA-антитела также продуцируются на ранних стадиях заболевания. Поэтому выявление IgM-антител к М. pneumoniae в ИФА свидетельствует о текущей или недавно перенесенной инфекции. Наличие специфического инфекционного процесса подтверждается также 4-кратным и более нарастанием концентрации IgG-антител к М. pneumoniae при исследовании парных сывороток пациента, собранных с интервалом не менее 2-3 нед. При отсутствии парных сывороток, которые трудно получить у детей раннего возраста, признаком острой микоплазменной инфекции является диагностический титр специфических IgM-антител в значениях, указанных фирмой-производителем.
Однако необходимо учитывать, что, несмотря на универсальность, серологические методы не обладают высокой чувствительностью. При интерпретации результатов серологических методов исследования следует знать, что достаточно высокий уровень антител класса IgG к М. pneumoniae может сохраняться длительное время после перенесенной инфекции, нарастание титра IgG может быть отсроченным во времени, a IgM у взрослых могут вообще не выявляться. В ряде случаев положительные результаты ИФА на М. pneumoniae могут быть связаны с перекрестным реагированием на микоплазмы других видов (фальш-позитивный результат). Нельзя исключить и фальш-негативные результаты ИФА. Кроме того, антитела к М. pneumoniae могут появляться только через 2 нед. после появления симптомов. Врачи должны также учитывать статус иммунной системы пациента. В частности, у части иммунокомпрометированных пациентов реакция на IgM может быть неспецифической или отсутствовать.
pneumoniae может сохраняться длительное время после перенесенной инфекции, нарастание титра IgG может быть отсроченным во времени, a IgM у взрослых могут вообще не выявляться. В ряде случаев положительные результаты ИФА на М. pneumoniae могут быть связаны с перекрестным реагированием на микоплазмы других видов (фальш-позитивный результат). Нельзя исключить и фальш-негативные результаты ИФА. Кроме того, антитела к М. pneumoniae могут появляться только через 2 нед. после появления симптомов. Врачи должны также учитывать статус иммунной системы пациента. В частности, у части иммунокомпрометированных пациентов реакция на IgM может быть неспецифической или отсутствовать.
Именно поэтому наибольшее значение в диагностике М. pneumoniae имеют МАНК, к которым относятся классическая полимеразная цепная реакция (ПЦР), «гнездная» ПЦР, ПЦР в реальном времени, мультиплексная ПЦР. «Гнездная» ПЦР характеризуется более высокой, по сравнению с классической ПЦР, чувствительностью; ПЦР в реальном времени позволяет выявлять уровень микробной нагрузки; мультиплексная ПЦР обеспечивает синхронное определение в исследуемом образце нескольких микроорганизмов. Необходимо отметить, что более высокая диагностическая ценность при выявлении М. pneumoniae у больных с ВП отмечается при исследовании мокроты по сравнению с орофарингеальными, назофарингеальными мазками или назофарингеальным аспиратом, что объясняется большей концентрацией возбудителя в нижних дыхательных путях. Поэтому у пациентов с ВП для культурального исследования и ПЦР следует использовать мокроту, и только при невозможности ее получения – образцы из верхних дыхательных путей.
Необходимо отметить, что более высокая диагностическая ценность при выявлении М. pneumoniae у больных с ВП отмечается при исследовании мокроты по сравнению с орофарингеальными, назофарингеальными мазками или назофарингеальным аспиратом, что объясняется большей концентрацией возбудителя в нижних дыхательных путях. Поэтому у пациентов с ВП для культурального исследования и ПЦР следует использовать мокроту, и только при невозможности ее получения – образцы из верхних дыхательных путей.
Таким образом, при лабораторной диагностике респираторного микоплазмоза необходимо использование комбинации методов, направленных на выявление в исследуемых материалах антигенов возбудителя методом ИФА или его генома при помощи ПЦР, с методами, характеризующими иммунный ответ пациента на М. pneumoniae, – определение специфических антител классов IgM, IgA и IgG при проведении ИФА.
Лечение
Лечение респираторного микоплазмоза базируется на антимикробной терапии. Выбор антибактериального препарата обусловлен биологическими свойствами возбудителя. С учетом структурных особенностей строения М. pneumoniae – отсутствия у него клеточной стенки в терапии микоплазмоза рекомендуется использовать антимикробные препараты, блокирующие репликацию возбудителя на этапе синтеза ДНК, например, хинолоны, или синтеза белка, такие как макролиды и тетрациклины. В педиатрической практике выбор лекарственного препарата определяется его профилем безопасности, поэтому в арсенале педиатра для лечения микоплазменной инфекции у детей до 8 лет основной группой антибактериальных препаратов являются макролиды.
Выбор антибактериального препарата обусловлен биологическими свойствами возбудителя. С учетом структурных особенностей строения М. pneumoniae – отсутствия у него клеточной стенки в терапии микоплазмоза рекомендуется использовать антимикробные препараты, блокирующие репликацию возбудителя на этапе синтеза ДНК, например, хинолоны, или синтеза белка, такие как макролиды и тетрациклины. В педиатрической практике выбор лекарственного препарата определяется его профилем безопасности, поэтому в арсенале педиатра для лечения микоплазменной инфекции у детей до 8 лет основной группой антибактериальных препаратов являются макролиды.
Макролиды – группа бактериостатических антибиотиков, химическая структура которых представлена макроциклическим лакто иным кольцом. В зависимости от числа атомов углерода в лактонном кольце различают 3 основных подкласса макролидов: 14-, 15- и 16-членные макролидные антибиотики, а в зависимости от происхождения выделяют природные и полусинтетические препараты. Установлено, что микробиологическая эффективность макролидов по отношению к М. pneumoniae практически одинакова.
Установлено, что микробиологическая эффективность макролидов по отношению к М. pneumoniae практически одинакова.
Длительность антибактериальной терапии определяется тяжестью и течением инфекции, а также наличием фоновых заболеваний. При ВП, вызванной типичными бактериями, длительность антибактериальной терапии обычно составляет 7-10 дней, атипичными бактериями — 10-14 дней. Согласно современным рекомендациям, антибактериальная терапия может быть завершена через 3- 4 дня после стойкой нормализации температуры тела.
В последние годы наблюдается тенденция к сокращению сроков использования антибактериальной терапии, даже при тяжелом варианте течения ВП. Однако в клинических рекомендациях «Внебольничная пневмония у детей» (2015 г.) указано, что эксперты считают, что продолжительность антибактериальной терапии при ВП должна составлять не менее 5 дней. В то же время использование азитромицина позволяет сократить длительность курса терапии микоплазменной инфекции до 5-7 сут с учетом фармакокинетических особенностей препарата.
В 2014 г. ВОЗ был опубликован «Глобальный отчет по надзору за резистентностью к антимикробным препаратам», согласно которому проблема устойчивости возбудителей к антибактериальным препаратам создает все большую угрозу для профилактики и лечения инфекционных заболеваний. Основной причиной резистентности микроорганизмов к антибактериальным препаратам становится их избыточное потребление, связанное как с необоснованным назначением препаратов, так и с отсутствием своевременной этиологической диагностики инфекции. В то время как внебольничные инфекции у детей после 5 лет до 40% случаев могут быть обусловлены М. pneumoniae, отсутствие этиологической диагностики ведет к необоснованному назначению данной группе пациентов, в соответствии с клиническими рекомендациями, бета-лактамных антибиотиков. Пациенты нередко получают несколько неэффективных курсов антимикробных препаратов, что способствует формированию к ним устойчивости бактерий.
Однако недостаточное использование антимикробных препаратов также ведет к росту антибиотикорезистентности. Обусловлено это может быть неправильным выбором лечения, неверной дозировкой, незавершенным курсом терапии. Одной из причин сложившейся тенденции в отношении макролидов является широкое использование некачественных дженериков. Несколько исследований, проведенных в РФ, продемонстрировали наличие более низких концентраций активных субстанций в ряде псевдодженериков и их низкую биодоступность, что потенциально может приводить к росту резистентности.
Обусловлено это может быть неправильным выбором лечения, неверной дозировкой, незавершенным курсом терапии. Одной из причин сложившейся тенденции в отношении макролидов является широкое использование некачественных дженериков. Несколько исследований, проведенных в РФ, продемонстрировали наличие более низких концентраций активных субстанций в ряде псевдодженериков и их низкую биодоступность, что потенциально может приводить к росту резистентности.
С 2001 г. появились данные об устойчивости к макролидам М. pneumoniae, выделяемой при инфекциях дыхательных путей у детей и взрослых в странах Азии (Япония, Китай). Так, макролидоустойчивая М. pneumoniae впервые была зарегистрирована в Японии в 2001 г., и с тех пор постоянно сообщается об увеличении процента ее выявления среди таких пациентов. Однако распространенность макролидорезистентной пневмонии различается в разных странах. В Китае зарегистрировано 69% пациентов с респираторным микоплазмозом, не чувствительным к терапии макролидами, в то время как в Нидерландах с 1997 по 2008 г. не было обнаружено случаев резистентности к макролидам М. pneumoniae. Данных о распространенности подобных штаммов в Российской Федерации нет.
не было обнаружено случаев резистентности к макролидам М. pneumoniae. Данных о распространенности подобных штаммов в Российской Федерации нет.
Резистентность М. pneumoniae к макролидам обусловлена точечными мутациями в генах р-РНК 23S субъединицы рибосомы у макролидорезистентных штаммов М. pneumoniae, поэтому в терапевтической практике необходимо учитывать, что резистентность микроорганизма отмечается ко всем макролидам, линкозамидам и кетолидам.
Однако, согласно данным литературы, резистентность М. pneumoniae к антибиотикам не составляет проблемы – подавляющее большинство штаммов чувствительно к макролидам. В настоящее время не описано клинических изолятов, имеющих резистентность к тетрациклинам и фторхинолонам, однако селектировать такие штаммы in vitro удавалось. Несмотря на распространенность макролидоустойчивых форм М. pneumoniae в мире, вопрос об изменении рекомендаций по терапии респираторного микоплазмоза в России, США и странах Европы не стоит.
В связи с распространенностью респираторных заболеваний, вызванных М. pneumoniae, участием данного патогена в развитии хронических бронхолегочных заболеваний все острее возникает вопрос о мерах специфической профилактики. С учетом того, что М. pneumoniae является вторым по частоте возбудителем ВП у детей старше 5 лет, в мире стоит цель создания действенной вакцины для борьбы с данным возбудителем.
pneumoniae, участием данного патогена в развитии хронических бронхолегочных заболеваний все острее возникает вопрос о мерах специфической профилактики. С учетом того, что М. pneumoniae является вторым по частоте возбудителем ВП у детей старше 5 лет, в мире стоит цель создания действенной вакцины для борьбы с данным возбудителем.
В 1960-1970-х гг. был проведен ряд исследований, посвященных иммуногенности и защитной эффективности нескольких вакцин. Метаанализ Linchevski et al. показал, что общая эффективность профилактики пневмонии в этих исследованиях составила 41% (54% – для пневмонии, вызванной М. pneumoniae). Исследования по созданию действенной вакцины продолжаются и в настоящее время. Создание вакцины для лиц с высоким риском заболеваемости, таких как школьники, призывники и пожилые люди, поможет снизить заболеваемость от пневмонии и вторичных осложнений. Своевременная вакцинация может также снизить развитие резистентных к макролидам штаммов М. pneumoniae.
Заключение
Таким образом, М. pneumoniae – достаточно распространенный возбудитель ОРЗ у детей. Он является вторым по значимости этиологическим фактором в развитии ВП у детей после 5 лет. Особенности данного возбудителя определяют возможность длительной персистенции микроорганизма и ускользание его из-под контроля иммунной системы хозяина, а также отсутствие стойкого постинфекционного иммунитета, что нередко способствует персистенции возбудителя и вызывает затяжное течение заболевания.
pneumoniae – достаточно распространенный возбудитель ОРЗ у детей. Он является вторым по значимости этиологическим фактором в развитии ВП у детей после 5 лет. Особенности данного возбудителя определяют возможность длительной персистенции микроорганизма и ускользание его из-под контроля иммунной системы хозяина, а также отсутствие стойкого постинфекционного иммунитета, что нередко способствует персистенции возбудителя и вызывает затяжное течение заболевания.
Несмотря на то, что эффективность лечения ОРЗ и особенно микоплазменной инфекции тесно связана с точностью этиологической диагностики, эта задача пока не решена. Отсутствуют специфические клинические и рентгенологические признаки заболевания, которые позволили бы практическому врачу с высокой степенью достоверности уточнить этиологическую диагностику ОРЗ. Вместе с этим лабораторные исследования с целью определения возбудителя в амбулаторных условиях в России часто недоступны и сложны. В этой связи наиболее перспективным является создание препаратов для специфической профилактики такой непростой инфекции, как респираторный микоплазмоз.
С.В. Зайцева, А.К. Застрожина, О.А. Муртазаева
2017 г.
Клинические проявления у младенцев и детей при инфекции Mycoplasma pneumoniae
PLoS One. 2018; 13(4): e01.
, Курирование данных, Формальный анализ, Исследование, Написание – первоначальный проект, 1, * , Исследование, Методология, Проверка, Написание – обзор и редактирование, 2 , Концептуализация, Методология, Надзор, Написание – обзор и редактирование , 2 и , Концептуализация, Методология, Управление проектом, Надзор, Написание – проверка и редактирование 1Миа Йоханна Сёндергаард
1 Отделение педиатрии, больница Nordsjællands, Hillerød, Дания
Martin Barfred Friis
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Dennis Schrøder Hansen
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Inger Merete Jørgensen
1 Отделение педиатрии, Больница Нордселландс, Хиллерёд, Дания
Оливер Шильдген, редактор
1 Отделение педиатрии, Больница Нордселландс, Хиллерёд, Дания
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Kliniken der Stadt Köln gGmbH, ГЕРМАНИЯ
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Поступила в редакцию 21 окт. 2016 г.; Принято 14 февраля 2018 г.
Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.Эта статья была процитирована. по другим статьям в PMC.Abstract
История вопроса
Mycoplasma pneumoniae является частой причиной внебольничной пневмонии у детей старшего возраста.Легочные и внелегочные симптомы, связанные с M . Зарегистрировано пневмонии инфекций. М . pneumoniae носит преимущественно эпидемический характер в Дании с рецидивами каждые 4-7 -го -го года.
Цели
Ретроспективно описать эпидемиологию и клинические особенности у младенцев и детей в течение М . pneumoniae эпидемия 2010 и 2011 гг.Включено pneumoniae за период 01. 02.2010–31.01.2012. Медицинские карты, а также рентгенологические данные были рассмотрены для всех детей с М . пневмонии . Для части когорты был проведен ретроспективный анализ вирусных коинфекций.
02.2010–31.01.2012. Медицинские карты, а также рентгенологические данные были рассмотрены для всех детей с М . пневмонии . Для части когорты был проведен ретроспективный анализ вирусных коинфекций.
Результаты
134 из 746 детей дали положительный результат на М . pneumoniae с помощью ПЦР или серологии. Положительные тесты были обнаружены у 65% детей 7 лет и старше, у 30% детей 2-6 лет и у 4% детей грудного возраста (до двух лет).Вирусная коинфекция была обнаружена в 27% протестированных образцов. Клиническими проявлениями были кашель, астматические симптомы и субфебрильная температура. Внелегочные симптомы были частыми и проявлялись тошнотой/рвотой у 33% детей и кожными проявлениями у 25%. 84% детей сделали рентген грудной клетки, и у 94% из них были положительные результаты рентгенологического исследования.
Заключение
М . pneumoniae также поражал младенцев и детей младшего возраста, и симптомы были похожи на инфекции респираторными вирусами, но также наблюдались тяжелые ИНДП. Во время надвигающейся эпидемии оценка внелегочных проявлений может быть полезной при диагностике M . пневмонии инфекций.
Во время надвигающейся эпидемии оценка внелегочных проявлений может быть полезной при диагностике M . пневмонии инфекций.
Введение
Mycoplasma pneumoniae ( M . pneumoniae ) является важной причиной инфекций дыхательных путей, особенно у детей и молодых людей, и, по оценкам, на нее приходится до 30–40% внебольничных инфекций. пневмонии (ВП) [1–4]. Легочные проявления обычно представляют собой трахеобронхит и пневмонию, сопровождающиеся кашлем, а также хрипами.Маленькие дети считаются менее восприимчивыми к M . pneumoniae у детей школьного возраста [5,6]. В Дании M . pneumoniae носит преимущественно эпидемический характер с частотой рецидивов каждые 4-7 — лет [7].
Дания испытала M . Эпидемия pneumoniae с пиком осенью 2010 г. и снова осенью 2011 г. Statens Serum Institut (SSI), отвечающий за национальную систему эпиднадзора в Дании, описал ее как две волны одной и той же эпидемии [7].
Осознание того, что дети дошкольного возраста и даже младенцы могут быть восприимчивы и иметь клинические симптомы от M . Инфекция pneumoniae развилась в последние годы и была зарегистрирована в исследованиях, проведенных в Европе и Австралии [8–14]. С клинической точки зрения важно установить, является ли M . pneumoniae играет важную дифференциальную роль в инфекциях нижних дыхательных путей и астмоподобных обострениях у детей раннего возраста и младенцев.В последние годы актуален вопрос о коинфекциях и бессимптомном носительстве М . pneumoniae и, следовательно, гипердиагностика M . pneumoniae с помощью ПЦР обсуждался [15].
Целью данного исследования было описание и характеристика M . pneumoniae в условиях стационара, а также для оценки возможных возрастных клинических признаков у младенцев, детей младшего возраста и детей старшего возраста, госпитализированных с диагнозом M . пневмония инфекция. Исследование было начато, так как мы испытали сдвиг в клинической картине нашего M . пневмонии больных во время эпидемии. Литература в этой области обширна и содержит различные мнения, как уже упоминалось, о патогенности бактерий и показаниях к лечению, а также о значении инфекций у детей дошкольного возраста. Наш отчет — еще один кирпичик в понимании этого патогена.
пневмония инфекция. Исследование было начато, так как мы испытали сдвиг в клинической картине нашего M . пневмонии больных во время эпидемии. Литература в этой области обширна и содержит различные мнения, как уже упоминалось, о патогенности бактерий и показаниях к лечению, а также о значении инфекций у детей дошкольного возраста. Наш отчет — еще один кирпичик в понимании этого патогена.
Материалы и методы
Мы разработали ретроспективный анализ всех детей в возрасте до 16 лет, поступивших в педиатрическое отделение больницы Нордселландс, Хиллерёд, Дания, которые были исследованы на M . pneumoniae либо с помощью полимеразной цепной реакции (ПЦР), либо с помощью серологии ( M . pneumoniae тест на антитела и тест холодовой агглютинации). Период исследования: с 01.02.2010 по 31.01.2012. Мы собрали результаты ПЦР и результаты образцов крови как в нашей местной микробиологической лаборатории (ПЦР), так и в SSI (ПЦР и серология). Данные были сопоставлены по номеру социального страхования, чтобы избежать двойной выборки. ПЦР проводили на мазках из ротоглотки, которые хранили и транспортировали в лабораторию в охлажденном виде.Диагностика М . pneumoniae был основан на коммерчески доступном наборе для ПЦР в реальном времени (RT-PCR) (Minerva Biolabs Venor R Mp Mycoplasma pneumoniae — Диагностический набор для количественной ПЦР типа I), направленном на ген цитоадгезии P1. ПЦР представлял собой мультиплексный анализ, также нацеленный на Chlamydophila pneumoniae/psittaci . Анализ проводили в соответствии с описанием производителя. Короче говоря, 10 мкл образца добавляли к 14,4 мкл мастермикса, содержащего 14 мкл буфера, 0.2 мкл Taq-полимеразы и 0,2 мкл урацил-N-гликозилазы. ОТ-ПЦР проводили при следующих условиях на машине Stratagene Mx 3005P RT-PCR: 10 мин при 95°C, затем 45 циклов по 30 с при 95°C, 30 с при 55°C и 30 с при 60°C. . М . В фильтре FAM было обнаружено pneumoniae .
Данные были сопоставлены по номеру социального страхования, чтобы избежать двойной выборки. ПЦР проводили на мазках из ротоглотки, которые хранили и транспортировали в лабораторию в охлажденном виде.Диагностика М . pneumoniae был основан на коммерчески доступном наборе для ПЦР в реальном времени (RT-PCR) (Minerva Biolabs Venor R Mp Mycoplasma pneumoniae — Диагностический набор для количественной ПЦР типа I), направленном на ген цитоадгезии P1. ПЦР представлял собой мультиплексный анализ, также нацеленный на Chlamydophila pneumoniae/psittaci . Анализ проводили в соответствии с описанием производителя. Короче говоря, 10 мкл образца добавляли к 14,4 мкл мастермикса, содержащего 14 мкл буфера, 0.2 мкл Taq-полимеразы и 0,2 мкл урацил-N-гликозилазы. ОТ-ПЦР проводили при следующих условиях на машине Stratagene Mx 3005P RT-PCR: 10 мин при 95°C, затем 45 циклов по 30 с при 95°C, 30 с при 55°C и 30 с при 60°C. . М . В фильтре FAM было обнаружено pneumoniae .
Серологические тесты были выполнены внешним коммерческим поставщиком (SSI) и основаны на M . pneumoniae специфические антитела IgM (MPT) вместе с холодовыми агглютининами (KAT).Титр как МФТ, так и КАТ выше или равный 64 считался положительным тестом. Поскольку титры КАТ падают быстрее после перенесенной инфекции, ее использовали для повышения вероятности продолжающейся инфекции. Подсчитано, что 95% лиц моложе 20 лет имеют положительные титры КАТ в ответ на М . Инфекция pneumoniae (тест-информация об ИОХВ).
Дети с двумя или более положительными ПЦР-тестами в течение трех месяцев рассматривались как один и тот же инфекционный эпизод и включались только один раз.
Дети были направлены врачами общей практики или отделением неотложной помощи больницы. Дежурный врач заказал М . pneumoniae отбор проб согласно клинической оценке.
Были собраны демографические и клинические данные о 134 детях с положительным тестом на M . pneumoniae , судя по медицинской карте. Карты 612 детей с отрицательными тестами не проверены. Медицинский анамнез систематически анализировался с использованием компьютеризированных медицинских карт, радиологических отчетов и лабораторных отчетов.Анализируемые характеристики включали демографические данные (возраст, пол, история болезни до поступления), клиническую картину (легочные и внелегочные симптомы, клиническое обследование, частота дыхания, аускультация, температура, сатурация кислорода), рентгенологические данные, биохимию (С-реактивный белок ( СРБ), количество лейкоцитов при поступлении) сопутствующие инфекции, осложнения и медикаментозное лечение. Для анализа данных дети были разделены на возрастные группы: до двух лет (далее в тексте — младенцы), 2–6 лет и 7–15 лет (дети школьного возраста).
pneumoniae , судя по медицинской карте. Карты 612 детей с отрицательными тестами не проверены. Медицинский анамнез систематически анализировался с использованием компьютеризированных медицинских карт, радиологических отчетов и лабораторных отчетов.Анализируемые характеристики включали демографические данные (возраст, пол, история болезни до поступления), клиническую картину (легочные и внелегочные симптомы, клиническое обследование, частота дыхания, аускультация, температура, сатурация кислорода), рентгенологические данные, биохимию (С-реактивный белок ( СРБ), количество лейкоцитов при поступлении) сопутствующие инфекции, осложнения и медикаментозное лечение. Для анализа данных дети были разделены на возрастные группы: до двух лет (далее в тексте — младенцы), 2–6 лет и 7–15 лет (дети школьного возраста).
Для дальнейшего ответа на вопрос о вирусных коинфекциях, ретроспективный анализ исходного замороженного образца ротоглоточного мазка из 49 из M . pneumoniae положительных когорты были протестированы с помощью ПЦР с использованием имеющегося в продаже набора (линейка Biomerieux Respiratory MWS R-Gene) на широкий спектр респираторных вирусов (включая респираторно-синцитиальный вирус (RSV), грипп A и B, метапневмовирус человека, риновирус , вирус парагриппа, коронавирус, бокавирус и аденовирус). Короче говоря, ПЦР проводили в четырех двойных комплексах; 10 мкл образца добавляли к 15 мкл мастер-микса, содержащего буфер, обратную транскриптазу и смесь праймер/зонд. ОТ-ПЦР проводили при следующих условиях на приборе Stratagene Mx 3005P для ОТ-ПЦР: 5 мин при 50°С, 15 мин при 95°С, затем 45 циклов по 10 с при 95°С, 40 с при 60°С. °С и 25 сек при 72°С. Цели Al были обнаружены либо в фильтре FAM, либо в фильтре HEX.
Короче говоря, ПЦР проводили в четырех двойных комплексах; 10 мкл образца добавляли к 15 мкл мастер-микса, содержащего буфер, обратную транскриптазу и смесь праймер/зонд. ОТ-ПЦР проводили при следующих условиях на приборе Stratagene Mx 3005P для ОТ-ПЦР: 5 мин при 50°С, 15 мин при 95°С, затем 45 циклов по 10 с при 95°С, 40 с при 60°С. °С и 25 сек при 72°С. Цели Al были обнаружены либо в фильтре FAM, либо в фильтре HEX.
Положительные образцы после более чем 35 Ct-циклов были повторно оценены для подтверждения действительно положительного результата.
Комитет по этике региона Ховедстаден (номер протокола: H-2-2012-132), а также Датское агентство по защите данных одобрили исследование. Это одобрение включало согласие на просмотр медицинских записей без информированного согласия пациентов.
Статистический анализ выполнен в STATA 10.0, программных пакетах SPSS версии 22 и Microsoft Excell. Chi 2 -критерий, точный критерий Фишера или Z-критерий использовали для анализа категорийных данных и двухвыборочный Т-критерий для числовых данных. Значение p <0,05 считалось значимым.
Значение p <0,05 считалось значимым.
Результаты
Эпидемиологические данные
Из 885 пациентов протестированы на M . pneumoniae в период исследования, 139 были исключены из-за возраста (старше 15 лет), двойного отбора проб или повторных проб в течение трех месяцев. Всего в исследование было включено 746 детей с инфекцией дыхательных путей (ИРТ), у 134 из которых был положительный тест на M . пневмонии . Из 740 М . pneumoniae Включено ПЦР-анализов, 132 из которых были положительными, а из 20 серологических тестов 3 были положительными. Четырнадцать детей были протестированы как с помощью ПЦР в реальном времени, так и с помощью серологии.
показывает количество детей, протестированных на M . pneumoniae и количество положительных случаев по месяцам. Эпидемия достигла своего пика в октябре 2010 года и снова в октябре-декабре 2011 года. Численность М . pneumoniae положительных случая составило 50 (из 386) в первый эпидемический сезон и 84 (из 360) во второй период эпидемии, при значительно более высоком показателе (0,13 против 0,23) положительных случаев в более позднем (р = 0,0002, хи 2 — тест). В целом у 18% детей, протестированных на M. pneumonia, был положительный образец.
В целом у 18% детей, протестированных на M. pneumonia, был положительный образец.
Количество положительных и отрицательных M . пневмонии тестов по годам и месяцам.
Высшая скорость М . pneumoniae положительных образца были у детей школьного возраста (65%), но особенно у детей дошкольного возраста (30%), и даже у шести детей в возрасте до двух лет (4%) было M . пневмонии положительных теста.
Клиническая картина, рентгенологические данные и лабораторные исследования
Характеристики пациентов, стратифицированные по возрастным группам, представлены в .
Таблица 1
Симптомы, внелегочные симптомы, объективные признаки, биохимические и рентгенологические данные у детей с Mycoplasma pneumoniae.
| <2 Y | 2-6 Y | 7-15 y | Всего | <2 Y | 2-6 y | 7-15 y | Всего | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Объективные признаки: | ||||||||||||
| Количество детей | 6 | 40 | 88 | 134 | тахипноэ, (%) W | 0 | 52 | 52 | 57 | 57 | 52 | 52 |
| мужчины (%) | 67 | 67 | 60324 | 53 | 56 | Температура ° C (Median [IQR]) | 38. 5 [37.4: 39.4] 5 [37.4: 39.4] | 37.8 [37.3: 38.5] | 37.9 [37.5: 38.8] | 37,9 [37.4: 38.8] | ||
| Симптоматические дни до приема (среднее) * | 4 | 12 | 10 | 10 | 10 | 10 | Auscultation-hheezing (%) | 33 | 24 | 23 | 23 | 24 |
| дня поступления (среднее) ** | 2 | 1,8 | 2,3 | 2,2 | 2,2 | 2,2 | Auscultation-Trackles / Снижение звуки дыхания (%) | 47 | 47 | 57 | 56 | |
| симптомов: | Лабораторные испытания: Y | |||||||||||
| Chough (%) | 100 | 100 | 99 | 99 | 99 | CRP, мг / л (медианы [IQR]) | 33 [слишком мало] | 28. 5 [17.5: 40.3] 5 [17.5: 40.3] | 25 [16.5: 32.5] | 28 [16.3: 39.3] | ||
| Hheezing (%) | 50 | 17 | 16 | 17 | Количество лейкоцитов (Median [IQR ]) | 17.0 [Слишком мало] | 8.1 [5.8: 11.9] | 10,3 [8.3: 12.7] | 9.3 [6.2: 12.2] | |||
| Rhinorrhoea (%) | 40 | 11 | 15 | Количество нейтрофилов (медиана [IQR]) | 9,6 [слишком мало] | 5. 3 [3.9: 9.3] 3 [3.9: 9.3] | 6.6 [5.1: 8.3] | 5.8 [4.0: 8.9] | ||||
| Боли в горле (%) | 0 | 18 | 26 | 26 | 22 | Количество лимфоцитов (Median [ IQR]) | 5.2 [Слишком мало] | 1.5 [1.1: 1.8] | 2.2 [1.7: 2.9] | [1.7: 2.9]1.7 [1.3: 2.5] | ||
| 0 | 0 | 5 | 3 | |||||||||
| внелегочного симптомы: | Рентгенологически: Z | |||||||||||
| Лихорадка ≥ 38 ° C (%) | 94 | 94 | 94 | 9 94 | 91 | 91 | Илала Аденопатия (исключительно) (%) | 3 | 13 | 5 | 903 49 8||
| Make Mainestation (ALL) x (%) | 18 | 18 | 24 | 23 | Infiltration Lobar (%) | 33 | 81 | 82 | 80 | |||
| Urticarial Rash (%) | 17 | 0 | 0 | 13 | 9 | Atelectasis (%) | 0 | 16 | 19 | 18 | 18 | |
| Стивен Джонсон Синдром (NO) | 0 | 0 | 2 | 2 | 2 | 2 | 9 | 9 | 9 | 9 | 9 | |
| Тошнота и / или рвота (%) | 33 | 32 | 30 | 31 | Эмпиема (нет) | 0 | 0 | 1 | 1 |
Дети в возрасте до двух лет поступали в стационар значительно раньше после появления симптомов s, чем дети старшего возраста, (p = 0. 01, двухвыборочный t-критерий). 61% детей были выписаны из стационара в день поступления.
01, двухвыборочный t-критерий). 61% детей были выписаны из стационара в день поступления.
Наиболее частым респираторным проявлением был кашель (100%) вместе с возрастной степенью хрипов (). При поступлении в стационар у 92% младенцев и детей был диагностирован эпизод неприятных симптомов со стороны легких продолжительностью не менее трех дней. Значительно больше детей младшего возраста (до трех лет) имели объективные хрипы и кашель (астмоподобные симптомы), чем дети старшего возраста (p = 0.01, Z-критерий). Предшествующее и клинически значимое хроническое заболевание диагностировано у 10% детей. Из них 4/13 (31%) имели ранее диагностированную и текущую астму, а также имели тяжелые обострения в течение М . пневмония инфекция.
Большинству пациентов (84%) была сделана рентгенограмма органов грудной клетки, и у 96% из них рентгенологические результаты были положительными (). Среди детей грудного и раннего возраста чаще встречалась эксклюзивная внутригрудная лимфаденопатия, в то время как у детей более старшего возраста обычно выявлялась значительная периферическая инфильтрация на рентгенограмме органов грудной клетки (10). Дети с ателектазом имели значительно большую продолжительность пребывания в стационаре; более трех дней (35% против 25%; p = 0,05). Частота легочных осложнений была одинаковой для детей с СРБ выше 50 мг/л (POCT (тестирование в месте оказания медицинской помощи), часть определения тяжелой пневмонии у взрослых) и ниже 50 мг/л (18% против 19%, p > 0,05). В возрастной группе до двух лет не было зарегистрировано легочных осложнений. Количество тяжелых проявлений пневмонии было одинаковым в возрастных группах; 2–6 лет и 7–15 лет (таблица).В целом 20% детей имели повышенный уровень СРБ более 50 мг/л, и все они были старше трех лет.
Дети с ателектазом имели значительно большую продолжительность пребывания в стационаре; более трех дней (35% против 25%; p = 0,05). Частота легочных осложнений была одинаковой для детей с СРБ выше 50 мг/л (POCT (тестирование в месте оказания медицинской помощи), часть определения тяжелой пневмонии у взрослых) и ниже 50 мг/л (18% против 19%, p > 0,05). В возрастной группе до двух лет не было зарегистрировано легочных осложнений. Количество тяжелых проявлений пневмонии было одинаковым в возрастных группах; 2–6 лет и 7–15 лет (таблица).В целом 20% детей имели повышенный уровень СРБ более 50 мг/л, и все они были старше трех лет.
Лечение антибиотиками получили 120 детей. Большинство пациентов лечились кларитромицином в соответствии с местными рекомендациями. 64 пациента, или 46%, лечились по подозрению. Из них 53% получали другие антибиотики (бета-лактам) до M . пневмония тестирование. Лечение было начато 56 больным (42%) после получения положительного результата теста. Только шесть детей лечили макролидными антибиотиками дважды из-за подозрения на рецидив или неэффективность лечения. Один образец был протестирован на устойчивость к макролидам и показал отрицательный результат.
Только шесть детей лечили макролидными антибиотиками дважды из-за подозрения на рецидив или неэффективность лечения. Один образец был протестирован на устойчивость к макролидам и показал отрицательный результат.
Наиболее частым внелегочным проявлением была тошнота с рвотой или без нее, о которой сообщала треть всех детей. У 23% всех детей была сыпь в той или иной форме, а у 9% была крапивница. У детей раннего возраста кожные проявления были в 33% случаев. У двух детей развился синдром Стивена-Джонсона (ССД) с симптомами поражения слизистых оболочек, возникшими до или одновременно с началом лечения антибиотиками.
Одновременно проведено исследование посевов мокроты на другие бактериальные возбудители у 37 детей. У 41% из них была диагностирована коинфекция. Наиболее распространенными бактериями были Moraxella catarrhalis , Haemophilus influenzae и S . пневмония . Из-за методологической установки все дети были протестированы на Chlamydophila pneumoniae ни один из них не оказался положительным.
Только двое детей были протестированы на вирусные инфекции во время клинической подготовки.Апостериорный анализ 49 мазков из ротоглотки показал, что 27% из них имели одиночную или смешанную вирусную коинфекцию (РСВ (1 ребенок), грипп А (2), метапневмовирус человека (1), риновирус (2), коронавирус). (3), бокавирус (2) и аденовирус (5)). Четверо детей оказались положительными с помощью ПЦР на два вируса, а также на M . пневмонии . показывает, по аналогии с , клинические характеристики детей с неизвестной вирусной инфекцией, без нее и с неизвестной вирусной инфекцией. Полученные данные свидетельствуют о том, что значительно чаще детей с микст-инфекцией М . pneumoniae и респираторный вирус имели ринорею (p = 0,02) и хрипы (тенденция, p = 0,07) по сравнению с теми, кто был положительным только на M . пневмонии . Мы не смогли выявить других различий между двумя группами, включая отсутствие рентгенологических расхождений.
Таблица 2
Симптомы, внелегочные симптомы, объективные признаки и рентгенологические данные у детей с Mycoplasma pneumoniae с вирусной коинфекцией или без нее.
| Мп положительный и вирус положительный | Мп положительный и вирус отрицательный | Мп положительный и вирус Неизвестный | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | <2 Y | 2-15 y | 2 <2 y | 2 -15 y | <2 Y | 2-15 Y | 9032 9 | Количество детей | 3 | 10 | 0 | 36 | 3 | 82 | 82 |
| мужчины (%) | 33 | 50 | — | — | — | — | — | 64 | 100 | 51 | 51 | 51 |
| Симптоматические дни до приема (среднее) | 4 | 16 | — | 9. 1 1 | 2,7 | 9,8 | ||||||
| Дни приема (средние) | 1,8 | 2,5 | — | 2,4 | 1,7 | 2,2 | ||||||
| Симптомы : | ||||||||||||
| Кашель (%) | 100 | 90 | — | 100 | 100 | 100 | ||||||
| хрипов (%) | 5024 | 50 * | — | 19 * | 50 | 50 | 10 | |||||
| Rhinorrehea (%) | 0 | 44 ** | — | 7 ** | 67 | 14 | ||||||
| Боль в горле (%) | NA | 24 9000 | — | 27 | 0 | 20 | ||||||
| крупе симптомы (%) | 0 | 0 | — | 0 | 0 | 7 | ||||||
| внелегочного симптомы : | ||||||||||||
| Лихорадка ≥ 38 ° С (%) | 100 | 70 | — | 97 | 67 | 67 | 93 | 93 | 93 | |||
| Skin Mainestation (ALL) x (%) | 67 | 67 | 0 | — | 14 | 0 | 29 | |||||
| Urticarial Rash (%) | 33 | 0 | — | 3 | 0 | 12 | ||||||
| Синдром Стивена Джонсона (нет) | 2 0— | 1 | 0 | 1 | ||||||||
| Тошнота и / или рвота (%) | 0 | 11 | — | 39 | 67 | 31 | ||||||
| Объективные признаки : | ||||||||||||
| тахипноэ Вт (%) | 0 | 44 | — | 53 | 0 | 57 | ||||||
| Температура °C (средняя) | 38. 4 4 | 38,1 — | 38,238,2 | 37,9 | ||||||||
| Аускультация-хрипы (%) | 33 | 20 | — | 24 | 0 | 27 | ||||||
| Auscultation- хрипы / уменьшились дыхание звуки (%) | 100 | 60 | — | 52 | 67 | 44 | ||||||
| Рентгенологически : | ||||||||||||
| внутригрудной лимфаденопатией (исключительно) (%) | 50 | 13 | — | 7 | Н. А. А. | 7 | ||||||
| Лобар инфильтрация (%) | 50 | 63 | — | 86 | н/д | 85 | ||||||
| Atelectasis (%) | 0 | 13 | — | — | 25 9 | Na | 19 | |||||
| 0 | 0 | — | 11 | Na | 7 | |||||||
| Эмпиема (нет) | 0 | 0 | — | 0 | NA | 1 | ||||||
Обсуждение
Мы представляем данные большой когорты детей с М . пневмония инфекция. Все включенные в исследование дети были направлены из системы первичной медико-санитарной помощи на госпитализацию в связи с характером и тяжестью симптомов. Большинство M . pneumoniae детей с положительным ПЦР-тестом имели ИНДП, что мы подтверждали высокой частотой рентгенологических находок (94%).
пневмония инфекция. Все включенные в исследование дети были направлены из системы первичной медико-санитарной помощи на госпитализацию в связи с характером и тяжестью симптомов. Большинство M . pneumoniae детей с положительным ПЦР-тестом имели ИНДП, что мы подтверждали высокой частотой рентгенологических находок (94%).
Мы обнаружили более высокую частоту положительных проб на поздней волне эпидемии в 2010 и 2011 годах. Дети школьного возраста чаще M . pneumoniae положительных (65%), чем у детей младшего возраста, но даже среди детей в возрасте от 2 до 6 лет 30% были М . pneumoniae положительный результат, подтверждающий наше первоначальное подозрение, что M . pneumoniae также поражает маленьких детей. Даже небольшое количество младенцев; 6 из 276 были диагностированы.
Это исследование проводилось как ретроспективное картографическое исследование. Врач по вызову решил, кого проверить на М . пневмонии . Дети с М . Инфекция pneumoniae могла быть недодиагностирована, если у них были незначительные респираторные симптомы, особенно во время первой волны эпидемического периода.Из-за общепринятых концепций эпидемиологии ВП, первоначально основанных на долгосрочном исследовании, проведенном в учреждениях первичной медико-санитарной помощи с 1963 по 1975 г., мы ожидаем, что младенцы и дети младшего возраста будут недодиагностированы из-за систематической ошибки отбора [6].
пневмонии . Дети с М . Инфекция pneumoniae могла быть недодиагностирована, если у них были незначительные респираторные симптомы, особенно во время первой волны эпидемического периода.Из-за общепринятых концепций эпидемиологии ВП, первоначально основанных на долгосрочном исследовании, проведенном в учреждениях первичной медико-санитарной помощи с 1963 по 1975 г., мы ожидаем, что младенцы и дети младшего возраста будут недодиагностированы из-за систематической ошибки отбора [6].
Даже очень маленькие дети могут заболеть от M . pneumoniae , хотя встречается реже. Необходимо учитывать дифференциальную диагностику респираторных вирусных инфекций и обострения астмоподобных симптомов. Клиническая картина с кашлем, свистящими хрипами, субфебрилитетом, СРБ ниже 50 мг/л и хрипами при аускультации у 33% детей раннего возраста также может быть расценена как обострение астмы детского возраста, в первую очередь за счет вирусной инфекции в дети дошкольного возраста. Действительно, у нас также была незначительная степень смешанных вирусных коинфекций, обнаруженных в нашем апостериорном анализе. Можно только предполагать, какой возбудитель явился первопричиной заболевания в этих случаях. В связи с нашими постфактум выводами, мы рекомендуем, чтобы маленькие дети с хрипами и ринореей были проверены на оба M . pneumoniae и респираторно-вирусные инфекции одновременно. За норвежский М . pneumoniae эпидемия, Inchly et al. описали аналогичное относительное количество вирусных коинфекций [14].
Действительно, у нас также была незначительная степень смешанных вирусных коинфекций, обнаруженных в нашем апостериорном анализе. Можно только предполагать, какой возбудитель явился первопричиной заболевания в этих случаях. В связи с нашими постфактум выводами, мы рекомендуем, чтобы маленькие дети с хрипами и ринореей были проверены на оба M . pneumoniae и респираторно-вирусные инфекции одновременно. За норвежский М . pneumoniae эпидемия, Inchly et al. описали аналогичное относительное количество вирусных коинфекций [14].
В голландском детстве этюд перевозки M . pneumoniae в верхних дыхательных путях (ВДП), сезон и год регистрации повлияли на распространенность бессимптомного носительства в пределах от 3% до 52% [17]. В нашем исследовании часть детей, выписанных из палаты в тот же день, что и госпитализированные, могли быть носителями М . пневмонии . Тем не менее, некоторые из этих детей получали антибиотики первой линии до поступления и были направлены в наше отделение из-за недостаточного ответа на лечение бета-лактамными антибиотиками.
Кроппи и др. [18] установили, что у 50% детей с ИНДП, вызванными М . pneumoniae были коинфицированы преимущественно S . pneumoniae или Chlamydiae spp. . Только небольшая часть этой когорты была проверена на бактериальную коинфекцию, но мы не считали это серьезной проблемой. Примечательно, что 59% детей перед обследованием на М лечились бета-лактамным антибиотиком. pneumoniae без улучшения инфекции.
В отдельные периоды эпидемии в Дании (2010–2011 гг.) Stockholm et al. выявили влияние азитромицина (антибиотик из группы макролидов) на продолжительность эпизода астмоподобных симптомов у детей младшего возраста. Нет исследований для M . Было выполнено pneumoniae , и критерии исключения частоты дыхания более 50/мин, температуры более 39°C и СРБ более 50 мг/л не исключали бы всех детей с возможным М . инфекция pneumoniae [19–21]. Два недавно опубликованных норвежских исследования описали несоответствие частоты клинических симптомов M . pneumoniae инфекций у детей дошкольного возраста между эпидемическим и эндемическим периодами [14,21]. Рандомизированные контролируемые исследования, касающиеся эффективности макролидов при астмоподобных симптомах, следует проводить в периоды эндемии или лучше контролировать для M . pneumoniae инфекций, особенно у детей раннего возраста, родившихся после эпидемического периода. Противовоспалительный эффект макролидов требует дальнейшего изучения [22].
pneumoniae инфекций у детей дошкольного возраста между эпидемическим и эндемическим периодами [14,21]. Рандомизированные контролируемые исследования, касающиеся эффективности макролидов при астмоподобных симптомах, следует проводить в периоды эндемии или лучше контролировать для M . pneumoniae инфекций, особенно у детей раннего возраста, родившихся после эпидемического периода. Противовоспалительный эффект макролидов требует дальнейшего изучения [22].
10% этой когорты страдали хроническими заболеваниями, главным образом тяжелыми респираторными заболеваниями.У нынешних астматиков диагностированы тяжелые обострения бронхиальной астмы.
Дети более старшего возраста, как правило, обращались за помощью позже после появления симптомов и были ответственны за более длительную госпитализацию. Это может указывать на то, что у детей более старшего возраста были более тяжелые инфекции или что задержка с госпитализацией привела к более тяжелому заболеванию и, следовательно, к более длительному периоду реабилитации. Несмотря на это, мы также выявили тяжелую пневмонию по рентгенологическим данным (ателектаз, плевральный выпот) у детей 2-6 лет.С поправкой на численность населения эти дошкольники имели повышенный риск развития тяжелой пневмонии по сравнению со школьниками во время этой эпидемии. Инчли и др. показали одинаковую картину, даже если их определение тяжелой пневмонии различалось [14]. Раннее лечение инфекций может снизить тяжелую заболеваемость и продолжительность пребывания в больнице.
Несмотря на это, мы также выявили тяжелую пневмонию по рентгенологическим данным (ателектаз, плевральный выпот) у детей 2-6 лет.С поправкой на численность населения эти дошкольники имели повышенный риск развития тяжелой пневмонии по сравнению со школьниками во время этой эпидемии. Инчли и др. показали одинаковую картину, даже если их определение тяжелой пневмонии различалось [14]. Раннее лечение инфекций может снизить тяжелую заболеваемость и продолжительность пребывания в больнице.
Обработка M . pneumoniae инфекций, вызванных антибиотиками-макролидами, является спорным, поскольку в Кокрейновском обзоре сделан вывод о недостаточности доказательств, чтобы делать какие-либо конкретные выводы об эффективности антибиотиков у M . пневмонии инфекций у детей [17,22]. Эффективность лечения антибиотиками следует обсуждать в свете правильного диагностического теста [15]. Бессимптомные носители M . pneumoniae необходимо дифференцировать от детей, страдающих симптомными инфекциями, ИНДП, вызванными М . pneumoniae [23]. Гардинер и др. подчеркивают необходимость проведения РКИ по этой теме [17]. В Дании SSI по-прежнему рекомендует лечение M . pneumoniae положительных ИННД у детей [24].Резистентность к макролидам является растущей проблемой во всем мире. В Дании частота оценивается в 2% [25]. Резистентности к макролидам в нашей группе детей выявлено не было.
pneumoniae [23]. Гардинер и др. подчеркивают необходимость проведения РКИ по этой теме [17]. В Дании SSI по-прежнему рекомендует лечение M . pneumoniae положительных ИННД у детей [24].Резистентность к макролидам является растущей проблемой во всем мире. В Дании частота оценивается в 2% [25]. Резистентности к макролидам в нашей группе детей выявлено не было.
Мы обнаружили рентгенологические изменения в 94% рентгенограмм грудной клетки, сделанных в этом исследовании. Рентгенологические данные были довольно разнообразны, но примечательно, что более 80% детей старше двух лет имели лобарную инфильтрацию, в то время как у детей младшего возраста были значительно более тонкие признаки. Это соответствовало итальянскому проспективному исследованию детского возраста [9].
Даже у детей старшего возраста нельзя было отличить симптомы ВП от других возбудителей. Рентгенологические заключения в M . pneumoniae pneumoniae в целом не отличались от ВП.
Почти у 25% всех детей во время болезни была какая-либо сыпь (эритема/крапивница), а у 33% были желудочно-кишечные симптомы, такие как тошнота и/или рвота. Тяжелые внелегочные проявления, сопровождающие респираторные инфекции, вызванные М . Ожидается появление pneumoniae [26].Двум детям в нашей когорте был поставлен диагноз SJS, который является известным осложнением M . pneumoniae [27]. Очаги М . Недавно сообщалось о pneumoniae -ассоциированном ССД у детей [28]. Мы не видели детей с неврологическими симптомами в этой когорте, чего можно было бы ожидать.
Заключение
М . pneumoniae является серьезной причиной ИНДП у детей и может вызывать инфекции, которые трудно отличить от ВП, вызванных другими респираторными патогенами. М . pneumoniae также поражают младенцев и детей раннего возраста в периоды эпидемий, и мы считаем, что M . pneumoniae следует рассматривать как дифференциальный диагноз с респираторными вирусными инфекциями и как причину проблемных симптомов со стороны легких у младенцев и детей и пневмонии. Рентгенограммы органов грудной клетки не имели патогномоничных признаков ВП. Во время надвигающейся эпидемии оценка внелегочных проявлений, особенно иммунологических кожных реакций, может быть полезной при диагностике M . пневмонии инфекций.
Рентгенограммы органов грудной клетки не имели патогномоничных признаков ВП. Во время надвигающейся эпидемии оценка внелегочных проявлений, особенно иммунологических кожных реакций, может быть полезной при диагностике M . пневмонии инфекций.
Вспомогательная информация
Набор данных S1
Анонимная версия базы данных.(XLSX)
Заявление о финансировании
Участвующие отделения (отделение педиатрии, больница Нордселландс, Хиллерёд, Дания и отделение клинической микробиологии, больница Херлев, Херлев, Дания) спонсировали это исследование, финансируя дополнительные микробиологические анализы. на клинические исследования и на заработную плату MJS, MBF, DSH и IMJ.Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Доступность данных
Все соответствующие данные содержатся в документе и в его файлах вспомогательной информации.
Литература
2. Хорнслет А. Вирусология острых респираторных инфекций. 1. Обследование этиологии у детей]. Угескр Лаегер. 1967; 129: 1253–1258. [PubMed] [Google Scholar]3. Хорнслет А. Вирусология острых инфекций дыхательных путей.2. Выделение вирусов у госпитализированных детей. Угескр Лаегер. 1967; 129: 1259–1265. [PubMed] [Google Scholar]4. Харрис М., Кларк Дж., Кут Н., Флетчер П., Харнден А., Маккин М. и др. Рекомендации Британского торакального общества по лечению внебольничной пневмонии у детей: обновление 2011 г. Thorax. 2011;66 Приложение 2: II1–23. doi: 10.1136/thoraxjnl-2011-200598 [PubMed] [Google Scholar]5. Залензинк Д., Вальехо Дж. Инфекция микоплазменной пневмонии у детей. 2009-е изд. Своевременно.
6. Glezen WP, Loda FA, Clyde WA, Senior RJ, Sheaffer CI, Conley WG, et al.Эпидемиологическая картина острых заболеваний нижних дыхательных путей у детей в педиатрической групповой практике. J Педиатр. 1971; 78: 397–406. дои: 10.1016/S0022-3476(71)80218-4 [PubMed] [Google Scholar]7. Uldum SA, Bangsborg JM, Gahrn-Hansen B, Ljung R, Mølvadgaard M, Føns Petersen R, et al.
Эпидемия инфекции Mycoplasma pneumoniae в Дании, 2010 и 2011 гг. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [Google Академия]8. Sørensen CM, Schønning K, Rosenfeldt V. Клинические характеристики детей с инфекцией Mycoplasma pneumoniae, госпитализированных во время эпидемии в Дании 2010–2012 гг.Дэн Мед Дж. 2013; 60: A4632
[PubMed] [Google Scholar]9. Дефилиппи А., Сильвестри М., Такчелла А., Джаккино Р., Мелиоли Г., Ди Марко Э. и др.
Эпидемиология и клинические особенности микоплазменной пневмонии у детей. Респир Мед. 2008; 102: 1762–1768. doi: 10.1016/j.rmed.2008.06.022
[PubMed] [Google Scholar] 10. Gadsby NJ, Reynolds AJ, McMenamin J, Gunson RN, McDonagh S, Molyneaux PJ, et al.
Увеличение количества сообщений о Mycoplasma pneumoniae из лабораторий в Шотландии в 2010 и 2011 годах — влияние эпидемии на младенцев.Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17.
Uldum SA, Bangsborg JM, Gahrn-Hansen B, Ljung R, Mølvadgaard M, Føns Petersen R, et al.
Эпидемия инфекции Mycoplasma pneumoniae в Дании, 2010 и 2011 гг. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [Google Академия]8. Sørensen CM, Schønning K, Rosenfeldt V. Клинические характеристики детей с инфекцией Mycoplasma pneumoniae, госпитализированных во время эпидемии в Дании 2010–2012 гг.Дэн Мед Дж. 2013; 60: A4632
[PubMed] [Google Scholar]9. Дефилиппи А., Сильвестри М., Такчелла А., Джаккино Р., Мелиоли Г., Ди Марко Э. и др.
Эпидемиология и клинические особенности микоплазменной пневмонии у детей. Респир Мед. 2008; 102: 1762–1768. doi: 10.1016/j.rmed.2008.06.022
[PubMed] [Google Scholar] 10. Gadsby NJ, Reynolds AJ, McMenamin J, Gunson RN, McDonagh S, Molyneaux PJ, et al.
Увеличение количества сообщений о Mycoplasma pneumoniae из лабораторий в Шотландии в 2010 и 2011 годах — влияние эпидемии на младенцев.Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [PubMed] [Google Scholar] 12. Чалкер В., Стоки Т., Литт Д., Бермингем А., Уотсон Дж., Флеминг Д. и др.
Рост выявления инфекции Mycoplasma pneumoniae у детей в Англии и Уэльсе, октябрь 2011 г. – январь 2012 г. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [PubMed] [Google Scholar] 13. Алмасри М., Диза Э., Папа А., Эбориаду М., Сулиу Э. Инфекции дыхательных путей Mycoplasma pneumoniae среди греческих детей.Гиппократия. 2011; 15: 147–152. [Бесплатная статья PMC] [PubMed] [Google Scholar]14. Инчли К.С., Берг А.С., Вахдани Бенам А., Квиссел А.К., Лигаард Т.М., Накстад Б. Mycoplasma Pneumoniae: перекрестное популяционное сравнение тяжести заболевания у детей дошкольного и школьного возраста. Pediatr Infect Dis J. 2017; 36: 930–936. дои: 10.1097/INF.0000000000001628
[PubMed] [Google Scholar] 15. Spuesens EBM, Fraaij PLA, Visser EG, Hoogenboezem T, Hop WCJ, van Adrichem LNA и др.
Носительство Mycoplasma pneumoniae в верхних дыхательных путях симптомных и бессимптомных детей: обсервационное исследование.
[PubMed] [Google Scholar] 12. Чалкер В., Стоки Т., Литт Д., Бермингем А., Уотсон Дж., Флеминг Д. и др.
Рост выявления инфекции Mycoplasma pneumoniae у детей в Англии и Уэльсе, октябрь 2011 г. – январь 2012 г. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [PubMed] [Google Scholar] 13. Алмасри М., Диза Э., Папа А., Эбориаду М., Сулиу Э. Инфекции дыхательных путей Mycoplasma pneumoniae среди греческих детей.Гиппократия. 2011; 15: 147–152. [Бесплатная статья PMC] [PubMed] [Google Scholar]14. Инчли К.С., Берг А.С., Вахдани Бенам А., Квиссел А.К., Лигаард Т.М., Накстад Б. Mycoplasma Pneumoniae: перекрестное популяционное сравнение тяжести заболевания у детей дошкольного и школьного возраста. Pediatr Infect Dis J. 2017; 36: 930–936. дои: 10.1097/INF.0000000000001628
[PubMed] [Google Scholar] 15. Spuesens EBM, Fraaij PLA, Visser EG, Hoogenboezem T, Hop WCJ, van Adrichem LNA и др.
Носительство Mycoplasma pneumoniae в верхних дыхательных путях симптомных и бессимптомных детей: обсервационное исследование. ПЛОС Мед. 2013;10: e1001444
doi: 10.1371/journal.pmed.1001444
[Бесплатная статья PMC] [PubMed] [Google Scholar]16. Флеминг С., Томпсон М., Стивенс Р., Хенеган С., Плюддеманн А., Маконочи И. и др.
Нормальные диапазоны частоты сердечных сокращений и частоты дыхания у детей от рождения до 18 лет: систематический обзор обсервационных исследований. Ланцет. 2011; 377: 1011–1018. дои: 10.1016/S0140-6736(10)62226-X
[Бесплатная статья PMC] [PubMed] [Google Scholar]17. Гардинер С.Дж., Гавранич Дж.Б., Чанг А.Б. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. В: The Cochrane Collaboration, под редакцией.Кокрановская база данных систематических обзоров. Чичестер, Великобритания: John Wiley & Sons, Ltd; 2015.
дои: 10.1002/14651858.CD004875.pub5
[PubMed] [Google Scholar] 18. Корппи М., Хейсканен-Косма Т., Клеемола М. Заболеваемость внебольничной пневмонией у детей, вызванной Mycoplasma pneumoniae: серологические результаты проспективного популяционного исследования в первичной медико-санитарной помощи.
ПЛОС Мед. 2013;10: e1001444
doi: 10.1371/journal.pmed.1001444
[Бесплатная статья PMC] [PubMed] [Google Scholar]16. Флеминг С., Томпсон М., Стивенс Р., Хенеган С., Плюддеманн А., Маконочи И. и др.
Нормальные диапазоны частоты сердечных сокращений и частоты дыхания у детей от рождения до 18 лет: систематический обзор обсервационных исследований. Ланцет. 2011; 377: 1011–1018. дои: 10.1016/S0140-6736(10)62226-X
[Бесплатная статья PMC] [PubMed] [Google Scholar]17. Гардинер С.Дж., Гавранич Дж.Б., Чанг А.Б. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. В: The Cochrane Collaboration, под редакцией.Кокрановская база данных систематических обзоров. Чичестер, Великобритания: John Wiley & Sons, Ltd; 2015.
дои: 10.1002/14651858.CD004875.pub5
[PubMed] [Google Scholar] 18. Корппи М., Хейсканен-Косма Т., Клеемола М. Заболеваемость внебольничной пневмонией у детей, вызванной Mycoplasma pneumoniae: серологические результаты проспективного популяционного исследования в первичной медико-санитарной помощи. Респирол Карлтон Вик. 2004; 9: 109–114. doi: 10.1111/j.1440-1843.2003.00522.x
[PubMed] [Google Scholar] 19. Stokholm J, Chawes BL, Vissing NH, Bjarnadóttir E, Pedersen TM, Vinding RK, et al.Азитромицин при эпизодах с астмоподобными симптомами у детей младшего возраста в возрасте 1–3 лет: рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет Респир Мед. 2016;4: 19–26. дои: 10.1016/S2213-2600(15)00500-7
[Бесплатная статья PMC] [PubMed] [Google Scholar]20. Stokholm J, Bisgaard H. Хроническая инфекция легких Chlamydia pneumoniae: забытое объяснение эффектов макролидов при хрипах и астме? – Ответ авторов. Ланцет Респир Мед. 2016;4: е8–е9. doi: 10.1016/S2213-2600(16)00050-3 [PubMed] [Google Scholar]21.Берг А.С., Инчли К.С., Аасэ А., Фьерли Х.О., Булл Р., Ааберге И. и др.
Этиология пневмонии у детей с высоким охватом пневмококковой вакциной: проспективное исследование. Pediatr Infect Dis J. 2016; 35: e69–75. дои: 10.1097/INF.0000000000001009
[PubMed] [Google Scholar] 22.
Респирол Карлтон Вик. 2004; 9: 109–114. doi: 10.1111/j.1440-1843.2003.00522.x
[PubMed] [Google Scholar] 19. Stokholm J, Chawes BL, Vissing NH, Bjarnadóttir E, Pedersen TM, Vinding RK, et al.Азитромицин при эпизодах с астмоподобными симптомами у детей младшего возраста в возрасте 1–3 лет: рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет Респир Мед. 2016;4: 19–26. дои: 10.1016/S2213-2600(15)00500-7
[Бесплатная статья PMC] [PubMed] [Google Scholar]20. Stokholm J, Bisgaard H. Хроническая инфекция легких Chlamydia pneumoniae: забытое объяснение эффектов макролидов при хрипах и астме? – Ответ авторов. Ланцет Респир Мед. 2016;4: е8–е9. doi: 10.1016/S2213-2600(16)00050-3 [PubMed] [Google Scholar]21.Берг А.С., Инчли К.С., Аасэ А., Фьерли Х.О., Булл Р., Ааберге И. и др.
Этиология пневмонии у детей с высоким охватом пневмококковой вакциной: проспективное исследование. Pediatr Infect Dis J. 2016; 35: e69–75. дои: 10.1097/INF.0000000000001009
[PubMed] [Google Scholar] 22. Малхолланд С., Гавранич Д.Б., Гиллис М.Б., Чанг А.Б. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. Cochrane Database Syst Rev. 2012;9: CD004875
дои: 10.1002/14651858.CD004875.pub4
[PubMed] [Google Scholar] 25. Ульдум С.А., Амберг П., Дженсен Дж.С. [Резистентность к макролидам у Mycoplasma pneumoniae при рецидивах и продолжительных заболеваниях]. Угескр Лаегер. 2012; 174: 730–731. [PubMed] [Google Scholar] 26. Бьёрн А-МБ, Лебех А-МК. Внелегочные осложнения микоплазменной пневмонии. Угескр Лаегер. 2002; 164: 1805–1809 гг. [PubMed] [Google Scholar]
Малхолланд С., Гавранич Д.Б., Гиллис М.Б., Чанг А.Б. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. Cochrane Database Syst Rev. 2012;9: CD004875
дои: 10.1002/14651858.CD004875.pub4
[PubMed] [Google Scholar] 25. Ульдум С.А., Амберг П., Дженсен Дж.С. [Резистентность к макролидам у Mycoplasma pneumoniae при рецидивах и продолжительных заболеваниях]. Угескр Лаегер. 2012; 174: 730–731. [PubMed] [Google Scholar] 26. Бьёрн А-МБ, Лебех А-МК. Внелегочные осложнения микоплазменной пневмонии. Угескр Лаегер. 2002; 164: 1805–1809 гг. [PubMed] [Google Scholar]Клинические проявления у младенцев и детей с инфекцией Mycoplasma pneumoniae
PLoS One.2018; 13(4): e01.
, Курирование данных, Формальный анализ, Исследование, Написание – первоначальный проект, 1, * , Исследование, Методология, Проверка, Написание – обзор и редактирование, 2 , Концептуализация, Методология, Надзор, Написание – обзор и редактирование , 2 и , Концептуализация, Методология, Управление проектом, Надзор, Написание – проверка и редактирование 1Миа Йоханна Сёндергаард
1 Отделение педиатрии, больница Nordsjællands, Hillerød, Дания
Martin Barfred Friis
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Dennis Schrøder Hansen
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Inger Merete Jørgensen
1 Отделение педиатрии, Больница Нордселландс, Хиллерёд, Дания
Оливер Шильдген, редактор
1 Отделение педиатрии, Больница Нордселландс, Хиллерёд, Дания
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Kliniken der Stadt Köln gGmbH, ГЕРМАНИЯ
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Поступила в редакцию 21 окт. 2016 г.; Принято 14 февраля 2018 г.
Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.Эта статья была процитирована. по другим статьям в PMC.Abstract
История вопроса
Mycoplasma pneumoniae является частой причиной внебольничной пневмонии у детей старшего возраста.Легочные и внелегочные симптомы, связанные с M . Зарегистрировано пневмонии инфекций. М . pneumoniae носит преимущественно эпидемический характер в Дании с рецидивами каждые 4-7 -го -го года.
Цели
Ретроспективно описать эпидемиологию и клинические особенности у младенцев и детей в течение М . pneumoniae эпидемия 2010 и 2011 гг.Включено pneumoniae за период 01. 02.2010–31.01.2012. Медицинские карты, а также рентгенологические данные были рассмотрены для всех детей с М . пневмонии . Для части когорты был проведен ретроспективный анализ вирусных коинфекций.
02.2010–31.01.2012. Медицинские карты, а также рентгенологические данные были рассмотрены для всех детей с М . пневмонии . Для части когорты был проведен ретроспективный анализ вирусных коинфекций.
Результаты
134 из 746 детей дали положительный результат на М . pneumoniae с помощью ПЦР или серологии. Положительные тесты были обнаружены у 65% детей 7 лет и старше, у 30% детей 2-6 лет и у 4% детей грудного возраста (до двух лет).Вирусная коинфекция была обнаружена в 27% протестированных образцов. Клиническими проявлениями были кашель, астматические симптомы и субфебрильная температура. Внелегочные симптомы были частыми и проявлялись тошнотой/рвотой у 33% детей и кожными проявлениями у 25%. 84% детей сделали рентген грудной клетки, и у 94% из них были положительные результаты рентгенологического исследования.
Заключение
М . pneumoniae также поражал младенцев и детей младшего возраста, и симптомы были похожи на инфекции респираторными вирусами, но также наблюдались тяжелые ИНДП.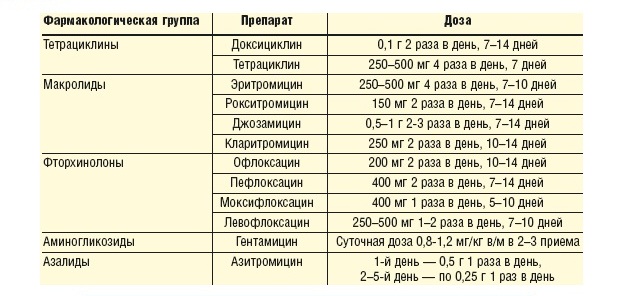 Во время надвигающейся эпидемии оценка внелегочных проявлений может быть полезной при диагностике M . пневмонии инфекций.
Во время надвигающейся эпидемии оценка внелегочных проявлений может быть полезной при диагностике M . пневмонии инфекций.
Введение
Mycoplasma pneumoniae ( M . pneumoniae ) является важной причиной инфекций дыхательных путей, особенно у детей и молодых людей, и, по оценкам, на нее приходится до 30–40% внебольничных инфекций. пневмонии (ВП) [1–4]. Легочные проявления обычно представляют собой трахеобронхит и пневмонию, сопровождающиеся кашлем, а также хрипами.Маленькие дети считаются менее восприимчивыми к M . pneumoniae у детей школьного возраста [5,6]. В Дании M . pneumoniae носит преимущественно эпидемический характер с частотой рецидивов каждые 4-7 — лет [7].
Дания испытала M . Эпидемия pneumoniae с пиком осенью 2010 г. и снова осенью 2011 г. Statens Serum Institut (SSI), отвечающий за национальную систему эпиднадзора в Дании, описал ее как две волны одной и той же эпидемии [7].
Осознание того, что дети дошкольного возраста и даже младенцы могут быть восприимчивы и иметь клинические симптомы от M . Инфекция pneumoniae развилась в последние годы и была зарегистрирована в исследованиях, проведенных в Европе и Австралии [8–14]. С клинической точки зрения важно установить, является ли M . pneumoniae играет важную дифференциальную роль в инфекциях нижних дыхательных путей и астмоподобных обострениях у детей раннего возраста и младенцев.В последние годы актуален вопрос о коинфекциях и бессимптомном носительстве М . pneumoniae и, следовательно, гипердиагностика M . pneumoniae с помощью ПЦР обсуждался [15].
Целью данного исследования было описание и характеристика M . pneumoniae в условиях стационара, а также для оценки возможных возрастных клинических признаков у младенцев, детей младшего возраста и детей старшего возраста, госпитализированных с диагнозом M . пневмония инфекция. Исследование было начато, так как мы испытали сдвиг в клинической картине нашего M . пневмонии больных во время эпидемии. Литература в этой области обширна и содержит различные мнения, как уже упоминалось, о патогенности бактерий и показаниях к лечению, а также о значении инфекций у детей дошкольного возраста. Наш отчет — еще один кирпичик в понимании этого патогена.
пневмония инфекция. Исследование было начато, так как мы испытали сдвиг в клинической картине нашего M . пневмонии больных во время эпидемии. Литература в этой области обширна и содержит различные мнения, как уже упоминалось, о патогенности бактерий и показаниях к лечению, а также о значении инфекций у детей дошкольного возраста. Наш отчет — еще один кирпичик в понимании этого патогена.
Материалы и методы
Мы разработали ретроспективный анализ всех детей в возрасте до 16 лет, поступивших в педиатрическое отделение больницы Нордселландс, Хиллерёд, Дания, которые были исследованы на M . pneumoniae либо с помощью полимеразной цепной реакции (ПЦР), либо с помощью серологии ( M . pneumoniae тест на антитела и тест холодовой агглютинации). Период исследования: с 01.02.2010 по 31.01.2012. Мы собрали результаты ПЦР и результаты образцов крови как в нашей местной микробиологической лаборатории (ПЦР), так и в SSI (ПЦР и серология). Данные были сопоставлены по номеру социального страхования, чтобы избежать двойной выборки. ПЦР проводили на мазках из ротоглотки, которые хранили и транспортировали в лабораторию в охлажденном виде.Диагностика М . pneumoniae был основан на коммерчески доступном наборе для ПЦР в реальном времени (RT-PCR) (Minerva Biolabs Venor R Mp Mycoplasma pneumoniae — Диагностический набор для количественной ПЦР типа I), направленном на ген цитоадгезии P1. ПЦР представлял собой мультиплексный анализ, также нацеленный на Chlamydophila pneumoniae/psittaci . Анализ проводили в соответствии с описанием производителя. Короче говоря, 10 мкл образца добавляли к 14,4 мкл мастермикса, содержащего 14 мкл буфера, 0.2 мкл Taq-полимеразы и 0,2 мкл урацил-N-гликозилазы. ОТ-ПЦР проводили при следующих условиях на машине Stratagene Mx 3005P RT-PCR: 10 мин при 95°C, затем 45 циклов по 30 с при 95°C, 30 с при 55°C и 30 с при 60°C. . М . В фильтре FAM было обнаружено pneumoniae .
Данные были сопоставлены по номеру социального страхования, чтобы избежать двойной выборки. ПЦР проводили на мазках из ротоглотки, которые хранили и транспортировали в лабораторию в охлажденном виде.Диагностика М . pneumoniae был основан на коммерчески доступном наборе для ПЦР в реальном времени (RT-PCR) (Minerva Biolabs Venor R Mp Mycoplasma pneumoniae — Диагностический набор для количественной ПЦР типа I), направленном на ген цитоадгезии P1. ПЦР представлял собой мультиплексный анализ, также нацеленный на Chlamydophila pneumoniae/psittaci . Анализ проводили в соответствии с описанием производителя. Короче говоря, 10 мкл образца добавляли к 14,4 мкл мастермикса, содержащего 14 мкл буфера, 0.2 мкл Taq-полимеразы и 0,2 мкл урацил-N-гликозилазы. ОТ-ПЦР проводили при следующих условиях на машине Stratagene Mx 3005P RT-PCR: 10 мин при 95°C, затем 45 циклов по 30 с при 95°C, 30 с при 55°C и 30 с при 60°C. . М . В фильтре FAM было обнаружено pneumoniae .
Серологические тесты были выполнены внешним коммерческим поставщиком (SSI) и основаны на M . pneumoniae специфические антитела IgM (MPT) вместе с холодовыми агглютининами (KAT).Титр как МФТ, так и КАТ выше или равный 64 считался положительным тестом. Поскольку титры КАТ падают быстрее после перенесенной инфекции, ее использовали для повышения вероятности продолжающейся инфекции. Подсчитано, что 95% лиц моложе 20 лет имеют положительные титры КАТ в ответ на М . Инфекция pneumoniae (тест-информация об ИОХВ).
Дети с двумя или более положительными ПЦР-тестами в течение трех месяцев рассматривались как один и тот же инфекционный эпизод и включались только один раз.
Дети были направлены врачами общей практики или отделением неотложной помощи больницы. Дежурный врач заказал М . pneumoniae отбор проб согласно клинической оценке.
Были собраны демографические и клинические данные о 134 детях с положительным тестом на M .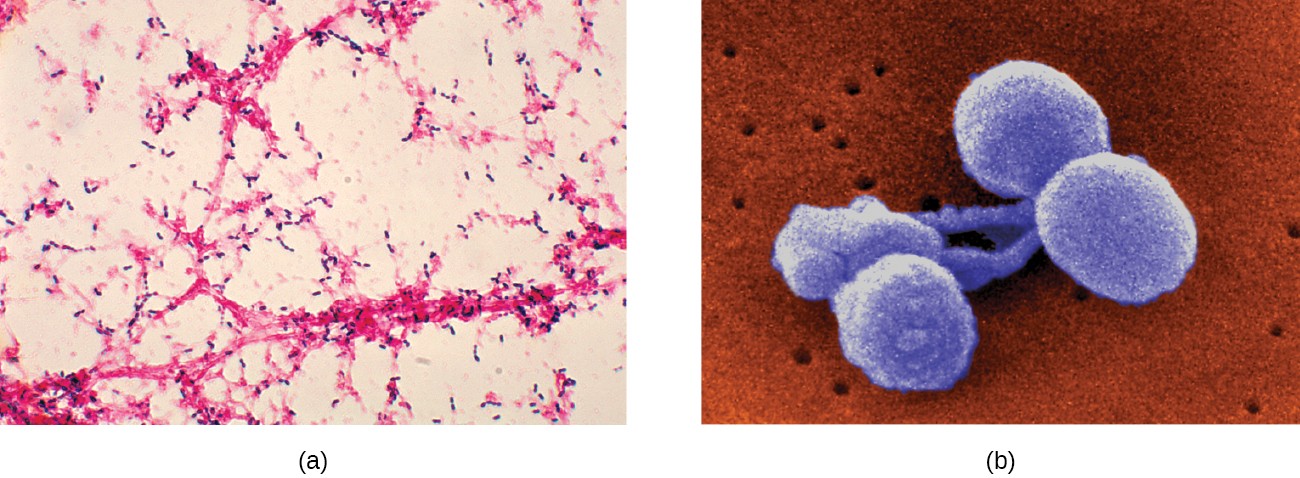 pneumoniae , судя по медицинской карте. Карты 612 детей с отрицательными тестами не проверены. Медицинский анамнез систематически анализировался с использованием компьютеризированных медицинских карт, радиологических отчетов и лабораторных отчетов.Анализируемые характеристики включали демографические данные (возраст, пол, история болезни до поступления), клиническую картину (легочные и внелегочные симптомы, клиническое обследование, частота дыхания, аускультация, температура, сатурация кислорода), рентгенологические данные, биохимию (С-реактивный белок ( СРБ), количество лейкоцитов при поступлении) сопутствующие инфекции, осложнения и медикаментозное лечение. Для анализа данных дети были разделены на возрастные группы: до двух лет (далее в тексте — младенцы), 2–6 лет и 7–15 лет (дети школьного возраста).
pneumoniae , судя по медицинской карте. Карты 612 детей с отрицательными тестами не проверены. Медицинский анамнез систематически анализировался с использованием компьютеризированных медицинских карт, радиологических отчетов и лабораторных отчетов.Анализируемые характеристики включали демографические данные (возраст, пол, история болезни до поступления), клиническую картину (легочные и внелегочные симптомы, клиническое обследование, частота дыхания, аускультация, температура, сатурация кислорода), рентгенологические данные, биохимию (С-реактивный белок ( СРБ), количество лейкоцитов при поступлении) сопутствующие инфекции, осложнения и медикаментозное лечение. Для анализа данных дети были разделены на возрастные группы: до двух лет (далее в тексте — младенцы), 2–6 лет и 7–15 лет (дети школьного возраста).
Для дальнейшего ответа на вопрос о вирусных коинфекциях, ретроспективный анализ исходного замороженного образца ротоглоточного мазка из 49 из M . pneumoniae положительных когорты были протестированы с помощью ПЦР с использованием имеющегося в продаже набора (линейка Biomerieux Respiratory MWS R-Gene) на широкий спектр респираторных вирусов (включая респираторно-синцитиальный вирус (RSV), грипп A и B, метапневмовирус человека, риновирус , вирус парагриппа, коронавирус, бокавирус и аденовирус). Короче говоря, ПЦР проводили в четырех двойных комплексах; 10 мкл образца добавляли к 15 мкл мастер-микса, содержащего буфер, обратную транскриптазу и смесь праймер/зонд. ОТ-ПЦР проводили при следующих условиях на приборе Stratagene Mx 3005P для ОТ-ПЦР: 5 мин при 50°С, 15 мин при 95°С, затем 45 циклов по 10 с при 95°С, 40 с при 60°С. °С и 25 сек при 72°С. Цели Al были обнаружены либо в фильтре FAM, либо в фильтре HEX.
Короче говоря, ПЦР проводили в четырех двойных комплексах; 10 мкл образца добавляли к 15 мкл мастер-микса, содержащего буфер, обратную транскриптазу и смесь праймер/зонд. ОТ-ПЦР проводили при следующих условиях на приборе Stratagene Mx 3005P для ОТ-ПЦР: 5 мин при 50°С, 15 мин при 95°С, затем 45 циклов по 10 с при 95°С, 40 с при 60°С. °С и 25 сек при 72°С. Цели Al были обнаружены либо в фильтре FAM, либо в фильтре HEX.
Положительные образцы после более чем 35 Ct-циклов были повторно оценены для подтверждения действительно положительного результата.
Комитет по этике региона Ховедстаден (номер протокола: H-2-2012-132), а также Датское агентство по защите данных одобрили исследование. Это одобрение включало согласие на просмотр медицинских записей без информированного согласия пациентов.
Статистический анализ выполнен в STATA 10.0, программных пакетах SPSS версии 22 и Microsoft Excell. Chi 2 -критерий, точный критерий Фишера или Z-критерий использовали для анализа категорийных данных и двухвыборочный Т-критерий для числовых данных. Значение p <0,05 считалось значимым.
Значение p <0,05 считалось значимым.
Результаты
Эпидемиологические данные
Из 885 пациентов протестированы на M . pneumoniae в период исследования, 139 были исключены из-за возраста (старше 15 лет), двойного отбора проб или повторных проб в течение трех месяцев. Всего в исследование было включено 746 детей с инфекцией дыхательных путей (ИРТ), у 134 из которых был положительный тест на M . пневмонии . Из 740 М . pneumoniae Включено ПЦР-анализов, 132 из которых были положительными, а из 20 серологических тестов 3 были положительными. Четырнадцать детей были протестированы как с помощью ПЦР в реальном времени, так и с помощью серологии.
показывает количество детей, протестированных на M . pneumoniae и количество положительных случаев по месяцам. Эпидемия достигла своего пика в октябре 2010 года и снова в октябре-декабре 2011 года. Численность М . pneumoniae положительных случая составило 50 (из 386) в первый эпидемический сезон и 84 (из 360) во второй период эпидемии, при значительно более высоком показателе (0,13 против 0,23) положительных случаев в более позднем (р = 0,0002, хи 2 — тест). В целом у 18% детей, протестированных на M. pneumonia, был положительный образец.
В целом у 18% детей, протестированных на M. pneumonia, был положительный образец.
Количество положительных и отрицательных M . пневмонии тестов по годам и месяцам.
Высшая скорость М . pneumoniae положительных образца были у детей школьного возраста (65%), но особенно у детей дошкольного возраста (30%), и даже у шести детей в возрасте до двух лет (4%) было M . пневмонии положительных теста.
Клиническая картина, рентгенологические данные и лабораторные исследования
Характеристики пациентов, стратифицированные по возрастным группам, представлены в .
Таблица 1
Симптомы, внелегочные симптомы, объективные признаки, биохимические и рентгенологические данные у детей с Mycoplasma pneumoniae.
| <2 Y | 2-6 Y | 7-15 y | Всего | <2 Y | 2-6 y | 7-15 y | Всего | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Объективные признаки: | ||||||||||||
| Количество детей | 6 | 40 | 88 | 134 | тахипноэ, (%) W | 0 | 52 | 52 | 57 | 57 | 52 | 52 |
| мужчины (%) | 67 | 67 | 60324 | 53 | 56 | Температура ° C (Median [IQR]) | 38. 5 [37.4: 39.4] 5 [37.4: 39.4] | 37.8 [37.3: 38.5] | 37.9 [37.5: 38.8] | 37,9 [37.4: 38.8] | ||
| Симптоматические дни до приема (среднее) * | 4 | 12 | 10 | 10 | 10 | 10 | Auscultation-hheezing (%) | 33 | 24 | 23 | 23 | 24 |
| дня поступления (среднее) ** | 2 | 1,8 | 2,3 | 2,2 | 2,2 | 2,2 | Auscultation-Trackles / Снижение звуки дыхания (%) | 47 | 47 | 57 | 56 | |
| симптомов: | Лабораторные испытания: Y | |||||||||||
| Chough (%) | 100 | 100 | 99 | 99 | 99 | CRP, мг / л (медианы [IQR]) | 33 [слишком мало] | 28. 5 [17.5: 40.3] 5 [17.5: 40.3] | 25 [16.5: 32.5] | 28 [16.3: 39.3] | ||
| Hheezing (%) | 50 | 17 | 16 | 17 | Количество лейкоцитов (Median [IQR ]) | 17.0 [Слишком мало] | 8.1 [5.8: 11.9] | 10,3 [8.3: 12.7] | 9.3 [6.2: 12.2] | |||
| Rhinorrhoea (%) | 40 | 11 | 15 | Количество нейтрофилов (медиана [IQR]) | 9,6 [слишком мало] | 5. 3 [3.9: 9.3] 3 [3.9: 9.3] | 6.6 [5.1: 8.3] | 5.8 [4.0: 8.9] | ||||
| Боли в горле (%) | 0 | 18 | 26 | 26 | 22 | Количество лимфоцитов (Median [ IQR]) | 5.2 [Слишком мало] | 1.5 [1.1: 1.8] | 2.2 [1.7: 2.9] | [1.7: 2.9]1.7 [1.3: 2.5] | ||
| 0 | 0 | 5 | 3 | |||||||||
| внелегочного симптомы: | Рентгенологически: Z | |||||||||||
| Лихорадка ≥ 38 ° C (%) | 94 | 94 | 94 | 9 94 | 91 | 91 | Илала Аденопатия (исключительно) (%) | 3 | 13 | 5 | 903 49 8||
| Make Mainestation (ALL) x (%) | 18 | 18 | 24 | 23 | Infiltration Lobar (%) | 33 | 81 | 82 | 80 | |||
| Urticarial Rash (%) | 17 | 0 | 0 | 13 | 9 | Atelectasis (%) | 0 | 16 | 19 | 18 | 18 | |
| Стивен Джонсон Синдром (NO) | 0 | 0 | 2 | 2 | 2 | 2 | 9 | 9 | 9 | 9 | 9 | |
| Тошнота и / или рвота (%) | 33 | 32 | 30 | 31 | Эмпиема (нет) | 0 | 0 | 1 | 1 |
Дети в возрасте до двух лет поступали в стационар значительно раньше после появления симптомов s, чем дети старшего возраста, (p = 0. 01, двухвыборочный t-критерий). 61% детей были выписаны из стационара в день поступления.
01, двухвыборочный t-критерий). 61% детей были выписаны из стационара в день поступления.
Наиболее частым респираторным проявлением был кашель (100%) вместе с возрастной степенью хрипов (). При поступлении в стационар у 92% младенцев и детей был диагностирован эпизод неприятных симптомов со стороны легких продолжительностью не менее трех дней. Значительно больше детей младшего возраста (до трех лет) имели объективные хрипы и кашель (астмоподобные симптомы), чем дети старшего возраста (p = 0.01, Z-критерий). Предшествующее и клинически значимое хроническое заболевание диагностировано у 10% детей. Из них 4/13 (31%) имели ранее диагностированную и текущую астму, а также имели тяжелые обострения в течение М . пневмония инфекция.
Большинству пациентов (84%) была сделана рентгенограмма органов грудной клетки, и у 96% из них рентгенологические результаты были положительными (). Среди детей грудного и раннего возраста чаще встречалась эксклюзивная внутригрудная лимфаденопатия, в то время как у детей более старшего возраста обычно выявлялась значительная периферическая инфильтрация на рентгенограмме органов грудной клетки (10). Дети с ателектазом имели значительно большую продолжительность пребывания в стационаре; более трех дней (35% против 25%; p = 0,05). Частота легочных осложнений была одинаковой для детей с СРБ выше 50 мг/л (POCT (тестирование в месте оказания медицинской помощи), часть определения тяжелой пневмонии у взрослых) и ниже 50 мг/л (18% против 19%, p > 0,05). В возрастной группе до двух лет не было зарегистрировано легочных осложнений. Количество тяжелых проявлений пневмонии было одинаковым в возрастных группах; 2–6 лет и 7–15 лет (таблица).В целом 20% детей имели повышенный уровень СРБ более 50 мг/л, и все они были старше трех лет.
Дети с ателектазом имели значительно большую продолжительность пребывания в стационаре; более трех дней (35% против 25%; p = 0,05). Частота легочных осложнений была одинаковой для детей с СРБ выше 50 мг/л (POCT (тестирование в месте оказания медицинской помощи), часть определения тяжелой пневмонии у взрослых) и ниже 50 мг/л (18% против 19%, p > 0,05). В возрастной группе до двух лет не было зарегистрировано легочных осложнений. Количество тяжелых проявлений пневмонии было одинаковым в возрастных группах; 2–6 лет и 7–15 лет (таблица).В целом 20% детей имели повышенный уровень СРБ более 50 мг/л, и все они были старше трех лет.
Лечение антибиотиками получили 120 детей. Большинство пациентов лечились кларитромицином в соответствии с местными рекомендациями. 64 пациента, или 46%, лечились по подозрению. Из них 53% получали другие антибиотики (бета-лактам) до M . пневмония тестирование. Лечение было начато 56 больным (42%) после получения положительного результата теста. Только шесть детей лечили макролидными антибиотиками дважды из-за подозрения на рецидив или неэффективность лечения. Один образец был протестирован на устойчивость к макролидам и показал отрицательный результат.
Только шесть детей лечили макролидными антибиотиками дважды из-за подозрения на рецидив или неэффективность лечения. Один образец был протестирован на устойчивость к макролидам и показал отрицательный результат.
Наиболее частым внелегочным проявлением была тошнота с рвотой или без нее, о которой сообщала треть всех детей. У 23% всех детей была сыпь в той или иной форме, а у 9% была крапивница. У детей раннего возраста кожные проявления были в 33% случаев. У двух детей развился синдром Стивена-Джонсона (ССД) с симптомами поражения слизистых оболочек, возникшими до или одновременно с началом лечения антибиотиками.
Одновременно проведено исследование посевов мокроты на другие бактериальные возбудители у 37 детей. У 41% из них была диагностирована коинфекция. Наиболее распространенными бактериями были Moraxella catarrhalis , Haemophilus influenzae и S . пневмония . Из-за методологической установки все дети были протестированы на Chlamydophila pneumoniae ни один из них не оказался положительным.
Только двое детей были протестированы на вирусные инфекции во время клинической подготовки.Апостериорный анализ 49 мазков из ротоглотки показал, что 27% из них имели одиночную или смешанную вирусную коинфекцию (РСВ (1 ребенок), грипп А (2), метапневмовирус человека (1), риновирус (2), коронавирус). (3), бокавирус (2) и аденовирус (5)). Четверо детей оказались положительными с помощью ПЦР на два вируса, а также на M . пневмонии . показывает, по аналогии с , клинические характеристики детей с неизвестной вирусной инфекцией, без нее и с неизвестной вирусной инфекцией. Полученные данные свидетельствуют о том, что значительно чаще детей с микст-инфекцией М . pneumoniae и респираторный вирус имели ринорею (p = 0,02) и хрипы (тенденция, p = 0,07) по сравнению с теми, кто был положительным только на M . пневмонии . Мы не смогли выявить других различий между двумя группами, включая отсутствие рентгенологических расхождений.
Таблица 2
Симптомы, внелегочные симптомы, объективные признаки и рентгенологические данные у детей с Mycoplasma pneumoniae с вирусной коинфекцией или без нее.
| Мп положительный и вирус положительный | Мп положительный и вирус отрицательный | Мп положительный и вирус Неизвестный | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | <2 Y | 2-15 y | 2 <2 y | 2 -15 y | <2 Y | 2-15 Y | 9032 9 | Количество детей | 3 | 10 | 0 | 36 | 3 | 82 | 82 |
| мужчины (%) | 33 | 50 | — | — | — | — | — | 64 | 100 | 51 | 51 | 51 |
| Симптоматические дни до приема (среднее) | 4 | 16 | — | 9.1 | 2,7 | 9,8 | ||||||
| Дни приема (средние) | 1,8 | 2,5 | — | 2,4 | 1,7 | 2,2 | ||||||
| Симптомы : | ||||||||||||
| Кашель (%) | 100 | 90 | — | 100 | 100 | 100 | ||||||
| хрипов (%) | 5024 | 50 * | — | 19 * | 50 | 50 | 10 | |||||
| Rhinorrehea (%) | 0 | 44 ** | — | 7 ** | 67 | 14 | ||||||
| Боль в горле (%) | NA | 24 9000 | — | 27 | 0 | 20 | ||||||
| крупе симптомы (%) | 0 | 0 | — | 0 | 0 | 7 | ||||||
| внелегочного симптомы : | ||||||||||||
| Лихорадка ≥ 38 ° С (%) | 100 | 70 | — | 97 | 67 | 67 | 93 | 93 | 93 | |||
| Skin Mainestation (ALL) x (%) | 67 | 67 | 0 | — | 14 | 0 | 29 | |||||
| Urticarial Rash (%) | 33 | 0 | — | 3 | 0 | 12 | ||||||
| Синдром Стивена Джонсона (нет) | 2 0— | 1 | 0 | 1 | ||||||||
| Тошнота и / или рвота (%) | 0 | 11 | — | 39 | 67 | 31 | ||||||
| Объективные признаки : | ||||||||||||
| тахипноэ Вт (%) | 0 | 44 | — | 53 | 0 | 57 | ||||||
| Температура °C (средняя) | 38.4 | 38,1 — | 38,238,2 | 37,9 | ||||||||
| Аускультация-хрипы (%) | 33 | 20 | — | 24 | 0 | 27 | ||||||
| Auscultation- хрипы / уменьшились дыхание звуки (%) | 100 | 60 | — | 52 | 67 | 44 | ||||||
| Рентгенологически : | ||||||||||||
| внутригрудной лимфаденопатией (исключительно) (%) | 50 | 13 | — | 7 | Н.А. | 7 | ||||||
| Лобар инфильтрация (%) | 50 | 63 | — | 86 | н/д | 85 | ||||||
| Atelectasis (%) | 0 | 13 | — | — | 25 9 | Na | 19 | |||||
| 0 | 0 | — | 11 | Na | 7 | |||||||
| Эмпиема (нет) | 0 | 0 | — | 0 | NA | 1 | ||||||
Обсуждение
Мы представляем данные большой когорты детей с М . пневмония инфекция. Все включенные в исследование дети были направлены из системы первичной медико-санитарной помощи на госпитализацию в связи с характером и тяжестью симптомов. Большинство M . pneumoniae детей с положительным ПЦР-тестом имели ИНДП, что мы подтверждали высокой частотой рентгенологических находок (94%).
Мы обнаружили более высокую частоту положительных проб на поздней волне эпидемии в 2010 и 2011 годах. Дети школьного возраста чаще M . pneumoniae положительных (65%), чем у детей младшего возраста, но даже среди детей в возрасте от 2 до 6 лет 30% были М . pneumoniae положительный результат, подтверждающий наше первоначальное подозрение, что M . pneumoniae также поражает маленьких детей. Даже небольшое количество младенцев; 6 из 276 были диагностированы.
Это исследование проводилось как ретроспективное картографическое исследование. Врач по вызову решил, кого проверить на М . пневмонии . Дети с М . Инфекция pneumoniae могла быть недодиагностирована, если у них были незначительные респираторные симптомы, особенно во время первой волны эпидемического периода.Из-за общепринятых концепций эпидемиологии ВП, первоначально основанных на долгосрочном исследовании, проведенном в учреждениях первичной медико-санитарной помощи с 1963 по 1975 г., мы ожидаем, что младенцы и дети младшего возраста будут недодиагностированы из-за систематической ошибки отбора [6].
Даже очень маленькие дети могут заболеть от M . pneumoniae , хотя встречается реже. Необходимо учитывать дифференциальную диагностику респираторных вирусных инфекций и обострения астмоподобных симптомов. Клиническая картина с кашлем, свистящими хрипами, субфебрилитетом, СРБ ниже 50 мг/л и хрипами при аускультации у 33% детей раннего возраста также может быть расценена как обострение астмы детского возраста, в первую очередь за счет вирусной инфекции в дети дошкольного возраста.Действительно, у нас также была незначительная степень смешанных вирусных коинфекций, обнаруженных в нашем апостериорном анализе. Можно только предполагать, какой возбудитель явился первопричиной заболевания в этих случаях. В связи с нашими постфактум выводами, мы рекомендуем, чтобы маленькие дети с хрипами и ринореей были проверены на оба M . pneumoniae и респираторно-вирусные инфекции одновременно. За норвежский М . pneumoniae эпидемия, Inchly et al. описали аналогичное относительное количество вирусных коинфекций [14].
В голландском детстве этюд перевозки M . pneumoniae в верхних дыхательных путях (ВДП), сезон и год регистрации повлияли на распространенность бессимптомного носительства в пределах от 3% до 52% [17]. В нашем исследовании часть детей, выписанных из палаты в тот же день, что и госпитализированные, могли быть носителями М . пневмонии . Тем не менее, некоторые из этих детей получали антибиотики первой линии до поступления и были направлены в наше отделение из-за недостаточного ответа на лечение бета-лактамными антибиотиками.
Кроппи и др. [18] установили, что у 50% детей с ИНДП, вызванными М . pneumoniae были коинфицированы преимущественно S . pneumoniae или Chlamydiae spp. . Только небольшая часть этой когорты была проверена на бактериальную коинфекцию, но мы не считали это серьезной проблемой. Примечательно, что 59% детей перед обследованием на М лечились бета-лактамным антибиотиком. pneumoniae без улучшения инфекции.
В отдельные периоды эпидемии в Дании (2010–2011 гг.) Stockholm et al. выявили влияние азитромицина (антибиотик из группы макролидов) на продолжительность эпизода астмоподобных симптомов у детей младшего возраста. Нет исследований для M . Было выполнено pneumoniae , и критерии исключения частоты дыхания более 50/мин, температуры более 39°C и СРБ более 50 мг/л не исключали бы всех детей с возможным М . инфекция pneumoniae [19–21]. Два недавно опубликованных норвежских исследования описали несоответствие частоты клинических симптомов M . pneumoniae инфекций у детей дошкольного возраста между эпидемическим и эндемическим периодами [14,21]. Рандомизированные контролируемые исследования, касающиеся эффективности макролидов при астмоподобных симптомах, следует проводить в периоды эндемии или лучше контролировать для M . pneumoniae инфекций, особенно у детей раннего возраста, родившихся после эпидемического периода. Противовоспалительный эффект макролидов требует дальнейшего изучения [22].
10% этой когорты страдали хроническими заболеваниями, главным образом тяжелыми респираторными заболеваниями.У нынешних астматиков диагностированы тяжелые обострения бронхиальной астмы.
Дети более старшего возраста, как правило, обращались за помощью позже после появления симптомов и были ответственны за более длительную госпитализацию. Это может указывать на то, что у детей более старшего возраста были более тяжелые инфекции или что задержка с госпитализацией привела к более тяжелому заболеванию и, следовательно, к более длительному периоду реабилитации. Несмотря на это, мы также выявили тяжелую пневмонию по рентгенологическим данным (ателектаз, плевральный выпот) у детей 2-6 лет.С поправкой на численность населения эти дошкольники имели повышенный риск развития тяжелой пневмонии по сравнению со школьниками во время этой эпидемии. Инчли и др. показали одинаковую картину, даже если их определение тяжелой пневмонии различалось [14]. Раннее лечение инфекций может снизить тяжелую заболеваемость и продолжительность пребывания в больнице.
Обработка M . pneumoniae инфекций, вызванных антибиотиками-макролидами, является спорным, поскольку в Кокрейновском обзоре сделан вывод о недостаточности доказательств, чтобы делать какие-либо конкретные выводы об эффективности антибиотиков у M . пневмонии инфекций у детей [17,22]. Эффективность лечения антибиотиками следует обсуждать в свете правильного диагностического теста [15]. Бессимптомные носители M . pneumoniae необходимо дифференцировать от детей, страдающих симптомными инфекциями, ИНДП, вызванными М . pneumoniae [23]. Гардинер и др. подчеркивают необходимость проведения РКИ по этой теме [17]. В Дании SSI по-прежнему рекомендует лечение M . pneumoniae положительных ИННД у детей [24].Резистентность к макролидам является растущей проблемой во всем мире. В Дании частота оценивается в 2% [25]. Резистентности к макролидам в нашей группе детей выявлено не было.
Мы обнаружили рентгенологические изменения в 94% рентгенограмм грудной клетки, сделанных в этом исследовании. Рентгенологические данные были довольно разнообразны, но примечательно, что более 80% детей старше двух лет имели лобарную инфильтрацию, в то время как у детей младшего возраста были значительно более тонкие признаки. Это соответствовало итальянскому проспективному исследованию детского возраста [9].
Даже у детей старшего возраста нельзя было отличить симптомы ВП от других возбудителей. Рентгенологические заключения в M . pneumoniae pneumoniae в целом не отличались от ВП.
Почти у 25% всех детей во время болезни была какая-либо сыпь (эритема/крапивница), а у 33% были желудочно-кишечные симптомы, такие как тошнота и/или рвота. Тяжелые внелегочные проявления, сопровождающие респираторные инфекции, вызванные М . Ожидается появление pneumoniae [26].Двум детям в нашей когорте был поставлен диагноз SJS, который является известным осложнением M . pneumoniae [27]. Очаги М . Недавно сообщалось о pneumoniae -ассоциированном ССД у детей [28]. Мы не видели детей с неврологическими симптомами в этой когорте, чего можно было бы ожидать.
Заключение
М . pneumoniae является серьезной причиной ИНДП у детей и может вызывать инфекции, которые трудно отличить от ВП, вызванных другими респираторными патогенами. М . pneumoniae также поражают младенцев и детей раннего возраста в периоды эпидемий, и мы считаем, что M . pneumoniae следует рассматривать как дифференциальный диагноз с респираторными вирусными инфекциями и как причину проблемных симптомов со стороны легких у младенцев и детей и пневмонии. Рентгенограммы органов грудной клетки не имели патогномоничных признаков ВП. Во время надвигающейся эпидемии оценка внелегочных проявлений, особенно кожных иммунологических реакций, может быть полезной при диагностике M . пневмонии инфекций.
Вспомогательная информация
Набор данных S1
Анонимная версия базы данных.(XLSX)
Заявление о финансировании
Участвующие отделения (отделение педиатрии, больница Нордселландс, Хиллерёд, Дания и отделение клинической микробиологии, больница Херлев, Херлев, Дания) спонсировали это исследование, финансируя дополнительные микробиологические анализы. на клинические исследования и на заработную плату MJS, MBF, DSH и IMJ.Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Доступность данных
Все соответствующие данные содержатся в документе и в его файлах вспомогательной информации.
Литература
2. Хорнслет А. Вирусология острых респираторных инфекций. 1. Обследование этиологии у детей]. Угескр Лаегер. 1967; 129: 1253–1258. [PubMed] [Google Scholar]3. Хорнслет А. Вирусология острых инфекций дыхательных путей.2. Выделение вирусов у госпитализированных детей. Угескр Лаегер. 1967; 129: 1259–1265. [PubMed] [Google Scholar]4. Харрис М., Кларк Дж., Кут Н., Флетчер П., Харнден А., Маккин М. и др. Рекомендации Британского торакального общества по лечению внебольничной пневмонии у детей: обновление 2011 г. Thorax. 2011;66 Приложение 2: II1–23. doi: 10.1136/thoraxjnl-2011-200598 [PubMed] [Google Scholar]5. Залензинк Д., Вальехо Дж. Инфекция микоплазменной пневмонии у детей. 2009-е изд. Своевременно.
6. Glezen WP, Loda FA, Clyde WA, Senior RJ, Sheaffer CI, Conley WG, et al.Эпидемиологическая картина острых заболеваний нижних дыхательных путей у детей в педиатрической групповой практике. J Педиатр. 1971; 78: 397–406. дои: 10.1016/S0022-3476(71)80218-4 [PubMed] [Google Scholar]7. Uldum SA, Bangsborg JM, Gahrn-Hansen B, Ljung R, Mølvadgaard M, Føns Petersen R, et al. Эпидемия инфекции Mycoplasma pneumoniae в Дании, 2010 и 2011 гг. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [Google Академия]8. Sørensen CM, Schønning K, Rosenfeldt V. Клинические характеристики детей с инфекцией Mycoplasma pneumoniae, госпитализированных во время эпидемии в Дании 2010–2012 гг.Дэн Мед Дж. 2013; 60: A4632 [PubMed] [Google Scholar]9. Дефилиппи А., Сильвестри М., Такчелла А., Джаккино Р., Мелиоли Г., Ди Марко Э. и др. Эпидемиология и клинические особенности микоплазменной пневмонии у детей. Респир Мед. 2008; 102: 1762–1768. doi: 10.1016/j.rmed.2008.06.022 [PubMed] [Google Scholar] 10. Gadsby NJ, Reynolds AJ, McMenamin J, Gunson RN, McDonagh S, Molyneaux PJ, et al. Увеличение количества сообщений о Mycoplasma pneumoniae из лабораторий в Шотландии в 2010 и 2011 годах — влияние эпидемии на младенцев.Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [PubMed] [Google Scholar] 12. Чалкер В., Стоки Т., Литт Д., Бермингем А., Уотсон Дж., Флеминг Д. и др. Рост выявления инфекции Mycoplasma pneumoniae у детей в Англии и Уэльсе, октябрь 2011 г. – январь 2012 г. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [PubMed] [Google Scholar] 13. Алмасри М., Диза Э., Папа А., Эбориаду М., Сулиу Э. Инфекции дыхательных путей Mycoplasma pneumoniae среди греческих детей.Гиппократия. 2011; 15: 147–152. [Бесплатная статья PMC] [PubMed] [Google Scholar]14. Инчли К.С., Берг А.С., Вахдани Бенам А., Квиссел А.К., Лигаард Т.М., Накстад Б. Mycoplasma Pneumoniae: перекрестное популяционное сравнение тяжести заболевания у детей дошкольного и школьного возраста. Pediatr Infect Dis J. 2017; 36: 930–936. дои: 10.1097/INF.0000000000001628 [PubMed] [Google Scholar] 15. Spuesens EBM, Fraaij PLA, Visser EG, Hoogenboezem T, Hop WCJ, van Adrichem LNA и др. Носительство Mycoplasma pneumoniae в верхних дыхательных путях симптомных и бессимптомных детей: обсервационное исследование.ПЛОС Мед. 2013;10: e1001444 doi: 10.1371/journal.pmed.1001444 [Бесплатная статья PMC] [PubMed] [Google Scholar]16. Флеминг С., Томпсон М., Стивенс Р., Хенеган С., Плюддеманн А., Маконочи И. и др. Нормальные диапазоны частоты сердечных сокращений и частоты дыхания у детей от рождения до 18 лет: систематический обзор обсервационных исследований. Ланцет. 2011; 377: 1011–1018. дои: 10.1016/S0140-6736(10)62226-X [Бесплатная статья PMC] [PubMed] [Google Scholar]17. Гардинер С.Дж., Гавранич Дж.Б., Чанг А.Б. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. В: The Cochrane Collaboration, под редакцией.Кокрановская база данных систематических обзоров. Чичестер, Великобритания: John Wiley & Sons, Ltd; 2015. дои: 10.1002/14651858.CD004875.pub5 [PubMed] [Google Scholar] 18. Корппи М., Хейсканен-Косма Т., Клеемола М. Заболеваемость внебольничной пневмонией у детей, вызванной Mycoplasma pneumoniae: серологические результаты проспективного популяционного исследования в первичной медико-санитарной помощи. Респирол Карлтон Вик. 2004; 9: 109–114. doi: 10.1111/j.1440-1843.2003.00522.x [PubMed] [Google Scholar] 19. Stokholm J, Chawes BL, Vissing NH, Bjarnadóttir E, Pedersen TM, Vinding RK, et al.Азитромицин при эпизодах с астмоподобными симптомами у детей младшего возраста в возрасте 1–3 лет: рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет Респир Мед. 2016;4: 19–26. дои: 10.1016/S2213-2600(15)00500-7 [Бесплатная статья PMC] [PubMed] [Google Scholar]20. Stokholm J, Bisgaard H. Хроническая инфекция легких Chlamydia pneumoniae: забытое объяснение эффектов макролидов при хрипах и астме? – Ответ авторов. Ланцет Респир Мед. 2016;4: е8–е9. doi: 10.1016/S2213-2600(16)00050-3 [PubMed] [Google Scholar]21.Берг А.С., Инчли К.С., Аасэ А., Фьерли Х.О., Булл Р., Ааберге И. и др. Этиология пневмонии у детей с высоким охватом пневмококковой вакциной: проспективное исследование. Pediatr Infect Dis J. 2016; 35: e69–75. дои: 10.1097/INF.0000000000001009 [PubMed] [Google Scholar] 22. Малхолланд С., Гавранич Д.Б., Гиллис М.Б., Чанг А.Б. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. Cochrane Database Syst Rev. 2012;9: CD004875 дои: 10.1002/14651858.CD004875.pub4 [PubMed] [Google Scholar] 25. Ульдум С.А., Амберг П., Дженсен Дж.С. [Резистентность к макролидам у Mycoplasma pneumoniae при рецидивах и продолжительных заболеваниях]. Угескр Лаегер. 2012; 174: 730–731. [PubMed] [Google Scholar] 26. Бьёрн А-МБ, Лебех А-МК. Внелегочные осложнения микоплазменной пневмонии. Угескр Лаегер. 2002; 164: 1805–1809 гг. [PubMed] [Google Scholar]Клинические проявления у младенцев и детей с инфекцией Mycoplasma pneumoniae
PLoS One.2018; 13(4): e01.
, Курирование данных, Формальный анализ, Исследование, Написание – первоначальный проект, 1, * , Исследование, Методология, Проверка, Написание – обзор и редактирование, 2 , Концептуализация, Методология, Надзор, Написание – обзор и редактирование , 2 и , Концептуализация, Методология, Управление проектом, Надзор, Написание – проверка и редактирование 1Миа Йоханна Сёндергаард
1 Отделение педиатрии, больница Nordsjællands, Hillerød, Дания
Martin Barfred Friis
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Dennis Schrøder Hansen
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Inger Merete Jørgensen
1 Отделение педиатрии, Больница Нордселландс, Хиллерёд, Дания
Оливер Шильдген, редактор
1 Отделение педиатрии, Больница Нордселландс, Хиллерёд, Дания
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Kliniken der Stadt Köln gGmbH, ГЕРМАНИЯ
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Поступила в редакцию 21 окт. 2016 г.; Принято 14 февраля 2018 г.
Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.Эта статья была процитирована. по другим статьям в PMC.Abstract
История вопроса
Mycoplasma pneumoniae является частой причиной внебольничной пневмонии у детей старшего возраста.Легочные и внелегочные симптомы, связанные с M . Зарегистрировано пневмонии инфекций. М . pneumoniae носит преимущественно эпидемический характер в Дании с рецидивами каждые 4-7 -го -го года.
Цели
Ретроспективно описать эпидемиологию и клинические особенности у младенцев и детей в течение М . pneumoniae эпидемия 2010 и 2011 гг.Включено pneumoniae за период 01.02.2010–31.01.2012. Медицинские карты, а также рентгенологические данные были рассмотрены для всех детей с М . пневмонии . Для части когорты был проведен ретроспективный анализ вирусных коинфекций.
Результаты
134 из 746 детей дали положительный результат на М . pneumoniae с помощью ПЦР или серологии. Положительные тесты были обнаружены у 65% детей 7 лет и старше, у 30% детей 2-6 лет и у 4% детей грудного возраста (до двух лет).Вирусная коинфекция была обнаружена в 27% протестированных образцов. Клиническими проявлениями были кашель, астматические симптомы и субфебрильная температура. Внелегочные симптомы были частыми и проявлялись тошнотой/рвотой у 33% детей и кожными проявлениями у 25%. 84% детей сделали рентген грудной клетки, и у 94% из них были положительные результаты рентгенологического исследования.
Заключение
М . pneumoniae также поражал младенцев и детей младшего возраста, и симптомы были похожи на инфекции респираторными вирусами, но также наблюдались тяжелые ИНДП.Во время надвигающейся эпидемии оценка внелегочных проявлений может быть полезной при диагностике M . пневмонии инфекций.
Введение
Mycoplasma pneumoniae ( M . pneumoniae ) является важной причиной инфекций дыхательных путей, особенно у детей и молодых людей, и, по оценкам, на нее приходится до 30–40% внебольничных инфекций. пневмонии (ВП) [1–4]. Легочные проявления обычно представляют собой трахеобронхит и пневмонию, сопровождающиеся кашлем, а также хрипами.Маленькие дети считаются менее восприимчивыми к M . pneumoniae у детей школьного возраста [5,6]. В Дании M . pneumoniae носит преимущественно эпидемический характер с частотой рецидивов каждые 4-7 — лет [7].
Дания испытала M . Эпидемия pneumoniae с пиком осенью 2010 г. и снова осенью 2011 г. Statens Serum Institut (SSI), отвечающий за национальную систему эпиднадзора в Дании, описал ее как две волны одной и той же эпидемии [7].
Осознание того, что дети дошкольного возраста и даже младенцы могут быть восприимчивы и иметь клинические симптомы от M . Инфекция pneumoniae развилась в последние годы и была зарегистрирована в исследованиях, проведенных в Европе и Австралии [8–14]. С клинической точки зрения важно установить, является ли M . pneumoniae играет важную дифференциальную роль в инфекциях нижних дыхательных путей и астмоподобных обострениях у детей раннего возраста и младенцев.В последние годы актуален вопрос о коинфекциях и бессимптомном носительстве М . pneumoniae и, следовательно, гипердиагностика M . pneumoniae с помощью ПЦР обсуждался [15].
Целью данного исследования было описание и характеристика M . pneumoniae в условиях стационара, а также для оценки возможных возрастных клинических признаков у младенцев, детей младшего возраста и детей старшего возраста, госпитализированных с диагнозом M . пневмония инфекция. Исследование было начато, так как мы испытали сдвиг в клинической картине нашего M . пневмонии больных во время эпидемии. Литература в этой области обширна и содержит различные мнения, как уже упоминалось, о патогенности бактерий и показаниях к лечению, а также о значении инфекций у детей дошкольного возраста. Наш отчет — еще один кирпичик в понимании этого патогена.
Материалы и методы
Мы разработали ретроспективный анализ всех детей в возрасте до 16 лет, поступивших в педиатрическое отделение больницы Нордселландс, Хиллерёд, Дания, которые были исследованы на M . pneumoniae либо с помощью полимеразной цепной реакции (ПЦР), либо с помощью серологии ( M . pneumoniae тест на антитела и тест холодовой агглютинации). Период исследования: с 01.02.2010 по 31.01.2012. Мы собрали результаты ПЦР и результаты образцов крови как в нашей местной микробиологической лаборатории (ПЦР), так и в SSI (ПЦР и серология). Данные были сопоставлены по номеру социального страхования, чтобы избежать двойной выборки. ПЦР проводили на мазках из ротоглотки, которые хранили и транспортировали в лабораторию в охлажденном виде.Диагностика М . pneumoniae был основан на коммерчески доступном наборе для ПЦР в реальном времени (RT-PCR) (Minerva Biolabs Venor R Mp Mycoplasma pneumoniae — Диагностический набор для количественной ПЦР типа I), направленном на ген цитоадгезии P1. ПЦР представлял собой мультиплексный анализ, также нацеленный на Chlamydophila pneumoniae/psittaci . Анализ проводили в соответствии с описанием производителя. Короче говоря, 10 мкл образца добавляли к 14,4 мкл мастермикса, содержащего 14 мкл буфера, 0.2 мкл Taq-полимеразы и 0,2 мкл урацил-N-гликозилазы. ОТ-ПЦР проводили при следующих условиях на машине Stratagene Mx 3005P RT-PCR: 10 мин при 95°C, затем 45 циклов по 30 с при 95°C, 30 с при 55°C и 30 с при 60°C. . М . В фильтре FAM было обнаружено pneumoniae .
Серологические тесты были выполнены внешним коммерческим поставщиком (SSI) и основаны на M . pneumoniae специфические антитела IgM (MPT) вместе с холодовыми агглютининами (KAT).Титр как МФТ, так и КАТ выше или равный 64 считался положительным тестом. Поскольку титры КАТ падают быстрее после перенесенной инфекции, ее использовали для повышения вероятности продолжающейся инфекции. Подсчитано, что 95% лиц моложе 20 лет имеют положительные титры КАТ в ответ на М . Инфекция pneumoniae (тест-информация об ИОХВ).
Дети с двумя или более положительными ПЦР-тестами в течение трех месяцев рассматривались как один и тот же инфекционный эпизод и включались только один раз.
Дети были направлены врачами общей практики или отделением неотложной помощи больницы. Дежурный врач заказал М . pneumoniae отбор проб согласно клинической оценке.
Были собраны демографические и клинические данные о 134 детях с положительным тестом на M . pneumoniae , судя по медицинской карте. Карты 612 детей с отрицательными тестами не проверены. Медицинский анамнез систематически анализировался с использованием компьютеризированных медицинских карт, радиологических отчетов и лабораторных отчетов.Анализируемые характеристики включали демографические данные (возраст, пол, история болезни до поступления), клиническую картину (легочные и внелегочные симптомы, клиническое обследование, частота дыхания, аускультация, температура, сатурация кислорода), рентгенологические данные, биохимию (С-реактивный белок ( СРБ), количество лейкоцитов при поступлении) сопутствующие инфекции, осложнения и медикаментозное лечение. Для анализа данных дети были разделены на возрастные группы: до двух лет (далее в тексте — младенцы), 2–6 лет и 7–15 лет (дети школьного возраста).
Для дальнейшего ответа на вопрос о вирусных коинфекциях, ретроспективный анализ исходного замороженного образца ротоглоточного мазка из 49 из M . pneumoniae положительных когорты были протестированы с помощью ПЦР с использованием имеющегося в продаже набора (линейка Biomerieux Respiratory MWS R-Gene) на широкий спектр респираторных вирусов (включая респираторно-синцитиальный вирус (RSV), грипп A и B, метапневмовирус человека, риновирус , вирус парагриппа, коронавирус, бокавирус и аденовирус).Короче говоря, ПЦР проводили в четырех двойных комплексах; 10 мкл образца добавляли к 15 мкл мастер-микса, содержащего буфер, обратную транскриптазу и смесь праймер/зонд. ОТ-ПЦР проводили при следующих условиях на приборе Stratagene Mx 3005P для ОТ-ПЦР: 5 мин при 50°С, 15 мин при 95°С, затем 45 циклов по 10 с при 95°С, 40 с при 60°С. °С и 25 сек при 72°С. Цели Al были обнаружены либо в фильтре FAM, либо в фильтре HEX.
Положительные образцы после более чем 35 Ct-циклов были повторно оценены для подтверждения действительно положительного результата.
Комитет по этике региона Ховедстаден (номер протокола: H-2-2012-132), а также Датское агентство по защите данных одобрили исследование. Это одобрение включало согласие на просмотр медицинских записей без информированного согласия пациентов.
Статистический анализ выполнен в STATA 10.0, программных пакетах SPSS версии 22 и Microsoft Excell. Chi 2 -критерий, точный критерий Фишера или Z-критерий использовали для анализа категорийных данных и двухвыборочный Т-критерий для числовых данных.Значение p <0,05 считалось значимым.
Результаты
Эпидемиологические данные
Из 885 пациентов протестированы на M . pneumoniae в период исследования, 139 были исключены из-за возраста (старше 15 лет), двойного отбора проб или повторных проб в течение трех месяцев. Всего в исследование было включено 746 детей с инфекцией дыхательных путей (ИРТ), у 134 из которых был положительный тест на M . пневмонии . Из 740 М . pneumoniae Включено ПЦР-анализов, 132 из которых были положительными, а из 20 серологических тестов 3 были положительными. Четырнадцать детей были протестированы как с помощью ПЦР в реальном времени, так и с помощью серологии.
показывает количество детей, протестированных на M . pneumoniae и количество положительных случаев по месяцам. Эпидемия достигла своего пика в октябре 2010 года и снова в октябре-декабре 2011 года. Численность М . pneumoniae положительных случая составило 50 (из 386) в первый эпидемический сезон и 84 (из 360) во второй период эпидемии, при значительно более высоком показателе (0,13 против 0,23) положительных случаев в более позднем (р = 0,0002, хи 2 — тест).В целом у 18% детей, протестированных на M. pneumonia, был положительный образец.
Количество положительных и отрицательных M . пневмонии тестов по годам и месяцам.
Высшая скорость М . pneumoniae положительных образца были у детей школьного возраста (65%), но особенно у детей дошкольного возраста (30%), и даже у шести детей в возрасте до двух лет (4%) было M . пневмонии положительных теста.
Клиническая картина, рентгенологические данные и лабораторные исследования
Характеристики пациентов, стратифицированные по возрастным группам, представлены в .
Таблица 1
Симптомы, внелегочные симптомы, объективные признаки, биохимические и рентгенологические данные у детей с Mycoplasma pneumoniae.
| <2 Y | 2-6 Y | 7-15 y | Всего | <2 Y | 2-6 y | 7-15 y | Всего | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Объективные признаки: | ||||||||||||
| Количество детей | 6 | 40 | 88 | 134 | тахипноэ, (%) W | 0 | 52 | 52 | 57 | 57 | 52 | 52 |
| мужчины (%) | 67 | 67 | 60324 | 53 | 56 | Температура ° C (Median [IQR]) | 38.5 [37.4: 39.4] | 37.8 [37.3: 38.5] | 37.9 [37.5: 38.8] | 37,9 [37.4: 38.8] | ||
| Симптоматические дни до приема (среднее) * | 4 | 12 | 10 | 10 | 10 | 10 | Auscultation-hheezing (%) | 33 | 24 | 23 | 23 | 24 |
| дня поступления (среднее) ** | 2 | 1,8 | 2,3 | 2,2 | 2,2 | 2,2 | Auscultation-Trackles / Снижение звуки дыхания (%) | 47 | 47 | 57 | 56 | |
| симптомов: | Лабораторные испытания: Y | |||||||||||
| Chough (%) | 100 | 100 | 99 | 99 | 99 | CRP, мг / л (медианы [IQR]) | 33 [слишком мало] | 28.5 [17.5: 40.3] | 25 [16.5: 32.5] | 28 [16.3: 39.3] | ||
| Hheezing (%) | 50 | 17 | 16 | 17 | Количество лейкоцитов (Median [IQR ]) | 17.0 [Слишком мало] | 8.1 [5.8: 11.9] | 10,3 [8.3: 12.7] | 9.3 [6.2: 12.2] | |||
| Rhinorrhoea (%) | 40 | 11 | 15 | Количество нейтрофилов (медиана [IQR]) | 9,6 [слишком мало] | 5.3 [3.9: 9.3] | 6.6 [5.1: 8.3] | 5.8 [4.0: 8.9] | ||||
| Боли в горле (%) | 0 | 18 | 26 | 26 | 22 | Количество лимфоцитов (Median [ IQR]) | 5.2 [Слишком мало] | 1.5 [1.1: 1.8] | 2.2 [1.7: 2.9] | [1.7: 2.9]1.7 [1.3: 2.5] | ||
| 0 | 0 | 5 | 3 | |||||||||
| внелегочного симптомы: | Рентгенологически: Z | |||||||||||
| Лихорадка ≥ 38 ° C (%) | 94 | 94 | 94 | 9 94 | 91 | 91 | Илала Аденопатия (исключительно) (%) | 3 | 13 | 5 | 903 49 8||
| Make Mainestation (ALL) x (%) | 18 | 18 | 24 | 23 | Infiltration Lobar (%) | 33 | 81 | 82 | 80 | |||
| Urticarial Rash (%) | 17 | 0 | 0 | 13 | 9 | Atelectasis (%) | 0 | 16 | 19 | 18 | 18 | |
| Стивен Джонсон Синдром (NO) | 0 | 0 | 2 | 2 | 2 | 2 | 9 | 9 | 9 | 9 | 9 | |
| Тошнота и / или рвота (%) | 33 | 32 | 30 | 31 | Эмпиема (нет) | 0 | 0 | 1 | 1 |
Дети в возрасте до двух лет поступали в стационар значительно раньше после появления симптомов s, чем дети старшего возраста, (p = 0.01, двухвыборочный t-критерий). 61% детей были выписаны из стационара в день поступления.
Наиболее частым респираторным проявлением был кашель (100%) вместе с возрастной степенью хрипов (). При поступлении в стационар у 92% младенцев и детей был диагностирован эпизод неприятных симптомов со стороны легких продолжительностью не менее трех дней. Значительно больше детей младшего возраста (до трех лет) имели объективные хрипы и кашель (астмоподобные симптомы), чем дети старшего возраста (p = 0.01, Z-критерий). Предшествующее и клинически значимое хроническое заболевание диагностировано у 10% детей. Из них 4/13 (31%) имели ранее диагностированную и текущую астму, а также имели тяжелые обострения в течение М . пневмония инфекция.
Большинству пациентов (84%) была сделана рентгенограмма органов грудной клетки, и у 96% из них рентгенологические результаты были положительными (). Среди детей грудного и раннего возраста чаще встречалась эксклюзивная внутригрудная лимфаденопатия, в то время как у детей более старшего возраста обычно выявлялась значительная периферическая инфильтрация на рентгенограмме органов грудной клетки (10).Дети с ателектазом имели значительно большую продолжительность пребывания в стационаре; более трех дней (35% против 25%; p = 0,05). Частота легочных осложнений была одинаковой для детей с СРБ выше 50 мг/л (POCT (тестирование в месте оказания медицинской помощи), часть определения тяжелой пневмонии у взрослых) и ниже 50 мг/л (18% против 19%, p > 0,05). В возрастной группе до двух лет не было зарегистрировано легочных осложнений. Количество тяжелых проявлений пневмонии было одинаковым в возрастных группах; 2–6 лет и 7–15 лет (таблица).В целом 20% детей имели повышенный уровень СРБ более 50 мг/л, и все они были старше трех лет.
Лечение антибиотиками получили 120 детей. Большинство пациентов лечились кларитромицином в соответствии с местными рекомендациями. 64 пациента, или 46%, лечились по подозрению. Из них 53% получали другие антибиотики (бета-лактам) до M . пневмония тестирование. Лечение было начато 56 больным (42%) после получения положительного результата теста.Только шесть детей лечили макролидными антибиотиками дважды из-за подозрения на рецидив или неэффективность лечения. Один образец был протестирован на устойчивость к макролидам и показал отрицательный результат.
Наиболее частым внелегочным проявлением была тошнота с рвотой или без нее, о которой сообщала треть всех детей. У 23% всех детей была сыпь в той или иной форме, а у 9% была крапивница. У детей раннего возраста кожные проявления были в 33% случаев. У двух детей развился синдром Стивена-Джонсона (ССД) с симптомами поражения слизистых оболочек, возникшими до или одновременно с началом лечения антибиотиками.
Одновременно проведено исследование посевов мокроты на другие бактериальные возбудители у 37 детей. У 41% из них была диагностирована коинфекция. Наиболее распространенными бактериями были Moraxella catarrhalis , Haemophilus influenzae и S . пневмония . Из-за методологической установки все дети были протестированы на Chlamydophila pneumoniae ни один из них не оказался положительным.
Только двое детей были протестированы на вирусные инфекции во время клинической подготовки.Апостериорный анализ 49 мазков из ротоглотки показал, что 27% из них имели одиночную или смешанную вирусную коинфекцию (РСВ (1 ребенок), грипп А (2), метапневмовирус человека (1), риновирус (2), коронавирус). (3), бокавирус (2) и аденовирус (5)). Четверо детей оказались положительными с помощью ПЦР на два вируса, а также на M . пневмонии . показывает, по аналогии с , клинические характеристики детей с неизвестной вирусной инфекцией, без нее и с неизвестной вирусной инфекцией. Полученные данные свидетельствуют о том, что значительно чаще детей с микст-инфекцией М . pneumoniae и респираторный вирус имели ринорею (p = 0,02) и хрипы (тенденция, p = 0,07) по сравнению с теми, кто был положительным только на M . пневмонии . Мы не смогли выявить других различий между двумя группами, включая отсутствие рентгенологических расхождений.
Таблица 2
Симптомы, внелегочные симптомы, объективные признаки и рентгенологические данные у детей с Mycoplasma pneumoniae с вирусной коинфекцией или без нее.
| Мп положительный и вирус положительный | Мп положительный и вирус отрицательный | Мп положительный и вирус Неизвестный | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | <2 Y | 2-15 y | 2 <2 y | 2 -15 y | <2 Y | 2-15 Y | 9032 9 | Количество детей | 3 | 10 | 0 | 36 | 3 | 82 | 82 |
| мужчины (%) | 33 | 50 | — | — | — | — | — | 64 | 100 | 51 | 51 | 51 |
| Симптоматические дни до приема (среднее) | 4 | 16 | — | 9.1 | 2,7 | 9,8 | ||||||
| Дни приема (средние) | 1,8 | 2,5 | — | 2,4 | 1,7 | 2,2 | ||||||
| Симптомы : | ||||||||||||
| Кашель (%) | 100 | 90 | — | 100 | 100 | 100 | ||||||
| хрипов (%) | 5024 | 50 * | — | 19 * | 50 | 50 | 10 | |||||
| Rhinorrehea (%) | 0 | 44 ** | — | 7 ** | 67 | 14 | ||||||
| Боль в горле (%) | NA | 24 9000 | — | 27 | 0 | 20 | ||||||
| крупе симптомы (%) | 0 | 0 | — | 0 | 0 | 7 | ||||||
| внелегочного симптомы : | ||||||||||||
| Лихорадка ≥ 38 ° С (%) | 100 | 70 | — | 97 | 67 | 67 | 93 | 93 | 93 | |||
| Skin Mainestation (ALL) x (%) | 67 | 67 | 0 | — | 14 | 0 | 29 | |||||
| Urticarial Rash (%) | 33 | 0 | — | 3 | 0 | 12 | ||||||
| Синдром Стивена Джонсона (нет) | 2 0— | 1 | 0 | 1 | ||||||||
| Тошнота и / или рвота (%) | 0 | 11 | — | 39 | 67 | 31 | ||||||
| Объективные признаки : | ||||||||||||
| тахипноэ Вт (%) | 0 | 44 | — | 53 | 0 | 57 | ||||||
| Температура °C (средняя) | 38.4 | 38,1 — | 38,238,2 | 37,9 | ||||||||
| Аускультация-хрипы (%) | 33 | 20 | — | 24 | 0 | 27 | ||||||
| Auscultation- хрипы / уменьшились дыхание звуки (%) | 100 | 60 | — | 52 | 67 | 44 | ||||||
| Рентгенологически : | ||||||||||||
| внутригрудной лимфаденопатией (исключительно) (%) | 50 | 13 | — | 7 | Н.А. | 7 | ||||||
| Лобар инфильтрация (%) | 50 | 63 | — | 86 | н/д | 85 | ||||||
| Atelectasis (%) | 0 | 13 | — | — | 25 9 | Na | 19 | |||||
| 0 | 0 | — | 11 | Na | 7 | |||||||
| Эмпиема (нет) | 0 | 0 | — | 0 | NA | 1 | ||||||
Обсуждение
Мы представляем данные большой когорты детей с М . пневмония инфекция. Все включенные в исследование дети были направлены из системы первичной медико-санитарной помощи на госпитализацию в связи с характером и тяжестью симптомов. Большинство M . pneumoniae детей с положительным ПЦР-тестом имели ИНДП, что мы подтверждали высокой частотой рентгенологических находок (94%).
Мы обнаружили более высокую частоту положительных проб на поздней волне эпидемии в 2010 и 2011 годах. Дети школьного возраста чаще M . pneumoniae положительных (65%), чем у детей младшего возраста, но даже среди детей в возрасте от 2 до 6 лет 30% были М . pneumoniae положительный результат, подтверждающий наше первоначальное подозрение, что M . pneumoniae также поражает маленьких детей. Даже небольшое количество младенцев; 6 из 276 были диагностированы.
Это исследование проводилось как ретроспективное картографическое исследование. Врач по вызову решил, кого проверить на М . пневмонии . Дети с М . Инфекция pneumoniae могла быть недодиагностирована, если у них были незначительные респираторные симптомы, особенно во время первой волны эпидемического периода.Из-за общепринятых концепций эпидемиологии ВП, первоначально основанных на долгосрочном исследовании, проведенном в учреждениях первичной медико-санитарной помощи с 1963 по 1975 г., мы ожидаем, что младенцы и дети младшего возраста будут недодиагностированы из-за систематической ошибки отбора [6].
Даже очень маленькие дети могут заболеть от M . pneumoniae , хотя встречается реже. Необходимо учитывать дифференциальную диагностику респираторных вирусных инфекций и обострения астмоподобных симптомов. Клиническая картина с кашлем, свистящими хрипами, субфебрилитетом, СРБ ниже 50 мг/л и хрипами при аускультации у 33% детей раннего возраста также может быть расценена как обострение астмы детского возраста, в первую очередь за счет вирусной инфекции в дети дошкольного возраста.Действительно, у нас также была незначительная степень смешанных вирусных коинфекций, обнаруженных в нашем апостериорном анализе. Можно только предполагать, какой возбудитель явился первопричиной заболевания в этих случаях. В связи с нашими постфактум выводами, мы рекомендуем, чтобы маленькие дети с хрипами и ринореей были проверены на оба M . pneumoniae и респираторно-вирусные инфекции одновременно. За норвежский М . pneumoniae эпидемия, Inchly et al. описали аналогичное относительное количество вирусных коинфекций [14].
В голландском детстве этюд перевозки M . pneumoniae в верхних дыхательных путях (ВДП), сезон и год регистрации повлияли на распространенность бессимптомного носительства в пределах от 3% до 52% [17]. В нашем исследовании часть детей, выписанных из палаты в тот же день, что и госпитализированные, могли быть носителями М . пневмонии . Тем не менее, некоторые из этих детей получали антибиотики первой линии до поступления и были направлены в наше отделение из-за недостаточного ответа на лечение бета-лактамными антибиотиками.
Кроппи и др. [18] установили, что у 50% детей с ИНДП, вызванными М . pneumoniae были коинфицированы преимущественно S . pneumoniae или Chlamydiae spp. . Только небольшая часть этой когорты была проверена на бактериальную коинфекцию, но мы не считали это серьезной проблемой. Примечательно, что 59% детей перед обследованием на М лечились бета-лактамным антибиотиком. pneumoniae без улучшения инфекции.
В отдельные периоды эпидемии в Дании (2010–2011 гг.) Stockholm et al. выявили влияние азитромицина (антибиотик из группы макролидов) на продолжительность эпизода астмоподобных симптомов у детей младшего возраста. Нет исследований для M . Было выполнено pneumoniae , и критерии исключения частоты дыхания более 50/мин, температуры более 39°C и СРБ более 50 мг/л не исключали бы всех детей с возможным М . инфекция pneumoniae [19–21]. Два недавно опубликованных норвежских исследования описали несоответствие частоты клинических симптомов M . pneumoniae инфекций у детей дошкольного возраста между эпидемическим и эндемическим периодами [14,21]. Рандомизированные контролируемые исследования, касающиеся эффективности макролидов при астмоподобных симптомах, следует проводить в периоды эндемии или лучше контролировать для M . pneumoniae инфекций, особенно у детей раннего возраста, родившихся после эпидемического периода. Противовоспалительный эффект макролидов требует дальнейшего изучения [22].
10% этой когорты страдали хроническими заболеваниями, главным образом тяжелыми респираторными заболеваниями.У нынешних астматиков диагностированы тяжелые обострения бронхиальной астмы.
Дети более старшего возраста, как правило, обращались за помощью позже после появления симптомов и были ответственны за более длительную госпитализацию. Это может указывать на то, что у детей более старшего возраста были более тяжелые инфекции или что задержка с госпитализацией привела к более тяжелому заболеванию и, следовательно, к более длительному периоду реабилитации. Несмотря на это, мы также выявили тяжелую пневмонию по рентгенологическим данным (ателектаз, плевральный выпот) у детей 2-6 лет.С поправкой на численность населения эти дошкольники имели повышенный риск развития тяжелой пневмонии по сравнению со школьниками во время этой эпидемии. Инчли и др. показали одинаковую картину, даже если их определение тяжелой пневмонии различалось [14]. Раннее лечение инфекций может снизить тяжелую заболеваемость и продолжительность пребывания в больнице.
Обработка M . pneumoniae инфекций, вызванных антибиотиками-макролидами, является спорным, поскольку в Кокрейновском обзоре сделан вывод о недостаточности доказательств, чтобы делать какие-либо конкретные выводы об эффективности антибиотиков у M . пневмонии инфекций у детей [17,22]. Эффективность лечения антибиотиками следует обсуждать в свете правильного диагностического теста [15]. Бессимптомные носители M . pneumoniae необходимо дифференцировать от детей, страдающих симптомными инфекциями, ИНДП, вызванными М . pneumoniae [23]. Гардинер и др. подчеркивают необходимость проведения РКИ по этой теме [17]. В Дании SSI по-прежнему рекомендует лечение M . pneumoniae положительных ИННД у детей [24].Резистентность к макролидам является растущей проблемой во всем мире. В Дании частота оценивается в 2% [25]. Резистентности к макролидам в нашей группе детей выявлено не было.
Мы обнаружили рентгенологические изменения в 94% рентгенограмм грудной клетки, сделанных в этом исследовании. Рентгенологические данные были довольно разнообразны, но примечательно, что более 80% детей старше двух лет имели лобарную инфильтрацию, в то время как у детей младшего возраста были значительно более тонкие признаки. Это соответствовало итальянскому проспективному исследованию детского возраста [9].
Даже у детей старшего возраста нельзя было отличить симптомы ВП от других возбудителей. Рентгенологические заключения в M . pneumoniae pneumoniae в целом не отличались от ВП.
Почти у 25% всех детей во время болезни была какая-либо сыпь (эритема/крапивница), а у 33% были желудочно-кишечные симптомы, такие как тошнота и/или рвота. Тяжелые внелегочные проявления, сопровождающие респираторные инфекции, вызванные М . Ожидается появление pneumoniae [26].Двум детям в нашей когорте был поставлен диагноз SJS, который является известным осложнением M . pneumoniae [27]. Очаги М . Недавно сообщалось о pneumoniae -ассоциированном ССД у детей [28]. Мы не видели детей с неврологическими симптомами в этой когорте, чего можно было бы ожидать.
Заключение
М . pneumoniae является серьезной причиной ИНДП у детей и может вызывать инфекции, которые трудно отличить от ВП, вызванных другими респираторными патогенами. М . pneumoniae также поражают младенцев и детей раннего возраста в периоды эпидемий, и мы считаем, что M . pneumoniae следует рассматривать как дифференциальный диагноз с респираторными вирусными инфекциями и как причину проблемных симптомов со стороны легких у младенцев и детей и пневмонии. Рентгенограммы органов грудной клетки не имели патогномоничных признаков ВП. Во время надвигающейся эпидемии оценка внелегочных проявлений, особенно иммунологических кожных реакций, может быть полезной при диагностике M . пневмонии инфекций.
Вспомогательная информация
Набор данных S1
Анонимная версия базы данных.(XLSX)
Заявление о финансировании
Участвующие отделения (отделение педиатрии, больница Нордселландс, Хиллерёд, Дания и отделение клинической микробиологии, больница Херлев, Херлев, Дания) спонсировали это исследование, финансируя дополнительные микробиологические анализы. на клинические исследования и на заработную плату MJS, MBF, DSH и IMJ.Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Доступность данных
Все соответствующие данные содержатся в документе и в его файлах вспомогательной информации.
Литература
2. Хорнслет А. Вирусология острых респираторных инфекций. 1. Обследование этиологии у детей]. Угескр Лаегер. 1967; 129: 1253–1258. [PubMed] [Google Scholar]3. Хорнслет А. Вирусология острых инфекций дыхательных путей.2. Выделение вирусов у госпитализированных детей. Угескр Лаегер. 1967; 129: 1259–1265. [PubMed] [Google Scholar]4. Харрис М., Кларк Дж., Кут Н., Флетчер П., Харнден А., Маккин М. и др. Рекомендации Британского торакального общества по лечению внебольничной пневмонии у детей: обновление 2011 г. Thorax. 2011;66 Приложение 2: II1–23. doi: 10.1136/thoraxjnl-2011-200598 [PubMed] [Google Scholar]5. Залензинк Д., Вальехо Дж. Инфекция микоплазменной пневмонии у детей. 2009-е изд. Своевременно.
6. Glezen WP, Loda FA, Clyde WA, Senior RJ, Sheaffer CI, Conley WG, et al.Эпидемиологическая картина острых заболеваний нижних дыхательных путей у детей в педиатрической групповой практике. J Педиатр. 1971; 78: 397–406. дои: 10.1016/S0022-3476(71)80218-4 [PubMed] [Google Scholar]7. Uldum SA, Bangsborg JM, Gahrn-Hansen B, Ljung R, Mølvadgaard M, Føns Petersen R, et al. Эпидемия инфекции Mycoplasma pneumoniae в Дании, 2010 и 2011 гг. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [Google Академия]8. Sørensen CM, Schønning K, Rosenfeldt V. Клинические характеристики детей с инфекцией Mycoplasma pneumoniae, госпитализированных во время эпидемии в Дании 2010–2012 гг.Дэн Мед Дж. 2013; 60: A4632 [PubMed] [Google Scholar]9. Дефилиппи А., Сильвестри М., Такчелла А., Джаккино Р., Мелиоли Г., Ди Марко Э. и др. Эпидемиология и клинические особенности микоплазменной пневмонии у детей. Респир Мед. 2008; 102: 1762–1768. doi: 10.1016/j.rmed.2008.06.022 [PubMed] [Google Scholar] 10. Gadsby NJ, Reynolds AJ, McMenamin J, Gunson RN, McDonagh S, Molyneaux PJ, et al. Увеличение количества сообщений о Mycoplasma pneumoniae из лабораторий в Шотландии в 2010 и 2011 годах — влияние эпидемии на младенцев.Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [PubMed] [Google Scholar] 12. Чалкер В., Стоки Т., Литт Д., Бермингем А., Уотсон Дж., Флеминг Д. и др. Рост выявления инфекции Mycoplasma pneumoniae у детей в Англии и Уэльсе, октябрь 2011 г. – январь 2012 г. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [PubMed] [Google Scholar] 13. Алмасри М., Диза Э., Папа А., Эбориаду М., Сулиу Э. Инфекции дыхательных путей Mycoplasma pneumoniae среди греческих детей.Гиппократия. 2011; 15: 147–152. [Бесплатная статья PMC] [PubMed] [Google Scholar]14. Инчли К.С., Берг А.С., Вахдани Бенам А., Квиссел А.К., Лигаард Т.М., Накстад Б. Mycoplasma Pneumoniae: перекрестное популяционное сравнение тяжести заболевания у детей дошкольного и школьного возраста. Pediatr Infect Dis J. 2017; 36: 930–936. дои: 10.1097/INF.0000000000001628 [PubMed] [Google Scholar] 15. Spuesens EBM, Fraaij PLA, Visser EG, Hoogenboezem T, Hop WCJ, van Adrichem LNA и др. Носительство Mycoplasma pneumoniae в верхних дыхательных путях симптомных и бессимптомных детей: обсервационное исследование.ПЛОС Мед. 2013;10: e1001444 doi: 10.1371/journal.pmed.1001444 [Бесплатная статья PMC] [PubMed] [Google Scholar]16. Флеминг С., Томпсон М., Стивенс Р., Хенеган С., Плюддеманн А., Маконочи И. и др. Нормальные диапазоны частоты сердечных сокращений и частоты дыхания у детей от рождения до 18 лет: систематический обзор обсервационных исследований. Ланцет. 2011; 377: 1011–1018. дои: 10.1016/S0140-6736(10)62226-X [Бесплатная статья PMC] [PubMed] [Google Scholar]17. Гардинер С.Дж., Гавранич Дж.Б., Чанг А.Б. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. В: The Cochrane Collaboration, под редакцией.Кокрановская база данных систематических обзоров. Чичестер, Великобритания: John Wiley & Sons, Ltd; 2015. дои: 10.1002/14651858.CD004875.pub5 [PubMed] [Google Scholar] 18. Корппи М., Хейсканен-Косма Т., Клеемола М. Заболеваемость внебольничной пневмонией у детей, вызванной Mycoplasma pneumoniae: серологические результаты проспективного популяционного исследования в первичной медико-санитарной помощи. Респирол Карлтон Вик. 2004; 9: 109–114. doi: 10.1111/j.1440-1843.2003.00522.x [PubMed] [Google Scholar] 19. Stokholm J, Chawes BL, Vissing NH, Bjarnadóttir E, Pedersen TM, Vinding RK, et al.Азитромицин при эпизодах с астмоподобными симптомами у детей младшего возраста в возрасте 1–3 лет: рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет Респир Мед. 2016;4: 19–26. дои: 10.1016/S2213-2600(15)00500-7 [Бесплатная статья PMC] [PubMed] [Google Scholar]20. Stokholm J, Bisgaard H. Хроническая инфекция легких Chlamydia pneumoniae: забытое объяснение эффектов макролидов при хрипах и астме? – Ответ авторов. Ланцет Респир Мед. 2016;4: е8–е9. doi: 10.1016/S2213-2600(16)00050-3 [PubMed] [Google Scholar]21.Берг А.С., Инчли К.С., Аасэ А., Фьерли Х.О., Булл Р., Ааберге И. и др. Этиология пневмонии у детей с высоким охватом пневмококковой вакциной: проспективное исследование. Pediatr Infect Dis J. 2016; 35: e69–75. дои: 10.1097/INF.0000000000001009 [PubMed] [Google Scholar] 22. Малхолланд С., Гавранич Д.Б., Гиллис М.Б., Чанг А.Б. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. Cochrane Database Syst Rev. 2012;9: CD004875 дои: 10.1002/14651858.CD004875.pub4 [PubMed] [Google Scholar] 25. Ульдум С.А., Амберг П., Дженсен Дж.С. [Резистентность к макролидам у Mycoplasma pneumoniae при рецидивах и продолжительных заболеваниях]. Угескр Лаегер. 2012; 174: 730–731. [PubMed] [Google Scholar] 26. Бьёрн А-МБ, Лебех А-МК. Внелегочные осложнения микоплазменной пневмонии. Угескр Лаегер. 2002; 164: 1805–1809 гг. [PubMed] [Google Scholar]Клинические проявления у младенцев и детей с инфекцией Mycoplasma pneumoniae
PLoS One.2018; 13(4): e01.
, Курирование данных, Формальный анализ, Исследование, Написание – первоначальный проект, 1, * , Исследование, Методология, Проверка, Написание – обзор и редактирование, 2 , Концептуализация, Методология, Надзор, Написание – обзор и редактирование , 2 и , Концептуализация, Методология, Управление проектом, Надзор, Написание – проверка и редактирование 1Миа Йоханна Сёндергаард
1 Отделение педиатрии, больница Nordsjællands, Hillerød, Дания
Martin Barfred Friis
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Dennis Schrøder Hansen
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Inger Merete Jørgensen
1 Отделение педиатрии, Больница Нордселландс, Хиллерёд, Дания
Оливер Шильдген, редактор
1 Отделение педиатрии, Больница Нордселландс, Хиллерёд, Дания
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Kliniken der Stadt Köln gGmbH, ГЕРМАНИЯ
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Поступила в редакцию 21 окт. 2016 г.; Принято 14 февраля 2018 г.
Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.Эта статья была процитирована. по другим статьям в PMC.Abstract
История вопроса
Mycoplasma pneumoniae является частой причиной внебольничной пневмонии у детей старшего возраста.Легочные и внелегочные симптомы, связанные с M . Зарегистрировано пневмонии инфекций. М . pneumoniae носит преимущественно эпидемический характер в Дании с рецидивами каждые 4-7 -го -го года.
Цели
Ретроспективно описать эпидемиологию и клинические особенности у младенцев и детей в течение М . pneumoniae эпидемия 2010 и 2011 гг.Включено pneumoniae за период 01.02.2010–31.01.2012. Медицинские карты, а также рентгенологические данные были рассмотрены для всех детей с М . пневмонии . Для части когорты был проведен ретроспективный анализ вирусных коинфекций.
Результаты
134 из 746 детей дали положительный результат на М . pneumoniae с помощью ПЦР или серологии. Положительные тесты были обнаружены у 65% детей 7 лет и старше, у 30% детей 2-6 лет и у 4% детей грудного возраста (до двух лет).Вирусная коинфекция была обнаружена в 27% протестированных образцов. Клиническими проявлениями были кашель, астматические симптомы и субфебрильная температура. Внелегочные симптомы были частыми и проявлялись тошнотой/рвотой у 33% детей и кожными проявлениями у 25%. 84% детей сделали рентген грудной клетки, и у 94% из них были положительные результаты рентгенологического исследования.
Заключение
М . pneumoniae также поражал младенцев и детей младшего возраста, и симптомы были похожи на инфекции респираторными вирусами, но также наблюдались тяжелые ИНДП.Во время надвигающейся эпидемии оценка внелегочных проявлений может быть полезной при диагностике M . пневмонии инфекций.
Введение
Mycoplasma pneumoniae ( M . pneumoniae ) является важной причиной инфекций дыхательных путей, особенно у детей и молодых людей, и, по оценкам, на нее приходится до 30–40% внебольничных инфекций. пневмонии (ВП) [1–4]. Легочные проявления обычно представляют собой трахеобронхит и пневмонию, сопровождающиеся кашлем, а также хрипами.Маленькие дети считаются менее восприимчивыми к M . pneumoniae у детей школьного возраста [5,6]. В Дании M . pneumoniae носит преимущественно эпидемический характер с частотой рецидивов каждые 4-7 — лет [7].
Дания испытала M . Эпидемия pneumoniae с пиком осенью 2010 г. и снова осенью 2011 г. Statens Serum Institut (SSI), отвечающий за национальную систему эпиднадзора в Дании, описал ее как две волны одной и той же эпидемии [7].
Осознание того, что дети дошкольного возраста и даже младенцы могут быть восприимчивы и иметь клинические симптомы от M . Инфекция pneumoniae развилась в последние годы и была зарегистрирована в исследованиях, проведенных в Европе и Австралии [8–14]. С клинической точки зрения важно установить, является ли M . pneumoniae играет важную дифференциальную роль в инфекциях нижних дыхательных путей и астмоподобных обострениях у детей раннего возраста и младенцев.В последние годы актуален вопрос о коинфекциях и бессимптомном носительстве М . pneumoniae и, следовательно, гипердиагностика M . pneumoniae с помощью ПЦР обсуждался [15].
Целью данного исследования было описание и характеристика M . pneumoniae в условиях стационара, а также для оценки возможных возрастных клинических признаков у младенцев, детей младшего возраста и детей старшего возраста, госпитализированных с диагнозом M . пневмония инфекция. Исследование было начато, так как мы испытали сдвиг в клинической картине нашего M . пневмонии больных во время эпидемии. Литература в этой области обширна и содержит различные мнения, как уже упоминалось, о патогенности бактерий и показаниях к лечению, а также о значении инфекций у детей дошкольного возраста. Наш отчет — еще один кирпичик в понимании этого патогена.
Материалы и методы
Мы разработали ретроспективный анализ всех детей в возрасте до 16 лет, поступивших в педиатрическое отделение больницы Нордселландс, Хиллерёд, Дания, которые были исследованы на M . pneumoniae либо с помощью полимеразной цепной реакции (ПЦР), либо с помощью серологии ( M . pneumoniae тест на антитела и тест холодовой агглютинации). Период исследования: с 01.02.2010 по 31.01.2012. Мы собрали результаты ПЦР и результаты образцов крови как в нашей местной микробиологической лаборатории (ПЦР), так и в SSI (ПЦР и серология). Данные были сопоставлены по номеру социального страхования, чтобы избежать двойной выборки. ПЦР проводили на мазках из ротоглотки, которые хранили и транспортировали в лабораторию в охлажденном виде.Диагностика М . pneumoniae был основан на коммерчески доступном наборе для ПЦР в реальном времени (RT-PCR) (Minerva Biolabs Venor R Mp Mycoplasma pneumoniae — Диагностический набор для количественной ПЦР типа I), направленном на ген цитоадгезии P1. ПЦР представлял собой мультиплексный анализ, также нацеленный на Chlamydophila pneumoniae/psittaci . Анализ проводили в соответствии с описанием производителя. Короче говоря, 10 мкл образца добавляли к 14,4 мкл мастермикса, содержащего 14 мкл буфера, 0.2 мкл Taq-полимеразы и 0,2 мкл урацил-N-гликозилазы. ОТ-ПЦР проводили при следующих условиях на машине Stratagene Mx 3005P RT-PCR: 10 мин при 95°C, затем 45 циклов по 30 с при 95°C, 30 с при 55°C и 30 с при 60°C. . М . В фильтре FAM было обнаружено pneumoniae .
Серологические тесты были выполнены внешним коммерческим поставщиком (SSI) и основаны на M . pneumoniae специфические антитела IgM (MPT) вместе с холодовыми агглютининами (KAT).Титр как МФТ, так и КАТ выше или равный 64 считался положительным тестом. Поскольку титры КАТ падают быстрее после перенесенной инфекции, ее использовали для повышения вероятности продолжающейся инфекции. Подсчитано, что 95% лиц моложе 20 лет имеют положительные титры КАТ в ответ на М . Инфекция pneumoniae (тест-информация об ИОХВ).
Дети с двумя или более положительными ПЦР-тестами в течение трех месяцев рассматривались как один и тот же инфекционный эпизод и включались только один раз.
Дети были направлены врачами общей практики или отделением неотложной помощи больницы. Дежурный врач заказал М . pneumoniae отбор проб согласно клинической оценке.
Были собраны демографические и клинические данные о 134 детях с положительным тестом на M . pneumoniae , судя по медицинской карте. Карты 612 детей с отрицательными тестами не проверены. Медицинский анамнез систематически анализировался с использованием компьютеризированных медицинских карт, радиологических отчетов и лабораторных отчетов.Анализируемые характеристики включали демографические данные (возраст, пол, история болезни до поступления), клиническую картину (легочные и внелегочные симптомы, клиническое обследование, частота дыхания, аускультация, температура, сатурация кислорода), рентгенологические данные, биохимию (С-реактивный белок ( СРБ), количество лейкоцитов при поступлении) сопутствующие инфекции, осложнения и медикаментозное лечение. Для анализа данных дети были разделены на возрастные группы: до двух лет (далее в тексте — младенцы), 2–6 лет и 7–15 лет (дети школьного возраста).
Для дальнейшего ответа на вопрос о вирусных коинфекциях, ретроспективный анализ исходного замороженного образца ротоглоточного мазка из 49 из M . pneumoniae положительных когорты были протестированы с помощью ПЦР с использованием имеющегося в продаже набора (линейка Biomerieux Respiratory MWS R-Gene) на широкий спектр респираторных вирусов (включая респираторно-синцитиальный вирус (RSV), грипп A и B, метапневмовирус человека, риновирус , вирус парагриппа, коронавирус, бокавирус и аденовирус).Короче говоря, ПЦР проводили в четырех двойных комплексах; 10 мкл образца добавляли к 15 мкл мастер-микса, содержащего буфер, обратную транскриптазу и смесь праймер/зонд. ОТ-ПЦР проводили при следующих условиях на приборе Stratagene Mx 3005P для ОТ-ПЦР: 5 мин при 50°С, 15 мин при 95°С, затем 45 циклов по 10 с при 95°С, 40 с при 60°С. °С и 25 сек при 72°С. Цели Al были обнаружены либо в фильтре FAM, либо в фильтре HEX.
Положительные образцы после более чем 35 Ct-циклов были повторно оценены для подтверждения действительно положительного результата.
Комитет по этике региона Ховедстаден (номер протокола: H-2-2012-132), а также Датское агентство по защите данных одобрили исследование. Это одобрение включало согласие на просмотр медицинских записей без информированного согласия пациентов.
Статистический анализ выполнен в STATA 10.0, программных пакетах SPSS версии 22 и Microsoft Excell. Chi 2 -критерий, точный критерий Фишера или Z-критерий использовали для анализа категорийных данных и двухвыборочный Т-критерий для числовых данных.Значение p <0,05 считалось значимым.
Результаты
Эпидемиологические данные
Из 885 пациентов протестированы на M . pneumoniae в период исследования, 139 были исключены из-за возраста (старше 15 лет), двойного отбора проб или повторных проб в течение трех месяцев. Всего в исследование было включено 746 детей с инфекцией дыхательных путей (ИРТ), у 134 из которых был положительный тест на M . пневмонии . Из 740 М . pneumoniae Включено ПЦР-анализов, 132 из которых были положительными, а из 20 серологических тестов 3 были положительными. Четырнадцать детей были протестированы как с помощью ПЦР в реальном времени, так и с помощью серологии.
показывает количество детей, протестированных на M . pneumoniae и количество положительных случаев по месяцам. Эпидемия достигла своего пика в октябре 2010 года и снова в октябре-декабре 2011 года. Численность М . pneumoniae положительных случая составило 50 (из 386) в первый эпидемический сезон и 84 (из 360) во второй период эпидемии, при значительно более высоком показателе (0,13 против 0,23) положительных случаев в более позднем (р = 0,0002, хи 2 — тест).В целом у 18% детей, протестированных на M. pneumonia, был положительный образец.
Количество положительных и отрицательных M . пневмонии тестов по годам и месяцам.
Высшая скорость М . pneumoniae положительных образца были у детей школьного возраста (65%), но особенно у детей дошкольного возраста (30%), и даже у шести детей в возрасте до двух лет (4%) было M . пневмонии положительных теста.
Клиническая картина, рентгенологические данные и лабораторные исследования
Характеристики пациентов, стратифицированные по возрастным группам, представлены в .
Таблица 1
Симптомы, внелегочные симптомы, объективные признаки, биохимические и рентгенологические данные у детей с Mycoplasma pneumoniae.
| <2 Y | 2-6 Y | 7-15 y | Всего | <2 Y | 2-6 y | 7-15 y | Всего | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Объективные признаки: | ||||||||||||
| Количество детей | 6 | 40 | 88 | 134 | тахипноэ, (%) W | 0 | 52 | 52 | 57 | 57 | 52 | 52 |
| мужчины (%) | 67 | 67 | 60324 | 53 | 56 | Температура ° C (Median [IQR]) | 38.5 [37.4: 39.4] | 37.8 [37.3: 38.5] | 37.9 [37.5: 38.8] | 37,9 [37.4: 38.8] | ||
| Симптоматические дни до приема (среднее) * | 4 | 12 | 10 | 10 | 10 | 10 | Auscultation-hheezing (%) | 33 | 24 | 23 | 23 | 24 |
| дня поступления (среднее) ** | 2 | 1,8 | 2,3 | 2,2 | 2,2 | 2,2 | Auscultation-Trackles / Снижение звуки дыхания (%) | 47 | 47 | 57 | 56 | |
| симптомов: | Лабораторные испытания: Y | |||||||||||
| Chough (%) | 100 | 100 | 99 | 99 | 99 | CRP, мг / л (медианы [IQR]) | 33 [слишком мало] | 28.5 [17.5: 40.3] | 25 [16.5: 32.5] | 28 [16.3: 39.3] | ||
| Hheezing (%) | 50 | 17 | 16 | 17 | Количество лейкоцитов (Median [IQR ]) | 17.0 [Слишком мало] | 8.1 [5.8: 11.9] | 10,3 [8.3: 12.7] | 9.3 [6.2: 12.2] | |||
| Rhinorrhoea (%) | 40 | 11 | 15 | Количество нейтрофилов (медиана [IQR]) | 9,6 [слишком мало] | 5.3 [3.9: 9.3] | 6.6 [5.1: 8.3] | 5.8 [4.0: 8.9] | ||||
| Боли в горле (%) | 0 | 18 | 26 | 26 | 22 | Количество лимфоцитов (Median [ IQR]) | 5.2 [Слишком мало] | 1.5 [1.1: 1.8] | 2.2 [1.7: 2.9] | [1.7: 2.9]1.7 [1.3: 2.5] | ||
| 0 | 0 | 5 | 3 | |||||||||
| внелегочного симптомы: | Рентгенологически: Z | |||||||||||
| Лихорадка ≥ 38 ° C (%) | 94 | 94 | 94 | 9 94 | 91 | 91 | Илала Аденопатия (исключительно) (%) | 3 | 13 | 5 | 903 49 8||
| Make Mainestation (ALL) x (%) | 18 | 18 | 24 | 23 | Infiltration Lobar (%) | 33 | 81 | 82 | 80 | |||
| Urticarial Rash (%) | 17 | 0 | 0 | 13 | 9 | Atelectasis (%) | 0 | 16 | 19 | 18 | 18 | |
| Стивен Джонсон Синдром (NO) | 0 | 0 | 2 | 2 | 2 | 2 | 9 | 9 | 9 | 9 | 9 | |
| Тошнота и / или рвота (%) | 33 | 32 | 30 | 31 | Эмпиема (нет) | 0 | 0 | 1 | 1 |
Дети в возрасте до двух лет поступали в стационар значительно раньше после появления симптомов s, чем дети старшего возраста, (p = 0.01, двухвыборочный t-критерий). 61% детей были выписаны из стационара в день поступления.
Наиболее частым респираторным проявлением был кашель (100%) вместе с возрастной степенью хрипов (). При поступлении в стационар у 92% младенцев и детей был диагностирован эпизод неприятных симптомов со стороны легких продолжительностью не менее трех дней. Значительно больше детей младшего возраста (до трех лет) имели объективные хрипы и кашель (астмоподобные симптомы), чем дети старшего возраста (p = 0.01, Z-критерий). Предшествующее и клинически значимое хроническое заболевание диагностировано у 10% детей. Из них 4/13 (31%) имели ранее диагностированную и текущую астму, а также имели тяжелые обострения в течение М . пневмония инфекция.
Большинству пациентов (84%) была сделана рентгенограмма органов грудной клетки, и у 96% из них рентгенологические результаты были положительными (). Среди детей грудного и раннего возраста чаще встречалась эксклюзивная внутригрудная лимфаденопатия, в то время как у детей более старшего возраста обычно выявлялась значительная периферическая инфильтрация на рентгенограмме органов грудной клетки (10).Дети с ателектазом имели значительно большую продолжительность пребывания в стационаре; более трех дней (35% против 25%; p = 0,05). Частота легочных осложнений была одинаковой для детей с СРБ выше 50 мг/л (POCT (тестирование в месте оказания медицинской помощи), часть определения тяжелой пневмонии у взрослых) и ниже 50 мг/л (18% против 19%, p > 0,05). В возрастной группе до двух лет не было зарегистрировано легочных осложнений. Количество тяжелых проявлений пневмонии было одинаковым в возрастных группах; 2–6 лет и 7–15 лет (таблица).В целом 20% детей имели повышенный уровень СРБ более 50 мг/л, и все они были старше трех лет.
Лечение антибиотиками получили 120 детей. Большинство пациентов лечились кларитромицином в соответствии с местными рекомендациями. 64 пациента, или 46%, лечились по подозрению. Из них 53% получали другие антибиотики (бета-лактам) до M . пневмония тестирование. Лечение было начато 56 больным (42%) после получения положительного результата теста.Только шесть детей лечили макролидными антибиотиками дважды из-за подозрения на рецидив или неэффективность лечения. Один образец был протестирован на устойчивость к макролидам и показал отрицательный результат.
Наиболее частым внелегочным проявлением была тошнота с рвотой или без нее, о которой сообщала треть всех детей. У 23% всех детей была сыпь в той или иной форме, а у 9% была крапивница. У детей раннего возраста кожные проявления были в 33% случаев. У двух детей развился синдром Стивена-Джонсона (ССД) с симптомами поражения слизистых оболочек, возникшими до или одновременно с началом лечения антибиотиками.
Одновременно проведено исследование посевов мокроты на другие бактериальные возбудители у 37 детей. У 41% из них была диагностирована коинфекция. Наиболее распространенными бактериями были Moraxella catarrhalis , Haemophilus influenzae и S . пневмония . Из-за методологической установки все дети были протестированы на Chlamydophila pneumoniae ни один из них не оказался положительным.
Только двое детей были протестированы на вирусные инфекции во время клинической подготовки.Апостериорный анализ 49 мазков из ротоглотки показал, что 27% из них имели одиночную или смешанную вирусную коинфекцию (РСВ (1 ребенок), грипп А (2), метапневмовирус человека (1), риновирус (2), коронавирус). (3), бокавирус (2) и аденовирус (5)). Четверо детей оказались положительными с помощью ПЦР на два вируса, а также на M . пневмонии . показывает, по аналогии с , клинические характеристики детей с неизвестной вирусной инфекцией, без нее и с неизвестной вирусной инфекцией. Полученные данные свидетельствуют о том, что значительно чаще детей с микст-инфекцией М . pneumoniae и респираторный вирус имели ринорею (p = 0,02) и хрипы (тенденция, p = 0,07) по сравнению с теми, кто был положительным только на M . пневмонии . Мы не смогли выявить других различий между двумя группами, включая отсутствие рентгенологических расхождений.
Таблица 2
Симптомы, внелегочные симптомы, объективные признаки и рентгенологические данные у детей с Mycoplasma pneumoniae с вирусной коинфекцией или без нее.
| Мп положительный и вирус положительный | Мп положительный и вирус отрицательный | Мп положительный и вирус Неизвестный | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | <2 Y | 2-15 y | 2 <2 y | 2 -15 y | <2 Y | 2-15 Y | 9032 9 | Количество детей | 3 | 10 | 0 | 36 | 3 | 82 | 82 |
| мужчины (%) | 33 | 50 | — | — | — | — | — | 64 | 100 | 51 | 51 | 51 |
| Симптоматические дни до приема (среднее) | 4 | 16 | — | 9.1 | 2,7 | 9,8 | ||||||
| Дни приема (средние) | 1,8 | 2,5 | — | 2,4 | 1,7 | 2,2 | ||||||
| Симптомы : | ||||||||||||
| Кашель (%) | 100 | 90 | — | 100 | 100 | 100 | ||||||
| хрипов (%) | 5024 | 50 * | — | 19 * | 50 | 50 | 10 | |||||
| Rhinorrehea (%) | 0 | 44 ** | — | 7 ** | 67 | 14 | ||||||
| Боль в горле (%) | NA | 24 9000 | — | 27 | 0 | 20 | ||||||
| крупе симптомы (%) | 0 | 0 | — | 0 | 0 | 7 | ||||||
| внелегочного симптомы : | ||||||||||||
| Лихорадка ≥ 38 ° С (%) | 100 | 70 | — | 97 | 67 | 67 | 93 | 93 | 93 | |||
| Skin Mainestation (ALL) x (%) | 67 | 67 | 0 | — | 14 | 0 | 29 | |||||
| Urticarial Rash (%) | 33 | 0 | — | 3 | 0 | 12 | ||||||
| Синдром Стивена Джонсона (нет) | 2 0— | 1 | 0 | 1 | ||||||||
| Тошнота и / или рвота (%) | 0 | 11 | — | 39 | 67 | 31 | ||||||
| Объективные признаки : | ||||||||||||
| тахипноэ Вт (%) | 0 | 44 | — | 53 | 0 | 57 | ||||||
| Температура °C (средняя) | 38.4 | 38,1 — | 38,238,2 | 37,9 | ||||||||
| Аускультация-хрипы (%) | 33 | 20 | — | 24 | 0 | 27 | ||||||
| Auscultation- хрипы / уменьшились дыхание звуки (%) | 100 | 60 | — | 52 | 67 | 44 | ||||||
| Рентгенологически : | ||||||||||||
| внутригрудной лимфаденопатией (исключительно) (%) | 50 | 13 | — | 7 | Н.А. | 7 | ||||||
| Лобар инфильтрация (%) | 50 | 63 | — | 86 | н/д | 85 | ||||||
| Atelectasis (%) | 0 | 13 | — | — | 25 9 | Na | 19 | |||||
| 0 | 0 | — | 11 | Na | 7 | |||||||
| Эмпиема (нет) | 0 | 0 | — | 0 | NA | 1 | ||||||
Обсуждение
Мы представляем данные большой когорты детей с М . пневмония инфекция. Все включенные в исследование дети были направлены из системы первичной медико-санитарной помощи на госпитализацию в связи с характером и тяжестью симптомов. Большинство M . pneumoniae детей с положительным ПЦР-тестом имели ИНДП, что мы подтверждали высокой частотой рентгенологических находок (94%).
Мы обнаружили более высокую частоту положительных проб на поздней волне эпидемии в 2010 и 2011 годах. Дети школьного возраста чаще M . pneumoniae положительных (65%), чем у детей младшего возраста, но даже среди детей в возрасте от 2 до 6 лет 30% были М . pneumoniae положительный результат, подтверждающий наше первоначальное подозрение, что M . pneumoniae также поражает маленьких детей. Даже небольшое количество младенцев; 6 из 276 были диагностированы.
Это исследование проводилось как ретроспективное картографическое исследование. Врач по вызову решил, кого проверить на М . пневмонии . Дети с М . Инфекция pneumoniae могла быть недодиагностирована, если у них были незначительные респираторные симптомы, особенно во время первой волны эпидемического периода.Из-за общепринятых концепций эпидемиологии ВП, первоначально основанных на долгосрочном исследовании, проведенном в учреждениях первичной медико-санитарной помощи с 1963 по 1975 г., мы ожидаем, что младенцы и дети младшего возраста будут недодиагностированы из-за систематической ошибки отбора [6].
Даже очень маленькие дети могут заболеть от M . pneumoniae , хотя встречается реже. Необходимо учитывать дифференциальную диагностику респираторных вирусных инфекций и обострения астмоподобных симптомов. Клиническая картина с кашлем, свистящими хрипами, субфебрилитетом, СРБ ниже 50 мг/л и хрипами при аускультации у 33% детей раннего возраста также может быть расценена как обострение астмы детского возраста, в первую очередь за счет вирусной инфекции в дети дошкольного возраста.Действительно, у нас также была незначительная степень смешанных вирусных коинфекций, обнаруженных в нашем апостериорном анализе. Можно только предполагать, какой возбудитель явился первопричиной заболевания в этих случаях. В связи с нашими постфактум выводами, мы рекомендуем, чтобы маленькие дети с хрипами и ринореей были проверены на оба M . pneumoniae и респираторно-вирусные инфекции одновременно. За норвежский М . pneumoniae эпидемия, Inchly et al. описали аналогичное относительное количество вирусных коинфекций [14].
В голландском детстве этюд перевозки M . pneumoniae в верхних дыхательных путях (ВДП), сезон и год регистрации повлияли на распространенность бессимптомного носительства в пределах от 3% до 52% [17]. В нашем исследовании часть детей, выписанных из палаты в тот же день, что и госпитализированные, могли быть носителями М . пневмонии . Тем не менее, некоторые из этих детей получали антибиотики первой линии до поступления и были направлены в наше отделение из-за недостаточного ответа на лечение бета-лактамными антибиотиками.
Кроппи и др. [18] установили, что у 50% детей с ИНДП, вызванными М . pneumoniae были коинфицированы преимущественно S . pneumoniae или Chlamydiae spp. . Только небольшая часть этой когорты была проверена на бактериальную коинфекцию, но мы не считали это серьезной проблемой. Примечательно, что 59% детей перед обследованием на М лечились бета-лактамным антибиотиком. pneumoniae без улучшения инфекции.
В отдельные периоды эпидемии в Дании (2010–2011 гг.) Stockholm et al. выявили влияние азитромицина (антибиотик из группы макролидов) на продолжительность эпизода астмоподобных симптомов у детей младшего возраста. Нет исследований для M . Было выполнено pneumoniae , и критерии исключения частоты дыхания более 50/мин, температуры более 39°C и СРБ более 50 мг/л не исключали бы всех детей с возможным М . инфекция pneumoniae [19–21]. Два недавно опубликованных норвежских исследования описали несоответствие частоты клинических симптомов M . pneumoniae инфекций у детей дошкольного возраста между эпидемическим и эндемическим периодами [14,21]. Рандомизированные контролируемые исследования, касающиеся эффективности макролидов при астмоподобных симптомах, следует проводить в периоды эндемии или лучше контролировать для M . pneumoniae инфекций, особенно у детей раннего возраста, родившихся после эпидемического периода. Противовоспалительный эффект макролидов требует дальнейшего изучения [22].
10% этой когорты страдали хроническими заболеваниями, главным образом тяжелыми респираторными заболеваниями.У нынешних астматиков диагностированы тяжелые обострения бронхиальной астмы.
Дети более старшего возраста, как правило, обращались за помощью позже после появления симптомов и были ответственны за более длительную госпитализацию. Это может указывать на то, что у детей более старшего возраста были более тяжелые инфекции или что задержка с госпитализацией привела к более тяжелому заболеванию и, следовательно, к более длительному периоду реабилитации. Несмотря на это, мы также выявили тяжелую пневмонию по рентгенологическим данным (ателектаз, плевральный выпот) у детей 2-6 лет.С поправкой на численность населения эти дошкольники имели повышенный риск развития тяжелой пневмонии по сравнению со школьниками во время этой эпидемии. Инчли и др. показали одинаковую картину, даже если их определение тяжелой пневмонии различалось [14]. Раннее лечение инфекций может снизить тяжелую заболеваемость и продолжительность пребывания в больнице.
Обработка M . pneumoniae инфекций, вызванных антибиотиками-макролидами, является спорным, поскольку в Кокрейновском обзоре сделан вывод о недостаточности доказательств, чтобы делать какие-либо конкретные выводы об эффективности антибиотиков у M . пневмонии инфекций у детей [17,22]. Эффективность лечения антибиотиками следует обсуждать в свете правильного диагностического теста [15]. Бессимптомные носители M . pneumoniae необходимо дифференцировать от детей, страдающих симптомными инфекциями, ИНДП, вызванными М . pneumoniae [23]. Гардинер и др. подчеркивают необходимость проведения РКИ по этой теме [17]. В Дании SSI по-прежнему рекомендует лечение M . pneumoniae положительных ИННД у детей [24].Резистентность к макролидам является растущей проблемой во всем мире. В Дании частота оценивается в 2% [25]. Резистентности к макролидам в нашей группе детей выявлено не было.
Мы обнаружили рентгенологические изменения в 94% рентгенограмм грудной клетки, сделанных в этом исследовании. Рентгенологические данные были довольно разнообразны, но примечательно, что более 80% детей старше двух лет имели лобарную инфильтрацию, в то время как у детей младшего возраста были значительно более тонкие признаки. Это соответствовало итальянскому проспективному исследованию детского возраста [9].
Даже у детей старшего возраста нельзя было отличить симптомы ВП от других возбудителей. Рентгенологические заключения в M . pneumoniae pneumoniae в целом не отличались от ВП.
Почти у 25% всех детей во время болезни была какая-либо сыпь (эритема/крапивница), а у 33% были желудочно-кишечные симптомы, такие как тошнота и/или рвота. Тяжелые внелегочные проявления, сопровождающие респираторные инфекции, вызванные М . Ожидается появление pneumoniae [26].Двум детям в нашей когорте был поставлен диагноз SJS, который является известным осложнением M . pneumoniae [27]. Очаги М . Недавно сообщалось о pneumoniae -ассоциированном ССД у детей [28]. Мы не видели детей с неврологическими симптомами в этой когорте, чего можно было бы ожидать.
Заключение
М . pneumoniae является серьезной причиной ИНДП у детей и может вызывать инфекции, которые трудно отличить от ВП, вызванных другими респираторными патогенами. М . pneumoniae также поражают младенцев и детей раннего возраста в периоды эпидемий, и мы считаем, что M . pneumoniae следует рассматривать как дифференциальный диагноз с респираторными вирусными инфекциями и как причину проблемных симптомов со стороны легких у младенцев и детей и пневмонии. Рентгенограммы органов грудной клетки не имели патогномоничных признаков ВП. Во время надвигающейся эпидемии оценка внелегочных проявлений, особенно иммунологических кожных реакций, может быть полезной при диагностике M . пневмонии инфекций.
Вспомогательная информация
Набор данных S1
Анонимная версия базы данных.(XLSX)
Заявление о финансировании
Участвующие отделения (отделение педиатрии, больница Нордселландс, Хиллерёд, Дания и отделение клинической микробиологии, больница Херлев, Херлев, Дания) спонсировали это исследование, финансируя дополнительные микробиологические анализы. на клинические исследования и на заработную плату MJS, MBF, DSH и IMJ.Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Доступность данных
Все соответствующие данные содержатся в документе и в его файлах вспомогательной информации.
Литература
2. Хорнслет А. Вирусология острых респираторных инфекций. 1. Обследование этиологии у детей]. Угескр Лаегер. 1967; 129: 1253–1258. [PubMed] [Google Scholar]3. Хорнслет А. Вирусология острых инфекций дыхательных путей.2. Выделение вирусов у госпитализированных детей. Угескр Лаегер. 1967; 129: 1259–1265. [PubMed] [Google Scholar]4. Харрис М., Кларк Дж., Кут Н., Флетчер П., Харнден А., Маккин М. и др. Рекомендации Британского торакального общества по лечению внебольничной пневмонии у детей: обновление 2011 г. Thorax. 2011;66 Приложение 2: II1–23. doi: 10.1136/thoraxjnl-2011-200598 [PubMed] [Google Scholar]5. Залензинк Д., Вальехо Дж. Инфекция микоплазменной пневмонии у детей. 2009-е изд. Своевременно.
6. Glezen WP, Loda FA, Clyde WA, Senior RJ, Sheaffer CI, Conley WG, et al.Эпидемиологическая картина острых заболеваний нижних дыхательных путей у детей в педиатрической групповой практике. J Педиатр. 1971; 78: 397–406. дои: 10.1016/S0022-3476(71)80218-4 [PubMed] [Google Scholar]7. Uldum SA, Bangsborg JM, Gahrn-Hansen B, Ljung R, Mølvadgaard M, Føns Petersen R, et al. Эпидемия инфекции Mycoplasma pneumoniae в Дании, 2010 и 2011 гг. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [Google Академия]8. Sørensen CM, Schønning K, Rosenfeldt V. Клинические характеристики детей с инфекцией Mycoplasma pneumoniae, госпитализированных во время эпидемии в Дании 2010–2012 гг.Дэн Мед Дж. 2013; 60: A4632 [PubMed] [Google Scholar]9. Дефилиппи А., Сильвестри М., Такчелла А., Джаккино Р., Мелиоли Г., Ди Марко Э. и др. Эпидемиология и клинические особенности микоплазменной пневмонии у детей. Респир Мед. 2008; 102: 1762–1768. doi: 10.1016/j.rmed.2008.06.022 [PubMed] [Google Scholar] 10. Gadsby NJ, Reynolds AJ, McMenamin J, Gunson RN, McDonagh S, Molyneaux PJ, et al. Увеличение количества сообщений о Mycoplasma pneumoniae из лабораторий в Шотландии в 2010 и 2011 годах — влияние эпидемии на младенцев.Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [PubMed] [Google Scholar] 12. Чалкер В., Стоки Т., Литт Д., Бермингем А., Уотсон Дж., Флеминг Д. и др. Рост выявления инфекции Mycoplasma pneumoniae у детей в Англии и Уэльсе, октябрь 2011 г. – январь 2012 г. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [PubMed] [Google Scholar] 13. Алмасри М., Диза Э., Папа А., Эбориаду М., Сулиу Э. Инфекции дыхательных путей Mycoplasma pneumoniae среди греческих детей.Гиппократия. 2011; 15: 147–152. [Бесплатная статья PMC] [PubMed] [Google Scholar]14. Инчли К.С., Берг А.С., Вахдани Бенам А., Квиссел А.К., Лигаард Т.М., Накстад Б. Mycoplasma Pneumoniae: перекрестное популяционное сравнение тяжести заболевания у детей дошкольного и школьного возраста. Pediatr Infect Dis J. 2017; 36: 930–936. дои: 10.1097/INF.0000000000001628 [PubMed] [Google Scholar] 15. Spuesens EBM, Fraaij PLA, Visser EG, Hoogenboezem T, Hop WCJ, van Adrichem LNA и др. Носительство Mycoplasma pneumoniae в верхних дыхательных путях симптомных и бессимптомных детей: обсервационное исследование.ПЛОС Мед. 2013;10: e1001444 doi: 10.1371/journal.pmed.1001444 [Бесплатная статья PMC] [PubMed] [Google Scholar]16. Флеминг С., Томпсон М., Стивенс Р., Хенеган С., Плюддеманн А., Маконочи И. и др. Нормальные диапазоны частоты сердечных сокращений и частоты дыхания у детей от рождения до 18 лет: систематический обзор обсервационных исследований. Ланцет. 2011; 377: 1011–1018. дои: 10.1016/S0140-6736(10)62226-X [Бесплатная статья PMC] [PubMed] [Google Scholar]17. Гардинер С.Дж., Гавранич Дж.Б., Чанг А.Б. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. В: The Cochrane Collaboration, под редакцией.Кокрановская база данных систематических обзоров. Чичестер, Великобритания: John Wiley & Sons, Ltd; 2015. дои: 10.1002/14651858.CD004875.pub5 [PubMed] [Google Scholar] 18. Корппи М., Хейсканен-Косма Т., Клеемола М. Заболеваемость внебольничной пневмонией у детей, вызванной Mycoplasma pneumoniae: серологические результаты проспективного популяционного исследования в первичной медико-санитарной помощи. Респирол Карлтон Вик. 2004; 9: 109–114. doi: 10.1111/j.1440-1843.2003.00522.x [PubMed] [Google Scholar] 19. Stokholm J, Chawes BL, Vissing NH, Bjarnadóttir E, Pedersen TM, Vinding RK, et al.Азитромицин при эпизодах с астмоподобными симптомами у детей младшего возраста в возрасте 1–3 лет: рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет Респир Мед. 2016;4: 19–26. дои: 10.1016/S2213-2600(15)00500-7 [Бесплатная статья PMC] [PubMed] [Google Scholar]20. Stokholm J, Bisgaard H. Хроническая инфекция легких Chlamydia pneumoniae: забытое объяснение эффектов макролидов при хрипах и астме? – Ответ авторов. Ланцет Респир Мед. 2016;4: е8–е9. doi: 10.1016/S2213-2600(16)00050-3 [PubMed] [Google Scholar]21.Берг А.С., Инчли К.С., Аасэ А., Фьерли Х.О., Булл Р., Ааберге И. и др. Этиология пневмонии у детей с высоким охватом пневмококковой вакциной: проспективное исследование. Pediatr Infect Dis J. 2016; 35: e69–75. дои: 10.1097/INF.0000000000001009 [PubMed] [Google Scholar] 22. Малхолланд С., Гавранич Д.Б., Гиллис М.Б., Чанг А.Б. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. Cochrane Database Syst Rev. 2012;9: CD004875 дои: 10.1002/14651858.CD004875.pub4 [PubMed] [Google Scholar] 25. Ульдум С.А., Амберг П., Дженсен Дж.С. [Резистентность к макролидам у Mycoplasma pneumoniae при рецидивах и продолжительных заболеваниях]. Угескр Лаегер. 2012; 174: 730–731. [PubMed] [Google Scholar] 26. Бьёрн А-МБ, Лебех А-МК. Внелегочные осложнения микоплазменной пневмонии. Угескр Лаегер. 2002; 164: 1805–1809 гг. [PubMed] [Google Scholar]Клинические проявления у младенцев и детей с инфекцией Mycoplasma pneumoniae
PLoS One.2018; 13(4): e01.
, Курирование данных, Формальный анализ, Исследование, Написание – первоначальный проект, 1, * , Исследование, Методология, Проверка, Написание – обзор и редактирование, 2 , Концептуализация, Методология, Надзор, Написание – обзор и редактирование , 2 и , Концептуализация, Методология, Управление проектом, Надзор, Написание – проверка и редактирование 1Миа Йоханна Сёндергаард
1 Отделение педиатрии, больница Nordsjællands, Hillerød, Дания
Martin Barfred Friis
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Dennis Schrøder Hansen
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Inger Merete Jørgensen
1 Отделение педиатрии, Больница Нордселландс, Хиллерёд, Дания
Оливер Шильдген, редактор
1 Отделение педиатрии, Больница Нордселландс, Хиллерёд, Дания
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Kliniken der Stadt Köln gGmbH, ГЕРМАНИЯ
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Поступила в редакцию 21 окт. 2016 г.; Принято 14 февраля 2018 г.
Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.Эта статья была процитирована. по другим статьям в PMC.Abstract
История вопроса
Mycoplasma pneumoniae является частой причиной внебольничной пневмонии у детей старшего возраста.Легочные и внелегочные симптомы, связанные с M . Зарегистрировано пневмонии инфекций. М . pneumoniae носит преимущественно эпидемический характер в Дании с рецидивами каждые 4-7 -го -го года.
Цели
Ретроспективно описать эпидемиологию и клинические особенности у младенцев и детей в течение М . pneumoniae эпидемия 2010 и 2011 гг.Включено pneumoniae за период 01.02.2010–31.01.2012. Медицинские карты, а также рентгенологические данные были рассмотрены для всех детей с М . пневмонии . Для части когорты был проведен ретроспективный анализ вирусных коинфекций.
Результаты
134 из 746 детей дали положительный результат на М . pneumoniae с помощью ПЦР или серологии. Положительные тесты были обнаружены у 65% детей 7 лет и старше, у 30% детей 2-6 лет и у 4% детей грудного возраста (до двух лет).Вирусная коинфекция была обнаружена в 27% протестированных образцов. Клиническими проявлениями были кашель, астматические симптомы и субфебрильная температура. Внелегочные симптомы были частыми и проявлялись тошнотой/рвотой у 33% детей и кожными проявлениями у 25%. 84% детей сделали рентген грудной клетки, и у 94% из них были положительные результаты рентгенологического исследования.
Заключение
М . pneumoniae также поражал младенцев и детей младшего возраста, и симптомы были похожи на инфекции респираторными вирусами, но также наблюдались тяжелые ИНДП.Во время надвигающейся эпидемии оценка внелегочных проявлений может быть полезной при диагностике M . пневмонии инфекций.
Введение
Mycoplasma pneumoniae ( M . pneumoniae ) является важной причиной инфекций дыхательных путей, особенно у детей и молодых людей, и, по оценкам, на нее приходится до 30–40% внебольничных инфекций. пневмонии (ВП) [1–4]. Легочные проявления обычно представляют собой трахеобронхит и пневмонию, сопровождающиеся кашлем, а также хрипами.Маленькие дети считаются менее восприимчивыми к M . pneumoniae у детей школьного возраста [5,6]. В Дании M . pneumoniae носит преимущественно эпидемический характер с частотой рецидивов каждые 4-7 — лет [7].
Дания испытала M . Эпидемия pneumoniae с пиком осенью 2010 г. и снова осенью 2011 г. Statens Serum Institut (SSI), отвечающий за национальную систему эпиднадзора в Дании, описал ее как две волны одной и той же эпидемии [7].
Осознание того, что дети дошкольного возраста и даже младенцы могут быть восприимчивы и иметь клинические симптомы от M . Инфекция pneumoniae развилась в последние годы и была зарегистрирована в исследованиях, проведенных в Европе и Австралии [8–14]. С клинической точки зрения важно установить, является ли M . pneumoniae играет важную дифференциальную роль в инфекциях нижних дыхательных путей и астмоподобных обострениях у детей раннего возраста и младенцев.В последние годы актуален вопрос о коинфекциях и бессимптомном носительстве М . pneumoniae и, следовательно, гипердиагностика M . pneumoniae с помощью ПЦР обсуждался [15].
Целью данного исследования было описание и характеристика M . pneumoniae в условиях стационара, а также для оценки возможных возрастных клинических признаков у младенцев, детей младшего возраста и детей старшего возраста, госпитализированных с диагнозом M . пневмония инфекция. Исследование было начато, так как мы испытали сдвиг в клинической картине нашего M . пневмонии больных во время эпидемии. Литература в этой области обширна и содержит различные мнения, как уже упоминалось, о патогенности бактерий и показаниях к лечению, а также о значении инфекций у детей дошкольного возраста. Наш отчет — еще один кирпичик в понимании этого патогена.
Материалы и методы
Мы разработали ретроспективный анализ всех детей в возрасте до 16 лет, поступивших в педиатрическое отделение больницы Нордселландс, Хиллерёд, Дания, которые были исследованы на M . pneumoniae либо с помощью полимеразной цепной реакции (ПЦР), либо с помощью серологии ( M . pneumoniae тест на антитела и тест холодовой агглютинации). Период исследования: с 01.02.2010 по 31.01.2012. Мы собрали результаты ПЦР и результаты образцов крови как в нашей местной микробиологической лаборатории (ПЦР), так и в SSI (ПЦР и серология). Данные были сопоставлены по номеру социального страхования, чтобы избежать двойной выборки. ПЦР проводили на мазках из ротоглотки, которые хранили и транспортировали в лабораторию в охлажденном виде.Диагностика М . pneumoniae был основан на коммерчески доступном наборе для ПЦР в реальном времени (RT-PCR) (Minerva Biolabs Venor R Mp Mycoplasma pneumoniae — Диагностический набор для количественной ПЦР типа I), направленном на ген цитоадгезии P1. ПЦР представлял собой мультиплексный анализ, также нацеленный на Chlamydophila pneumoniae/psittaci . Анализ проводили в соответствии с описанием производителя. Короче говоря, 10 мкл образца добавляли к 14,4 мкл мастермикса, содержащего 14 мкл буфера, 0.2 мкл Taq-полимеразы и 0,2 мкл урацил-N-гликозилазы. ОТ-ПЦР проводили при следующих условиях на машине Stratagene Mx 3005P RT-PCR: 10 мин при 95°C, затем 45 циклов по 30 с при 95°C, 30 с при 55°C и 30 с при 60°C. . М . В фильтре FAM было обнаружено pneumoniae .
Серологические тесты были выполнены внешним коммерческим поставщиком (SSI) и основаны на M . pneumoniae специфические антитела IgM (MPT) вместе с холодовыми агглютининами (KAT).Титр как МФТ, так и КАТ выше или равный 64 считался положительным тестом. Поскольку титры КАТ падают быстрее после перенесенной инфекции, ее использовали для повышения вероятности продолжающейся инфекции. Подсчитано, что 95% лиц моложе 20 лет имеют положительные титры КАТ в ответ на М . Инфекция pneumoniae (тест-информация об ИОХВ).
Дети с двумя или более положительными ПЦР-тестами в течение трех месяцев рассматривались как один и тот же инфекционный эпизод и включались только один раз.
Дети были направлены врачами общей практики или отделением неотложной помощи больницы. Дежурный врач заказал М . pneumoniae отбор проб согласно клинической оценке.
Были собраны демографические и клинические данные о 134 детях с положительным тестом на M . pneumoniae , судя по медицинской карте. Карты 612 детей с отрицательными тестами не проверены. Медицинский анамнез систематически анализировался с использованием компьютеризированных медицинских карт, радиологических отчетов и лабораторных отчетов.Анализируемые характеристики включали демографические данные (возраст, пол, история болезни до поступления), клиническую картину (легочные и внелегочные симптомы, клиническое обследование, частота дыхания, аускультация, температура, сатурация кислорода), рентгенологические данные, биохимию (С-реактивный белок ( СРБ), количество лейкоцитов при поступлении) сопутствующие инфекции, осложнения и медикаментозное лечение. Для анализа данных дети были разделены на возрастные группы: до двух лет (далее в тексте — младенцы), 2–6 лет и 7–15 лет (дети школьного возраста).
Для дальнейшего ответа на вопрос о вирусных коинфекциях, ретроспективный анализ исходного замороженного образца ротоглоточного мазка из 49 из M . pneumoniae положительных когорты были протестированы с помощью ПЦР с использованием имеющегося в продаже набора (линейка Biomerieux Respiratory MWS R-Gene) на широкий спектр респираторных вирусов (включая респираторно-синцитиальный вирус (RSV), грипп A и B, метапневмовирус человека, риновирус , вирус парагриппа, коронавирус, бокавирус и аденовирус).Короче говоря, ПЦР проводили в четырех двойных комплексах; 10 мкл образца добавляли к 15 мкл мастер-микса, содержащего буфер, обратную транскриптазу и смесь праймер/зонд. ОТ-ПЦР проводили при следующих условиях на приборе Stratagene Mx 3005P для ОТ-ПЦР: 5 мин при 50°С, 15 мин при 95°С, затем 45 циклов по 10 с при 95°С, 40 с при 60°С. °С и 25 сек при 72°С. Цели Al были обнаружены либо в фильтре FAM, либо в фильтре HEX.
Положительные образцы после более чем 35 Ct-циклов были повторно оценены для подтверждения действительно положительного результата.
Комитет по этике региона Ховедстаден (номер протокола: H-2-2012-132), а также Датское агентство по защите данных одобрили исследование. Это одобрение включало согласие на просмотр медицинских записей без информированного согласия пациентов.
Статистический анализ выполнен в STATA 10.0, программных пакетах SPSS версии 22 и Microsoft Excell. Chi 2 -критерий, точный критерий Фишера или Z-критерий использовали для анализа категорийных данных и двухвыборочный Т-критерий для числовых данных.Значение p <0,05 считалось значимым.
Результаты
Эпидемиологические данные
Из 885 пациентов протестированы на M . pneumoniae в период исследования, 139 были исключены из-за возраста (старше 15 лет), двойного отбора проб или повторных проб в течение трех месяцев. Всего в исследование было включено 746 детей с инфекцией дыхательных путей (ИРТ), у 134 из которых был положительный тест на M . пневмонии . Из 740 М . pneumoniae Включено ПЦР-анализов, 132 из которых были положительными, а из 20 серологических тестов 3 были положительными. Четырнадцать детей были протестированы как с помощью ПЦР в реальном времени, так и с помощью серологии.
показывает количество детей, протестированных на M . pneumoniae и количество положительных случаев по месяцам. Эпидемия достигла своего пика в октябре 2010 года и снова в октябре-декабре 2011 года. Численность М . pneumoniae положительных случая составило 50 (из 386) в первый эпидемический сезон и 84 (из 360) во второй период эпидемии, при значительно более высоком показателе (0,13 против 0,23) положительных случаев в более позднем (р = 0,0002, хи 2 — тест).В целом у 18% детей, протестированных на M. pneumonia, был положительный образец.
Количество положительных и отрицательных M . пневмонии тестов по годам и месяцам.
Высшая скорость М . pneumoniae положительных образца были у детей школьного возраста (65%), но особенно у детей дошкольного возраста (30%), и даже у шести детей в возрасте до двух лет (4%) было M . пневмонии положительных теста.
Клиническая картина, рентгенологические данные и лабораторные исследования
Характеристики пациентов, стратифицированные по возрастным группам, представлены в .
Таблица 1
Симптомы, внелегочные симптомы, объективные признаки, биохимические и рентгенологические данные у детей с Mycoplasma pneumoniae.
| <2 Y | 2-6 Y | 7-15 y | Всего | <2 Y | 2-6 y | 7-15 y | Всего | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Объективные признаки: | ||||||||||||
| Количество детей | 6 | 40 | 88 | 134 | тахипноэ, (%) W | 0 | 52 | 52 | 57 | 57 | 52 | 52 |
| мужчины (%) | 67 | 67 | 60324 | 53 | 56 | Температура ° C (Median [IQR]) | 38.5 [37.4: 39.4] | 37.8 [37.3: 38.5] | 37.9 [37.5: 38.8] | 37,9 [37.4: 38.8] | ||
| Симптоматические дни до приема (среднее) * | 4 | 12 | 10 | 10 | 10 | 10 | Auscultation-hheezing (%) | 33 | 24 | 23 | 23 | 24 |
| дня поступления (среднее) ** | 2 | 1,8 | 2,3 | 2,2 | 2,2 | 2,2 | Auscultation-Trackles / Снижение звуки дыхания (%) | 47 | 47 | 57 | 56 | |
| симптомов: | Лабораторные испытания: Y | |||||||||||
| Chough (%) | 100 | 100 | 99 | 99 | 99 | CRP, мг / л (медианы [IQR]) | 33 [слишком мало] | 28.5 [17.5: 40.3] | 25 [16.5: 32.5] | 28 [16.3: 39.3] | ||
| Hheezing (%) | 50 | 17 | 16 | 17 | Количество лейкоцитов (Median [IQR ]) | 17.0 [Слишком мало] | 8.1 [5.8: 11.9] | 10,3 [8.3: 12.7] | 9.3 [6.2: 12.2] | |||
| Rhinorrhoea (%) | 40 | 11 | 15 | Количество нейтрофилов (медиана [IQR]) | 9,6 [слишком мало] | 5.3 [3.9: 9.3] | 6.6 [5.1: 8.3] | 5.8 [4.0: 8.9] | ||||
| Боли в горле (%) | 0 | 18 | 26 | 26 | 22 | Количество лимфоцитов (Median [ IQR]) | 5.2 [Слишком мало] | 1.5 [1.1: 1.8] | 2.2 [1.7: 2.9] | [1.7: 2.9]1.7 [1.3: 2.5] | ||
| 0 | 0 | 5 | 3 | |||||||||
| внелегочного симптомы: | Рентгенологически: Z | |||||||||||
| Лихорадка ≥ 38 ° C (%) | 94 | 94 | 94 | 9 94 | 91 | 91 | Илала Аденопатия (исключительно) (%) | 3 | 13 | 5 | 903 49 8||
| Make Mainestation (ALL) x (%) | 18 | 18 | 24 | 23 | Infiltration Lobar (%) | 33 | 81 | 82 | 80 | |||
| Urticarial Rash (%) | 17 | 0 | 0 | 13 | 9 | Atelectasis (%) | 0 | 16 | 19 | 18 | 18 | |
| Стивен Джонсон Синдром (NO) | 0 | 0 | 2 | 2 | 2 | 2 | 9 | 9 | 9 | 9 | 9 | |
| Тошнота и / или рвота (%) | 33 | 32 | 30 | 31 | Эмпиема (нет) | 0 | 0 | 1 | 1 |
Дети в возрасте до двух лет поступали в стационар значительно раньше после появления симптомов s, чем дети старшего возраста, (p = 0.01, двухвыборочный t-критерий). 61% детей были выписаны из стационара в день поступления.
Наиболее частым респираторным проявлением был кашель (100%) вместе с возрастной степенью хрипов (). При поступлении в стационар у 92% младенцев и детей был диагностирован эпизод неприятных симптомов со стороны легких продолжительностью не менее трех дней. Значительно больше детей младшего возраста (до трех лет) имели объективные хрипы и кашель (астмоподобные симптомы), чем дети старшего возраста (p = 0.01, Z-критерий). Предшествующее и клинически значимое хроническое заболевание диагностировано у 10% детей. Из них 4/13 (31%) имели ранее диагностированную и текущую астму, а также имели тяжелые обострения в течение М . пневмония инфекция.
Большинству пациентов (84%) была сделана рентгенограмма органов грудной клетки, и у 96% из них рентгенологические результаты были положительными (). Среди детей грудного и раннего возраста чаще встречалась эксклюзивная внутригрудная лимфаденопатия, в то время как у детей более старшего возраста обычно выявлялась значительная периферическая инфильтрация на рентгенограмме органов грудной клетки (10).Дети с ателектазом имели значительно большую продолжительность пребывания в стационаре; более трех дней (35% против 25%; p = 0,05). Частота легочных осложнений была одинаковой для детей с СРБ выше 50 мг/л (POCT (тестирование в месте оказания медицинской помощи), часть определения тяжелой пневмонии у взрослых) и ниже 50 мг/л (18% против 19%, p > 0,05). В возрастной группе до двух лет не было зарегистрировано легочных осложнений. Количество тяжелых проявлений пневмонии было одинаковым в возрастных группах; 2–6 лет и 7–15 лет (таблица).В целом 20% детей имели повышенный уровень СРБ более 50 мг/л, и все они были старше трех лет.
Лечение антибиотиками получили 120 детей. Большинство пациентов лечились кларитромицином в соответствии с местными рекомендациями. 64 пациента, или 46%, лечились по подозрению. Из них 53% получали другие антибиотики (бета-лактам) до M . пневмония тестирование. Лечение было начато 56 больным (42%) после получения положительного результата теста.Только шесть детей лечили макролидными антибиотиками дважды из-за подозрения на рецидив или неэффективность лечения. Один образец был протестирован на устойчивость к макролидам и показал отрицательный результат.
Наиболее частым внелегочным проявлением была тошнота с рвотой или без нее, о которой сообщала треть всех детей. У 23% всех детей была сыпь в той или иной форме, а у 9% была крапивница. У детей раннего возраста кожные проявления были в 33% случаев. У двух детей развился синдром Стивена-Джонсона (ССД) с симптомами поражения слизистых оболочек, возникшими до или одновременно с началом лечения антибиотиками.
Одновременно проведено исследование посевов мокроты на другие бактериальные возбудители у 37 детей. У 41% из них была диагностирована коинфекция. Наиболее распространенными бактериями были Moraxella catarrhalis , Haemophilus influenzae и S . пневмония . Из-за методологической установки все дети были протестированы на Chlamydophila pneumoniae ни один из них не оказался положительным.
Только двое детей были протестированы на вирусные инфекции во время клинической подготовки.Апостериорный анализ 49 мазков из ротоглотки показал, что 27% из них имели одиночную или смешанную вирусную коинфекцию (РСВ (1 ребенок), грипп А (2), метапневмовирус человека (1), риновирус (2), коронавирус). (3), бокавирус (2) и аденовирус (5)). Четверо детей оказались положительными с помощью ПЦР на два вируса, а также на M . пневмонии . показывает, по аналогии с , клинические характеристики детей с неизвестной вирусной инфекцией, без нее и с неизвестной вирусной инфекцией. Полученные данные свидетельствуют о том, что значительно чаще детей с микст-инфекцией М . pneumoniae и респираторный вирус имели ринорею (p = 0,02) и хрипы (тенденция, p = 0,07) по сравнению с теми, кто был положительным только на M . пневмонии . Мы не смогли выявить других различий между двумя группами, включая отсутствие рентгенологических расхождений.
Таблица 2
Симптомы, внелегочные симптомы, объективные признаки и рентгенологические данные у детей с Mycoplasma pneumoniae с вирусной коинфекцией или без нее.
| Мп положительный и вирус положительный | Мп положительный и вирус отрицательный | Мп положительный и вирус Неизвестный | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | <2 Y | 2-15 y | 2 <2 y | 2 -15 y | <2 Y | 2-15 Y | 9032 9 | Количество детей | 3 | 10 | 0 | 36 | 3 | 82 | 82 |
| мужчины (%) | 33 | 50 | — | — | — | — | — | 64 | 100 | 51 | 51 | 51 |
| Симптоматические дни до приема (среднее) | 4 | 16 | — | 9.1 | 2,7 | 9,8 | ||||||
| Дни приема (средние) | 1,8 | 2,5 | — | 2,4 | 1,7 | 2,2 | ||||||
| Симптомы : | ||||||||||||
| Кашель (%) | 100 | 90 | — | 100 | 100 | 100 | ||||||
| хрипов (%) | 5024 | 50 * | — | 19 * | 50 | 50 | 10 | |||||
| Rhinorrehea (%) | 0 | 44 ** | — | 7 ** | 67 | 14 | ||||||
| Боль в горле (%) | NA | 24 9000 | — | 27 | 0 | 20 | ||||||
| крупе симптомы (%) | 0 | 0 | — | 0 | 0 | 7 | ||||||
| внелегочного симптомы : | ||||||||||||
| Лихорадка ≥ 38 ° С (%) | 100 | 70 | — | 97 | 67 | 67 | 93 | 93 | 93 | |||
| Skin Mainestation (ALL) x (%) | 67 | 67 | 0 | — | 14 | 0 | 29 | |||||
| Urticarial Rash (%) | 33 | 0 | — | 3 | 0 | 12 | ||||||
| Синдром Стивена Джонсона (нет) | 2 0— | 1 | 0 | 1 | ||||||||
| Тошнота и / или рвота (%) | 0 | 11 | — | 39 | 67 | 31 | ||||||
| Объективные признаки : | ||||||||||||
| тахипноэ Вт (%) | 0 | 44 | — | 53 | 0 | 57 | ||||||
| Температура °C (средняя) | 38.4 | 38,1 — | 38,238,2 | 37,9 | ||||||||
| Аускультация-хрипы (%) | 33 | 20 | — | 24 | 0 | 27 | ||||||
| Auscultation- хрипы / уменьшились дыхание звуки (%) | 100 | 60 | — | 52 | 67 | 44 | ||||||
| Рентгенологически : | ||||||||||||
| внутригрудной лимфаденопатией (исключительно) (%) | 50 | 13 | — | 7 | Н.А. | 7 | ||||||
| Лобар инфильтрация (%) | 50 | 63 | — | 86 | н/д | 85 | ||||||
| Atelectasis (%) | 0 | 13 | — | — | 25 9 | Na | 19 | |||||
| 0 | 0 | — | 11 | Na | 7 | |||||||
| Эмпиема (нет) | 0 | 0 | — | 0 | NA | 1 | ||||||
Обсуждение
Мы представляем данные большой когорты детей с М . пневмония инфекция. Все включенные в исследование дети были направлены из системы первичной медико-санитарной помощи на госпитализацию в связи с характером и тяжестью симптомов. Большинство M . pneumoniae детей с положительным ПЦР-тестом имели ИНДП, что мы подтверждали высокой частотой рентгенологических находок (94%).
Мы обнаружили более высокую частоту положительных проб на поздней волне эпидемии в 2010 и 2011 годах. Дети школьного возраста чаще M . pneumoniae положительных (65%), чем у детей младшего возраста, но даже среди детей в возрасте от 2 до 6 лет 30% были М . pneumoniae положительный результат, подтверждающий наше первоначальное подозрение, что M . pneumoniae также поражает маленьких детей. Даже небольшое количество младенцев; 6 из 276 были диагностированы.
Это исследование проводилось как ретроспективное картографическое исследование. Врач по вызову решил, кого проверить на М . пневмонии . Дети с М . Инфекция pneumoniae могла быть недодиагностирована, если у них были незначительные респираторные симптомы, особенно во время первой волны эпидемического периода.Из-за общепринятых концепций эпидемиологии ВП, первоначально основанных на долгосрочном исследовании, проведенном в учреждениях первичной медико-санитарной помощи с 1963 по 1975 г., мы ожидаем, что младенцы и дети младшего возраста будут недодиагностированы из-за систематической ошибки отбора [6].
Даже очень маленькие дети могут заболеть от M . pneumoniae , хотя встречается реже. Необходимо учитывать дифференциальную диагностику респираторных вирусных инфекций и обострения астмоподобных симптомов. Клиническая картина с кашлем, свистящими хрипами, субфебрилитетом, СРБ ниже 50 мг/л и хрипами при аускультации у 33% детей раннего возраста также может быть расценена как обострение астмы детского возраста, в первую очередь за счет вирусной инфекции в дети дошкольного возраста.Действительно, у нас также была незначительная степень смешанных вирусных коинфекций, обнаруженных в нашем апостериорном анализе. Можно только предполагать, какой возбудитель явился первопричиной заболевания в этих случаях. В связи с нашими постфактум выводами, мы рекомендуем, чтобы маленькие дети с хрипами и ринореей были проверены на оба M . pneumoniae и респираторно-вирусные инфекции одновременно. За норвежский М . pneumoniae эпидемия, Inchly et al. описали аналогичное относительное количество вирусных коинфекций [14].
В голландском детстве этюд перевозки M . pneumoniae в верхних дыхательных путях (ВДП), сезон и год регистрации повлияли на распространенность бессимптомного носительства в пределах от 3% до 52% [17]. В нашем исследовании часть детей, выписанных из палаты в тот же день, что и госпитализированные, могли быть носителями М . пневмонии . Тем не менее, некоторые из этих детей получали антибиотики первой линии до поступления и были направлены в наше отделение из-за недостаточного ответа на лечение бета-лактамными антибиотиками.
Кроппи и др. [18] установили, что у 50% детей с ИНДП, вызванными М . pneumoniae были коинфицированы преимущественно S . pneumoniae или Chlamydiae spp. . Только небольшая часть этой когорты была проверена на бактериальную коинфекцию, но мы не считали это серьезной проблемой. Примечательно, что 59% детей перед обследованием на М лечились бета-лактамным антибиотиком. pneumoniae без улучшения инфекции.
В отдельные периоды эпидемии в Дании (2010–2011 гг.) Stockholm et al. выявили влияние азитромицина (антибиотик из группы макролидов) на продолжительность эпизода астмоподобных симптомов у детей младшего возраста. Нет исследований для M . Было выполнено pneumoniae , и критерии исключения частоты дыхания более 50/мин, температуры более 39°C и СРБ более 50 мг/л не исключали бы всех детей с возможным М . инфекция pneumoniae [19–21]. Два недавно опубликованных норвежских исследования описали несоответствие частоты клинических симптомов M . pneumoniae инфекций у детей дошкольного возраста между эпидемическим и эндемическим периодами [14,21]. Рандомизированные контролируемые исследования, касающиеся эффективности макролидов при астмоподобных симптомах, следует проводить в периоды эндемии или лучше контролировать для M . pneumoniae инфекций, особенно у детей раннего возраста, родившихся после эпидемического периода. Противовоспалительный эффект макролидов требует дальнейшего изучения [22].
10% этой когорты страдали хроническими заболеваниями, главным образом тяжелыми респираторными заболеваниями.У нынешних астматиков диагностированы тяжелые обострения бронхиальной астмы.
Дети более старшего возраста, как правило, обращались за помощью позже после появления симптомов и были ответственны за более длительную госпитализацию. Это может указывать на то, что у детей более старшего возраста были более тяжелые инфекции или что задержка с госпитализацией привела к более тяжелому заболеванию и, следовательно, к более длительному периоду реабилитации. Несмотря на это, мы также выявили тяжелую пневмонию по рентгенологическим данным (ателектаз, плевральный выпот) у детей 2-6 лет.С поправкой на численность населения эти дошкольники имели повышенный риск развития тяжелой пневмонии по сравнению со школьниками во время этой эпидемии. Инчли и др. показали одинаковую картину, даже если их определение тяжелой пневмонии различалось [14]. Раннее лечение инфекций может снизить тяжелую заболеваемость и продолжительность пребывания в больнице.
Обработка M . pneumoniae инфекций, вызванных антибиотиками-макролидами, является спорным, поскольку в Кокрейновском обзоре сделан вывод о недостаточности доказательств, чтобы делать какие-либо конкретные выводы об эффективности антибиотиков у M . пневмонии инфекций у детей [17,22]. Эффективность лечения антибиотиками следует обсуждать в свете правильного диагностического теста [15]. Бессимптомные носители M . pneumoniae необходимо дифференцировать от детей, страдающих симптомными инфекциями, ИНДП, вызванными М . pneumoniae [23]. Гардинер и др. подчеркивают необходимость проведения РКИ по этой теме [17]. В Дании SSI по-прежнему рекомендует лечение M . pneumoniae положительных ИННД у детей [24].Резистентность к макролидам является растущей проблемой во всем мире. В Дании частота оценивается в 2% [25]. Резистентности к макролидам в нашей группе детей выявлено не было.
Мы обнаружили рентгенологические изменения в 94% рентгенограмм грудной клетки, сделанных в этом исследовании. Рентгенологические данные были довольно разнообразны, но примечательно, что более 80% детей старше двух лет имели лобарную инфильтрацию, в то время как у детей младшего возраста были значительно более тонкие признаки. Это соответствовало итальянскому проспективному исследованию детского возраста [9].
Даже у детей старшего возраста нельзя было отличить симптомы ВП от других возбудителей. Рентгенологические заключения в M . pneumoniae pneumoniae в целом не отличались от ВП.
Почти у 25% всех детей во время болезни была какая-либо сыпь (эритема/крапивница), а у 33% были желудочно-кишечные симптомы, такие как тошнота и/или рвота. Тяжелые внелегочные проявления, сопровождающие респираторные инфекции, вызванные М . Ожидается появление pneumoniae [26].Двум детям в нашей когорте был поставлен диагноз SJS, который является известным осложнением M . pneumoniae [27]. Очаги М . Недавно сообщалось о pneumoniae -ассоциированном ССД у детей [28]. Мы не видели детей с неврологическими симптомами в этой когорте, чего можно было бы ожидать.
Заключение
М . pneumoniae является серьезной причиной ИНДП у детей и может вызывать инфекции, которые трудно отличить от ВП, вызванных другими респираторными патогенами. М . pneumoniae также поражают младенцев и детей раннего возраста в периоды эпидемий, и мы считаем, что M . pneumoniae следует рассматривать как дифференциальный диагноз с респираторными вирусными инфекциями и как причину проблемных симптомов со стороны легких у младенцев и детей и пневмонии. Рентгенограммы органов грудной клетки не имели патогномоничных признаков ВП. Во время надвигающейся эпидемии оценка внелегочных проявлений, особенно иммунологических кожных реакций, может быть полезной при диагностике M . пневмонии инфекций.
Вспомогательная информация
Набор данных S1
Анонимная версия базы данных.(XLSX)
Заявление о финансировании
Участвующие отделения (отделение педиатрии, больница Нордселландс, Хиллерёд, Дания и отделение клинической микробиологии, больница Херлев, Херлев, Дания) спонсировали это исследование, финансируя дополнительные микробиологические анализы. на клинические исследования и на заработную плату MJS, MBF, DSH и IMJ.Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Доступность данных
Все соответствующие данные содержатся в документе и в его файлах вспомогательной информации.
Литература
2. Хорнслет А. Вирусология острых респираторных инфекций. 1. Обследование этиологии у детей]. Угескр Лаегер. 1967; 129: 1253–1258. [PubMed] [Google Scholar]3. Хорнслет А. Вирусология острых инфекций дыхательных путей.2. Выделение вирусов у госпитализированных детей. Угескр Лаегер. 1967; 129: 1259–1265. [PubMed] [Google Scholar]4. Харрис М., Кларк Дж., Кут Н., Флетчер П., Харнден А., Маккин М. и др. Рекомендации Британского торакального общества по лечению внебольничной пневмонии у детей: обновление 2011 г. Thorax. 2011;66 Приложение 2: II1–23. doi: 10.1136/thoraxjnl-2011-200598 [PubMed] [Google Scholar]5. Залензинк Д., Вальехо Дж. Инфекция микоплазменной пневмонии у детей. 2009-е изд. Своевременно.
6. Glezen WP, Loda FA, Clyde WA, Senior RJ, Sheaffer CI, Conley WG, et al.Эпидемиологическая картина острых заболеваний нижних дыхательных путей у детей в педиатрической групповой практике. J Педиатр. 1971; 78: 397–406. дои: 10.1016/S0022-3476(71)80218-4 [PubMed] [Google Scholar]7. Uldum SA, Bangsborg JM, Gahrn-Hansen B, Ljung R, Mølvadgaard M, Føns Petersen R, et al. Эпидемия инфекции Mycoplasma pneumoniae в Дании, 2010 и 2011 гг. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [Google Академия]8. Sørensen CM, Schønning K, Rosenfeldt V. Клинические характеристики детей с инфекцией Mycoplasma pneumoniae, госпитализированных во время эпидемии в Дании 2010–2012 гг.Дэн Мед Дж. 2013; 60: A4632 [PubMed] [Google Scholar]9. Дефилиппи А., Сильвестри М., Такчелла А., Джаккино Р., Мелиоли Г., Ди Марко Э. и др. Эпидемиология и клинические особенности микоплазменной пневмонии у детей. Респир Мед. 2008; 102: 1762–1768. doi: 10.1016/j.rmed.2008.06.022 [PubMed] [Google Scholar] 10. Gadsby NJ, Reynolds AJ, McMenamin J, Gunson RN, McDonagh S, Molyneaux PJ, et al. Увеличение количества сообщений о Mycoplasma pneumoniae из лабораторий в Шотландии в 2010 и 2011 годах — влияние эпидемии на младенцев.Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [PubMed] [Google Scholar] 12. Чалкер В., Стоки Т., Литт Д., Бермингем А., Уотсон Дж., Флеминг Д. и др. Рост выявления инфекции Mycoplasma pneumoniae у детей в Англии и Уэльсе, октябрь 2011 г. – январь 2012 г. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012;17. [PubMed] [Google Scholar] 13. Алмасри М., Диза Э., Папа А., Эбориаду М., Сулиу Э. Инфекции дыхательных путей Mycoplasma pneumoniae среди греческих детей.Гиппократия. 2011; 15: 147–152. [Бесплатная статья PMC] [PubMed] [Google Scholar]14. Инчли К.С., Берг А.С., Вахдани Бенам А., Квиссел А.К., Лигаард Т.М., Накстад Б. Mycoplasma Pneumoniae: перекрестное популяционное сравнение тяжести заболевания у детей дошкольного и школьного возраста. Pediatr Infect Dis J. 2017; 36: 930–936. дои: 10.1097/INF.0000000000001628 [PubMed] [Google Scholar] 15. Spuesens EBM, Fraaij PLA, Visser EG, Hoogenboezem T, Hop WCJ, van Adrichem LNA и др. Носительство Mycoplasma pneumoniae в верхних дыхательных путях симптомных и бессимптомных детей: обсервационное исследование.ПЛОС Мед. 2013;10: e1001444 doi: 10.1371/journal.pmed.1001444 [Бесплатная статья PMC] [PubMed] [Google Scholar]16. Флеминг С., Томпсон М., Стивенс Р., Хенеган С., Плюддеманн А., Маконочи И. и др. Нормальные диапазоны частоты сердечных сокращений и частоты дыхания у детей от рождения до 18 лет: систематический обзор обсервационных исследований. Ланцет. 2011; 377: 1011–1018. дои: 10.1016/S0140-6736(10)62226-X [Бесплатная статья PMC] [PubMed] [Google Scholar]17. Гардинер С.Дж., Гавранич Дж.Б., Чанг А.Б. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. В: The Cochrane Collaboration, под редакцией.Кокрановская база данных систематических обзоров. Чичестер, Великобритания: John Wiley & Sons, Ltd; 2015. дои: 10.1002/14651858.CD004875.pub5 [PubMed] [Google Scholar] 18. Корппи М., Хейсканен-Косма Т., Клеемола М. Заболеваемость внебольничной пневмонией у детей, вызванной Mycoplasma pneumoniae: серологические результаты проспективного популяционного исследования в первичной медико-санитарной помощи. Респирол Карлтон Вик. 2004; 9: 109–114. doi: 10.1111/j.1440-1843.2003.00522.x [PubMed] [Google Scholar] 19. Stokholm J, Chawes BL, Vissing NH, Bjarnadóttir E, Pedersen TM, Vinding RK, et al.Азитромицин при эпизодах с астмоподобными симптомами у детей младшего возраста в возрасте 1–3 лет: рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет Респир Мед. 2016;4: 19–26. дои: 10.1016/S2213-2600(15)00500-7 [Бесплатная статья PMC] [PubMed] [Google Scholar]20. Stokholm J, Bisgaard H. Хроническая инфекция легких Chlamydia pneumoniae: забытое объяснение эффектов макролидов при хрипах и астме? – Ответ авторов. Ланцет Респир Мед. 2016;4: е8–е9. doi: 10.1016/S2213-2600(16)00050-3 [PubMed] [Google Scholar]21.Берг А.С., Инчли К.С., Аасэ А., Фьерли Х.О., Булл Р., Ааберге И. и др. Этиология пневмонии у детей с высоким охватом пневмококковой вакциной: проспективное исследование. Pediatr Infect Dis J. 2016; 35: e69–75. дои: 10.1097/INF.0000000000001009 [PubMed] [Google Scholar] 22. Малхолланд С., Гавранич Д.Б., Гиллис М.Б., Чанг А.Б. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. Cochrane Database Syst Rev. 2012;9: CD004875 дои: 10.1002/14651858.CD004875.pub4 [PubMed] [Google Scholar] 25. Ульдум С.А., Амберг П., Дженсен Дж.С. [Резистентность к макролидам у Mycoplasma pneumoniae при рецидивах и продолжительных заболеваниях]. Угескр Лаегер. 2012; 174: 730–731. [PubMed] [Google Scholar] 26. Бьёрн А-МБ, Лебех А-МК. Внелегочные осложнения микоплазменной пневмонии. Угескр Лаегер. 2002; 164: 1805–1809 гг. [PubMed] [Google Scholar]Пневмония | Медицина Джона Хопкинса
Что такое пневмония?
Пневмония — это инфекция одного или обоих легких, вызванная бактериями, вирусами или грибками.Это серьезная инфекция, при которой воздушные мешочки заполняются гноем и другой жидкостью.
Что вызывает пневмонию?
Существует более 30 различных причин пневмонии, и они сгруппированы по причине. Основными видами пневмонии являются:
Бактериальная пневмония. Этот тип вызывается различными бактериями. Наиболее распространенным является Streptococcus pneumoniae . Обычно это происходит, когда организм каким-либо образом ослаблен, например, из-за болезни, плохого питания, старости или ослабленного иммунитета, и бактерии могут проникнуть в легкие.Бактериальная пневмония может возникнуть в любом возрасте, но вы подвергаетесь большему риску, если злоупотребляете алкоголем, курите сигареты, ослаблены, недавно перенесли операцию, страдаете респираторным заболеванием или вирусной инфекцией или имеете ослабленную иммунную систему.
Вирусная пневмония. Этот тип вызывается различными вирусами, в том числе гриппом (гриппом), и является причиной примерно одной трети всех случаев пневмонии. У вас может быть больше шансов заболеть бактериальной пневмонией, если у вас вирусная пневмония.
Микоплазменная пневмония. Этот тип имеет несколько другие симптомы и физические признаки и называется атипичной пневмонией. Вызывается бактерией Mycoplasma pneumoniae . Как правило, это легкая, широко распространенная пневмония, поражающая все возрастные группы.
Другие пневмонии. Существуют и другие менее распространенные пневмонии, которые могут быть вызваны другими инфекциями, включая грибки.
Кто подвержен риску пневмонии?
Каждый может заболеть пневмонией.Однако наибольшему риску подвержены следующие группы:
Каковы симптомы пневмонии?
Симптомы бактериальной пневмонии включают:
Голубоватый цвет губ и ногтей
Спутанность сознания или делирий, особенно у пожилых людей
Кашель с выделением зеленой, желтой или кровянистой слизи
Лихорадка
Сильное потоотделение
Потеря аппетита
Низкий уровень энергии и сильная усталость
Быстрое дыхание
Быстрый импульс
Озноб
Острая или колющая боль в груди, усиливающаяся при глубоком дыхании или кашле
Одышка, усиливающаяся при физической нагрузке
Микоплазменная пневмония имеет несколько иные симптомы, в том числе сильный кашель, который может сопровождаться выделением слизи.
Как диагностируется пневмония?
Диагноз обычно ставится на основании вашего недавнего анамнеза (например, операции, простуда или воздействие во время путешествий) и степени заболевания. Основываясь на этих факторах, ваш лечащий врач может диагностировать пневмонию просто на основе тщательного сбора анамнеза и физического осмотра. Для подтверждения диагноза могут быть использованы следующие тесты:
Рентген грудной клетки. Этот тест позволяет получить изображения внутренних тканей, костей и органов, включая легкие.
Анализы крови. Этот тест можно использовать для определения наличия инфекции и распространения инфекции в кровоток (культуры крови). Анализ газов артериальной крови проверяет количество кислорода в кровотоке.
Посев мокроты. Этот тест проводится на материале, который откашливается из легких и попадает в рот. Его часто используют, чтобы увидеть, есть ли инфекция в легких.
Пульсоксиметрия. Оксиметр — это небольшой прибор, который измеряет количество кислорода в крови. Небольшой датчик приклеивается скотчем или прикрепляется к пальцу. Когда машина включена, на датчике можно увидеть небольшой красный свет. Тест безболезненный, красный свет не нагревается.
КТ грудной клетки. Эта процедура визуализации использует комбинацию рентгеновских лучей и компьютерных технологий для получения четких, подробных горизонтальных или осевых изображений (часто называемых срезами) тела.Компьютерная томография показывает подробные изображения любой части тела, включая кости, мышцы, жир и органы. Компьютерная томография более подробна, чем обычный рентген.
Бронхоскопия. Это прямое исследование бронхов (основных дыхательных путей легких) с помощью гибкой трубки (называемой бронхоскопом). Он помогает оценивать и диагностировать проблемы с легкими, оценивать закупорку и брать образцы ткани и/или жидкости для анализа,
Посев плевральной жидкости. В этом тесте образец жидкости берется из плевральной полости. Это пространство между легкими и грудной стенкой. Длинная тонкая игла вводится через кожу между ребрами в плевральную полость. Жидкость набирается в шприц, прикрепленный к игле. Его отправляют в лабораторию, где его проверяют, чтобы выяснить, какие бактерии вызывают пневмонию.
Как лечится пневмония?
Лечение зависит от типа вашей пневмонии. Большую часть времени пневмонию лечат дома, но тяжелые случаи можно лечить в больнице.Антибиотики используются при бактериальной пневмонии. Антибиотики также могут ускорить выздоровление при микоплазменной пневмонии и некоторых особых случаях. Большинство вирусных пневмоний не имеют специфического лечения. Обычно они выздоравливают сами по себе.
Другое лечение может включать в себя правильное питание, увеличение потребления жидкости, отдых, оксигенотерапию, обезболивающие препараты, контроль температуры и, возможно, лекарства от кашля, если кашель сильный.
Можно ли предотвратить пневмонию?
Проконсультируйтесь со своим лечащим врачом по поводу вакцинации.Грипп является частой причиной пневмонии. По этой причине ежегодная прививка от гриппа может помочь предотвратить как грипп, так и пневмонию.
Существует также пневмококковая вакцина. Это защитит вас от распространенной формы бактериальной пневмонии. Эта прививка должна быть сделана детям младше 5 лет и взрослым в возрасте 65 лет и старше.
Прививка от пневмококка также рекомендуется всем детям и взрослым, которые подвержены повышенному риску пневмококковой инфекции из-за других заболеваний.
Каковы осложнения пневмонии?
Большинство людей с пневмонией хорошо поддаются лечению, но пневмония может быть очень серьезной и даже смертельной.
У вас больше шансов получить осложнения, если вы пожилой человек, очень маленький ребенок, у вас ослаблена иммунная система или у вас серьезные проблемы со здоровьем, такие как диабет или цирроз печени. Осложнения могут включать:
Острый респираторный дистресс-синдром (ОРДС). Это тяжелая форма дыхательной недостаточности.
Абсцессы легких. Это очаги гноя, которые образуются внутри или вокруг легкого. Возможно, их необходимо дренировать хирургическим путем
Дыхательная недостаточность. Это требует использования дыхательного аппарата или аппарата ИВЛ.
Сепсис. Это когда инфекция попадает в кровь. Это может привести к органной недостаточности.
Основные сведения о пневмонии
Пневмония — это инфекция одного или обоих легких, вызванная бактериями, вирусами или грибками.
Существует более 30 различных причин пневмонии, и они сгруппированы по причине.Основными видами пневмонии являются бактериальная, вирусная и микоплазменная пневмония.
Наиболее распространенным симптомом пневмонии является кашель с выделением зеленой, желтой или кровянистой слизи. Другие симптомы включают лихорадку, озноб, одышку, упадок сил и сильную усталость.
Пневмонию часто можно диагностировать при тщательном сборе анамнеза и физическом осмотре. Также могут использоваться тесты, используемые для осмотра легких, анализы крови и тесты на мокроту, которую вы кашляете.
Лечение зависит от типа вашей пневмонии. Антибиотики используются при бактериальной пневмонии. Это также может ускорить выздоровление от микоплазменной пневмонии и некоторых особых случаев. Большинство вирусных пневмоний не имеют специального лечения и проходят сами по себе. Другое лечение может включать в себя здоровую диету, больше жидкости, отдых, кислородную терапию и лекарства от боли, кашля и лихорадки.
Большинство людей с пневмонией хорошо поддаются лечению, но пневмония может вызывать серьезные проблемы с легкими и инфекции.Это может быть даже смертельно.
Внебольничная пневмония у младенцев и детей
1. Комитет по стандартам медицинской помощи Британского торакального общества. Рекомендации Британского торакального общества по лечению внебольничной пневмонии у детей. Грудная клетка . 2002;57дополнение 1:i1–24….
2. Мерфи Т.Ф., Хендерсон Ф.В., Клайд В. А. младший, Коллиер А.М., Денни ФВ. Пневмония: одиннадцатилетнее исследование в педиатрической практике. Am J Эпидемиол . 1981; 113:12–21.
3. Йокинен С, Хейсканен Л, Ювонен Х, Каллинен С, Каркола К, Корппи М, и другие. Заболеваемость внебольничной пневмонией среди населения четырех муниципалитетов восточной Финляндии. Am J Эпидемиол . 1993; 137: 977–88.
4. Boschi-Pinto C, Debay M. Неофициальная консультация по эпидемиологическим оценкам здоровья детей. 11–12 июня 2001 г. Доступ онлайн 27 февраля 2004 г. по адресу: http://www.who.int/child-adolescent-health/New_Publications/Overview/Report_of_CHERG_meeting.htm.
5. Редд СК, Вреулс Р, Метсинг М, Мохобане ПХ, Патрик Э, Мотити М. Клинические признаки пневмонии у детей, посещающих амбулаторное отделение больницы в Лесото. Bull World Health Organ . 1994; 72: 113–8.
6. Ювен Т, Мерцола Дж, Варис М, Лейнонен М, Мерман О, Ройвайнен М, и другие.Этиология внебольничной пневмонии у 254 госпитализированных детей. Pediatr Infect Dis J . 2000; 19: 293–8.
7. Гастон Б. Пневмония. Детская редакция . 2002; 23: 132–40.
8. Макинтош К. Внебольничная пневмония у детей. N Английский J Med . 2002; 346: 429–37.
9. Брэдли Дж.С. Ведение внебольничной детской пневмонии в эпоху растущей устойчивости к антибиотикам и конъюгированных вакцин.Pediatr Infect Dis J 2002;21:592–8, 613–4.
10. Принципы N, Эспозито С. Mycoplasma pneumoniae и Chlamydia pneumoniae вызывают поражение нижних дыхательных путей у детей. Curr Opin Infect Dis . 2002; 15: 295–300.
11. Хейсканен-Косма Т, Корппи М, Йокинен С, Курки С, Хейсканен Л, Ювонен Х, и другие. Этиология детской пневмонии: серологические результаты проспективного популяционного исследования. Pediatr Infect Dis J . 1998; 17: 986–91.
12. Марголис П., Гадомский А. Рациональное клиническое обследование. У этого ребенка пневмония? ДЖАМА . 1998; 279: 308–13.
13. Политика медицинского центра детской больницы Цинциннати и программа клинической эффективности. Руководство по клинической практике, основанное на доказательствах. Внебольничная пневмония у детей в возрасте от 60 дней до 17 лет. Доступ онлайн 27 февраля 2004 г. по адресу: http://www.cincinnatichildrens.org/NR/rdonlyres/E25BBF59-5EDD-4B75-A28F-24B6F6C35016/0/PneumoniaGL.pdf.
14. Всемирная организация здравоохранения. Политика в отношении основных лекарственных средств и лекарственных средств. Препараты, применяемые при бактериальных инфекциях. Доступ онлайн 27 февраля 2004 г. по адресу: http://www.who.int/medicines/library/bacterial_model_pres/bacterial_content.shtml.
15. Руководящий комитет по руководящим принципам клинической практики провинции Альберта. Руководство по диагностике и лечению внебольничной пневмонии: педиатрия. 2002. Доступ онлайн 1 июня 2004 г., по адресу: http://www.albertadoctors.org/bcm/ama/ama-website.nsf/AllDocSearch/87256DB000705C3F87256E0500553605/$File/PNEUMONIA_PEDIATRICS.PDF.
16. Маккракен Г. Х. мл. Диагностика и лечение пневмонии у детей. Pediatr Infect Dis J . 2000;19:924–8.
17. Корппи М, Хейсканен-Косма Т, Лейнонен М, Халонен П. Анализы на антигены и антитела в этиологической диагностике респираторных инфекций у детей. Acta Pediatr .1993; 82: 137–41.
18. Корппи М., Лейнонен М. Пневмококковые иммунные комплексы в диагностике инфекций нижних дыхательных путей у детей. Pediatr Infect Dis J1998;17:992–5.
19. Принципы N, Эспозито С. Новая роль Mycoplasma pneumoniae и Chlamydia pneumoniae при инфекциях дыхательных путей у детей. Ланцет Infect Dis . 2001; 1: 334–44.
20. Ногинек Х, Валкейла Э, Лейнонен М, Эскола Дж. Скорость оседания эритроцитов, количество лейкоцитов и С-реактивный белок сыворотки в оценке этиологического диагноза острых инфекций нижних дыхательных путей у детей. Pediatr Infect Dis J . 1995; 14: 484–90.
21. Эспозито С., Босис С, Каванья Р, Фаэлли Н, Белятти Э, Маркизио П, и другие. Характеристика Streptococcus pneumoniae и атипичных бактериальных инфекций у детей 2–5 лет с внебольничной пневмонией. Клин Заражение Дис . 2002; 35:1345–52.
22. Корппи М, Кикара О, Хейсканен-Косма Т, Соймакаллио С.Сравнение рентгенологических данных и микробной этиологии детской пневмонии. Acta Pediatr . 1993; 82: 360–3.
23. Брэдли Дж.С., Нельсон Дж.Д. 2002–2003 Карманный справочник Нельсона по детской противомикробной терапии. 15-е изд. Филадельфия: Липпинкотт, Уильямс и Уилкинс; 2002: 31–5.
24. Питер Г. Пневмония. В: Бург Ф.Д., Геллис С.С., Каган Б.М. Текущая педиатрическая терапия Геллиса и Кагана. 16-е изд. Филадельфия: Сондерс; 1999: 32–5.
25.Фишер Дж. Э., Штайнер Ф, Зукол Ф, Бергер С, Мартиньон Л, Боссарт В, и другие. Использование простых эвристик для назначения макролидов детям с внебольничной пневмонией. Arch Pediatr Adolesc Med . 2002; 156:1005–8.
26. Нельсон Д.Д. Внебольничная пневмония у детей: рекомендации по лечению. Pediatr Infect Dis J . 2000;19:251–3.
27. Гибсон Н.А., Холлман А.С., Патон Ю.Ю.Значение рентгенологического наблюдения за детской пневмонией. БМЖ . 1993;307:1117.
28. Хеффельфингер Д.Д., Доуэлл С.Ф., Йоргенсен Дж. Х., Клугман КП, Мабри ЛР, Мушер ДМ, и другие. Лечение внебольничной пневмонии в эпоху устойчивости к пневмококкам: отчет Терапевтической рабочей группы по лекарственно-устойчивым стрептококкам. Arch Intern Med . 2000; 160:1399–408.
29. Маккракен Г. Х. мл. Этиология и лечение пневмонии. Pediatr Infect Dis J . 2000;19:373–7.
30. Манделл Г.Л., Дуглас Р.Г., Беннетт Дж.Е., Долин Р. Манделл, Дуглас и Принципы практики Беннета при инфекционных заболеваниях. 5-е изд. Филадельфия: Черчилль Ливингстон, 2000: 2416–7.
31. Черный S, Шайнфилд Х, пожарный Б, Льюис Э, Рэй П, Хансен Дж.Р., и другие. Эффективность, безопасность и иммуногенность семивалентной пневмококковой конъюгированной вакцины у детей.Группа Центра изучения вакцин Kaiser Permanente в Северной Калифорнии. Pediatr Infect Dis J . 2000;19:187–95.
32. Черный SB, отдел кадров Шайнфилд, Лин С, Хансен Дж, пожарный Б, Весна Д, и другие. Эффективность семивалентной пневмококковой конъюгированной вакцины у детей в возрасте до пяти лет для профилактики пневмонии. Pediatr Infect Dis J . 2002; 21:810–5.
33. Лин П.Л., Майклс М.Г., Яноски Дж, Ортензо М, Уолд Э.Р., Мейсон ЭО мл.Заболеваемость инвазивной пневмококковой инфекцией у детей в возрасте от 3 до 36 месяцев в педиатрическом центре третичного уровня через 2 года после лицензирования пневмококковой конъюгированной вакцины. Педиатрия . 2003; 1114, часть 1: 896–9.
34. Уитни К.Г., Фарли ММ, Хэдлер Дж, Харрисон Л.Х., Беннет Н.М., Линфилд Р, и другие. Снижение инвазивной пневмококковой инфекции после введения белково-полисахаридной конъюгированной вакцины. N Английский J Med . 2003; 348: 1737–46.
35. Эскола Дж., Килпи Т, Палму А, Йокинен Дж, Хаапакоски Дж, Эрва Э, и другие. Эффективность пневмококковой конъюгированной вакцины против острого среднего отита. N Английский J Med . 2001; 344: 403–9.
36. Комитет по инфекционным заболеваниям. Американская академия педиатрии. Снижение бремени гриппа у детей. Педиатрия . 2002; 110:1246–52.
37. Мосты СВ, Фукуда К, Уеки ТМ, Кокс Нью-Джерси. Синглтон Дж. А.; Центры по контролю и профилактике заболеваний, Консультативный комитет по практике иммунизации. Профилактика и борьба с гриппом.


 На данный момент слабо изучены.
На данный момент слабо изучены. д.
д.