Норма общего анализа крови во время беременности. Гемоглобин, тромбоциты, гематокрит, эритроциты и лейкоциты при беременности. Клинический анализ крови во время беременности. Гематологические изменения при беременности.
Перевод материалов сайта UpTodate.com
Нормально протекающая беременность характеризуется значительными изменениями почти во всех органах и системах для приспособления к требованиям фетоплацентарного комплекса, в том числе, во время беременности меняются показатели анализов крови.
Нормы анализа крови при беременности: краткое содержание статьи
- Значимыми гематологические изменениями в течение беременности являются физиологическая анемия, нейтрофилия, умеренная тромбоцитопения, повышение факторов свертывания крови и снижение фибринолиза.
- К 6-12 неделям беременности объем плазмы крови повышается примерно на 10-15 %. Самые быстрые темпы увеличения объема плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяется незначительно.

- Количество эритроцитов начинает увеличиваться на 8-10 неделях беременности и к концу беременности увеличивается на 20-30% (250-450 мл) относительно нормального уровня для небеременных женщин к концу беременности Значительное увеличение объема плазмы относительно увеличения количества гемоглобина и объема эритроцитов приводит к умеренному снижению уровня гемоглобина (физиологическая анемия беременных), что наблюдается у здоровых беременных.
- У беременных женщин возможно незначительное снижение количества тромбоцитов по сравнению со здоровыми небеременными женщинами.
- Количество нейтрофилов начинает расти на втором месяце беременности и стабилизируется во втором или третьем триместрах, в это время количество лейкоцитов. Абсолютное количество лимфоцитов не изменяется.
В данной статье описаны гематологические изменения, происходящие во время беременности, наиболее важными из которых являются:
- Повышение объема плазмы крови и уменьшение гематокрита
- Физиологическая анемия, низкий гемоглобин
- Повышенные лейкоциты при беременности
- Нейтрофилия
- Умеренная тромбоцитопения
- Повышение прокоагулянтных факторов
- Уменьшение фибринолиза
Анализы, упоминаемые в статье
Как сдать анализы крови и получить скидку 5%? Зайдите в интернет-магазин лабораторий ЦИР!Объем плазмы крови
К 6-12 неделям беременности объем плазмы крови повышается примерно на 10-15 %.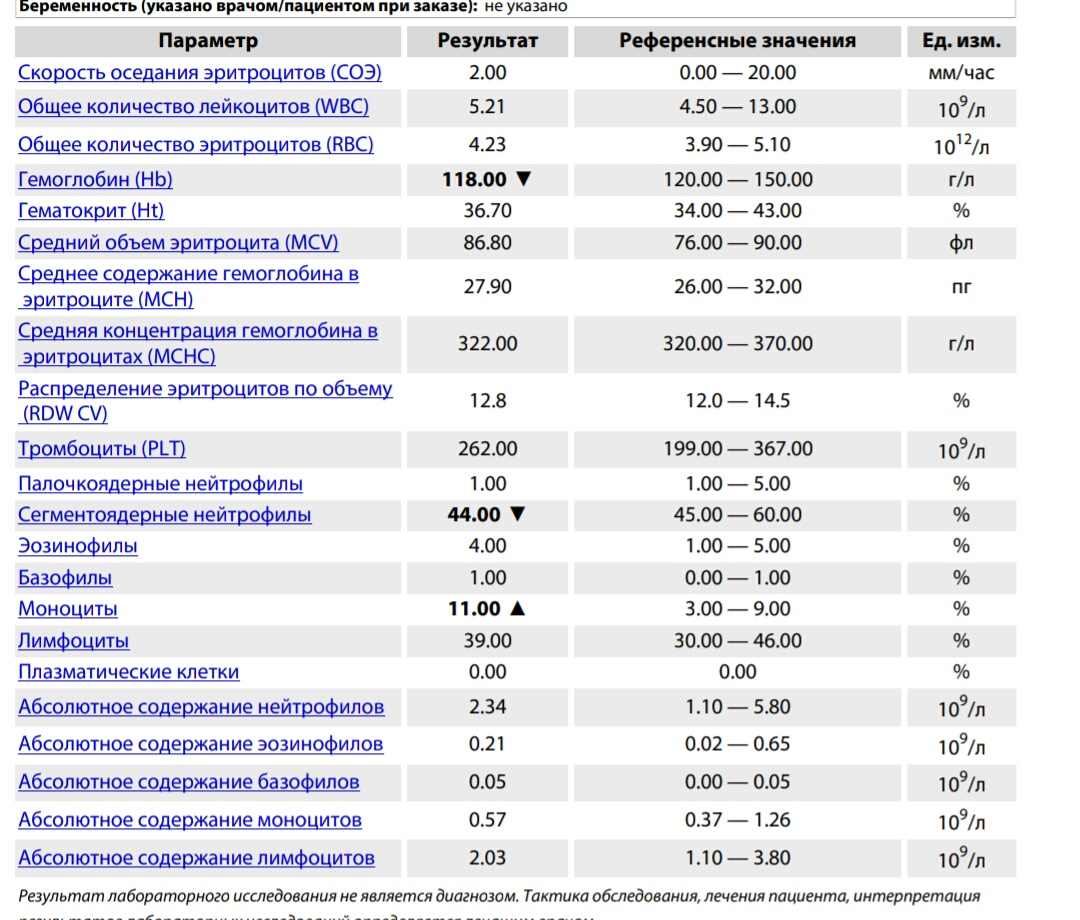 Самые быстрые темпы увеличения объема плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяется незначительно. В среднем объем плазмы крови увеличивается на 1100-1600 мл в триместр, и в результате объем плазмы за беременность увеличивается до 4700-5200 мл, что на 30 до 50% выше объема плазмы у небеременных женщин.
Самые быстрые темпы увеличения объема плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяется незначительно. В среднем объем плазмы крови увеличивается на 1100-1600 мл в триместр, и в результате объем плазмы за беременность увеличивается до 4700-5200 мл, что на 30 до 50% выше объема плазмы у небеременных женщин.
В течение беременности активность ренина плазмы крови имеет тенденцию повышаться, при этом уровень предсердного натрийуретического пептида несколько снижается. Это говорит о том, что увеличение объема плазмы вызвано недостаточностью сосудистой системы, к которой приводит системная вазодилатация (расширение сосудов во всем организме) и увеличение сосудистой емкости. Так как изначально увеличивается именно объем плазмы крови, то его воздействие на почечные и предсердные рецепторы приводит к противоположным воздействиям на гормональный фон (снижение активности ренина плазмы и увеличение натрийуретического пептида). Эта гипотеза также подтверждается наблюдением, что повышение потребления натрия не влияет на дальнейшее увеличение объема плазмы крови.
После родов объем плазмы сразу снижается, но вновь повышается через 2-5 дней, возможно из-за увеличения секреции альдостерона, происходящей в это время. Затем объем плазмы вновь постепенно снижается: через 3 недели после родов он все ещё повышен на 10-15% относительно нормального уровня для небеременных женщин, но обычно полностью приходит норме через 6 недель после родов.
Эритроциты при беременности, СОЭ при беременности
Количество эритроцитов начинает увеличиваться на 8-10 неделе беременности и к концу беременности увеличивается на 20-30% (250-450 мл) относительно нормального уровня для небеременных, в особенности у женщин, принимавших препараты железа во время беременности. Среди беременных, не принимавших препараты железа, количество эритроцитов может увеличиваться только на 15-20%. Продолжительность жизни эритроцитов немного снижается в течение нормальной беременности.
Уровень эритропоэтина при нормальной беременности повышается на 50% и его изменение зависит от наличия осложнений беременности. Повышение эритропоэтина в плазме приводит к увеличению количества эритроцитов, которые частично обеспечивают высокие метаболические требования в кислороде в течение беременности.
Повышение эритропоэтина в плазме приводит к увеличению количества эритроцитов, которые частично обеспечивают высокие метаболические требования в кислороде в течение беременности.
У женщин, не принимающих препараты железа, средний объем эритроцитов снижается во время беременности и в третьем триместре в среднем составляет 80-84 фл. Однако, у здоровых беременных и у беременных с умеренным дефицитом железа средний объем эритроцитов увеличивается примерно на 4 фл.
СОЭ при беременности увеличивается, что не имеет диагностического значения.
Анемия при беременности, гемоглобин при беременности, гематокрит при беременности, низкий гемоглобин при беременности
Снижение гемоглобина при беременности
Значительное увеличение объема плазмы относительно увеличения количества гемоглобина и объема эритроцитов приводит к умеренному снижению уровня гемоглобина (физиологическая анемия или низкий гемоглобин у беременных), что наблюдается у здоровых беременных. Самая большая разница между темпами роста объема плазмы крови и количества эритроцитов в материнском кровотоке, формируется в течение конца второго, начале третьего триместра (снижение гемоглобина обычно происходит в 28-36 недель беременности). Концентрация гемоглобина повышается благодаря прекращению увеличения объема плазмы и продолжения повышения количества гемоглобина. Наоборот, отсутствие появления физиологической анемии является фактором риска мертворождения.
Самая большая разница между темпами роста объема плазмы крови и количества эритроцитов в материнском кровотоке, формируется в течение конца второго, начале третьего триместра (снижение гемоглобина обычно происходит в 28-36 недель беременности). Концентрация гемоглобина повышается благодаря прекращению увеличения объема плазмы и продолжения повышения количества гемоглобина. Наоборот, отсутствие появления физиологической анемии является фактором риска мертворождения.
Анемия при беременности
Установление четкого определения анемии у беременных женщин достаточно сложно, т.к. оно складывается из связанных с беременностью изменений в объеме плазмы крови и количества эритроцитов, физиологическими различиями в концентрации гемоглобина между женщинами и мужчинами и частотой использования препаратов железа при беременности.
- Центр профилактики и контроля заболеваний определил анемию, как уровень гемоглобина меньше, чем 110 г/л (гематокрит меньше 33%) в первом и третьем триместрах и менее, чем 105 г/л (гематокрит менее 32%) во втором триместре.

- ВОЗ определила анемию у беременных, как снижение гемоглобина меньше 110 г/л (11 г/дл) или гематокрит меньше 6,83 ммоль/л или 33%. Тяжелая анемия беременных определяется уровнем гемоглобина меньше 70 г/л и нуждается в медицинском лечении. Очень тяжелая анемия определяется уровнем гемоглобина меньше 40 г/л и нуждается в неотложной медицинской помощи в связи с риском застойной сердечной недостаточности.
Женщины со значением гемоглобина ниже этих уровней считаются анемичными и должны подвергаться стандартным анализам (общий анализ крови с оценкой мазка периферической крови, подсчет ретикулоцитов, сывороточное железо, ферритин, трансферрин). Если при обследовании отклонений не выявлено, то гемоглобин, сниженный до уровня 100 г/л можно считать физиологической анемией с большим разнообразием факторов, влияющих на нормальный уровень гемоглобина у конкретного человека.
Хроническая тяжелая анемия наиболее распространена у женщин в развивающихся странах.
Тяжелая хроническая анемия обычно связана с недостаточным запасом железа (из-за недостаточного потребления с пищей или кишечных глистных инвазий), дефицитом фолатов (из-за недостаточного потребления и хронических гемолитических состояний, таких как малярия). Таким образом, предупреждение хронической анемии и улучшение исход беременности возможно при применении пищевых добавок и использовании мер контроля за инфекциями.
Проведение переливания крови и эритроцитарной массы (в тех местах, где доступно безопасное переливание крови) является разумным агрессивным лечением тяжелой формы анемии, особенно если есть признаки гипоксии плода.
Признаки физиологической анемии беременных исчезают через 6 недель после родов, когда объем плазмы возвращается к норме.
Потребность в железе
При одноплодной беременности потребность в железе составляет 1000 мг за беременность: примерно 300 мг для плода и плаценты и, примерно, 500 мг, если таковые имеются, для увеличения количества гемоглобина. 200 мг теряется через кишечник, мочу и кожу. Так как у большинства женщин нет адекватного запаса железа для обеспечения потребностей во время беременности, то железо обычно назначают в составе мультивитаминов, или как отдельный элемент. В целом, у женщин, принимающих препараты железа, концентрация гемоглобина выше на 1 г/дл, чем у женщин, не принимающих железо.
Потребность в фолатах
Ежедневная потребность в фолатах для небеременных женщин составляет 50-100 мкг. Повышение количества эритроцитов во время беременности приводит к увеличению потребностей в фолиевой кислоте, что обеспечивается увеличением дозы фолиевой кислоты до 400-800 мкг в сутки, для предотвращения дефектов нервной трубки у плода.
Тромбоциты при беременности
В большинстве случаев, количество тромбоцитов во время неосложненной беременности остается в пределах нормы для небеременных женщин, но так же у беременных женщин возможно и снижение количества тромбоцитов по сравнению со здоровыми небеременными женщинами. Количество тромбоцитов начинает расти сразу после родов и продолжает увеличиваться в течение 3-4 недель, пока не вернется к нормальным значениям.
Тромбоцитопения при беременности
Наиболее важное в акушерстве изменение в физиологии тромбоцитов при беременности — это тромбоцитопения, которая может быть связана с осложнениями беременности (тяжелая преэклампсия, HELLP-синдром), медикаментозными расстройствами (иммунная тромбоцитопения) либо может являться гестационной тромбоцитопенией.
Гестационная или случайная тромбоцитопения протекает бессимптомно в третьем триместре беременности у пациенток без предшествующей тромбоцитопении. Она не ассоциирована с материнскими, плодными или неонатальными осложнениями и спонтанно разрешается после родов. 9/л. Количество лейкоцитов снижается до референсного интервала для небеременных женщин к шестому дню после родов.
9/л. Количество лейкоцитов снижается до референсного интервала для небеременных женщин к шестому дню после родов.
В периферической крови у беременных женщин может быть небольшое количество миелоцитов и метамиелоцитов. По данным некоторых исследований наблюдается увеличение количества юных форм нейтрофилов во время беременности. Тельца Доли (голубое окрашивание цитоплазматических включений в гранулоцитах) считаются нормой у беременных женщин.
У здоровых женщин при неосложненной беременности не происходит изменений абсолютного количества лимфоцитов и нет значительных изменений в относительном количестве Т- и В-лимфоцитов. Число моноцитов обычно не изменяется, число базофилов может немного снижаться, а число эозинофилов может несколько повышаться.
Факторы свертывания крови и ингибиторы
При нормальной беременности происходят следующие изменения уровней факторов свертывания крови, приводящие к физиологической гиперкоагуляции:
- Из-за гормональных изменений при беременности снижается активность общего протеин S антигена, свободного протеин S антигена и протеина S.

- Устойчивость к активированному протеину С повышается во втором и третьем триместрах. Данные изменения были выявлены при проведении тестов первого поколения с использованием чистой плазмы крови (т.е. не лишенной фактора V), однако этот тест редко применяется клинически и имеет лишь исторический интерес.
- Фибриноген и факторы II, VII, VIII, X, XII и XIII повышаются на 20-200%.
- Повышается фактор фон Виллебранда.
- Повышается активность ингибиторов фибринолиза, TAF1, PAI-1 и PAI-2. Так же заметно повышается уровень PAI-1.
- Уровни антитромбина III, протеина С, фактора V и фактора IX чаще всего остаются без изменений или повышаются незначительно.
Конечный результат данных изменений — повышение тенденции к тромбообразованию, увеличение вероятности венозных тромбозов в течение беременности и, особенно, в послеродовый период. Наряду с сокращением миометрия и повышением уровня децидуального тканевого фактора, гиперкоагуляция защищает беременную от чрезмерного кровотечения во время родов и отделения плаценты.
АЧТВ остается в норме в течение беременности, но может немного снижаться. Протромбиновое время может укорачиваться. Время кровотечения не изменяется.
Сроки нормализации активности свертывания крови в послеродовый период могут варьировать в зависимости от факторов, но все должно вернуться в нормальные рамки через 6-8 недель после родов. Гемостазиограмму не нужно оценивать ранее, чем через 3 месяца после родов и после завершения лактации для исключения влияния факторов беременности.
Влияние факторов приобретенной либо наследственной тромбофилии на беременность является сферой для исследований.
Послеродовый период
Гематологические изменения, связанные с беременностью, возвращаются в нормальные рамки через 6-8 недель после родов. Скорость и характер нормализации изменений, связанных с беременностью, конкретных гематологических показателей описаны выше в разделе, посвященном каждому параметру.
Гематологические осложнения при беременности
- Железодефицитная анемия.

- Тромбоцитопения.
- Неонатальная аллоиммунная тромбоцитопения.
- Приобретенная гемофилия А.
- Венозные тромбозы.
- Резус- и не резус-аллоиммунизация. Для диагностики проводится анализ на резус-антитела и антигрупповые антитела.
- Проявление ранее нераспознанного нарушения свертывающей системы, такое как болезнь фон Виллебранда, наиболее часто манифестирует у женщин в период беременности и родов. Для скрининга болезни фон Виллебранда сдается анализ для оценки агрегации тромбоцитов с ристоцетином.
- Апластическая анемия.
Моноциты и СОЭ при беременности — Вопрос гематологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.
Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 74 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского онколога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, липидолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, подолога, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.34% вопросов.
Оставайтесь с нами и будьте здоровы!
Беременность — III триместр
Комплексный тест, включающий группу лабораторных исследований для определения общего состояния здоровья, функционирования основных систем и органов беременной женщины в третьем триместре беременности.
Синонимы русские
Беременность, III триместр.
Синонимы английские
Pregnancy third (III) trimester.
Какой биоматериал можно использовать для исследования?
Венозную кровь, среднюю порцию утренней мочи.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Исключить из рациона жирную пищу в течение 24 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Исключить (по согласованию с врачом) прием мочегонных препаратов в течение 48 часов до сбора мочи.

- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
- Сбор мочи рекомендуется производить до менструации или через 2-3 дня после её окончания.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Исследование на наличие ВИЧ-инфекции может проводиться анонимно и конфиденциально. При конфиденциальном обследовании в обязательном порядке необходимо предъявление паспорта.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Третий (III) триместр беременности включает в себя период между 27 (28) и 38 (40) неделями беременности. В этот период происходит активный рост плода, совершенствование систем органов, в частности дыхательной системы, развитие органов чувств, созревание нервной системы. Клиническая лабораторная диагностика направлена на оценку функционирования основных органов и систем, в частности почек, печени, свертывающей системы крови, эндокринной системы беременной женщины, а также на контроль инфицирования во время беременности.
Клинический анализ крови позволяет оценить качественный и количественный состав крови по основным показателям: эритроциты, лейкоциты и их разновидности в абсолютном и процентном соотношении, тромбоциты. Выявление отклонений в данных показателях может свидетельствовать о наличии патологических процессов и заболеваний у беременной женщины. Сниженное количество эритроцитов, содержание гемоглобина в эритроцитах может свидетельствовать о наличии анемии беременных. Данное состояние может привести к плацентарной недостаточности — основной причине невынашивания, рождения маловесных детей и гибели плода. Изменения в лейкоцитарной формуле могут свидетельствовать о большом спектре изменений в организме беременной. Это могут быть лабораторные признаки воспалительных и инфекционных заболеваний, патологий, имеющихся у женщины, но не диагностированные ранее. Количество тромбоцитов при беременности может быть ниже нормы, что необходимо принимать во внимание. Значительные изменения в данных показателях, развивающаяся тромбоцитопения требуют особого наблюдения, так как могут являться косвенными признаками патологий свертывающей системы крови, а также такого тяжелого осложнения беременности, как ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания). Изменение СОЭ может отмечаться при наличии острых и хронических воспалительных заболеваний, при инфекционных процессах. Незначительное увеличение СОЭ может наблюдаться при беременности. Данный тест обладает высокой чувствительностью, но низкой специфичностью и назначается в комплексе с другими показателями.
Изменение СОЭ может отмечаться при наличии острых и хронических воспалительных заболеваний, при инфекционных процессах. Незначительное увеличение СОЭ может наблюдаться при беременности. Данный тест обладает высокой чувствительностью, но низкой специфичностью и назначается в комплексе с другими показателями.
Общий анализ мочи с микроскопией мочевого осадка представляет собой совокупность диагностических тестов, позволяющих оценить общие свойства мочи, её физико-химические свойства, содержание продуктов обмена веществ, выявить качественное и количественное содержание ряда органических соединений. Данные тесты отображают функциональное состояние почек, мочевыводящих путей, позволяют судить об общих метаболических процессах, предположить наличие возможных нарушений, инфекционных и воспалительных процессов. Обнаружение глюкозы и кетоновых тел в моче может свидетельствовать о развитии нарушения толерантности к углеводам, сахарного диабета, диабета беременных. Обнаружение белка в моче может быть признаком развивающейся нефропатии беременных, протеинурия более 0,3 г в суточной моче может свидетельствовать о развитии тяжелого осложнения беременности – преэклампсии. Тяжесть данного состояния значительно варьируется. Так, при развитии легкой преэклампсии после 36 недели прогноз обычно благоприятный. Напротив, угроза здоровью матери или плода серьезно возрастает, если преэклампсия развивается рано (до 33 недели) и усугубляется при наличии сопутствующих заболеваний.
Тяжесть данного состояния значительно варьируется. Так, при развитии легкой преэклампсии после 36 недели прогноз обычно благоприятный. Напротив, угроза здоровью матери или плода серьезно возрастает, если преэклампсия развивается рано (до 33 недели) и усугубляется при наличии сопутствующих заболеваний.
В III триместре беременности также необходимо контролировать функциональное состояние системы свертывания крови и фибринолиза. Для оценки внешнего пути свертывания крови используется тест на протромбиновое время. В качестве результатов получают следующие показатели: протромбиновое время по Квику и международное нормализованное отношение. Активированное частичное тромбопластиновое время (АЧТВ) характеризует внутренний путь свертывания крови. Фибриноген является фактор I (первым) фактором свертывающей системы плазмы крови. Данные показатели позволяют оценить функциональное состояние печени, основные пути свертывающей системы крови, оценить функциональное состояние её компонентов. Их определение важно для прогнозирования тромбозов во время беременности, диагностики такого осложнения, как ДВС-синдром, планового назначения необходимой терапии во время родов — процесса, сопровождающегося массивной кровопотерей. Следует отметить, что отмечается физиологичное повышение уровней протромбина и фибриногена в III триместре беременности. Но резкое повышение данных показателей требует особого наблюдения и назначения необходимой терапии. Уровень D-димера также нарастает при физиологичном течении беременности, особенно на сроках 35-40 недель, но резкое повышение концентрации D-димера может указывать на большое количество тромбов в кровяном русле, что чаще всего обусловлено венозной тромбоэмболией или ДВС-синдромом.
Следует отметить, что отмечается физиологичное повышение уровней протромбина и фибриногена в III триместре беременности. Но резкое повышение данных показателей требует особого наблюдения и назначения необходимой терапии. Уровень D-димера также нарастает при физиологичном течении беременности, особенно на сроках 35-40 недель, но резкое повышение концентрации D-димера может указывать на большое количество тромбов в кровяном русле, что чаще всего обусловлено венозной тромбоэмболией или ДВС-синдромом.
Определение таких биохимических показателей, как аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), билирубин общий и фракция прямого билирубина, белок общий в сыворотке, позволяет оценить функциональное состояние печени. Уровни АЛТ может быть немного повышен, в то время как уровень АСТ снижен. Значительное повышение концентрации трансаминаз может говорить о наличии поражения печени, гепатита, развитии преэклампсии. Снижение уровня общего белка в сыворотке крови наряду с потерей белка с мочой и при повышении АД более 140/90 мм рт.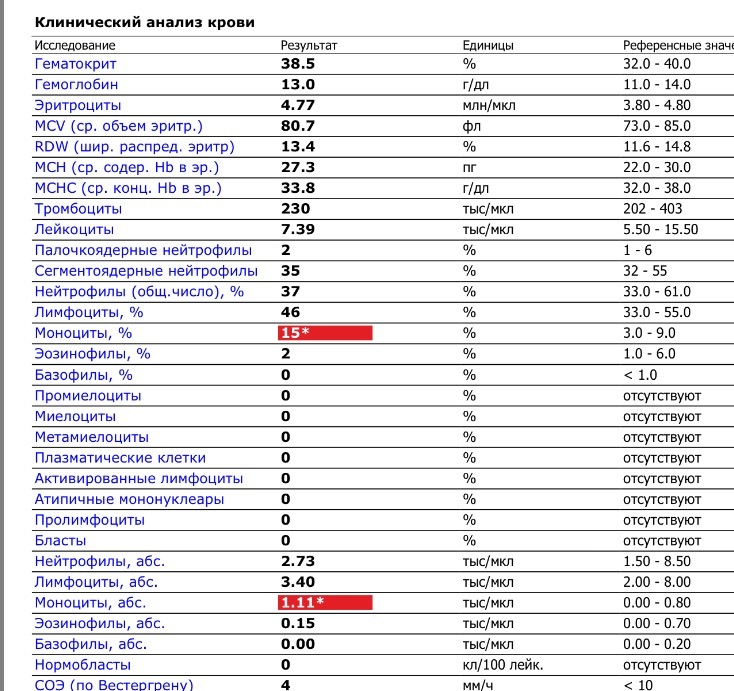 ст. также является признаком развивающейся преэклампсии.
ст. также является признаком развивающейся преэклампсии.
Для исключения развития диабета беременных (гестационного диабета), развития осложнений, в частности диабетической нефропатии, необходимо определять уровень глюкозы в плазме крови.
Для оценки функционального состояния почек, в частности сохранности процессов клубочковой фильтрации, используется несколько диагностических параметров. Наиболее важными и характерными является определение уровней мочевины и креатинина в сыворотке крови, а также оценка скорости клубочковой фильтрации. Важно, что содержание креатинина снижено у беременных женщин почти наполовину из-за увеличения объема крови, повышающегося кровотока в почках и, соответственно, возрастающей степени фильтрации. Также увеличение почечной фильтрации вызывает снижение количества мочевины у беременных женщин.
Как правило, беременность протекает при нормальных уровнях тиреотропного гормона (ТТГ) в крови. Такое эутиреоидное состояние поддерживается всеми компонентами тиреоидной системы и плацентарными гормонами, в частности хорионическим гонадотропином человека и хорионическим тиреотропином. Система тиреоидных гормонов матери и плода независимы друг от друга и слабо проникают через зрелую плаценту. Уровень ТТГ крови беременных может повышаться при развитии преэклампсии.
Система тиреоидных гормонов матери и плода независимы друг от друга и слабо проникают через зрелую плаценту. Уровень ТТГ крови беременных может повышаться при развитии преэклампсии.
В III триместре беременности также рекомендуется повторно провести обследование на гепатит В — HBsAg, гепатит С — anti-HCV, антитела, ВИЧ-инфекцию — HIV 1,2 Ag/AbCombo (определение антител к ВИЧ типов 1 и 2 и антигена p24), сифилис — антитела к Treponema pallidum. Инкубационный период некоторых инфекций сильно варьируется и отрицательный результат анализов, проведенных в начале беременности, может измениться на последних неделях беременности или также остаться отрицательным. Это необходимо для предотвращения заражения плода при родах, назначения необходимого лечения или планового проведения кесарева сечения.
Для чего используется исследование?
- Для профилактического осмотра беременных в III триместре беременности.
- При подозрении на отклонения нормального функционирования систем и органов беременных.

- Для диагностики осложнений III триместра беременности.
Когда назначается исследование?
- Беременным женщинам в третьем триместре на сроке 27-38 (40) недель беременности.
Что означают результаты?
Референсные значения
Для каждого показателя, входящего в состав комплекса:
Что может влиять на результат?
- Применение лекарственных препаратов, в частности гормональных.
«Внутрисосудистое свертывание крови при COVID-19 определяет весь ход болезни»
Беседа с академиком А.Д. Макацария, крупнейшим специалистом в области клинической гемостазиологии
Сегодня известно, что при COVID-19, в первую очередь, страдает свертывающая система крови. Вот почему у всех умерших от осложнений новой коронавирусной инфекции находят большое количество тромбов. Как это объяснить? Почему это заметили не сразу? Каким образом и почему это происходит? Можно ли предотвратить развитие такого осложнения? Об этом – наш разговор с А.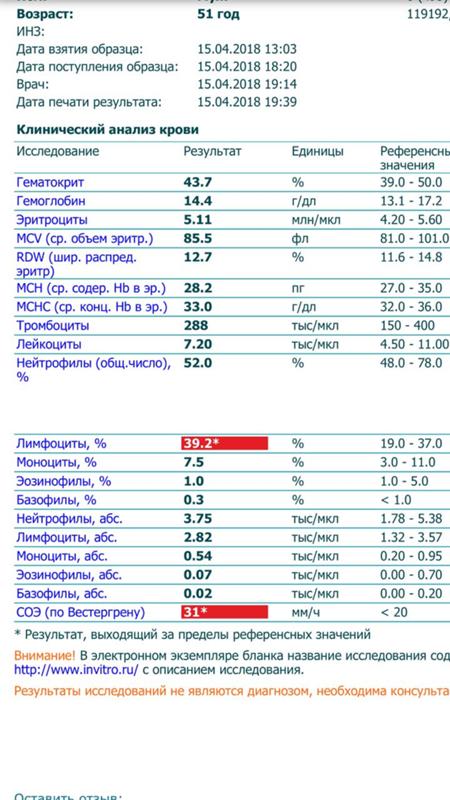 Д. Макацария, академиком РАН, одним из крупнейших в мире специалистов по изучению нарушений свертываемости крови, создателем Школы клинической гемостазиологии, заведующим кафедрой Сеченовского университета. Александр Давидович и его ученики активно сотрудничают с университетом Сорбонны, Венским, Римским, Миланским и Тель-Авивским университетами, Технион в Хайфе. Под его руководителем защищено 150 кандидатских и докторских диссертаций. Автор более 1200 научных трудов, в том числе 40 монографий.
Д. Макацария, академиком РАН, одним из крупнейших в мире специалистов по изучению нарушений свертываемости крови, создателем Школы клинической гемостазиологии, заведующим кафедрой Сеченовского университета. Александр Давидович и его ученики активно сотрудничают с университетом Сорбонны, Венским, Римским, Миланским и Тель-Авивским университетами, Технион в Хайфе. Под его руководителем защищено 150 кандидатских и докторских диссертаций. Автор более 1200 научных трудов, в том числе 40 монографий.
– Александр Давидович, в последнее время во всем мире появляется всё больше сообщений о том, что при COVID-19 страдает свертывающая система крови. Так ли это, и если да, то чем вы объясняете этот феномен?
– Безусловно, это так. Более того, хочу сказать, что практически нет такой инфекции (вирусной или, тем более, бактериальной), которая бы не влияла на свертывание крови. Доказательство тому – учение о сепсисе и септическом шоке как универсальной модели ДВС-синдрома – синдрома диссеминированного внутрисосудистого свертывания крови.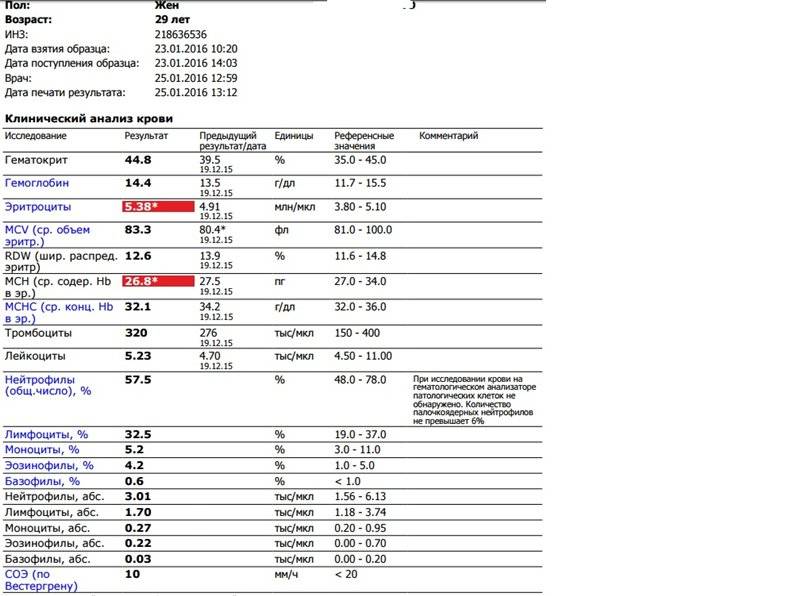 Степень тяжести тромботических нарушений зависит от особенностей возбудителя и организма-хозяина (иммунная система, система гемостаза, наличие сопутствующих заболеваний и т.д.).
Степень тяжести тромботических нарушений зависит от особенностей возбудителя и организма-хозяина (иммунная система, система гемостаза, наличие сопутствующих заболеваний и т.д.).
– Но ведь не у всех пациентов развивается сепсис и септический шок?
– Конечно, не у всех. Поэтому очень актуальным и далеко не изученным в настоящее время является механизм патогенеза осложнений, вызванных коронавирусной инфекцией. Во многом это обусловлено особенностями вируса, а также особенностями организма человека, начиная от количества и качества рецепторов, представленных у человека и их способностью связываться с этим вирусом. Безусловно, на исходы заболевания огромное влияние оказывает коморбидность, то есть наличие сопутствующих хронических заболеваний у пациента.
– Почему, по вашему мнению, эта особенность течения болезни проявилась не сразу?
— Я считаю, что все это проявилось сразу, но не было адекватно оценено врачами изначально: еще не было такого количества вскрытий и широкого тестирования на гемостазиологические маркеры.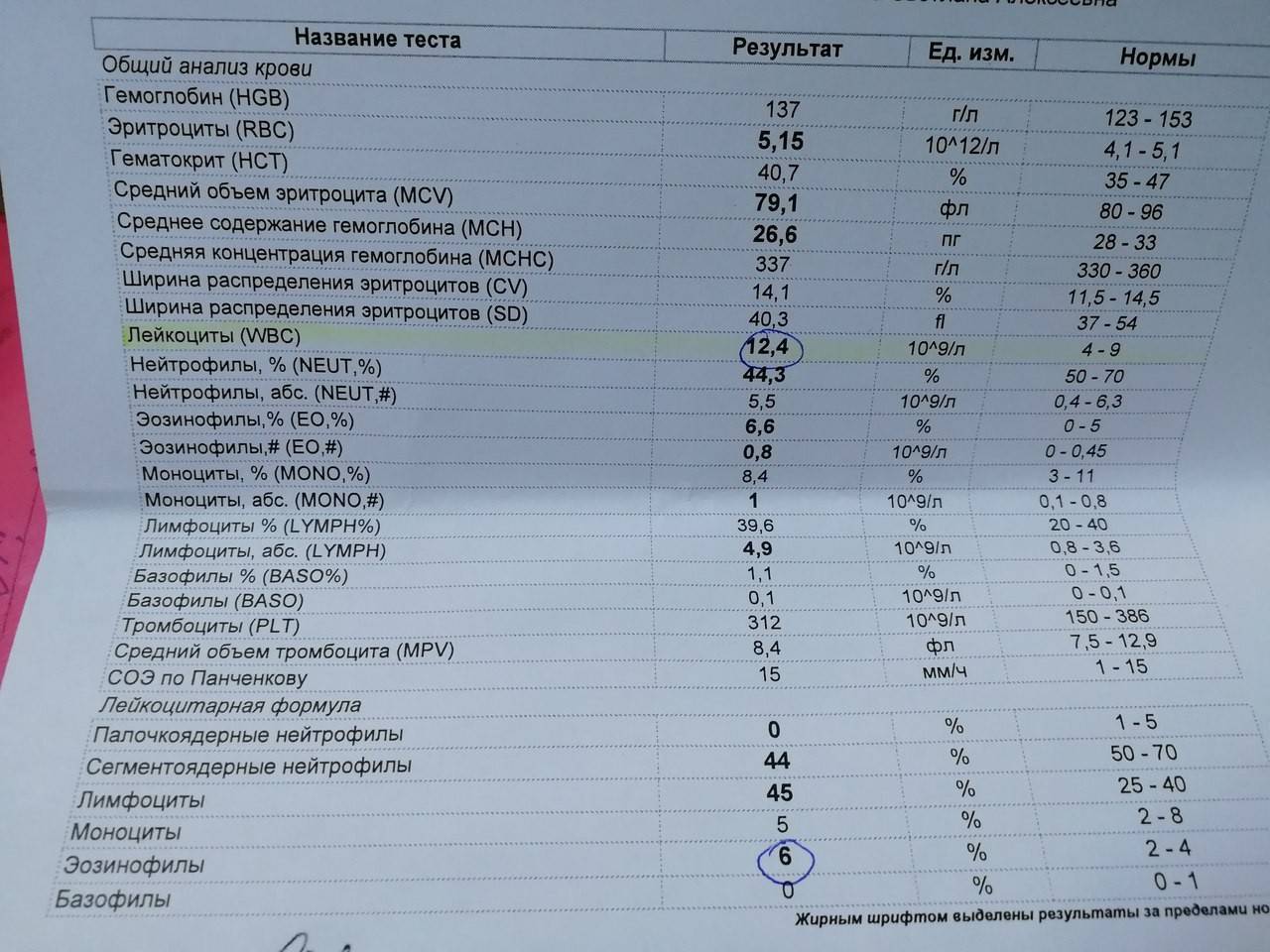 Надо сказать, мы занимаемся изучением этой проблемы довольно давно, практически с самого начала эпидемии. Еще в самом начале апреля мы опубликовали работу, основанную на первых наблюдениях наших китайских коллег. Работа называлась «COVID-19 и синдром диссеминированного внутрисосудистого свертывания крови». Она имела чрезвычайно широкий резонанс, поскольку уже тогда врачи начали понимать роль свертывающей системы крови в инфекционном процессе.
Надо сказать, мы занимаемся изучением этой проблемы довольно давно, практически с самого начала эпидемии. Еще в самом начале апреля мы опубликовали работу, основанную на первых наблюдениях наших китайских коллег. Работа называлась «COVID-19 и синдром диссеминированного внутрисосудистого свертывания крови». Она имела чрезвычайно широкий резонанс, поскольку уже тогда врачи начали понимать роль свертывающей системы крови в инфекционном процессе.
– Каков механизм тромбообразования при covid-19 и отличается ли он от этого процесса при других патологиях?
– Это очень непростой вопрос. На сегодняшний день однозначно можно утверждать – при этом вирусе с самого начала имеет место активация гемостаза, внутрисосудистое свертывание крови и тромбообразование в сосудах мелкого калибра жизненно важных органов. При этом повреждаются не только легкие, а блокада микроциркуляции и ее необратимый характер определяют исход заболевания. Позднее начало антикоагулянтной терапии является неблагоприятным фактором. Причем этот процесс внутрисосудистого свертывания в капиллярах легкого играет важную роль в развитии острого респираторного дистресс-синдрома (ОРДС), о котором все говорят. Но далеко не все с самого начала уловили связь между внутрисосудистым свертыванием крови и ОРДС.
Причем этот процесс внутрисосудистого свертывания в капиллярах легкого играет важную роль в развитии острого респираторного дистресс-синдрома (ОРДС), о котором все говорят. Но далеко не все с самого начала уловили связь между внутрисосудистым свертыванием крови и ОРДС.
В западной литературе даже появился термин «легочная интраваскулярная коагуляция». Практически во всех случаях имеет место активация системного воспалительного ответа. Это общебиологическая реакция, которая особенно проявляется в ответ на инфекцию, вирусные возбудители. Международные организации признали, что коронавирусная инфекция – это сепсис.
С другой стороны, международная организация по тромбозу и гемостазу в абсолютном числе случаев признала наличие ДВС-синдрома у тяжелых больных с COVID-19 . Сочетание сепсиса и коагулопатии – это септический шок. Еще китайские коллеги указывали, что в 92% случаев больные умирают от септического шока. Конечно, нельзя отрицать, что наряду с вирусом причиной септического шока может быть присоединение вторичной бактериальной инфекции. У больных COVID-19 и нарушениями в системе гемостаза, как правило, имеет место гиперферритинемия, которая возникает при критических состояниях как реактант острой фазы воспаления и характеризуется цитокиновым штормом вследствие гиперактивации макрофагов и моноцитов. Вследствие этого вырабатывается большое количество ферритина – сложного белкового комплекса, выполняющего роль основного внутриклеточного депо железа у человека и животных. В данном случае это всегда белок острой фазы, маркер тяжелого воспаления, а вовсе не показатель перегрузки железом, как можно подумать на первый взгляд.
У больных COVID-19 и нарушениями в системе гемостаза, как правило, имеет место гиперферритинемия, которая возникает при критических состояниях как реактант острой фазы воспаления и характеризуется цитокиновым штормом вследствие гиперактивации макрофагов и моноцитов. Вследствие этого вырабатывается большое количество ферритина – сложного белкового комплекса, выполняющего роль основного внутриклеточного депо железа у человека и животных. В данном случае это всегда белок острой фазы, маркер тяжелого воспаления, а вовсе не показатель перегрузки железом, как можно подумать на первый взгляд.
Таким образом, цитокиновый и тромботический шторм усугубляют состояние больного и определяют степень тяжести. Но есть и особенности. Возможно, при COVID-19 в первую очередь повреждается фибринолиз – часть системы гемостаза, которая обеспечивает процесс разрушения уже сформированных кровяных сгустков, тем самым, выполняя защитную функцию предотвращения закупорки кровеносных сосудов фибриновыми сгустками. Отсюда синдром фибринирования при меньшей частоте геморрагических осложнений. И отсюда же открывается перспектива применения тромболитиков, о чем сейчас так много говорят и пишут. А впервые предложили такую схему наши американские коллеги.
Отсюда синдром фибринирования при меньшей частоте геморрагических осложнений. И отсюда же открывается перспектива применения тромболитиков, о чем сейчас так много говорят и пишут. А впервые предложили такую схему наши американские коллеги.
– А ведь есть немало людей с нарушениями свертываемости крови. Сейчас, во время эпидемии, для них настали трудные времена.
– Это так. В нашей популяции есть люди не только с явными, но и со скрытыми нарушениями гемостаза, предрасполагающими к тромбозам – генетические тромбофилии, антифосфолипидный синдром и ряд других заболеваний, сопровождающихся избыточной активацией системы гемостаза; а также люди с высокой готовностью к супервоспалительному ответу (врожденные факторы и ряд ревматологических и иммунных заболеваний). Им сейчас важно контролировать своё состояние, а врачам не забывать об этом.
И, наконец, COVID-19 – это тромбовоспаление. Это, по сути, вирус-опосредованная модель NET-оза, которая характеризует тесную взаимосвязь таких биологических процессов, как воспаление и тромбообразование.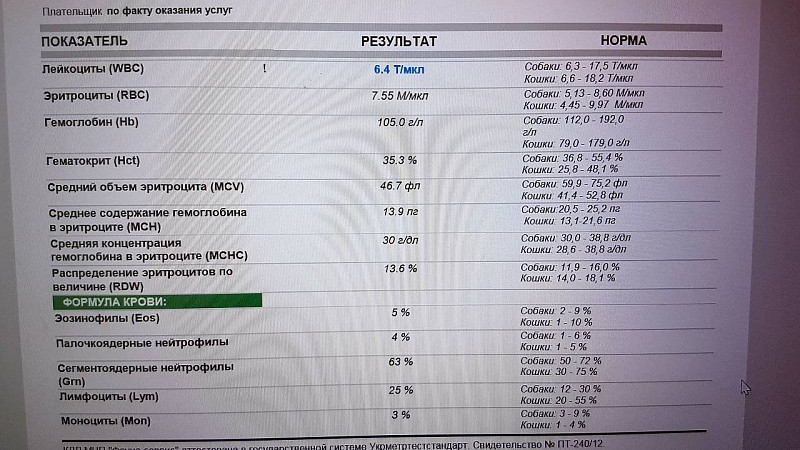 Нейтрофилы и выделяемые ими внеклеточные ловушки нейтрофилов (NET) играют огромную роль в развитии так называемых иммунотромбозов. Это одно из приоритетных научных направлений сегодня , которое мы сейчас вместе с учениками и в том числе зарубежными коллегами также разрабатываем.
Нейтрофилы и выделяемые ими внеклеточные ловушки нейтрофилов (NET) играют огромную роль в развитии так называемых иммунотромбозов. Это одно из приоритетных научных направлений сегодня , которое мы сейчас вместе с учениками и в том числе зарубежными коллегами также разрабатываем.
Вообще надо сказать, что открытие NET расширило горизонты в понимании биологии нейтрофилов и роли этих клеток в организме. Использование организмом хозяина хроматина в сочетании с внутриклеточными белками в качестве естественного противомикробного агента имеет древнюю историю и меняет наше представление о хроматине как только о носителе генетической информации. Благодаря избыточному и неконтролируемому формированию NET, нейтрофилы могут способствовать развитию патологического венозного и артериального тромбоза, или «иммунотромбоза», а также играют важную роль в процессах атеротромбоза и атеросклероза. Высвобождение NET является, как выяснилось, одной из причин тромбообразования при таких состояниях, как сепсис и рак. Наличие NET при этих заболеваниях и состояниях дает возможность использовать их или отдельные компоненты в качестве потенциальных биомаркеров. NET и их компоненты могут быть привлекательны в качестве терапевтических мишеней. Дальнейшие исследования нейтрофилов и NET необходимы для разработки новых подходов к диагностике и лечению воспалительных и тромботических состояний.
Наличие NET при этих заболеваниях и состояниях дает возможность использовать их или отдельные компоненты в качестве потенциальных биомаркеров. NET и их компоненты могут быть привлекательны в качестве терапевтических мишеней. Дальнейшие исследования нейтрофилов и NET необходимы для разработки новых подходов к диагностике и лечению воспалительных и тромботических состояний.
– Размышляя о высокой летальности у пациентов, которым пришлось применить ИВЛ, вы констатируете, что мы, возможно, пошли не тем путем. А какой путь может оказаться более верным?
– Да, я имел в виду, что при оценке вентиляционно-перфузионных нарушений при COVID-19 превалируют перфузионные нарушения, нарушения микроциркуляции, а это значит, что главная терапевтическая мишень – восстановление нормальной перфузии тканей, то есть противотромботическая терапия, а возможно, даже и фибринолитическая. Механическая вентиляция не может решить вопрос перфузионных нарушений.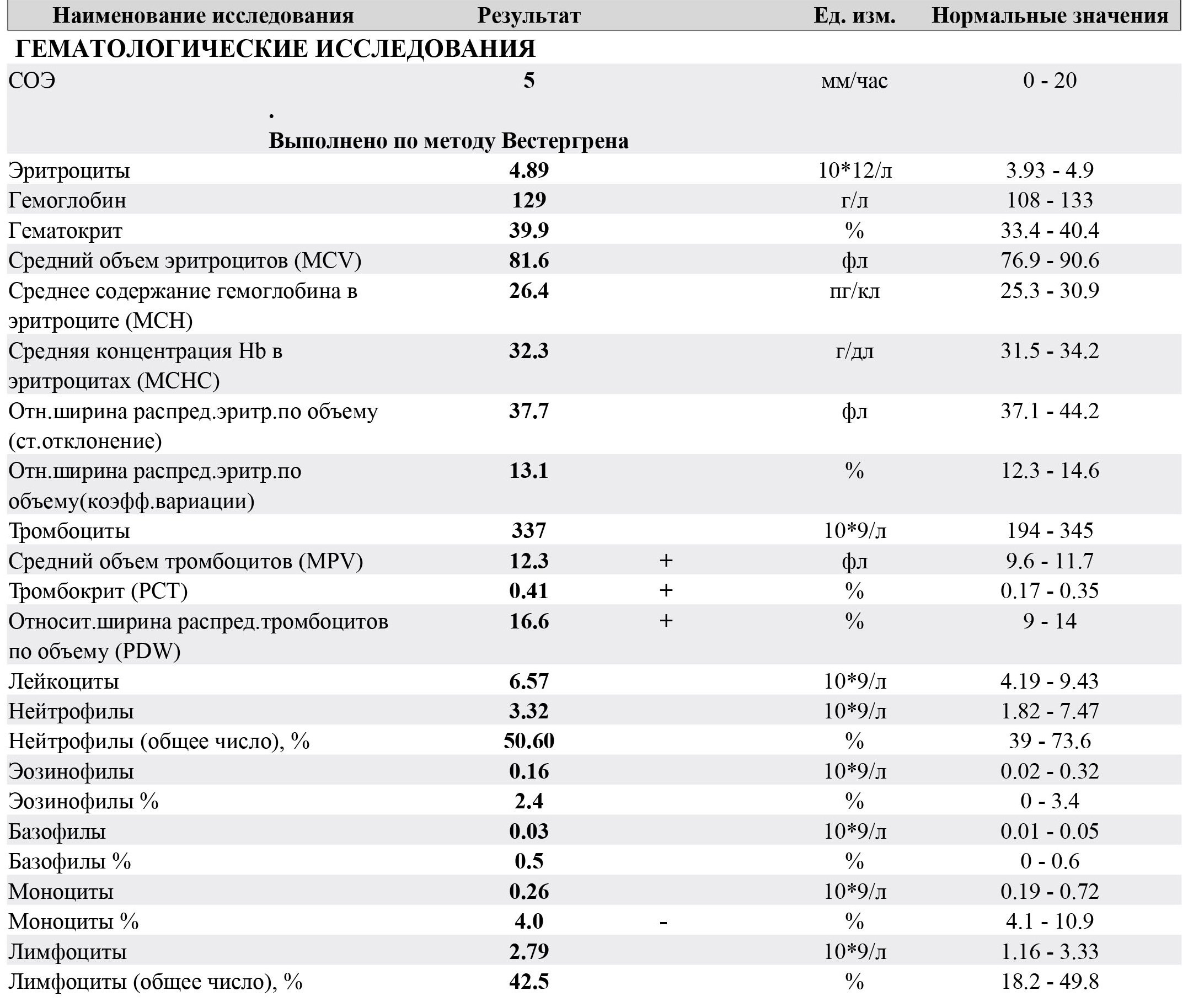
– Видите ли вы, что в связи с эпидемией стали более частыми проблемы тромбообразования в акушерско-гинекологической практике?
– Случилось так, что во многом и благодаря нашим стараниям (лекциям и публикациям), большинство акушеров сегодня осведомлены о том, что беременность – это состояние так называемой физиологической гиперкоагуляции, и этим пациенткам нередко назначаются антикоагулянты во время беременности. Тем не менее, требуются дальнейшие исследования для вынесения суждения о частоте тромбозов у беременных с COVID-19.
Вообще надо сказать, что большинство осложнений беременности либо обусловлены, либо сочетаются с высоким тромбогенным потенциалом. Генетические факторы свертывания крови, особенно антифосфолипидный синдром, являются факторами риска огромного количества осложнений беременности – это и внутриутробные гибели плода, и неудачи ЭКО, и задержка внутриутробного развития плода, и преждевременная отслойка плаценты, что приводит к тяжелым тромбогеморрагическим осложнениям, это, наконец, тромбозы и тромбоэмболии.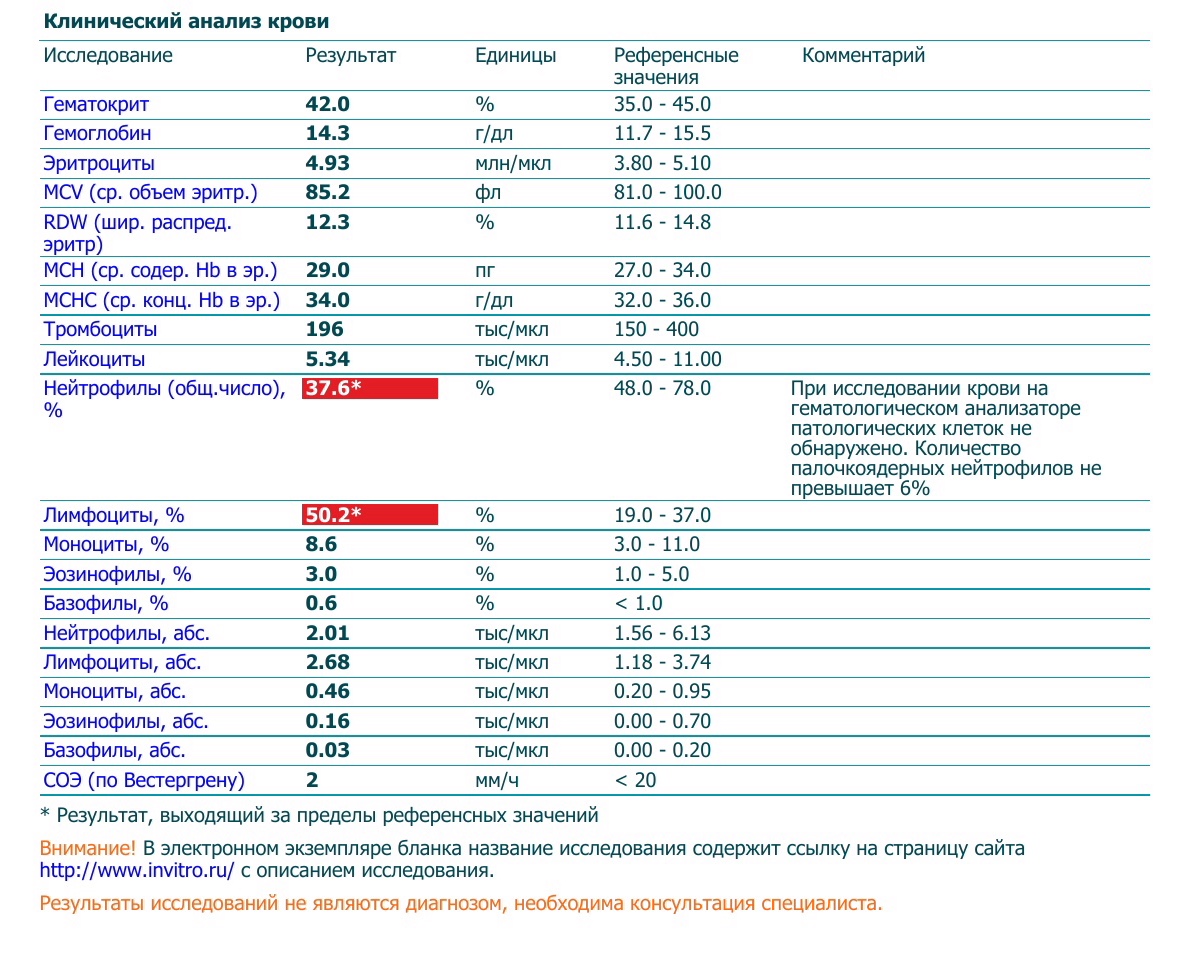 Поэтому, конечно, можно ожидать, что в условиях COVID-19 эти осложнения могут представлять собой еще большую опасность. Ведь вирус может быть фактором, активирующим факторы свертываемости крови. Конечно, тут нужны обобщающие исследования, но уже сейчас наши отдельные наблюдения говорят о том, что риск таких осложнений возрастает.
Поэтому, конечно, можно ожидать, что в условиях COVID-19 эти осложнения могут представлять собой еще большую опасность. Ведь вирус может быть фактором, активирующим факторы свертываемости крови. Конечно, тут нужны обобщающие исследования, но уже сейчас наши отдельные наблюдения говорят о том, что риск таких осложнений возрастает.
– Являются ли, на ваш взгляд, одним из проявлений этой проблемы случаи тяжелого течения covid-19 в педиатрии (состояния, похожие на синдром Кавасаки)?
–
Глава ВОЗ Тедрос Аданом Гебрейесус призвал врачей всех стран обратить особое внимание на сообщения о том, что у некоторых детей, заразившихся коронавирусом, проявляются симптомы, схожие с еще одним заболеванием — синдромом Кавасаки (мультисистемным воспалительным синдромом). Действительно, в сообщениях из Европы и Северной Америки говорилось, что некоторое число детей поступало в отделения интенсивной терапии с мультисистемным воспалительным состоянием, с некоторыми симптомами, похожими на синдром Кавасаки и синдром токсического шока.
Синдром Кавасаки был впервые описан в 1967 году японским педиатром по имени Томисаку Кавасаки. Он обычно поражает детей до пяти лет. При этом синдроме у пациента начинается воспаление кровеносных сосудов (васкулит) и лихорадка. Болезнь Кавасаки имеет четко выраженный набор симптомов, включая постоянно высокую температуру, покраснение глаз и области вокруг рта, сыпь на теле и покраснение и отек ног и рук.
13 мая нынешнего года в авторитетном медицинском издании The Lancet было опубликовано исследование итальянских врачей, которые сообщили, что в провинции Бергамо, одной из наиболее пострадавших от эпидемии коронавируса, была зафиксирована вспышка синдрома Кавасаки или схожего с ним синдрома.
Важно, что в большинстве случаев дети также имели положительный результат теста на антитела к КОВИД-19, предполагая, что синдром последовал за вирусной инфекцией.
Болезнь Кавасаки имеет тенденцию проявляться в группах генетически похожих детей и может выглядеть немного по-разному в зависимости от генетики, лежащей в основе группы.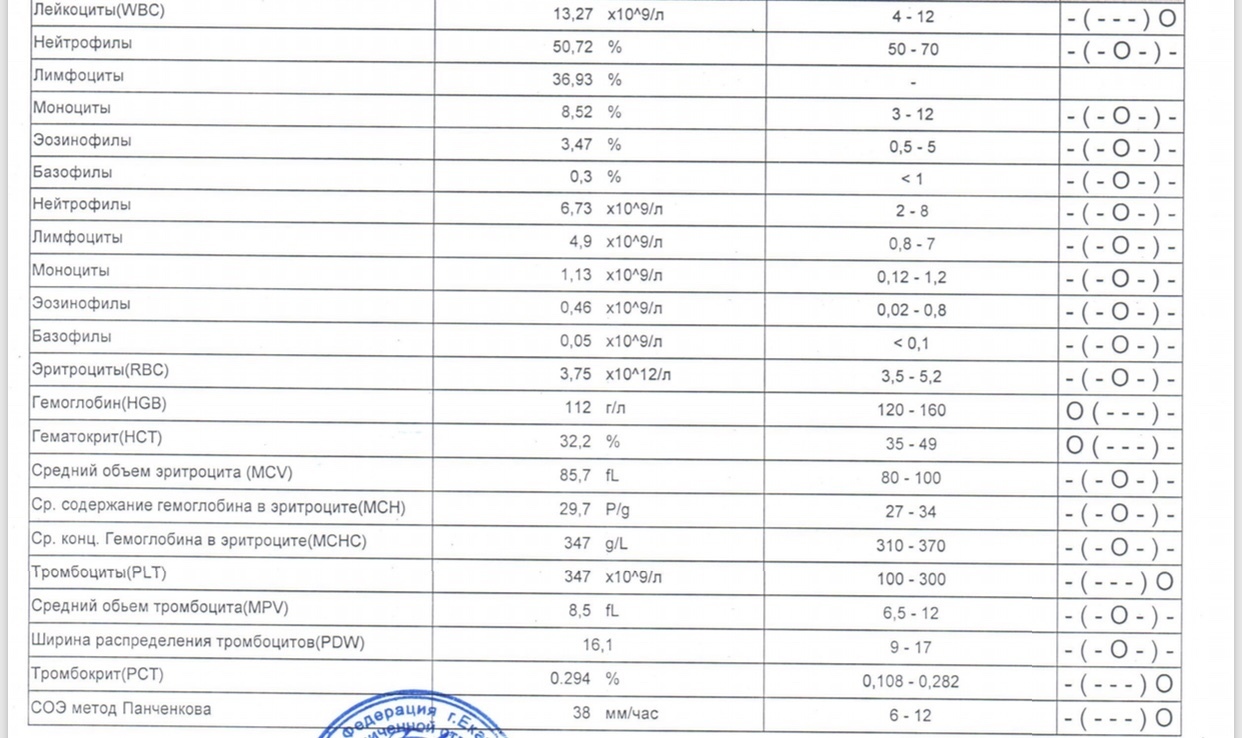 Это говорит о том, что различные триггеры могут вызывать воспалительную реакцию у детей с определенной генетической предрасположенностью.
Это говорит о том, что различные триггеры могут вызывать воспалительную реакцию у детей с определенной генетической предрасположенностью.
Вполне возможно, что атипичная пневмония SARS-COV-2, вызванная вирусом COVID-19, является одним из таких триггеров. Это важный вопрос, требующий пристального изучения.
– Александр Давидович, как вы думаете, почему у всех COVID-19 проявляется по-разному?
– Тут очень важна проблема факторов риска. Всё дело в том, что, помимо видимых болезней типа сахарного диабета или гипертонии, существуют болезни невидимые, о которых мы зачастую даже не подозреваем. В последние годы большое распространение получило учение о генетической тромбофилии. Во всем мире это примерно до 20 процентов людей, которые являются носителями той или иной формы генетической тромбофилии. С этим можно жить сто лет, но если возникает инфекция, травма, делается операция – больной может погибнуть от тромбоэмболии, даже если операция выполнена на высочайшем техническом уровне.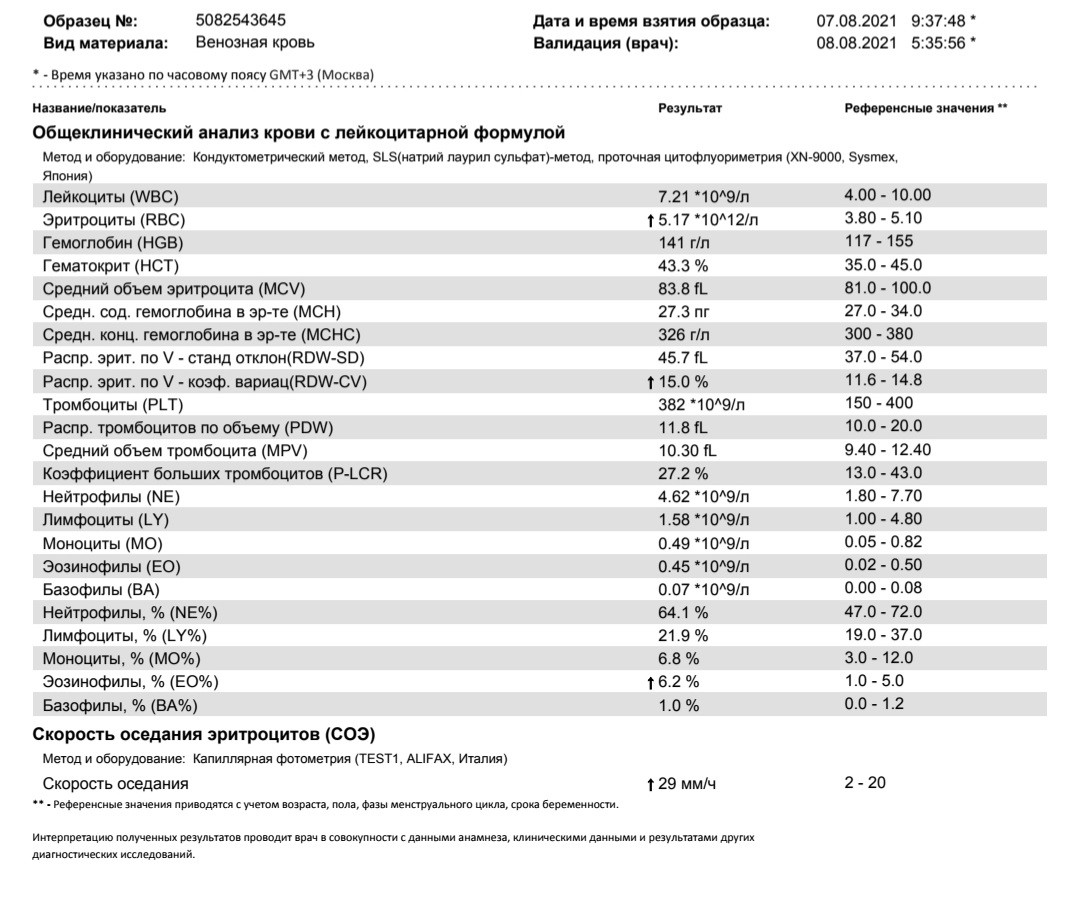 Причиной тому – скрытая генетическая тромбофилия – мутация, которая делает её носителя подверженным высокому риску тромбообразования.
Причиной тому – скрытая генетическая тромбофилия – мутация, которая делает её носителя подверженным высокому риску тромбообразования.
Одна из форм тромбофилии – так называемая гипергомоцистеинемия, которая может быть как приобретенной так и генетически обусловленной, также может быть важным фактором тромбозов, инфарктов, инсультов. А сейчас есть данные о том, что гипергомоцистеинемия усугубляется и при SARS-CoV2 инфекции. Соответственно, в группу риска входят все те, у кого повышен уровень гомоцистеина в крови , но человек может не знать об этом. Поэтому мы сейчас начали масштабное исследование по выявлению этих групп риска, выделению различных форм тромбофилии у больных с COVID-19. Наша цель – узнать, входят ли эти люди в группы риска по развитию тяжелых осложнений новой коронавирусной инфекции.
Высокая контагиозность вируса и большое количество заболевших поневоле «позволяет» вирусу выявить людей с изначальной явной или скрытой предрасположенностью к тромбозам.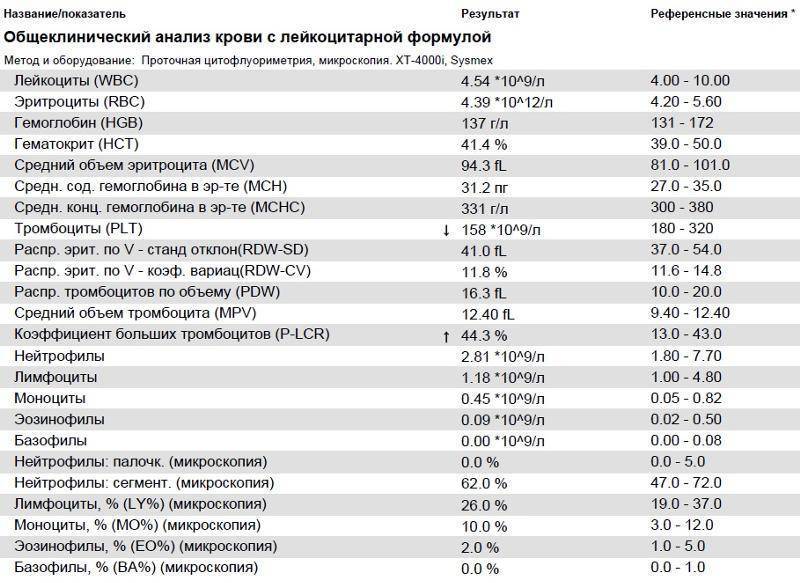 Это пациенты не только с генетической тромбофилией или антифосфолипидным синдромом, но и с сахарным диабетом, ожирением, ревматическими болезнями и другими патологическими состояниями, ассоциированными с повышенным свертыванием и/или воспалением.
Это пациенты не только с генетической тромбофилией или антифосфолипидным синдромом, но и с сахарным диабетом, ожирением, ревматическими болезнями и другими патологическими состояниями, ассоциированными с повышенным свертыванием и/или воспалением.
– Какие методы профилактики и лечения covid-19 вы считаете перспективными?
– Помимо уже названных, это противовирусная терапия, терапия специфическими иммуноглобулинами, противотромботическая терапия и лечение, направленное на снижение воспаления (так называемые антицитокиновые препараты). Многое нам предстоит ещё понять об этом новом для нас заболевании, но постепенно мы движемся в сторону лучшего объяснения многих его механизмов. Вы знаете, я всегда много работал, но, пожалуй, никогда ещё я не был так занят исследовательской и практической работой, как сейчас. Уверен, что она даст свои важные результаты.
Беседу вела Наталия Лескова.
Лабораторная диагностика туберкулеза — сдать анализы в СЗЦДМ
Туберкулез — инфекционная болезнь, возбудителем которой является микобактерия.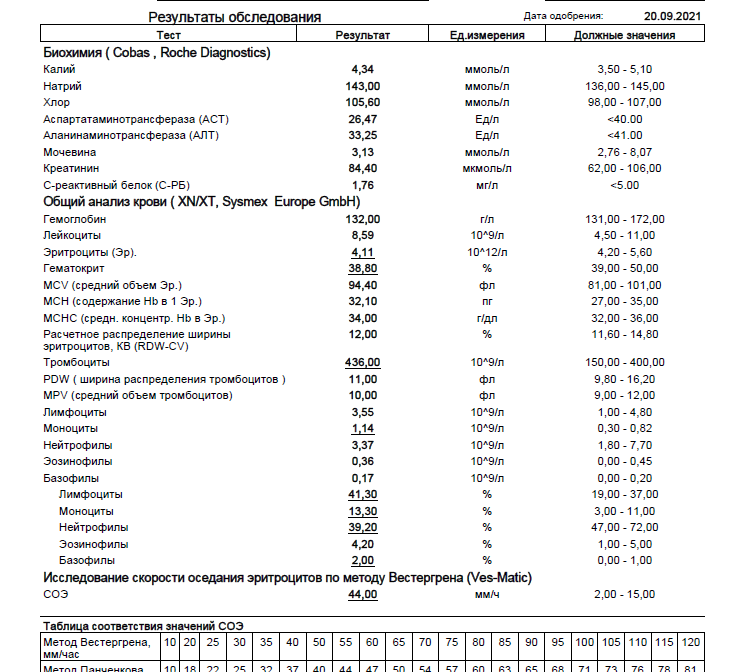 Чаще всего поражает дыхательную системы, однако может распространяться и в другие ткани и органы. Наиболее распространенный путь передачи — воздушно-капельный. Для того чтобы развилась активная форма болезни, необходимы благоприятные условия, например, сниженный иммунитет.
Чаще всего поражает дыхательную системы, однако может распространяться и в другие ткани и органы. Наиболее распространенный путь передачи — воздушно-капельный. Для того чтобы развилась активная форма болезни, необходимы благоприятные условия, например, сниженный иммунитет.
Патология проявляется длительным кашлем, субфебрильной температурой, которая может удерживаться в течении нескольких месяцев, ночным потоотделением, лимфаденопатией. Современные схемы лечения позволяют избавиться от болезни. Однако, для этого необходима своевременная постановка диагноза. Первое время туберкулез может не вызывать клиническую симптоматику, поэтому диагностика должна быть профилактической и регулярной. Ранняя терапия позволяет избавиться от осложнений, среди которых выраженные структурные нарушения дыхательной системы и вторичное распространение инфекции.
Различают следующие методы диагностики патологии:
-
бактериологический анализ мочи;
-
общий анализ мочи;
-
биохимическое исследование крови;
-
T-SPOT.
 TB;
TB;
-
микробиологические методы диагностики;
-
исследование свертывающей системы;
-
микроскопический анализ мокроты;
-
лучевые методы диагностики.
Перейти к анализам
Рассмотрим эти методы подробнее.Бактериологический анализ мочи
Показан при внелегочной форме туберкулеза. Этот метод диагностики крайне важен, ведь туберкулез мочеполовой системы часто вызывает осложнения и долгое время не вызывает симптомов. Именно туберкулез может долго маскироваться под воспалительный процесс или мочекаменную болезнь. Поэтому, длительная патология данных органов, которая сложно поддается лечению, является показанием к диагностике. Также, анализ мочи показан при туберкулезе для исключения вовлечения в процесс мочеполовой системы.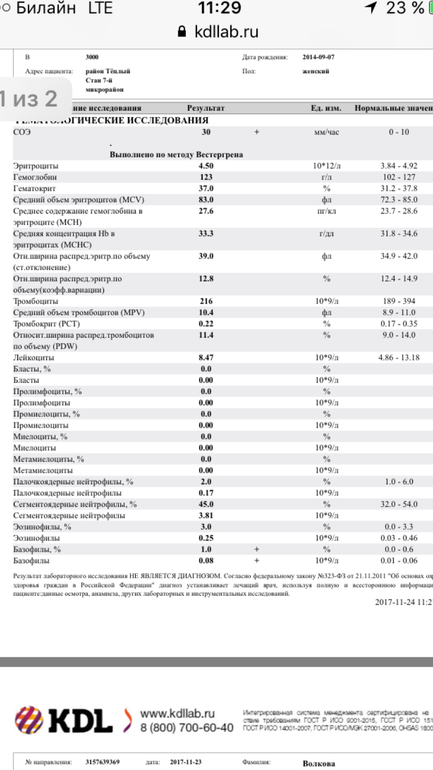
Для того, чтобы определить наличие возбудителя в моче, проводится бактериоскопия или посев на среду.
Для обнаружения микобактерии проводится специальное окрашивание, при котором возбудитель приобретает другой оттенок, отличный от здоровых клеток.
Другой метод заключается в посеве образца мочи на питательную среду. Если наблюдается рост культуры микобактерий, это говорит о наличии в организме возбудителя.
Общий анализ мочи
В общем анализе мочи наблюдаются характерные изменения при туберкулезе. Это появление капель гноя, наличие или следы белка и более кислая реакция. Также появляются видоизмененные лейкоциты, бактерии, эритроциты.
Биохимический анализ крови
На некоторых стадиях болезни выявляются изменения в биохимическом исследовании крови. При неактивной форме никаких изменений в данных анализах нет, хотя они могут появляться при сопутствующей патологии.
Острая форма туберкулеза приводит к снижению альбумино-глобулинового коэффициента. Если патология привела к осложнениям в виде поражения печени, повышается уровень трансаминаз, разных фракций билирубина. Эти показатели входят в обязательное обследование пациента с туберкулезом. Пациент сдает этот анализ в динамике, для оценки состояния.
Ухудшение работы почек может отражаться в повышении креатинина, изменениях скорости клубочковой фильтрации.
Биохимический анализ крови не имеет специфической диагностической ценности, однако является важным компонентом оценки качества лечения и состояния пациента.
К иммунологическим методам диагностики относится методика T-SPOT.TB. Основа способа заключается в изучении реакции Т-лимфоцитов. Процедура имеет высокую чувствительность и довольно информативен. Ложные результаты исключены даже тогда, когда остальные методики нечувствительны к результату. Метод применяется в сомнительных случаях, например после прививок, у пациентов с аутоиммунной патологией, у медработников. Данный способ позволяет оценить наличие возбудителя количественно, но не дает информации о фазе процесса.
Метод применяется в сомнительных случаях, например после прививок, у пациентов с аутоиммунной патологией, у медработников. Данный способ позволяет оценить наличие возбудителя количественно, но не дает информации о фазе процесса.
Особое место данная диагностика занимает у носителей ВИЧ. Дело в том, что вирус поражает именно лимфоциты. Несмотря на это диагностика по методу T-SPOT.TB дает точные результаты.
Высокая точность теста объясняется также тем, что тест-система чувствительна к компонентам возбудителя, но именно к тем, которых нет ни в вакцине БЦЖ, ни в других микроорганизмах, которые имеют сходные компоненты. Суть метода заключается в количественном определении в крови эффекторных Т-клеток (CD4 и CD8), вырабатывающих ИФН-ɣ (гамма-интерферон), который продуцируется в ответ на стимуляцию специально подобранными антигенами ESAT-6 и CFP10. Речь идет об одном из фрагментов генома микобактерии. Примечательно, что высокая специфичность наблюдается и в латентную, и в активную фазу.
Особенной подготовки к сдаче анализов не требуется — достаточно ограничить прием пищи за два часа до процедуры. Проводится забор венозной крови. Это необходимо проводить в соответствующих условиях, с соблюдением правил асептики и антисептики.
Положительный результат теста говорит о том, что в организме присутствует микобактерия, а отрицательный — об обратном.
Микробиологические методы диагностики
Применяются для прямого обнаружения возбудителя туберкулеза в биологических тканях организма. Применяются различные методики.
Окраска по Цилю-Нельсену заключается в том, что мазок с препаратом обрабатывается специфическим красителем. Микобактерии приобретают характерный оттенок, что говорит о том, что реакция произошла. Так можно подтвердить или исключить наличие возбудителя в материале. Метод экономичный и сравнительно быстрый. Однако, он чувствителен только при высокой концентрации микроорганизмов в образце.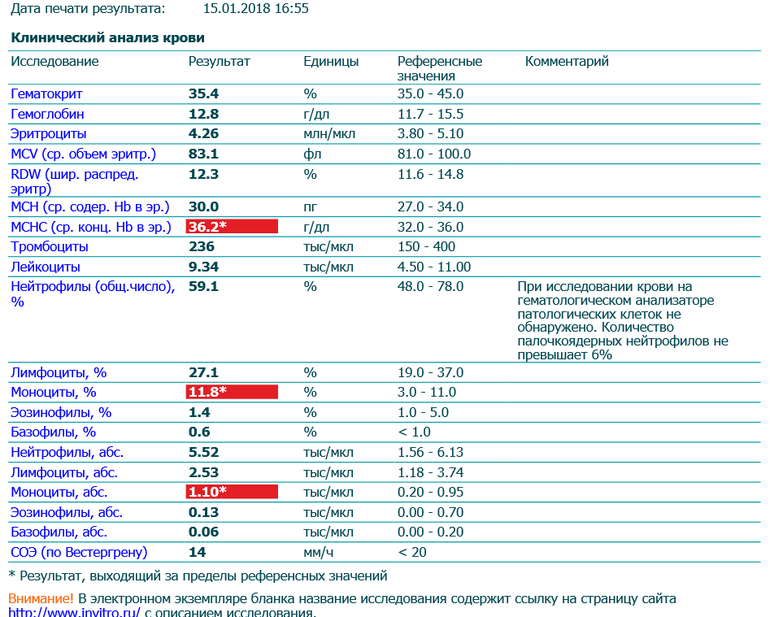
Люминесцентная микроскопия дает более высокое разрешение и улучшает методику окраски. Требуется применение флуорохромов — специфических веществ, которые “подсвечивают” микобактерии и делают их более видимыми под микроскопом.
Полимеразно-цепная реакция позволяет осуществить воспроизведение ДНК бактерии из её фрагментов, которые содержатся в тканях. Это быстрый и информативный метод диагностики, который имеет высокую специфичность и чувствительность.
Культуральный метод заключается в выращивании культуры из микобактерий. Для этого берется фрагмент биоматериала и сеется на питательную среду. Потом оценивается штамм, который вырос на среде и подтверждается или исключается диагноз. Используется специфическая среда, на которой с большей вероятностью вырастет необходимая среда. Выращенные колонии можно использовать для определения чувствительности к антибиотикам.
ВАСТЕС460 — это современный метод диагностики, в ходе которого используется радиометрическая система и меченый СО2. Бактерия поглощает элемент-индикатор и её можно обнаружить в исследуемом материале.
Бактерия поглощает элемент-индикатор и её можно обнаружить в исследуемом материале.
Исследование свертывающей системы крови
Коагулограмма часто используется в фтизиатрии, так как у пациентов с туберкулезом постепенно возникает кровохаркание или легочные кровотечения. Это приводит к изменению показателей гемостаза. Анализ может меняться и после хирургического лечения болезни.
Контроль коагулограммы основан на анализе таких показателей, как АЧТВ, фибриноген, время кровотечения, время свертывания. Эти показатели могут колебаться в разные стороны, в зависимости от объема кровопотери. Если она незначительна — коагуляционная система стимулируется и показатели повышаются. Потеря большого объема крови приводит к снижению в организме факторов свертывания и соответствующим изменениям коагулограммы.
Микроскопический анализ мокроты
Анализ мокроты — обязательное исследование при туберкулезе. При этой патологии мокроты выделяется в небольшом количестве, имеет вкрапления крови, гноя, слизи. На ранних стадиях, кровь может не появляться. Кавернозная форма болезни приводит к появлению в материале так называемых рисовых телец. Также, наблюдаются вкрапления кристаллов, эластичных волокон, холестерина. Повышается белок в общем составе мокроты. Если произошел распад — мокрота содержит кальций, волокна различного происхождения, холестерин и, собственно, туберкулезные микобактерии.
При этой патологии мокроты выделяется в небольшом количестве, имеет вкрапления крови, гноя, слизи. На ранних стадиях, кровь может не появляться. Кавернозная форма болезни приводит к появлению в материале так называемых рисовых телец. Также, наблюдаются вкрапления кристаллов, эластичных волокон, холестерина. Повышается белок в общем составе мокроты. Если произошел распад — мокрота содержит кальций, волокна различного происхождения, холестерин и, собственно, туберкулезные микобактерии.
Проводится также бактериология мокроты. Применяется специфический метод окраски, который позволяет определить наличие микобактерии. Посевы на питательные среды также имеют диагностическую ценность.
Бактериоскопия мокроты подразумевает её изучение под необходимым увеличением микроскопа. При высокой концентрации микроорганизмов методика довольно специфична и чувствительна. Мокрота изучается 3 раза для того, чтобы получить наиболее точный результат.
Лучевые методы диагностики
Лучевые методы позволяют визуализировать изменения в организме, к которым привела микобактерия.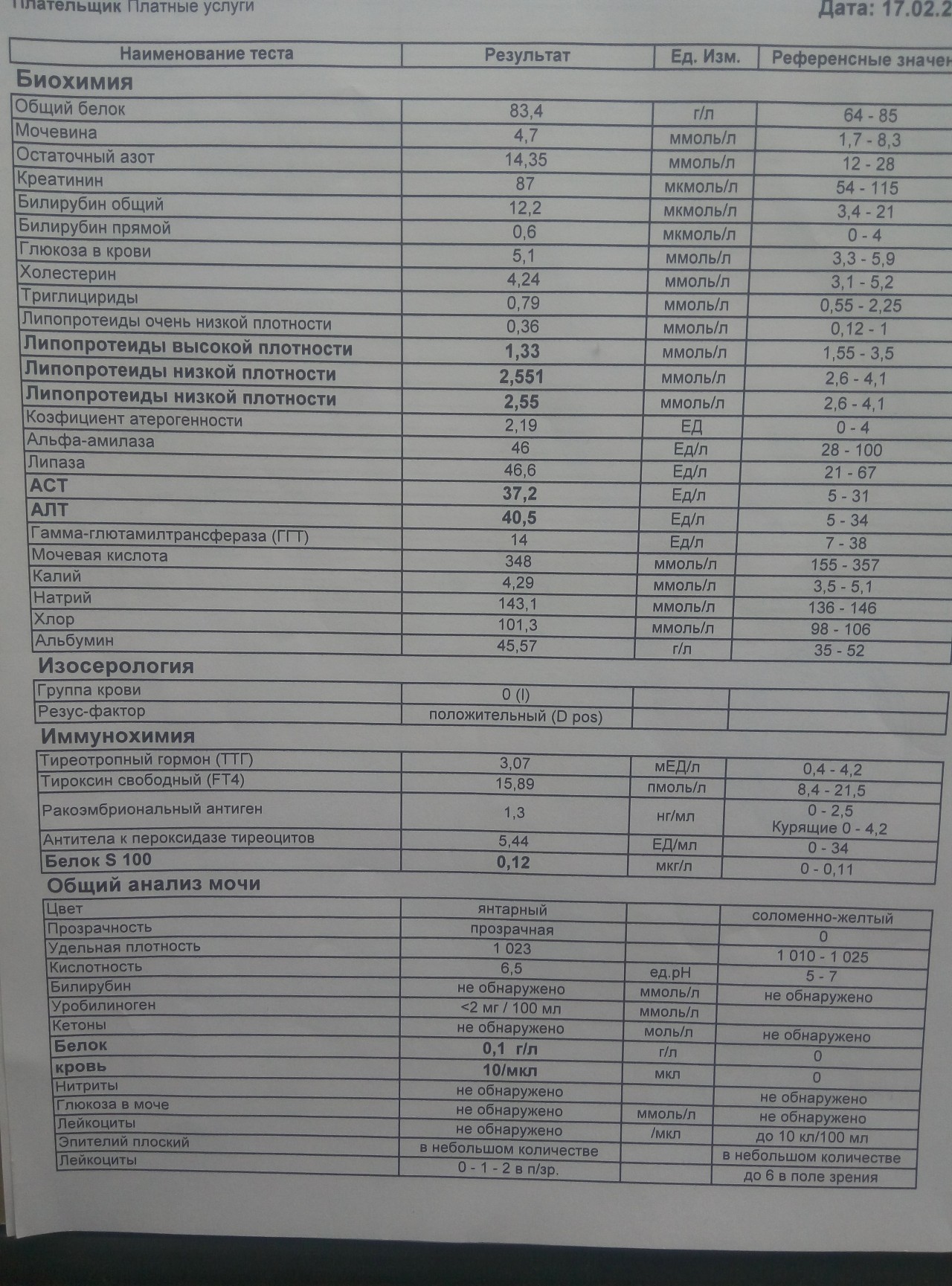 Это и скрининговый метод диагностики, и способ оценки тяжести и степени патологии. Также, лучевая диагностика — метод динамической оценки пациента. Различают такие лучевые методики в диагностике туберкулеза:
Это и скрининговый метод диагностики, и способ оценки тяжести и степени патологии. Также, лучевая диагностика — метод динамической оценки пациента. Различают такие лучевые методики в диагностике туберкулеза:
- флюорография;
- рентгенография;
- томография;
- рентгеноконтрастные исследования.
Флюорография используется для скрининговой диагностики, которая требует подтверждения при подозрительных результатах. Неспецифический метод, который используется для профилактического осмотра. Цифровая методика позволяет оценивать изображение на экране с использованием увеличения и приближения картинки. Метод прост, быстрый и экономичный.
Рентгенография является более точной методикой и позволяет полноценно обследовать структуры грудной клетки. на снимке можно обнаружить признаки функциональной недостаточности различных органов, проследить топография новообразования, диагностировать каверну, ателектаз, абсцесс или нарушение целостности плевральной полости. Выполняется в двух проекциях для более точных результатов. Иногда используется прицельное проведение диагностики.
Выполняется в двух проекциях для более точных результатов. Иногда используется прицельное проведение диагностики.
Томография является наиболее точной методикой визуализации структур грудной клетки. Это формирование послойных изображений органов и структур. Можно определить распространение и локализацию очага болезни, увидеть, какие ткани он поразил и насколько глубоко проник.
Методики с использованием контраста применяются для получения изображения бронхиального дерева (бронхография). Можно обнаружить полостные изменения, нарушения дренажной функции, структурные изменения и наличие фистул. также применяется ангиопульмонография. контраст вводится в сосудистое русло и позволяет оценить легочной кровоток. особенно это важно при кровохарканьи и кровотечениях.
Применяются радионуклидные методы, сцинтиграфия. Они применяются для оценки функциональной активности или нарушений.
Ультразвуковая методика применяется для оценки деятельности сердца, диагностики состояния плевральных синусов, лимфатических узлов.
Для анализа мочи на туберкулез применяется утренняя порция. необходимо провести туалет наружных половых органов и не касаться ими резервуара для сбора материала. Контейнер должен быть стерильным и сухим. Собранный биоматериал необходимо как можно скорее доставить в лабораторию, не допускать его высыхания и нагревания. За сутки до сдачи анализа необходимо отказаться от таких продуктов, как черника, морковь, свекла и других ярких овощей и фруктов. Также следует ограничить прием диуретиков, витаминов, ацетилсалициловой кислоты. Женщинам следует помнить, что анализы мочи не сдают во время менструаций. Сдается средняя, промежуточная порция мочи.
Сдача крови происходит натощак, так как прием пищи может исказить результаты исследования. Стоит проконсультироваться с лечащим врачом на предмет отмены некоторых препаратов. Накануне не следует употреьоять кофе, алкоголь, табак. Сбор крови происходит в стерильных условиях, с соблюдением правил забора материала. Для некоторых исследований необходима капиллярная, а для некоторых — венозная кровь.
Сбор крови происходит в стерильных условиях, с соблюдением правил забора материала. Для некоторых исследований необходима капиллярная, а для некоторых — венозная кровь.
Мокрота собирается натощак, с соблюдением основных правил. Материал необходимо откашлять, чтобы в посуду не попала слизь изо рта или носоглотки. Используется специальная плевательница из темного стекла, с плотной крышкой. Мокрота не должна обветриваться или высыхать.
К инструментальным методам исследования не требуется особая подготовка. Исключение — применение контрастного вещества. Перед его использованием необходимо оценить функцию почек. Большинство рентгеноконтрастных веществ выводится именно эти органом и врач должен быть уверен в том, что выделительная система выдержит эту нагрузку.
Нормы и выявляемые отклонения
В норме, в организме не должно быть микобактерий. Их наличие расценивается как положительный результат диагностики туберкулеза. Негативный результат говорит о том, что у пациента нет данной патологии. Некоторые методы неспецифичны и не обладают высокой диагностической ценностью. Они используются для оценки общего состояния. Бактериологические методики более специфичны и их положительные результаты можно считать подтверждением диагноза. Отрицательный результат является поводом для повторных анализов, если есть клинические признаки болезни.
Негативный результат говорит о том, что у пациента нет данной патологии. Некоторые методы неспецифичны и не обладают высокой диагностической ценностью. Они используются для оценки общего состояния. Бактериологические методики более специфичны и их положительные результаты можно считать подтверждением диагноза. Отрицательный результат является поводом для повторных анализов, если есть клинические признаки болезни.
Общий и биохимический анализ крови, мокроты и мочи может быть готов в течении нескольких часов. Как правило, результаты сообщаются на следующий день.
Бактериологический метод с окраской занимает около 24 часов.
Посевы занимают больше времени — до нескольких недель.
Результат лучевых методов диагностики зависит от скорости описания снимка. Чаще всего, это занимает около суток.Понятная расшифровка общего анализа крови у кошки, кота и собаки
Общий анализ крови — дает представление о форменных элементах (клетках крови), их соотношении с жидкой частью крови, плазмой (гематокрит) и содержании гемоглобина.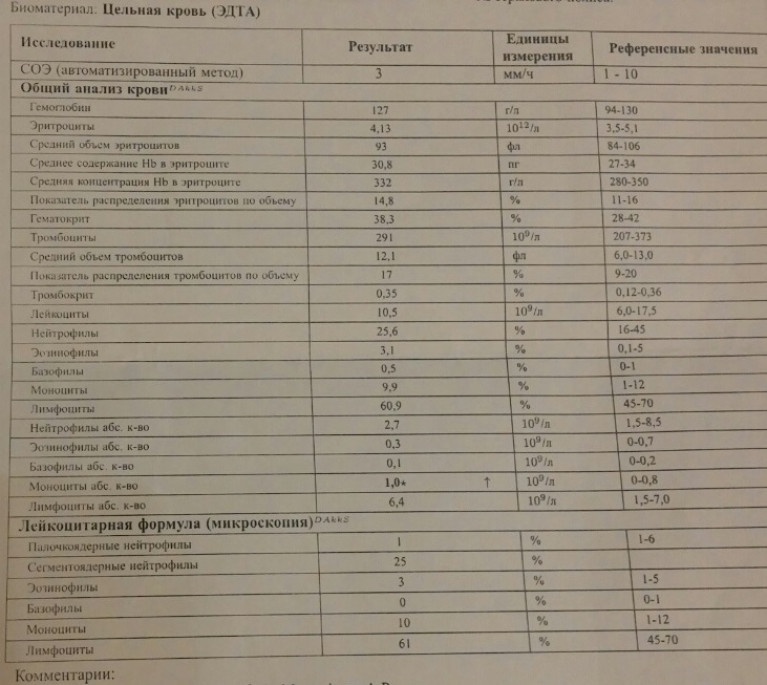
Кровь состоит из клеток (форменных элементов) и жидкой части (плазмы). Форменные элементы – эритроциты, лейкоциты и тромбоциты – образуются и созревают в костном мозге и должны попадать в системный кровоток по мере необходимости. Расшифровка общего анализа крови у кошки или собаки предполагает подсчёт форменных элементов и расчёт некоторых косвенных показателей. Так, отношение объема форменных элементов к плазме называется гематокритом.
Клинический анализ крови у животных применяют для оценки состояния здоровья, диагностики анемии, инфекций и других заболеваний.
После получения анализа крови у владельца питомца часто возникает вопрос, что означают итоговые цифры и показатели, как их расшифровывать и толковать? Собрали для вас основную информацию по показателям общего анализа крови у кошки или собаки (ОАК), которые дают представление о форменных элементах (клетках крови), их соотношении с жидкой частью крови, плазмой (гематокрит) и содержанием гемоглобина.
Анализ крови у собак и кошек — расшифровка
Лейкоциты у кошки и собаки
Лейкоциты — (WBC) – клетки крови, которые защищают организм от патологических агентов.
Расшифровка общего анализа крови у животных:
- норма лейкоцитов у собак — 6,0–17,0 ×109 кл/л
- норма лейкоцитов у кошек — 5,5–19,5×109 кл/л
Диагностическое значение при отклонении от нормы: повышенные лейкоциты у кошки или собаки, также как и пониженные лейкоциты (т.е. любое отклонение от нормы) говорит о наличии инфекций у животного или, например, заболеваний костного мозга.
Тромбоциты у кошки и собаки
Тромбоциты (PLT) – элементы крови, отвечающие за ее свертывание.
- норма тромбоцитов у собак — 160 — 550 ×109 кл/л
- норма тромбоцитов у кошек – 160 — 630 кл/л
Их повышение может означать наличие злокачественных опухолей, вирусных или бактериальных инфекций.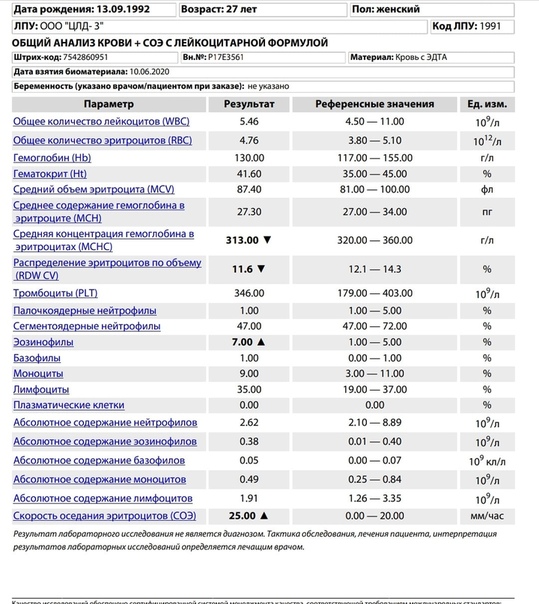 Иногда такое наблюдается после операций или при обострении хронических заболеваний.
Иногда такое наблюдается после операций или при обострении хронических заболеваний.
Низкие тромбоциты у кошки или собаки, это может быть сигналом к наличию опухолевых поражений, гепатитов, аденовирусов, аутоиммунных заболеваний и других недугов.
Диагностическое значение при отклонении от нормы: выявление нарушений свертывания крови, дегидратации (обезвоживания), или заболеваний костного мозга.
Эритроциты у кошки и собаки
Эритроциты (RBC) – красные клетки крови, которые содержат гемоглобин. Их основное назначение — это перенос кислорода по организму.
- норма эритроцитов у собак 5,5 — 8,5 ×1012 кл/л
- норма эритроцитов у кошек — 5,0 — 1,0 ×1012 кл/л
Повышенные эритроциты могут свидетельствовать о заболеваниях крови или легких, о пороках сердца или проблемах с надпочечниками. Кроме того, их количество растет при рвоте и диарее.
Понижение уровня эритроцитов означает дефицит железа, витамина B12 или фолиевой кислоты.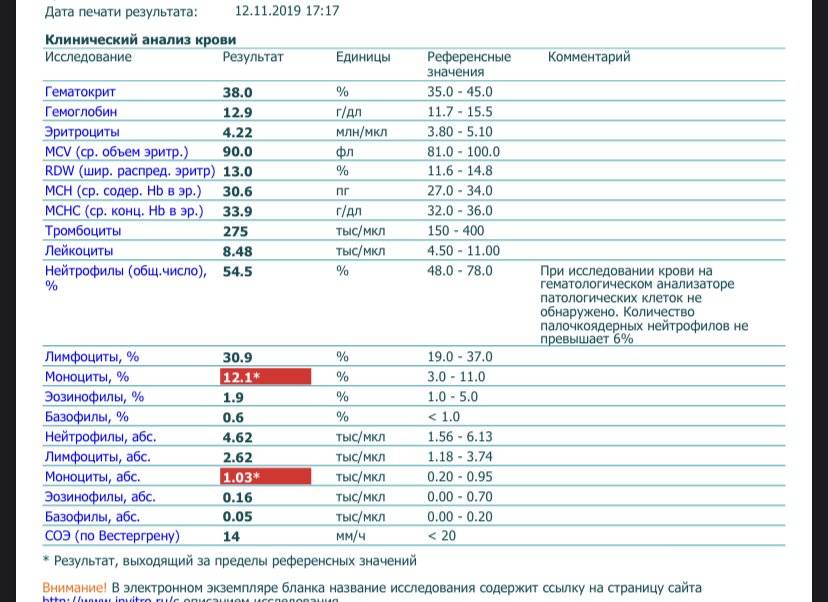 Также это считается симптомом кровопотери и гемолиза.
Также это считается симптомом кровопотери и гемолиза.
Диагностическое значение при отклонении от нормы: свидетельствует о диагностике анемий.
Гемоглобин у кошки и собаки
Гемоглобин (HGB) – красный пигмент крови, который содержит железо, необходимое для перенесения кислорода и углекислого газа по крови.
- норма гемоглобина у собак 12 — 18 г/дл
- норма гемоглобина у кошек – 8 — 15 г/дл
Повышенный гемоглобин у собаки или кота свидетельствует о пороках сердца, легочном фиброзе, кишечной непроходимости или наличии опухолей. Также повышение гемоглобина наблюдается у многих рабочих пород собак из-за большого количества физических нагрузок.
Пониженный гемоглобин свидетельствует о потере крови, аутоиммунных или инфекционных болезнях, о наличии глистов, заболеваниях крови и плохой усвояемости витамина B12 или железа.
Диагностическое значение при отклонении от нормы: оценка тяжести анемии или полицитемии и для контроля за эффективностью терапии этих состояний.
Гематокрит у кошек и собак
Гематокрит (НСТ) – соотношение объема плазмы и эритроцитов.
- норма гематокрита у собак 37 — 55%
- норма гематокрита у кошек – 25 — 45%
Повышение этого показателя может означать лейкозы, гипоксию, поликистоз, новообразования почек или их гидронефроз, перитонит, ожоговую болезнь и иные недуги. Понижение наблюдается при беременности, анемии или гипергидратации.
Диагностическое значение при отклонении от нормы: комплексная оценка анемий и полицитемий, для принятия решения о переливании крови и оценки результатов этой процедуры.
Эритроциты у кошек и собак
Средний объем эритроцита (MCV) – показатель, отражающий размер эритроцитов. Информативен для дифференциальной диагностики различных типов анемий. При B12-дефицитной анемии размер эритроцитов увеличивается, при железодефицитной –уменьшается.
Среднее содержание гемоглобина в эритроците (MCH) – показатель отражающий, сколько гемоглобина в среднем содержится в одном эритроците. При B12-дефицитной анемии в увеличенных эритроцитах количество гемоглобина повышено, а при железодефицитной анемии – снижено.
При B12-дефицитной анемии в увеличенных эритроцитах количество гемоглобина повышено, а при железодефицитной анемии – снижено.
Средняя концентрация гемоглобина в эритроците (MCHC) отражает насыщение эритроцита гемоглобином. Это более чувствительный параметр для определения нарушений образования гемоглобина, чем MCH, так как он не зависит от среднего объема эритроцита.
Распределение эритроцитов по объему (RDW) – показатель, определяющий степень различия эритроцитов по размеру. Имеет значение в диагностике анемий.
Средний объем тромбоцита (MPV) – характеристика тромбоцитов, которая может косвенно свидетельствовать об их повышенной активности или о наличии чрезмерного количества молодых тромбоцитов.
Как правильно подготовить кошку, кота или собаку к сдаче анализа крови?
- Cоблюдение 12-ти часовой голодной диеты. ВОДА БЕЗ ОГРАНИЧЕНИЙ!
- Если у вас щенок или котенок, или если питомец не может выдержать длительное голодание (например при сахарном диабете), тогда достаточно 6 часов голода.

- Ограничьте физическую нагрузку за 24 часа.
- Избегайте стрессовых ситуаций для питомца.
- При необходимости (предварительно проконсультировавшись с врачом) до поездки дайте седативный препарат.
- Если животное принимает какие-либо лекарственные препараты, сообщите об этом врачу.
Общий анализ крови кошки или собаки — базовое исследование, которое много может рассказать о здоровье вашего питомца.
Рекомендуем своевременно обследовать животное у ветеринарного врача и проходить назначенные исследования.
Ветеринарная клиника «ВэллВет» Ветеринарная клиника «ВэллВет» 2021-06-16 11:49:00 2021-06-16 11:49:00Биохимический и общий анализ крови у кошек: расшифровка, отклонения, нормы
Анализы крови могут показать отклонения в здоровье кошки.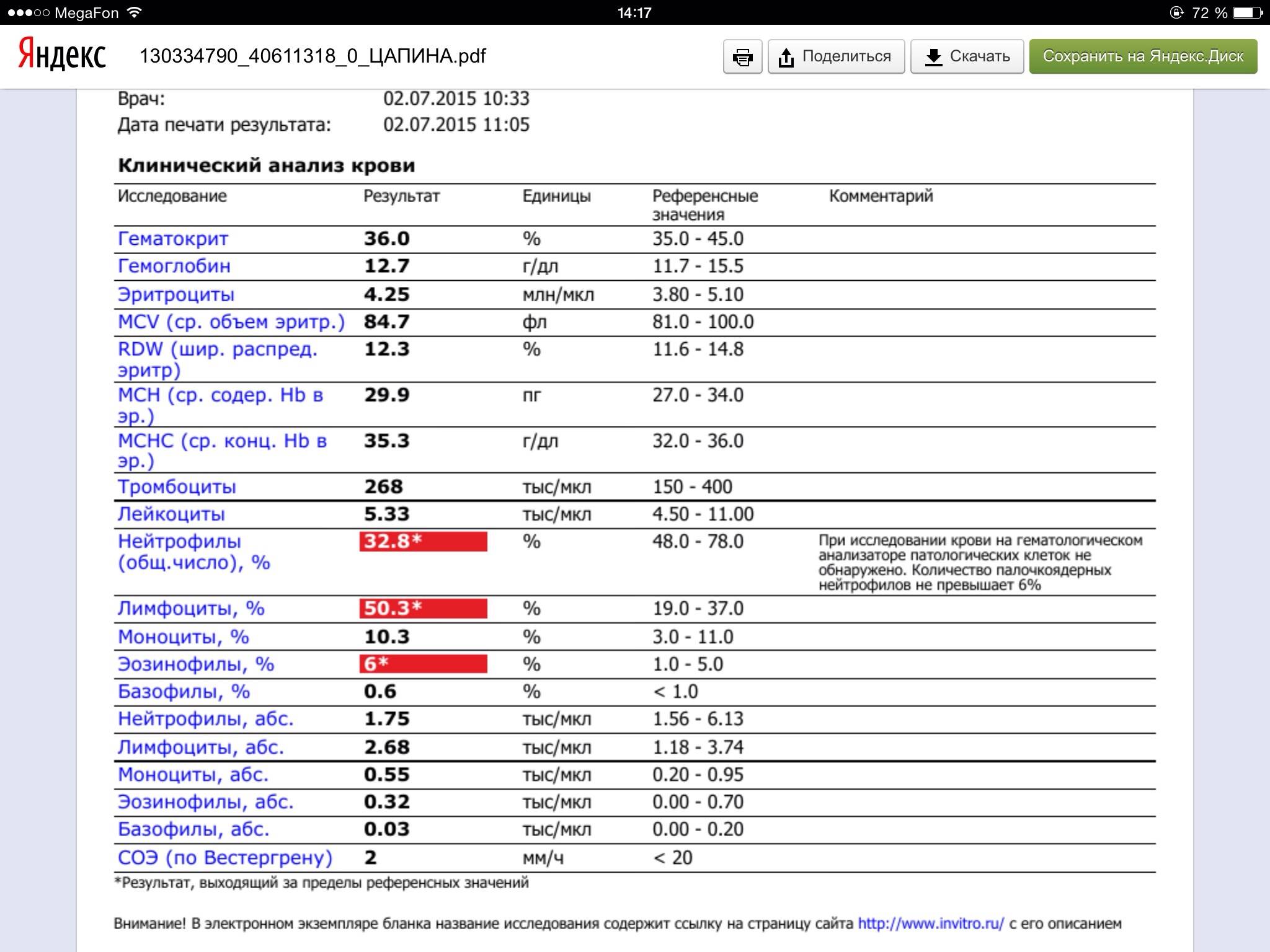 Братья наши меньшие не могут сами сказать, что и где у них болит, а кошки, при этом, как истинные хищники, еще и максимально маскируют свои симптомы от окружающих.
Расшифровка биохимии и общего анализа крови показывает не только интенсивность заболеваний у кошек, но и дает понимание, насколько эффективно лечение. Именно поэтому рекомендуется сдавать анализы как до, так и после пройденного лечения животного.
Братья наши меньшие не могут сами сказать, что и где у них болит, а кошки, при этом, как истинные хищники, еще и максимально маскируют свои симптомы от окружающих.
Расшифровка биохимии и общего анализа крови показывает не только интенсивность заболеваний у кошек, но и дает понимание, насколько эффективно лечение. Именно поэтому рекомендуется сдавать анализы как до, так и после пройденного лечения животного.
Виды анализов крови у кошек
Для диагностики заболеваний у кошек чаще всего используются общий клинический анализ (ОКА) и биохимический анализ крови (БХ).
Но, чтобы уметь интерпретировать изменения показателей, нужно понимать природу каждого из них. Об этом мы и поговорим ниже.
Общий анализ
Результаты общего анализа крови у кошек используются для выявления воспалительного процесса (острого или хронического), анемии, инфекций, заболеваний костного мозга и других отклонений.
Основные показатели:
- Эритроциты (RBC) — крупные безъядерные клетки, отвечающие за транспорт кислорода и других веществ. Их снижение будет указывать на анемию, тогда как повышение может говорить о кислородном голодании.
- Гематокрит (Ht) — процентный показатель количества эритроцитов по отношению к объему крови. Чем больше эритроцитов в крови, тем выше этот показатель. Повышение гематокрита обычно не несет особого клинического значения, тогда как его понижение — плохой знак.
- Гемоглобин (Hb) — белковый комплекс, содержащийся в эритроцитах и связывающий кислород. Этот показатель почти всегда коррелируется с эритроцитами и гематокритом и несет такое же клиническое значение.
- Эритроцитарные индексы (MCV, MCH, MCHC) — показатели, указывающие на размеры эритроцитов и их цветовые показатели. Простыми словами, знание этих индексов дает нам понимание о том, как именно выглядят эритроциты и насколько они наполнены гемоглобином.
 При диагностике анемий для определения природы заболевания эти показатели важно учитывать. Косвенно мы можем предполагать по ним регенерацию (образование новых эритроцитов), железодефицитные состояния, заболевания костного мозга.
При диагностике анемий для определения природы заболевания эти показатели важно учитывать. Косвенно мы можем предполагать по ним регенерацию (образование новых эритроцитов), железодефицитные состояния, заболевания костного мозга. - Лейкоциты (WBC) — белые клетки крови. Они являются основным компонентом иммунной системы. В эту группу входит несколько видов клеток. Соотношение разных форм лейкоцитов друг к другу называется лейкограммой, или лейкоцитарной формулой.
- Нейтрофилы — весьма подвижны. Они способны покидать кровяное русло и обладают способностью к фагоцитозу (поглощению) инфекционных агентов (вирусы, бактерии и т. п.). Существует 2 группы нейтрофилов. Палочкоядерные — незрелые нейтрофилы, которые только-только попали в кровоток. Если их количество повышено, это значит, что организм остро реагирует на заболевание, тогда как преобладание сегментоядерных (зрелых) форм нейтрофилов будет говорить о хроническом течении болезни.
- Эозинофилы — крупные клетки, основная цель которых — борьба с многоклеточными паразитами.
 Их повышение почти всегда говорит о паразитарной инвазии, хотя у кошек они почти никогда не повышаются, даже если паразиты есть.
Их повышение почти всегда говорит о паразитарной инвазии, хотя у кошек они почти никогда не повышаются, даже если паразиты есть. - Базофилы — клетки, отвечающие за аллергическую реакцию. У кошек базофилы повышаются очень редко и, как правило, не несут клинического значения.
- Моноциты — крупные клетки, которые способные проникать практически в любой очаг воспаления. Именно они являются основным компонентом гноя. Повышаются при сепсисе (попадании бактерий в кровоток).
- Лимфоциты ответственны за специфический иммунитет. Встретившись с инфекцией, они “запоминают” возбудителя и учатся с ним бороться. Их повышение будет говорить об инфекционном процессе, также они могут повышаться при онкологии. Их понижение будет говорить о снижении иммунитета, заболеваниях костного мозга или вирусах.
- Тромбоциты — безъядерные клетки, основная функция которых — остановка кровотечения. Как компенсаторный механизм, при кровопотерях они всегда будут повышаться.
 Понижены тромбоциты могут быть только по двум причинам: либо они избыточно теряются (тромболитические яды, кровопотеря, инфекции), либо недостаточно образуются (опухоли, заболевания костного мозга и др.). Но нередко они занижены ошибочно, например, если в пробирке образовался тромб (артефакт исследования).
Понижены тромбоциты могут быть только по двум причинам: либо они избыточно теряются (тромболитические яды, кровопотеря, инфекции), либо недостаточно образуются (опухоли, заболевания костного мозга и др.). Но нередко они занижены ошибочно, например, если в пробирке образовался тромб (артефакт исследования).
Биохимия крови у кошек
Биохимический анализ нужен для оценки общего состояния организма, выявления заболеваний отдельных органов (почки, печень и др.), а также для определения интенсивности болезни у кошек.
Основные показатели:
- Альбумин — простой белок, растворимый в воде. У него много функций в организме — от питания клеток до транспорта витаминов. Его повышение не имеет клинического значения, тогда как понижение может говорить о серьезных заболеваниях с потерей белка или нарушении белкового обмена.

- АЛТ (аланинаминотрансфераза) — фермент, содержащийся во многих тканях организма, но больше всего — в клетках печени, почек, сердечной и мышечной мускулатуре. При заболеваниях этих органов (особенно печени) АЛТ повышается. Также он может резко повыситься после травм, из-за повреждения мышц и при гемолизе (разрушение эритроцитов).
- АСТ (аспартатаминотрансфераза) — фермент, как и АЛТ содержащийся в печени, мышцах, миокарде, почках, эритроцитах, стенке кишечника. Его уровень почти всегда коррелируется с уровнем АЛТ, то есть говорит, в первую очередь, о заболеваниях печени, гемолизе, травмах. Но при заболеваниях миокарда уровень АСТ будет выше уровня АЛТ, что имеет высокую диагностическую ценность. Соотношение уровня АЛТ и АСТ в крови называется коэффициентом Ритиса.
- Альфа-амилаза — фермент, вырабатываемый в поджелудочной железе (ПЖ) для расщепления углеводов. Ранее этот показатель считался маркером патологий ПЖ, но на самом деле амилаза, как показатель, имеет малое клиническое значение.
 В кровь она попадает из 12-перстной кишки, соответственно, ее повышение может быть связано скорее с повышением проницаемости кишечника, нежели с заболеваниями ПЖ. Для диагностики данных заболеваний гораздо информативнее использовать УЗИ.
В кровь она попадает из 12-перстной кишки, соответственно, ее повышение может быть связано скорее с повышением проницаемости кишечника, нежели с заболеваниями ПЖ. Для диагностики данных заболеваний гораздо информативнее использовать УЗИ. - Билирубин — пигмент, содержащийся в желчи. Повышается при заболеваниях гепатобилиарной системы (печень, желчный пузырь). Он весьма токсичен и очень долго сохраняться в тканях. При его повышении слизистые и кожа принимают характерный иктеричный (желтушный) оттенок, моча тоже становится ярко-оранжевого цвета.
- ГГТ (гамма-глутамилтрансфераза) — фермент, содержащийся в клетках печени, поджелудочной железы, молочной железе, селезенке, кишечнике. Но его не бывает в миокарде и мышцах. Повышение уровня ГГТ говорит о повреждении тканей, в которых он содержится.
- Глюкоза — простой сахар, используется как источник энергии. Изменения его количества в крови, в первую очередь, говорят о состоянии обмена веществ.
 Дефицит чаще всего связан с ее недостаточным поступлением (при голоде) или вовсе — потерей (отравление, некоторые лекарства). Незначительное повышение глюкозы может быть нормой из-за стресса. Также может свидетельствовать о серьезных заболеваниях, таких как диабет, почечная недостаточность и др.
Дефицит чаще всего связан с ее недостаточным поступлением (при голоде) или вовсе — потерей (отравление, некоторые лекарства). Незначительное повышение глюкозы может быть нормой из-за стресса. Также может свидетельствовать о серьезных заболеваниях, таких как диабет, почечная недостаточность и др. - Креатинин — продукт распада белка. Выводится почками, поэтому при нарушении их работы будет повышен. Однако креатинин может быть высоким и при обезвоживании, травмах, несоблюдении голода перед анализом крови.
- Мочевина — конечный продукт распада белка. Она образуется в печени и выводится почками. Повышение показателя мочевины бывает при поражении этих органов. При печеночной недостаточности он, наоборот, будет снижен (цирроз, портосистемный шунт).
- Щелочная фосфатаза (ЩФ) — фермент, содержащийся в клетках печени, почек, кишечника, поджелудочной железы, плаценты, а также в костях. При заболеваниях желчного пузыря ЩФ почти всегда повышается.
 Но может быть и повышена при беременности, энтеропатии, заболеваниях ротовой полости, в период роста.
Но может быть и повышена при беременности, энтеропатии, заболеваниях ротовой полости, в период роста.
Нормы показателей крови у кошек
В общем анализе крови
Таблица расшифровки норм показателей общего анализа крови у кошек
|
Показатель |
Взрослая кошка, норма |
Котенок, норма |
|
Гемоглобин (г/л) |
80—150 |
85—127 |
|
Гематокрит (%) |
28—47 |
25—37 |
|
Эритроциты (млн/мкл) |
5—10 |
4. |
|
Средний объем эритроцита (MCV, фл) |
39—53 |
39—53 |
|
Среднее содержание гемоглобина в эритроците (MCH, пг) |
13—20 |
13—20 |
|
Средняя концентрация гемоглобина в эритроците (MCHC, г/дл) |
30—36 |
30—36 |
|
Лейкоциты (тыс./мкл) |
5.5—18 |
5.5—18 |
|
Нейтрофилы палочкоядерные (%) |
0—3 |
0—3 |
|
Нейтрофилы сегментоядерные (%) |
35—75 |
35—75 |
|
Моноциты (%) |
1—4 |
1—4 |
|
Лимфоциты (%) |
20—55 |
20—55 |
|
Базофилы |
Отсутствуют |
Отсутствуют |
|
Эозинофилы |
0—3 |
0—3 |
|
Тромбоциты (тыс. |
300—630 |
300—630 |
В биохимическом анализе
Таблица расшифровки норм показателей биохимического анализа крови у кошек
|
Показатель |
Взрослая кошка, норма |
Котенок, норма |
|
Альбумин (г/л) |
24—39 |
19—38 |
|
АЛТ (ед./л) |
10—85 |
10—75 |
|
АСТ (ед./л) |
10—56 |
7—40 |
|
Альфа-амилаза (ед. |
350—2000 |
350—2000 |
|
Билирубин прямой Билирубин общий (мкмоль/л) |
<5 <10 |
<5 <10 |
|
ГГТ (ед./л) |
<6 |
<6 |
|
Глюкоза (ммоль/л) |
3.2—7.9 |
3—12 |
|
Мочевина (ммоль/л) |
3.5—12 |
3.5—12 |
|
Креатинин (мкмоль/л) |
44—160 |
44—160 |
|
Щелочная фосфатаза (ед. |
10—92 |
21—538 |
|
Кальций (ммоль/л) |
1.9—2.6 |
2.1—3.3 |
|
Фосфор (ммоль/л) |
0.9—2.5 |
1.45—3.3 |
Отклонения
Общий анализ
|
Показатель |
Выше нормы |
Ниже нормы |
|
Гемоглобин Гематокрит Эритроциты Эритроцитарные индексы |
Обезвоживание Гипоксия (заболевания легких, сердца) Опухоли ККМ |
Анемия хронических заболеваний Хроническая болезнь почек Потеря крови Гемолиз Дефицит железа Заболевания костного мозга Длительное голодание |
|
Лейкоциты |
Инфекции (бактериальные, вирусные) Недавний прием пищи Беременность Общий воспалительный процесс |
Инфекции (например парвовирусный энтерит) Иммуносупрессия Заболевания костного мозга Кровотечение |
|
Нейтрофилы палочкоядерные |
Острое воспаление Острая инфекция |
— |
|
Нейтрофилы сегментоядерные |
Хроническое воспаление Хроническая инфекция |
Заболевания ККМ Потеря крови Некоторые инфекции |
|
Моноциты |
Инфекция Опухоли Раны |
Заболевания ККМ Кровопотеря Иммуносупрессия |
|
Лимфоциты |
Инфекции Опухоли (в т. |
Заболевания ККМ Кровопотеря Иммуносупрессия Вирусные инфекции |
|
Тромбоциты |
Перенесенные недавно кровопотери/травмы Заболевания ККМ Обезвоживание |
Потеря крови Гемолитические вещества (отравления, некоторые препараты) Заболевания ККМ Нарушение преаналитики |
Биохимический анализ
|
Показатель |
Выше нормы |
Ниже нормы |
|
Альбумин |
Обезвоживание |
Печеночная недостаточность Энтеропатия или нефропатия с потерей белка Инфекции Обширные поражения кожи (Пиодерма, атопия, экземы) Недостаточное поступление белка Выпоты/отеки Потеря крови |
|
АЛТ |
Атрофия печени Дефицит пиридоксина |
Гепатопатия (неоплазия, гепатит, липидоз печени и др. Гипоксия Отравление Панкреатит Травмы |
|
АСТ |
Атрофия печени Дефицит пиридоксина |
Гепатопатия Отравление/интоксикация Применение кортикостероидов Гипоксия Травма Гемолиз Панкреатит |
|
Альфа-амилаза |
— |
Обезвоживание Панкреатит Заболевания почек Энтеропатии/разрыв кишечника Гепатопатии Прием кортикостероидов |
|
Билирубин |
— |
Гемолиз Заболевания печени и желчного пузыря |
|
ГГТ |
— |
Заболевания печени и желчного пузыря |
|
Глюкоза |
Голодание Опухоли Сепсис Печеночная недостаточность Поздние сроки беременности |
Диабет Беспокойство/страх Гепатокожный синдром Гипертиреоидизм Инсулинорезистентность (при акромегалии, гиперадренокортицизме и др. |
|
Мочевина |
Печеночная недостаточность Потеря белка Асцит Голодание |
Обезвоживание/гиповолемия/шок Ожоги Почечная недостаточность и другие поражения почек Отравления |
|
Креатинин |
Беременность Гипертиреоидизм Кахексия |
Обезвоживание/гиповолемия Заболевания почек Сердечная недостаточность Высокое поступление белка (мясное кормление) |
|
Щелочная фосфатаза |
— |
Заболевания печени и желчного пузыря Терапия антиконвульсантами Панкреатит Молодой возраст Заболевания зубов Заболевания костей (резорбция, переломы) Опухоли |
Как проходит забор крови?
У кошек берут кровь из передней или задней лапы, в зависимости от темперамента питомца и для удобства для врача.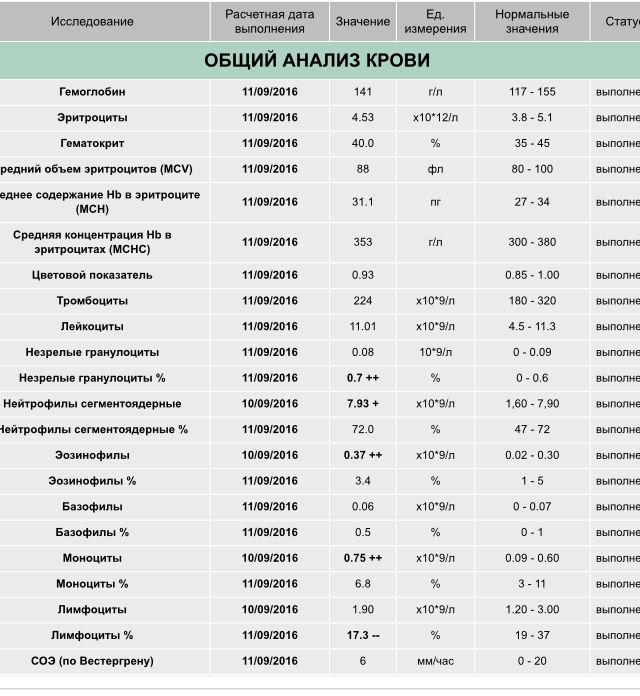
Перед взятием анализа место введения обрабатывают спиртом, на конечность накладывают жгут, после чего собирают необходимые анализы в пробирки.
Самое важное в этом деле — максимально снизить стресс у кошки. Гладьте ее, успокаивайте. Хоть сама процедура и неболезненная, кошки — существа свободолюбивые и, как правило, не терпят любых вмешательств. Если не удается успокоить любимицу лаской, врач поможет зафиксировать ее при помощи специальных средств (фиксационная сумка, одеяло, защитный воротник).
Как подготовить кошку к процедуре?
Перед анализом нужно выдержать голод. Для взрослых кошек голод должен составлять 8—10 часов. Котятам не стоит голодать более 8 часов, поэтому для них достаточно выдержать 6 часов без еды. Пить воду перед анализами крови можно в неограниченном объеме.
Ответы на часто задаваемые вопросы
Статья была полезна?
Спасибо, давайте дружить!
Подписывайтесь на наш Инстаграмм
ПодписатьсяСпасибо за обратную связь!
Давайте дружить — скачайте приложение Petstory
Беременность и преэклампсия влияют на субпопуляции моноцитов у людей и крыс
Введение
Во время беременности иммунная система матери адаптируется к полуаллогенным плодам [1], [2]. Основное изменение связано со значительной активацией врожденной иммунной системы, что выражается в увеличении количества моноцитов периферической крови [3]–[7]. Начиная со второго триместра эти клетки также проявляют активированный фенотип, сравнимый с наблюдаемым при системном сепсисе [7]–[11].Согласно Номенклатурному комитету Международного союза иммунологических обществ [12] моноциты человека состоят из 3 подмножеств и, по-видимому, выполняют разные функции [13]. Неизвестно, являются ли изменения в количестве и поведении моноцитов во время беременности результатом изменений в субпопуляциях моноцитов, и это является предметом настоящего сообщения.
Основное изменение связано со значительной активацией врожденной иммунной системы, что выражается в увеличении количества моноцитов периферической крови [3]–[7]. Начиная со второго триместра эти клетки также проявляют активированный фенотип, сравнимый с наблюдаемым при системном сепсисе [7]–[11].Согласно Номенклатурному комитету Международного союза иммунологических обществ [12] моноциты человека состоят из 3 подмножеств и, по-видимому, выполняют разные функции [13]. Неизвестно, являются ли изменения в количестве и поведении моноцитов во время беременности результатом изменений в субпопуляциях моноцитов, и это является предметом настоящего сообщения.
Новая классификация моноцитов основана на экспрессии CD14 (рецептор липополисахарида) и CD16 (Fcγ-рецептор III) [12].CD14-hi CD16-neg моноциты обычно называют «классическим подмножеством». Классические моноциты связаны с экстравазацией и воспалением. После проникновения в ткани эти моноциты превращаются в макрофаги и способствуют элиминации патогенов и заживлению ран [14]. Моноциты CD14-lo CD16-hi обычно называют «неклассической подгруппой», а моноциты CD14-hi CD16-int — «промежуточной подгруппой». Предполагается, что промежуточное подмножество является переходной популяцией между классическим и неклассическим подмножествами [12] и часто группируется вместе с неклассическим подмножеством в литературе, вместе также называемым неклассическим подмножеством.Функция промежуточного подмножества неизвестна, но считается, что комбинированные неклассические и промежуточные подмножества восполняют резидентные в тканях макрофаги и дендритные клетки [14] и, как было показано, продуцируют провоспалительные цитокины [12], [15]. Их провоспалительная ассоциация также иллюстрируется тем фактом, что их количество увеличивается при воспалительных состояниях, таких как сепсис [12], [16], [17].
Моноциты CD14-lo CD16-hi обычно называют «неклассической подгруппой», а моноциты CD14-hi CD16-int — «промежуточной подгруппой». Предполагается, что промежуточное подмножество является переходной популяцией между классическим и неклассическим подмножествами [12] и часто группируется вместе с неклассическим подмножеством в литературе, вместе также называемым неклассическим подмножеством.Функция промежуточного подмножества неизвестна, но считается, что комбинированные неклассические и промежуточные подмножества восполняют резидентные в тканях макрофаги и дендритные клетки [14] и, как было показано, продуцируют провоспалительные цитокины [12], [15]. Их провоспалительная ассоциация также иллюстрируется тем фактом, что их количество увеличивается при воспалительных состояниях, таких как сепсис [12], [16], [17].
У крыс такое же подразделение подмножеств моноцитов, как и у людей, можно провести на основе маркера CD43 [18].Было обнаружено, что подмножество CD43-lo похоже на классическое подмножество, а подмножество CD43-hi похоже на неклассическое подмножество у людей [14]. Таким образом, крыса потенциально может служить моделью для изучения субпопуляций моноцитов во время беременности.
Таким образом, крыса потенциально может служить моделью для изучения субпопуляций моноцитов во время беременности.
В настоящем исследовании мы исследовали субпопуляции моноцитов в периферической крови беременных и небеременных женщин и крыс. Мы предположили, что, поскольку беременность считается провоспалительным состоянием, в этом состоянии, в частности, будут увеличены неклассические/промежуточные моноциты.В дополнение к здоровой беременности мы также исследовали субпопуляции моноцитов у субъектов с преэклампсией, серьезным осложнением беременности с неизвестной этиологией и лишь частично известным патогенезом [19]. Это заболевание возникает в плаценте, которая содержит участки ишемии. Циркулирующие в материнской крови факторы, продуцируемые ишемизированной плацентой, вызывают дисфункцию эндотелия и системные воспалительные реакции, приводящие к клиническим проявлениям заболевания: артериальной гипертензии, протеинурии и отекам [20].Системный воспалительный ответ отражается значительным увеличением моноцитов периферической крови и измененным статусом активации этих моноцитов по сравнению со здоровой беременностью [21]–[26].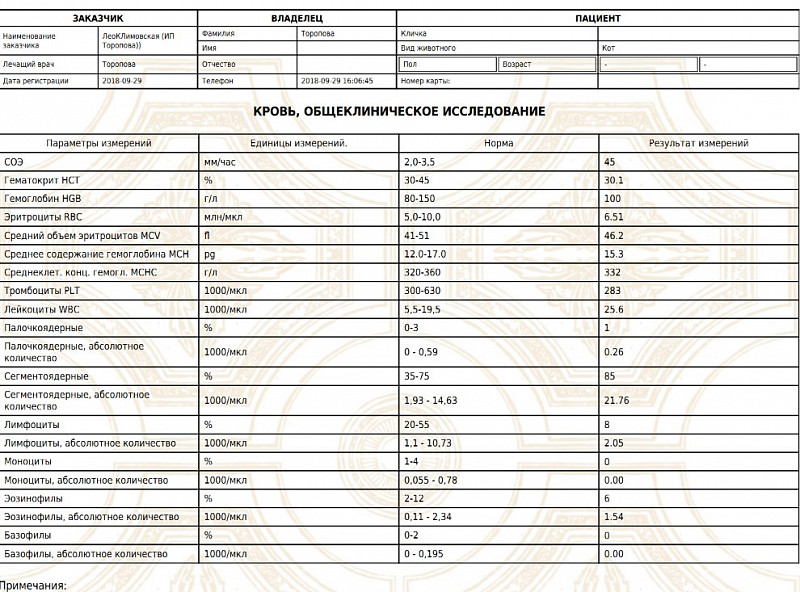 Поэтому мы предположили, что во время преэклампсии неклассические/промежуточные моноциты могут быть даже дополнительно увеличены по сравнению с нормальной беременностью.
Поэтому мы предположили, что во время преэклампсии неклассические/промежуточные моноциты могут быть даже дополнительно увеличены по сравнению с нормальной беременностью.
Изменения моноцитов при преэклампсии могут быть результатом наличия провоспалительных факторов. Одним из провоспалительных факторов, обнаруживаемых в крови женщин с преэклампсией, является аденозинтрифосфат (АТФ) [28].Ранее мы показали, что инфузия АТФ беременным крысам оказывает провоспалительное действие и вызывает симптомы, подобные преэклампсии [29]. Следовательно, АТФ может быть фактором, влияющим на субпопуляции моноцитов у беременных. Таким образом, мы также изучали, может ли введение беременным крысам провоспалительного стимулятора АТФ вызывать изменения в субпопуляциях моноцитов, подобные тем, которые наблюдаются при преэклампсии у человека.
Показано, что моноциты инфильтрируют децидуальную оболочку с наступлением беременности и развиваются в регуляторные макрофаги и незрелые дендритные клетки [30]–[34].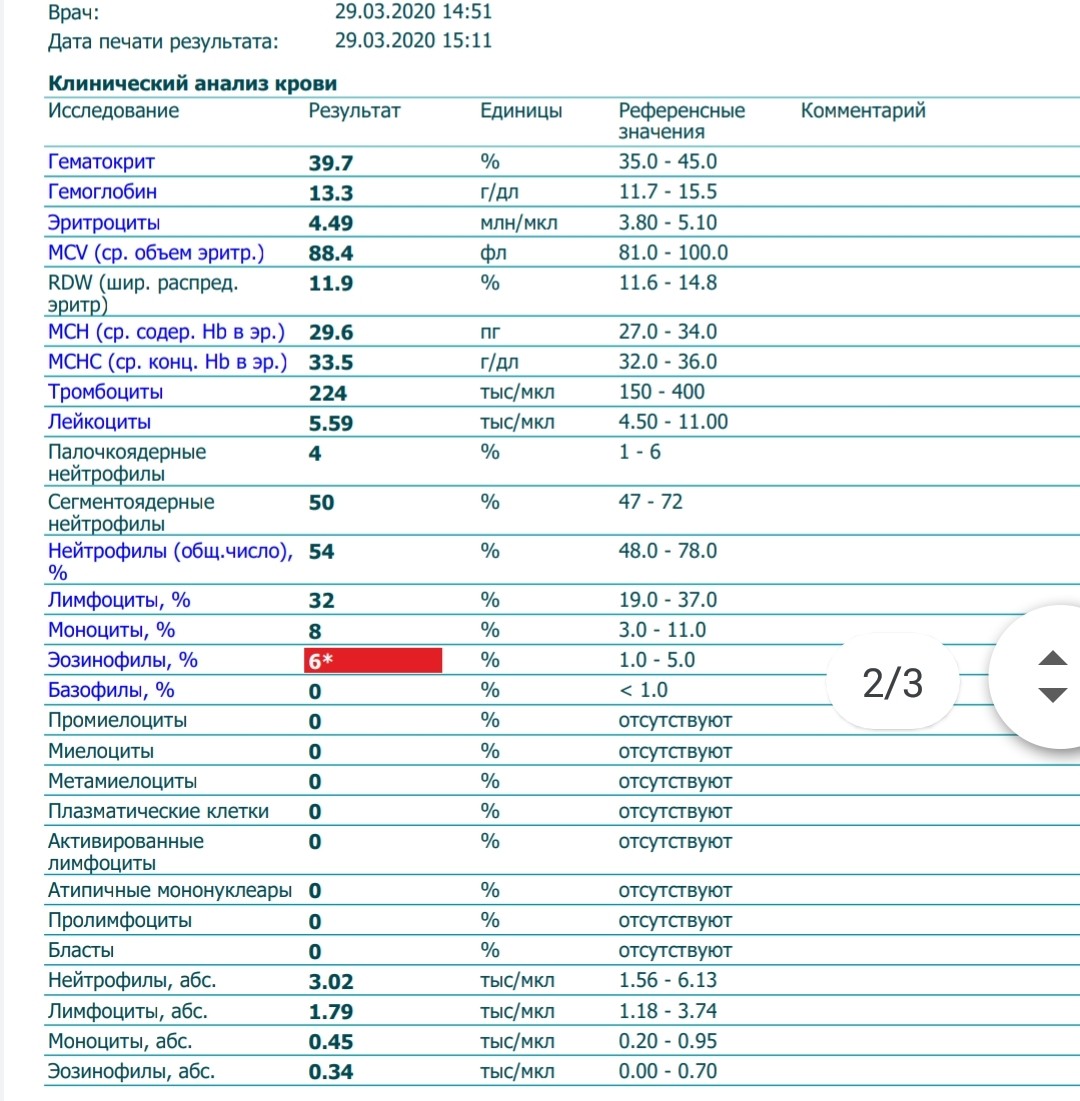 Было постулировано, что эти макрофаги необходимы для правильного ремоделирования спиральных артерий и индукции толерантности плода [32], [35], [36], но неизвестно, развиваются ли они из одной конкретной подгруппы моноцитов. Поэтому мы также исследовали плаценты этих беременных крыс, чтобы оценить, повлияет ли АТФ на количество регуляторных макрофагов в децидуальной оболочке.
Было постулировано, что эти макрофаги необходимы для правильного ремоделирования спиральных артерий и индукции толерантности плода [32], [35], [36], но неизвестно, развиваются ли они из одной конкретной подгруппы моноцитов. Поэтому мы также исследовали плаценты этих беременных крыс, чтобы оценить, повлияет ли АТФ на количество регуляторных макрофагов в децидуальной оболочке.
Материалы и методы
Заявление об этике
Настоящее исследование на людях было проведено после одобрения Комитета по медицинской этике (номер заявки NL25930.042.08) в Университетском медицинском центре Гронингена. От всех участников были получены подписанные формы информированного согласия.
Все эксперименты на животных были одобрены Институциональным комитетом по уходу и использованию животных Гронингенского университета (номер заявки DEC-4270C). Все операции проводились под изофлюрановой/кислородной анестезией, и были предприняты все усилия для минимизации страданий, включая использование бупренорфина для обезболивания после операции.
Пациенты
Пациентки с ранней преэклампсией (n = 26) и здоровые беременные контрольной группы (n = 23) были набраны из дородового отделения Университетского медицинского центра Гронингена.Преэклампсия определялась в соответствии со стандартами Международного общества по изучению артериальной гипертензии у беременных (ISSHP): диастолическое артериальное давление 90 мм рт. ст. или более в двух или более последовательных случаях с интервалом более 4 часов и протеинурия более 300 мг/24. часов [37]. Мы включили женщин с ранним началом преэклампсии, определяемой как начало преэклампсии до 34 недель. Образцы крови были взяты у небеременных женщин, а также у пациенток с преэклампсией и здоровых беременных женщин между 28 и 32 неделями беременности.Небеременные женщины (n = 19) были набраны из персонала больниц и студентов. Критериями исключения для всех групп были предсуществующая артериальная гипертензия, сахарный диабет, васкулит, заболевание почек, аутоиммунное заболевание, злокачественные новообразования или женщины, недавно перенесшие травму или операцию.
Образцы материнской крови как беременных женщин, так и женщин с преэклампсией были собраны во время обычного забора крови. Образцы крови брали из локтевой вены в пробирки объемом 10 мл, содержащие ЭДТА (Venoject, Terumo Europe NV, Левен, Бельгия).Образцы были немедленно подготовлены для проточной цитометрии. См. характеристики пациентов.
Таблица 1
Характеристики небеременных, здоровых беременных и женщин с преэклампсией.
| Небеременные (n = 19) | Беременные (n = 23) | Преэклампсия (n = 26) | ||
| Возраст матери (лет) | 26,5 (23–35) | 30 (21–39) | 30 (23–40) | |
| Кавказец | 19 | 23 | 26 | |
| Забор крови | ||||
Гестационный возраст (нед.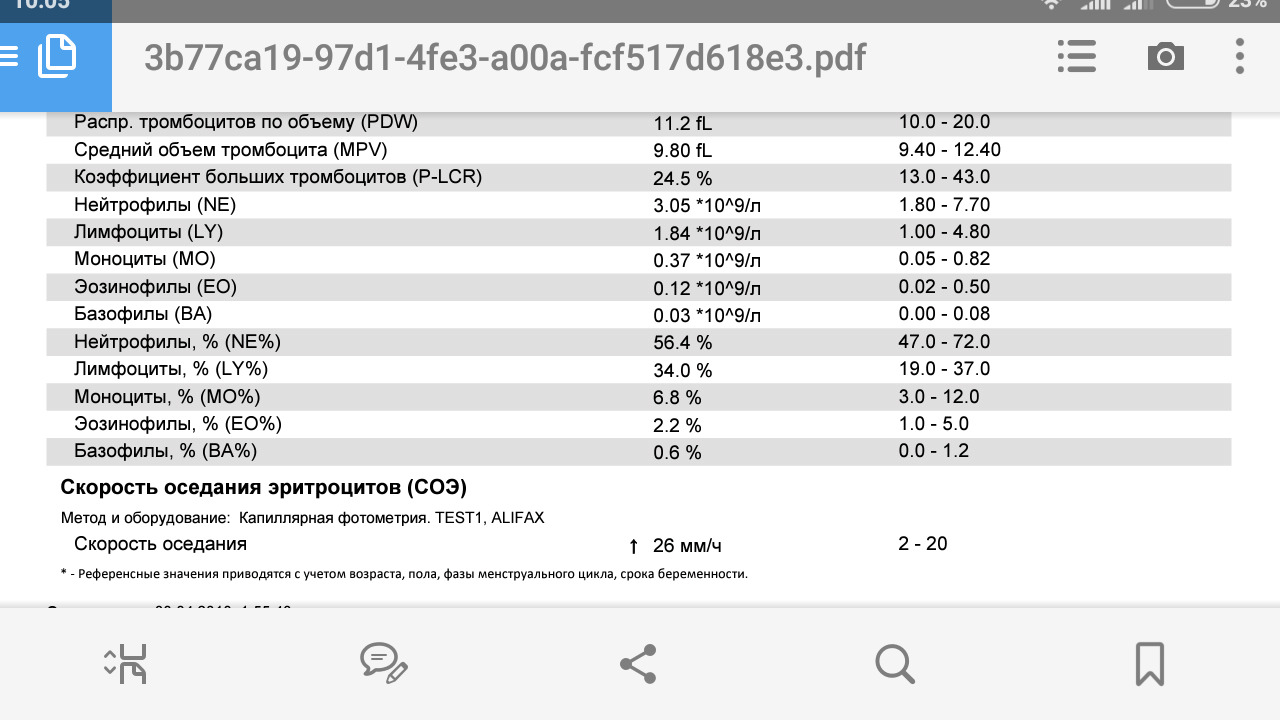 ) ) | NA | 29.8 (28-32) | 30 (23-31,0) | |
| Систолическое артериальное давление (ММГГ) | ND | ND * | 160 (140-200) | |
| Диастолическое артериальное давление (MMHG ) | ND | ND | *105 (90-115) | |
| Протеинурия (G / 24 HR) | ND | ND * | 1. 1 (0.3-7.1) 1 (0.3-7.1) | |
| Доставка | ||||
| Гестационный возраст (нед.) | NA | 40 (38.4-42) | 30.6 (25.8-34.3) # | |
| вес рождения (G) | Na | 3570 (2820-4430) | 1123.5 (530-2000) # |
Лейкоциты counts
Перед окрашиванием клеток для проточной цитометрии часть (500 мкл) образцов крови человека использовали для определения общего числа лейкоцитов крови. Лейкоциты подсчитывали с использованием счетчика микроклеток (модель Sysmex PocH 100i, Sysmex Netherlands, Etten-Leur, Нидерланды).
Лейкоциты подсчитывали с использованием счетчика микроклеток (модель Sysmex PocH 100i, Sysmex Netherlands, Etten-Leur, Нидерланды).
Окрашивание крови человека для проточной цитометрии
Все образцы крови были немедленно разведены RPMI-1640 (1∶1) и инкубированы с PE-конъюгированными антителами к CD16 (Biolegend, Uithoorn, Нидерланды) и с FITC-конъюгированными анти-CD16 антителами. -CD14-антитела (Биолегенда) на 30 минут в темноте.Затем эритроциты лизировали с использованием лизирующего раствора BD FACS TM (BD Biosciences, Бреда, Нидерланды) в течение 5 минут. Затем клетки дважды промывали (1% раствором бычьего сывороточного альбумина в PBS), фиксировали 2% раствором параформальдегида и выдерживали в темноте при 4°С (не более суток) до проведения FACS-анализа. Все этапы проводились при комнатной температуре.
Сбор и оценка данных
Данные были собраны на проточном цитометре BD LSR II (BD Biosciences) и проанализированы с использованием программного обеспечения FlowJo (Tree star, Inc. , Ашленд, Орегон, США). Для каждого анализа было подсчитано не менее 200 000 событий.
, Ашленд, Орегон, США). Для каждого анализа было подсчитано не менее 200 000 событий.
В стратегии гейтирования, используемой для анализа трех подмножеств моноцитов в крови человека, живые клетки были сначала выбраны из графика прямого/бокового рассеяния (см. ). Затем моноциты отбирали из живых клеток на графике прямого/бокового рассеяния, а затем копировали на график CD14/CD16 (см. ). Были идентифицированы три подмножества: CD14-hi CD16-neg (классическое подмножество), CD14-lo CD16-hi (неклассическое подмножество) и CD14-hi CD16-int (промежуточное подмножество) (см. ).Рассчитывали процентное содержание трех популяций в популяции моноцитов (% моноцитов). Мы использовали официальную номенклатуру для трех подгрупп, но для сравнения с другими, более ранними публикациями, в которых не делалось различий между неклассическими и промежуточными моноцитами, мы также использовали комбинированную неклассическую/промежуточную подгруппу. Абсолютное количество моноцитов рассчитывали, используя количество лейкоцитов и процент моноцитов в популяции живых клеток.
Мертвые клетки исключали, выбирая все живые клетки на графике прямого/бокового рассеяния (A), после чего отбирали моноциты (B). Впоследствии клетки были нанесены на график их экспрессии CD14 и CD16, после чего можно было выбрать и проанализировать три отдельные субпопуляции моноцитов (классические, неклассические и промежуточные) (С).
Животные
Самки беспородных крыс линии Вистар (около 200 г) содержались в помещении с контролируемой температурой и светом (свет включен с 7:30 до 19:30) со свободным доступом к пище и воде.До отбора для экспериментов ежедневно брали вагинальные мазки, и крыс оплодотворяли, помещая их в период до эструса с фертильными самцами на одну ночь.
При обнаружении сперматозоидов в мазке на следующий день этот день обозначали как 0-й день беременности. Некоторым крысам в правую яремную вену вводили канюлю под изофлюрановой/кислородной анестезией, как описано ранее [38].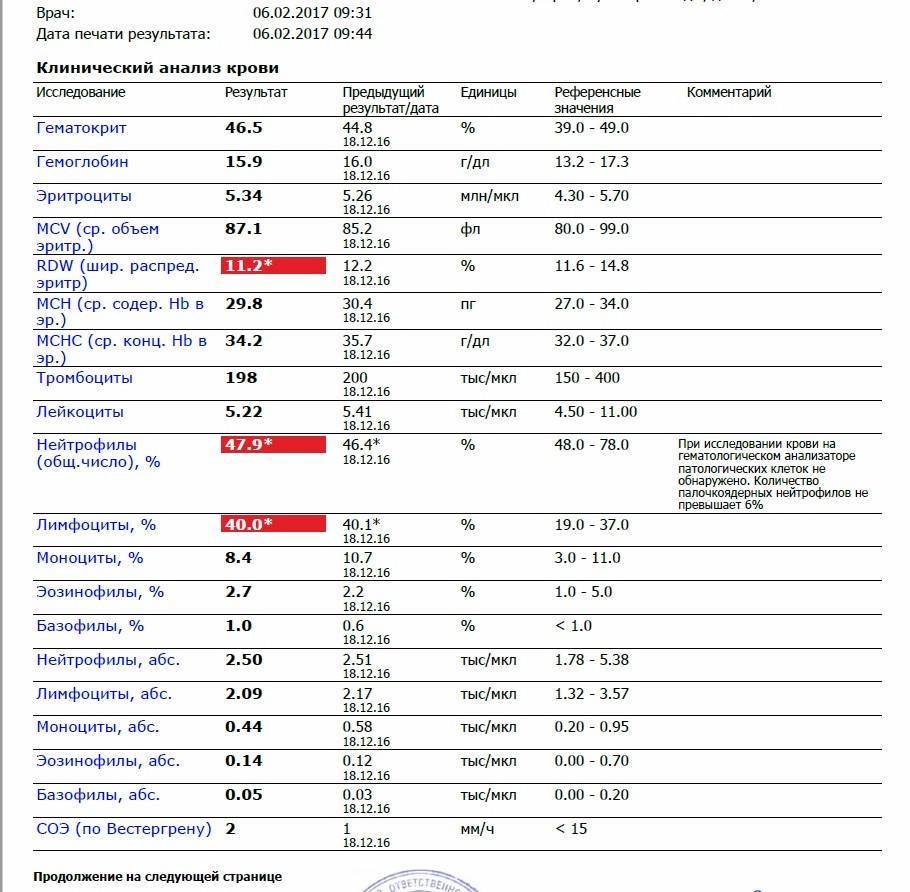 Эта канюля позволяет без стресса брать кровь и вливать ее. Были приложены все усилия, чтобы минимизировать страдания животных.
Эта канюля позволяет без стресса брать кровь и вливать ее. Были приложены все усилия, чтобы минимизировать страдания животных.
Экспериментальный дизайн Эксперимент на животных
В начальном эксперименте мы проверили, изменяются ли субпопуляции моноцитов при беременности крысы, как и при беременности человека. В этом эксперименте беременных (20-й день; n = 5) и небеременных (n = 5) крыс умерщвляли путем пункции аорты под анестезией (изофлуран/кислород). Образцы крови с ЭДТА были взяты для анализа количества лейкоцитов и проточной цитометрии.
Во втором эксперименте крысам вводили провоспалительный стимул АТФ [29], [39], чтобы оценить, увеличивает ли провоспалительный стимул во время беременности неклассическую субпопуляцию моноцитов.Беременным крысам вводили 3000 мкг/кг массы тела АТФ в 2,0 мл физиологического раствора (n = 9) или только 2,0 мл физиологического раствора (n = 7) на 14-й день беременности, как описано ранее [29]. Небеременным крысам вводили 3000 мкг/кг массы тела АТФ в 2,0 мл физиологического раствора (n = 6) или только физиологический раствор (n = 5) во время диэструса.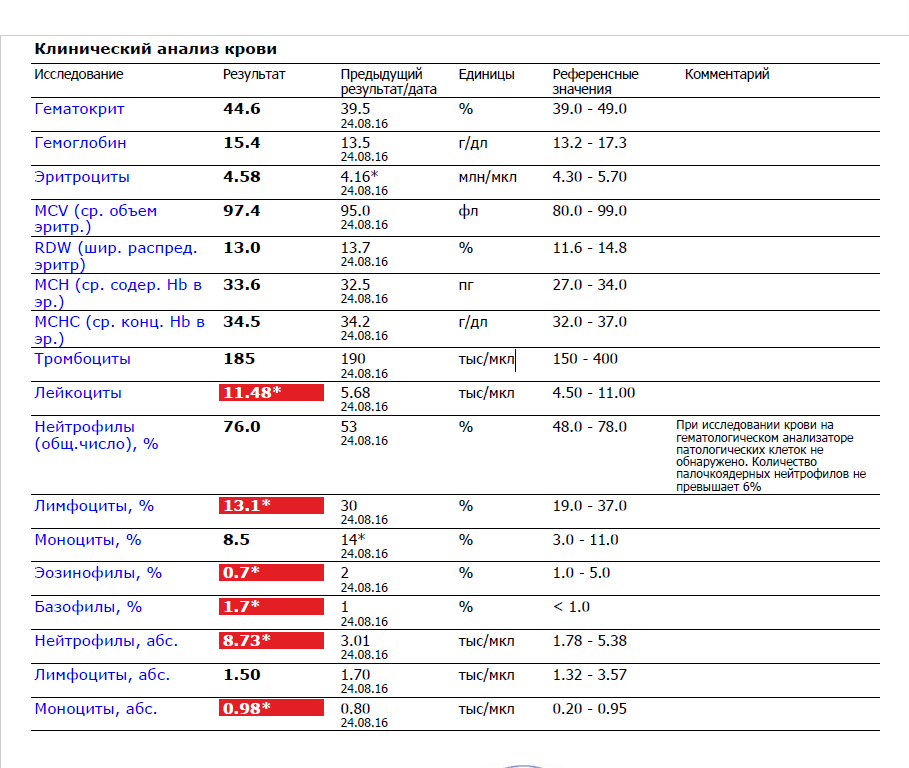 Для определения количества лейкоцитов и для проточной цитометрии образцы крови с ЭДТА (0,4 мл) брали из канюли яремной вены за 7 дней до (7-й день), за 1 день до (13-й день), через 1 день после (15-й день) и через 3 дня после (день 17) настой.Образцы крови брали на 20-й день во время умерщвления путем пункции аорты под анестезией (изофлуран/кислород). Во время умерщвления плаценты с мезометриальным треугольником отделяли от рога матки и фиксировали в параформальдегиде (4%) в течение 24 часов. Затем их переносили в спирт (70%) до заливки в парафин.
Для определения количества лейкоцитов и для проточной цитометрии образцы крови с ЭДТА (0,4 мл) брали из канюли яремной вены за 7 дней до (7-й день), за 1 день до (13-й день), через 1 день после (15-й день) и через 3 дня после (день 17) настой.Образцы крови брали на 20-й день во время умерщвления путем пункции аорты под анестезией (изофлуран/кислород). Во время умерщвления плаценты с мезометриальным треугольником отделяли от рога матки и фиксировали в параформальдегиде (4%) в течение 24 часов. Затем их переносили в спирт (70%) до заливки в парафин.
Подсчет лейкоцитов в крови крыс
Перед окрашиванием клеток для проточной цитометрии 20 мкл крысиной крови с ЭДТА разводили в 500 мкл буфера pOCH (Sysmex Netherlands) для подсчета лейкоцитов.Лейкоциты подсчитывали с использованием счетчика микроклеток (модель Sysmex PocH 100i, Sysmex Netherlands).
Окрашивание крови крыс для проточной цитометрии
Образцы цельной крови окрашивали для идентификации субпопуляций моноцитов (т. е. экспрессии CD172a и CD43), а у крыс из эксперимента 2 статус активации моноцитов также исследовали с использованием экспрессии CD4 и CD62L. Образцы промывали PBS и затем инкубировали с PE-конъюгированным анти-CD172a (Biolegend) и AlexaFluor647-конъюгированным анти-CD43 (Biolegend) для идентификации двух субпопуляций моноцитов (30 минут в темноте).Кроме того, образцы крыс из эксперимента 2 также инкубировали с FITC-конъюгированным анти-CD4 (BD Pharmingen) и PercP-конъюгированным анти-CD62L (Biolegend) или с изотипическими контролями для оценки состояния активации моноцитов. После инкубации с антителами клетки промывали 0,5 мл буфера FACS (PBS с 2% фетальной телячьей сывороткой и 1,3 мМ ЭДТА), эритроциты лизировали, а лейкоциты фиксировали путем инкубации с лизирующим раствором BD FACS TM (BD биологические науки) в течение 30 минут. Затем клетки дважды промывали, ресуспендировали в FACS-буфере и выдерживали в темноте при 4°C (не более суток) до проведения FACS-анализа.Все этапы проводились при комнатной температуре.
е. экспрессии CD172a и CD43), а у крыс из эксперимента 2 статус активации моноцитов также исследовали с использованием экспрессии CD4 и CD62L. Образцы промывали PBS и затем инкубировали с PE-конъюгированным анти-CD172a (Biolegend) и AlexaFluor647-конъюгированным анти-CD43 (Biolegend) для идентификации двух субпопуляций моноцитов (30 минут в темноте).Кроме того, образцы крыс из эксперимента 2 также инкубировали с FITC-конъюгированным анти-CD4 (BD Pharmingen) и PercP-конъюгированным анти-CD62L (Biolegend) или с изотипическими контролями для оценки состояния активации моноцитов. После инкубации с антителами клетки промывали 0,5 мл буфера FACS (PBS с 2% фетальной телячьей сывороткой и 1,3 мМ ЭДТА), эритроциты лизировали, а лейкоциты фиксировали путем инкубации с лизирующим раствором BD FACS TM (BD биологические науки) в течение 30 минут. Затем клетки дважды промывали, ресуспендировали в FACS-буфере и выдерживали в темноте при 4°C (не более суток) до проведения FACS-анализа.Все этапы проводились при комнатной температуре.
Сбор и оценка данных
Данные были собраны на проточном цитометре BD LSR II (BD Biosciences) и проанализированы с использованием программного обеспечения FlowJo (Tree star). На один анализ подсчитывали не менее 200 000 клеток.
В стратегии гейтирования, используемой для анализа субпопуляций моноцитов в крови крыс, сначала отбирали живые клетки из диаграммы прямого/бокового рассеяния (см. ). Из живых клеток были нарисованы широкие ворота вокруг моноцитов (крысиные моноциты часто не являются отдельной популяцией в прямом/боковом рассеянии, поэтому, чтобы убедиться, что все моноциты включены, мы решили установить более широкие ворота в прямом/боковом рассеянии). и копировали на точечный график, на котором классические (CD43-lo) и неклассические (CD43-hi) моноциты идентифицировали на основе экспрессии CD43 и CD172a (см.).
Стратегия гейтирования методом проточной цитометрии субпопуляций моноцитов в периферической крови крыс. Мертвые клетки и эритроциты были исключены путем выбора всех живых клеток из графика прямого/бокового рассеяния (A), после чего были выбраны широкие ворота вокруг моноцитов и гранулоцитов (B) и скопированы на график CD172a/CD43 ( С). Общая популяция моноцитов (используемая для расчета общего числа моноцитов) была выбрана из графика CD172a/CD43 (C) и впоследствии нанесена на новый график для расчета процентного содержания двух классических (CD43-lo) и неклассических (CD43-hi ) подмножества в общей популяции моноцитов (D).
Общая популяция моноцитов (используемая для расчета общего числа моноцитов) была выбрана из графика CD172a/CD43 (C) и впоследствии нанесена на новый график для расчета процентного содержания двух классических (CD43-lo) и неклассических (CD43-hi ) подмножества в общей популяции моноцитов (D).
Для анализа экспрессии CD4 и CD62L на субпопуляциях моноцитов образцы крови, окрашенные изотипическими контролями, использовали для установки ворот, которые для каждой флуоресцентной метки (FITC для CD4 и PercP для CD62L) содержали не более 1% популяции. Затем этот гейт копировали в образцы, окрашенные CD4 и CD62L, после чего рассчитывали среднюю интенсивность флуоресценции (MFI) экспрессии CD4 и CD62L на моноцитах.
На основании этих данных рассчитывали либо процент моноцитов определенного подмножества в общем количестве моноцитов (% моноцитов), либо процент подмножества моноцитов во всей живой популяции (% живых).На крысу рассчитывали процентное отклонение от 13-го дня. Абсолютное количество моноцитов рассчитывали, используя количество лейкоцитов и процентное содержание клеток CD172a+ в популяции живых клеток.
Иммуногистохимия CD68 и CD206
Общее количество макрофагов/моноцитов и М2-подобных макрофагов идентифицировали путем окрашивания на CD68 (разведение 1∶100, клон ED1, AbD Serotec, Дюссельдорф, Германия) и CD206 (разведение 1∶1000; Abcam, Кембридж) , Великобритания) соответственно по стандартным методикам. Короче говоря, фиксированные параформальдегидом (4%) парафиновые срезы (4 мкм) плаценты крыс, которым вводили физиологический раствор или АТФ, депарафинизировали и инкубировали в 10 мМ Трис/1 мМ ЭДТА-буфере, рН = 9 (для CD68, 15 мин.) или в 10 мМ цитратном буфере pH = 6 (для CD206, 10 мин) при 100°C для поиска антигена. После инкубации с 10% нормальной козьей сывороткой (30 мин) в качестве первого этапа (60 мин) использовали антитела мыши против CD68 или кролика против CD206. Срезы промывали PBS (pH = 7,2) и активность эндогенной пероксидазы блокировали 3% H 2 O 2 в метаноле, а активность эндогенного авидина/биотина блокировали набором для блокирования биотина (Dako, Heverlee, Бельгия). После промывания PBS в качестве второй стадии (30 мин) добавляли конъюгированные с биотином козьи антимышиные антитела (для CD68, Southern Biotech, Бирмингем, Алабама, США) и биотинконъюгированные козьи антимышиные антитела (для CD206, Dako). .). Срезы промывали PBS, добавляли конъюгированный с пероксидазой стрептавидин (Dako) (30 мин) и затем окрашивание визуализировали с помощью 3-амино-9-этилкарбазола. Для окрашивания ядер использовали гематоксилин. Все этапы инкубации процедур окрашивания проводились при комнатной температуре. Контрольные срезы, которые были последовательно отрицательными, были срезами, инкубированными без первого антитела.
После промывания PBS в качестве второй стадии (30 мин) добавляли конъюгированные с биотином козьи антимышиные антитела (для CD68, Southern Biotech, Бирмингем, Алабама, США) и биотинконъюгированные козьи антимышиные антитела (для CD206, Dako). .). Срезы промывали PBS, добавляли конъюгированный с пероксидазой стрептавидин (Dako) (30 мин) и затем окрашивание визуализировали с помощью 3-амино-9-этилкарбазола. Для окрашивания ядер использовали гематоксилин. Все этапы инкубации процедур окрашивания проводились при комнатной температуре. Контрольные срезы, которые были последовательно отрицательными, были срезами, инкубированными без первого антитела.
Морфометрический анализ иммуногистохимического окрашивания
Срезы, окрашенные на CD68 и CD206, сканировали с помощью Aperio ScanScope CS и анализировали с помощью Aperio ImageScope v10.2.2.2319 (Аперио, Виста, Калифорния, США). Алгоритм «Подсчет положительных пикселей V9» использовали для анализа CD68 или CD206-положительных (красных) пикселей, а также общего количества неокрашенных пикселей ткани как в децидуальной оболочке, так и в мезометриальном треугольнике (сопоставимом с плацентарным ложем человека) плаценты крысы. Впоследствии эти данные использовали для расчета процентного содержания CD68 или CD206-позитивной ткани в каждом из двух компартментов.
Впоследствии эти данные использовали для расчета процентного содержания CD68 или CD206-позитивной ткани в каждом из двух компартментов.
Статистический анализ
Для статистического анализа различий в субпопуляциях моноцитов в образцах крови человека мы использовали непараметрический критерий Краскела-Уоллиса с последующим U-тестом Манна-Уитни.Для проверки различий между подмножествами моноцитов в первом эксперименте с крысами и проверки различий в окрашивании на CD68 и CD206 также выполняли U-тест Манна-Уитни. Для статистического анализа лонгитюдных данных во втором эксперименте на крысах были проведены непараметрические тесты повторных измерений Фридмана, а затем посттесты Данна, сравнивающие значения до инфузии на 13-й день со значениями на 15-й, 17-й или 20-й день после инфузии. Различия считались значимыми, если р<0,05, и статистической тенденцией, если р<0.1. Данные представлены в виде медианы с указанием диапазона или интерквартильного диапазона.
Результаты
Субпопуляции моноцитов периферической крови человека у беременных и женщин с преэклампсией
По сравнению с небеременными женщинами у здоровых беременных женщин было обнаружено значительно более высокое количество лейкоцитов, и даже больше у женщин с преэклампсией по сравнению со здоровыми беременными женщинами () . Кроме того, общее количество моноцитов было значительно выше у здоровых беременных женщин по сравнению с небеременными женщинами.
Кроме того, общее количество моноцитов было значительно выше у здоровых беременных женщин по сравнению с небеременными женщинами.
Таблица 2
Количество лейкоцитов и моноцитов в образцах периферической крови небеременных, здоровых беременных и женщин с преэклампсией.
| Небеременные (n = 19) | Беременные (n = 23) | Преэклампсия (n = 26) | |||||
| Число лейкоцитов (×10 9 клеток/л) | 6,5 (4,2–11,2) | 8.5 (5,8–14,2)# | 10,5 (6,1–18,2)* | ||||
| Всего моноцитов Count (× 10 9 клетки / л) ** | 0,3 (0,1-0,8) | 0,6 (0,4-0,9) ∧ | 0,5 (0. 1-1.1) 1-1.1) |
| Небеременные (n = 5) | Беременные (n = 5) | |
| Количество лейкоцитов (×10 9 клеток/л) | 3,2 (2,1–5,1) | 5,6 (3,7–7,0)# |
| Всего моноцитов количество (×10 9 клеток/л) ** | 0. 13 (0,07–0,49) 13 (0,07–0,49) | 0,57 (0,29–0,59)* |
Влияние провоспалительной АТФ на субпопуляции моноцитов во время беременности крыс
Поскольку беременность и преэклампсия являются провоспалительными состояниями, мы исследовали во втором эксперименте мог ли провоспалительный стимул во время беременности вызывать увеличение неклассических моноцитов, наблюдаемое при беременности и преэклампсии человека. В качестве провоспалительного стимула мы использовали АТФ, так как его уровень повышается при преэклампсии [28] и индуцирует симптомы, подобные преэклампсии, у беременных крыс [29].
В качестве контроля использовали беременных крыс, которым вводили физиологический раствор, что позволило изучить ход изменений субпопуляций моноцитов во время беременности. показывают, что моноциты CD43-lo существенно не различаются между беременными и небеременными животными в течение беременности (сравнения были проведены между беременными крысами, получавшими физиологический раствор, и небеременными крысами, получавшими физиологический раствор), и что моноциты CD43-hi выше у беременных крыс со дня 13 и далее.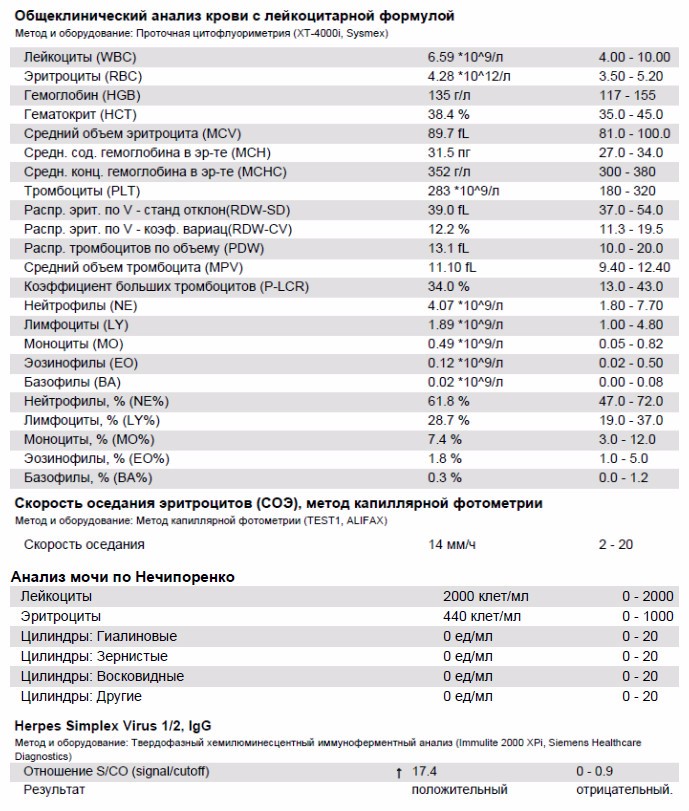
Никаких изменений в классических моноцитах (в процентах от живых клеток) (A) не было обнаружено после инфузии АТФ (сплошная линия, сплошные символы) или физиологического раствора (пунктирная линия, незаштрихованные символы) между беременными (Pr, квадраты) и небеременными (NP, кружки) крысам, которым вводили на 14-й день беременности, тогда как процент неклассических моноцитов (Б) увеличивался после введения АТФ только у беременных крыс. Показаны медианы с межквартильным диапазоном, *p<0,05 в тесте повторных измерений Фридмана с последующим посттестом Данна по сравнению с 13-м днем (до инфузии).a = p<0,05 и b = p<0,1 в солевом растворе для беременных по сравнению с физиологическим раствором для небеременных при тестировании с Университетом Манна Уитни в тот же день. НП + физиологический раствор n = 5; НП + АТФ n = 6; Пр + физиологический раствор n = 7; Pr + АТФ n = 9.
Не наблюдалось влияния инфузии АТФ по сравнению с инфузией физиологического раствора на процент подмножеств моноцитов у небеременных крыс ().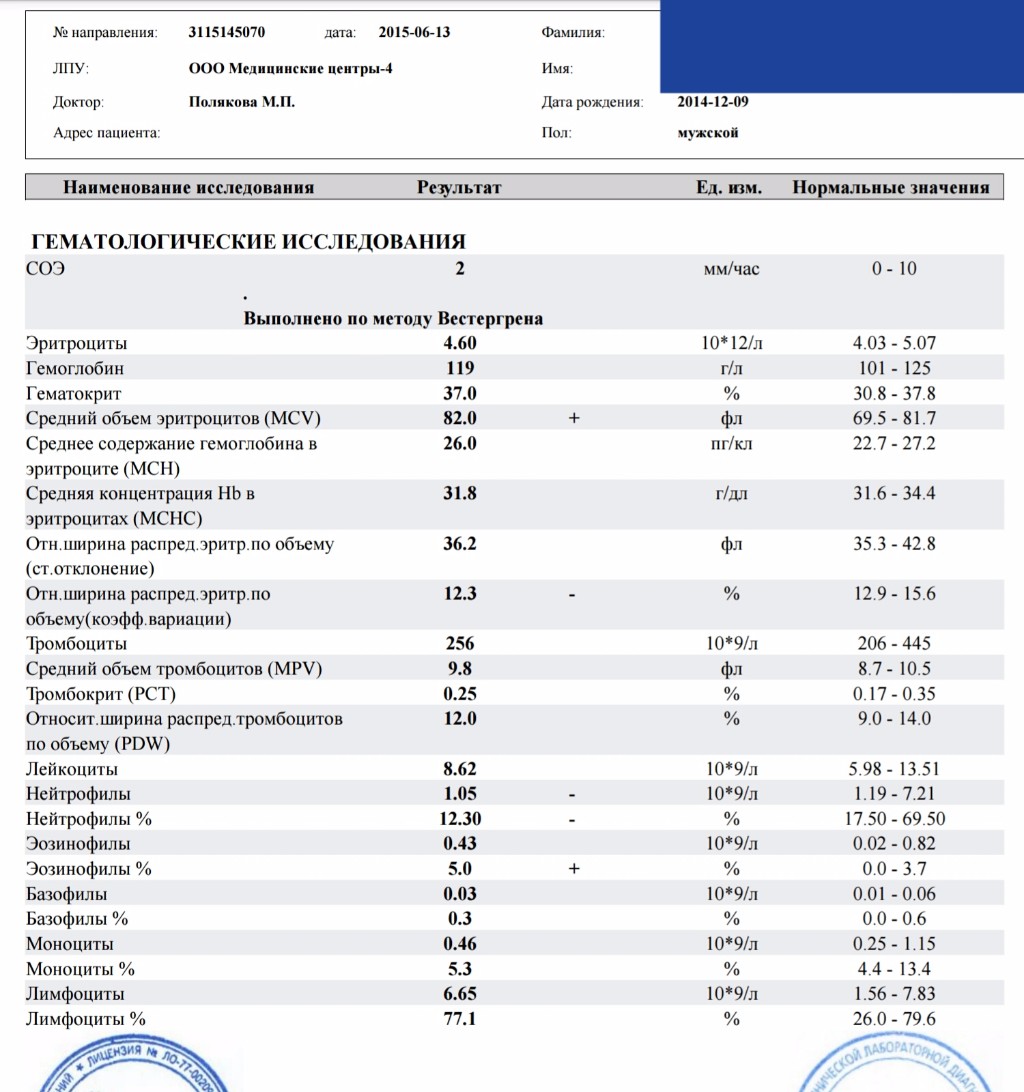 Однако у беременных крыс инфузия АТФ индуцировала значительное увеличение процентного содержания неклассических моноцитов на 17-й и 20-й день беременности по сравнению с показателями до инфузии на 13-й день, в то время как у беременных животных, которым вводили физиологический раствор, такого значительного увеличения не наблюдалось. (р<0.05, ). Никаких изменений в процентном содержании классических моноцитов после инфузии АТФ или физиологического раствора у беременных или небеременных крыс обнаружено не было ().
Однако у беременных крыс инфузия АТФ индуцировала значительное увеличение процентного содержания неклассических моноцитов на 17-й и 20-й день беременности по сравнению с показателями до инфузии на 13-й день, в то время как у беременных животных, которым вводили физиологический раствор, такого значительного увеличения не наблюдалось. (р<0.05, ). Никаких изменений в процентном содержании классических моноцитов после инфузии АТФ или физиологического раствора у беременных или небеременных крыс обнаружено не было ().
Чтобы выяснить, активирует ли АТФ также моноциты, мы оценили экспрессию CD62L и CD4 до и после инфузии АТФ или физиологического раствора у беременных крыс и у небеременных крыс. CD62L и CD4 являются маркерами ранней и поздней активации моноцитов крыс соответственно, и известно, что их экспрессия снижается после активации [21], [40]–[43]. Через сутки после введения АТФ беременным крысам экспрессия маркера ранней активации CD62L на неклассических моноцитах снижалась (тренд p<0.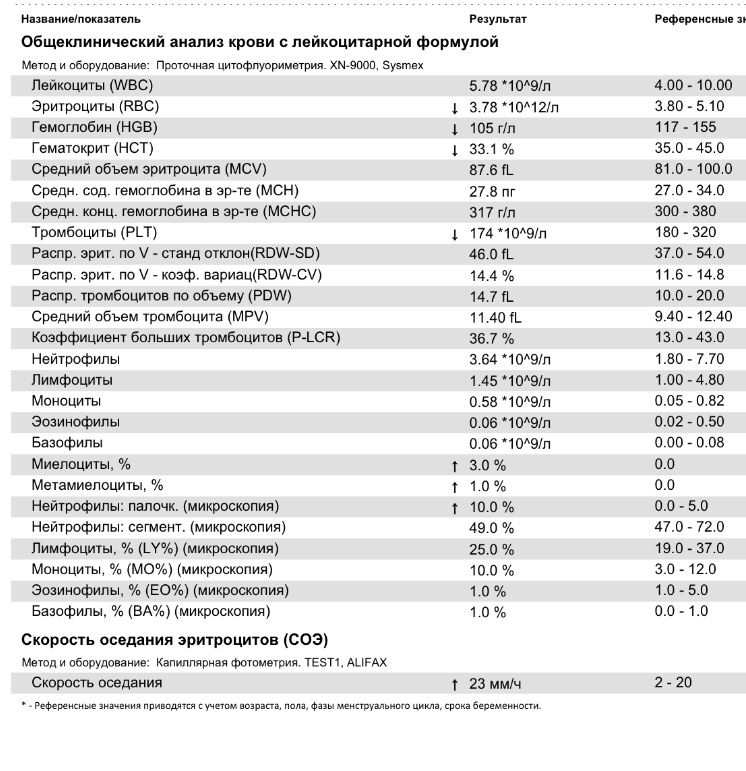 1 на 15-й день, ) по сравнению со значениями до инфузии. В более поздние моменты времени для этого маркера различий обнаружено не было. С другой стороны, экспрессия CD4 на неклассических моноцитах существенно не отличалась от значений до инфузии вскоре после инфузии АТФ (15-й и 17-й дни), но значительно снижалась на 20-й день (p<0,05 на 20-й день). Никаких изменений в экспрессии CD4 и CD62L не наблюдалось на классических моноцитах после инфузии АТФ или физиологического раствора беременным крысам (данные не представлены). Кроме того, не наблюдалось никаких эффектов экспрессии CD62L и CD4 ни на классические, ни на неклассические моноциты после инфузии АТФ или физиологического раствора у небеременных крыс (данные не представлены).
1 на 15-й день, ) по сравнению со значениями до инфузии. В более поздние моменты времени для этого маркера различий обнаружено не было. С другой стороны, экспрессия CD4 на неклассических моноцитах существенно не отличалась от значений до инфузии вскоре после инфузии АТФ (15-й и 17-й дни), но значительно снижалась на 20-й день (p<0,05 на 20-й день). Никаких изменений в экспрессии CD4 и CD62L не наблюдалось на классических моноцитах после инфузии АТФ или физиологического раствора беременным крысам (данные не представлены). Кроме того, не наблюдалось никаких эффектов экспрессии CD62L и CD4 ни на классические, ни на неклассические моноциты после инфузии АТФ или физиологического раствора у небеременных крыс (данные не представлены).
Активацию неклассических моноцитов оценивали по более низкой средней интенсивности флуоресценции (MFI) двух маркеров активации, CD62L (A, маркер ранней активации) и CD4 (B, маркер поздней активации) [21], [40].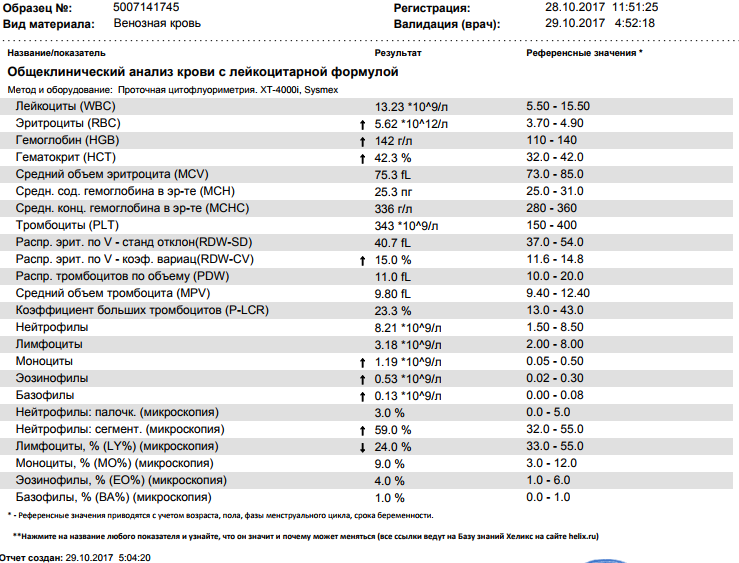 Снижение экспрессии CD62L было обнаружено у крыс, получавших АТФ, только на неклассических моноцитах на 15-й день (тренд) беременности по сравнению с 13-м днем до инфузии, в то время как экспрессия CD4 на неклассических моноцитах была снижена на 20-й день беременности по сравнению с днем до инфузии. 13 в той же экспериментальной группе.Показаны процентные отклонения от 13-го дня до инфузии. Показаны медианы с межквартильным диапазоном, #p<0,1 (тренд), *p<0,05 в тесте повторных измерений Фридмана с последующим посттестом Данна по сравнению с 13-м днем (до инфузии). НП + физиологический раствор n = 5; НП + АТФ n = 6; Пр + физиологический раствор n = 7; Pr + АТФ n = 9.
Снижение экспрессии CD62L было обнаружено у крыс, получавших АТФ, только на неклассических моноцитах на 15-й день (тренд) беременности по сравнению с 13-м днем до инфузии, в то время как экспрессия CD4 на неклассических моноцитах была снижена на 20-й день беременности по сравнению с днем до инфузии. 13 в той же экспериментальной группе.Показаны процентные отклонения от 13-го дня до инфузии. Показаны медианы с межквартильным диапазоном, #p<0,1 (тренд), *p<0,05 в тесте повторных измерений Фридмана с последующим посттестом Данна по сравнению с 13-м днем (до инфузии). НП + физиологический раствор n = 5; НП + АТФ n = 6; Пр + физиологический раствор n = 7; Pr + АТФ n = 9.
Влияние провоспалительной АТФ на общие и М2-подобные макрофаги в плаценте крысы плаценты, мы количественно определили процентное содержание общих макрофагов (CD68-положительные макрофаги) и M2-подобных/регуляторных макрофагов (CD206-положительные макрофаги) в децидуальной оболочке и мезометриальном треугольнике (сравнимо с плацентарным ложем человека) плаценты крыс, подвергавшихся воздействию физиологического раствора или АТФ ( путем количественного определения процента положительно окрашенной области от общей площади децидуального/мезометриального треугольника).

Большая часть окрашивания CD68-позитивных макрофагов была локализована в нижней части децидуальной оболочки, граничащей с трофоспонгием, в то время как в децидуальной оболочке было обнаружено лишь несколько CD206-позитивных макрофагов. Мы не обнаружили различий в процентной площади, окрашенной для CD68-позитивных и CD206-позитивных децидуальных макрофагов между крысами, которым вводили физиологический раствор и АТФ.
Суммарные и CD206-положительные макрофаги в плацентах беременных крыс, которым вводили физиологический раствор и АТФ. После инфузии АТФ (квадраты) в децидуальной оболочке (А) и мезометриальном треугольнике (В) не было обнаружено никаких изменений в общем количестве CD68-позитивных макрофагов (в процентах от положительно окрашенной ткани) по сравнению с инфузией физиологического раствора (кружки).Было обнаружено, что окрашивание CD206-позитивных макрофагов ниже в ткани мезометрия (D) крыс, получавших АТФ, по сравнению с физиологическим раствором. Не было обнаружено различий для CD206 в децидуальной ткани между АТФ и крысами, которым вводили физиологический раствор (С). Показаны медианы, #p<0,1; U-тест Манна-Уитни.
Не было обнаружено различий для CD206 в децидуальной ткани между АТФ и крысами, которым вводили физиологический раствор (С). Показаны медианы, #p<0,1; U-тест Манна-Уитни.
Макрофаги в мезометриальном треугольнике располагались по всему интерстицию и вокруг спиральных артерий. Мы не обнаружили различий в процентной площади, окрашенной для CD68-положительных мезометриальных макрофагов, между крысами, которым вводили физиологический раствор и АТФ.CD206-положительные макрофаги в основном располагались вокруг спиральных артерий на внешнем крае мезометриального треугольника вблизи продольного мышечного слоя миометрия. Было обнаружено, что процент площади, окрашенной для этих макрофагов, ниже (p<0,1, тренд) у крыс, которым вводили АТФ, по сравнению с крысами, которым вводили физиологический раствор (10).
Обсуждение
Это исследование показывает, что процент комбинированных неклассических/промежуточных моноцитов выше во время беременности у людей и крыс по сравнению с небеременными контрольными животными.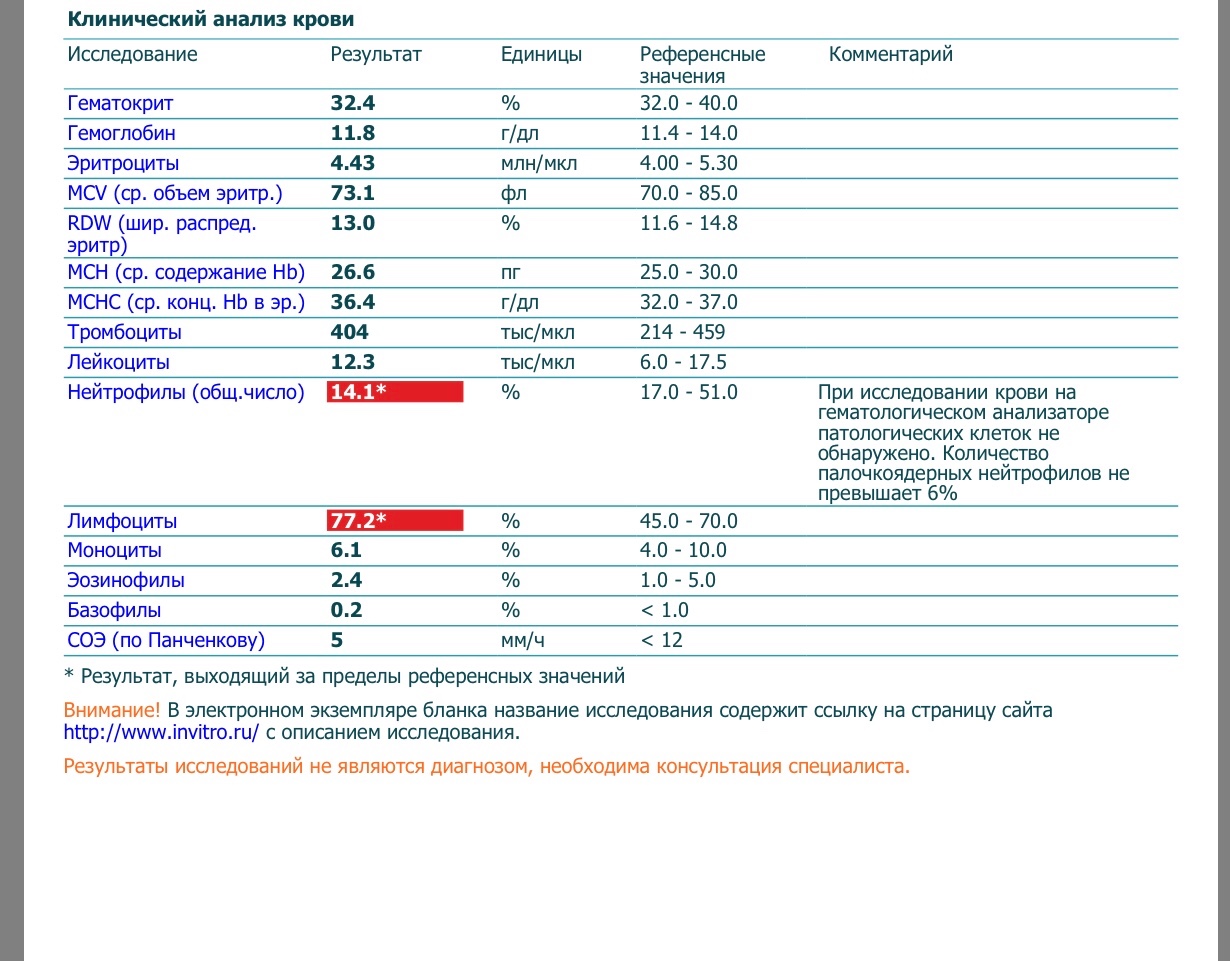 Это увеличение неклассических/промежуточных моноцитов согласуется с общим мнением о том, что беременность напоминает провоспалительное состояние [8]. Большинство исследований подмножеств моноцитов были сосредоточены на комбинированных неклассических/промежуточных моноцитах. В настоящем сообщении мы также исследовали отдельные промежуточные и неклассические подмножества, присутствующие у людей. Мы обнаружили, что более высокий процент промежуточных моноцитов по сравнению с неклассическими моноцитами отвечает за более высокий процент комбинированных неклассических/промежуточных моноцитов.У беременных с преэклампсией, состоянием с еще более выраженным провоспалительным статусом по сравнению со здоровой беременностью [20], эти различия были еще более заметными. Более того, данные, полученные на беременных крысах, позволяют предположить, что более высокий процент неклассических моноцитов индуцируется циркулирующими провоспалительными стимулами, присутствующими во время преэклампсии (АТФ в настоящем исследовании), и сопровождается меньшим количеством регуляторных/М2-подобных макрофагов вокруг спиральных артерий.
Это увеличение неклассических/промежуточных моноцитов согласуется с общим мнением о том, что беременность напоминает провоспалительное состояние [8]. Большинство исследований подмножеств моноцитов были сосредоточены на комбинированных неклассических/промежуточных моноцитах. В настоящем сообщении мы также исследовали отдельные промежуточные и неклассические подмножества, присутствующие у людей. Мы обнаружили, что более высокий процент промежуточных моноцитов по сравнению с неклассическими моноцитами отвечает за более высокий процент комбинированных неклассических/промежуточных моноцитов.У беременных с преэклампсией, состоянием с еще более выраженным провоспалительным статусом по сравнению со здоровой беременностью [20], эти различия были еще более заметными. Более того, данные, полученные на беременных крысах, позволяют предположить, что более высокий процент неклассических моноцитов индуцируется циркулирующими провоспалительными стимулами, присутствующими во время преэклампсии (АТФ в настоящем исследовании), и сопровождается меньшим количеством регуляторных/М2-подобных макрофагов вокруг спиральных артерий.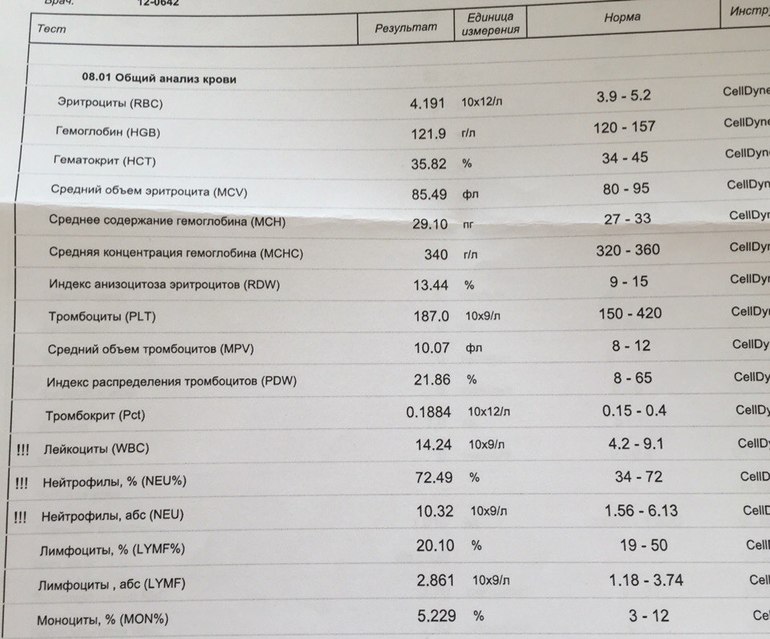 в мезометриальном треугольнике.
в мезометриальном треугольнике.
Изменения в субпопуляциях моноцитов, наблюдаемые в этом исследовании, подтверждают мнение о том, что беременность является провоспалительным состоянием, которое еще более заметно при преэклампсии. Иммунологически беременность характеризуется сдвигом от Th2 к Th3 ответам и генерализованной активацией неспецифического иммунитета [8], [44], [45]. Наблюдаемые изменения в подмножествах моноцитов в третьем триместре беременности могут хорошо вписываться в этот измененный воспалительный статус, поскольку большее количество комбинированных неклассических/промежуточных моноцитов было связано с несколькими воспалительными заболеваниями [46]–[49].Например, более высокое количество циркулирующих комбинированных неклассических/промежуточных моноцитов было зарегистрировано при сепсисе, ревматоидном артрите, ВИЧ-1-инфекции, метастатическом раке, туберкулезе и астме [46]–[49]. Комбинированная подгруппа неклассических/промежуточных моноцитов состоит из 2 субпопуляций, и наши данные показывают, что увеличение промежуточных моноцитов отвечает за более высокий процент этой комбинированной подгруппы при здоровой беременности и преэклампсии. Данные по другим воспалительным состояниям (сепсис, астма, ревматоидный артрит, атеросклероз, ВИЧ-1-инфекция) подтверждают, что при воспалении обнаруживаются промежуточные моноциты в больших количествах [46], [48], [50], [51]. .
Данные по другим воспалительным состояниям (сепсис, астма, ревматоидный артрит, атеросклероз, ВИЧ-1-инфекция) подтверждают, что при воспалении обнаруживаются промежуточные моноциты в больших количествах [46], [48], [50], [51]. .
Хотя точные функции различных субпопуляций моноцитов остаются неясными, по сравнению с классическими моноцитами комбинированные неклассические/промежуточные моноциты продуцируют более высокие количества TNF-α и IL-1ß после стимуляции, проявляют более низкую фагоцитарную активность и обладают более высокой антигенпрезентирующей способностью [15]. ], [46], [51]–[54]. Насколько нам известно, никаких конкретных данных о функции различных субпопуляций моноцитов во время беременности опубликовано не было. В небеременной ситуации исследования показали, что транскриптом промежуточного подмножества соответствует провоспалительным характеристикам и что эти моноциты демонстрируют высокую продукцию токсичных кислородных радикалов [51].Данные других исследований позволяют предположить, что неклассические моноциты, в отличие от промежуточных моноцитов, готовы выйти из кровотока, потому что они имеют самую высокую экспрессию генов, участвующих в адгезии и трансэндотелиальной миграции [51], [55], [56]. Следовательно, может показаться, что неклассические моноциты играют роль в тканях, потому что они демонстрируют фенотип, который допускает экстравазацию, и что промежуточные моноциты играют роль циркулирующих провоспалительных клеток, представляющих первую линию защиты хозяина.Повышенное активационное состояние этих клеток может быть необходимо для компенсации адаптации адаптивного иммунитета во время беременности, т. е. отхода от иммунных ответов Th2-типа [44].
Следовательно, может показаться, что неклассические моноциты играют роль в тканях, потому что они демонстрируют фенотип, который допускает экстравазацию, и что промежуточные моноциты играют роль циркулирующих провоспалительных клеток, представляющих первую линию защиты хозяина.Повышенное активационное состояние этих клеток может быть необходимо для компенсации адаптации адаптивного иммунитета во время беременности, т. е. отхода от иммунных ответов Th2-типа [44].
Поскольку функциональные исследования подмножеств моноцитов человека in vivo ограничены, мы исследовали, коррелируют ли изменения, которые мы обнаружили у беременных женщин, с беременными крысами. У крыс обнаружено только две субпопуляции моноцитов. Они характеризуются высокой экспрессией CD172a (сигнально-регуляторный белок альфа) и либо низкой, либо высокой экспрессией CD43 (лейкосиалин) [18].Было обнаружено, что моноциты CD172a+ CD43-lo сравнимы с классическими моноцитами, а моноциты CD172a+ CD43-hi — с неклассическими моноцитами, при этом не сообщается о дальнейшем подразделении этих неклассических моноцитов [14]. В конце беременности у здоровых беременных крыс мы обнаружили в среднем более высокий процент общего количества моноцитов по сравнению с небеременными животными, как и у человека. Более того, неклассическая подгруппа также была выше во время беременности крысы, аналогично беременности человека. Это увеличение неклассических моноцитов уже наблюдалось с 13-го дня беременности до конца беременности, что позволяет предположить, что провоспалительное состояние у крыс развивается на второй неделе беременности.Будут ли эти сроки аналогичны у людей, еще предстоит выяснить. Однако ранее было показано, что фенотипическая активация моноцитов увеличивается во втором триместре и еще больше увеличивается в третьем триместре [7], что позволяет предположить, что и при беременности у человека провоспалительное состояние развивается во втором триместре.
В конце беременности у здоровых беременных крыс мы обнаружили в среднем более высокий процент общего количества моноцитов по сравнению с небеременными животными, как и у человека. Более того, неклассическая подгруппа также была выше во время беременности крысы, аналогично беременности человека. Это увеличение неклассических моноцитов уже наблюдалось с 13-го дня беременности до конца беременности, что позволяет предположить, что провоспалительное состояние у крыс развивается на второй неделе беременности.Будут ли эти сроки аналогичны у людей, еще предстоит выяснить. Однако ранее было показано, что фенотипическая активация моноцитов увеличивается во втором триместре и еще больше увеличивается в третьем триместре [7], что позволяет предположить, что и при беременности у человека провоспалительное состояние развивается во втором триместре.
Чтобы выяснить, может ли более высокий процент неклассических моноцитов при преэклампсии быть вызван провоспалительными стимулами, мы вводили беременным крысам АТФ, провоспалительный стимул [29].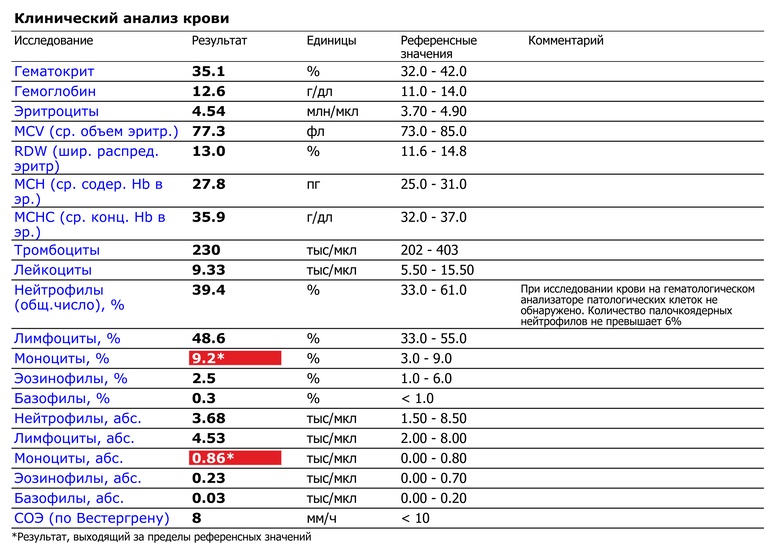 Мы обнаружили дальнейшее увеличение неклассических моноцитов у беременных крыс, которым вводили АТФ, по сравнению с контрольными беременными крысами, которым вводили физиологический раствор. Это подтверждает нашу гипотезу о том, что провоспалительный стимул при преэклампсии отвечает за увеличение неклассических моноцитов в этом состоянии. Кроме того, у женщин с преэклампсией наблюдаются более высокие уровни АТФ по сравнению со здоровыми беременными, что позволяет предположить, что при преэклампсии АТФ может играть патофизиологическую роль [28].
Мы обнаружили дальнейшее увеличение неклассических моноцитов у беременных крыс, которым вводили АТФ, по сравнению с контрольными беременными крысами, которым вводили физиологический раствор. Это подтверждает нашу гипотезу о том, что провоспалительный стимул при преэклампсии отвечает за увеличение неклассических моноцитов в этом состоянии. Кроме того, у женщин с преэклампсией наблюдаются более высокие уровни АТФ по сравнению со здоровыми беременными, что позволяет предположить, что при преэклампсии АТФ может играть патофизиологическую роль [28].
Увеличение процента неклассических моноцитов после инфузии АТФ сопровождается более высоким статусом активации этой подгруппы моноцитов по сравнению с обработкой физиологическим раствором.Для оценки их статуса активации мы использовали два маркера, которые, как известно, подавляются при активации моноцитов, то есть CD62L (L-селектин) и CD4. CD62L быстро, но временно теряется после провоспалительных сигналов [41], [42], в то время как CD4 подавляется в течение более длительных периодов времени [40], [43].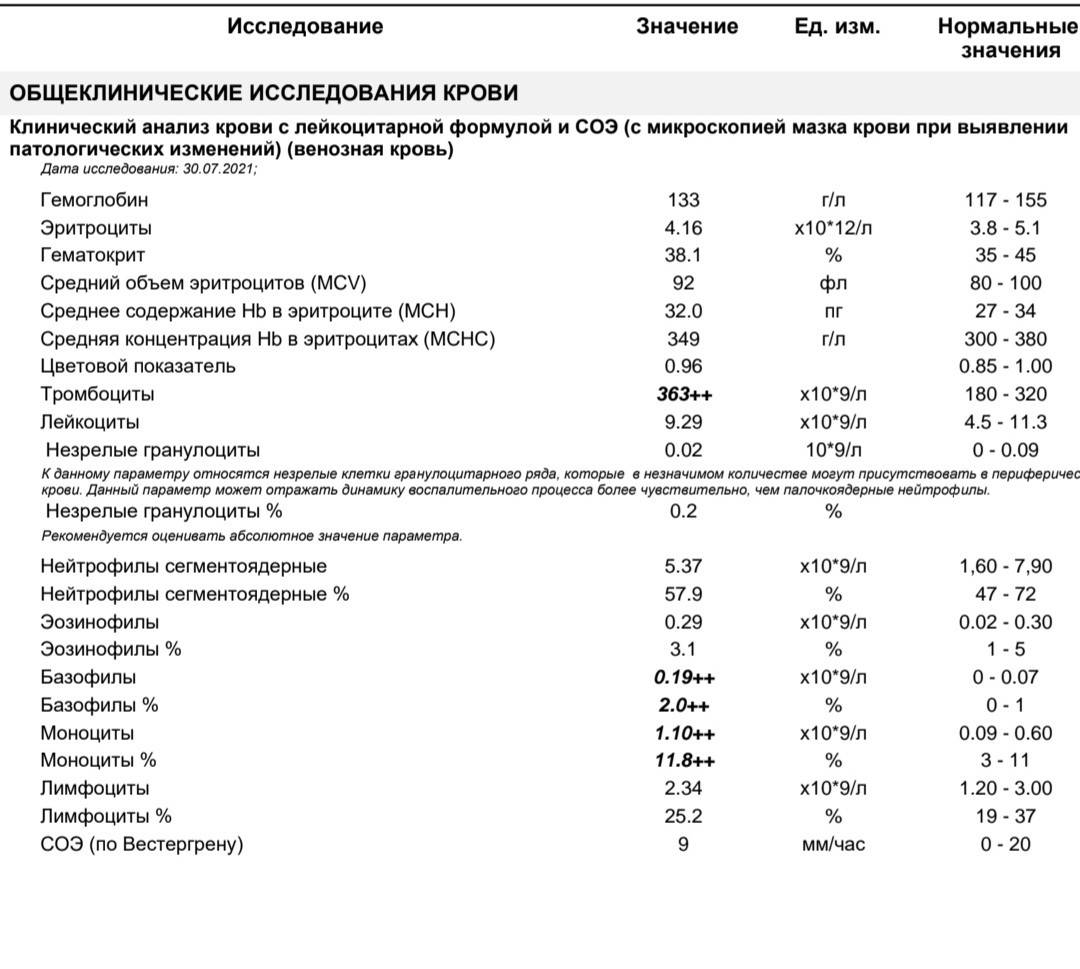 Потеря CD62L считается защитным механизмом против чрезмерного или аберрантного рекрутирования моноцитов [42], в то время как функция понижающей регуляции CD4 остается неизвестной. Интересно, что АТФ не оказывает такого действия на моноциты небеременных животных или на классические моноциты беременных животных.По-видимому, состояние беременности само по себе изменяет реактивность неклассических моноцитов, что приводит к усилению активации после провоспалительного стимула. Мы предполагаем, что характеристики преэклампсии после введения АТФ беременным крысам опосредованы (по крайней мере, частично) повышенной активностью неклассических моноцитов [29], [57].
Потеря CD62L считается защитным механизмом против чрезмерного или аберрантного рекрутирования моноцитов [42], в то время как функция понижающей регуляции CD4 остается неизвестной. Интересно, что АТФ не оказывает такого действия на моноциты небеременных животных или на классические моноциты беременных животных.По-видимому, состояние беременности само по себе изменяет реактивность неклассических моноцитов, что приводит к усилению активации после провоспалительного стимула. Мы предполагаем, что характеристики преэклампсии после введения АТФ беременным крысам опосредованы (по крайней мере, частично) повышенной активностью неклассических моноцитов [29], [57].
Наше исследование показывает, что изменения в подмножествах моноцитов в периферическом кровообращении в нашей модели крыс, по-видимому, сопровождаются изменениями в подмножествах макрофагов в мезометриальном треугольнике, т.е.е. плацентарное ложе. Тенденция к уменьшению количества М2-подобных или регуляторных макрофагов наблюдалась в мезометриальном треугольнике на 20-й день беременности у крыс, которым вводили АТФ, по сравнению с контрольными крысами, которым вводили физиологический раствор. Это может быть похоже на ситуацию с человеком, в которой мы ранее показали более низкую экспрессию маркеров макрофагов М2 в децидуальной фазе беременностей, позже осложнившихся гипертензией, вызванной беременностью [58]. Однако наши исследования до сих пор не дают ответа на вопрос, как связаны количество и тип моноцитов периферической крови и плацентарных макрофагов.Из исследований на мышах было высказано предположение, что классические моноциты инфильтрируют остро воспаленные ткани [59], в то время как неклассические моноциты предполагают пополнение тканевых макрофагов в стационарных условиях [27], [60]. Заманчиво предположить, что во время нормальной беременности неклассические моноциты инфильтрируют мезометриальный треугольник и что этот процесс ингибируется после введения АТФ беременным крысам.
Это может быть похоже на ситуацию с человеком, в которой мы ранее показали более низкую экспрессию маркеров макрофагов М2 в децидуальной фазе беременностей, позже осложнившихся гипертензией, вызванной беременностью [58]. Однако наши исследования до сих пор не дают ответа на вопрос, как связаны количество и тип моноцитов периферической крови и плацентарных макрофагов.Из исследований на мышах было высказано предположение, что классические моноциты инфильтрируют остро воспаленные ткани [59], в то время как неклассические моноциты предполагают пополнение тканевых макрофагов в стационарных условиях [27], [60]. Заманчиво предположить, что во время нормальной беременности неклассические моноциты инфильтрируют мезометриальный треугольник и что этот процесс ингибируется после введения АТФ беременным крысам.
Точный механизм, вызывающий более высокий процент неклассических моноцитов при беременности и преэклампсии, еще предстоит установить.АТФ, как предполагалось выше, но также и провоспалительные цитокины, высвобождаемые из плаценты, могут быть ответственны за это [61], а также за выделение микрочастиц мембраны синцитиотрофобласта (STBM) [62].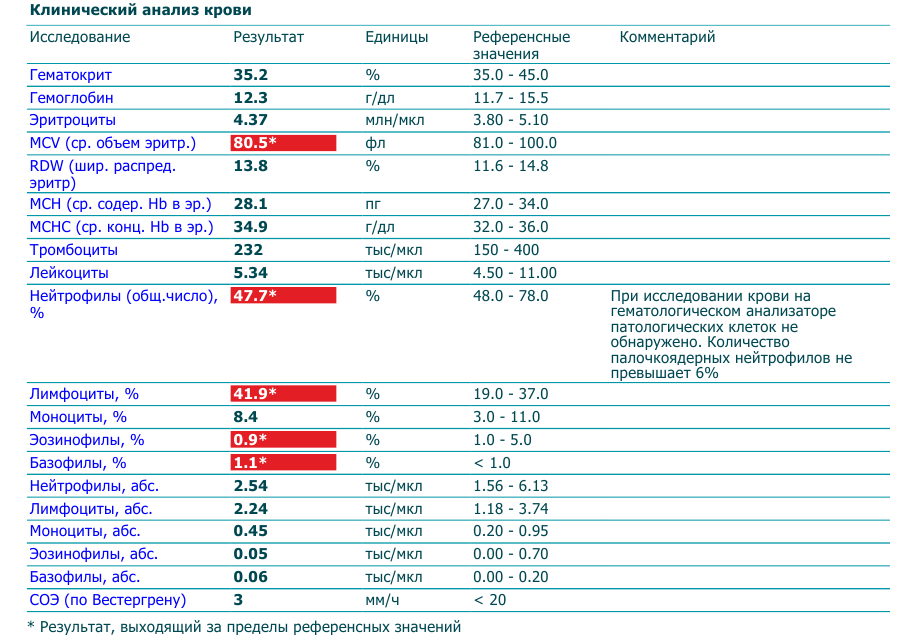 Было обнаружено, что STBM активируют моноциты и значительно увеличиваются во время преэклампсии [63]–[65], но, к сожалению, ни в одном из этих исследований не изучались различные субпопуляции моноцитов. Недавние исследования, посвященные взаимодействию между активированными тромбоцитами и моноцитами, также могут предложить объяснение увеличения количества промежуточных моноцитов [66].Преэклампсия характеризуется активацией тромбоцитов [67], и эти исследования показали, что активированные тромбоциты увеличивают пул промежуточных моноцитов зависимым от циклооксигеназы-2 образом [66].
Было обнаружено, что STBM активируют моноциты и значительно увеличиваются во время преэклампсии [63]–[65], но, к сожалению, ни в одном из этих исследований не изучались различные субпопуляции моноцитов. Недавние исследования, посвященные взаимодействию между активированными тромбоцитами и моноцитами, также могут предложить объяснение увеличения количества промежуточных моноцитов [66].Преэклампсия характеризуется активацией тромбоцитов [67], и эти исследования показали, что активированные тромбоциты увеличивают пул промежуточных моноцитов зависимым от циклооксигеназы-2 образом [66].
В заключение, во время беременности у людей и крыс процент провоспалительных комбинированных неклассических/промежуточных моноцитов выше, что соответствует провоспалительному статусу здоровой беременности. У людей это увеличение вызвано увеличением промежуточных моноцитов в этой комбинированной подгруппе неклассических/промежуточных моноцитов.Во время преэклампсии промежуточные моноциты еще больше увеличиваются.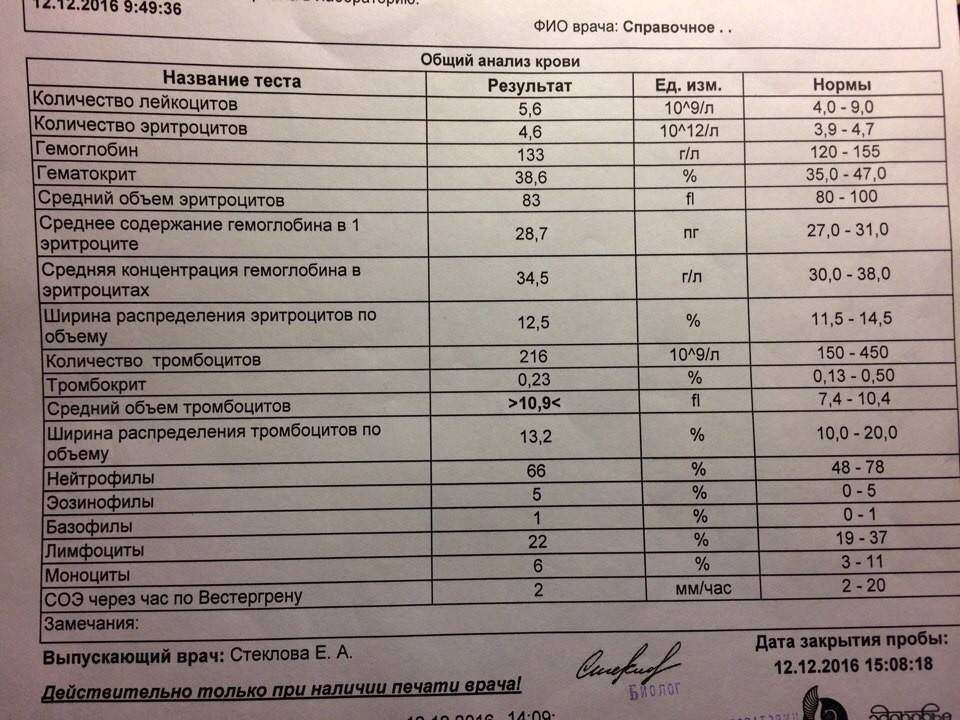 Наблюдение, что АТФ увеличивает количество и активирует неклассические моноциты только у беременных крыс, предполагает, что это подмножество специфически изменяется во время беременности и что они могут играть роль в патофизиологии преэклампсии. Остается установить, проникает ли это конкретное подмножество в мезометриальный треугольник, то есть в плацентарное ложе при здоровой беременности.
Наблюдение, что АТФ увеличивает количество и активирует неклассические моноциты только у беременных крыс, предполагает, что это подмножество специфически изменяется во время беременности и что они могут играть роль в патофизиологии преэклампсии. Остается установить, проникает ли это конкретное подмножество в мезометриальный треугольник, то есть в плацентарное ложе при здоровой беременности.
Вреден ли высокий уровень лейкоцитов при беременности?
Цель FirstCry Parenting — предоставить вам самую актуальную, точную и актуальную информацию.Каждая статья, которую мы публикуем, соответствует строгим правилам и включает в себя несколько уровней рецензирования, как нашей редакционной группы, так и экспертов. Мы приветствуем ваши предложения по тому, как сделать эту платформу более полезной для всех наших пользователей. Напишите нам по адресу [email protected]
Последнее обновление
Беременность приносит много изменений в женский организм. В течение девяти месяцев женщина претерпевает множество физических, умственных и эмоциональных изменений, которые могут быть весьма травмирующими, если не знать об этих изменениях.Одним из таких изменений, вызывающих страх, являются гематологические изменения или изменения, происходящие в крови. Эти изменения связаны с тромбоцитами, гемоглобином, эритроцитами и лейкоцитами.
Что такое лейкоциты?
Клетки иммунной системы представляют собой лейкоциты. Они защищают тело от чужеродных частиц и убивают любой элемент, который может причинить вред телу. Эти клетки, известные с научной точки зрения как лейкоциты, встречаются по всему телу. Следовательно, они становятся индикатором того, насколько человек физически здоров, непригоден или болен.
Какова роль лейкоцитов?
Лейкоциты, вырабатываемые костным мозгом, выполняют различные функции. В общем, их основная цель — быть опорой иммунной системы, но, в частности, разные наборы лейкоцитов играют разные роли.
- Нейтрофилы : Они в основном заселены клетками и занимают самое большое место. Они борются с инфекциями бактериальной или грибковой природы.
- Моноциты : Они притягивают и всасывают токсичные отходы и бактерии, в конечном итоге уничтожая их.
- Эозинофилы : Это солдаты, защищающие организм от паразитов и аллергических реакций.
- Базофилы : Они могут составлять менее 1% лейкоцитов, но они усердно работают над регуляцией кровотока и увеличением количества клеток, чтобы иммунная система оставалась сильной во время болезни.
- Лимфоциты: Вырабатывают антитела против инородных частиц и разрушают их.
Изменения, относящиеся к типам WBC
Увеличение или уменьшение этих пяти типов лейкоцитов приведет к изменениям в организме.Это ключевой фактор, вызывающий дисбаланс из-за гемолитических изменений во время беременности.
- Количество лейкоцитов увеличивается, когда иммунная система борется с инфекцией.
 Высокая популяция этих клеток указывает на потребность в поддержке иммунной системы. Причинами могут быть травма, беременность, аллергические реакции или аутоиммунное заболевание. Некоторые симптомы, связанные с повышенным содержанием лейкоцитов, включают лихорадку, головокружение, частые аллергические реакции и воспаление.
Высокая популяция этих клеток указывает на потребность в поддержке иммунной системы. Причинами могут быть травма, беременность, аллергические реакции или аутоиммунное заболевание. Некоторые симптомы, связанные с повышенным содержанием лейкоцитов, включают лихорадку, головокружение, частые аллергические реакции и воспаление.
- Лейкоциты уменьшаются, когда в клетках преобладает инфекция, что ослабляет иммунную систему и еще больше ослабляет организм.Причинами этого могут быть нарушения функции костного мозга, инфекции и сепсис. Некоторые симптомы, связанные со снижением количества лейкоцитов, включают в себя вялость, усталость и серьезные сочетания простых инфекций.
Эти изменения применимы ко всем. Беременные женщины увидят некоторые подобные изменения, и в большинстве случаев эти изменения безвредны:
1. Нейтрофилы
Количество этих клеток увеличивается во время беременности, но это не опасно для организма или плода.Это лишь указывает на реакцию костного мозга на повышенную выработку эритроцитов.
2. Моноциты
В начале беременности иммунная система матери претерпевает изменения, чтобы избежать нападения на плод. Одним из наблюдаемых изменений является увеличение моноцитов. Однако побочные эффекты этого заключаются в том, что это может привести к определенным осложнениям во время беременности, таким как преэклампсия. Чтобы снять эти опасения, врач может посоветовать пройти тест, когда моноциты наблюдают слишком высокие.
3. Эозинофилы
Количество этих ячеек не изменилось. Любое изменение будет свидетельствовать о слабом иммунитете или атаке инфекции.
4. Базофилы
Значимых изменений количества базофилов нет.
5. Лимфоциты
Он снижается в первые два триместра и увеличивается в последнем триместре и после родов. Эти изменения обусловлены подавлением иммунологической активности во время беременности.
Каково нормальное количество лейкоцитов во время беременности?
Общее количество лейкоцитов у небеременных женщин в среднем составляет от 4 500 до 11 000/мм3. Во время беременности минимальное количество, которое необходимо поддерживать, составляет 6000/мм3. В третьем триместре нормальным считается диапазон между 12000-18000 на микролитр.
Во время беременности минимальное количество, которое необходимо поддерживать, составляет 6000/мм3. В третьем триместре нормальным считается диапазон между 12000-18000 на микролитр.
Что произойдет, если у вас высокий уровень лейкоцитов во время беременности?
Поскольку иммунная система приспосабливается к растущему внутри вашего малыша, вы можете ожидать, что количество лейкоцитов будет увеличиваться через разные промежутки времени. В этом нет ничего необычного, и любые мысли о серьезной неотложной медицинской помощи следует немедленно отбросить.
Однако, если есть такие симптомы, как лихорадка, гипертония, острый стресс или любые другие проблемы, связанные с иммунитетом, немедленно обратитесь к врачу.
Причины высокого количества лейкоцитов во время беременности
Причины повышения или понижения различных типов лейкоцитов у беременной и небеременной женщины схожи. Неизвестное чрезмерное увеличение вызывает патологическое состояние, и лучше избегать определенных элементов, которые могут вызвать его увеличение.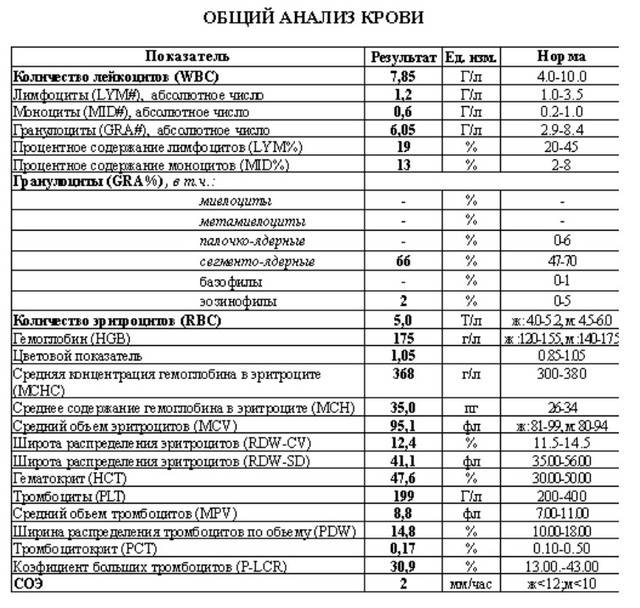 Основные четыре причины объясняются здесь:
Основные четыре причины объясняются здесь:
1.стресс
Стресс во время беременности бывает не только эмоциональным, но и физическим. Это приводит к тому, что количество лейкоцитов становится выше обычного, чтобы защитить организм от вреда. Поэтому вам следует практиковать йогу и медитацию, чтобы снять стресс.
2. Инфекция
Любая бактериальная или грибковая инфекция, начиная от обычной простуды и заканчивая ИМП, увеличивает количество лейкоцитов. Примите меры предосторожности, чтобы обезопасить себя от таких инфекций. Ваша иммунная система занята защитой вас сейчас больше, чем когда-либо, так что берегите себя.
3. Воспаление
Воспалительные заболевания и связанные с ними аллергические реакции также приведут к увеличению. Лейкоциты устремляются к областям, которые нуждаются в помощи и созревают. Дыхательные техники и полное избегание аллергических зон могут помочь.
4. Лейкемия или аутоиммунное заболевание
Аутоиммунные заболевания, такие как болезнь Крона, болезнь Грейвса или лейкемия, увеличивают количество нефункциональных лейкоцитов. В отличие от других случаев, эти клетки ничего не делают, а просто увеличиваются до угрожающих размеров.
В отличие от других случаев, эти клетки ничего не делают, а просто увеличиваются до угрожающих размеров.
Когда обратиться к врачу
Хотя количество лейкоцитов у беременных женщин намного выше, есть определенные симптомы, на которые следует обратить внимание и которые могут вызывать беспокойство. Немедленно обратитесь к врачу, если заметите:
1. Лихорадка и боль
Лихорадка и боль являются признаками того, что ваш организм борется с инфекцией. Врачу необходимо диагностировать причину и назначить вам соответствующее лечение, прежде чем она причинит вред вам или плоду.
2.Проблемы с дыханием
Если у вас возникли проблемы с дыханием, такие как одышка, свистящее дыхание и т. д., обязательно немедленно обратитесь к врачу. Это может быть признаком аллергической реакции в легких, которую необходимо лечить как можно скорее.
3. Сыпь, зуд или крапивница
Аллергия на коже, вызывающая сыпь, зуд, крапивницу или покраснение, потенциально может быть опасной и указывать на инфекцию, поэтому обязательно проконсультируйтесь с врачом для соответствующего лечения.
Бесчисленные изменения происходят во время беременности и после нее. Повышение уровня лейкоцитов во время беременности не является поводом для беспокойства, но любой признак ослабления иммунитета является сигналом для посещения врача. Они обычно меняются, чтобы укрепить тело матери и матку. Однако продолжайте слушать свое тело. Если вы чувствуете себя некомфортно, посетите врача и всегда оставайтесь позитивным. Счастливая мать обычно означает счастливую беременность.
Читайте также: Общий анализ крови во время беременности
Иммунологическая адаптация к беременности у женщин с диабетом 1 типа
Anderson, J.Х., младший и др. Снижение постпрандиальной гипергликемии и частоты гипогликемии у пациентов с ИЗСД при лечении аналогами инсулина. Многоцентровая исследовательская группа Insulin Lispro. Диабет 46, 265–270 (1997).
КАС Статья пабмед Google ученый
Эверс, И. М., де Валк, Х. В. и Виссер, Г. Х. Риск осложнений беременности у женщин с диабетом 1 типа: общенациональное проспективное исследование в Нидерландах. BMJ 328, 915 (2004).
М., де Валк, Х. В. и Виссер, Г. Х. Риск осложнений беременности у женщин с диабетом 1 типа: общенациональное проспективное исследование в Нидерландах. BMJ 328, 915 (2004).
Артикул пабмед ПабМед Центральный Google ученый
Groen, B. et al. Аберрантные адаптации к беременности в периферическом иммунном ответе при диабете 1 типа: модель на крысах. PLoS One 8, e65490 (2013 г.).
КАС Статья ОБЪЯВЛЕНИЯ пабмед ПабМед Центральный Google ученый
Веенстра ван Ньювенховен, А. Л., Хайнеман, М. Дж. и Фаас, М.М. Иммунология благополучной беременности. Гум. Воспр. Обновление 9, стр. 347–357 (2003 г.).
КАС Статья пабмед Google ученый
Pijnenborg, R. Имплантация и иммунология: материнские воспалительные и иммунные клеточные реакции на имплантацию и инвазию трофобласта. Воспр. Биомед. Интернет 4, Приложение 3, 14–17 (2002).
Воспр. Биомед. Интернет 4, Приложение 3, 14–17 (2002).
Артикул пабмед Google ученый
Секерес-Барто, Й.Иммунологические взаимоотношения матери и плода. Междунар. Преподобный Иммунол. 21, 471–495 (2002).
КАС Статья пабмед Google ученый
Raghupathy, R. et al. Продукция цитокинов материнскими лимфоцитами во время нормальной беременности человека и при необъяснимом рецидивирующем самопроизвольном аборте. Гум. Воспр. 15, 713–718 (2000).
КАС Статья пабмед Google ученый
Сайто, С., Сакаи М., Сасаки Ю., Накашима А. и Шиодзаки А. Неадекватная индукция толерантности может вызвать преэклампсию. Дж. Репрод. Иммунол. 76, 30–39 (2007).
КАС Статья пабмед Google ученый
Орси, Н. М. и Трайб, Р. М. Цитокиновые сети и регуляция функции матки при беременности и родах. Дж. Нейроэндокринол. 20, 462–469 (2008).
Дж. Нейроэндокринол. 20, 462–469 (2008).
КАС Статья пабмед Google ученый
Сайто, С., Nakashima, A., Shima, T. & Ito, M. Th2/Th3/Th27 и парадигма регуляторных Т-клеток при беременности. Являюсь. Дж. Репрод. Иммунол. 63, 601–610 (2010).
КАС Статья пабмед Google ученый
Veenstra van Nieuwenhoven, A.L. et al. Продукция цитокинов натуральными киллерами и лимфоцитами у беременных по сравнению с женщинами в фолликулярной фазе овариального цикла. Плодородный. Стерильно. 77, 1032–1037 (2002).
Артикул пабмед Google ученый
Боржиховский А.М., Крой Б.А., Чан В.Л., Редман С.В. и Сарджент И.Л. Изменения системного иммунитета 1-го и 2-го типов при нормальной беременности и преэклампсии могут быть опосредованы естественными клетками-киллерами. Евро. Дж. Иммунол. 35, 3054–3063 (2005).
КАС Статья пабмед Google ученый
Sacks, G. P., Studena, K., Sargent, K. & Redman, C. W. Нормальная беременность и преэклампсия вызывают воспалительные изменения в лейкоцитах периферической крови, сходные с таковыми при сепсисе.Являюсь. Дж. Обст. Гинекол. 179, 80–86 (1998).
КАС Статья пабмед Google ученый
van Nieuwenhoven, A.L., Moes, H., Heineman, MJ, Santema, J. & Faas, M.M. Продукция цитокинов моноцитами, NK-клетками и лимфоцитами отличается у пациенток с преэклампсией по сравнению со здоровыми беременными женщинами. гипертензии. Беременность 27, 207–224 (2008).
Артикул КАС пабмед Google ученый
Циглер-Хейтброк, Л.и Хофер, Т. П. К уточненному определению подмножеств моноцитов. Передний. Иммунол. 4, 23 (2013).
Артикул КАС пабмед ПабМед Центральный Google ученый
Мельгерт, Б.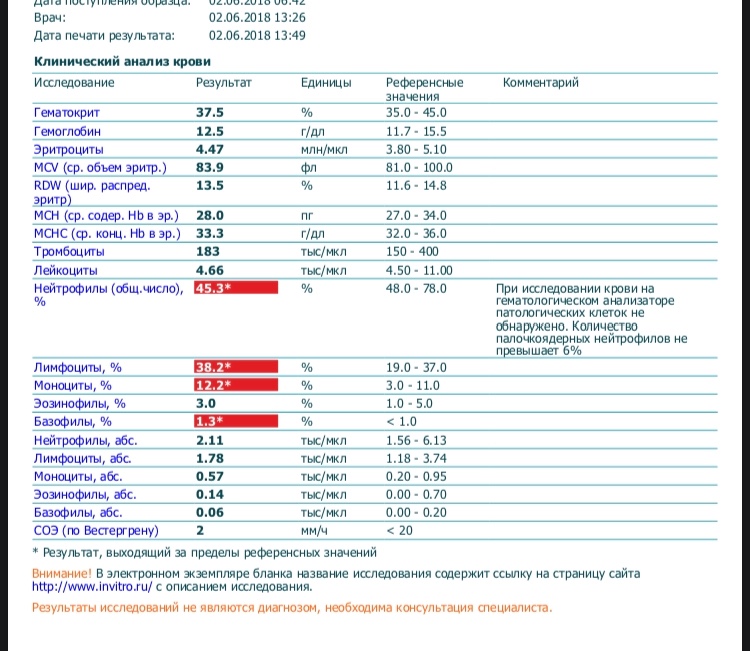 Н. и др. Беременность и преэклампсия влияют на субпопуляции моноцитов у людей и крыс. PLoS One 7, e45229 (2012 г.).
Н. и др. Беременность и преэклампсия влияют на субпопуляции моноцитов у людей и крыс. PLoS One 7, e45229 (2012 г.).
КАС Статья ОБЪЯВЛЕНИЯ пабмед ПабМед Центральный Google ученый
Себени, А.и другие. Ответы клеток Th2 и Th3 пациентов с диабетом 1 типа и здоровых людей на пептиды белка теплового шока 60 человека AA437-460 и AA394-408. Воспаление. Рез. 54, 415–419 (2005).
КАС Статья пабмед Google ученый
Haseda, F., Imagawa, A., Murase-Mishiba, Y., Terasaki, J. & Hanafusa, T. CD4(+) CD45RA(-) FoxP3high активированные регуляторные Т-клетки функционально нарушены и связаны с остаточными инсулинсекретирующей способности у больных сахарным диабетом 1 типа.клин. Эксп. Иммунол. 173, 207–216 (2013).
КАС Статья пабмед ПабМед Центральный Google ученый
Rodacki, M. et al. Измененные естественные клетки-киллеры у пациентов с диабетом 1 типа. Диабет 56, 177–185 (2007).
et al. Измененные естественные клетки-киллеры у пациентов с диабетом 1 типа. Диабет 56, 177–185 (2007).
КАС Статья пабмед Google ученый
Гур, К. и др. Активирующий рецептор NKp46 необходим для развития диабета 1 типа.Нац. Иммунол. 11, 121–128 (2010).
КАС Статья пабмед Google ученый
Фукуи А. и др. Корреляция между природными рецепторами цитотоксичности и внутриклеточной экспрессией цитокинов NK-клетками периферической крови у женщин с привычными невынашиваниями беременности и неудачами имплантации. Являюсь. Дж. Репрод. Иммунол. 62, 371–380 (2009).
КАС Статья пабмед Google ученый
Фукуи, А.и другие. Изменения NK-клеток при преэклампсии. Являюсь. Дж. Репрод. Иммунол. 67, 278–286 (2012).
КАС Статья пабмед Google ученый
Robinson, D. P. & Klein, S. L. Беременность и гормоны, связанные с беременностью, изменяют иммунные реакции и патогенез заболевания. Горм. Поведение 62, 263–271 (2012).
P. & Klein, S. L. Беременность и гормоны, связанные с беременностью, изменяют иммунные реакции и патогенез заболевания. Горм. Поведение 62, 263–271 (2012).
КАС Статья пабмед ПабМед Центральный Google ученый
Сауткомб, Дж., Таннетта Д., Редман С. и Сарджент И. Иммуномодулирующая роль микровезикул синцитиотрофобласта. PLoS One 6, e20245 (2011 г.).
КАС Статья ОБЪЯВЛЕНИЯ пабмед ПабМед Центральный Google ученый
Redman, C.W. & Sargent, I.L. Циркулирующие микрочастицы при нормальной беременности и преэклампсии. Плацента 29, Дополнение A, S73–7 (2008 г.).
Артикул КАС пабмед Google ученый
Баккер, В., Eringa, E.C., Sipkema, P. & van Hinsberg, VW. Эндотелиальная дисфункция и диабет: роль гипергликемии, нарушение передачи сигналов инсулина и ожирение. Сотовые Ткани Res. 335, 165–189 (2009).
335, 165–189 (2009).
КАС Статья пабмед Google ученый
Cipollone, F. et al. Улучшенный растворимый лиганд CD40 способствует дисфункции эндотелиальных клеток in vitro и активации моноцитов у пациентов с сахарным диабетом: эффект улучшенного метаболического контроля.Диабетология 48, 1216–1224 (2005).
КАС Статья пабмед Google ученый
Пачот, А. и др. Экспрессия матричной РНК генов главного комплекса гистосовместимости класса II в цельной крови пациентов с септическим шоком. крит. Уход Мед. 33, 31–8; обсуждение 236–7 (2005).
КАС Статья пабмед Google ученый
Ши, Ф. Д. и Ван Каер, Л.Реципрокная регуляция между естественными клетками-киллерами и аутореактивными Т-клетками. Нац. Преподобный Иммунол. 6, 751–760 (2006).
КАС Статья пабмед Google ученый
Моретта, А.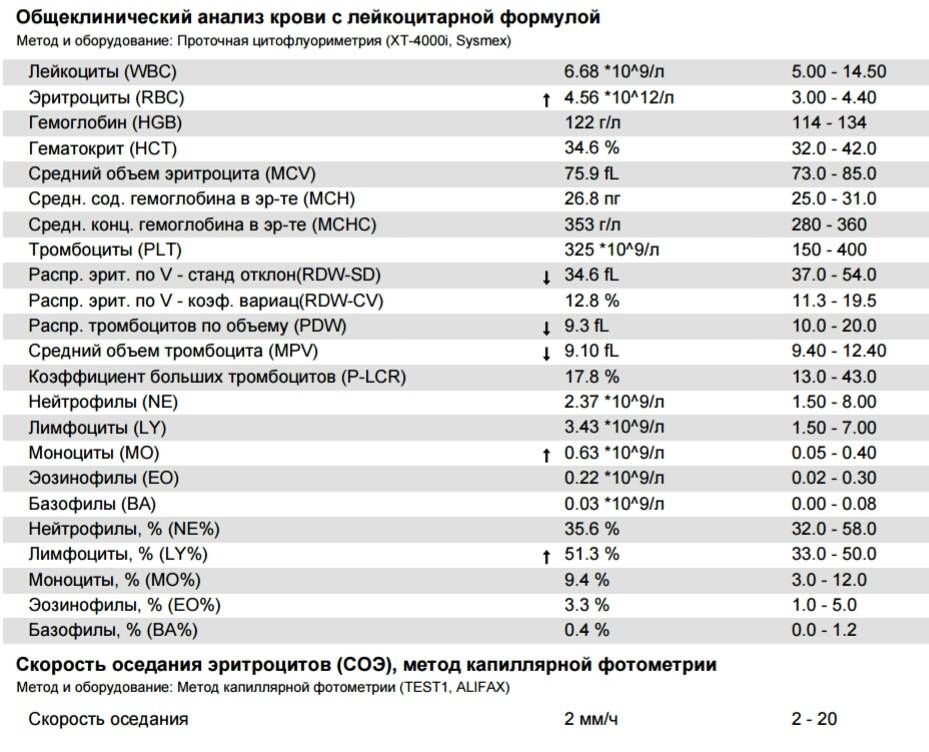 и др. Активация рецепторов и корецепторов, участвующих в опосредованном клетками естественных киллерах цитолизе человека. Анну. Преподобный Иммунол. 19, 197–223 (2001).
и др. Активация рецепторов и корецепторов, участвующих в опосредованном клетками естественных киллерах цитолизе человека. Анну. Преподобный Иммунол. 19, 197–223 (2001).
КАС Статья пабмед Google ученый
Накаэ, С., Ивакура Ю., Суто Х. и Галли С.Дж. Фенотипические различия между клетками Th2 и Th27 и негативная регуляция дифференцировки клеток Th2 с помощью IL-17. Дж. Лейкок. биол. 81, 1258–1268 (2007).
КАС Статья пабмед Google ученый
Mjosberg, J. et al. Системное снижение функционально супрессивных CD4dimCD25highFoxp3+ Treg у человека во втором триместре беременности индуцируется прогестероном и 17бета-эстрадиолом. Дж.Иммунол. 183, 759–769 (2009).
Артикул КАС пабмед Google ученый
Xiong, H., Zhou, C. & Qi, G. Пропорциональные изменения CD4+CD25+Foxp3+ регуляторных Т-клеток в периферической крови матери во время беременности и родов при доношенных и недоношенных. клин. Вкладывать деньги. Мед. 33, E422 (2010).
клин. Вкладывать деньги. Мед. 33, E422 (2010).
Артикул пабмед Google ученый
Кунерт М., Штромайер Р., Стегмюллер М. и Хальберштадт Э. Изменения в субпопуляциях лимфоцитов при нормальной беременности. Евро. Дж. Обст. Гинекол. Воспр. биол. 76, 147–151 (1998).
КАС Статья пабмед Google ученый
Yokota, M. et al. Роль экспрессии NKp46 в продукции цитокинов CD56-позитивными NK-клетками в периферической крови и эндометрии матки. Являюсь. Дж. Репрод. Иммунол. 69, 202–211 (2013).
КАС Статья пабмед Google ученый
Герьери, Д.и другие. Моноциты, обработанные ингибитором сериновой лейкоцитарной протеиназы, ингибируют пролиферацию CD4(+) лимфоцитов человека. Иммунология 133, 434–441 (2011).
КАС Статья пабмед ПабМед Центральный Google ученый
Wittmann, S.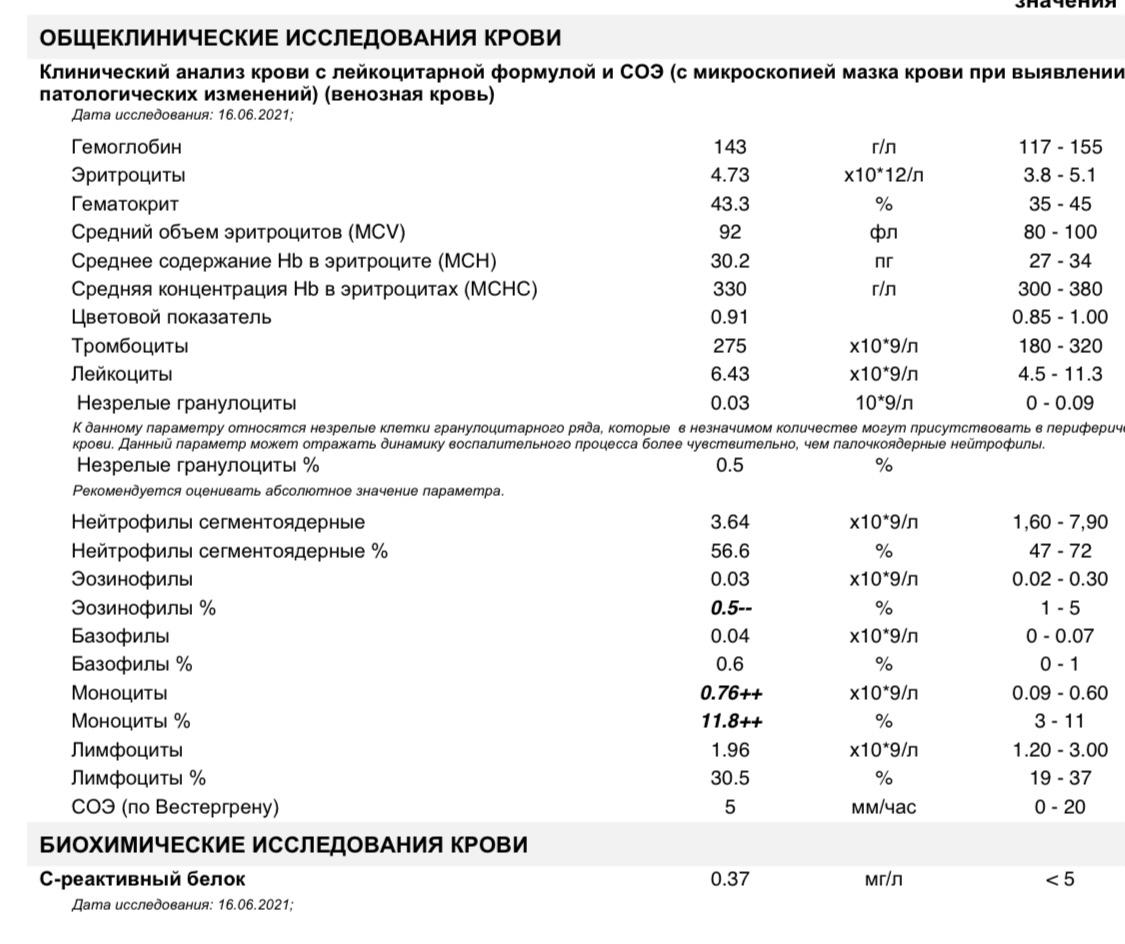 , Rothe, G., Schmitz, G. & Frohlich, D. Цитокиновая активация поверхностных антигенов коррелирует с инициацией нейтрофильной реакции окислительного взрыва. Цитометрия А. 57, 53–62 (2004).
, Rothe, G., Schmitz, G. & Frohlich, D. Цитокиновая активация поверхностных антигенов коррелирует с инициацией нейтрофильной реакции окислительного взрыва. Цитометрия А. 57, 53–62 (2004).
КАС Статья пабмед Google ученый
Фаас, М.М., Спаанс, Ф. и Де Вос, П. Моноциты и макрофаги при беременности и преэклампсии. Передний. Иммунол. 5, 298 (2014).
Артикул КАС пабмед ПабМед Центральный Google ученый
Вахаби, Х. А., Алзейдан, Р. А., Бавазир, Г. А., Алансари, Л. А. и Эсмаил, С. А. Уход за женщинами с диабетом до зачатия для улучшения исходов для матери и плода: систематический обзор и метаанализ. BMC Беременность Роды 10, 63 (2010).
Артикул пабмед ПабМед Центральный Google ученый
Radder, JK & van Roosmalen, J. HbA1c у здоровых беременных женщин. Нет. Дж. Мед. 63, 256–259 (2005).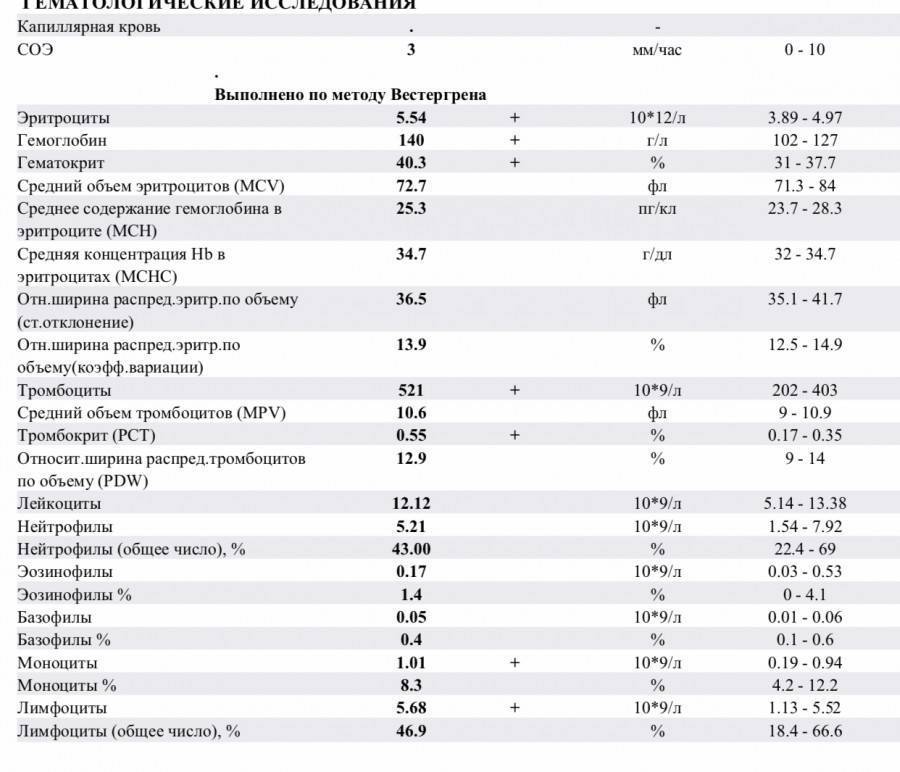
КАС пабмед Google ученый
Norgaard, M. et al. Ревматоидный артрит и исходы родов: датское и шведское общенациональное исследование распространенности. Дж. Стажер. Мед. 268, 329–337 (2010).
КАС Статья пабмед Google ученый
Сервера Р., Фонт Дж., Кармона Ф. и Балаш Дж. Исход беременности при системной красной волчанке: хорошие новости для нового тысячелетия. Аутоиммун. Ред. 1, 354–359 (2002).
Артикул пабмед Google ученый
Браун, М. А., Линдхеймер, М. Д., де Свит, М., Ван Аш, А. и Муткин, Дж.М. Классификация и диагностика гипертонических расстройств беременных: заключение Международного общества по изучению гипертензии беременных (ISSHP). гипертензии. Беременность 20, IX – XIV (2001).
КАС Статья пабмед Google ученый
Виссер, Г.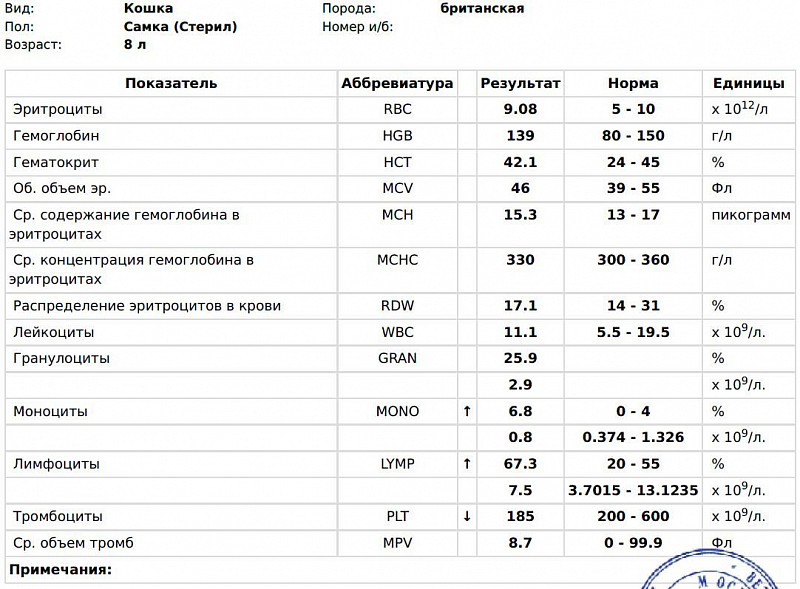 Х., Эйлерс, П. Х., Эльферинк-Стинкенс, П. М., Меркус, Х. М. и Вит, Дж. М. Новые голландские эталонные кривые массы тела при рождении в зависимости от гестационного возраста. Ранний гул.Дев. 85, 737–744 (2009).
Х., Эйлерс, П. Х., Эльферинк-Стинкенс, П. М., Меркус, Х. М. и Вит, Дж. М. Новые голландские эталонные кривые массы тела при рождении в зависимости от гестационного возраста. Ранний гул.Дев. 85, 737–744 (2009).
Артикул пабмед Google ученый
(PDF) Моноциты и макрофаги при беременности и преэклампсии
Faas et al. Моноциты и макрофаги при беременности и преэклампсии
ЛИТЕРАТУРА
1. Steegers EA, von Dadelszen P, Duvekot JJ, Pijnenborg R. Преэклампсия. Ланцет
(2010) 376(9741):631–44. doi:10.1016/S0140-6736(10)60279-6
2. Duley L. Глобальное влияние преэклампсии и эклампсии.Семин Перинатол
(2009) 33(3):130–7. doi:10.1053/j.semperi.2009.02.010
3. Redman CW, Sargent IL. Плацентарный стресс и преэклампсия: пересмотренный взгляд.
Placenta (2009) 30 (Приложение A): S38–42. doi:10.1016/j.placenta.2008.11.021
4. Sacks GP, Sargent IL, Redman CWG. Врожденный взгляд на человеческую беременность.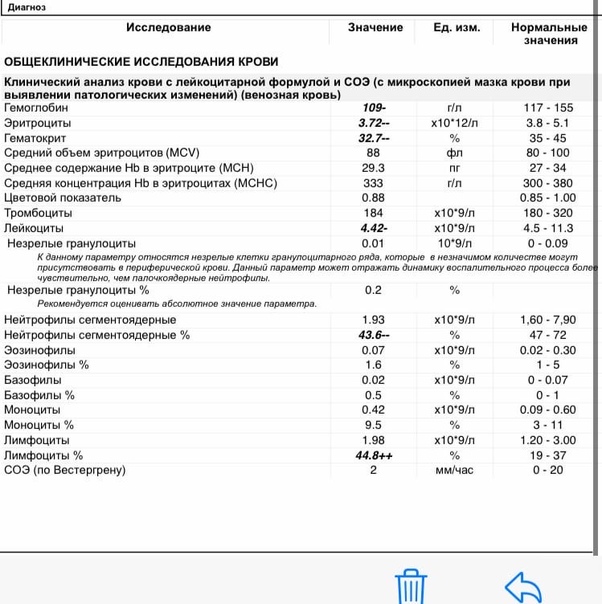
Immunol Today (1999) 20(3):114–8. doi:10.1016/S0167-5699(98)01393-0
5. Меллембаккен Дж.Р., Аукруст П., Олафсен М.К., Уеланд Т., Хестдал К., Видем В.
Активация лейкоцитов при маточно-плацентарном пассаже при гестозе.
Гипертензия (2002) 39(1):155–60. doi:10.1161/hy0102.100778
6. Хун Т.Х., Чарнок-Джонс Д.С., Скеппер Д.Н., Бертон Г.Дж. Секреция фактора некроза опухоли-альфа из тканей плаценты человека, индуцированная гипоксией-
реоксигенацией, вызывает активацию эндотелиальных клеток in vitro: потенциальный медиатор воспалительной реакции при преэклампсии. Ам Дж. Патол (2004)
164 (3): 1049–61.doi:10.1016/S0002-9440(10)63192-6
7. Levine RJ, Maynard SE, Qian C, Lim KH, England LJ, Yu KF, et al. Циркулирующие ангиогенные факторы и риск преэклампсии. N Engl J Med (2004)
350 (7): 672–83. doi:10.1056/NEJMoa031884
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW. Системный воспалительный прайминг при нормальной беременности и преэклампсии: роль циркулирующих микрочастиц синцитиотрофобласта. J Immunol (2007) 178(9):5949–56.
J Immunol (2007) 178(9):5949–56.
doi:10.4049/jimmunol.178.9.5949
9. Spaans F, Vos PD, Bakker WW, van Goor H, Faas MM. Сигналы опасности от
АТФ и аденозина при беременности и преэклампсии. Гипертония (2014)
63(6):1154–60. doi:10.1161/HYPERTENSIONAHA.114.03240
10. Wallace AE, Fraser R, Cartwright JE. Вневорсинчатый трофобласт и децидуальные
естественные клетки-киллеры: партнерство по ремоделированию. Обновление Hum Reprod (2012 г.)
18 (4): 458–71. doi:10.1093/humupd/dms015
11.Свенссон-Арвелунд Дж., Эрнеруд Дж., Бус Э., Клайн Дж. М., Хегер Дж. Д., Диксон
Д. и др. Плацента в токсикологии. Часть II: системная и местная иммунная
адаптации при беременности. Токсикол Патол (2014) 42(2):327–38. doi:10.1177/
01313482205
12. Гордон С., Тейлор П.Р. Моноцитарная и макрофагальная гетерогенность. Nat Rev
Immunol (2005) 5(12):953–64. doi:10.1038/nri1733
13. Ziegler-Heitbrock L, Ancuta P, Crowe S, Dalod M, Grau V, Hart DN, et al.
Номенклатура моноцитов и дендритных клеток крови. Кровь (2010)
116(16):e74–80. doi:10.1182/blood-2010-02-258558
14. Sunderkötter C, Nikolic T, Dillon MJ, Van Rooijen N, Stehling M, Drevets
DA, et al. Субпопуляции моноцитов крови мышей различаются по стадии созревания и воспалительной реакции. J Immunol (2004) 172(7):4410–7.
doi:10.4049/jimmunol.172.7.4410
15. Auffray C, Fogg D, Garfa M, Elain G, Join-Lambert O, Kayal S, et al.Мониторинг кровеносных сосудов и тканей
популяцией моноцитов с патрулирующим
поведением. Наука (2007) 317 (5838): 666–70. doi:10.1126/science.1142883
16. Fingerle G, Pforte A, Passlick B, Blumenstein M, Strobel M, Ziegler-Heitbrock
HW. Новая субпопуляция CD14+/CD16+ моноцитов крови увеличивается у
пациентов с сепсисом. Кровь (1993) 82 (10): 3170–6.
17. Zimmermann HW, Seidler S, Nattermann J, Gassler N, Hellerbrand C, Zer-
necke A, et al.Функциональный вклад повышенных циркулирующих и печеночных не-
классических моноцитов CD14CD16 в воспаление и фиброз печени человека.
PLoS One (2010) 5(6):e11049. doi:10.1371/journal.pone.0011049
18. Mantovani A, Biswas SK, Galdiero MR, Sica A, Locati M. Пластичность и поляризация макрофагов при восстановлении и ремоделировании тканей. Дж. Патол (2013)
229 (2): 176–85. doi:10.1002/path.4133
19. Porcheray F, Viaud S, Rimaniol AC, Léone C, Samah B, Dereuddre-Bosquet N,
et al.Переключение активации макрофагов: актив для разрешения воспаления. Clin Exp Immunol (2005) 142(3):481–9. doi:10.1111/j.365-2249.2005.
02934.x
20. Yang J, Zhang L, Yu C, Yang XF, Wang H. Дифференциация моноцитов и макрофагов. Биомарк Рез (2014) 2(1):1. doi:10.1186/2050-7771-2-1
21. Spahn JH, Kreisel D. Моноциты при стерильном воспалении: набор и функциональные последствия.Arch Immunol Ther Exp (Warsz) (2013) 62 (3): 187–94.
doi:10.1007/s00005-013-0267-5
22. Wegmann TG, Lin H, Guilbert L, Mosmann TR. Двунаправленные взаимодействия цитокинов
в отношениях матери и плода: является ли успешная беременность феноменом Th3
? Immunol Today (1993) 14:353–6. doi:10.1016/0167-5699(93)
doi:10.1016/0167-5699(93)
23. Veenstra van Nieuwenhoven AL, Bouman A, Moes H, Heineman MJ, de Leij LF,
Santema J, et al. Продукция цитокинов натуральными киллерами и лимфоцитами у
беременных по сравнению с женщинами в фолликулярной фазе овариального
цикла.Фертил Стерил (2002) 77 (5): 1032–7. doi:10.1016/S0015-0282(02)02976-X
24. Saito S, Sakai M, Sasaki Y, Tanebe K, Tsuda H, Michimata T. Количественный
анализ периферической крови Th0, Th2, Th3 и Th2 Соотношение клеток :Th3 при нормальной беременности и преэклампсии. Clin Exp Immunol (1999) 117:550–5.
doi:10.1046/j.1365-2249.1999.00997.x
25. Borzychowski AM, Croy BA, Chan WL, Redman CW, Sargent IL. Изменения
системного иммунитета 1-го и 2-го типа при нормальной беременности и преэклампсии
могут быть опосредованы естественными клетками-киллерами.Eur J Immunol (2005) 35(10):3054–63.
doi:10.1002/eji.200425929
26. Ernerudh J, Berg G, Mjösberg J. Регуляторные Т-хелперы при беременности и их роль в системной и местной иммунной толерантности. Am J Reprod Immunol
Регуляторные Т-хелперы при беременности и их роль в системной и местной иммунной толерантности. Am J Reprod Immunol
(2011) 66 (Приложение 1): 31–43. doi:10.1111/j.1600-0897.2011.01049.x
27. Saito S, Nakashima A, Shima T, Ito M. Парадигма клеток Th2/Th3/Th27 и регуляторных T-
при беременности. Am J Reprod Immunol (2010) 63(6):601–10.
дои:10.1111/j.1600-0897.2010.00852.x
28. Siegel I, Gleicher N. Изменения периферических мононуклеаров при беременности.
Am J Reprod Immunol (1981) 1(3):154–5.
29. Kuhnert M, Strohmeier R, Stegmuller M, Halberstadt E. Изменения в субпопуляциях лимфоцитов
при нормальной беременности. Obstet Gynecol (1998) 76:147–51.
30. Veenstra van Nieuwenhoven AL, Bouman A, Moes H, Heineman MJ, de Leij
FMLH, Santema J, et al. Эндотоксин-индуцированная продукция цитокинов моноцитами беременных женщин в третьем триместре по сравнению с женщинами в фолликулярной фазе менструального цикла.Am J Obstet Gynecol (2003) 188:1073–7.
doi:10.1067/mob.2003.263
31. Macey MG, McCarthy DA, Vordermeier S, Newland AC, Brown KA. Влияние методов очистки клеток
на экспрессию CD11b и L-селектина, а также на прилипание и активацию лейкоцитов. J Immunol Methods (1995) 181(2):211–9.
doi:10.1016/0022-1759(95)00003-S
32. Sacks GP, Studena K, Sargent IL, Redman CWG. Нормальная беременность и преэклампсия вызывают воспалительные изменения лейкоцитов периферической крови, сходные с таковыми при сепсисе.Am J Obstet Gynecol (1998) 179:80–6. doi:10.1016/
S0002-9378(98)70254-6
33. Naccasha N, Gervasi MT, Chaiworapongsa T, Berman S, Yoon BH, Maymon
E, et al. Фенотипические и метаболические характеристики моноцитов и гранулоцитов при нормальной беременности и материнской инфекции. Am J Obstet Gynecol (2001)
185(5):1118–23. doi:10.1067/mob.2001.117682
34. Luppi P, Haluszczak C, Betters D, Richard CAH, Trucco M, DeLoia JA. Моноциты
постепенно активируются в кровотоке беременных женщин.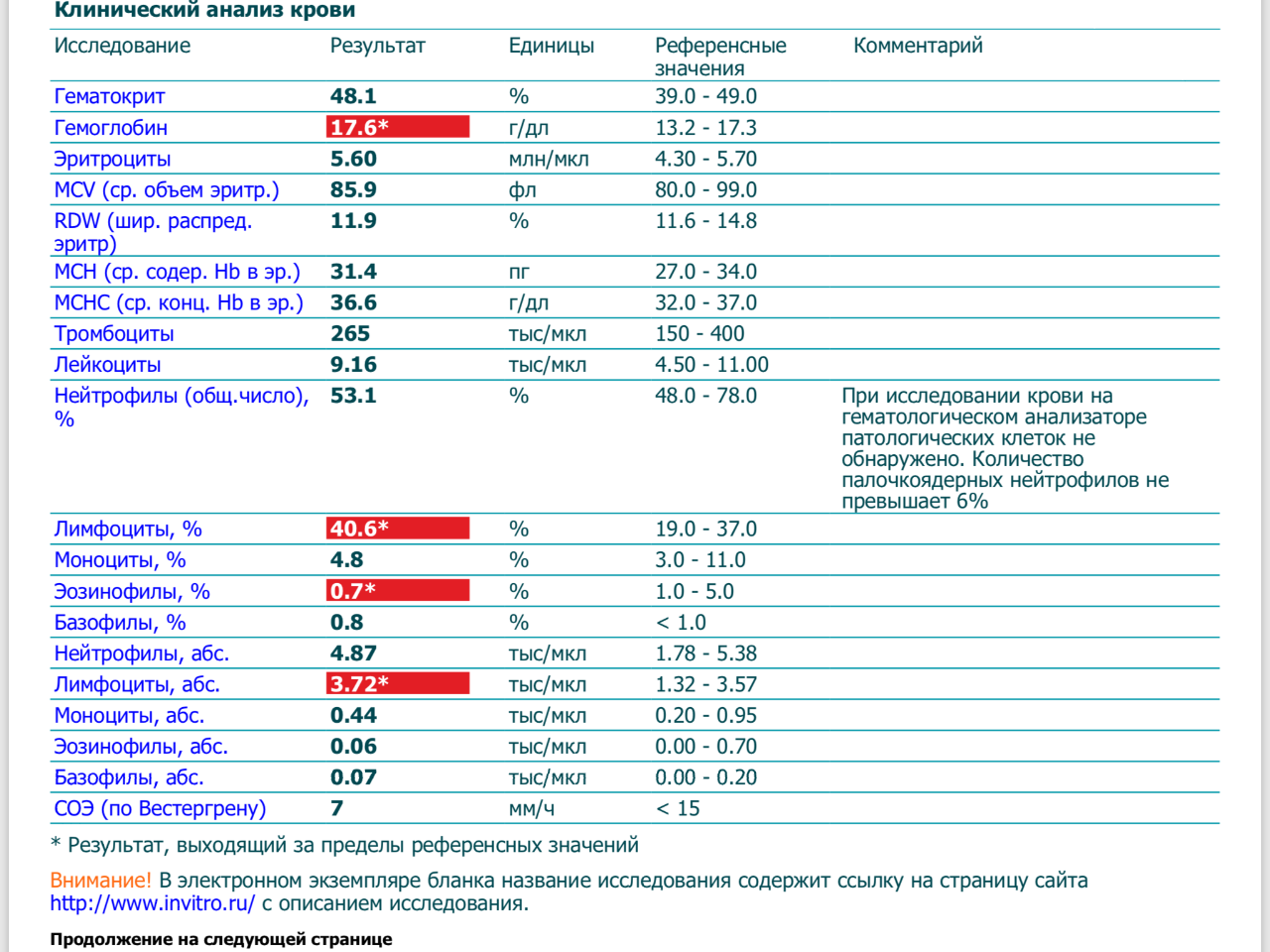 J Leukoc
J Leukoc
Biol (2002) 72(5):874–84.
35. Луппи П., Халущак С., Трукко М., ДеЛойя Дж.А. Нормальная беременность связана с активацией периферических лейкоцитов. Am J Reprod Immunol (2002)
47(2):72–81. doi:10.1034/j.1600-0897.2002.1o041.x
36. Faas MM, Kunnen A, Dekker DC, Harmsen HJ, Aarnoudse JG, Abbas F, et al.
Porphyromonas gingivalis и E-coli индуцируют разные модели продукции цитокинов
у беременных женщин.PLoS One (2014) 9(1):e86355. doi: 10.1371 / журнал.
pone.0086355
37. Бекманн И., Эфраим С.Б., Вервоорт М., Виссер В., Валленбург Х.К.
фактор некроза опухоли-альфа в культурах цельной крови пациенток с преэклампсией и здоровых
беременных и небеременных женщин. Гипертоническая беременность (2004) 23(3):319–29.
doi:10.1081/PRG-200030334
38. Sacks GP, Redman CWG, Sargent IL. Моноциты праймированы для продукции цитокина
Th2-типа IL-12 при нормальной беременности человека: внутриклеточный поток
цитометрический анализ мононуклеарных клеток периферической крови. Clin Exp Immunol
Clin Exp Immunol
(2003) 131(3):490–7. doi:10.1046/j.1365-2249.2003.02082.x
39. Faas MM, Moes H, Fijen JW, Muller Kobold AC, Tulleken JE, Zijlstra JG.
Внутриклеточная продукция цитокинов моноцитами во время эндотоксемии человека с
или без второго введения ЛПС in vitro: влияние RWJ067657, ингибитора МАР-киназы p36
, на гипочувствительность к ЛПС. Clin Exp Immunol (2002)
127:337–43. doi:10.1046/j.1365-2249.2002.01765.x
40.Чен Дж., Ивашкив Л.Б. IFN-γ отменяет толерантность к эндотоксину, способствуя индуцированному toll-
подобным рецептором ремоделированию хроматина. Proc Natl Acad Sci U S A (2010)
107(45):19438–43. doi:10.1073/pnas.1007816107
41. Melgert BN, Spaans F, Borghuis T, Klok PA, Groen B, Bolt A, et al. Беременность
и преэклампсия влияют на субпопуляции моноцитов у людей и крыс. PLoS One (2012)
7(9):e45229. doi:10.1371/journal.pone.0045229
42. Россол М., Краус С., Пирер М. , Бервальд С., Вагнер У.Субпопуляция моноцитов CD14(bright)
, Бервальд С., Вагнер У.Субпопуляция моноцитов CD14(bright)
CD16+ увеличивается при ревматоидном артрите и способствует развитию
Frontiers in Immunology | Воспаление Июнь 2014 | Том 5 | Статья 298 | 8
Повышение провоспалительной реакции моноцитов и плазмоцитоидных дендритных клеток на инфекцию вирусом гриппа А во время беременности | Журнал инфекционных болезней
Аннотация
Изменения иммунитета, вызванные беременностью, могут способствовать повышению заболеваемости, связанной с инфекцией вируса гриппа А во время беременности.Мы охарактеризовали иммунный ответ моноцитов и плазмацитоидных дендритных клеток (пДК) на инфекцию вирусом гриппа А у 21 беременной и 21 небеременной женщины. У беременных моноциты и пДК проявляют усиленный провоспалительный иммунный ответ на 2 штамма вируса гриппа А по сравнению с небеременными женщинами, характеризующийся повышенной экспрессией главного комплекса гистосовместимости II класса (примерно в 2,0 раза), CD69 (примерно в 2,2 раза) , индуцированный интерфероном γ белок 10 (приблизительно 2.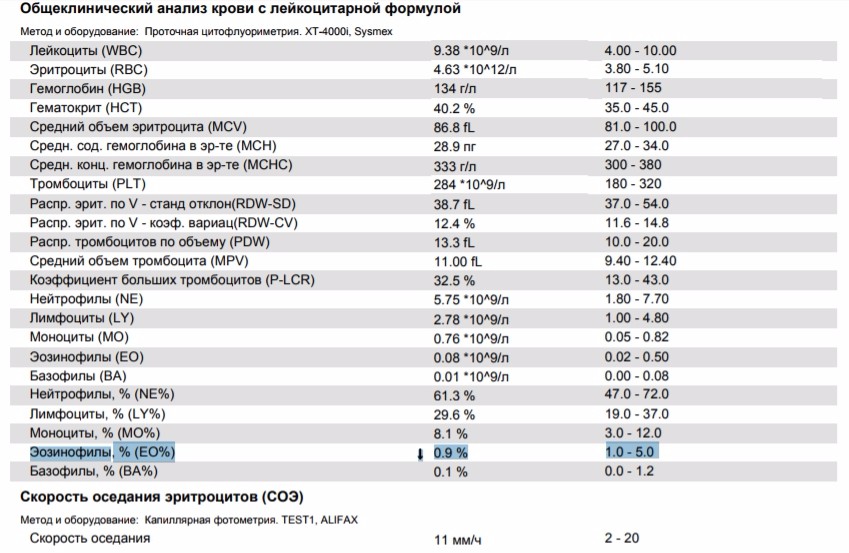 в 0 раз) и воспалительного белка макрофагов 1β (примерно в 1,5 раза). Эта усиленная врожденная воспалительная реакция во время беременности может способствовать воспалению легких после инфицирования вирусом гриппа А.
в 0 раз) и воспалительного белка макрофагов 1β (примерно в 1,5 раза). Эта усиленная врожденная воспалительная реакция во время беременности может способствовать воспалению легких после инфицирования вирусом гриппа А.
У беременных женщин, инфицированных вирусом гриппа А, заболеваемость и смертность значительно выше, чем у небеременных женщин, инфицированных вирусом гриппа А [1]. Повышенная заболеваемость и смертность особенно заметны во время пандемий, однако они возникают и при ежегодном сезонном гриппе [2].Степень, в которой изменения в иммунной системе во время беременности способствуют этому увеличению заболеваемости и смертности, остается неясной.
Некоторые аспекты иммунитета подавляются во время беременности, что позволяет матери переносить антигены плода. Например, естественные киллеры (NK) и Т-клетки беременных женщин были дефицитны в продукции интерферона γ (IFN-γ) и макрофагального воспалительного белка 1β (MIP-1β) после стимуляции цитокинов [3]. Однако NK- и Т-клетки беременных женщин демонстрировали усиленный ответ IFN-γ и MIP-1β на вирус гриппа А по сравнению с таковыми у небеременных женщин [4].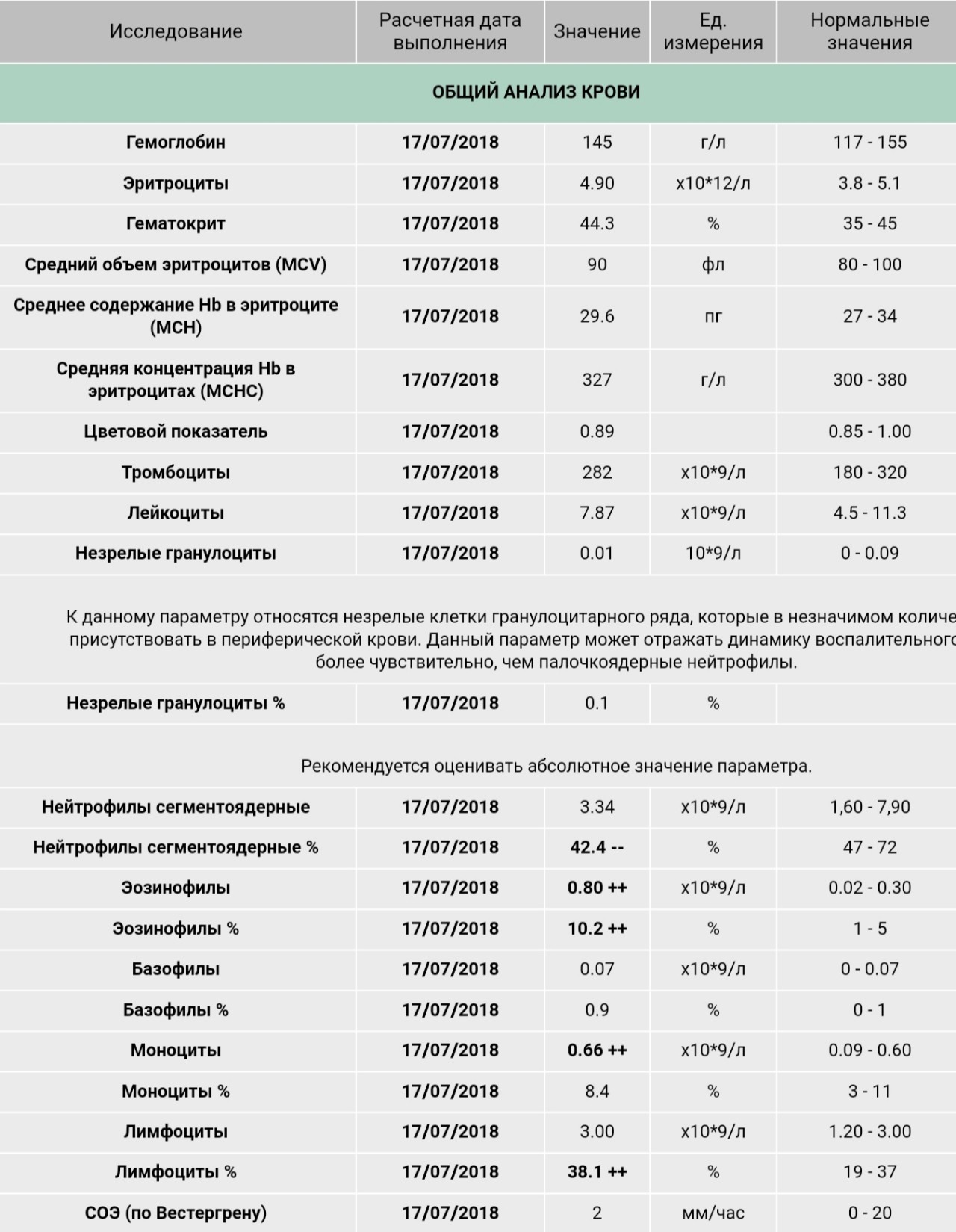 Эти противоречивые результаты предполагают, что клеточные иммунные ответы не подавляются повсеместно, а вместо этого зависят либо от условий стимуляции (цитокин против вируса гриппа А), либо от контекста стимуляции. Например, в первом исследовании NK- и Т-клетки выделяли до стимуляции, тогда как в последнем NK- и Т-клетки стимулировали в контексте инфекции цельных мононуклеарных клеток периферической крови (PBMC), что позволяло осуществлять межклеточную коммуникацию. .
Эти противоречивые результаты предполагают, что клеточные иммунные ответы не подавляются повсеместно, а вместо этого зависят либо от условий стимуляции (цитокин против вируса гриппа А), либо от контекста стимуляции. Например, в первом исследовании NK- и Т-клетки выделяли до стимуляции, тогда как в последнем NK- и Т-клетки стимулировали в контексте инфекции цельных мононуклеарных клеток периферической крови (PBMC), что позволяло осуществлять межклеточную коммуникацию. .
Моноциты и плазмоцитоидные дендритные клетки (pDC) продуцируют цитокины и хемокины для активации и рекрутирования NK- и Т-клеток и играют ключевую роль в элиминации вируса гриппа А [5, 6].Вирусная инфекция гриппа увеличивает экспрессию моноцитов и pDC маркеров активации, таких как CD69 и молекула главного комплекса гистосовместимости класса II HLA-DR, способствуя активации CD4 + Т-клеток [7]. Моноциты и pDC продуцируют провоспалительные цитокины, такие как интерферон-α (IFN-α), и хемокины, такие как IFN-γ-индуцируемый белок 10 (IP-10) и MIP-1β.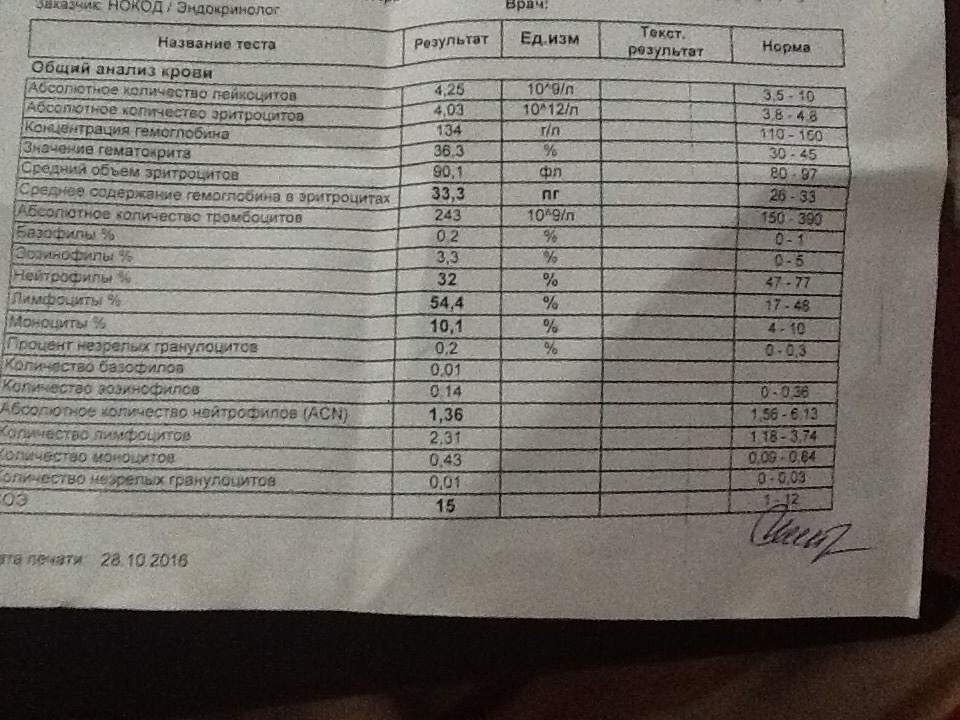 IP-10 и MIP-1β рекрутируют и активируют иммунные эффекторные клетки, такие как нейтрофилы, CD8 + Т-клетки и NK-клетки, способствуя элиминации вируса гриппа А [8, 9].В одном исследовании РВМС беременных женщин продуцировали меньше IFN-α и IFN-λ, чем РВМС небеременных женщин в ответ на вирус гриппа А [10]. Таким образом, возможно, что различные ответы моноцитов и пДК на инфекцию вируса гриппа А могут способствовать различиям в функции NK и Т-клеток.
IP-10 и MIP-1β рекрутируют и активируют иммунные эффекторные клетки, такие как нейтрофилы, CD8 + Т-клетки и NK-клетки, способствуя элиминации вируса гриппа А [8, 9].В одном исследовании РВМС беременных женщин продуцировали меньше IFN-α и IFN-λ, чем РВМС небеременных женщин в ответ на вирус гриппа А [10]. Таким образом, возможно, что различные ответы моноцитов и пДК на инфекцию вируса гриппа А могут способствовать различиям в функции NK и Т-клеток.
Здесь, в свете потенциальной перекрестной связи между РВМС, мы оценили, изменяет ли беременность реакцию моноцитов и рДК на вирус гриппа А A/California/7/2009 (ph2N1) и A/Victoria/361/2011 (h4N2) у люди.Воспользовавшись возможностью профилировать множественные иммунные параметры в высоком измерении с помощью масс-цитометрии, мы оценили экспрессию маркеров активации и продукцию цитокинов и хемокинов моноцитами и пДК в когорте из 21 беременной и 21 небеременной женщины.
МЕТОДЫ
Участники и план исследования
В период с октября 2013 г. по март 2014 г. была набрана 21 здоровая беременная женщина из акушерской клиники детской больницы Люсиль Паккард.В Стэнфордском отделе клинических и трансляционных исследований была набрана 21 небеременная женщина. Собирали венозную кровь. Критерии участия перечислены на рисунке 1 A . Это исследование было проведено в соответствии с Хельсинкской декларацией и одобрено Институциональным наблюдательным советом Стэнфордского университета; письменное информированное согласие было получено от всех участников.
по март 2014 г. была набрана 21 здоровая беременная женщина из акушерской клиники детской больницы Люсиль Паккард.В Стэнфордском отделе клинических и трансляционных исследований была набрана 21 небеременная женщина. Собирали венозную кровь. Критерии участия перечислены на рисунке 1 A . Это исследование было проведено в соответствии с Хельсинкской декларацией и одобрено Институциональным наблюдательным советом Стэнфордского университета; письменное информированное согласие было получено от всех участников.Рисунок 1.
Моноциты и плазмацитоидные дендритные клетки (pDC) Частота и скорость инфицирования вирусом гриппа A/California/7/2009 (ph2N1) и A/Victoria/361/2011 (h4N2) у беременных (P) и небеременных (НП) женщин.Мононуклеарные клетки периферической крови (МКПК) женщин в группах НП (черные точки) и П (серые точки) были инфицированы вирусом гриппа А ph2N1 или h4N2 при множественности заражения 3 в течение 7 часов или были ложно инфицированы (NS). A , Демографические характеристики когорты.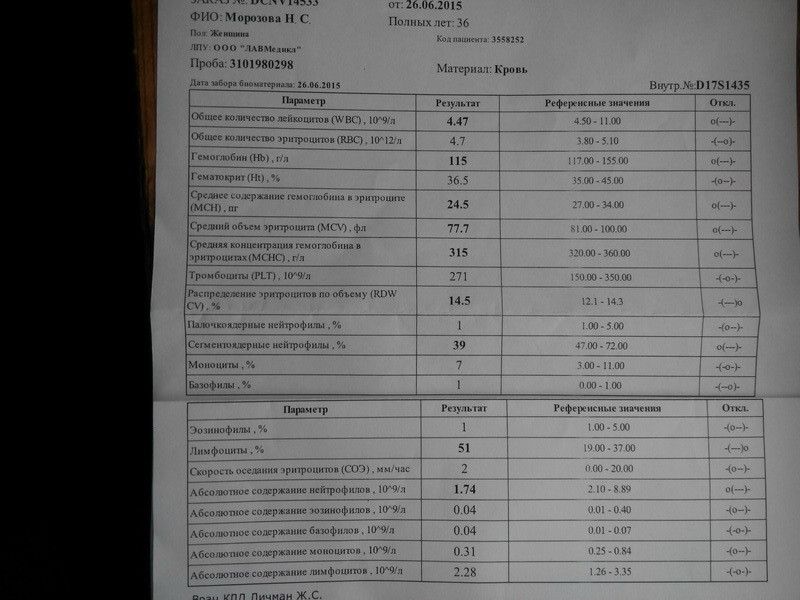 B , Частота моноцитов и пДК. C , Частота нуклеопротеинов вируса гриппа (NP)-положительных моноцитов и pDC, соответственно, по данным внутриклеточного окрашивания. Каждая точка представляет частоту клеток от 1 пациента.Столбцы представляют среднее значение для каждой совокупности. * P < 0,05, *** P < 0,001 и **** P < 0,0001 для различий между группами P и NP.
B , Частота моноцитов и пДК. C , Частота нуклеопротеинов вируса гриппа (NP)-положительных моноцитов и pDC, соответственно, по данным внутриклеточного окрашивания. Каждая точка представляет частоту клеток от 1 пациента.Столбцы представляют среднее значение для каждой совокупности. * P < 0,05, *** P < 0,001 и **** P < 0,0001 для различий между группами P и NP.
Рисунок 1.
Моноциты и плазмацитоидные дендритные клетки (pDC) Частота и скорость инфицирования вирусом гриппа A/California/7/2009 (ph2N1) и A/Victoria/361/2011 (h4N2) у беременных (P) и небеременных (НП) женщин. Мононуклеарные клетки периферической крови (МКПК) женщин в группах НП (черные точки) и П (серые точки) были инфицированы вирусом гриппа А ph2N1 или h4N2 при множественности заражения 3 в течение 7 часов или были ложно инфицированы (NS). A , Демографические характеристики когорты. B , Частота моноцитов и пДК. C , Частота нуклеопротеинов вируса гриппа (NP)-положительных моноцитов и pDC, соответственно, по данным внутриклеточного окрашивания.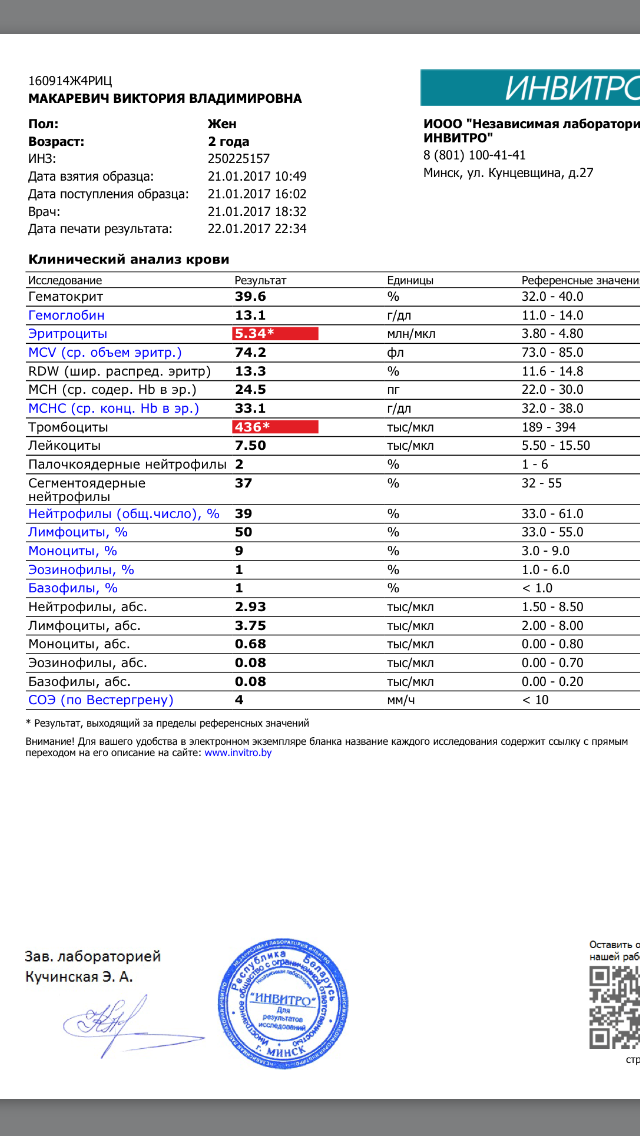 Каждая точка представляет частоту клеток от 1 пациента. Столбцы представляют среднее значение для каждой совокупности. * P < 0,05, *** P < 0,001 и **** P < 0,0001 для различий между группами P и NP.
Каждая точка представляет частоту клеток от 1 пациента. Столбцы представляют среднее значение для каждой совокупности. * P < 0,05, *** P < 0,001 и **** P < 0,0001 для различий между группами P и NP.
Изоляция РВМС, подготовка вируса и заражение
РВМС выделяли из цельной крови с помощью Ficoll-Paque (GE Healthcare) и криоконсервировали в смеси 90% эмбриональной бычьей сыворотки (Thermo Scientific)/10% диметилсульфоксида (Sigma-Aldrich).Вирусы гриппа А дикого типа ph2N1 и h4N2 размножали в эмбрионах куриных яиц. Криоконсервированные РВМС оттаивали, промывали и ресуспендировали в бессывороточной среде перед заражением ph2N1 или h4N2 при множественности заражения 3 в течение 1 часа при 37°С, после чего добавляли сыворотку до достижения 10% фетальной бычьей сыворотки. Через 2 часа клетки ресуспендировали с 2 мкМ монензина и 3 мкг/мл брефельдина А в течение 4 часов, в результате чего общая продолжительность стимуляции составила 7 часов [4].
Окрашивание клеток и получение CyTOF
Подробные протоколы окрашивания описаны в другом месте [11].Панели окрашивания описаны в дополнительной таблице 1. Все антитела были конъюгированы с использованием наборов для мечения MaxPar X8 (DVS Sciences). Окрашенные клетки анализировали на CyTOF-1 (Fluidigm) и анализировали с помощью FloJo v10 (Treestar).
Статистический анализ
Статистический анализ выполнен с использованием GraphPad Prism, версия 7.0a (программное обеспечение GraphPad). Характеристики беременных и контрольных участников сравнивали с использованием тестов Манна-Уитни. A P значение < .05 считалось статистически значимым.
РЕЗУЛЬТАТЫ
Частота и уровни заражения вирусом гриппа А в моноцитах и пДК
Мы количественно оценили частоты CD14 + моноцитов и CD4 + CD123 + pDC в размороженных PBMC, полученных от 21 беременной и 21 небеременной женщины (см. Дополнительную фигуру 1 для схемы селекции). В ложно инфицированных (нестимулированных) образцах у беременных женщин частота моноцитов в 1,4 раза выше ( P = .04) и в 1,7 раза более высокая частота pDC ( P = 0,03) по сравнению с контролем (рис. 1 B и дополнительные таблицы 2 и 3) в соответствии с предыдущими исследованиями [12]. После инфицирования вирусами гриппа А ph2N1 и h4N2 существенной разницы в частоте моноцитов не наблюдалось. Однако частота пДК оставалась значительно выше у беременных после инфекции ph2N1 (в 2,1 раза выше; P = 0,02) или h4N2 (в 1,4 раза выше; P = 0,04) (рис. 1 B и Дополнительные таблицы 2 и 3).Не было никаких существенных различий в частоте инфицирования моноцитов или пДК у беременных и небеременных женщин, инфицированных вирусом гриппа А ph2N1 или h4N2, на основании окрашивания внутриклеточного нуклеопротеина вируса гриппа А (рис. 1 C ).
Дополнительную фигуру 1 для схемы селекции). В ложно инфицированных (нестимулированных) образцах у беременных женщин частота моноцитов в 1,4 раза выше ( P = .04) и в 1,7 раза более высокая частота pDC ( P = 0,03) по сравнению с контролем (рис. 1 B и дополнительные таблицы 2 и 3) в соответствии с предыдущими исследованиями [12]. После инфицирования вирусами гриппа А ph2N1 и h4N2 существенной разницы в частоте моноцитов не наблюдалось. Однако частота пДК оставалась значительно выше у беременных после инфекции ph2N1 (в 2,1 раза выше; P = 0,02) или h4N2 (в 1,4 раза выше; P = 0,04) (рис. 1 B и Дополнительные таблицы 2 и 3).Не было никаких существенных различий в частоте инфицирования моноцитов или пДК у беременных и небеременных женщин, инфицированных вирусом гриппа А ph2N1 или h4N2, на основании окрашивания внутриклеточного нуклеопротеина вируса гриппа А (рис. 1 C ).
Влияние вируса гриппа А на моноциты и активацию pDC во время беременности
Чтобы оценить, изменяется ли иммунный ответ моноцитов и пДК на вирус гриппа А во время беременности, мы измерили экспрессию маркеров активации HLA-DR и CD69.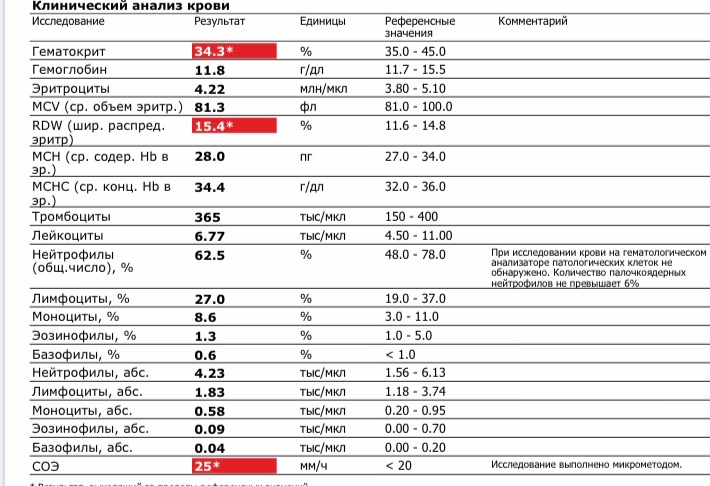 Инфекция вирусом гриппа А ph2N1 и h4N2 значительно увеличивала экспрессию CD69 в моноцитах и pDC как у беременных, так и у контрольных женщин (рис. 2 A , дополнительная фигура 4 и дополнительные таблицы 3 и 4). Однако активация моноцитов была значительно более резкой во время беременности. Экспрессия CD69 была в 1,9 раза выше в моноцитах, инфицированных h2N1 ( P = 0,05), и в 2,4 раза выше в моноцитах, инфицированных h4N2 ( P = 0,005) у беременных женщин, по сравнению с контрольной группой (рис. 2). А ).Точно так же экспрессия HLA-DR на инфицированных моноцитах была в 1,4 раза (для ph2N1; P = 0,01) и в 1,8 раза (для h4N2; P = 0,01) выше у беременных женщин (рис. 2, B и Дополнительный рисунок 4 B ). В pDC не было значительных различий в активации CD69 между беременными и контрольными женщинами (рисунок 2 A и дополнительный рисунок 4 A ). Однако экспрессия HLA-DR была в 8,9 раз выше на исходном уровне ( P = 0,0001) и 2.
Инфекция вирусом гриппа А ph2N1 и h4N2 значительно увеличивала экспрессию CD69 в моноцитах и pDC как у беременных, так и у контрольных женщин (рис. 2 A , дополнительная фигура 4 и дополнительные таблицы 3 и 4). Однако активация моноцитов была значительно более резкой во время беременности. Экспрессия CD69 была в 1,9 раза выше в моноцитах, инфицированных h2N1 ( P = 0,05), и в 2,4 раза выше в моноцитах, инфицированных h4N2 ( P = 0,005) у беременных женщин, по сравнению с контрольной группой (рис. 2). А ).Точно так же экспрессия HLA-DR на инфицированных моноцитах была в 1,4 раза (для ph2N1; P = 0,01) и в 1,8 раза (для h4N2; P = 0,01) выше у беременных женщин (рис. 2, B и Дополнительный рисунок 4 B ). В pDC не было значительных различий в активации CD69 между беременными и контрольными женщинами (рисунок 2 A и дополнительный рисунок 4 A ). Однако экспрессия HLA-DR была в 8,9 раз выше на исходном уровне ( P = 0,0001) и 2.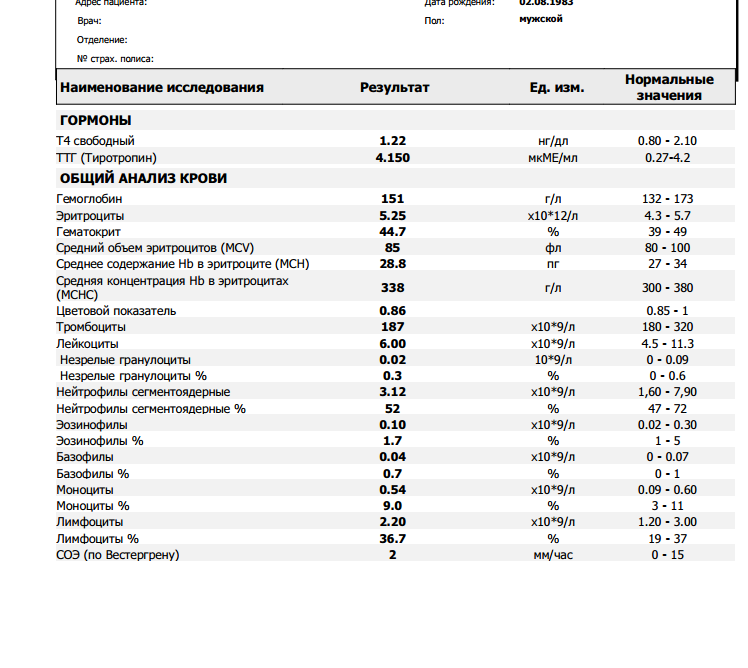 В 1 раз выше после инфицирования вирусом h2N1 ( P = 0,01) у беременных женщин (рис. 2 A и 2 B и дополнительный рисунок 4 B ). Не было различий в частоте моноцитов или pDC, экспрессирующих HLA-DR и CD69, во втором и третьем триместрах беременности (дополнительная фигура 3).
В 1 раз выше после инфицирования вирусом h2N1 ( P = 0,01) у беременных женщин (рис. 2 A и 2 B и дополнительный рисунок 4 B ). Не было различий в частоте моноцитов или pDC, экспрессирующих HLA-DR и CD69, во втором и третьем триместрах беременности (дополнительная фигура 3).Рисунок 2.
Иммунный ответ моноцитов и плазмацитоидных дендритных клеток (pDC) на инфекцию вируса гриппа A/California/7/2009 (ph2N1) и A/Victoria/361/2011 (h4N2) у беременных (P) и небеременных ( НП) женщины.Мононуклеарные клетки периферической крови (МКПК) женщин в группах НП (черные точки) и П (серые точки) были инфицированы вирусом гриппа А ph2N1 или h4N2 при множественности заражения 3 в течение 7 часов или были ложно инфицированы (NS). A , Частота CD69-экспрессирующих моноцитов (слева) и пДК (справа). B , Частота экспрессии HLA-DR на моноцитах и пДК. C и D , Частота моноцитов и pDCs, продуцирующих интерферон γ-индуцированный белок 10 (IP-10) и макрофагальный воспалительный белок 1β (MIP-1β), соответственно. Каждая точка представляет частоту клеток для 1 пациента. * P < 0,05, ** P < 0,01, *** P < 0,001 и **** P < 0,0001 для различий между группами P и NP.
Каждая точка представляет частоту клеток для 1 пациента. * P < 0,05, ** P < 0,01, *** P < 0,001 и **** P < 0,0001 для различий между группами P и NP.
Рисунок 2.
Иммунный ответ моноцитов и плазмацитоидных дендритных клеток (pDC) на вирус гриппа A/California/7/2009 (ph2N1) и A/Victoria/361/2011 (h4N2) у беременных (P) и небеременных (НП) женщины. Мононуклеарные клетки периферической крови (МКПК) женщин в группах НП (черные точки) и П (серые точки) были инфицированы вирусом гриппа А ph2N1 или h4N2 при множественности заражения 3 в течение 7 часов или были ложно инфицированы (NS). A , Частота CD69-экспрессирующих моноцитов (слева) и пДК (справа). B , Частота экспрессии HLA-DR на моноцитах и пДК. C и D , Частота моноцитов и pDCs, продуцирующих интерферон γ-индуцированный белок 10 (IP-10) и макрофагальный воспалительный белок 1β (MIP-1β), соответственно. Каждая точка представляет частоту клеток для 1 пациента. * P < 0,05, ** P < 0,01, *** P < 0,001 и **** P < .0001 для различий между группами P и NP.
* P < 0,05, ** P < 0,01, *** P < 0,001 и **** P < .0001 для различий между группами P и NP.
Влияние вируса гриппа А на функцию моноцитов и pDC во время беременности
Для оценки функциональных ответов моноцитов и пДК на вирус гриппа А у беременных и небеременных женщин мы оценили внутриклеточные уровни провоспалительного цитокина IFN-α и хемокинов MIP-1β и IP-10. Как у беременных, так и у небеременных женщин инфекция вируса гриппа А привела к значительно более высокой частоте моноцитов и pDC, продуцирующих IFN-α, IP-10 и MIP-1β (рис. 2 C и 2 D , дополнительные рисунки 2 и 4 и дополнительные таблицы 3 и 4).Не было никаких существенных различий в частоте моноцитов и pDC, продуцирующих IFN-α, между беременными и небеременными женщинами (дополнительная фигура 3), хотя наблюдалось значительное увеличение средней интенсивности сигнала (MSI) IFN-α среди беременных женщин в ответ к вирусу гриппа А (дополнительная фигура 4). После инфекции ph2N1 и h4N2 у беременных женщин наблюдалась значительно более высокая частота моноцитов и пДК, продуцирующих IP-10, чем у небеременных женщин, с 2,0-кратным увеличением частоты моноцитов, продуцирующих IP-10, и 1.6-кратное увеличение частоты pDC, продуцирующих IP-10 (рис. 2 C ). Кроме того, у беременных женщин было 1,5-кратное увеличение процента пДК, продуцирующих MIP-1β, после заражения вирусами гриппа А ph2N1 и h4N2 (рис. 2 D ). Таким образом, ответы моноцитов и пДК на вирусы гриппа А ph2N1 и h4N2 усиливаются во время беременности.
После инфекции ph2N1 и h4N2 у беременных женщин наблюдалась значительно более высокая частота моноцитов и пДК, продуцирующих IP-10, чем у небеременных женщин, с 2,0-кратным увеличением частоты моноцитов, продуцирующих IP-10, и 1.6-кратное увеличение частоты pDC, продуцирующих IP-10 (рис. 2 C ). Кроме того, у беременных женщин было 1,5-кратное увеличение процента пДК, продуцирующих MIP-1β, после заражения вирусами гриппа А ph2N1 и h4N2 (рис. 2 D ). Таким образом, ответы моноцитов и пДК на вирусы гриппа А ph2N1 и h4N2 усиливаются во время беременности.
ОБСУЖДЕНИЕ
Во время беременности иммунная система сталкивается с проблемой предотвращения отторжения плода и одновременной защиты от патогенов.Эта проблема может способствовать необычной восприимчивости беременных женщин к осложнениям, вызванным инфекцией, вызванной вирусом гриппа А. Моноциты и пДК являются ключевыми клетками врожденного иммунитета в защите от вирусной инфекции гриппа А. Здесь мы оценили иммунный фенотип и функцию моноцитов и пДК беременных женщин при инфицировании РВМС вирусами гриппа ph2N1 и h4N2. Моноциты и клетки pDC демонстрируют повышенную экспрессию маркеров активации HLA-DR и CD69, повышенную продукцию IP-10 и повышенную продукцию MIP-1β pDC у беременных женщин.Эти данные подтверждают идею о том, что моноциты и пДК проявляют повышенную активацию и провоспалительный фенотип при заражении вирусом гриппа А во время беременности. Эта чрезмерная активация может исказить иммунный ответ от здорового ответа до разрушительной, если не фатальной реакции.
Здесь мы оценили иммунный фенотип и функцию моноцитов и пДК беременных женщин при инфицировании РВМС вирусами гриппа ph2N1 и h4N2. Моноциты и клетки pDC демонстрируют повышенную экспрессию маркеров активации HLA-DR и CD69, повышенную продукцию IP-10 и повышенную продукцию MIP-1β pDC у беременных женщин.Эти данные подтверждают идею о том, что моноциты и пДК проявляют повышенную активацию и провоспалительный фенотип при заражении вирусом гриппа А во время беременности. Эта чрезмерная активация может исказить иммунный ответ от здорового ответа до разрушительной, если не фатальной реакции.
Эти наблюдения согласуются с той важной ролью, которую статус активации моноцитов и пДК играет в иммунном ответе на вирус гриппа А [5, 6]. Повышенная частота и статус активации моноцитов и пДК в ответ на инфекцию вируса гриппа А могут усиливать примирование и активацию других иммунных клеток, особенно Т-клеток CD4 + , распознающих HLA-DR.Это может объяснить усиленный CD4 + Т-клеточный ответ беременных женщин на инфицирование вирусом гриппа смешанных культур РВМС, о котором мы сообщали ранее [4].
Еще более драматичным, чем повышенный статус активации, было повышение продукции IP-10 и MIP-1β, отмеченное в моноцитах и пДК беременных женщин в ответ на инфекцию вируса гриппа А. Хемокины, такие как IP-10 и MIP-1β, играют важную роль в рекрутировании эффекторных клеток, таких как нейтрофилы, NK-клетки и Т-клетки, для обеспечения элиминации вируса гриппа.Однако несколько линий доказательств подтверждают идею о том, что повышенное количество хемокинов во время инфекции вируса гриппа связано с повышенным уровнем заболеваемости и смертности [13]. Например, системные уровни IP-10 были значительно повышены в сыворотке пациентов с острым респираторным дистресс-синдромом (ОРДС), вызванным вирусом сезонного гриппа A(h2N1) 2009 г., по сравнению с пациентами без осложнений [14]. Кроме того, в мышиной модели ось IP-10 и CXCR3 усиливает развитие ОРДС посредством рекрутирования нейтрофилов после заражения вирусом гриппа ph2N1 [15].Наши результаты и эти предыдущие открытия предполагают, что во время беременности инфекция вируса гриппа А приводит к острой и чрезмерной продукции IP-10 и MIP-1β моноцитами и пДК, что может способствовать ОРДС и другим респираторным осложнениям, повышая риск гриппоподобных заболеваний. ассоциированная смертность среди беременных.
Моноциты и пДК являются наиболее мощными продуцентами IFN-α в составе РВМС человека. Forbes и соавт. сообщили, что продукция IFN-α нарушается в PBMC у беременных женщин по сравнению с контрольной группой при заражении вирусом гриппа [10].Здесь мы не обнаружили различий в частоте IFN-α-продуцирующих моноцитов и пДК между беременными женщинами и контрольной группой. Причины этого несоответствия неясны, но важно отметить, что существует несколько различий в дизайне исследования, которые могут объяснить результаты. Во-первых, после проведения временного анализа для определения времени пиковой активности клеток врожденного иммунитета мы использовали масс-цитометрию для оценки частоты клеток, продуцирующих цитокины, через 7 часов после заражения. В предыдущих исследованиях изучалась концентрация цитокинов через 48 часов культивирования, когда мы наблюдали значительные уровни гибели клеток в моноцитах и пДК в инфицированных культурах.Таким образом, возможно, что моноциты и пДК у беременных женщин продуцируют меньшие уровни цитокинов на клетку или что на результаты повлияли различия во времени ответа. Необходимы дальнейшие исследования для выяснения конкретных типов клеток и механизмов, дефектных в продукции IFN-α из всех РВМС во время беременности во время инфекции вируса гриппа А. Кроме того, во всех исследованиях участвовали относительно небольшие когорты субъектов с различным предшествующим статусом иммунизации и различиями в расовом распределении, что могло дополнительно повлиять на результаты.
Эффективный противовирусный ответ обусловлен взаимодействием между иммунными клетками как языком для достижения надлежащего и здорового иммунного ответа. Следует отметить, что в нескольких предшествующих исследованиях иммунитета к гриппу во время беременности, особенно тех, которые были сосредоточены на NK- и Т-клетках, эти клетки изучались изолированно и было обнаружено, что их ответы подавлены [3]. Такие исследования исключали перекрестные помехи с другими иммунными клетками. Наше обнаружение того, что моноциты и пДК имеют повышенный хемокиновый ответ на вирус гриппа А во время беременности, может объяснить наш предыдущий вывод с использованием смешанных инфекций, что ответы NK-клеток и Т-клеток были усилены, поскольку лимфоциты могли быть активированы моноцитами и пДК. [4].Степень, в которой врожденные и адаптивные иммунные клетки взаимодействуют во время инфекции вируса гриппа, может обеспечить дальнейшее понимание патогенеза гриппа.
Таким образом, мы сообщаем здесь, что моноциты и пДК при беременности проявляют выраженный провоспалительный фенотип во время инфекции вирусом гриппа А in vitro. Эти данные вместе с нашей предыдущей работой, подчеркивающей повышенную чувствительность Т-клеток и NK-клеток к инфекции вируса гриппа А ph2N1, предоставляют дополнительные доказательства, подтверждающие усиленный и непропорциональный воспалительный ответ на вирус гриппа А во время беременности.Этот усиленный ответ может способствовать повышенной заболеваемости и смертности во время беременности и может предоставить возможности для терапевтического вмешательства.
Примечания
Благодарности. Мы благодарим беременных и добровольцев контрольной группы за их участие; Канта Суббарао, MBBS, MPH (Национальный институт здравоохранения) за предоставление вируса гриппа; Джоанн Лау за выдающуюся помощь в регистрации беременных пациенток; и Салли Макки (менеджер по регулированию и данным), Сью Своуп, RN (менеджер клиники), Тони Трела и Нэнси Мастман (медсестры-исследователи), Ашима Гоэл, Ракель Флейшманн, Кирстен Спанн и Сушил Батра (ассистенты по клиническим исследованиям, которые оказывали регуляторную поддержку , составление расписания и ввод данных) и Мишель Угур (флеботомист; все сотрудники Стэнфордской программы вакцинации LPCH) за набор добровольцев в контрольную группу.
Финансовая поддержка. Эта работа была поддержана Благотворительным фондом Дорис Дьюк (премия за развитие клинических ученых 2013 г., 2013099 для CAB), Стэнфордским научно-исследовательским институтом детского здоровья (награда Талии и Джона Моргридж для стипендиатов факультета CAB), Премией факультета Маккормика (для CAB), Консорциум Стэнфордского проекта иммунологии человека (Фонд инфраструктуры и возможностей для CAB и гранты U19AI0 и U19A1057229 для MMD), Стэнфордский научно-исследовательский институт детского здоровья (Стэнфордская клиническая и трансляционная научная награда UL1 TR000093 для A.WK), Национальных институтов здравоохранения (NIH; учебный грант [вирусные инфекции у детей] T32 AI78896-05 для AWK), стипендия для выпускников Stanford Family Smith (для NLB) и NIH/Национальный центр исследовательских ресурсов (клинические и премия переводческой науки UL1 RR025744).
Возможные конфликты интересов. Все авторы: Нет сообщений о конфликтах. Все авторы представили форму ICMJE для раскрытия потенциальных конфликтов интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Каталожные номера
1Куртис
АП
,Чтение
JS
,Джеймисон
DJ
.Беременность и инфекции
.N Engl J Med
2014
;371
:1075
–7
.2Расмуссен
СА
,Джеймисон
DJ
,Бриз
JS
.Пандемический грипп и беременные женщины
.Emerg Infect Dis
2008
;14
:95
–100
.3Краус
ТА
,Engel
SM
,Sperling
RS
и др. .Характеристика иммунного фенотипа при беременности: результаты исследования вирусного иммунитета и беременности (ВИП)
.J Clin Immunol
2012
;32
:300
–11
.4Кей
АВ
,Фукуяма
J
,Азиз
N
и др. .Усиленный ответ естественных клеток-киллеров и Т-клеток на вирус гриппа А во время беременности
.Proc Natl Acad Sci USA
2014
;111
:14506
–11
.5Аллен
ИЦ
,Череп
MA
,Мур
CB
и др. .Инфламмасома NLRP3 опосредует in vivo врожденный иммунитет к вирусу гриппа А посредством распознавания вирусной РНК
.Иммунитет
2009
;30
:556
–65
.6Ичинохе
Т
,Панг
ИК
,Ивасаки
А
.Вирус гриппа активирует инфламмасомы через свой внутриклеточный ионный канал M2
.Нат Иммунол
2010
;11
:404
–10
.7Гертсван Кессель
Ч
,Willart
MAM
,van Rijt
LS
и др. .Клиренс вируса гриппа из легких зависит от мигрирующих лангерин+CD11b-, но не от плазмоцитоидных дендритных клеток
.J Exp Med
2008
;205
:1621
–34
.8Бусфельд
Д
,Kaufmann
A
,Meyer
RG
,Gemsa
D
,Sprenger
H
.Дифференциальные мононуклеарные лейкоциты, привлекающие продукцию хемокинов после стимуляции активным и инактивированным вирусом гриппа А
.Селл Иммунол
1998
;186
:1
–7
.9Дюфур
ДЖХ
,dziejman
M
,LIU
MT
,Leung
JH
,Lane
TE
,Luster
AD
.Мыши с дефицитом белка 10 (IP-10; CXCL10), индуцируемого гамма-интерфероном, обнаруживают роль IP-10 в образовании и переносе эффекторных Т-клеток
.J Иммунол
2002
;168
:3195
–204
.10Форбс
РЛ
,Wark
PAB
,Murphy
VE
,Gibson
PG
.Беременные женщины имеют ослабленный врожденный интерфероновый ответ на вирус пандемического гриппа А 2009 года подтипа h2N1
.J Infect Dis
2012
;206
:646
–53
.11Штраус-Олби
немецких марок ,Fukuyama
J
,Liang
EC
и др. .Разнообразие репертуара NK-клеток человека отражает иммунный опыт и коррелирует с восприимчивостью к вирусам
.Sci Transl Med
2015
;7
:297ra115
.12Краус
ТА
,Sperling
RS
,Engel
SM
и др..Цитокиновый профиль периферической крови при беременности и в послеродовом периоде
.Am J Reprod Immunol
2010
;64
:411
–26
.13де Йонг
МД
,Simmons
CP
,Thanh
TT
и др. .Летальный исход человеческого гриппа А (H5N1) связан с высокой вирусной нагрузкой и гиперцитокинемией
.Nat Med
2006
;12
:1203
–7
.14от
до
ККВ
,Hung
IFN
,Li
IWS
и др. .Замедленный клиренс вирусной нагрузки и заметная активация цитокинов в тяжелых случаях пандемического гриппа h2N1 2009
.Clin Infect Dis
2010
;50
:850
–9
.15Итикава
А
,Куба
К
,Морита
М
и др. .CXCL10-CXCR3 усиливает развитие опосредованного нейтрофилами молниеносного повреждения легких вирусного и невирусного происхождения
.Am J Respir Crit Care Med
2013
;187
:65
–77
.Примечания автора
© Автор 2016.Опубликовано Oxford University Press для Американского общества инфекционистов. Все права защищены. Для получения разрешений отправьте электронное письмо по адресу [email protected].Материнские моноциты при беременности и преэклампсии у людей и крыс
%PDF-1.7 % 1 0 объект > /Метаданные 2 0 R /Имена 3 0 Р /OpenAction [4 0 R /FitH 910] /Контуры 5 0 R /PageLabels 6 0 R /PageLayout /Одностраничный /PageMode /UseOutlines /Страницы 7 0 Р /StructTreeRoot 8 0 R /Нитки [9 0 R] /Тип /Каталог >> эндообъект 10 0 объект > эндообъект 2 0 объект > поток приложение/pdf10.1016/j.jri.2016.06.009
Гематологические нормальные диапазоны при беременности | Статья
Данную главу следует цитировать следующим образом:
Мортон А, Глоб.библиотека женская медицина .,
ISSN: 1756-2228; DOI 10.3843/GLOWM.413403
Непрерывный учебник по женской медицине, серия –
Том 8
Здоровье матери и расстройства во время беременности
Редактор томов: Кеннет К. Чен, MD , Медицинская школа Альперта Брауновского университета, США
Глава
Гематологические нормальные диапазоны при беременности
Впервые опубликовано: февраль 2021 г.
АВТОРЫ
Адам Мортон
Акушерская медицина, Mater Health, Южный Брисбен, Квинсленд, Австралия
Вариант оценки исследования
Ответив на 4 вопроса с несколькими вариантами ответов (выбранных случайным образом) после изучения этой главы, читатели могут претендовать на Награды за непрерывное профессиональное развитие от FIGO плюс a Сертификат об окончании обучения от GLOWM
Подробнее см. в конце главы
ВВЕДЕНИЕ
Интерпретация лабораторных исследований основывается на контрольных интервалах.Физиологические изменения во время беременности могут привести к значительным изменениям нормальных значений многих гематологических анализов, и поэтому такие результаты могут быть ошибочно истолкованы как ненормальные или маскировать патологическое состояние. Существуют значительные различия между лабораториями в зависимости от метода тестирования, используемого анализа и популяционных факторов. Везде, где это возможно, клиницисты должны использовать референтный интервал, характерный для лаборатории, проводившей тест.
КОЛИЧЕСТВО ЭРИТРИЦ
Здоровая беременность связана со снижением уровня гемоглобина (Hb) и гематокрита из-за того, что увеличение объема плазмы превышает увеличение массы эритроцитов и происходит на более ранних сроках беременности (таблица 1).Объем плазмы начинает увеличиваться с 6-й недели беременности, примерно на 10% выше уровня до беременности в начале второго триместра, затем быстро увеличивается, достигая уровней более чем на 50% выше уровня до беременности к 26 неделе беременности, затем стабилизируется до конца беременности. Объем плазмы начинает снижаться с 6-го дня после родов, достигая небеременных уровней через 6 недель после родов. 1 Масса эритроцитов не увеличивается примерно до 20 недель беременности и увеличивается примерно на 30% по сравнению с небеременным состоянием.Масса эритроцитов также возвращается к нормальному уровню через 6 недель после родов. 1
1
Референтные интервалы образцов для гематологических анализов при здоровой беременности.
Baseline | Второй триместр | ||||||
Hemoglobin (HB) (G / DL) 2 | 12–16 | 11.5-14 | 10-15 | ||||
| 2 | 35-44 | 31-41 | 30-39 | 28-40 28-40 | |||
белых кровяных клеток (WBC) (× 10 9 / L) 2 | 4-10 | 6-16 | 6-16 | 6-16 | |||
тромбоцитов (× 10 9 / l) 2 | 150-400 | 170-390 | 150-400 | 145-400 | |||
эритропоэтин (EPO) (U / L) 2 | 4-27 | 12-25 | 8-67 | 14-222 | |||
Активируемая часть Время EAL тромбопластина (APTT) 3 | 30-40 | 26-42 | 24-36 | 26-35 | |||
Время тромбина (S ) 3 | 12–14 | 11.7-17 | 10-16 | 11.1-15.5 | |||
протромбин Время (PT) (ы) 3 | 11-15 | 9.7-12.5 | 8.5-13.2 | 8.6-12.4 | |||
антитромбин (AT) III (%) 3 | 80-120 | 92-12068-125 | 56–119 | ||||
Фибриноген (г/л) 3 | 1.5-4.0 | 2.38-4.44 | 2.8-5.9 | ||||
Белок C (%) 3 | 70-140 | 80 -120 | 83-138 | 67-135 | |||
Белок S (бесплатно) (%) 3 | 70-140 | 21-133 | 19–113 | 20–165 | |||
D-димер (мкг/мл) 3 | < 9000 0,00045 | 0.01-0.31 | 0.05-0.73 | 0.14-2.82 | |||
Von Willebrand Factor (VWF): AG (U / DL) 4 | 60- 95 | 135-245 135-245 | |||||
фактор VIII: C (U / DL) 4 | 90-140 | 110-160 | 125-200 125-200 160-230 160-230 | ||||
122 ± 34 122 ± 34 | — | — | 118 ± 29 | ||||
Скорость оседания эритроцитов (СОЭ) (мм/ч) 5 | 0–20 | 7-47 (19) | 13-70 (32) | ферритин (NG / ML) 6 | 10-150 | 14- 133 (32) | 7-130 (18) | 5-110 (21) | 8
Transferrin SAT (%) 6 | 12-45 | 12 -54 | 10-56 10-56 | 5-65 | |||
Общая емкость для связывания железа (TIBC) (MMOL / L) 6 | 41-77 | 40 -84 | 52-100 | 54-120 | |||
Религиозный рецептор передачи 6 | 1.9-4.4 | 0,4-2,0 | 1.2-3.0 | 2.3-5.2 | |||
Total Vitamin B12 (PMOL / L) 7 | 130-650 | 60-320 (230) | 50-360 (170) 50-360 (170) | 60-390 (170) | |||
Active Vitamin B12 (PMOL / L) 7 | 35 -260 | (79) | 30-260 (79) | ||||
сывороточный фолат (NMOL / L) 8 | 10-45 10-45 | 7-30 (14) | 6-20 (10) | 5-20 (10) | |||
Редкообразная клеточная клетка (ммоль / л) 8 | 0.5-1.4 | 0.5-1.4 (0,84) | 0.45-1.3 (0,75) | 0,4-1,2 (0,65) | |||
Лактат дегидрогеназа (LDH) (u / l) 2 | 115-211 115-211 | 78-433 | 80-447 | 82-524 82-524 | |||
Haptoglobin (G / L) 9 | 0,3 –2,0 | 0,44–0.49 (0.47) | 0.24-0.32 (0.28) | 0.27-0.36 (0.32) | |||
Total Bilirobin (MMOL / L) 2 | 5-22 | 2–7 | 2–14 | 2–19 | |||
Несоедин. Билирубин (ммоль / л) 2 | 3-15 | 2-7 | 2-7 | 2-8 |
Характеристика | HELLP | ТТП | |
тромбоцитопения | Переменная | Среднее число тромбоцитов 25 × 10 9 / л | |
| гемолиза | Переменные | Тяжелые | |
| Лихорадка | Отсутствует | 25% | |
| желтуха | 5-10% | Редкие | |
Неврологическое участие | Редкие эклампсии | 75% | |
Повышенные трансаминаз | Сильной | Mild | |
Острое повреждение почек | 7– 36% | 80-90% | |
Уровни антитермин III | 60-80% | 85- 120% (нормальный) | LDH: AST соотношение | <22 |
| Среднее 31% | <10% | ||
диссеминированные внутрисосудистые коагуляции (DIC) | 5-13% | необычайно |
костного мозга аспирация
по сравнению с небеременными женщинами, рассмотрение костного мозга здоровых беременных женщин повышение клеточности во второй половине беременности и первые 8 дней после родов, увеличение нормобластического эритропоэтина лейкоз с повышенным количеством ядерных эритроцитов, повышенным гранулопоэзом и небольшим увеличением плазматических клеток и клеток фагоцитарного ретикулума. 50
ПРОФИЛЬ КОАГУЛЯЦИИ
Активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (ПВ) и тромбиновое время снижаются на 10–20 % с момента зачатия до третьего триместра здоровой беременности. 51 , , 52 52 , 53 , 54 54 , 3 , 55 Авторы цитируют ссылочные интервалы 8,5-12,05, 8,5-12,4 и 9,5-12,6 s для PT в третьем триместре.Продолжительное ПТ является практически универсальным признаком AFLP. 56
Исследования, изучающие возможные физиологические изменения антитромбина III (ATIII) во время неосложненной беременности, дали противоречивые результаты. В нескольких исследованиях не было описано никаких изменений ATIII на протяжении всей беременности по сравнению со значениями до зачатия. 52 52 , 57 57 , 58 58 9198, 59 59 60108, 60109 60109 Другие авторы сообщили о падении в Atiii из Мидтримера, третий триместр, что составляет 13% -20% ниже, чем беременные значения. 3 , 61 , 62 Снижение уровня ATIII во время беременности было больше при многоплодной беременности, чем при одноплодной. 62 Сразу после родов уровни ATIII снижаются, достигая надира (средний уровень ATIII 76%) через 12 часов после родов, прежде чем вернуться к исходному уровню через 72 часа после родов. 61 Активность ATIII ниже при преэклампсии, чем при неосложненной беременности, со средними уровнями в диапазоне от 60% до 85% в пяти исследованиях. 63 63 , 64 64 64 , 65 65 66 66 , 67 , 68 Точно так же средние уровни ATIII варьировались от 62% до 80% в синдроме Хельпа. 64 , 66 , 67 , 69 Считается, что низкий уровень ATIII при HELLP-синдроме возникает в первую очередь в результате повышенного потребления, а не увеличения потерь мочи. 70 Уровень ATIII считается полезным для дифференциации AFLP от HELLP. Обзор 61 случая в литературе женщин с диагнозом AFLP показал, что средний уровень ATIII составляет 16,1% (диапазон 0–69%). 56 ATIII может быть низким при AFLP из-за сниженного печеночного синтеза, измененного коэффициента транскапиллярного потока, коагулопатии потребления и потери мочи с протеинурией. 71 , 72
При здоровой беременности наблюдается значительное снижение уровней общего и свободного белка S с первого по второй триместр. 73 Описана большая вариабельность изменений протеина С, при этом в некоторых исследованиях обнаружено увеличение протеина С, а в других исследованиях никаких изменений по сравнению с небеременными взрослыми. Резистентность к активированному протеину С оставалась постоянной на протяжении всей беременности. Обследование беременных женщин с тромбоэмболическими осложнениями на дефицит протеина S следует отложить до 3 месяцев после родов.
Распространенность антикардиолипиновых антител, анти-β2 гликопротеина 1 и волчаночного антикоагулянта при здоровой беременности составляет 1,6–11%, 2–3,9% и 7–8% соответственно. 74 74 , 75 75 75 , 76 76 , 77
77
Уровни фибриногенов значительно поднимаются во время беременности, а использование небеременных референс-интервалов может недооценивать распространенность распространенной внутрисосудистой коагуляции (DIC) . 78 , 79 Уровень фибриногена менее 3 г/л вместе с количеством тромбоцитов менее 50 и удлиненным ПВ и АЧТВ согласуется с ДВС-синдромом при беременности.Модифицированная шкала беременности, учитывающая физиологические изменения PT, фибриногена и тромбоцитов, показала чувствительность 88% и специфичность 96% для диагностики ДВС-синдрома (таблица 3). 80 ДВС-синдром осложняет 0,03% беременностей. Причины включают отслойку плаценты (37%), послеродовое кровотечение (29%), ПЭТ/HELLP (14%), AFLP (8%), сепсис (6%) и эмболию околоплодными водами (6%). Коагулопатия/ДВС-синдром гораздо реже встречается при HELLP-синдроме, чем при AFLP. Шесть исследований описали ДВС-синдром, осложняющий 5.6–13% случаев HELLP-синдрома. 69 , , 81 81 , 82 82 82 9184, 83 83 84 84 , 85 До 20 лет Обзор обнаружил, что DIC сложно только 0,2% случаев тяжелого питомца . 86 Серия случаев AFLP сообщала о ДВС-синдроме у 16–77% пациентов. 56
Уровень D-димера неуклонно повышается во время беременности. 87 , 88 Исследования показали, что уровни D-димера превышают порог отсутствия беременности у 15–50% женщин в первом триместре, 67–78% во втором триместре и 96–100% в третьем триместре. 88 , 89 , 90 Уровни D-димера заметно повышены во время родов, быстро снижаясь в течение первых 3 дней после родов, хотя нормализация может произойти только через 4 недели после родов. 91 Были предложены пороговые значения D-димера для беременных; однако валидированные пороговые значения для исключения тромбоэмболии отсутствуют. Роль оценки клинической вероятности в диагностическом ведении беременных неясна.Руководства профессиональных обществ содержат противоречивые рекомендации. Пока не будут проведены дальнейшие валидационные исследования, алгоритмы, основанные на измерении D-димера, не следует использовать для исключения легочной эмболии во время беременности или после родов.
3
Модифицированный показатель синдрома диссеминированного внутрисосудистого свертывания крови (ДВС-синдром) при беременности. 74
94 94 9009Параметры | ||
/ L) | <50 = 1 | |
50-100 = 2 | ||
100-185 = 2 | ||
Протромбин Время (пациент / нормальное значение) | 0.5-1 = 5 | |
1.0-1.5 = 12 | ||
> 1.5 = 25 > 1.5 = 25 | ||
Фибриноген (G / L) | ≤3,0 = 25 | |
3.0-4.0 = 6 | ||
4.0-4.5 = 1 40-4.5 = 1 | ||
> 4.5 = 0 | ||
Общий балл | > 26 = Высокая вероятность DIC |
Уровни фактора фон Виллебранда (ФВ) увеличиваются примерно в 2 раза от периода до зачатия до третьего триместра, достигая пика незадолго до рождения как у здоровых женщин, так и у лиц с болезнью фон Виллебранда (БВ). 4 Активность фактора Виллебранда после родов и активность фактора VIII (FVIII : C) остаются на более высоком уровне в течение 2 дней, а затем начинают снижаться на третий день после родов. 92 У 32 женщин с болезнью Виллебранда типа 1 ФВ : Ag и активность фактора VIII (FVIII : C) нормализовались во время беременности, кофактор фон Виллебранда ристоцетин (ФВ : RCo) оставался ниже нормального уровня для небеременных только у трех пациенток . 93 В четырех из девяти беременностей у женщин с болезнью Виллебранда 2 типа все факторы свертывания нормализовались в третьем триместре.Однако качественные отклонения у женщин с болезнью Виллебранда 2 типа будут сохраняться, и тромбоцитопения может ухудшиться. Для регионарной анестезии, родоразрешения и, по крайней мере, в течение первых 5 дней после родов уровни фактора Виллебранда и фактора VIII: C следует поддерживать на уровне более 50 МЕ/мл. Низкий FVIII : C, по-видимому, является наиболее важным фактором, определяющим послеродовое кровотечение. Уровни фактора Виллебранда могут быстро падать после родов, а чрезмерное кровотечение может возникнуть уже через 21 день после родов.
РЕАКТИВЫ ОСТРОЙ ФАЗЫ
В большинстве исследований сообщается, что уровни С-реактивного белка (СРБ) остаются неизменными во время здоровой беременности, хотя в первые 2 дня после родов уровни повышаются в четыре раза. 94 , 95 , 96 , 97
Скорость оседания эритроцитов (СОЭ) В исследовании с участием 1019 женщин референтный диапазон 95% у женщин без анемии вырос с 4–57 мм/ч в первом триместре до 13–70 мм/ч в третьем триместре. Соответствующие значения у женщин с анемией составляли 8–83 мм/ч во втором триместре и 12–91 мм/ч в третьем триместре. 5
Таким образом, СРБ предпочтительнее, чем СОЭ, как индикатор воспаления или инфекции во время беременности.
ИССЛЕДОВАНИЯ ЖЕЛЕЗА
Уровень ферритина в сыворотке обычно достаточен для диагностики дефицита железа, за исключением случаев активного воспаления, поскольку ферритин действует как реагент острой фазы. Диагностические пороги дефицита железа во время беременности значительно различаются. В то время как ВОЗ определяет железодефицитную анемию на основе сывороточного ферритина <15 нг/мл, беременные женщины с сывороточным уровнем ферритина <30 нг/мл считаются подверженными риску железодефицитной анемии в Соединенном Королевстве, а в Дании предполагается, что женщинам с сывороточным ферритином <70 г/мл следует назначить препараты железа. 98 Сывороточный ферритин постепенно снижается с первого триместра и достигает надира к третьему триместру примерно на 50% от значений до зачатия, независимо от баланса железа. 99
Исследования, связывающие наличие или отсутствие окрашиваемого железа в костном мозге с сывороточным ферритином, показали, что уровень <30 нг/мл имеет 92% чувствительность и 98% специфичность для диагностики дефицита железа, тогда как сывороточный ферритин менее 10 нг /мл имеет только 25% чувствительность при выявлении дефицита железа. 100 , 101
В условиях острого воспаления может быть полезным измерение насыщения трансферрина (TS). TS менее 16% считается маркером функционального дефицита железа.
Использование микроцитоза при скрининге приводит к недооценке распространенности железодефицитной анемии, так как снижение уровня гемоглобина обычно предшествует снижению среднего объема эритроцитов. 102 Микроцитоз присутствовал только у 27,5–65% пациентов с дефицитом железа. 103 , 104 Уровни растворимых рецепторов трансферрина увеличиваются при дефиците железа и не зависят от воспаления. Метаанализ 10 исследований показал, что уровни растворимых рецепторов трансферрина имеют чувствительность 86% и специфичность 75% при выявлении дефицита железа. 105 Анализ не стандартизирован и не широко доступен. Гепсидин регулирует системную биодоступность железа, определяя, насколько хорошо железо всасывается при пероральном приеме. Уровни гепсидина падают во время беременности, женщины с неопределяемым уровнем передают плоду больше железа, поступившего от матери, чем женщины с определяемым уровнем гепсидина.Оценивается полезность уровней гепсидина в качестве биомаркера дефицита железа, одно недавнее исследование показало, что сывороточный гепсидин превосходит гемоглобин, сывороточное железо, сывороточный ферритин, TS и способность связывать железо трансферрина в качестве показателя ЖДА у беременных женщин. 106 Гепсидин может быть особенно полезен при выявлении дефицита железа при инфекционных или воспалительных заболеваниях.
На основе показателей эритроцитарного и ретикулоцитарного индексов, включая содержание Hb в ретикулоцитах и процент гипохромных эритроцитов и микроцитарных эритроцитов, Demmers et al. пришел к выводу, что, в отличие от небеременных женщин с дефицитом железа, низкие концентрации ферритина у беременных женщин не связаны с функциональным дефицитом железа. 98 Метаболизм железа может по-разному регулироваться для оптимального роста и развития плода, несмотря на низкие запасы железа у матери.
Уровни железа в сыворотке остаются относительно стабильными во время беременности. Уровень трансферрина в сыворотке увеличивается примерно на 10%. Насыщение трансферрина несколько падает. Железосвязывающая способность трансферрина постепенно увеличивается с первого триместра. 107
ВИТАМИН B12
Содержание общего витамина B12 в сыворотке значительно снижается во время беременности из-за снижения уровня хологаптокоррина. 108 Холотранскобаламин (активный B12), фракция B12, проникающая через плаценту, не изменяется и должна использоваться для диагностики дефицита B12 во время беременности. 7 Метилмалоновая кислота является наиболее специфическим функциональным индикатором статуса B12, поскольку гомоцистеин также определяется статусом фолиевой кислоты и других витаминов группы B. 109 Уровни витамина B12 значительно различаются у разных этнических групп, поэтому контрольные интервалы во время беременности должны быть специфичными для населения и лаборатории. Женщины южноазиатского происхождения, проживающие в Ванкувере, продемонстрировали значительно более низкие уровни витамина B12 и более высокие показатели дефицита и неадекватности витамина B12 в первом триместре, чем женщины европейского происхождения. 110 Сообщаемая распространенность дефицита B12 на ранних сроках беременности достигает 70% в Индии по сравнению с 5–17% в Северной Америке.
ФОЛАТ
У женщин, не получавших добавки, уровни фолиевой кислоты в плазме и эритроцитах постепенно снижались с 16–18 недель беременности до 8 недель после родов, что сопровождалось реципрокным повышением уровня гомоцистеина в плазме. 8 , 111
МАРКЕРЫ ГЕМОЛИЗА
Некоторые авторы сообщают, что ЛДГ может повышаться по сравнению с таковыми в первом триместре, при этом значения у здоровых женщин в третьем триместре могут вдвое превышать значения до беременности. 2 Другие авторы сообщают об отсутствии изменений ЛДГ. 112 Исследования изоферментов ЛДГ у девяти женщин с HELLP-синдромом показали, что преобладающим типом является изофермент ЛДГ 5 (печень, скелетные мышцы) с относительным снижением изоферментов ЛДГ 1 и 2 (эритроциты, сердечная мышца). 113 Таким образом, общая ЛДГ не является надежным маркером внутрисосудистого гемолиза при синдроме HELLP.
Уровни гаптоглобина падают примерно на 25% по сравнению со значениями в первом триместре, достигая надира на 24–27 неделе беременности, а затем снова повышаются к концу здоровой беременности. 97 , 9 Одно исследование выявило низкий уровень гаптоглобина у 39% из 220 здоровых беременных женщин с прямой зависимостью между низким уровнем гаптоглобина и концентрацией гемоглобина. Авторы пришли к выводу, что причиной низких значений гаптоглобина, вероятно, была гемодилюция и повышение концентрации эстрогенов в крови во время беременности. 114 В клиническом случае также описаны неопределяемые уровни гаптоглобина на 31 неделе беременности без других признаков гемолиза, сывороточный гаптоглобин возвращается к нормальным значениям в течение 3 дней после родов. 115
Нет никаких изменений в субпопуляциях ретикулоцитов и зрелости между небеременными женщинами и женщинами в первом триместре. Со второго триместра происходит изменение зрелости ретикулоцитов со значительным увеличением числа незрелых ретикулоцитов и уменьшением числа зрелых ретикулоцитов. 116 , 117 Индекс зрелости ретикулоцитов резко снижается через 1–4 недели после родов, опускаясь до уровня небеременных женщин через 5 недель после родов.У курильщиков абсолютное количество ретикулоцитов в третьем триместре ниже, чем у некурящих. Могут быть значительные этнические различия в количестве ретикулоцитов при здоровой беременности, анемичные гречанки и итальянки демонстрируют значительно более высокое количество ретикулоцитов, чем англо-саксонские женщины. 118 Как правило, если количество ретикулоцитов превышает 3% при анемии, механизмом является гемолиз или кровопотеря, тогда как количество ретикулоцитов менее 3% указывает на гипопролиферативный костный мозг.
На протяжении всей беременности наблюдается легкое снижение верхней границы референтного интервала для общего и несвязанного билирубина. 119
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Физиологические изменения во время беременности могут привести к значительным изменениям нормальных значений многих гематологических тестов возможно, клиницисты должны использовать референтный интервал, характерный для лаборатории, проводившей тест.
КОНФЛИКТ ИНТЕРЕСОВ
Автор(ы) этой главы заявляют, что у них нет интересов, противоречащих содержанию главы.
Обратная связь
Примечание издателя: Мы постоянно стараемся обновлять и улучшать главы этой серии. Поэтому, если у вас есть какие-либо конструктивные комментарии по поводу этой главы, поделитесь ими с нами, выбрав ссылку «Ваш отзыв» в левой колонке.
ССЫЛКИ
1 | Morrison J PM.Анемия, связанная с беременностью. Glob Libr Women’s Med 2016. | ||
2 | Abbassi-Ghanavati M, Greer LG, Cunningham FG. Беременность и лабораторные исследования: справочная таблица для клиницистов. Obstet Gynecol 2009;114:1326–31. DOI: 10.1097/AOG.0b013e3181c2bde8. | ||
3 | Цуй С, Ян С, Чжан Дж, и др. Референсные интервалы коагуляции и антикоагуляции для здоровой беременности в зависимости от триместра. Thromb Res 2017; 156:82–6. DOI: 10.1016/j.thromres.2017.05.021. | ||
4 | Epiney M, Boehlen F, Boulvain M, et al. Уровни D-димера во время родов и после родов. J Thromb Haemost 2005;3:268–71. DOI: 10.1111/j.1538–7836.2004.01108.x. | ||
5 | Харам К., Аугенсен К., Эльсайед С. Структура белков сыворотки при нормальной беременности с особым вниманием к острофазовым реагентам. Br J Obstet Gynaecol 1983; 90:139–45. | ||
6 | Шекхар С., Дидди Г. Болезнь печени при беременности. Тайвань J Obstet Gynecol 2015; 54: 475–82. DOI: 10.1016/j.tjog.2015.01.004. | ||
7 | Моркбак А.Л., Хвас А.М., Мильман Н., и др. Голотранскобаламин остается неизменным во время беременности. Продольные изменения кобаламинов и связывающих их белков во время беременности и после родов. Haematologica 2007;92:1711–2. DOI: 10.3324/гематол.11636. | ||
8 | Мильман Н, Быг К.Е., Хвас А.М., и др. Фолиевая кислота в эритроцитах, фолиевая кислота в плазме и гомоцистеин в плазме при нормальной беременности и после родов: лонгитюдное исследование с участием 404 датских женщин. Eur J Haematol 2006;76:200–5. DOI: 10.1111/j.1600–0609.2005.00606.x. | ||
9 | Хамм В., Ричардсен Г., Свитковски Р.Изоферменты лактатдегидрогеназы у больных с синдромом HELLP. Z Geburtshilfe Neonatol 1996;200:115–8. | ||
10 | Организация WH. Всемирная организация здравоохранения, Распространенность анемии во всем мире, 1993–2005 гг.: Глобальная база данных ВОЗ по анемии, 2008 г. | ||
11 | Milman N, Byg KE, Agger AO. Показатели гемоглобина и эритроцитов во время нормальной беременности и после родов у 206 женщин с добавками железа и без них. Acta Obstet Gynecol Scand 2000;79:89–98. | ||
12 | Комитет G. Мнение Комитета № 691: Скрининг носителей генетических заболеваний. Obstet Gynecol 2017;129:e41–55. DOI: 10.1097/AOG.0000000000001952. | ||
13 | Бенцайова Г., Дапото К., Циммерманн Р., и др. Показатели эритроцитов при скрининге антенатальной несерповидной гемоглобинопатии. Int J Womens Health 2015; 7:379–84.DOI: 10.2147/IJWH.S73362. | ||
14 | Школа ТО. Статус железа во время беременности: подготовка к матери и ребенку. Am J Clin Nutr 2005;81:1218S–22S. DOI: 10.1093/ajcn/81.5.1218. | ||
15 | Арнольд Д.Л., Уильямс М.А., Миллер Р.С., и др. Железодефицитная анемия, курение сигарет и риск отслойки плаценты. J Obstet Gynaecol Res 2009;35:446–52.DOI: 10.1111/j.1447–0756.2008.00980.x. | ||
16 | Виллар Дж., Мериальди М., Гулмезоглу А.М., и др. Вмешательства в области питания во время беременности для профилактики или лечения материнской заболеваемости и преждевременных родов: обзор рандомизированных контролируемых исследований. J Nutr 2003;133:1606S–25S. DOI: 10.1093/jn/133.5.1606S. | ||
17 | Сурьянараяна Р., Чандраппа М., Сантурам А.Н., и др. Проспективное исследование распространенности анемии среди беременных женщин и его исходов: исследование на базе сообщества. J Family Med Prim Care 2017;6:739–43. DOI: 10.4103/jfmpc.jfmpc_33_17. | ||
18 | Рахмати С., Милад Азами, Паризад Н., и др. Связь между материнской анемией во время беременности и преждевременными родами: систематический обзор и метаанализ. J Matern Fetal Neonatal Med 2018:1–151. DOI: 10.1080/14767058.2018.1555811. | ||
19 | Фигейреду А., Гомеш-Фильо И.С., Силва Р.Б., и др. Материнская анемия и низкий вес при рождении: систематический обзор и метаанализ. Питательные вещества 2018;10. DOI: 10.3390/nu10050601. | ||
20 | Chen C, Grewal J, Betran AP, et al. Тяжелая анемия, серповидно-клеточная анемия и талассемия как факторы риска гипертензивных расстройств во время беременности в развивающихся странах. Гипертензия беременных 2018;13:141–7. DOI: 10.1016/j.preghy.2018.06.001. | ||
21 | Дару Дж., Самора Дж., Фернандес-Феликс Б.М., и др. Риск материнской смертности у женщин с тяжелой анемией во время беременности и после родов: многоуровневый анализ. Lancet Glob Health 2018;6:e548&ndashe54. DOI: 10.1016/S2214–109X(18)30078–0. | ||
22 | Ауэрбах М., Джеймс С.Е., Николетти М., и др. Результаты первого американского проспективного исследования внутривенного введения железа беременным с дефицитом железа при пероральной непереносимости железа. Am J Med 2017; 130:1402–7. DOI: 10.1016/j.amjmed.2017.06.025. | ||
23 | Рахман М.М., Абэ С.К., Рахман М.С., и др. Материнская анемия и риск неблагоприятных исходов родов и здоровья в странах с низким и средним уровнем дохода: систематический обзор и метаанализ. Am J Clin Nutr 2016;103:495–504.DOI: 10.3945/ajcn.115.107896. | ||
24 | ElAlfy MS, El-Farrash RA, Taha HM, et al. Слуховая реакция ствола головного мозга у доношенных новорожденных, рожденных от матерей с железодефицитной анемией: связь с тяжестью заболевания. J Matern Fetal Neonatal Med 2018: 1–8. DOI: 10.1080/14767058.2018.1533940. | ||
25 | Бегин Ю., Липсей Г., Орис Р., и др. Сывороточный иммунореактивный эритропоэтин при беременности и в раннем послеродовом периоде. BrJ Haematol 1990;76:545–9. | ||
26 | Макмаллин М.Ф., Уайт Р., Лаппин Т., и др. Гемоглобин во время беременности: связь с эритропоэтином и кроветворным статусом. Eur J Haematol 2003; 71:44–50. | ||
27 | Henry DH, Beall GN, Benson CA, et al. Рекомбинантный человеческий эритропоэтин в лечении анемии, связанной с инфекцией, вызванной вирусом иммунодефицита человека (ВИЧ), и терапией зидовудином.Обзор четырех клинических испытаний. Ann Intern Med 1992;117:739–48. | ||
28 | Мицуи Ю., Эгучи К., Хирамацу Ю., и др. Изменения деформируемости эритроцитов при нормально протекающей беременности и гипертензии, вызванной беременностью, по данным электронного спинового резонанса. Acta Med Okayama 1994; 48:1–5. DOI: 10.18926/AMO/31133. | ||
29 | Шульман К.Э., Дорман Э.К., Балмер Дж.Н.Малярия как причина тяжелой анемии беременных. Ланцет 2002; 360:494. DOI: 10.1016/s0140–6736(02)09662–9. | ||
30 | Васкес А.М., Медина А.С., Тобон-Кастано А., и др. Проведение высокочувствительного экспресс-теста (HS-RDT) для выявления малярии в образцах периферической и плацентарной крови беременных женщин в Колумбии. PLoS One 2018;13:e0201769. DOI: 10.1371/journal.pone.0201769. | ||
31 | Райли Л.К., Руперт Дж.Оценка пациентов с лейкоцитозом. Am Fam Physician 2015;92:1004–11. | ||
32 | Джеймс Д., Стир П., Вайнер С., и др. Беременность и лабораторные исследования: справочная таблица для клиницистов. Obstet Gynecol 2010;115:868; ответ автора 868–9. DOI: 10.1097/AOG.0b013e3181d7131e. | ||
33 | Пайдас М., Хоссейн Н. Гематологические изменения во время беременности. Гемостаз и тромбоз в акушерстве и гинекологии . Wiley, 2011, стр. 1–11. | ||
34 | Уоллес Э.М., Эккель К., Коттер Т., и др. Гематологические эффекты лечения бетаметазоном на поздних сроках беременности. Aust NZ J Obstet Gynaecol 1998;38:396–8. | ||
35 | Каданали С., Ингеч М., Кукукозкан Т., и др. Изменения количества лейкоцитов, гранулоцитов и лимфоцитов после антенатального введения бетаметазона беременным женщинам. Int J Gynaecol Obstet 1997; 58: 269–74. | ||
36 | Bauer ME, Price LK, MacEachern MP, et al. Материнский лейкоцитоз после антенатального введения кортикостероидов: систематический обзор и метаанализ. J Obstet Gynaecol 2018;38:210–6. DOI: 10.1080/01443615.2017.1342614. | ||
37 | Каралис I, Надар СК, Аль-Йемени Э., и др. Активация тромбоцитов при артериальной гипертензии, вызванной беременностью. Thromb Res 2005; 116:377–83. DOI: 10.1016/j.thromres.2005.01.009. | ||
38 | Эдельштам Г., Лоубер К., Крал Г., и др. Новые референтные значения для рутинных образцов крови и нейтрофильного липокалина человека во время беременности в третьем триместре. Scand J Clin Lab Invest 2001;61:583–92. | ||
39 | Риз Дж.А., Пек Дж.Д., Макинтош Дж.Дж., и др. Количество тромбоцитов у женщин с нормальной беременностью: систематический обзор. Am J Hematol 2017;92:1224–32. DOI: 10.1002/ajh.24829. | ||
40 | Леви Дж.А., Мерфи Л.Д. Тромбоцитопения при беременности. J Am Board Fam Pract 2002;15:290–7. | ||
41 | Риз Дж.А., Пек Дж.Д., Дешам Д.Р., и др. Количество тромбоцитов во время беременности. N Engl J Med 2018; 379:32–43. DOI: 10.1056/NEJMoa1802897. | ||
42 | Пандей А. СР.Тромбоцитопения во время беременности: институциональное проспективное исследование продолжительностью один год. Международный журнал исследований в области медицинских наук 2017;5:3502–5. | ||
43 | van Veen JJ, Nokes TJ, Makris M. Риск гематомы позвоночника после нейроаксиальной анестезии или люмбальной пункции у пациентов с тромбоцитопенией. BrJ Haematol 2010;148:15–25. DOI: 10.1111/j.1365–2141.2009.07899.x. | ||
44 | Бейлин Ю., Арнольд И., Хоссейн С.Оценка анализатора функции тромбоцитов (PFA-100) по сравнению с тромбоэластограммой (ТЭГ) у роженицы. Int J Obstet Anesth 2006; 15:7–12. DOI: 10.1016/j.ijoa.2005.04.013. | ||
45 | Карлссон О., Спорронг Т., Хилларп А., и др. Проспективное лонгитюдное исследование тромбоэластографии и стандартных гемостатических лабораторных тестов у здоровых женщин при нормально протекающей беременности. Anesth Analg 2012;115:890–8. ДОИ: 10.1213/АНЭ.0b013e3182652a33. | ||
46 | Huang J, McKenna N, Babins N. Полезность тромбоэластографии во время нейроаксиальной блокады у рожениц с тромбоцитопенией. AANA J 2014; 82: 127–30. | ||
47 | Кейзер С.Д., Бойд К.В., Реберг Дж.Ф., и др. Высокое отношение ЛДГ к АСТ помогает дифференцировать связанную с беременностью тромботическую тромбоцитопеническую пурпуру (ТТП) от HELLP-синдрома. J Matern Fetal Neonatal Med 2012;25:1059–63. DOI: 10.3109/14767058.2011.619603. | ||
48 | Латтуада А., Росси Э., Кальзаросса С., и др. Снижение уровня протеазы, расщепляющей фактор фон Виллебранда (ADAMTS-13), от легкой до умеренной у беременных с микроангиопатическим синдромом HELLP. Haematologica 2003;88:1029–34. | ||
49 | Санчес-Лусерос А., Фариас К.Э., Амарал М.М., и др. Активность протеазы, расщепляющей фактор фон Виллебранда (ADAMTS13), у нормальных небеременных женщин, беременных женщин и женщин после родов. Thromb Haemost 2004;92:1320–6. DOI: 10.1160/TH03–11–0683. | ||
50 | Ловенштейн Л., Брэмлидж, Калифорния. Костный мозг при беременности и послеродовом периоде. Кровь 1957; 12: 261–77. | ||
51 | Хань Л., Лю С., Ли Х., и др. Показатели свертывания крови и индексы тромбоцитов: изменения при нормальной и преэклампсии при беременности и прогностические значения преэклампсии. PLoS One 2014;9:e114488. DOI: 10.1371/journal.pone.0114488. | ||
52 | Чернека Ф., Риччи Г., Симеоне Р., и др. Изменения коагуляции и фибринолиза при нормальной беременности. Повышенный уровень прокоагулянтов и сниженный уровень ингибиторов во время беременности вызывают состояние гиперкоагуляции в сочетании с реактивным фибринолизом. Eur J Obstet Gynecol Reprod Biol 1997;73:31–6. | ||
53 | Лю Дж., Юань Э., Ли Л.Специфические для гестационного возраста референтные интервалы для рутинных анализов гемостаза при нормальной беременности. Clin Chim Acta 2012; 413:258–61. DOI: 10.1016/j.cca.2011.09.046. | ||
54 | Гонг Дж.М., Шэнь И., Хе И.С. Референтные интервалы рутинных анализов коагуляции во время беременности и послеродового периода. J Clin Lab Anal 2016;30:912–7. DOI: 10.1002/jcla.21956. | ||
55 | Хуэй С., Лили М., Либин С., и др. Изменения коагуляции и гемодинамики при беременности: проспективное лонгитюдное исследование 58 случаев. Arch Gynecol Obstet 2012;285:1231–6. DOI: 10.1007/s00404–011–2137-х. | ||
56 | Мортон А., Лори Дж. Физиологические изменения беременности и критерии Суонси в диагностике острого жирового гепатоза беременных. Obstet Med 2018;11:126–31. DOI: 10.1177/1753495X18759353. | ||
57 | Шривастава М., Бали С., Пандей Дж., и др. Гипертония, вызванная беременностью, и антитромбин-III. Indian J Pathol Microbiol 1995;38:257–60. | ||
58 | Сюй К.Г., Чжоу Л., Шонг С.Г., и др. Активность антитромбина III у китайских женщин с преэклампсией. Thromb Res 1990; 59: 401–6. | ||
59 | Гранинджер В., Татра Г., Пирич К., и др. Низкий уровень антитромбина III и высокий уровень фибронектина в плазме при преэклампсии. Eur J Obstet Gynecol Reprod Biol 1985;19:223–9. | ||
60 | Weenink GH, Treffers PE, Kahle LH, et al. Антитромбин III при нормальной беременности. Thromb Res 1982; 26: 281–7. | ||
61 | Джеймс А.Х., Ри Э., Темз Б., и др. Характеристика уровней антитромбина при беременности. Thromb Res 2014; 134:648–51. DOI: 10.1016/j.thromres.2014.07.025. | ||
62 | Цунода Т., Окучи А., Изуми А., и др. Активность антитромбина III и количество тромбоцитов с большей вероятностью снижаются при многоплодной беременности, чем при одноплодной беременности. Acta Obstet Gynecol Scand 2002;81:840–5. | ||
63 | Weiner CP, Kwaan HC, Xu C, et al. Активность антитромбина III у женщин с артериальной гипертензией во время беременности. Obstet Gynecol 1985;65:301–6. | ||
64 | Патерностер Д.М., Стелла А., Симиони П., и др. Параметры коагуляции и фибронектина плазмы при синдроме HELLP. Int J Gynaecol Obstet 1995;50:263–8. | ||
65 | Демир С, Дилек И. Естественные ингибиторы свертывания крови и резистентность к активному протеину с при преэклампсии. Клиники (Сан-Паулу) 2010;65:1119–22.DOI: 10.1590/s1807–5 | ||
66 | де Бур К., Буллер Х.Р., тен Кейт Дж.В., и др. Исследования коагуляции при синдроме гемолиза, повышенных ферментах печени и низких тромбоцитах. Br J Obstet Gynaecol 1991; 98:42–7. | ||
67 | Мариэтта М., Симони Л., Педрацци П., и др. Снижение уровня антитромбина в плазме связано с ухудшением течения преэклампсии. Int J Lab Hematol 2009; 31:227–32. DOI: 10.1111/j.1751–553X.2008.01031.x. | ||
68 | Chen Y, Lin L. Потенциальное значение параметров коагуляции для предположения о преэклампсии в третьем триместре беременности. Am J Med Sci 2017; 354:39–43. DOI: 10.1016/j.amjms.2017.03.012. | ||
69 | Vigil-De Gracia P. Острая жировая дистрофия печени и HELLP-синдром: два различных расстройства беременности. Int J Gynaecol Obstet 2001;73:215–20. | ||
70 | Вайнер К.П., Бонсиб СМ. Взаимосвязь между гистологией почек и активностью антитромбина III в плазме у женщин с ранним началом преэклампсии. Am J Perinatol 1990;7:139–43. DOI: 10.1055/s-2007–999466. | ||
71 | Канфер А. Факторы свертывания крови при нефротическом синдроме. Am J Nephrol 1990;10(1):63–8. ДОИ: 10.1159/000168196. | ||
72 | Knot E, Ten Cate JW, Drijfhout HR, и др. Метаболизм антитромбина III у пациентов с заболеваниями печени. Дж. Клин Патол 1984; 37: 523–30. DOI: 10.1136/jcp.37.5.523. | ||
73 | Кристофферсен А.Х., Петерсен П.Х., Рораас Т., и др. Оценка внутрисубъектной биологической изменчивости протеина С, антитромбина, свободного протеина S, активности протеина S и резистентности к активированному протеину С у беременных женщин. Clin Chem 2017;63:898–907. DOI: 10.1373/clinchem.2016.265900. | ||
74 | Рой-Грин К., Фредерик Дж., Уорф Г., и др. Антифосфолипидные и другие аутоантитела в когорте привычных абортов и здоровых повторнородящих женщин на Ямайке. Hum Antibodies 2011; 20:1–5. DOI: 10.3233/HAB20110236 | ||
75 | Faden D, Tincani A, Tanzi P, et al. Антитела к бета-2 гликопротеину I в общей акушерской популяции: предварительные результаты по распространенности и корреляции с исходом беременности. Антитела к бета2-гликопротеину I связаны с некоторыми акушерскими осложнениями, в основном с преэклампсией-эклампсией. Eur J Obstet Gynecol Reprod Biol 1997;73:37–42. | ||
76 | Аводу О.А., Эджеле О.А., Шокунби В.А., и др. Распространенность волчаночного антикоагулянта у повторнородящих женщин в Бенин-Сити, Нигерия. Niger Postgrad Med J 2003; 10:19–22. | ||
77 | Рикс П., Стентофт Дж., Ауншолт Н.А., и др. Волчаночный антикоагулянт и антикардиолипиновые антитела в акушерской популяции. Acta Obstet Gynecol Scand 1992;71:605–9. | ||
78 | Адлер Г., Духинский Т., Ясинская А., и др. Фракции фибриногена в третьем триместре беременности и в послеродовом периоде. Thromb Res 2000; 97: 405–10. | ||
79 | Manten GT, Franx A, Sikkema JM, и др. Фибриноген и высокомолекулярный фибриноген во время и после нормально протекающей беременности. Thromb Res 2004; 114:19–23. DOI: 10.1016/j.thromres.2004.04.008. | ||
80 | Эрез О., Новак Л., Беер-Вайзел Р., и др. Шкала ДВС-синдрома у беременных – популяционная модификация шкалы Международного общества тромбоза и гемостаза. PLoS One 2014;9:e | . DOI: 10.1371/journal.pone.00 | . |
81 | Windsperger K, Lehner R. Соотношение фибриноген/СРБ как новый параметр для диагностики диссеминированного внутрисосудистого свертывания крови у пациентов с HELLP-синдромом и как прогностический фактор неонатального исхода. Am J Obstet Gynecol 2013;208:118 e111–7. DOI: 10.1016/j.ajog.2012.11.025. | ||
82 | Челик С., Гезгинч К., Алтынтепе Л., и др. Результаты беременностей с синдромом HELLP. Рен Фэйл 2003; 25: 613–8. DOI: 10.1081/jdi-120022553. | ||
83 | Зубери Н.Ф., Ариф К., Хан Ф.М., и др. Сравнение тяжелой преэклампсии/эклампсии у пациенток с HELLP-синдромом и без него. J Pak Med Assoc 1998; 48:29–32. | ||
84 | Хаддад Б., Бартон Дж. Р., Ливингстон Дж. К., и др. Синдром HELLP (гемолиз, повышенный уровень печеночных ферментов и низкий уровень тромбоцитов) по сравнению с тяжелой преэклампсией: начало в < или =28.0 недель беременности. Am J Obstet Gynecol 2000;183:1475–9. | ||
85 | Van Dam PA, Renier M, Baekelandt M, et al. ДВС-синдром и синдром гемолиза, повышенный уровень печеночных ферментов и низкий уровень тромбоцитов при тяжелой преэклампсии. Obstet Gynecol 1989;73:97–102. | ||
86 | Рэттрей Д.Д., О’Коннелл К.М., Баскетт Т.Ф. Острое диссеминированное внутрисосудистое свертывание крови в акушерстве: обзор населения третичного центра (с 1980 по 2009 год). J Obstet Gynaecol Can 2012;34:341–7. DOI: 10.1016/S1701–2163(16)35214–8. | ||
87 | Van der Pol LM, Mairuhu AT, Tromeur C, et al. Использование правил клинического прогнозирования и тестов на D-димер в диагностическом ведении беременных с подозрением на острую легочную эмболию. Blood Rev 2017; 31:31–6. DOI: 10.1016/j.blre.2016.09.003. | ||
88 | Клайн Дж.А., Уильямс Г.В., Эрнандес-Нино Дж.Концентрации D-димера при нормальной беременности: необходимы новые диагностические пороги. Clin Chem 2005;51:825–9. DOI: 10.1373/clinchem.2004.044883. | ||
89 | Ковач М., Микович З., Ракичевич Л., и др. Использование D-димера с новой отсечкой может быть полезным в диагностике венозной тромбоэмболии у беременных. Eur J Obstet Gynecol Reprod Biol 2010;148:27–30. DOI: 10.1016/j.ejogrb.2009.09.005. | ||
90 | Ван М., Лу С., Ли С., и др. Референтные интервалы D-димера в период беременности и послеродового периода на коагуляционном анализаторе STA-R evolution. Clin Chim Acta 2013; 425:176–80. DOI: 10.1016/j.cca.2013.08.006. | ||
91 | Друри-Стюарт Д.Н., Ланнерт К.В., Чанг Д.В., и др. Комплексные изменения параметров, ассоциированных с фактором фон Виллебранда, приобретаются при неосложненной беременности. PLoS One 2014;9:e112935. DOI: 10.1371/журнал.поне.0112935. | ||
92 | Huq FY, Kulkarni A, Agbim EC, et al. Изменения уровней фактора VIII и фактора фон Виллебранда в послеродовом периоде. Гемофилия 2012;18:241–5. DOI: 10.1111/j.1365–2516.2011.02625.x. | ||
93 | Delbruck C, Miesbach W. Курс активности фактора фон Виллебранда и фактора VIII у пациентов с болезнью фон Виллебранда во время беременности. Acta Haematol 2019:1–8. DOI: 10.1159/000496820. | ||
94 | Nielsen FR, Bek KM, Rasmussen PE, et al. С-реактивный белок при нормальной беременности. Eur J Obstet Gynecol Reprod Biol 1990;35:23–7. | ||
95 | Гаврилишин П., Бернштейн П., Миллиган Дж. Э., и др. Преждевременный разрыв плодных оболочек: роль С-реактивного белка в прогнозировании хориоамнионита. Am J Obstet Gynecol 1983;147:240–6. | ||
96 | Watts DH, Krohn MA, Wener MH, et al. С-реактивный белок при нормально протекающей беременности. Obstet Gynecol 1991;77:176–80. | ||
97 | Ван ден Бро Н.Р., Лецкий Е.А. Беременность и скорость оседания эритроцитов. BJOG 2001; 108:1164–7. | ||
98 | Деммерс М.В., Ниенс М., ван дер Хаар Г., и др. Маркеры функционального дефицита железа отсутствуют во время беременности, несмотря на признаки низкого уровня запасов железа. Энн Клин Биохим 2019:4563219837290. DOI: 10.1177/0004563219837290. | ||
99 | M R. Нормальные значения. В: Джеймс Д. С.П., Вайнер С.П., Гоник Б., Кроутер К.А., Робсон С.К. (ред.) Беременность с высоким риском: варианты ведения . 4-е изд. Saunders/Elsevier, 2011. | ||
100 | Ауэрбах М.Комментарий: Дефицит железа при беременности – новый подход с внутривенным введением железа. Reprod Health 2018;15:96. DOI: 10.1186/s12978–018–0536–1. | ||
101 | Koenig MD, Tussing-Humphreys L, Day J, et al. Гепсидин и гомеостаз железа во время беременности. Питательные вещества 2014;6:3062–83. DOI: 10.3390/nu6083062. | ||
102 | Джолобе ОМП. Предостережения в лечении железодефицитной анемии. Европейское отделение J Intern Med 2018;48:e38. DOI: 10.1016/j.ejim.2017.07.032. | ||
103 | Петросян И., Блейсон Г., Андрес Э., и др. Анемия у пожилых людей: этиологический профиль проспективной когорты из 95 госпитализированных пациентов. Eur J Intern Med 2012;23:524–8. DOI: 10.1016/j.ejim.2012.03.013. | ||
104 | Фрэнсис Дж., Шеридан Д., Саманта А., и др. Железодефицитная анемия при хронических воспалительных ревматических заболеваниях: низкий средний клеточный гемоглобин является лучшим маркером, чем низкий средний клеточный объем. Энн Реум Дис 2005; 64: 787–8. DOI: 10.1136/ard.2004.025890. | ||
105 | Инфузино I, Брага Ф, Дольчи А, и др. Рецептор растворимого трансферрина (sTfR) и индекс sTfR/log ферритина для диагностики железодефицитной анемии. Метаанализ. Am J Clin Pathol 2012;138:642–9.DOI: 10.1309/AJCP16NTXZLZFAIB. | ||
106 | Заман Б., Расул С., Джасим С., и др. Гепсидин как диагностический биомаркер железодефицитной анемии при беременности. J Matern Fetal Neonatal Med 2019:1–241. DOI: 10.1080/14767058.2019.1635112. | ||
107 | Курхаде Г.А., Ханоркар С.В., Пураник Б.М., и др. Уровень железа и трансферрина в сыворотке крови при беременности и в послеродовом периоде. Indian J Physiol Pharmacol 1994; 38:34–8. | ||
108 | Мильман Н., Быг К.Е., Бергхолт Т., и др. Статус кобаламина при нормальной беременности и послеродовом периоде: лонгитюдное исследование с участием 406 датских женщин. Eur J Haematol 2006;76:521–5. DOI: 10.1111/j.0902–4441.2006.t01–1-EJh3550.x. | ||
109 | Шредер Т.Х., Тан А., Матман А., и др. Референсные интервалы концентрации общего витамина B12 и холотранскобаламина в сыворотке крови и точки их изменения в зависимости от концентрации метилмалоновой кислоты для оценки статуса витамина B12 на ранних и средних сроках беременности. Clin Chem Lab Med 2019. DOI: 10.1515/cclm-2018–1337. | ||
110 | Schroder TH, Sinclair G, Mattman A, et al. Беременные женщины южноазиатского происхождения в Канаде имеют значительно более низкий уровень витамина B12 по сравнению с беременными женщинами европейского происхождения. Бр Ж Нутр 2017;118:454–62. DOI: 10.1017/S0007114517002331. | ||
111 | Брюинс Х.В., ван ден Берг Х.Изменения уровня некоторых витаминов во время и после нормальной беременности. Eur J Obstet Gynecol Reprod Biol 1995;61:31–7. | ||
112 | Каттоццо Г., Калоначи А., Албени С., и др. Референтные значения для аланинаминотрансферазы, альфа-амилазы, аспартатаминотрансферазы, гамма-глутамилтрансферазы и лактатдегидрогеназы, измеренные в соответствии со стандартом IFCC при неосложненной беременности. Clin Chem Lab Med 2013;51:e239–41.DOI: 10.1515/cclm-2013–0371. | ||
113 | Ларссон А., Палм М., Ханссон Л.О., и др. Референсные значения альфа-1-кислого гликопротеина, альфа-1-антитрипсина, альбумина, гаптоглобина, С-реактивного белка, IgA, IgG и IgM при беременности. Acta Obstet Gynecol Scand 2008;87:1084–8. DOI: 10.1080/00016340802428146. | ||
114 | Арекул С., Китиани У., Укоскит К. Гаптоглобины сыворотки при беременности. Юго-Восточная Азия J Trop Med Public Health 1975;6:567–72. | ||
115 | Гацка С., Бремерих Д., Кауфманн М., и др. Изолированное снижение гаптоглобина при беременности: диагноз случайный или патологический? ]. Централбл Гинакол 2002;124:120–2. DOI: 10.1055/s-2002–24234. | ||
116 | Чой Дж.В., Пай С.Х. Изменение эритропоэза с гестационным возрастом при беременности. Энн Хематол 2001; 80: 26–31. | ||
117 | Mercelina-Roumans PE, Ubachs JM, van Wersch JW. Количество ретикулоцитов и их субфракций у курящих и некурящих беременных. Eur J Clin Chem Clin Biochem 1995;33:263–5. | ||
118 | Трейл ЛМ. Ретикулоциты при здоровой беременности. Med J Aust 1975; 2: 205–6. | ||
119 | Ю Ф, Чжоу В, Инь М, и др. Проспективное и лонгитюдное исследование показателей метаболизма железа при нормальной беременности у китайских женщин. Clin Lab 2019;65. DOI: 10.7754/Clin.Lab.2018.180928. |
Вариант оценки онлайн-исследования
Все читатели, являющиеся квалифицированными врачами или смежными медицинскими работниками, теперь могут автоматически получить 2 кредита непрерывного профессионального развития от FIGO плюс и сертификат о завершении исследования от GLOWM за успешные ответы на 4 вопроса с несколькими вариантами ответов (выбранных случайным образом) на основе по изучению этой главы.

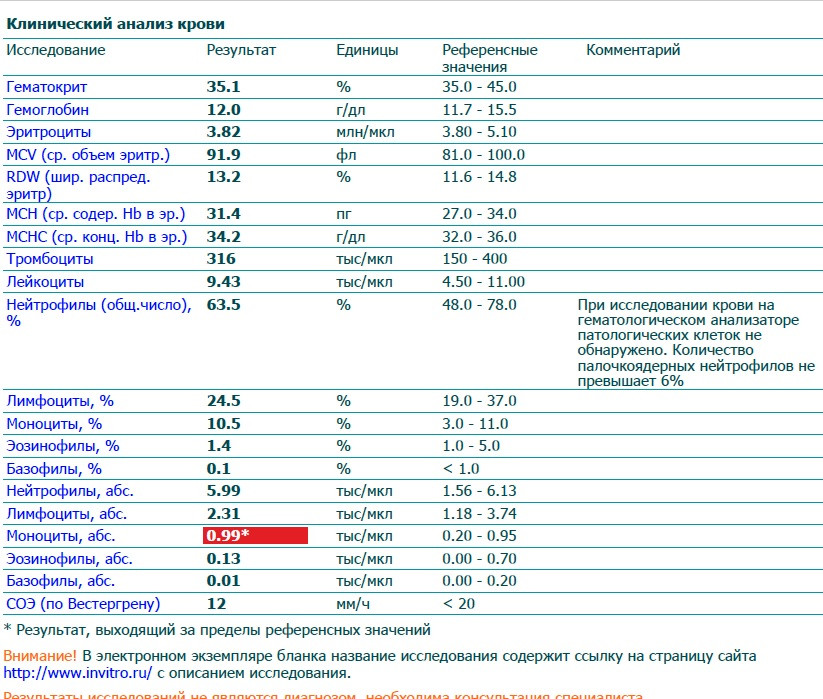

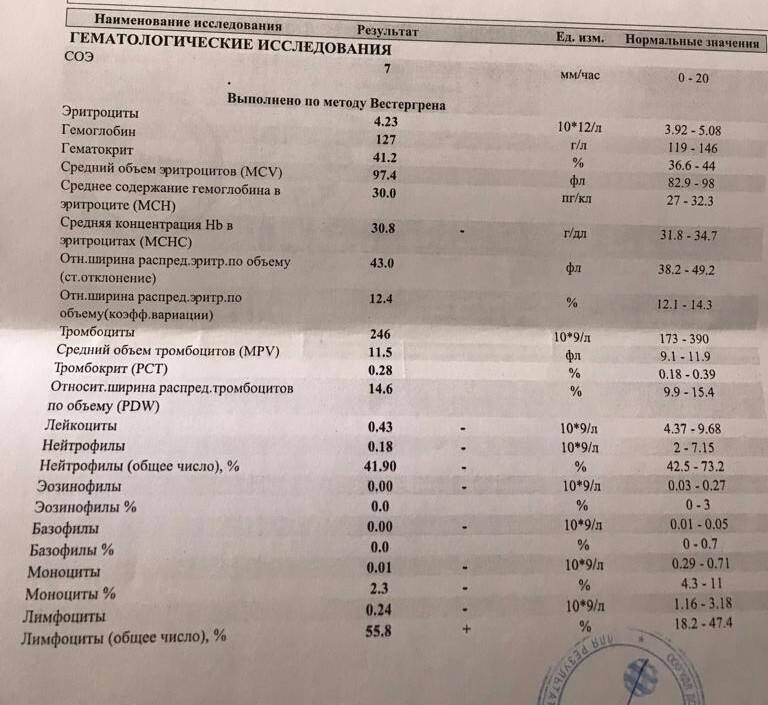
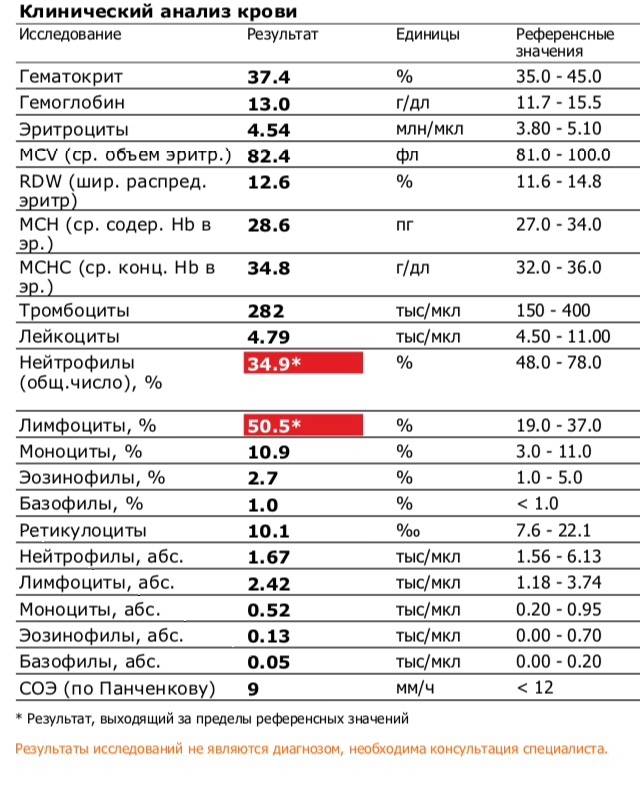


 TB;
TB;
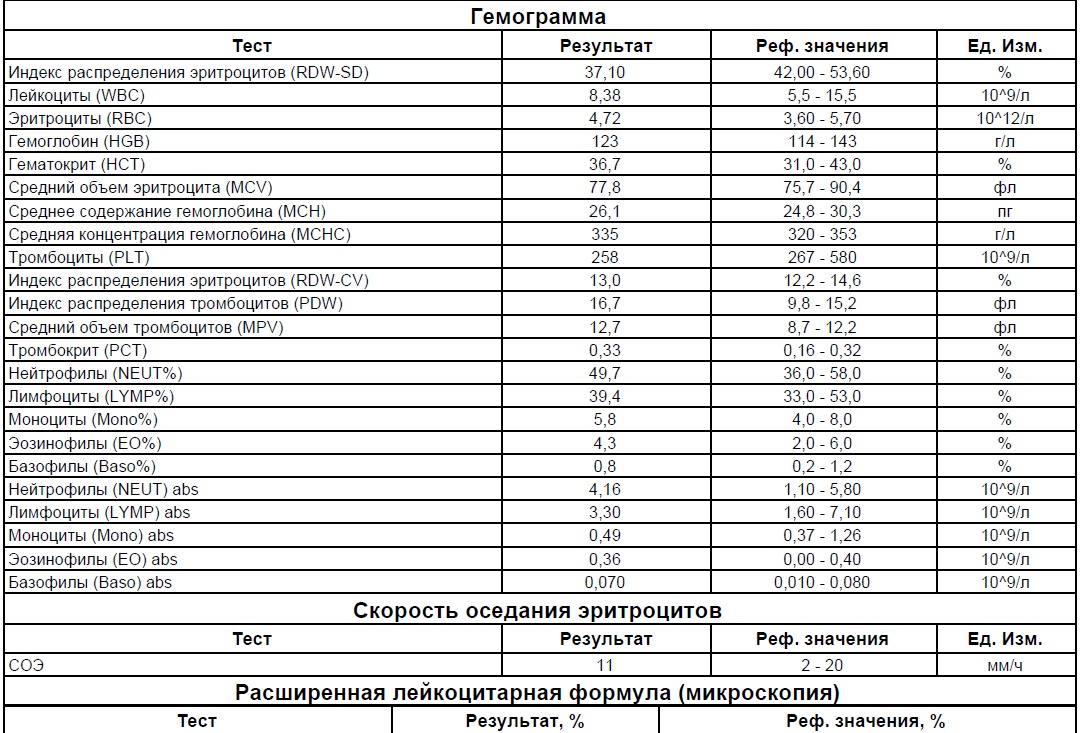
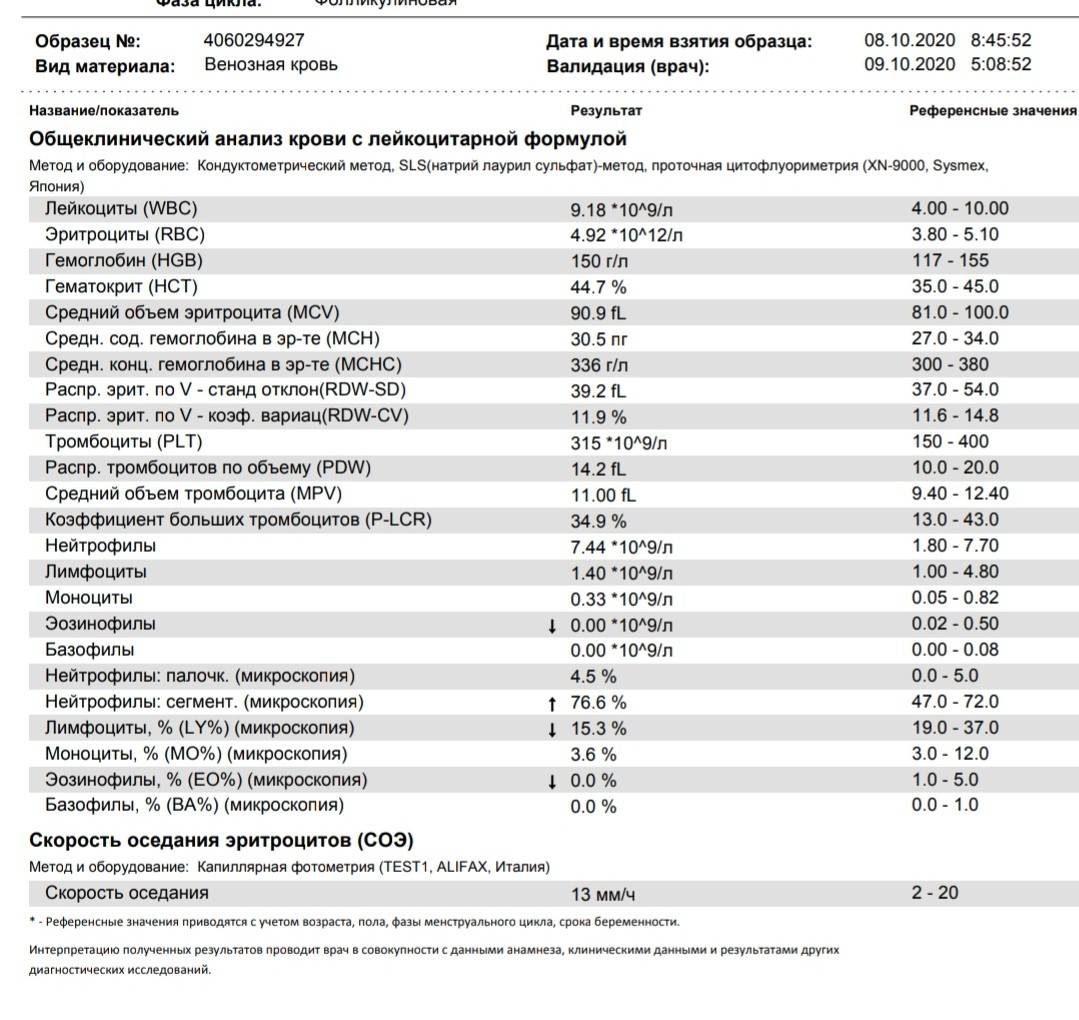 При диагностике анемий для определения природы заболевания эти показатели важно учитывать. Косвенно мы можем предполагать по ним регенерацию (образование новых эритроцитов), железодефицитные состояния, заболевания костного мозга.
При диагностике анемий для определения природы заболевания эти показатели важно учитывать. Косвенно мы можем предполагать по ним регенерацию (образование новых эритроцитов), железодефицитные состояния, заболевания костного мозга.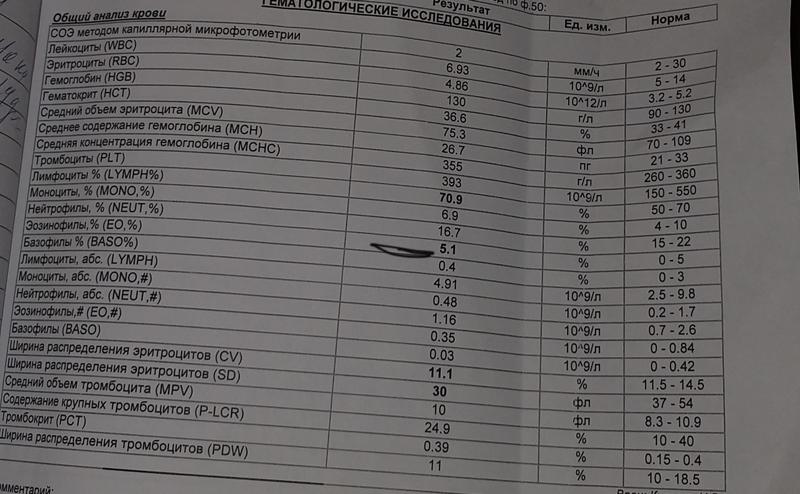 Их повышение почти всегда говорит о паразитарной инвазии, хотя у кошек они почти никогда не повышаются, даже если паразиты есть.
Их повышение почти всегда говорит о паразитарной инвазии, хотя у кошек они почти никогда не повышаются, даже если паразиты есть.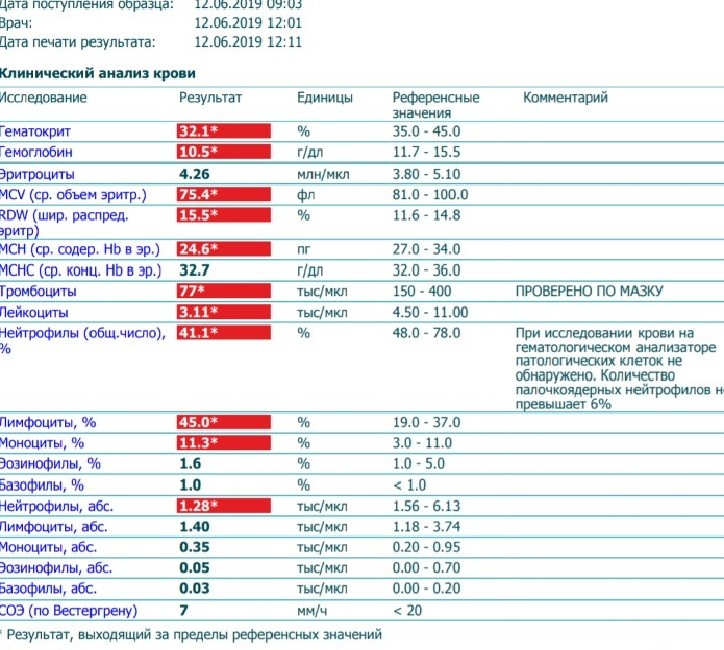 Понижены тромбоциты могут быть только по двум причинам: либо они избыточно теряются (тромболитические яды, кровопотеря, инфекции), либо недостаточно образуются (опухоли, заболевания костного мозга и др.). Но нередко они занижены ошибочно, например, если в пробирке образовался тромб (артефакт исследования).
Понижены тромбоциты могут быть только по двум причинам: либо они избыточно теряются (тромболитические яды, кровопотеря, инфекции), либо недостаточно образуются (опухоли, заболевания костного мозга и др.). Но нередко они занижены ошибочно, например, если в пробирке образовался тромб (артефакт исследования).
 В кровь она попадает из 12-перстной кишки, соответственно, ее повышение может быть связано скорее с повышением проницаемости кишечника, нежели с заболеваниями ПЖ. Для диагностики данных заболеваний гораздо информативнее использовать УЗИ.
В кровь она попадает из 12-перстной кишки, соответственно, ее повышение может быть связано скорее с повышением проницаемости кишечника, нежели с заболеваниями ПЖ. Для диагностики данных заболеваний гораздо информативнее использовать УЗИ. 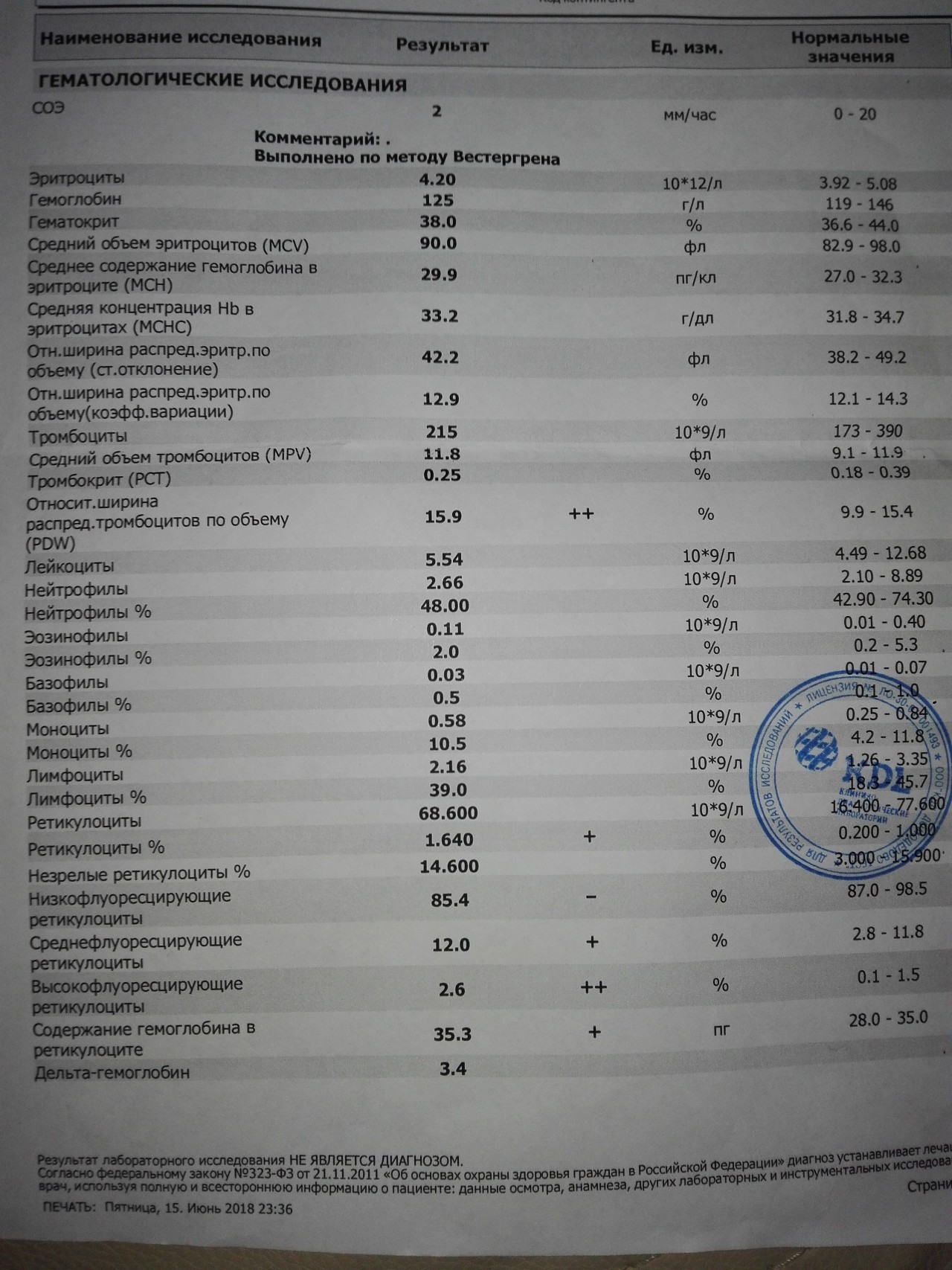 Дефицит чаще всего связан с ее недостаточным поступлением (при голоде) или вовсе — потерей (отравление, некоторые лекарства). Незначительное повышение глюкозы может быть нормой из-за стресса. Также может свидетельствовать о серьезных заболеваниях, таких как диабет, почечная недостаточность и др.
Дефицит чаще всего связан с ее недостаточным поступлением (при голоде) или вовсе — потерей (отравление, некоторые лекарства). Незначительное повышение глюкозы может быть нормой из-за стресса. Также может свидетельствовать о серьезных заболеваниях, таких как диабет, почечная недостаточность и др.  Но может быть и повышена при беременности, энтеропатии, заболеваниях ротовой полости, в период роста.
Но может быть и повышена при беременности, энтеропатии, заболеваниях ротовой полости, в период роста. 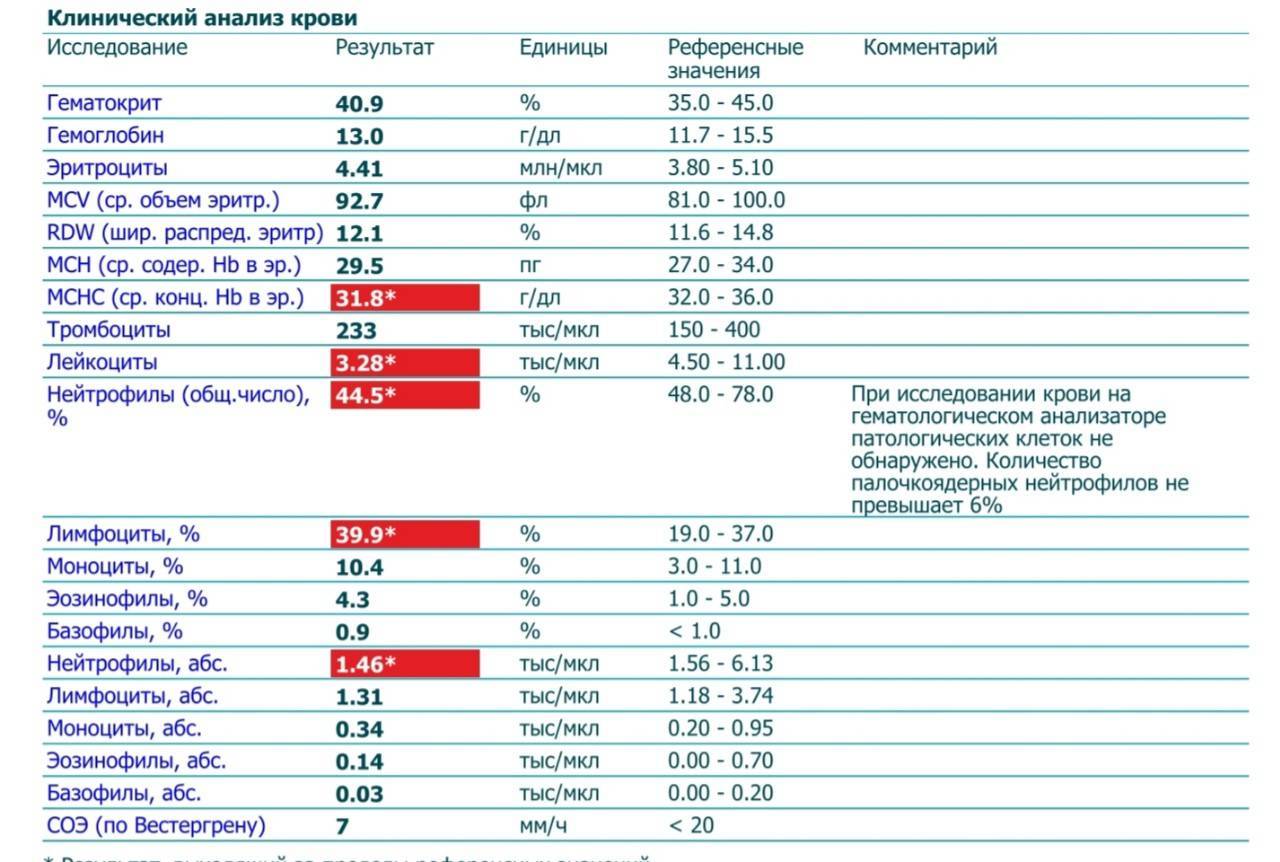 7—8.1
7—8.1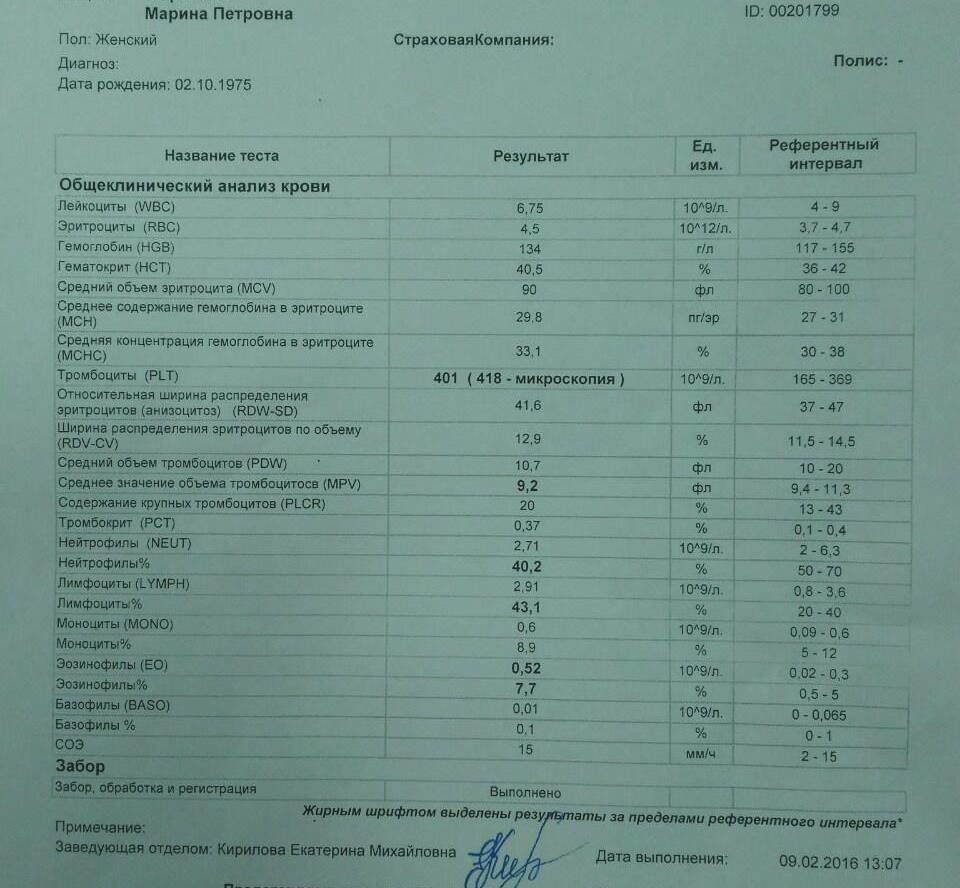 /мкл)
/мкл) /л)
/л)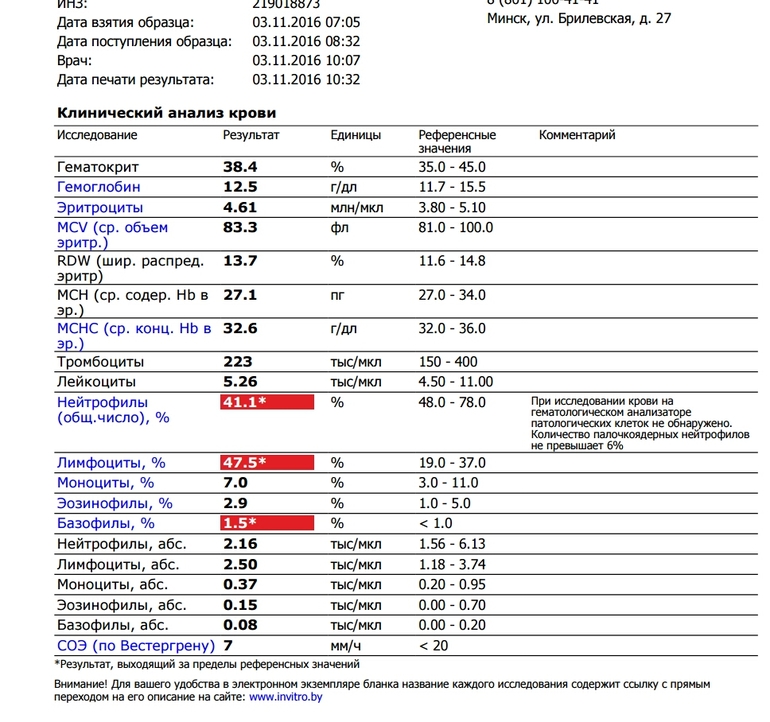 /л)
/л)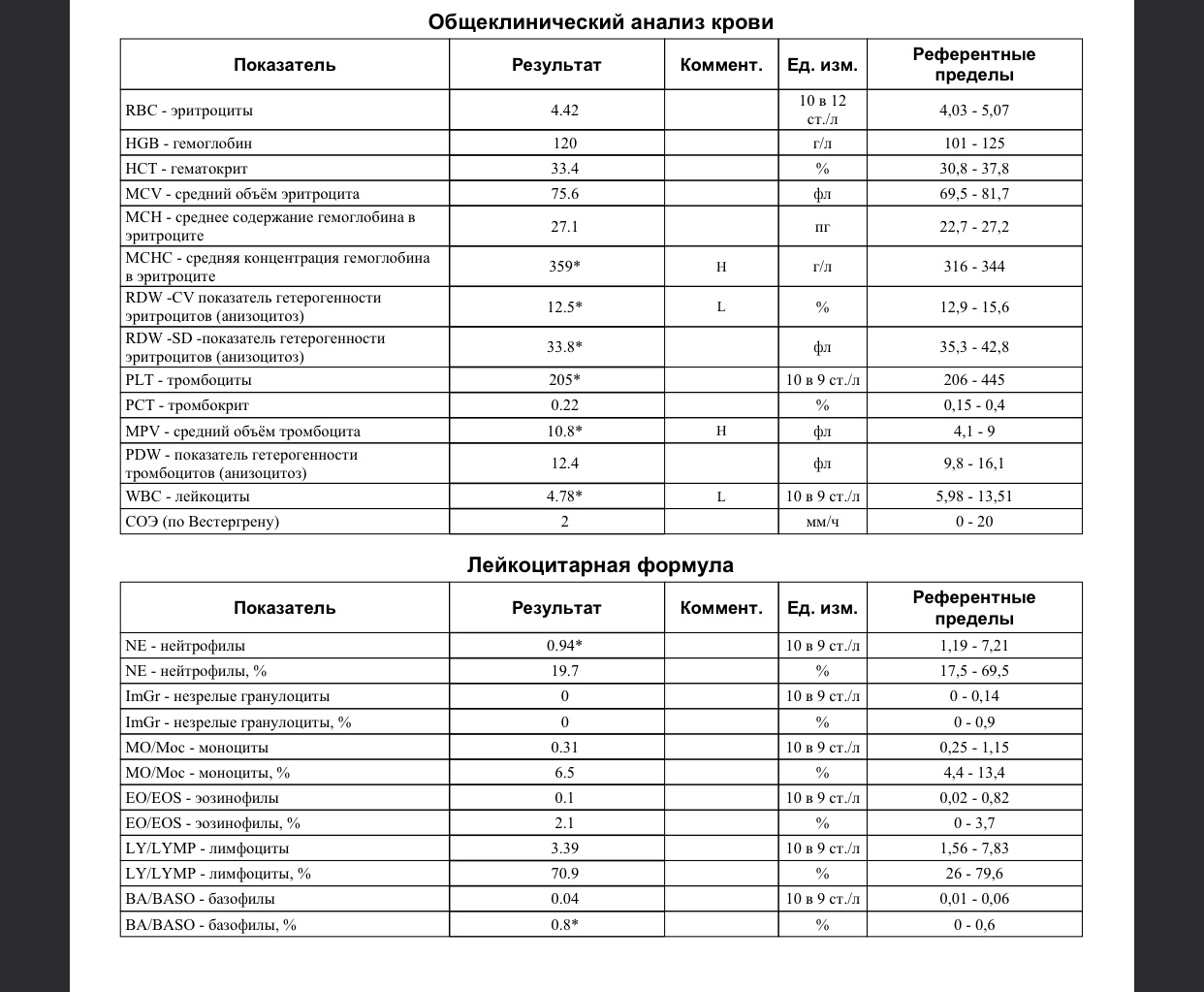 ч. лимфома)
ч. лимфома)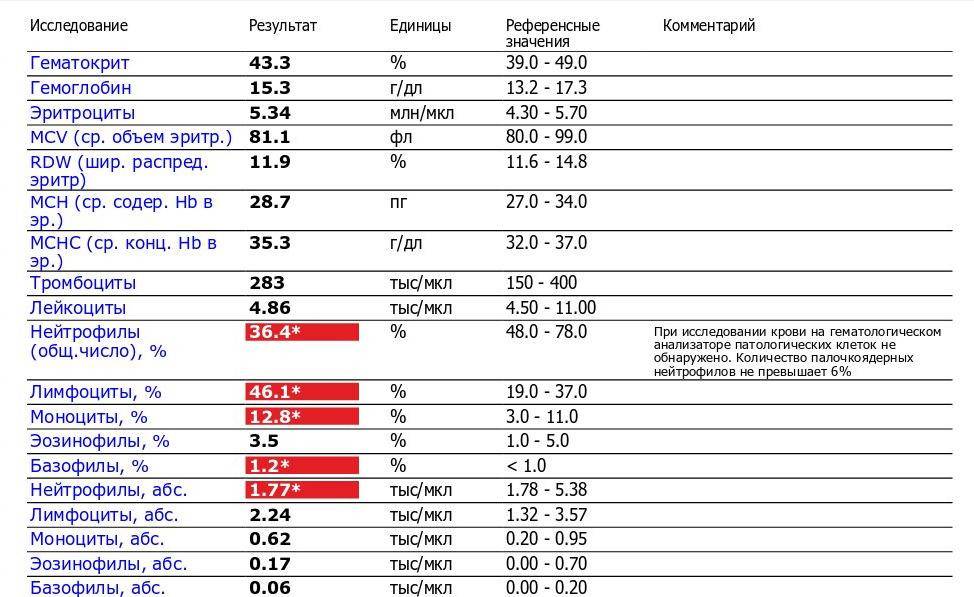 )
) )
) Более высокий процент комбинированных неклассических/промежуточных моноцитов был обнаружен у беременных женщин по сравнению с небеременными женщинами и даже более высокий процент у пациенток с преэклампсией по сравнению со здоровыми беременными женщинами (B).При делении на неклассические и промежуточные моноциты достоверных изменений в неклассических моноцитах (К) не наблюдалось, хотя у женщин с преэклампсией наблюдалась тенденция к снижению неклассических моноцитов по сравнению со здоровыми беременными. Напротив, более высокий процент промежуточных моноцитов был обнаружен у здоровых беременных женщин по сравнению с небеременными женщинами и даже более высокий процент у пациенток с преэклампсией по сравнению со здоровыми беременными женщинами (D). Показаны медианы, #p<0,1, *p<0.05; **р<0,01; ***р<0,001; U-тест Манна-Уитни.
Более высокий процент комбинированных неклассических/промежуточных моноцитов был обнаружен у беременных женщин по сравнению с небеременными женщинами и даже более высокий процент у пациенток с преэклампсией по сравнению со здоровыми беременными женщинами (B).При делении на неклассические и промежуточные моноциты достоверных изменений в неклассических моноцитах (К) не наблюдалось, хотя у женщин с преэклампсией наблюдалась тенденция к снижению неклассических моноцитов по сравнению со здоровыми беременными. Напротив, более высокий процент промежуточных моноцитов был обнаружен у здоровых беременных женщин по сравнению с небеременными женщинами и даже более высокий процент у пациенток с преэклампсией по сравнению со здоровыми беременными женщинами (D). Показаны медианы, #p<0,1, *p<0.05; **р<0,01; ***р<0,001; U-тест Манна-Уитни.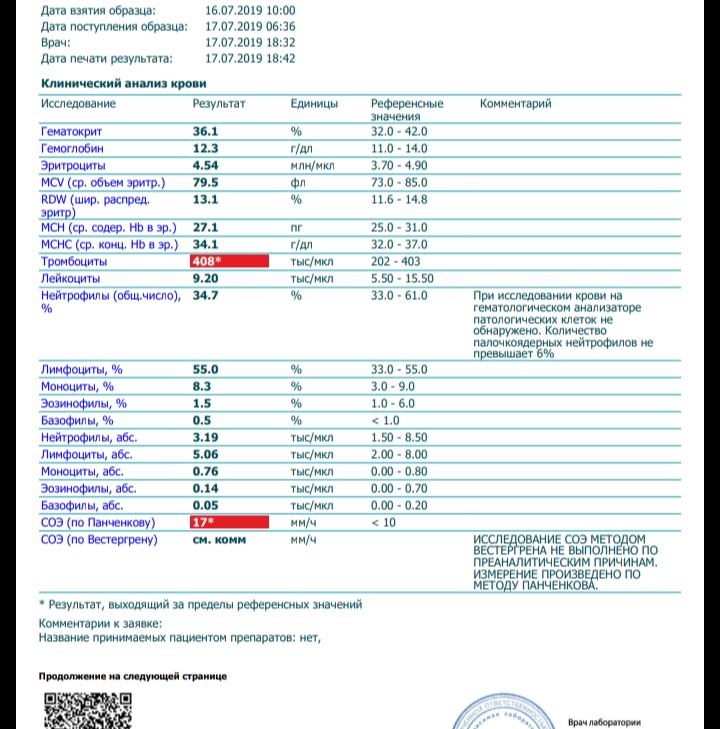 Напротив, в периферической крови здоровых беременных женщин было обнаружено значительно более высокое процентное содержание промежуточных моноцитов по сравнению с небеременными женщинами (p<0,0.01, ) и даже более высокие проценты в периферической крови пациенток с преэклампсией по сравнению со здоровыми беременными (p<0,001, ).
Напротив, в периферической крови здоровых беременных женщин было обнаружено значительно более высокое процентное содержание промежуточных моноцитов по сравнению с небеременными женщинами (p<0,0.01, ) и даже более высокие проценты в периферической крови пациенток с преэклампсией по сравнению со здоровыми беременными (p<0,001, ).
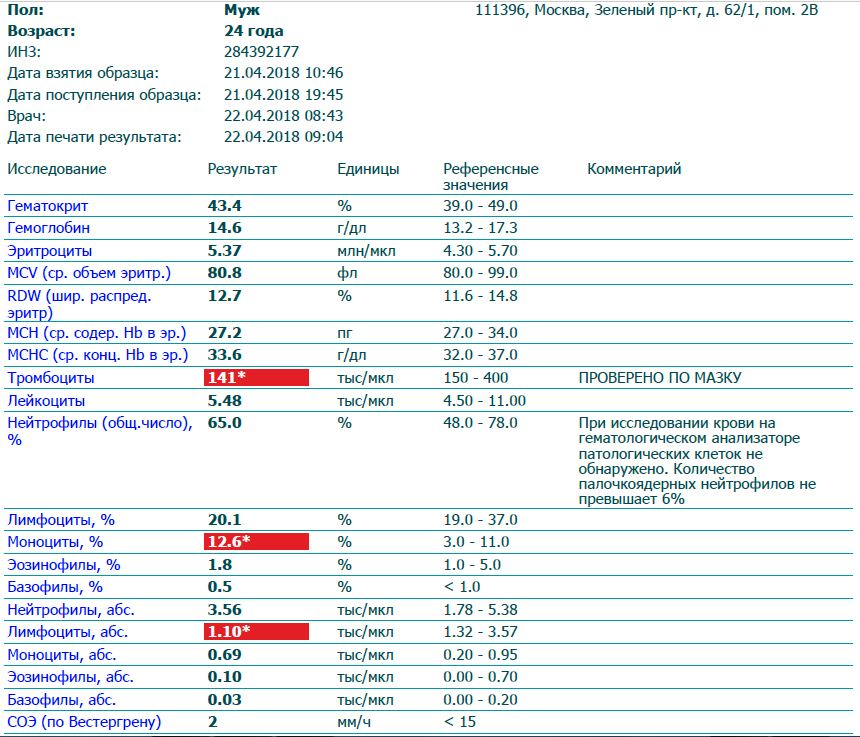 Высокая популяция этих клеток указывает на потребность в поддержке иммунной системы. Причинами могут быть травма, беременность, аллергические реакции или аутоиммунное заболевание. Некоторые симптомы, связанные с повышенным содержанием лейкоцитов, включают лихорадку, головокружение, частые аллергические реакции и воспаление.
Высокая популяция этих клеток указывает на потребность в поддержке иммунной системы. Причинами могут быть травма, беременность, аллергические реакции или аутоиммунное заболевание. Некоторые симптомы, связанные с повышенным содержанием лейкоцитов, включают лихорадку, головокружение, частые аллергические реакции и воспаление.