Анемия у детей: причины и симптомы
Анемия возникает, когда в организме снижается уровень гемоглобина и/или эритроцитов. Эритроциты – это особые клетки крови, которые переносят кислород от легких к тканям. Анемия у новорожденных и младенцев — частое явление, также она встречается у детей старшего возраста и взрослых. Анемия у грудничка может развиться по ряду причин. Из этой статьи вы узнаете о причинах анемии, ее признаках и симптомах, а также о лечении анемии у детей раннего возраста.
Что такое анемия
Чтобы понять, что такое анемия, сперва надо разобраться, как функционируют клетки крови. Кровь состоит из нескольких типов клеток, почти половина из которых — это эритроциты (они же красные кровяные тельца). Эти клетки содержат красный пигментированный белок — гемоглобин. Функция гемоглобина — переносить кислород от легких к тканям, а диоксид углерода, образующийся при метаболизме, из тканей к альвеолам легких.
Анемия развивается, когда в эритроцитах недостаточно гемоглобина или когда для транспортировки кислорода по телу не хватает здоровых эритроцитов. На фоне анемии могут возникнуть проблемы с функцией и ростом клеток.
На фоне анемии могут возникнуть проблемы с функцией и ростом клеток.
Анемия у новорожденных и младенцев
Вот некоторые из причин и факторов риска развития анемии у новорожденных и младенцев:
Недостаточно гемоглобина.
Анемия мамы во время беременности – огромный процент женщин имеют железодефицитную анемию в период беременности. Это приводит к тому, что малыш, находясь в утробе, недополучает необходимое количество железа, развивая тем самым анемию.
Недоношенность – так же является фактором риска развития анемии, так как именно на поздних сроках беременности происходит активная передача железа от матери к плоду.

Разрушается слишком много эритроцитов. Это может происходить, если ребенок страдает такими заболеваниями, как гемолитическая или серповидно-клеточная анемия. Последняя чаще встречается у детей африканского происхождения.
В эритроцитах низкий уровень гемоглобина. Передаваемые по наследству заболевания крови, такие как талассемия, часто наблюдаемые у людей азиатского, африканского, ближневосточного, греческого и итальянского происхождения, могут привести к недостаточному уровню гемоглобина или к низкому количеству эритроцитов.
Потеря крови. Это может быть результатом травмы или такого состояния, как гемофилия, при котором кровь не свертывается должным образом.
Признаки и симптомы анемии у детей раннего возраста
К часто встречающимся признакам и симптомам анемии относятся:
Бледность кожных покровов и слизистых
плаксивость и раздражительность
слабость
быстрая утомляемость или необычная сонливость
желтизна кожных покровов и/или белков глаз (желтуха)
моча темного цвета
Среди признаков анемии тяжелой степени встречаются:
одышка
учащенное сердцебиение
отеки рук и ног
головные боли
головокружение и обмороки
Анемия у грудничка может быть вызвана дефицитом железа. Этот тип анемии характерен для малышей в возрасте от 9 до 24 месяцев. Вот признаки и симптомы анемии, вызванной дефицитом железа:
Этот тип анемии характерен для малышей в возрасте от 9 до 24 месяцев. Вот признаки и симптомы анемии, вызванной дефицитом железа:
снижение аппетита
плаксивость и раздражительность
беспокойное состояние
сложности с удерживанием внимания
Если вы заметили у ребенка какие-либо из вышеперечисленных признаков и симптомов или вам кажется, что он не получает достаточно железа с едой, проконсультируйтесь с педиатром.
Как лечится анемия у детей раннего возраста
Существуют различные виды анемии, и они требуют различных методов лечения. Поэтому не стоит давать ребенку витамины, пищевые добавки или любые другие лекарства, отпускаемые без рецепта, без консультации с врачом.
Для лечения анемии у детей врач может выписать лекарственные средства или дать рекомендации по коррекции питания. Если анемия вызвана недостатком железа, врач может назначить препарат железа в жидкой форме.
Если малыш родился недоношенным или сильно болен, в некоторых случаях для лечения анемии может быть показано переливание крови.
Общаясь с педиатром, не забудьте упомянуть все симптомы анемии, которые вы заметили у ребенка, а также сообщите, была ли у кого-то в семье анемия или заболевания крови.
Методы профилактики анемии у детей раннего возраста
Не все виды анемии поддаются профилактике, особенно те, которые вызваны генетическими заболеваниями, такими как серповидно-клеточная анемия или талассемия. Однако анемию из-за нехватки железа или другого пищевого дефицита можно предотвратить за счет сбалансированного питания.
Методы профилактики железодефицитной анемии у новорожденных и маленьких детей:
Однако анемию из-за нехватки железа или другого пищевого дефицита можно предотвратить за счет сбалансированного питания.
Методы профилактики железодефицитной анемии у новорожденных и маленьких детей:
Не давайте малышу коровье, а также козье молоко до года.
Если малыш на грудном вскармливании, педиатр может назначить прием препарата железа с четырех месяцев и до момента ввода прикорма с высоким содержанием железа (обогащенные злаки, мясное пюре).
Если ваш ребенок на искусственном вскармливании, выбирайте смесь с добавлением железа.
Когда малыш привыкнет есть твердую пищу, включайте в рацион продукты, богатые железом, такие как красное мясо, яичные желтки, картофель, помидоры, бобы, сухофрукты и темные листовые овощи.
Включайте в рацион продукты, богатые витамином С, так как он помогает усвоению железа. Это могут быть цитрусовые, апельсиновый сок, сладкий перец, помидоры, шпинат и брокколи.

Заключение
В большинстве случаев анемия у детей успешно лечится с помощью коррекции рациона или приема лекарственных препаратов, рекомендованных врачом. Если анемия вызвана генетическим заболеванием, педиатр может направить вас на консультацию к профильному специалисту. Если вы переживаете, что у ребенка может быть анемия, или заметили такие проявления, как бледность и вялость, проконсультируйтесь с педиатром. Уровень железа в крови проверяется с помощью простого анализа крови. Поставив диагноз, врач сможет порекомендовать ход лечения (если оно потребуется). Чем раньше вы узнаете о возможных нарушениях, тем быстрее вы сможете помочь малышу.
Как была написана эта статья
Информация, представленная в этой статье, основана на рекомендациях специалистов, опубликованных достоверными (медицинскими и государственными) источниками, такими как Американская ассоциация педиатрии и Американский колледж акушеров и гинекологов. Полный список ссылок на источники, использованные для написания этой статьи, вы найдете в конце статьи. Информация на данной странице не заменяет профессиональной медицинской консультации. Всегда обращайтесь к врачу для постановки диагноза и назначения лечения.
Полный список ссылок на источники, использованные для написания этой статьи, вы найдете в конце статьи. Информация на данной странице не заменяет профессиональной медицинской консультации. Всегда обращайтесь к врачу для постановки диагноза и назначения лечения.
Ответы на самые распространенные вопросы — Into-Sana
Какой уровень гемоглобина у ребенка считается нормой? В чем причины его снижения? Какие продукты помогут нормализовать гемоглобин? Какие причины анемии, и как их определить? На эти и другие вопросы отвечает специалист клиники Into-Sana, врач-педиатр Чехун Наталья Николаевна.
Какой уровень гемоглобина у ребенка считается нормой?
При определении нормы уровня гемоглобина имеет значение возраст ребенка. Например, у новорожденного уровень гемоглобина 130 г/л и выше – это норма. Для 3-месячного ребенка нормой будет 100 г/л и выше. У ребенка 1–3 лет нормой считается 110 г/л и выше, 4–12 лет –115 г/л и выше, 12–16 лет – 120 г/л и выше.
Каковы причины снижения уровня гемоглобина?
Причин анемии (снижения уровня гемоглобина) у детей очень много. Описать все их в рамках подобной статьи невозможно, поэтому просто перечислим основные.
Условно причины анемии можно разделить на такие группы:
1. Нарушения поступления в организм веществ, необходимых для синтеза гемоглобина – железа, например:
- Нерациональное питание, особенно у детей первого года жизни. Лучшей пищей для грудничков является, несомненно, грудное молоко. Вскармливание детей первого года жизни коровьим или козьим молоком может вызвать анемию, поэтому при невозможности грудного вскармливания лучше использовать адаптированные детские смеси, они, кроме прочего, обогащены железом.
- Некоторые специфические заболевания органов ЖКТ: гастриты, энтериты, язвенная болезнь желудка и 12-ти перстной кишки, при которых может нарушаться усвоение железа из пищи.
- Недостаточность витамина В12 в организме может вызывать снижение гемоглобина, так как этот витамин участвует в переносе железа из кишечника в кровь.

2. Также анемия может развиваться при избыточном разрушении эритроцитов.
- При острых или хронических отравлениях некоторыми ядовитыми веществами (змеиные яды, некоторые грибы, угарный газ, кислоты и щелочи, а так же тяжелые металлы, анилин и другие органические вещества, соединения мышьяка, и т.д.).
- При заболеваниях, связанных с разрушением эритроцитов – наследственная серповидно-клеточная анемия, некоторые заболевания селезенки. А также некоторые инвазии.
3. Причинами снижения уровня гемоглобина могут стать кровотечения различного генеза.
- Острые кровотечения – последствия травм или операций.
- Хронические, незначительные по объему, но частые кровотечения. Например, у девочек в пубертатном периоде снижение гемоглобина может быть при обильных или длительных менструациях. Другой пример – заболевания желудка, 12-ти перстной кишки, толстого кишечника, при которых также возможны небольшие, но частые кровотечения.

4. Относительно редкой, но от этого не менее опасной причиной снижения гемоглобина является угнетение кроветворения. Происходит это чаще всего при опухолевых заболеваниях крови (лейкозы и им подобные), когда в кроветворных органах патологический опухолевый клон клеток вытесняет нормальное кроветворение.
Каковы последствия пониженного гемоглобина?Последствия пониженного гемоглобина – это кислородное голодание всех органов и систем организма, и в результате этого развитие дистрофических, иногда даже необратимых изменений в органах и тканях. Страдает больше всего сердце, головной мозг, кожа. Появляются усталость, утомляемость, головокружения и т.д.. Снижается иммунитет.
Какие продукты помогут нормализовать гемоглобин? И можно ли вообще питанием регулировать и поддерживать нормальный уровень гемоглобина?Устранение причины снижения гемоглобина обязательно приведет к нормализации его уровня. Конечно же, если причина была в недостатке поступления железы с пищей, то именно продукты питания и рациональный прием пищи обеспечат ребенку нормальный уровень гемоглобина в крови. Наибольшее содержание железа находится в мясе кролика, говядине, нежирной свинине. Также относительно богаты железом овощи, фрукты, крупы. Поэтому в рационе ребенка должны присутствовать такие продукты: мясо и рыба, злаки и каши, молоко и кисломолочные продукты, овощи и фрукты.
Наибольшее содержание железа находится в мясе кролика, говядине, нежирной свинине. Также относительно богаты железом овощи, фрукты, крупы. Поэтому в рационе ребенка должны присутствовать такие продукты: мясо и рыба, злаки и каши, молоко и кисломолочные продукты, овощи и фрукты.
В каких случаях одного питания недостаточно и необходимо потребление лекарственных препаратов? Когда показано применение препаратов железа? И что делать, если есть непереносимость железа?
Лечение анемии зависит от ее причины и механизма развития. Не установив причину, нет смысла начинать лечение, иначе симптомы болезни быстро вернутся. Когда анемия связана с затруднениями усвоения железа из пищи (заболевания желудка или кишечника), или когда недостаток железа в организме слишком велик, прибегают к железосодержащим лекарственным препаратам. Ориентируется врач при этом обычно на уровень гемоглобина. Препараты железа необходимы при развитии анемии средней степени тяжести, т.е. когда уровень гемоглобина составляет 70-90 г/л, если анемия легкой степени тяжести, гемоглобин при этом 90–110 г/л (не забываем учитывать возраст ребенка), можно ограничиться устранением причины анемии и нормальным питанием.
норма для ребенка, повышенный и пониженный уровень
https://ria.ru/20220126/gemoglobin-1769685892.html
Обмороки и одышка у детей: признаки проблем с гемоглобином и их решение
Гемоглобин у детей в крови: норма для ребенка, повышенный и пониженный уровень
Обмороки и одышка у детей: признаки проблем с гемоглобином и их решение
Гемоглобин играет ключевую роль в обогащении организма кислородом. Высокий или низкий уровень этого белка в крови может стать причиной развития патологий. РИА Новости, 26.01.2022
2022-01-26T20:26
2022-01-26T20:26
2022-01-26T20:25
дети
здоровье — общество
здоровье
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/07e6/01/1a/1769679833_0:120:3068:1846_1920x0_80_0_0_221f9940209631afa40d37ef71d8fdd0.jpg
МОСКВА, 26 янв — РИА Новости. Гемоглобин играет ключевую роль в обогащении организма кислородом. Высокий или низкий уровень этого белка в крови может стать причиной развития патологий.Отклонения от нормы гемоглобина у детей: симптомы повышенного, что делать при пониженном, сколько раз в год ребенку нужно сдавать анализ крови, — в материале РИА Новости.Гемоглобин у детейВ состав белка гемоглобина входит атом двухвалентного железа, находящийся внутри эритроцита – красной кровяной клетки крови. Это один из важнейших ее элементов, основная функция которого – доставка кислорода из легких в ткани. Также гемоглобин участвует в переносе углекислого газа от тканей и поддерживает кислотно-щелочной баланс в организме.Таким образом, он играет важную роль в клеточном дыхании, необходим для жизнедеятельности всех клеток.Уровень гемоглобина у детей до года выше, чему взрослых. После года он снижается, приближаясь к показателям совершеннолетнего человека.Как определяется“Самый простой способ определить уровень гемоглобина – общий анализ крови. В рамках исследования можно узнать и показатели содержания гемоглобина в эритроцитах — эритроцитарные индексы (MCV, MCH).
Высокий или низкий уровень этого белка в крови может стать причиной развития патологий.Отклонения от нормы гемоглобина у детей: симптомы повышенного, что делать при пониженном, сколько раз в год ребенку нужно сдавать анализ крови, — в материале РИА Новости.Гемоглобин у детейВ состав белка гемоглобина входит атом двухвалентного железа, находящийся внутри эритроцита – красной кровяной клетки крови. Это один из важнейших ее элементов, основная функция которого – доставка кислорода из легких в ткани. Также гемоглобин участвует в переносе углекислого газа от тканей и поддерживает кислотно-щелочной баланс в организме.Таким образом, он играет важную роль в клеточном дыхании, необходим для жизнедеятельности всех клеток.Уровень гемоглобина у детей до года выше, чему взрослых. После года он снижается, приближаясь к показателям совершеннолетнего человека.Как определяется“Самый простой способ определить уровень гемоглобина – общий анализ крови. В рамках исследования можно узнать и показатели содержания гемоглобина в эритроцитах — эритроцитарные индексы (MCV, MCH). Они показывают наличие или отсутствие анемии даже при нормальном уровне гемоглобина. Такой анализ можно сдать как в частной лаборатории, так и в государственной поликлинике. Если нужно узнать уровень железа в организме (например, сывороточное железо, ферритин), необходимо сдать биохимический анализ крови”, — поясняет Татьяна Журавлева, врач-педиатр, гастроэнтеролог многопрофильной клиники семейного типа “Медицинская коллегия”.Измерить уровень гемоглобина можно в домашних условиях с помощью портативного биохимического анализатора. Достаточно небольшой капли крови для того, чтобы прибор показал уровень гемоглобина, глюкозы и холестерина в организме. Такой способ достаточно удобен, но результаты измерений зачастую имеют небольшую погрешность.Норма“Показатель гемоглобина у детей зависит от возраста. Наиболее высокий уровень наблюдается у новорожденных, показатели варьируются от 137 до 220 г/л. Объясняется это тем, что младенцу необходимо компенсировать низкую концентрацию кислорода в процессе родов.
Они показывают наличие или отсутствие анемии даже при нормальном уровне гемоглобина. Такой анализ можно сдать как в частной лаборатории, так и в государственной поликлинике. Если нужно узнать уровень железа в организме (например, сывороточное железо, ферритин), необходимо сдать биохимический анализ крови”, — поясняет Татьяна Журавлева, врач-педиатр, гастроэнтеролог многопрофильной клиники семейного типа “Медицинская коллегия”.Измерить уровень гемоглобина можно в домашних условиях с помощью портативного биохимического анализатора. Достаточно небольшой капли крови для того, чтобы прибор показал уровень гемоглобина, глюкозы и холестерина в организме. Такой способ достаточно удобен, но результаты измерений зачастую имеют небольшую погрешность.Норма“Показатель гемоглобина у детей зависит от возраста. Наиболее высокий уровень наблюдается у новорожденных, показатели варьируются от 137 до 220 г/л. Объясняется это тем, что младенцу необходимо компенсировать низкую концентрацию кислорода в процессе родов. Далее в течение нескольких недель уровень гемоглобина снижается за счет снижения эритропоэза (образования красных клеток крови)”, — добавляет эксперт.Чтобы поддерживать уровень железа и гемоглобина у ребенка после рождения, нужно особое внимание уделить правильному, полноценному и сбалансированному питанию кормящей мамы. В такой период основной способ обогащения организма малыша железом – грудное вскармливание. При искусственном вскармливании целесообразно использовать обогащенные железом смеси.После года специалисты рекомендуют сдавать анализ на проверку значений минимум один раз в год.Повышенный гемоглобин у ребенкаПовышенный уровень гемоглобина – сигнал о необходимости обращения к врачу для установки точной причины этого явления.ПричиныОбезвоживание – самая распространенная причина повышенного гемоглобина. Нехватка жидкости в организме ребенка может наблюдаться в результате интенсивного потоотделения, лихорадки, нервного перенапряжения, недостаточного питья.Также причиной повышенного гемоглобина могут стать:Высокий уровень гемоглобина может наблюдаться при ожогах кожи.
Далее в течение нескольких недель уровень гемоглобина снижается за счет снижения эритропоэза (образования красных клеток крови)”, — добавляет эксперт.Чтобы поддерживать уровень железа и гемоглобина у ребенка после рождения, нужно особое внимание уделить правильному, полноценному и сбалансированному питанию кормящей мамы. В такой период основной способ обогащения организма малыша железом – грудное вскармливание. При искусственном вскармливании целесообразно использовать обогащенные железом смеси.После года специалисты рекомендуют сдавать анализ на проверку значений минимум один раз в год.Повышенный гемоглобин у ребенкаПовышенный уровень гемоглобина – сигнал о необходимости обращения к врачу для установки точной причины этого явления.ПричиныОбезвоживание – самая распространенная причина повышенного гемоглобина. Нехватка жидкости в организме ребенка может наблюдаться в результате интенсивного потоотделения, лихорадки, нервного перенапряжения, недостаточного питья.Также причиной повышенного гемоглобина могут стать:Высокий уровень гемоглобина может наблюдаться при ожогах кожи. Происходит это из-за того, что организм начинает производить больше эритроцитов, вследствие чего увеличивается и уровень гемоглобина. Это естественный процесс, в ходе которого происходит транспортировка кислорода и питательных веществ к поврежденным участками ткани.В подростковом возрасте высокий гемоглобин может стать следствием курения. Также регулярные стрессы и прием анаболиков влияют на уровень железосодержащего белка.СимптомыЗачастую при повышенном уровне гемоглобина у ребенка появляются следующие признаки:Кроме того, может наблюдаться посинение или побледнение пальцев и губ. Резкое снижение веса также случается при повышенном гемоглобине.ПоследствияЕсли не предпринимать никаких действий в течение длительного времени, из-за нарушений процесса кровотока и затрудненного прохождения крови по сосудам может наблюдаться сильное сгущение крови. Это может стать причиной возникновения физической и умственной задержки развития, а также привести к нарушению кровообращения (гемодинамики) и закупорке сосудов.
Происходит это из-за того, что организм начинает производить больше эритроцитов, вследствие чего увеличивается и уровень гемоглобина. Это естественный процесс, в ходе которого происходит транспортировка кислорода и питательных веществ к поврежденным участками ткани.В подростковом возрасте высокий гемоглобин может стать следствием курения. Также регулярные стрессы и прием анаболиков влияют на уровень железосодержащего белка.СимптомыЗачастую при повышенном уровне гемоглобина у ребенка появляются следующие признаки:Кроме того, может наблюдаться посинение или побледнение пальцев и губ. Резкое снижение веса также случается при повышенном гемоглобине.ПоследствияЕсли не предпринимать никаких действий в течение длительного времени, из-за нарушений процесса кровотока и затрудненного прохождения крови по сосудам может наблюдаться сильное сгущение крови. Это может стать причиной возникновения физической и умственной задержки развития, а также привести к нарушению кровообращения (гемодинамики) и закупорке сосудов. Как понизитьЕсли у ребенка гемоглобин превышает норму, первым делом необходимо увеличить количество потребляемой воды. Следующий шаг – корректировка питания. Прежде всего нужно ограничить употребление продуктов с высоким содержанием железа (например, говядина, печень, яблоки и т.д.). В рацион стоит добавить больше молочных продуктов, так как они затрудняют процесс усвоения железа организмом. Также при повышенном гемоглобине специалисты рекомендуют есть больше морепродуктов и куриного мяса.Помимо корректировки питания, чтобы снизить уровень гемоглобина, стоит уменьшить количество физических нагрузок. Важно урегулировать уровень влажности в помещении, где часто пребывает ребенок.Следующим шагом является повторный анализ крови. Если ничего не изменилось, возможно потребуется дообследование.Иногда специалисты назначают медикаменты, разжижающие кровь. В ситуациях, когда высокий показатель связан с наличием патологии, необходимо заняться лечением основного заболевания.“При нормальных показателях гемоглобина может наблюдаться сниженное количество железа.
Как понизитьЕсли у ребенка гемоглобин превышает норму, первым делом необходимо увеличить количество потребляемой воды. Следующий шаг – корректировка питания. Прежде всего нужно ограничить употребление продуктов с высоким содержанием железа (например, говядина, печень, яблоки и т.д.). В рацион стоит добавить больше молочных продуктов, так как они затрудняют процесс усвоения железа организмом. Также при повышенном гемоглобине специалисты рекомендуют есть больше морепродуктов и куриного мяса.Помимо корректировки питания, чтобы снизить уровень гемоглобина, стоит уменьшить количество физических нагрузок. Важно урегулировать уровень влажности в помещении, где часто пребывает ребенок.Следующим шагом является повторный анализ крови. Если ничего не изменилось, возможно потребуется дообследование.Иногда специалисты назначают медикаменты, разжижающие кровь. В ситуациях, когда высокий показатель связан с наличием патологии, необходимо заняться лечением основного заболевания.“При нормальных показателях гемоглобина может наблюдаться сниженное количество железа. В таких случаях снижаются эритроцитарные индексы (MCV, MVH) — они определяются при проведении классического клинического анализа крови. В этой ситуации рекомендуется посмотреть уровень сывороточного железа и ферритина.Очень часто железо сыворотки снижено — тогда выставляется диагноз: латентный дефицит железа. Это не анемия, но при этом диагнозе уже требуется медикаментозная коррекция”, — комментирует Татьяна Журавлева.Пониженный гемоглобин у ребенкаНедостаток гемоглобина – наиболее распространенное отклонение от нормы, встречающееся у детей.ПричиныПри любом типе анемии организм страдает от нехватки кислорода, в результате чего может наблюдаться отставание как в физическом, так и в интеллектуальном развитии ребенка. Также может снизиться иммунитет и возникнуть нарушения в работе сердца.Наиболее часто недостаток железа наблюдается у детей следующих возрастных категорий:Также причинами пониженного гемоглобина может быть недостаток витамина В12 и/или фолиевой кислоты или врожденный дефект самих эритроцитов (красные кровяные клетки могут быть слишком маленькие, неправильной формы и тд)”, — добавляет врач-педиатр.
В таких случаях снижаются эритроцитарные индексы (MCV, MVH) — они определяются при проведении классического клинического анализа крови. В этой ситуации рекомендуется посмотреть уровень сывороточного железа и ферритина.Очень часто железо сыворотки снижено — тогда выставляется диагноз: латентный дефицит железа. Это не анемия, но при этом диагнозе уже требуется медикаментозная коррекция”, — комментирует Татьяна Журавлева.Пониженный гемоглобин у ребенкаНедостаток гемоглобина – наиболее распространенное отклонение от нормы, встречающееся у детей.ПричиныПри любом типе анемии организм страдает от нехватки кислорода, в результате чего может наблюдаться отставание как в физическом, так и в интеллектуальном развитии ребенка. Также может снизиться иммунитет и возникнуть нарушения в работе сердца.Наиболее часто недостаток железа наблюдается у детей следующих возрастных категорий:Также причинами пониженного гемоглобина может быть недостаток витамина В12 и/или фолиевой кислоты или врожденный дефект самих эритроцитов (красные кровяные клетки могут быть слишком маленькие, неправильной формы и тд)”, — добавляет врач-педиатр. СимптомыОсновные признаки пониженного гемоглобина у ребенка:ПоследствияПри возникновении анемии не стоит пренебрегать обращением к специалисту за консультацией. Ведь дефицит гемоглобина приводит к нарушениям процесса клеточного дыхания, в результате чего все органы (в особенности мозг) страдают от нехватки кислорода.Анемия может привести к задержке умственного развития, ухудшению памяти и внимания и другим заболеваниям нервной и сердечно-сосудистой систем.Как повыситьПри возникновении симптомов пониженного уровня гемоглобина следует сдать общий анализ крови, который покажет и уровень эритроцитарных индексов, необходимых для постановки диагноза. Следующий шаг – обращение к педиатру. Грамотный специалист на основании жалоб, клинических проявлений и полученных результатов анализа сможет установить наличие и характер анемии и подобрать правильное лечение. Суть терапии при таком нарушении состоит в повышении уровня железа в организме и одновременном устранении причин его дефицита, что в комплексе будет способствовать повышению уровню гемоглобина в крови.
СимптомыОсновные признаки пониженного гемоглобина у ребенка:ПоследствияПри возникновении анемии не стоит пренебрегать обращением к специалисту за консультацией. Ведь дефицит гемоглобина приводит к нарушениям процесса клеточного дыхания, в результате чего все органы (в особенности мозг) страдают от нехватки кислорода.Анемия может привести к задержке умственного развития, ухудшению памяти и внимания и другим заболеваниям нервной и сердечно-сосудистой систем.Как повыситьПри возникновении симптомов пониженного уровня гемоглобина следует сдать общий анализ крови, который покажет и уровень эритроцитарных индексов, необходимых для постановки диагноза. Следующий шаг – обращение к педиатру. Грамотный специалист на основании жалоб, клинических проявлений и полученных результатов анализа сможет установить наличие и характер анемии и подобрать правильное лечение. Суть терапии при таком нарушении состоит в повышении уровня железа в организме и одновременном устранении причин его дефицита, что в комплексе будет способствовать повышению уровню гемоглобина в крови. Врачу необходимо собрать все сведения о развитии ребенка, начиная с внутриутробного возраста, выяснить особенности протекания беременности у матери. Также необходима информация о режиме и привычках питания, перенесенных ранее заболеваниях, наличии каких-либо травм и хронических болезней. В процессе обследования педиатр должен назначить биохимический анализ крови и общий анализ мочи и кала на скрытую кровь, при необходимости применяются инструментальные методы исследования. На основании результатов этих анализов назначается лечение основного заболевания, которое спровоцировало снижение гемоглобина. Для устранения анемии обычно нужно не менее трех месяцев.Также специалисты рекомендуют больше находиться на свежем воздухе, так как активное пребывание на улице способствует улучшению процессов кроветворения.ПрофилактикаС повышенным или пониженным гемоглобином может столкнуться каждый ребенок. Важно в таком вопросе своевременно обнаружить нарушения и обратиться ко врачу за консультацией. При соблюдении всех рекомендаций можно достаточно легко справиться с проблемой.
Врачу необходимо собрать все сведения о развитии ребенка, начиная с внутриутробного возраста, выяснить особенности протекания беременности у матери. Также необходима информация о режиме и привычках питания, перенесенных ранее заболеваниях, наличии каких-либо травм и хронических болезней. В процессе обследования педиатр должен назначить биохимический анализ крови и общий анализ мочи и кала на скрытую кровь, при необходимости применяются инструментальные методы исследования. На основании результатов этих анализов назначается лечение основного заболевания, которое спровоцировало снижение гемоглобина. Для устранения анемии обычно нужно не менее трех месяцев.Также специалисты рекомендуют больше находиться на свежем воздухе, так как активное пребывание на улице способствует улучшению процессов кроветворения.ПрофилактикаС повышенным или пониженным гемоглобином может столкнуться каждый ребенок. Важно в таком вопросе своевременно обнаружить нарушения и обратиться ко врачу за консультацией. При соблюдении всех рекомендаций можно достаточно легко справиться с проблемой. Чтобы не допускать отклонения от нормы гемоглобина, ребенку необходимо соблюдать режим дня, питания, которое должно быть полноценным и сбалансированным, обязательны физические нагрузки на свежем воздухе. Также рекомендовано раз в год сдавать общий анализ крови в профилактических целях. В таком случае на ранних стадиях удастся выявить и диагностировать нарушение в работе организма и своевременно провести коррекцию.
Чтобы не допускать отклонения от нормы гемоглобина, ребенку необходимо соблюдать режим дня, питания, которое должно быть полноценным и сбалансированным, обязательны физические нагрузки на свежем воздухе. Также рекомендовано раз в год сдавать общий анализ крови в профилактических целях. В таком случае на ранних стадиях удастся выявить и диагностировать нарушение в работе организма и своевременно провести коррекцию.
https://ria.ru/20220116/analiz-1768052567.html
https://ria.ru/20180609/1522396267.html
https://ria.ru/20201218/rvota-1589979048.html
https://ria.ru/20211203/zhelezo-1762063650.html
https://ria.ru/20211126/koliki-1760988217.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2022
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria. ru/docs/about/copyright.html
ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/07e6/01/1a/1769679833_0:0:2732:2048_1920x0_80_0_0_afca5a43566f1b1ff021b8fde9e1fa72.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
дети, здоровье — общество, здоровье
МОСКВА, 26 янв — РИА Новости. Гемоглобин играет ключевую роль в обогащении организма кислородом. Высокий или низкий уровень этого белка в крови может стать причиной развития патологий.
Отклонения от нормы гемоглобина у детей: симптомы повышенного, что делать при пониженном, сколько раз в год ребенку нужно сдавать анализ крови, — в материале РИА Новости.
Гемоглобин у детей
В состав белка гемоглобина входит атом двухвалентного железа, находящийся внутри эритроцита – красной кровяной клетки крови. Это один из важнейших ее элементов, основная функция которого – доставка кислорода из легких в ткани. Также гемоглобин участвует в переносе углекислого газа от тканей и поддерживает кислотно-щелочной баланс в организме.
Таким образом, он играет важную роль в клеточном дыхании, необходим для жизнедеятельности всех клеток.
Уровень гемоглобина у детей до года выше, чему взрослых. После года он снижается, приближаясь к показателям совершеннолетнего человека.
Как определяется
“Самый простой способ определить уровень гемоглобина – общий анализ крови. В рамках исследования можно узнать и показатели содержания гемоглобина в эритроцитах — эритроцитарные индексы (MCV, MCH). Они показывают наличие или отсутствие анемии даже при нормальном уровне гемоглобина. Такой анализ можно сдать как в частной лаборатории, так и в государственной поликлинике. Если нужно узнать уровень железа в организме (например, сывороточное железо, ферритин), необходимо сдать биохимический анализ крови”, — поясняет Татьяна Журавлева, врач-педиатр, гастроэнтеролог многопрофильной клиники семейного типа “Медицинская коллегия”.
Если нужно узнать уровень железа в организме (например, сывороточное железо, ферритин), необходимо сдать биохимический анализ крови”, — поясняет Татьяна Журавлева, врач-педиатр, гастроэнтеролог многопрофильной клиники семейного типа “Медицинская коллегия”.
Измерить уровень гемоглобина можно в домашних условиях с помощью портативного биохимического анализатора. Достаточно небольшой капли крови для того, чтобы прибор показал уровень гемоглобина, глюкозы и холестерина в организме. Такой способ достаточно удобен, но результаты измерений зачастую имеют небольшую погрешность.
Норма
“Показатель гемоглобина у детей зависит от возраста. Наиболее высокий уровень наблюдается у новорожденных, показатели варьируются от 137 до 220 г/л. Объясняется это тем, что младенцу необходимо компенсировать низкую концентрацию кислорода в процессе родов. Далее в течение нескольких недель уровень гемоглобина снижается за счет снижения эритропоэза (образования красных клеток крови)”, — добавляет эксперт.
Чтобы поддерживать уровень железа и гемоглобина у ребенка после рождения, нужно особое внимание уделить правильному, полноценному и сбалансированному питанию кормящей мамы. В такой период основной способ обогащения организма малыша железом – грудное вскармливание. При искусственном вскармливании целесообразно использовать обогащенные железом смеси.
Средний уровень гемоглобина у детей
Возраст | Содержание гемоглобина (г/л) |
Новорожденные | 137–220 |
1 — 2 месяца | 107–180 |
2 — 3 месяца | 90–140 |
3 — 6 месяцев | 95–141 |
6 -12 месяцев | 105–141 |
1 — 2 года | 105–145 |
3 — 6 лет | 110-150 |
7 -10 лет | 115-150 |
11 — 12 лет | 120-155 |
13 — 15 лет | 112-152 |
15 — 18 лет | 115-155 |
После года специалисты рекомендуют сдавать анализ на проверку значений минимум один раз в год.
Повышенный гемоглобин у ребенка
Повышенный уровень гемоглобина – сигнал о необходимости обращения к врачу для установки точной причины этого явления.
Причины
Обезвоживание – самая распространенная причина повышенного гемоглобина. Нехватка жидкости в организме ребенка может наблюдаться в результате интенсивного потоотделения, лихорадки, нервного перенапряжения, недостаточного питья.
Также причиной повышенного гемоглобина могут стать:
—
заболевания крови;—
гипоксия;—
воздействие угарного газа;—
патологии почек;—
врожденные пороки сердца;—
онкологические заболевания;—
фиброз легких.
Высокий уровень гемоглобина может наблюдаться при ожогах кожи. Происходит это из-за того, что организм начинает производить больше эритроцитов, вследствие чего увеличивается и уровень гемоглобина. Это естественный процесс, в ходе которого происходит транспортировка кислорода и питательных веществ к поврежденным участками ткани.
В подростковом возрасте высокий гемоглобин может стать следствием курения. Также регулярные стрессы и прием анаболиков влияют на уровень железосодержащего белка.
16 января, 07:25
Биохимия крови: показатели нормы, что можно узнать по результатам анализаСимптомы
Зачастую при повышенном уровне гемоглобина у ребенка появляются следующие признаки:
—
сонливость, слабость, чрезмерная утомляемость;—
снижение аппетита;—
головная боль, обмороки и головокружения;—
нарушение зрения и слуха;—
появление синяков даже при легких прикосновениях;—
аритмия, тахикардия, гипертония.
Кроме того, может наблюдаться посинение или побледнение пальцев и губ. Резкое снижение веса также случается при повышенном гемоглобине.
Последствия
Если не предпринимать никаких действий в течение длительного времени, из-за нарушений процесса кровотока и затрудненного прохождения крови по сосудам может наблюдаться сильное сгущение крови. Это может стать причиной возникновения физической и умственной задержки развития, а также привести к нарушению кровообращения (гемодинамики) и закупорке сосудов.
Это может стать причиной возникновения физической и умственной задержки развития, а также привести к нарушению кровообращения (гемодинамики) и закупорке сосудов.
Как понизить
Если у ребенка гемоглобин превышает норму, первым делом необходимо увеличить количество потребляемой воды. Следующий шаг – корректировка питания. Прежде всего нужно ограничить употребление продуктов с высоким содержанием железа (например, говядина, печень, яблоки и т.д.). В рацион стоит добавить больше молочных продуктов, так как они затрудняют процесс усвоения железа организмом. Также при повышенном гемоглобине специалисты рекомендуют есть больше морепродуктов и куриного мяса.
9 июня 2018, 01:00НаукаУченые нашли способ предсказания даты рождения ребенка по анализу кровиПомимо корректировки питания, чтобы снизить уровень гемоглобина, стоит уменьшить количество физических нагрузок. Важно урегулировать уровень влажности в помещении, где часто пребывает ребенок.
Следующим шагом является повторный анализ крови. Если ничего не изменилось, возможно потребуется дообследование.
Если ничего не изменилось, возможно потребуется дообследование.
Иногда специалисты назначают медикаменты, разжижающие кровь. В ситуациях, когда высокий показатель связан с наличием патологии, необходимо заняться лечением основного заболевания.
“При нормальных показателях гемоглобина может наблюдаться сниженное количество железа. В таких случаях снижаются эритроцитарные индексы (MCV, MVH) — они определяются при проведении классического клинического анализа крови. В этой ситуации рекомендуется посмотреть уровень сывороточного железа и ферритина.
Очень часто железо сыворотки снижено — тогда выставляется диагноз: латентный дефицит железа. Это не анемия, но при этом диагнозе уже требуется медикаментозная коррекция”, — комментирует Татьяна Журавлева.
Пониженный гемоглобин у ребенка
Недостаток гемоглобина – наиболее распространенное отклонение от нормы, встречающееся у детей.
Причины
“Одной из основных, но не единственной причиной пониженного гемоглобина является низкий уровень железа в организме. При таких нарушениях врачи ставят диагноз «железодефицитная анемия», следствием которой является снижение количества железа в сыворотки крови и уровня эритроцитов – кровяных клеток, переносящих гемоглобин”, — комментирует Татьяна Журавлева.
При таких нарушениях врачи ставят диагноз «железодефицитная анемия», следствием которой является снижение количества железа в сыворотки крови и уровня эритроцитов – кровяных клеток, переносящих гемоглобин”, — комментирует Татьяна Журавлева.
При любом типе анемии организм страдает от нехватки кислорода, в результате чего может наблюдаться отставание как в физическом, так и в интеллектуальном развитии ребенка. Также может снизиться иммунитет и возникнуть нарушения в работе сердца.
Наиболее часто недостаток железа наблюдается у детей следующих возрастных категорий:
—
недоношенные;—
с шести месяцев до двух лет;—
подростки.
18 декабря 2020, 20:58
Что делать, если у ребенка началась рвота: инструкция для родителей“Причинами снижения гемоглобина в этих возрастных периодах служат сниженный запас железа у недоношенных детей, активный рост и смена типа питания у детей с шести месяцев до двух лет, а также гормональная перестройка у подростков. Поэтому в эти периоды следует более пристально следить за гемоглобином и эритроцитарными индексами в клиническом анализе крови, так как именно они могут сообщить о латентном (скрытом) дефиците железа.
Поэтому в эти периоды следует более пристально следить за гемоглобином и эритроцитарными индексами в клиническом анализе крови, так как именно они могут сообщить о латентном (скрытом) дефиците железа.
Также причинами пониженного гемоглобина может быть недостаток витамина В12 и/или фолиевой кислоты или врожденный дефект самих эритроцитов (красные кровяные клетки могут быть слишком маленькие, неправильной формы и тд)”, — добавляет врач-педиатр.
Симптомы
Основные признаки пониженного гемоглобина у ребенка:
—
повышенная слабость и сонливость;—
бледная кожа;—
шелушение, сухость кожи;—
ломкость и тусклость волос;—
одышка, тахикардия;—
шум в ушах;—
трещинки на ступнях и ладонях;—
головная боль, головокружения, обмороки;—
повышенная раздражительность, нервозность, плаксивость;—
незаживающие язвочки в уголках губ;—
беспричинное повышение температуры до 37-37,5 градуса.
3 декабря 2021, 18:10
Дефицит железа в организме: чем опасен и как восполнить за счет продуктовПоследствия
При возникновении анемии не стоит пренебрегать обращением к специалисту за консультацией. Ведь дефицит гемоглобина приводит к нарушениям процесса клеточного дыхания, в результате чего все органы (в особенности мозг) страдают от нехватки кислорода.
Анемия может привести к задержке умственного развития, ухудшению памяти и внимания и другим заболеваниям нервной и сердечно-сосудистой систем.
Как повысить
При возникновении симптомов пониженного уровня гемоглобина следует сдать общий анализ крови, который покажет и уровень эритроцитарных индексов, необходимых для постановки диагноза. Следующий шаг – обращение к педиатру. Грамотный специалист на основании жалоб, клинических проявлений и полученных результатов анализа сможет установить наличие и характер анемии и подобрать правильное лечение. Суть терапии при таком нарушении состоит в повышении уровня железа в организме и одновременном устранении причин его дефицита, что в комплексе будет способствовать повышению уровню гемоглобина в крови.
Врачу необходимо собрать все сведения о развитии ребенка, начиная с внутриутробного возраста, выяснить особенности протекания беременности у матери. Также необходима информация о режиме и привычках питания, перенесенных ранее заболеваниях, наличии каких-либо травм и хронических болезней. В процессе обследования педиатр должен назначить биохимический анализ крови и общий анализ мочи и кала на скрытую кровь, при необходимости применяются инструментальные методы исследования. На основании результатов этих анализов назначается лечение основного заболевания, которое спровоцировало снижение гемоглобина. Для устранения анемии обычно нужно не менее трех месяцев.
Также специалисты рекомендуют больше находиться на свежем воздухе, так как активное пребывание на улице способствует улучшению процессов кроветворения.
26 ноября 2021, 22:41
Колики у новорожденного: эффективные способы помочь малышуПрофилактика
С повышенным или пониженным гемоглобином может столкнуться каждый ребенок. Важно в таком вопросе своевременно обнаружить нарушения и обратиться ко врачу за консультацией. При соблюдении всех рекомендаций можно достаточно легко справиться с проблемой.
Важно в таком вопросе своевременно обнаружить нарушения и обратиться ко врачу за консультацией. При соблюдении всех рекомендаций можно достаточно легко справиться с проблемой.
Чтобы не допускать отклонения от нормы гемоглобина, ребенку необходимо соблюдать режим дня, питания, которое должно быть полноценным и сбалансированным, обязательны физические нагрузки на свежем воздухе. Также рекомендовано раз в год сдавать общий анализ крови в профилактических целях. В таком случае на ранних стадиях удастся выявить и диагностировать нарушение в работе организма и своевременно провести коррекцию.
Анемия при сердечно-сосудистых заболеваниях
С.П. Сидорук, Е.Б. Петрова, Н.П. Митьковская
Госпиталь, Аль-Ахса, Саудовская Аравия, УО «Белорусский государственный медицинский университет»
Анемия часто встречается у пациентов с патологией сердечно-сосудистой системы: может наблюдаться у трети пациентов с застойной сердечной недостаточностью и у 10-20% пациентов с ишемической болезнью сердца (ИБС). Причины анемии при болезнях сердца многофакторны и могут включать хроническое воспаление, абсолютный или функциональный дефицит железа, недостаточную выработку и активность эритропоэтина, гемоделюцию, нарушения функции почек. Гемодинамические и негемодинамические изменения вследствие анемии при наличии сопутствующих хронических болезней сердца вносят вклад в увеличение частоты сердечно-сосудистых осложнений. Анемия является независимым фактором риска неблагоприятного исхода при сердечно-сосудистых заболеваниях и, вероятно, является как медиатором, так и маркером неблагоприятного прогноза. Лечение анемии у пациентов с сердечно-сосудистыми заболеваниями может включать эритропоэтины, переливание крови и прием препаратов железа.
Причины анемии при болезнях сердца многофакторны и могут включать хроническое воспаление, абсолютный или функциональный дефицит железа, недостаточную выработку и активность эритропоэтина, гемоделюцию, нарушения функции почек. Гемодинамические и негемодинамические изменения вследствие анемии при наличии сопутствующих хронических болезней сердца вносят вклад в увеличение частоты сердечно-сосудистых осложнений. Анемия является независимым фактором риска неблагоприятного исхода при сердечно-сосудистых заболеваниях и, вероятно, является как медиатором, так и маркером неблагоприятного прогноза. Лечение анемии у пациентов с сердечно-сосудистыми заболеваниями может включать эритропоэтины, переливание крови и прием препаратов железа.
ключевые слова: анемия, сердечно-сосудистые заболевания, ишемическая болезнь сердца, артериальная гипертензия, дефицит железа, карбоскимальтоза
для цитирования: Сидорук С.П., Петрова Е.Б., Митьковская Н.П. Анемия при сердечно-сосудистых заболеваниях. Неотложная кардиология и кардиооваскулярные риски, 2017, Т. 1, №1, С. 38-45.
Неотложная кардиология и кардиооваскулярные риски, 2017, Т. 1, №1, С. 38-45.
Введение
Сердечно-сосудистые заболевания являются основной причиной смерти во всем мире. Многие пациенты с сердечно-сосудистой патологией страдают анемией в результате острых или хронических сопутствующих состояний. Согласно критериям Всемирной организации здравоохранения термин «анемия» раскрывается как состояние, при котором наблюдается согласно гендерной принадлежности снижение концентрации гемоглобина в крови: у женщин — менее 120 г/л и менее 130 г/л у мужчин. Анемия является важной проблемой практического здравоохранения, так как влияет на качество жизни, смертность и является частой причиной обращения к врачу.
Во всем мире анемией страдают 1,62 миллиарда людей, что составляет 24,8% от общего населения планеты. Наиболее часто анемии подвержены дети дошкольного возраста (47%), а реже всего – мужчины (12,7%). В половине случаев причиной анемии является дефицит железа [1]. Недостаток железа не только нарушает образование эритроцитов, но и ухудшает клеточные функции, связанные с мышечным метаболизмом, влияет на функцию митохондрий, нейротрансмиттеров, синтез ДНК и иммунную систему [2]. Частота анемии увеличивается с возрастом, что делает ее частым спутником сердечно-сосудистых катастроф. Анализ литературных источников продемонстрировал, что анемия является независимым предиктором кардиоваскулярных заболеваний и неблагоприятных исходов [3].
Недостаток железа не только нарушает образование эритроцитов, но и ухудшает клеточные функции, связанные с мышечным метаболизмом, влияет на функцию митохондрий, нейротрансмиттеров, синтез ДНК и иммунную систему [2]. Частота анемии увеличивается с возрастом, что делает ее частым спутником сердечно-сосудистых катастроф. Анализ литературных источников продемонстрировал, что анемия является независимым предиктором кардиоваскулярных заболеваний и неблагоприятных исходов [3].
Влияние анемии на сердечно-сосудистую систему
Для оценки патологического влияния снижения концентрации уровня гемоглобина в крови на кардиоваскулярные риски необходимо рассмотреть физиологическую реакцию организма на анемию. Основными факторами, ответственными за газообмен, выступают: интенсивность кровотока и его распределение, потребление кислорода клетками, оксигенация крови. Гипоксия при анемии компенсируется каскадом гемодинамических и гемодинамически не ассоциированных механизмов, таких как активация продукции эритропоэтина, повышение тканевой утилизации кислорода. Реализация основных гемодинамических факторов достигается путем повышения контрактильной способности миокарда, уменьшения постнагрузки, увеличения преднагрузки, реализацией положительного ино- и хронотропных эффектов. Повышение продукции оксида азота, индуцированная гипоксией вазодилатация и снижение вязкости крови являются причиной уменьшения сосудистого сопротивления и приводят к снижению постнагрузки. Хроническая анемия стимулирует ангиогенез и образование новых мелких сосудов. Развитие коллатералей и микроциркуляторного русла способствует снижению постнаргузки. Повышение венозного возврата (преднагрузки) и кровенаполнения левого желудочка способствуют увеличению конечного диастолического объема и фракции выброса левого желудочка. При кратковременной анемии эти изменения обратимы, при хронизации процесса — приводят к ремоделированию с формированием эссентрической гипертрофии миокарда левого желудочка, как и при других формах объёмных перегрузок.
Реализация основных гемодинамических факторов достигается путем повышения контрактильной способности миокарда, уменьшения постнагрузки, увеличения преднагрузки, реализацией положительного ино- и хронотропных эффектов. Повышение продукции оксида азота, индуцированная гипоксией вазодилатация и снижение вязкости крови являются причиной уменьшения сосудистого сопротивления и приводят к снижению постнагрузки. Хроническая анемия стимулирует ангиогенез и образование новых мелких сосудов. Развитие коллатералей и микроциркуляторного русла способствует снижению постнаргузки. Повышение венозного возврата (преднагрузки) и кровенаполнения левого желудочка способствуют увеличению конечного диастолического объема и фракции выброса левого желудочка. При кратковременной анемии эти изменения обратимы, при хронизации процесса — приводят к ремоделированию с формированием эссентрической гипертрофии миокарда левого желудочка, как и при других формах объёмных перегрузок.
Увеличение сердечного выброса в свою очередь способствует развитию артериального ремоделирования центральных сосудов эластического типа, таких как аорта и общие сонные артерии, за счёт увеличения просвета и компенсаторного утолщения комплекса интима-медии. Как следствие — повышение систолического давления и инерции, большая масса крови попадает в дилатированную артериальную систему. Активация симпатической нервной системы усиливает контрактильность левого желудочка и увеличивает частоту сердечных сокращений. В присутствии хронических заболеваний сердца эти дополнительные эффекты, опосредованные анемией, способствуют увеличению частоты сердечно-сосудистых осложнений [4].
Как следствие — повышение систолического давления и инерции, большая масса крови попадает в дилатированную артериальную систему. Активация симпатической нервной системы усиливает контрактильность левого желудочка и увеличивает частоту сердечных сокращений. В присутствии хронических заболеваний сердца эти дополнительные эффекты, опосредованные анемией, способствуют увеличению частоты сердечно-сосудистых осложнений [4].
Анемия при артериальной гипертензии
Нормохромная анемия – нередкая находка у пациентов, страдающих артериальной гипертензией (АГ), и чаще встречается при неконтролируемой гипертензии. Низкий уровень гемоглобина ассоциируется с плохим контролем артериального давления и является индикатором повышенного сердечно-сосудистого риска [5]. Согласно литературным данным, пациенты, страдающие АГ с сопутствующей анемией, имеют более высокие значения среднесуточного, ночного и недостаточное снижение ночного систолического артериального давления по сравнению с теми, у которых наблюдался нормальный уровень гемоглобина. У пациентов с анемией также прослеживается тенденция к увеличению среднесуточных значений диастолического артериального давления [6]. У пациентов с изолированной систолической гипертензией и гипертрофией левого желудочка с сопутствующим снижением уровня гемоглобина наблюдается увеличение сердечно-сосудистой смертности и частоты развитий острых нарушений мозгового кровообращения [7].
У пациентов с анемией также прослеживается тенденция к увеличению среднесуточных значений диастолического артериального давления [6]. У пациентов с изолированной систолической гипертензией и гипертрофией левого желудочка с сопутствующим снижением уровня гемоглобина наблюдается увеличение сердечно-сосудистой смертности и частоты развитий острых нарушений мозгового кровообращения [7].
Изменение электрокардиограммы при анемии
Электрокардиографические реполяризационные изменения (депрессия сегмента ST, инверсия зубца Т, удлинение интервала QT) часто встречаются у пациентов с анемией как в покое, так и при нагрузке [8]. Было обнаружено, что уровень гемоглобина сильно коррелирует с изменениями на электрокардиограмме [9].
Удлинение интервала QT является предиктором желудочковой аритмии и внезапной смерти. Гипоксия и нарушение доставки кислорода у пациентов с анемией может быть причиной нарушения реполяризации миокарда. Согласно проведенным исследованиям, анемия, макроцитоз и анизоцитоз коррелируют с удлинением интервала QT у пациентов с артериальной гипертензией и могут учитываться в оценке риска внезапной смерти [10]. Низкий уровень железа в остальном у практически здоровых детей отрицательно коррелирует с интервалами QT и QTс и может указывать на дополнительный риск развития аритмии [11].
Низкий уровень железа в остальном у практически здоровых детей отрицательно коррелирует с интервалами QT и QTс и может указывать на дополнительный риск развития аритмии [11].
Mehta и соавт. продемонстрировал значимую и воспроизводимую депрессию сегмента ST у пациентов с железно-дефицитной анемией во время нагрузочных тестов. Эти электрофизиологические изменения исчезали после лечения препаратами железа ещё до нормализации уровня гемоглобина, что может объясняться эффектом железа на тканевом уровне [12].
Анемия при ишемической болезни сердца
Ишемия миокарда определяется степенью выраженности несоответствия потребности кардиомиоцитов в кислороде и возможностями его доставки. Определяющими факторами, влияющими на заинтересованность миокарда в кислороде, являются: частота сердечных сокращений, контрактильность миокарда и напряжение стенки сердца. Факторами, определяющими доставку кислорода к сердцу, являются содержание кислорода в крови и интенсивность коронарного кровотока.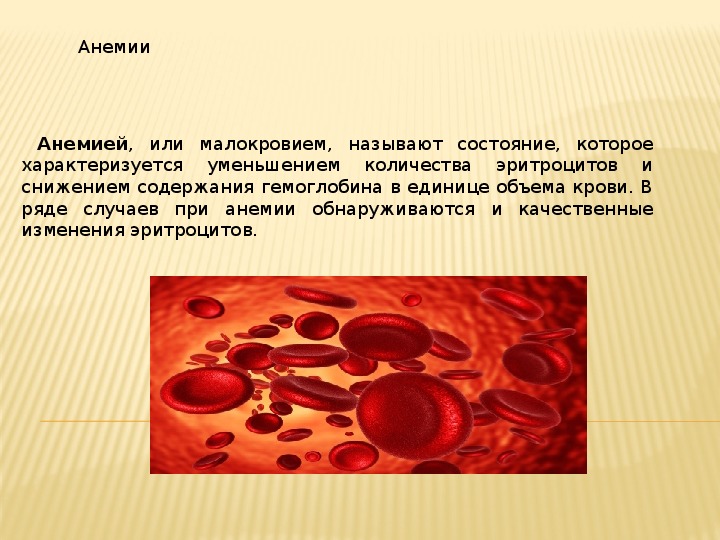 Увеличение доставки кислорода к миокарду в ответ на увеличение потребления происходит путем уменьшения сопротивления коронарного русла. Экстракция кислорода кардиомиоцитами даже в покое составляет около 90% [13]. У пациентов без коронарной патологии даже значительное снижение содержания кислорода в коронарном кровотоке может компенсироваться за счёт периферической вазодилатации. При коронарном стенозе этот механизм имеет ограниченные возможности. Согласно данным литературы, у животных с анемией при остром инфаркте миокарда увеличивалась зона инфарцирования, снижалась насосная функция сердца и выживаемость. Переливание крови животным с анемией до уровня гемоглобина 100 г/л уменьшало зону инфаркта и улучшало контрактильную возможность миокарда. Вместе с тем, переливание крови до уровня гемоглобина 120 г/л было связано с увеличением зоны инфаркта [14].
Увеличение доставки кислорода к миокарду в ответ на увеличение потребления происходит путем уменьшения сопротивления коронарного русла. Экстракция кислорода кардиомиоцитами даже в покое составляет около 90% [13]. У пациентов без коронарной патологии даже значительное снижение содержания кислорода в коронарном кровотоке может компенсироваться за счёт периферической вазодилатации. При коронарном стенозе этот механизм имеет ограниченные возможности. Согласно данным литературы, у животных с анемией при остром инфаркте миокарда увеличивалась зона инфарцирования, снижалась насосная функция сердца и выживаемость. Переливание крови животным с анемией до уровня гемоглобина 100 г/л уменьшало зону инфаркта и улучшало контрактильную возможность миокарда. Вместе с тем, переливание крови до уровня гемоглобина 120 г/л было связано с увеличением зоны инфаркта [14].
Sabatine et al. обнаружил U-образную зависимость клинических событий при остром коронарном синдроме к 30-му дню: у пациентов с инфарктом миокарда с подъемом сегмента ST наблюдалось увеличение смертности при уровне гемоглобина ниже 140 г/л и выше 170 г/л, в то время как у пациентов с инфарктом миокарда без подъема сегмента ST смертность, размер инфаркта и ишемии увеличивались при уровне гемоглобина менее 110 г/л и более 160 г/л [15].
Анемия является весомым фактором риска при ишемической болезни сердца (ИБС). Пациенты с ишемической болезнью сердца и сопутствующей анемией имеют более выраженную степень коронарной патологии. Согласно ряду публикаций, у пациентов с ИБС и анемией уровень гемоглобина, сывороточного железа и общая железосвязывающая способность крови отрицательно коррелируют с тяжестью коронарной патологии [16]. У пациентов с ишемической болезнью сердца и сопутствующей анемией наблюдается увеличение смертности по сравнению с категорией лиц с изолированной ИБС, а анемия выступает независимым предиктором возникновения острого ишемического повреждения миокарда [17].
Исследование Ferreira и соавт. выявило, что уровень гемоглобина менее 108 г/л являлся одним из наиболее сильных независимых предикторов смертности к концу первого года при остром коронарном синдроме. Он предложил включить уровень гемоглобина в оценку риска пациентов, госпитализированных с острым коронарным синдромом, так как это является доступным параметром и систематически оценивается при госпитализации [18].
В исследовании Cadilac анемия часто встречалась у пациентов, направленных на первичную ангиопластику по поводу острого инфаркта миокарда. Была продемонстрирована сильная корреляционная связь между снижением уровня гемоглобина и развитием неблагоприятных исходов, увеличением смертности. Сделан вывод, что анемия выступала независимым предиктором госпитальной и общей смертности к концу первого года постинфарктного периода [19]. Тяжелая анемия может приводить к дисбалансу между доставкой и потреблением кислорода в миокарде даже при отсутствии гемодинамически значимого коронарного стенозирования. Bailey с соавт. описал пример развития острого коронарного синдрома с подъемом сегмента ST у пациента с тяжелой анемией в отсутствии ангиографически значимого коронарного стеноза, тромбоза или спазма [20].
Таким образом, причины неблагоприятных исходов у пациентов с анемией и коронарной патологией многочисленны. Уменьшение кислородной емкости крови, а также активация симпатической нервной системы могут повышать потребность миокарда в кислороде и усугублять ишемию.
Анемия при сердечной недостаточности
Анемия – частое сопутствующее патологическое состояние при сердечной недостаточности (СН). У пациентов с сердечной недостаточностью и сопутствующей анемией прослеживается следующая тенденция: у них более выражены симптомы левожелудочковой недостаточности, выше частота госпитализаций по поводу декомпенсации хронической сердечной недостаточности (ХСН), среди них чаще встречаются женщины, пациенты представлены старшей возрастной группой, у них чаще диагностируется сахарный диабет, сопутствующая почечная недостаточность и артериальная гипертензия [21]. Анемия – мощный предиктор повторных госпитализаций и низкой выживаемости при хронической сердечной недостаточности [22]. Частота встречаемости анемии возрастает при увеличении степени тяжести сердечной недостаточности и может достигать 79.1% у пациентов с IV функциональным классом СН по классификации Нью-Йоркской Ассоциации Сердца [23].
Этиология анемии при сердечной недостаточности является многофакторной, и множество механизмов ответственно за это состояние. Увеличение системного воспаления, нейрогуморальная активация, нарушение питания, дисфункция почек, снижение ответа костного мозга на запрос и эффект приема ряда лекарственных средств вносят вклад в ее развитие. Увеличение циркулирующих провоспалительных цитокинов при СН вызывает нарушение мобилизации железа, недостаточную продукцию эритропоэтина в ответ на активацию ренин-ангиотензин-альдостероновой системы и снижение почечного кровотока, снижение функции костного мозга. Использование ингибиторов ангиотензин-превращающего фермента может дополнительно уменьшать секрецию эритропоэтина. Нарушение питания вследствие отсутствия аппетита, желудочно-кишечная мальабсорбция, прием аспирина могут усугублять железодефицитную анемию. Гемоделюция также вносит дополнительный вклад в становление анемии [24].
Увеличение системного воспаления, нейрогуморальная активация, нарушение питания, дисфункция почек, снижение ответа костного мозга на запрос и эффект приема ряда лекарственных средств вносят вклад в ее развитие. Увеличение циркулирующих провоспалительных цитокинов при СН вызывает нарушение мобилизации железа, недостаточную продукцию эритропоэтина в ответ на активацию ренин-ангиотензин-альдостероновой системы и снижение почечного кровотока, снижение функции костного мозга. Использование ингибиторов ангиотензин-превращающего фермента может дополнительно уменьшать секрецию эритропоэтина. Нарушение питания вследствие отсутствия аппетита, желудочно-кишечная мальабсорбция, прием аспирина могут усугублять железодефицитную анемию. Гемоделюция также вносит дополнительный вклад в становление анемии [24].
Дефицит железа
Дефицит железа (ДЖ) – наиболее частая причина анемии у пациентов с сердечной недостаточностью [25,26]. Дефицит железа может наблюдаться и при нормальном уровне гемоглобина, а железодефицитное состояние без анемии выявляется у 46% пациентов со стабильной сердечной недостаточностью [27].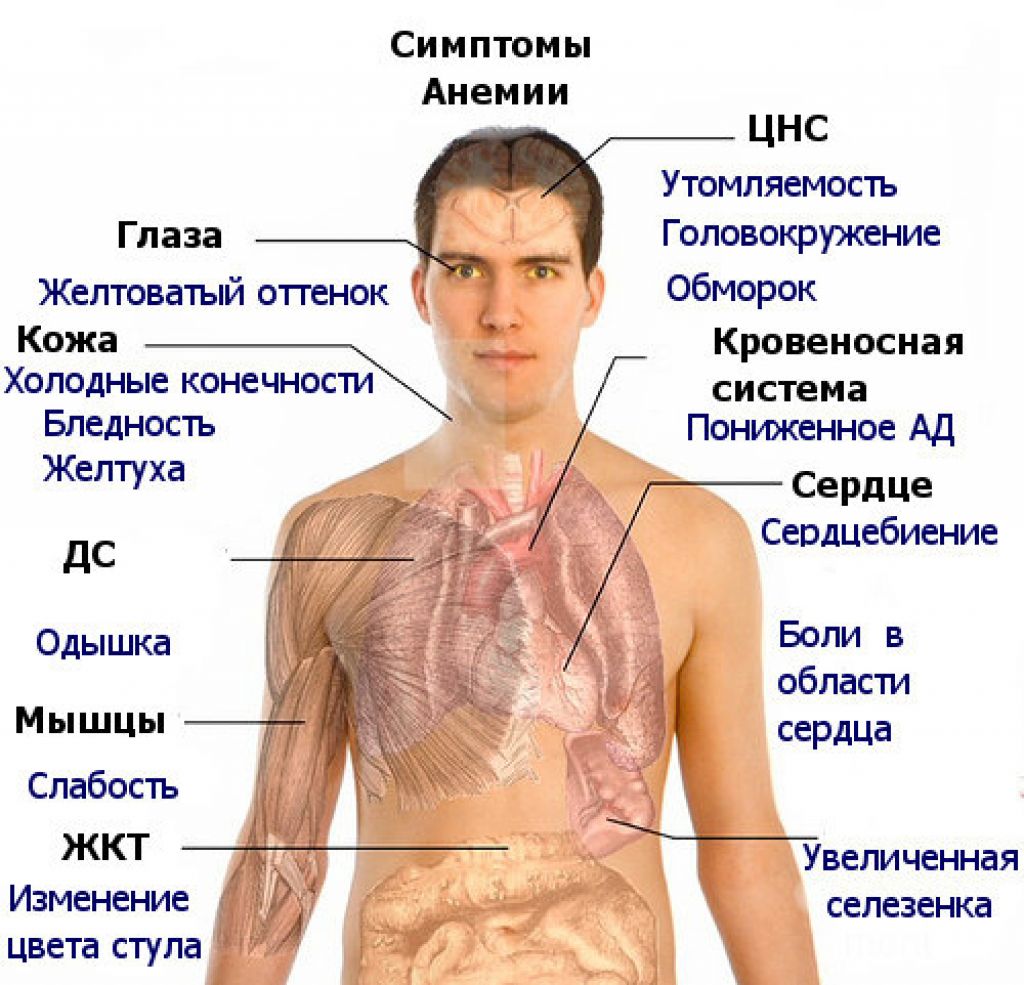 ДЖ может быть представлен в абсолютной и функциональной формах. При абсолютном дефиците железа наступает истощение его запасов в организме, а железодефицитная анемия может рассматриваться как конечная стадия этого истощения. Функциональный дефицит железа связан с неадекватным его высвобождением из депо в ответ на потребности костного мозга и встречается при многих острых и хронических воспалительных состояниях. Дефицит железа ассоциируется с прогрессированием симптомов сердечной недостаточности, снижением качества жизни, увеличением смертности и госпитализаций [28-30].
ДЖ может быть представлен в абсолютной и функциональной формах. При абсолютном дефиците железа наступает истощение его запасов в организме, а железодефицитная анемия может рассматриваться как конечная стадия этого истощения. Функциональный дефицит железа связан с неадекватным его высвобождением из депо в ответ на потребности костного мозга и встречается при многих острых и хронических воспалительных состояниях. Дефицит железа ассоциируется с прогрессированием симптомов сердечной недостаточности, снижением качества жизни, увеличением смертности и госпитализаций [28-30].
Активация симпатической и ренин-ангиотензин-альдостероновой систем, хроническое воспаление, абсолютный и функциональный дефицит железа, нарушение образования и активности эритропоэтина, гемоделюция, почечная дисфункция ухудшают прогноз у пациентов с сердечной недостаточностью. Вероятно, анемия является как медиатором, так и маркером неблагоприятного прогноза у пациентов с сердечной недостаточностью.
Лечение анемии у пациентов с заболеваниями сердца
Лечение анемии при сердечной недостаточности и ишемической болезни сердца может включать прием эритропоэтинов, при наличии железодефицитных состояний с анемией или без нее — терапию препаратами железа, при тяжелом течении — переливание эритроцитарной массы.
Шестнадцать рандомизированных контролируемых исследований оценивало эффект эритропоэтинов у пациентов с сердечной недостаточностью. Большинство этих исследований включало пациентов с систолической сердечной недостаточностью. Полученные данные с умеренной степенью доказательности продемонстрировали отсутствие улучшения качества жизни и переносимости физических нагрузок при лечении эритропоэтинами. В то же время данные с высокой степенью доказательности продемонстрировали отсутствие снижения смертности при лечении эритропоэтинами. Среди серьезных побочных эффектов, связанных с их применением, выделили развитие сосудистых тромбозов [31].
Несмотря на то, что анемия часто встречается у пациентов с хронической сердечной недостаточностью и ишемической болезнью сердца, лечение эритропоэтинами не уменьшало смертность, риск кардиоваскулярных событий или частоту госпитализаций [31]. Американский Колледж Врачей не рекомендует использование эритропоэтинов у пациентов с сердечной недостаточностью или коронарной болезнью сердца при незначительной или умеренной степени тяжести анемии [31].
Переливание крови было предложено для коррекции тяжелой анемии у пациентов с коронарной болезнью сердца, но результаты ее эффективности противоречивы. Большинство данных получено при использовании либеральных или рестриктивных протоколов гемотрансфузий. Либеральный подход к переливанию крови был определен как гемотрансфузия при уровне гемоглобина менее 90 г/л. Рестриктивная трансфунзионная стратегия — трансфузия с уровнем гемоглобина менее 70 г/л. Метаанализ 10 исследований, включавший 203,665 пациентов с острым коронарным синдромом выявил, что либеральная гемотрансфузия ассоциировалась с увеличением общей смертности по сравнению с рестриктивной гемотрансфузией или ведением пациентов без нее [32]. Но стоит отметить, что гемотрансфузия ассоциировалась со значимым увеличением риска смерти к 30-му дню только при показателе гематокрита более 25% [32].
На сегодняшний день нет единого мнения в отношении либеральной и рестриктивной гемотрансфузионной тактики у пациентов с ИБС. Ряд исследований с низкой степенью доказательности показывают, что ограничительная трансфузия не оказывает эффект на смертность у пациентов с коронарной патологией сердца по сравнению с либеральной трансфузией.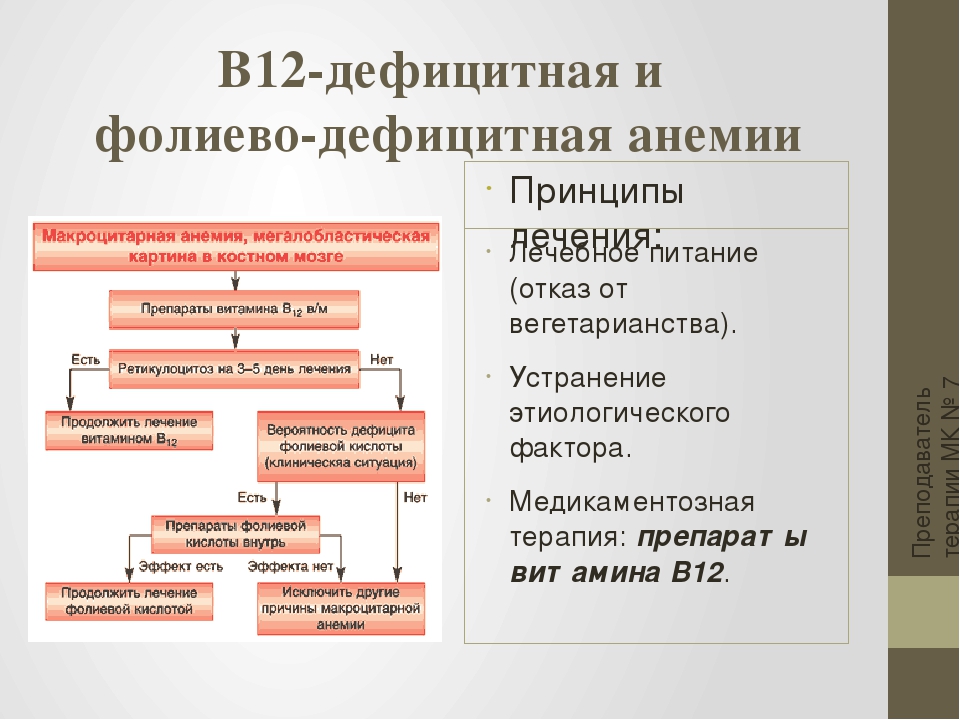 Ряд исследований, основанных на клиническом наблюдении пациентов, выдвинули утверждение: гемотрансфузия не имеет практической пользы и может нанести вред пациентам с сердечно-сосудистой патологией при уровне гемоглобина более 100г/л [31]. Пилотное исследование, включавшее 110 пациентов с острым коронарным синдромом или стабильной стенокардией, которые подвергались коронарным вмешательствам, продемонстрировало, что гемоглобин менее 100г/л коррелировал с тенденцией к увеличению больших коронарных событий, включая смерть от сердечно-сосудистых причин у пациентов с либеральной по сравнению с рестриктивной стратегией гемотрансфузий [33].
Ряд исследований, основанных на клиническом наблюдении пациентов, выдвинули утверждение: гемотрансфузия не имеет практической пользы и может нанести вред пациентам с сердечно-сосудистой патологией при уровне гемоглобина более 100г/л [31]. Пилотное исследование, включавшее 110 пациентов с острым коронарным синдромом или стабильной стенокардией, которые подвергались коронарным вмешательствам, продемонстрировало, что гемоглобин менее 100г/л коррелировал с тенденцией к увеличению больших коронарных событий, включая смерть от сердечно-сосудистых причин у пациентов с либеральной по сравнению с рестриктивной стратегией гемотрансфузий [33].
Из-за противоречивых результатов исследований и недостатка полноценных рандомизированных контролируемых исследований рестриктивная гемотрансфузия может иметь место в условиях острого коронарного синдрома и у госпитализированных пациентов с коронарной болезнью сердца [31, 34].
Положительные эффекты лечения внутривенными препаратами железа при дефиците железа с анемией или без у пациентов с сердечной недостаточностью
Железо является жизненно необходимым элементом для организации целого ряда жизненно важных функций в организме. Оно служит переносчиком кислорода к клеткам, является частью важных ферментных систем в различных тканях. Железосодержащие ферменты выполняют функцию по переносу электронов внутри клетки, а их функция в окислительном метаболизме – перенос энергии внутри митохондрии. Другой ключевой функцией железосодержащих ферментов (например, цитохром Р450) является синтез стероидных гормонов и желчных кислот; обезвреживание токсинов в печени; контроль эффекта нейротрансмиттеров, таких как допамин, и серотониновых систем головного мозга [35].
Оно служит переносчиком кислорода к клеткам, является частью важных ферментных систем в различных тканях. Железосодержащие ферменты выполняют функцию по переносу электронов внутри клетки, а их функция в окислительном метаболизме – перенос энергии внутри митохондрии. Другой ключевой функцией железосодержащих ферментов (например, цитохром Р450) является синтез стероидных гормонов и желчных кислот; обезвреживание токсинов в печени; контроль эффекта нейротрансмиттеров, таких как допамин, и серотониновых систем головного мозга [35].
Несколько исследований были адресованы лечению пациентов с заболеваниями сердца внутривенными препаратами железа. Данные Fair-HF исследования, которое включало пациентов с анемией и без продемонстрировали: только 27,6% пациентов, получавших препарат карбоксимальтозы железа внутривенно, имели кардиоваскулярные события по сравнению с 50,2% пациентов, получавших плацебо (р=0.01). Внутривенное назначение карбоксимальтозы железа увеличивало переносимость и продолжительность физических нагрузок у пациентов со стабильной сердечной недостаточностью и хроническим заболеванием почек (ХБП), не выше 3 стадии ХБП.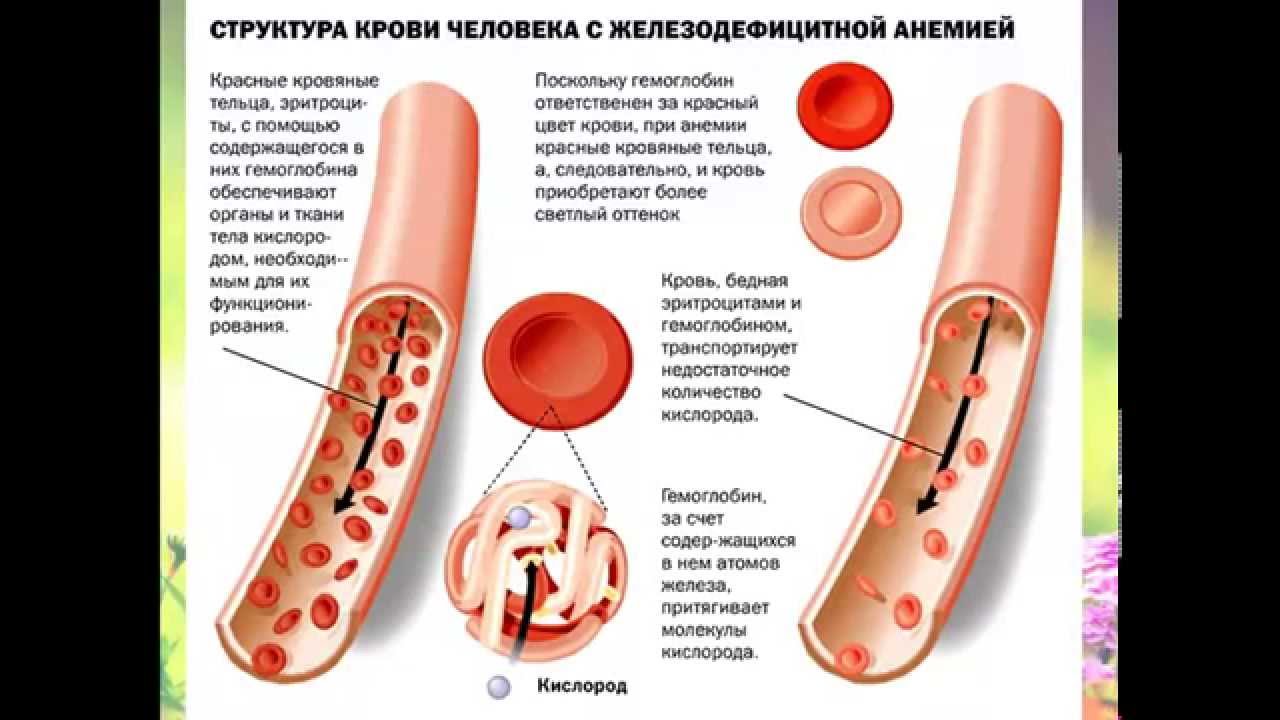 У большинства пациентов, включенных в исследование, уровень ферритина был менее 100 мг/л [36]. Это исследование показало, что назначение 200 мг препарата карбоксимальтозы железа внутривенно увеличивало дистанцию теста 6-минутной ходьбы (317 м против 277 м) по сравнению с внутривенным назначением физиологического раствора [36]. Данное исследование с умеренной степенью доказанности продемонстрировало, что внутривенный препарат железа улучшал качество жизни у пациентов с анемией или дефицитом железа со стабильным течением ХСН и хроническим заболеванием почек не выше 3 стадии. Fair-HF исследование показало, что лечение внутривенным препаратом железа улучшало функциональный класс сердечной недостаточности и показатели качества жизни независимо от того, присутствовали в пациента лабораторные признаки анемии или нет [36]. Это исследование также продемонстрировало отсутствие статистически значимой разницы в частоте существенных побочных эффектов между пациентами, принимавшими внутривенно карбосимальтозу железа, и контрольной группой [36].
У большинства пациентов, включенных в исследование, уровень ферритина был менее 100 мг/л [36]. Это исследование показало, что назначение 200 мг препарата карбоксимальтозы железа внутривенно увеличивало дистанцию теста 6-минутной ходьбы (317 м против 277 м) по сравнению с внутривенным назначением физиологического раствора [36]. Данное исследование с умеренной степенью доказанности продемонстрировало, что внутривенный препарат железа улучшал качество жизни у пациентов с анемией или дефицитом железа со стабильным течением ХСН и хроническим заболеванием почек не выше 3 стадии. Fair-HF исследование показало, что лечение внутривенным препаратом железа улучшало функциональный класс сердечной недостаточности и показатели качества жизни независимо от того, присутствовали в пациента лабораторные признаки анемии или нет [36]. Это исследование также продемонстрировало отсутствие статистически значимой разницы в частоте существенных побочных эффектов между пациентами, принимавшими внутривенно карбосимальтозу железа, и контрольной группой [36].
Целью CONFIRM-HF исследования было изучение долгосрочного эффекта от лечения препаратом карбоксимальтозой железа у пациентов с симптоматической сердечной недостаточностью и дефицитом железа. В исследование было включено 304 пациента со стабильной сердечной недостаточностью класса II или III согласно Нью-Йоркской Ассоциации Сердца (NYHA), с фракцией выброса левого желудочка ≤45%, повышенным уровнем натрийуритических пептидов (мозговой натрийуретический пептид >100 пг/мл и/или N-терминальный фрагмент натрийуритического пептида > 400 пг/мл), наличием дефицита железа (уровень сыворочного феритина < 100нг/мл, или от 100 до 300 нг/мл, если сатурация трансферрина < 20%) и гемоглобином до 15 г/дл.
В результате исследования было выявлено, что лечение стабильных симптоматических пациентов с сердечной недостаточностью и дефицитом железа внутривенным препаратом карбоксимальтозой железа приводит к устойчивому улучшению их функционального состояния согласно тесту 6-минутной ходьбы; улучшению качества жизни; значительному уменьшению риска госпитализаций вследствие прогрессирования сердечной недостаточности. Наблюдения за пациентами осуществлялось в течение одного года. Вышеперечисленные положительные эффекты были отмечены во всех подгруппах, включая пациентов с анемией или без нее [37].
Наблюдения за пациентами осуществлялось в течение одного года. Вышеперечисленные положительные эффекты были отмечены во всех подгруппах, включая пациентов с анемией или без нее [37].
Результаты CONFIRM-HF исследования по сравнению с Fair-HF имели более объективные первичную и конечную точки, показали более продолжительный положительный эффект от лечения карбоксимальтозой железа с хорошим профилем безопасности и продемонстрировали значительное снижение риска госпитализации вследствие ухудшения сердечной недостаточности [37].
Метаанализ всех рандомезированных контролируемых исследований, изучавших эффект лечения внутривенными препаратами железа у пациентов с систолической сердечной недостаточностью и дефицитом железа, показал, что ее применение у данной категории пациентов уменьшает риск комбинированных конечных точек: общей смертности и сердечно-сосудистых госпитализаций, сердечно-сосудистой смертности и госпитализации по поводу ухудшения сердечной недостаточности, и риск госпитализаций по причине декомпенсации ХСН. Не было выявлено значимого эффекта на общую и на смертность от сердечно-сосудистых причин. Вместе с тем, внутривенная терапия препаратами железа приводила к улучшению переносимости физических нагрузок, уменьшению симптомов сердечной недостаточности и улучшению качества жизни пациентов [38].
Не было выявлено значимого эффекта на общую и на смертность от сердечно-сосудистых причин. Вместе с тем, внутривенная терапия препаратами железа приводила к улучшению переносимости физических нагрузок, уменьшению симптомов сердечной недостаточности и улучшению качества жизни пациентов [38].
Внутривенное назначение препарата карбоксимальтозы железа должно рассматриваться в качестве лечения у симптомных пациентов с систолической сердечной недостаточностью и дефицитом железа для уменьшения клинических проявлений, повышения толерантности к физическим нагрузкам и улучшения качества жизни [39].
Заключение
Лечение анемии у пациентов с заболеваниями сердца может существенно отличаться от лечения анемии в общей популяции. Однако понимание доказательной базы и использование клинического суждения крайне необходимы для лечения данной категории лиц. Анемия коррелирует с ухудшением прогнозов у пациентов с кардиоваскулярной патологией и становится новой терапевтической мишенью для данной категории пациентов. Вопрос, является ли анемия причиной или маркером неблагоприятных исходов и отражает лишь тяжесть сердечно — сосудистого заболевания, остается актуальным по сей день.
Вопрос, является ли анемия причиной или маркером неблагоприятных исходов и отражает лишь тяжесть сердечно — сосудистого заболевания, остается актуальным по сей день.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, способного повлиять на результаты исследования или их трактовку.
Introduction. Cardiovascular disease is a significant health problem around the world and accounts for the majority of deaths annually. Many of such patients have anemia due to acute blood loss (surgery or trauma) or chronic conditions such as renal failure or cancer.
According to the World Health Organization criteria anemia is defined in cases when hemoglobin is less than 120 g/l in females and less than 30 g/l in males. It is a major health problem that increases the mortality rate, affects physical status, and demands referral to health-care professionals. Globally, anemia affects 1.62 billion people, which corresponds to 24..gif) 8% of the total population. The highest prevalence is in preschool-age children (47.4%), and the lowest prevalence is in men (12.7%). Half of the cases are due to iron deficiency [1] which affects not only red blood cell production but also cellular functions related to muscle metabolism, mitochondrial function, neurotransmitters, DNA synthesis, and the immune system [2].
8% of the total population. The highest prevalence is in preschool-age children (47.4%), and the lowest prevalence is in men (12.7%). Half of the cases are due to iron deficiency [1] which affects not only red blood cell production but also cellular functions related to muscle metabolism, mitochondrial function, neurotransmitters, DNA synthesis, and the immune system [2].
Prevalence of anemia increases with the advanced age making it a common associated comorbidity in patients with cardiovascular diseases. It has been established that anemia is an independent risk factor for cardiovascular diseases (CVD) outcomes [3].
Effects of anemia on the cardiovascular system. Understanding the physiologic response to anemia is important in order to take into account the implications of this state in regards to cardiac diseases. Three main factors are responsible for oxygen delivery to organs: blood flow and its distribution; the oxygen-carrying capacity of the blood, i. e. hemoglobin concentration; and oxygen extraction. Hypoxia in anemia is compensated through several non-hemodynamic (increased erythropoietin production to stimulate erythropoiesis, increased oxygen extraction) and hemodynamic mechanisms. The main hemodynamic factors are decreased afterload, increased preload, and positive inotropic and chronotropic effects. Enhanced nitric oxide activity, hypoxia-induced vasodilatation and lower blood viscosity are responsible for reduced vascular resistance and lead to the decreased afterload. Chronic anemia stimulates angiogenesis and recruitment of new microvessels. Enhanced venous return (preload) and left ventricular (LV) filling lead to the increased LV end-diastolic volume and cardiac output. Increased cardiac output is responsible for arterial remodeling of the central elastic arteries such as the aorta and common carotid artery through arterial enlargement and compensatory arterial intima-media thickening, leading to the elevated systolic pressure and high inertia due to higher blood mass in the dilated arterial system.
e. hemoglobin concentration; and oxygen extraction. Hypoxia in anemia is compensated through several non-hemodynamic (increased erythropoietin production to stimulate erythropoiesis, increased oxygen extraction) and hemodynamic mechanisms. The main hemodynamic factors are decreased afterload, increased preload, and positive inotropic and chronotropic effects. Enhanced nitric oxide activity, hypoxia-induced vasodilatation and lower blood viscosity are responsible for reduced vascular resistance and lead to the decreased afterload. Chronic anemia stimulates angiogenesis and recruitment of new microvessels. Enhanced venous return (preload) and left ventricular (LV) filling lead to the increased LV end-diastolic volume and cardiac output. Increased cardiac output is responsible for arterial remodeling of the central elastic arteries such as the aorta and common carotid artery through arterial enlargement and compensatory arterial intima-media thickening, leading to the elevated systolic pressure and high inertia due to higher blood mass in the dilated arterial system. Activation of sympathetic activity enhances LV contractility, and the heart rate. Short-lasting anemia is reversible but in chronic anemia hemodynamic changes lead to cardiac enlargement and development of eccentric LV hypertrophy (LVH). It also occurs in other forms of the volume overload. In case of heart diseases chronic anemia contributes to a high incidence of cardiovascular complications [4].
Activation of sympathetic activity enhances LV contractility, and the heart rate. Short-lasting anemia is reversible but in chronic anemia hemodynamic changes lead to cardiac enlargement and development of eccentric LV hypertrophy (LVH). It also occurs in other forms of the volume overload. In case of heart diseases chronic anemia contributes to a high incidence of cardiovascular complications [4].
Anemia in arterial hypertension
Normocytic anemia is common in hypertensive patients but more prevalent in uncontrolled hypertension. Lower hemoglobin is associated with poor blood pressure control, indicating a higher cardiovascular risk in uncontrolled hypertension [5]. It was noted that hypertensive patients with anemia had higher nocturnal systolic and mean blood pressure and a lower dipping status compared to the patients with normal hemoglobin levels. There was a trend for increased diastolic blood pressure [6].
In patients with isolated systolic hypertension and left ventricular hypertrophy lower hemoglobin was associated with the increased cardiovascular death or stroke [7].
Electrocardiographic changes in anemia.
Electrocardiographic (ECG) repolarization abnormalities (ST segment depression, T wave inversion, prolonged QT) are highly prevalent in anemic patients at rest and during the tests with physical loading [8]. It has been shown that the hemoglobin level is strongly correlated with ECG changes [9].
A long ECG QT interval duration is a predictor of ventricular arrhythmia and sudden cardiac death. Hypoxia and impaired oxygen supply in anemic patients may affect repolarization of the myocardium. It has been found that anemia, macrocytosis and anisocytosis are associated with prolonged QT intervals in hypertensive patients and may contribute to the risk of sudden cardiac death [10]. Low iron stores in otherwise healthy children negatively correlated with QT and QTc intervals and may indicate some risk in developing arrhythmias [11].
Mehta et al. showed significant reproducible ST depression in anemic patients with iron deficiency during the tests with physical loading.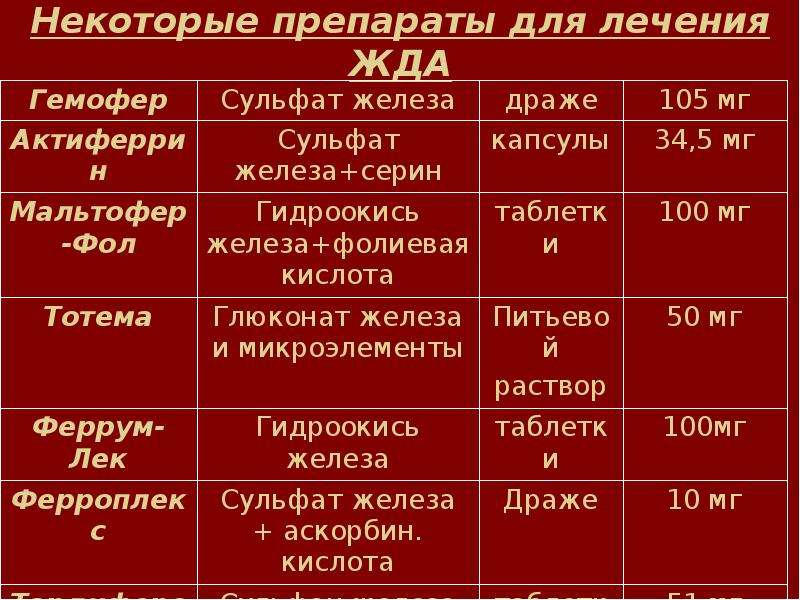 These electrophysiological changes were corrected after iron therapy, even before the rise of hemoglobin occurred, which may be explained by the effect of iron on the tissue level [12].
These electrophysiological changes were corrected after iron therapy, even before the rise of hemoglobin occurred, which may be explained by the effect of iron on the tissue level [12].
Anemia in Ischemic Heard Disease
Myocardial ischemia is defined as oxygen delivery that is insufficient to meet oxygen requirements. The determinants of myocardial oxygen demand are wall tension, heart rate and contractility. The determinants of myocardial oxygen delivery are arterial oxygen content and coronary arterial blood flow. The increase of oxygen delivery in response to the enhancement of oxygen demand occurs through the changes in coronary vascular resistance, as the extraction ratio of myocardium at rest is nearly 90% [13]. Patients without coronary artery disease, therefore, have a tremendous ability to compensate the decrease in coronary arterial oxygen content through distal vasodilatation but in the presence of coronary stenosis this compensatory mechanism has a limited ability.
It was proved that anemic animals have the increased infarct size, decreased cardiac function and the survival rate in case of acute myocardial infarction (MI). Transfusion of fresh blood to anemic animals up to 100 g/L Hb reduced the infarct size and improved the cardiac function. However, blood transfusion up to 120 g/L Hb was associated with larger infarcts [14].
Sabatine et al. found out a U-shaped relationship with clinical events by the 30th day: in patients with ST-elevation MI; the mortality rate was higher in those with the hemoglobin levels below 140g/L or above 170g/L, while in patients with non-ST elevation acute coronary syndrome (ACS), death, infarction and ischemia increased in case when hemoglobin levels were below 110g/L or above 160/L [15].
Anemia is a risk factor for ischemic heart disease. Patients with ischemic heard disease (IHD) and anemia have a more advanced degree of ischemic heart disease compared to patients with isolated IHD. In anemic patients with IHD the level of hemoglobin, serum iron and total iron-binding capacity negatively correlated with the severity of IHD [16]. The mortality rate in anemic patients with IHD was higher than in patients with isolated IHD [16]. Anemia was an independent predictor of acute coronary syndrome based on the hemoglobin level, while both anemia and a high hematocrit level were predictors of myocardial infarction based on hematocrit [17].
The mortality rate in anemic patients with IHD was higher than in patients with isolated IHD [16]. Anemia was an independent predictor of acute coronary syndrome based on the hemoglobin level, while both anemia and a high hematocrit level were predictors of myocardial infarction based on hematocrit [17].
The investigations made by Ferreira et al. revealed that hemoglobin<108g/L was one of the strongest independent predictors of one-year mortality in population with acute coronary syndrome (ACS). He suggested including the hemoglobin level in risk stratification scores of patients admitted for ACS, given that it is an easy parameter to measure and is systematically assessed at admission [18].
In the Cadilac trial anemia was common in patients with AMI who underwent primary PCI and was strongly associated with the adverse outcomes and increased mortality [19]. Anemia was an independent predictor of in-hospital mortality by the end of the first year [19].
Severe anemia can lead to disbalance between oxygen delivery and demand in the myocardium even in patients without coronary stenosis. Bailey D et al. reported a case of the ST segment elevation myocardial infarction (STEMI) secondary to severe anemia which occurred in the absence of angiographically significant coronary artery stenosis, thrombosis or coronary artery spasm [20].
Bailey D et al. reported a case of the ST segment elevation myocardial infarction (STEMI) secondary to severe anemia which occurred in the absence of angiographically significant coronary artery stenosis, thrombosis or coronary artery spasm [20].
Thus, there are a number of reasons for the worse outcomes in anemic patients with the obstructive coronary artery disease. Diminished oxygen-carrying capacity, activation of the sympathetic nervous system can increase myocardial oxygen demand and worsen ischemia.
Anemia in Heart Failure
Anemia is a very common comorbidity in chronic heart failure. Anemic patients are elderly women with more advanced symptoms and signs of heart failure, greater functional impairment and a higher hospitalization rate; they have a history of diabetes mellitus, renal insufficiency, and hypertension [21]. Anemia is a powerful predictor of rehospitalization rates and survival in case of chronic heart failure [22]. The prevalence of anemia increases with the severity of heart failure (HF) and can reach 79. 1% in those with Class IV according to the classification of the New York Heart Association [23].
1% in those with Class IV according to the classification of the New York Heart Association [23].
Etiology of anemia in HF may be multifactorial and a number of potential mechanisms may be responsible for such a condition in heart failure. Neurohormonal and inflammatory activation, renal dysfunction, bone marrow hyporesponsiveness, malnutrition, drug effects contribute to its development. Increased circulating proinflammatory cytokines enable defective iron mobilization, inappropriate erythropoietin production, depressed bone marrow function. Activation of the renin-angiotensin-aldosteron system, decreased renal perfusion caused by the low blood pressure and stroke volume stimulate the release of erythropoietin but the response is blunted due to effect of the circulatory cytokines. Poor nutrition due to anorexia, gastrointestinal malabsorbtion and aspirin use may precipitate iron deficiency anemia. Hemodilution can contribute to anemia. The use of the angiotensin-converting enzyme (ACE) inhibitor therapy may reduce secretion of erythropoietin [24].
Iron deficiency (ID) is the most frequent cause of anemia in patients with HF [25, 26] and can be revealed in ∼46% of non-anemic patients with stable systolic HF [27].
Iron deficiency may exist in absolute or functional forms. Absolute iron deficiency occurs when total body iron stores become exhausted and ID anemia can be considered as the final phase of iron stores depletion; functional iron deficiency refers to inadequate iron release in response to the demands of the bone marrow. Functional iron deficiency can be seen in many acute and chronic inflammatory states. ID is associated with the worsening of symptoms in patients with heart failure, impaired life quality, the increased mortality and hospitalization level [28, 29, 30].
Activation of sympathetic and renin-angiotensin-aldosteron systems, chronic inflammation, absolute and functional iron deficiency, impaired production and activity of erythropoietin, hemodilution, renal dysfunction impair prognosis in heart failure patients. Probably, anemia acts as a mediator and a marker of a poor prognosis in HF patients.
Probably, anemia acts as a mediator and a marker of a poor prognosis in HF patients.
Treatment of anemia in patients with heart diseases. Anemia treatment strategies in heart failure and CHD patients include erythropoiesis-stimulating agents (ESAs), red blood cell transfusions and iron replacement in iron deficient patients with or without anemia.
Sixteen randomized, controlled trials assessed the impact of ESAs in patients with heart disease. Most of these studies included patients with CHF and the reduced systolic function. Overall, moderate-quality evidence showed no benefit from ESAs in regard to improving exercise tolerance and duration or quality of life, and high-quality evidence showed no mortality benefit [31]. Serious harmful effects associated with the treatment include mortality and vascular thrombosis [31]. So, the damage outweighs the benefits in treatment of patients with mild to moderate anemia using ESAs. Although anemia is common in patients with CHF and CHD, treatment with ESAs did not decrease mortality, cardiovascular events or hospitalization rates [31]. The American College of Physicians does not recommend using erythropoiesis-stimulating agents to patients with mild to moderate anemia and congestive heart failure or coronary heart disease [31].
Blood transfusion has been suggested to correct severe anemia in patients with coronary artery disease, but data in regard to its effectiveness are contradictory. In the majority of studies investigating different transfusion protocols, a liberal blood transfusion strategy was defined as any red blood cell transfusion at a hemoglobin level up to 90 g/L, while a restrictive blood transfusion strategy was defined as any transfusion at a hemoglobin level up to 70 g/L. A meta-analysis of 10 studies totaling 203 665 patients with acute coronary syndrome (both STEMI and NSTEMI-ACS) reported that blood transfusion or a liberal transfusion strategy was associated with the increased all-cause mortality, compared with no blood transfusion or a restrictive transfusion strategy [32]. However, a transfusion or liberal transfusion strategy was associated with a significantly higher mortality risk by the 30th day only in case when a nadir hematocrit is more than 25% [32].
However, low-quality evidence data demonstrate that blood transfusion using restrictive compared with liberal transfusion protocols had no effect on mortality in patients with CHD. Observational studies suggested that transfusion is not beneficial and may be harmful for patients with heart disease and hemoglobin levels of more than 100 g/L (31). A pilot trial of 110 patients with acute coronary syndrome or stable angina undergoing cardiac catheterization and hemoglobin <100 g/L revealed a trend of fewer major cardiac events and deaths in patients with the liberal transfusion strategy as compared with a more restrictive strategy [33].
Due to inconsistent results of the studies and the lack of adequately powered RCTs restrictive red blood cell transfusion strategy may be considered in the settings of ACS and for hospitalized patients with coronary heart disease [31, 34]
Benefits of using intravenous iron injections in treatment of iron deficiency with or without anemia in HF patients.
Iron has several vital functions in the body. It serves as a carrier of oxygen to the tissues, a transport medium for electrons within cells, and an integrated part of important enzyme systems in various tissues. Several iron-containing enzymes act as electron carriers within the cell and their role in the oxidative metabolism is to transfer energy within the cell and mitochondria. Other key functions for the iron-containing enzymes (e.g. cytochrome P450) include synthesis of steroid hormones and bile acids; detoxification of foreign substances in the liver; and signal controlling in some neurotransmitters, such as the dopamine and serotonin systems in the brain [5].
Few studies addressed to intravenous iron therapy for patients with heart disease. Data from Fair-HF study, which included patients with and without anemia demonstrated, that 27.6% of patients treated with intravenous iron carboxymaltose had cardiovascular events compared with 50.2% of patients receiving placebo (p=0.01). Moderate-quality evidence showed that intravenous iron administration increased exercise tolerance and duration in patients with stable CHF including patients with Stage 3 chronic kidney disease. FAIR-HF trial (Ferinject Assessment in Patients with Iron Deficiency and Chronic Heart Failure) included anemic and nonanemic patients, with the majority of them having ferritin levels less than 100 µg/L [36]. This trial showed that 200 mg of intravenous ferric carboxymaltose (FCM) increased a 6-minute walk distance (313 m vs. 277 m) compared with intravenous saline [36]. Moderate-quality evidence showed that intravenous iron improved quality of life in patients with anemia or iron deficiency, stable CHF, and chronic kidney disease excluding the patients with the 4th and 5th stages. The FAIR-HF study showed that intravenous iron treatment improved Patient Global Assessment scores compared with control patients and the improved NYHA functional class, regardless of the anemia status (hemoglobin level ≤120 g/L) [36]. This trial also showed improved life quality. [36]. There was no statistically significant difference in serious harmful effects between the intravenous iron treatment and the control groups [36].
The CONFIRM-HF trial was aimed at studying effects of long-term intravenous iron therapy in ferric carboxymaltose inpatients with symptomatic heart failure and iron deficiency. Totally 304 patients with stable ambulatory HF (class II or III according to New York Heart Association (NYHA) classification) and left ventricular ejection fraction (LVEF) ≤45%, elevated natriuretic peptides (brain natriuretic peptide >100 pg/mL and/or N-terminal-pro-brain natriuretic peptide>400 pg/mL), presence of ID (defined as serum ferritin level <100 ng/mL, or between 100 and 300 ng/mL if transferrin saturation was <20%) and hemoglobin (Hb) up to15 g/L were enrolled in the study. This study showed that treatment of stable, symptomatic, ‘iron-deficient HF patients with intravenous iron (FCM) results in sustainable improvement of functional capacity as measured over a 1-year period using the 6-MWT walking test, improvement in quality of life, significantly reduced risk of hospital admission due to worsening of HF during a1-year follow-up period. These favorable results were consistent across all pre-specified subgroups including patients with and without anemia [37].
The results of CONFIRM-HF compared with FAIR-HF had a more objective primary end-point, documented longer-term sustainability of beneficial effects of treatment with FCM and the acceptable safety profile (i.e. 12 months compared with 6 months or less in previous studies) and provided data on significant risk reduction of the hospitalization due to HF worsening [37].
A meta-analysis of all randomized controlled trials that investigated the effects of intravenous iron therapy in iron-deficient patients with systolic HF (also analyzed separately in anemic and non-anemic subjects) showed that intravenous iron therapy in patients with systolic HF and ID reduced the risk of the combined endpoint of all-cause death or cardiovascular hospitalization, the risk of the combined endpoint of cardiovascular death or hospitalization due to advanced HF. However there was no effect on either all-cause or cardiovascular mortality, parenteral iron therapy resulted in the improved exercise capacity (as reflected by a longer 6MWT distance) and life quality, and also in alleviation of HF symptoms (reduction in the NYHA class) [38].
Intravenous FCM should be considered in symptomatic patients with systolic heart failure and iron deficiency (serum ferritin level <100 ng/mL, or between 100 and 300 ng/mL if transferrin saturation <20%) in order to alleviate HF symptoms, and improve exercise capacity and life quality [39].
Conclusion. Management of patients with heart disease and anemia might appropriately differ from that of the general population. Hence, clinical judgment and understanding the evidence base are critical when managing these patients. Anemia is associated with worse outcomes in patients with cardiovascular diseases. However, it is uncertain if anemia is the cause or the marker of poor outcomes and thus it only reflects advanced cardiovascular disease.
1. de Benoist B. et al., eds. Worldwide prevalence of anaemia 1993-2005. WHO Global Database on Anaemia Geneva, World Health Organization, 2008.
2. von DrygalskiA., Adamson J. W. Ironing out fatigue. Blood,2011, vol. 118, pp. 3191-3192.
3. Sarnak M. J., Tighiouart H., Manjunath G., MacLeod B., Griffith J., Salem D., Levey A. S. Anemia as a Risk Factor for Cardiovascular Disease in the Atherosclerosis Risk in Communities (ARIC) Study. J Am Coll Cardiology, 2002, vol. 40, no. 1, pp. 27-33.
4. Metivier F., Marchais S. J., Guerin A. P., Pannier B., London G. M. Pathophysiology of anaemia: focus on the heart and blood vessels, Nephrol Dial Transplant, 2000, vol. 15, no. 3, pp. 14-18.
5. Paul B., Wilfred N. C., Woodman R., Depasquale C. Prevalence and correlates of anaemia in essential hypertension. Clin Exp Pharmacol Physio, 2008, vol. 35, no. 12, pp. 1461-1464
6. Marketou M., Patrianakos A., Parthenakis F. Systemic blood pressure profile in hypertensive patients with low hemoglobin concentrations. Int J Cardiol, 2010, vol. 142, no. 1, pp. 95-96.
7. Marianne L. Smebye Emil K. Iversen A. H. Effect of Hemoglobin Levels on Cardiovascular Outcomes in Patients With Isolated Systolic Hypertension and Left Ventricular Hypertrophy (from the LIFE Study). Am J Cardiol, 2007, Sep 1, vol. 100, no. 5, pp. 747-912.
8. Stanojevic M., Stankov S. Electrocardiographic changes in patients with chronic anemia. Srp Arh Celok Lek, 1998, Nov-Dec. 126, no. 11-12, pp. 461-466.
9. Gv S., Pk S., Herur A., Chinagudi S., Patil S. S., Ankad R. B., Badami S. V. Correlation Between Haemoglobin Level and Electrocardiographic (ECG) Findings in Anaemia: A Cross-Sectional Study. J Clin Diagn Res, 2014, vol. 8, no.:4, doi: 10.7860/ JCDR/2014/8966.4202.
10. Mozos I., Serban C., Mihaescu R. Anemia and the QT interval in hypertensive patients. Int J Coiiabor Res Int Med Public Health, 2012, vol. 4, no 12, pp. 2084-2091.
11. Karadeniz C., Ozdemir R., Demirol M., Katipoglu N., Yozgat Y., Mege T., Onal N. Low Iron Stores in Otherwise Healthy Children Affect Electrocardiographic Markers of Important Cardiac events. Pediatr Cardiol, 2017, vol. 38, no. 5, pp. 909-914.
12. Mehta B. C., Panjwani D. D., Jhala D. A. Electrophysiologic abnormalities of heart in iron deficiency anemia. Effect of iron therapy. Acta Haematol, 1983, vol. 70, no. 3, pp. 189-193.
13. Hoffman J. I. Determinants and prediction of transmural myocardial perfusion. Circulation, 1978, vol. 58, pp. 381-339.
14. Hu H., Xenocostas A., Chin-Yee I., Lu X., Feng Q., Effects of anemia and blood transfusion in acute myocardial infarction in rats. Transfusion, 2010, vol. 50, no. 1. pp. 243-251.
15. Sabatine M. S., Morrow D. A., Giugliano R. P., Burton P. B., Murphy S. A., McCabe C.H., Gibson C. M., Braunwald E. Association of hemoglobin levels with clinical outcomes in acute coronary syndromes. Circulation, 2005, vol. 111, pp. 2042-2049.
16. Zeidman A., Fradin Z., Blecher A., Oster H. S., Avrahami Y., Mittelman M., Anemia as a risk factor for ischemic heart disease. Circulation. 2004, vol. 6, no. 1, pp. 16-18.
17. Mahmoodi M. R., Kimiagar S. M., Abadi A. R. Is anemia an independent predictor of occurrence of acute coronary syndrome? Results from the modares heart study. Am Heart Hosp J, 2007, vol. 5, no. 2, pp. 73-79.
18. Ferreira M., Antonio N., Gongalves F., Hemoglobina: um mero valor analitico ou um poderoso preditor de risco em doentes com sindromes coronarias agudas? Revista Portuguesa de Cardiologia, 2012, vol. 31, pp. 121-130.
19. Nikolsky E., Aymong E. D., Halkin A., Grines C. L., Cox D. A., Garcia E., Mehran R., Tcheng J. E., Griffin J. J., Guagliumi G., Stuckey T., Turco M., Cohen D. A., Negoita M., Lansky A. J., Stone G. W. Impact of anemia in patients with acute myocardial infarction undergoing primary percutaneous coronary intervention: Analysis from the controlled abciximab and device investigation to lower late angioplasty complications (cadillac) trial. J Am Coll Cardiol, 2004, Aug 4, vol. 44, no. 3, pp. 547-553.
20. Bailey D., Aude Y. W., Gordon P., Burtt D. ST-segment elevation myocardial infarction, severe anemia and nonobstructive coronary disease: case report and brief comment. Conn Med, 2003, vol. 67, no. 1, pp. 3-5.
21. Ezekowitz J. A., McAlister F.A., Armstrong P. W. Anemia is common in heart failure and is associated with poor outcomes: Insights from a cohort of 12,065 patients with new- onset heart failure. Circulation, 2003, vol. 107, pp. 223-225.
22. Mozaffarian D., Nye R., Levy W. C. Amemia predicts mortality in severe heart failure: The Prospective Randomized Amlodipine Survival Evaluation (PRAISE). J Am Coll Cardiol, 2003, vol. 41, pp. 1933-1939.
23. Silverberg D. S., Wexler D., Blum M., Keren G., Sheps D., Leibovitch E., Brosh D., Laniado S., Schwartz D., Yachnin T., Shapira I., Gavish D., Baruch R., Koifman B., Kaplan C., Steinbruch S., Iaina A. The use of subcutaneous erythropoietin and intravenous iron for the treatment of the anemia of severe, resistant congestive heart failure improves cardiac and renal function and functional cardiac class, and markedly reduces hospitalizations. J Am Coll Cardiol, 2000, vol. 35, no. 7, pp. 1737-1744.
24. Tang Y. D., Katz S. D. Anemia in chronic heart failure: Prevalence, etiology, clinical correlates and treatment options. Circulation, 2006, vol. 113, pp. 2454-2461.
25. Nanas J. N., Matsouka C., Karageorgopoulos D., Leonti A., Tsolakis E., Drakos S. G., Tsagalou E. P., Maroulidis G. D., Alexopoulos G. P., Kanakakis J. E., Anastasiou-Nana M. I. Etiology of anemia in patients with advanced heart failure. J Am Coll Cardiol, 2006, vol. 48, pp. 2485-2489.
26. Jankowska E. A., von Haehling S., Anker S. D., Macdougall I. C., Ponikowski P. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J, 2013, vol. 34, pp. 816-829.
27. Klip I. T., Comin-Colet J., Voors A. A., Ponikowski P., Enjuanes C., Banasiak W., Lok D. J., Rosentryt P., Torrens A., Polonski L., van Veldhuisen D. J., van der Meer P., Jankowska E. A. Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J, 2013, vol. 165, pp. 575-582.e3.
28. Jankowska E. A., Rozentryt P., Witkowska A., Nowak J., Hartmann O., Ponikowska B., Borodulin-Nadzieja L., Banasiak W., Polonski L., Filippatos G., McMurray J.J., Anker S. D., Ponikowski P. Iron deficiency: an ominous sign in patients with systolic chronic heart failure. Eur Heart J, 2010, vol. 31, pp. 1872-1880.
29. Jankowska E. A., Rozentryt P., Witkowska A., Nowak J., Hartmann O., Ponikowska B., Borodulin-Nadzieja L., von Haehling S., Doehner W., Banasiak W., Polonski L., Filippatos G., Anker S. D., Ponikowski P. Iron deficiency predicts impaired exercise capacity in patients with systolic chronic heart failure. J Card Fail, 2011, vol. 17, pp. 899-906.
30. Enjuanes C., Klip I. T., Bruguera J., Cladellas M., Ponikowski P., Banasiak W., van Veldhuisen D. J., van der Meer P., Jankowska E. A., Comin-Colet J. Iron deficiency and health-related quality of life in chronic heart failure: results from a multicenter European study. Int J Cardiol, 2014, vol. 174, pp. 268-275. doi: 10.1016/j.ijcard.2014.03.169.
31. Qaseem A., Humphrey L. L., Fitterman N., Starkey M., Shekelle P. Clinical Guidelines Committee of the American College of Physicians.Treatment of Anemia in Patients With Heart Disease: A Clinical Practice Guideline From the American College of Physicians. Ann Intern Med, 2013, vol. 159, no. 11, pp. 770-779.
32. Chatterjee S., Wetterslev J., Sharma A., Lichstein E., Mukherjee D. Association of blood transfusion with increased mortality in myocardial infarction: a meta-analysis and diversity-adjusted study sequential analysis. JAMA Intern Med, 2013, vol. 173, pp. 132-139.
33. Carson J. L., Brooks M. M., Abbott J. D., Chaitman B., Kelsey S. F., Triulzi D. J., Srinivas V., Menegus M. A., Marroquin O. C., Rao S. V., Noveck H., Passano E., Hardison R. M., Smitherman T., Vagaonescu T., Wimmer N. J., Williams D. O. Liberal versus restrictive transfusion thresholds for patients with symptomatic coronary artery disease. Am Heart, 2013, vol. 165, no. 6, pp. 964-971.
34. Roffi M., Patron C. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J, 2016, vol. 37, pp. 267-315. doi:10.1093/eurheartj/ehv320.
35. Gupta C. P. Role of Iron (Fe) in Body. J Appl Chem (IOSR-JAC), 2014, vol. 7, no. 11, pp. 38-46.
36. Anker S. D., Comin C. J., Filippatos G., Willenheimer R., Dickstein K., Drexler H., Luscher T. F., Bart B., Banasiak W., Niegowska J., Kirwan B. A., Mori C., von Eisenhart R. B., Pocock S. J., Poole-Wilson P.A., Ponikowski P. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med, 2009, vol. 361, no. 25, pp. 2436-2448.
37. Ponikowski P., van Veldhuisen D. J., Comin-Colet J., Ertl G., Komajda M., Mareev V., McDonagh T., Parkhomenko A., Tavazzi L., Levesque V., Mori C., Roubert B., Filippatos G., Ruschitzka F., Anker S. D. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J, 2015, vol. 36, no. 11, pp. 657-658.
38. Jankowska E. A., Tkaczyszyn M., Suchocki T., Drozd M., von Haehling S., Doehner W., Banasiak W., Filippatos G., Anker S. D., Ponikowski P. Effects of intravenous iron therapy in iron-deficient patients with systolic heart failure: a meta-analysis of randomized controlled trials. Eur J Hearts Faii, 2016, vol. 18, no. 7, pp. 786-795. doi:10.1002/ejhf.473
39. Ponikowski P., Voors A. A., Anker S. D., Bueno H., Cleland J. G., Coats A. J., Falk V., Gonzalez-Juanatey J.R., Harjola V. P., Jankowska E. A., Jessup M., Linde C., Nihoyannopoulos P., Parissis J. T., Pieske B., Riley J. P., Rosano G. M., Ruilope L. M., Ruschitzka F., Rutten F. H., van der Meer P. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. RevEsp Cardiol (Engl Ed). 2016, vol. 69, no. 12, p. 1167. doi: 10.1016/j.rec.2016.11.005.
Анемия:Причины анемии,Симптомы анемии,Профилактика анемии | doc.ua
Анемия может протекать бессимптомно и возникает по разным причинам, на фоне различных заболеваний и патологий. При данном заболевании снижается уровень гемоглобина, необходимого для переноса кислорода в клетки и для других важных процессов в организме. Женщины больше подвержены анемии, так как теряют железо не только ежедневно, но и во время менструаций и вынашивания ребенка. Болезнь может протекать в легкой, средней и тяжелой форме. Последствия анемии могут быть серьезными, так как она приводит к гипоксии, которая негативно влияет на состояние всех систем организма.
Классификация насчитывает более 400 видов анемии, различающихся по признакам и происхождению болезни.
Железодефицитная анемия — самая распространенная форма анемии, составляет 90% случаев из всех видов заболевания. Возникает при недостатке железа в организме, из-за чего не вырабатывается нормальное количество гемоглобина. Часто наблюдается у беременных, так как в этом периоде железа необходимо в два раза больше, чем в обычном состоянии. Дополнительное железо используется в образовании кровяных телец вынашиваемого плода. Также может встречаться у детей из-за нерационального питания.
Гемолитическая анемия — при данном типе заболевания происходит уменьшение продолжительности жизни красных кровяных клеток. В большинстве случаев это врожденная патология.
Апластическая анемия — тип анемии, возникающий из-за того, что костный мозг перестает вырабатывать клетки крови в нормальном количестве. Это редкий вид заболевания, наблюдается в любом возрасте у женщин и мужчин.
Гипохромная анемия — при данном виде заболевания нарушен процесс образования гемоглобина из-за снижения уровня эритроцитов. Причиной может быть нехватка железа, наследственные нарушения в образовании гемоглобина и хроническое отравление свинцом.
Постгеморрагическая анемия — заболевание может начаться после сильной кровопотери или хронических необильных кровотечений, после частых операций или травм.
Пернициозная анемия — форма анемии, возникающая из-за нарушения в образовании кровяных клеток, прогрессирует на фоне дефицита витамина В12.
Если анемия возникает при беременности, она может привести к тяжелым последствиям. Плод недополучает кислород, который необходим для нормального развития организма, особенно для головного мозга. Женщины во время беременности с тяжелыми формами анемии хуже переносят период вынашивания ребенка, возрастает вероятность родов раньше срока. Повышается риск развития инфекций после родов.
Причины анемии
Причины, вызывающие состояние анемии, могут быть врожденными либо приобретенными:
- Скудное и неполноценное питание. Употребление продуктов с дефицитом железа и животного белка, недостаток витаминов и минералов, необходимых для кроветворения. Анемия часто встречается у вегетарианцев, так как они исключают животный белок из питания.
- Постоянная потеря крови. Потеря крови может происходить во время заболеваний (полименорея, геморрой, кровоточивость десен), а также при тяжелых травмах и хирургических вмешательствах.
- Частое донорство. В этом случае анемия протекает недолго и быстро лечится путем сбалансированного питания и временного отказа от донорства.
- Глистные явления. При появлении паразитов в желудочно-кишечном тракте существенно снижается процесс усваивания питательных веществ в кишечнике. В том числе и железа, необходимого для достаточного образования гемоглобина. По этой причине может возникать анемия у ребенка.
- Анемия — частое явление при беременности, поскольку в железе нуждается не только мать, но и будущий ребенок. Потребность в железе возрастает в два раза.
- Уменьшение продолжительности жизни эритроцитов в организме. В нормальном состоянии красные клетки циркулируют в крови около 120 дней, а затем распадаются. При аутоиммунных заболеваниях, наследственных нарушениях и инфекционных заболеваниях эритроциты проживают меньший срок и распадаются раньше времени.
- Заболевания соединительной ткани. К данным болезням можно отнести узелковый полиартериит, ревматоидный артрит, системную красную волчанку, болезнь Хортона и другие.
- Хронические инфекционные заболевания, такие как: абсцесс лёгкого, туберкулез, бактериальный эндокардит, бруцеллез, болезни бронхов, пиелонефрит, остеомиелит и другие.
Симптомы анемии
Анемия может протекать без тяжелых проявлений, однако тревожным сигналом могут быть следующие симптомы:
- высокая утомляемость и слабость, головокружение, возможны обморочные состояния;
- ухудшение памяти и рассеянное внимание, низкая мыслительная активность;
- возникает одышка и учащенный пульс;
- периодический свист в ушах;
- потеря аппетита, ухудшение сна и бессонница;
- бледный цвет кожных покровов и губ, может быть голубоватого оттенка, синие круги под глазами;
- у пожилых людей может возникать приступ стенокардии, ноющие боли в области сердца;
- перепады настроения и депрессия.
Некоторые виды анемии могут иметь специфические признаки. При железодефицитной анемии может появиться потребность съесть мел или землю, ногти становятся вогнутыми, трескаются губы и язык, уголки рта воспаляются и не поддаются лечению. В некоторых случаях может возникать гастрит, нарушения со стороны мочевыделительной системы.
Пернициозная анемия проявляется такими характерными симптомами как: чувство онемения или покалывания в руках или ногах, ухудшение мыслительных процессов и успеваемости, нарушение памяти, походка может стать неуверенной.
При гемолитической анемии, врожденной или приобретенной, начинается желтуха, так как селезенка убивает неполноценные эритроциты в большом количестве. Может возникать спленомегалия, при которой увеличивается селезенка из-за особой реакции. Селезенка уничтожает эритроциты в большом количестве, поэтому значительно увеличивается в размере. При данном форме анемии моча изменяет цвет и становится похожа на темное пиво, так как при разрушении эритроцитов в кровь попадает билирубин в большом количестве, который выводится из организма вместе с мочой.
Лечение анемии
Лечение анемии зависит от формы заболевания и причин его развития. Оно включает в себя прием препаратов с содержанием железа и витамины, полноценное питание и в некоторых случаях переливание крови. Самостоятельно лечить анемию запрещено, препараты должен назначить врач согласно анализу крови. При железодефицитной анемии назначаются препараты с повышенным содержанием железа, которые нужно принимать на протяжении четырех месяцев. Пациент должен строго соблюдать диету, в которую включается мясо, овощи и свежевыжатые соки. Больше всего железа содержится в говяжьем языке и свином мясе, железо из овощей практически не усваивается организмом.
В тяжелых формах анемии препараты железа вводятся внутривенно. При диагнозе пернициозной анемии назначается прием препарата цианокобаламина, витамина В12. В лечение гемолитической анемии входит прием глюкокортикостероидов, а в тяжелых случаях производят удаление селезенки. При обильном кровотечении его необходимо приостановить. При хронических кровопотерях назначается лечение для устранения причин заболевания.
В некоторых случаях лечение анемии производится с помощью переливания крови, при тяжелых состояниях больного: обильной кровопотере, образовании опухолей и наследственных заболеваниях. Апластическая анемия предполагает хирургическое вмешательство и трансплантацию костного мозга.
Профилактика анемии
В меры профилактики анемии входит соблюдение полноценного питания, прием витамина В12, укрепление общего состояния организма. Необходимо включать в пищу продукты, богатые железом и фолиевой кислотой. Железо содержится в большом количестве в животном белке, поэтому необходимо употреблять достаточную норму мяса. Не увлекаться диетами и снижением веса, так как это может привести к анемии. Необходимо поддерживать нормальное состояние желудочно-кишечного тракта, чтобы пища хорошо усваивалась организмом.
Профилактика анемии включает прием витамина В12 и фолиевой кислоты, так как эти вещества играют большую роль в образовании эритроцитов. Среди народных средств выделяют настойки из растений одуванчика, молодой крапивы, травы тысячелистника. Также из них можно делать свежие салаты с добавлением растительного масла. Для того чтобы железо хорошо усвоилось организмом, необходимо включить в питание продукты, содержащие фолиевую кислоту и витамин С.
Большой уровень витамина С содержится в ягодах шиповника, листьях и плодах черной смородины, рябины, соцветиях боярышника. Из них можно готовить чаи и настойки, употреблять в свежем виде. Не менее богата железом и фолиевой кислотой свежая петрушка, шпинат, листья салата и другая зелень. Очень полезны при анемии свежие соки, изготовленные из свеклы, яблок, граната, моркови и тыквы. Большое количество железа содержат сухофрукты: курага, чернослив и изюм.
В профилактику анемии входят регулярные прогулки на свежем воздухе, подвижный образ жизни и занятия щадящим видом спорта. Избегайте тяжелых физических нагрузок, переутомления и стресса. Беременным женщинам рекомендуется принимать дополнительно витамины и фолиевую кислоту, так как потребность в железе возрастает в этом периоде вдвойне.
Профилактика / КонсультантПлюс
— Для профилактики анемии у новорожденного рекомендуется отсроченное пережатие и пересечение пуповины спустя 60 — 120 сек при отсутствии необходимости в немедленном оказании помощи матери или ребенку [70 — 72].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1)
Комментарии: Альтернативой отсроченному пережатию может являться сцеживание пуповины. Рутинное применение сцеживания пуповины не рекомендуется в связи с отсутствием достаточных доказательств его безопасности у глубоко недоношенных новорожденных [70].
— Для профилактики анемии у недоношенного новорожденного рекомендуется минимизировать флеботомические потери и диагностические венепункции [73 — 76].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 2)
Комментарии: следует придерживаться обоснованного подхода к проведению дополнительных лабораторных исследований крови, использовать микрометоды определения минимально необходимых параметров крови и использовать неинвазивный мониторинг газового состава крови и уровня билирубина при возможности в конкретной МО.
— Для профилактики анемии недоношенных не рекомендуется рутинное назначение других антианемических препаратов (код ATX B03XA) всем недоношенным новорожденным [55, 59].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 1).
Комментарии: В группу «другие антианемические препараты» (код ATX B03XA) входят следующие препараты, применяемые у новорожденных: эпоэтин альфа** и эпоэтин бета**. Также есть исследования по применению #дарбопоэтина альфа** у новорожденных [59 — 62]. Схемы терапии Эпоэтином альфа** (рекомбинантным человеческим эритропоэтином): раннее назначение Эпоэтина альфа** — с 3 суток жизни в дозе 200 МЕ/кг три раза в неделю внутривенно или подкожно до достижения целевых значений уровня гемоглобина и гематокрита, но не более 6 недель. Схема терапии Эпоэтином бета** — с 3 суток жизни в дозе 250 МЕ/кг три раза в неделю внутривенно или подкожно до достижения целевых значений уровня гемоглобина и гематокрита, но не более 6 недель. Режим дозирования #дарбэпоэтина альфа** 10 мкг/кг 1 раз в неделю [60, 63]. При назначении препаратов следует руководствоваться инструкцией к препарату. Режим дозирования и способ введения препаратов могут отличаться в инструкциях различных производителей.
При нормализации уровня гемоглобина и гематокрита препараты отменяются.
— Рекомендуется назначение эпоэтина альфа** или эпоэтина бета** (код ATX B03XA) у глубоко недоношенных новорожденных гестационного возраста менее 31 недели с целью повышения уровня гемоглобина на момент выписки из стационара [59, 64 — 68].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2).
Комментарии: Схемы лечения см. в комментариях предыдущей рекомендации.
— Недоношенным новорожденным с ОНМТ и ЭНМТ для профилактики развития железодефицитного состояния рекомендуется назначение пероральных препаратов трехвалентного железа (код ATX B03AB) с двух недель жизни [29, 77 — 82].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1).
Комментарии: Рекомендуемая доза пероральных препаратов трехвалентного железа (код ATX B03AB) для недоношенных новорожденных с ОНМТ и ЭНМТ составляет 2 — 3 мг/кг/сут. Новорожденным массой тела 1500 — 2000 г может рекомендоваться дотация пероральных препаратов трехвалентного железа (код ATX B03AB) #железа (III) гидроксид полимальтозат** в дозе 2 мг/кг/сут, начиная с 2 — 4 недель жизни; новорожденным массой тела при рождении 2000 — 2500 г — в дозе 1 — 2 мг/кг/сут, начиная с 2 — 6 недель жизни. Лечение может продолжаться до 6 — 12 месяцев жизни в зависимости от индивидуальных показателей [83].
Терапия препаратами трехвалентного железа (код ATX B03AB) проводится под контролем содержания гемоглобина, эритроцитов и ферритина в крови [83].
Референтные значения ферритина у недоношенных от 35 до 300 мкг/л (таблица 4).
Таблица 4. Рекомендуемые значения для диагностики избытка железа и железодефицита у детей до 2 лет (модифицирована из , 2017) [83].
Ферритин мкг/л | Новорожденные | 2 месяца | 4 месяца | 6 — 24 месяца |
Избыток железа | > 300 | > 300 | > 250 | > 200 |
Дефицит железа | < 35 | < 40 | < 20 | < 10 — 12 |
В случае снижения ферритина менее 35 мкг/л следует увеличить дозу препаратов железа до 3 — 4 (максимум до 6) мг/кг/сут на ограниченный период. Длительной терапии препаратами железа в дозе > 3 мг/кг/сут следует избегать в связи с возможными неблагоприятными побочными эффектами. Повышение уровня ферритина более 300 мкг/л может встречаться, в том числе, и при перегрузке железом вследствие многократных гемотрансфузий. В этом случае терапию препаратами железа следует прекратить до снижения уровня ферритина ниже 300 мкг/л [83].
При проведении гемотрансфузий терапию препаратами трехвалентного железа (код ATX B03AB) недоношенным детям рекомендуется продолжить, исключая случаи наличия сопутствующих гемолитических состояний. Если у ребенка имеются гемолитические нарушения, то при переливании крови рекомендуется отказаться от применения препаратов железа на 2 недели [81].
Во время терапии другими антианемическими препаратами (эпоитин альфа**, эпоитин бета**, #дарбэпоитин альфа**) (код ATX B03XA) повышается потребность в железе, поэтому при назначении эпоитина альфа**, эпоитина бета**, #дарбэпоитина альфа** (код ATX B03XA) рекомендуемая доза препаратов железа составляет до 6 мг/кг/сут [83, 84].
Дефицит железа в критические периоды раннего постнатального развития мозга может иметь неблагоприятные последствия для нервно-психического развития недоношенного ребенка. Однако при назначении пероральных препаратов трехвалентного железа (код ATX B03AB) не следует забывать о побочных эффектах и опасности перегрузки железом. К побочным эффектам пероральных препаратов трехвалентного железа (код ATX B03AB) относятся рвота, диарея, запор и другие заболевания желудочно-кишечного тракта. Избыток железа может оказывать негативное влияние на нервно-психическое развитие, кроме того, свободное сывороточное железо является потенциальным сильным окислителем, способствующим окислительному повреждению легких и сетчатки глаза недоношенных новорожденных [77, 80, 81].
— Недоношенному ребенку с целью профилактики ранней анемии недоношенных не рекомендуется рутинное назначение витамина E [85 — 87].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2).
Комментарии: Недоношенные дети, особенно с ОНМТ и ЭНМТ имеют дефицит витамина E при рождении. Однако адекватное вскармливание ребенка (парентеральное/энтеральное) позволяет уже в течение первых 6 недель жизни достигнуть пороговых значений витамина E в сыворотке крови [85]. Данные литературы также свидетельствуют о влиянии дополнительного применения витамина E на снижение гемолиза, повышения количества эритроцитов, показателя гемоглобина у недоношенных детей [86]. При использовании высоких доз препаратов железа (6 мг/кг/сутки), как правило при применении эпоитина альфа**, эпоитина бета**, #дарбэпоитина альфа** (код ATX B03XA), развивается высокий риск перикисного окисления свободных радикалов железа, наряду со сниженными запасами витамина E в первые 2 недели жизни, запуская таким образом каскад отрицательного влияния железо-индуцированного окислительного стресса и гемолиза. Таким образом, оправдано дополнительное применение витамина E в дозе 15 — 25 МЕ/сутки в течение периода использования высоких доз препаратов железа в течение 6 недель [80, 84].
Фолиевая кислота.
Физиологическая потребность у недоношенных детей в фолатах при энтеральном питании составляет 35 — 100 мкг/кг [88].
В настоящее время установлено, что недоношенные дети имеют достаточную обеспеченность фолатами, если их матери получали добавки фолиевой кислоты** (код ATX B03BB) во время беременности, а дети — оптимальное парентеральное и энтеральное питание [89 — 92]. При применении современных схем вскармливания нет риска развития дефицита фолатов у недоношенных детей, а бесконтрольное дополнительное назначение фолиевой кислоты** (код ATX B03BB) может приводить к ее избыточному поступлению и чрезмерным концентрациям в крови недоношенных детей [88].
— Рекомендуется дополнительное назначение #фолиевой кислоты** (код ATX B03BB) недоношенным новорожденным с целью профилактики анемии недоношенных в случае недостаточного поступления в организм фолатов (неоптимальное питание беременной, неоптимальное вскармливание недоношенного ребенка) в дозе до 100 мкг/сут [88, 89].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4).
Дефицит железа
Специалисты много говорят о нехватке железа в организме и ее последствиях, неустанно напоминая о важности время от времени сдавать анализы для проверки запасов железа. В последнее время также большое значение уделяется солнечному гормону или витамину D в поддержании здоровья.
Анемия сама по себе не является основным диагнозом. Это предвестник какого-то другого процесса в организме, который вызывает, среди прочего, анемию, и поэтому он не должен оставаться без обследования и лечения. Анемия — это изменение в составе крови, которое приводит к уменьшению количества красных телец или содержащегося в них гемоглобина. Когда они уменьшаются, крови не хватает «транспортных единиц», ответственных за доставку достаточного количества кислорода везде, где это необходимо. А именно, функция красных телец или эритроцитов заключается в доставке кислорода из легких в ткани по всему телу и углекислого газа в обратном направлении — из тканей в легкие для выдоха. В эритроцитах, которым отводится эта важная роль, кислород транспортируется гемоглобином, железосодержащим белком, который также придает клетке характерный красный цвет.
ВАЖНО ЗНАТЬ:
Чаще всего анемия носит хронический характер. Это означает, что потеря эритроцитов или гемоглобина является умеренной и может быть частично компенсирована организмом, поэтому последствия не являются существенными. Таким образом, дефицит железа вначале часто упускается из виду.
КАК ОПРЕДЕЛИТЬ АНЕМИЮ?
• Нужно сделать анализ крови — образец крови, взятый из вены в лаборатории, который называется общий анализ крови. Он предоставляет информацию о количестве различных клеток крови и гемоглобина, а также о других показателях, которые могут помочь врачу определить направление, в котором следует искать причину анемии.
• Существуют также так называемые методы экспресс-диагностики, при которых небольшое количество гемоглобина можно измерить менее чем за одну минуту, нанеся небольшое количество крови из пальца на тест-полоску с помощью специального устройства, которое сейчас доступно в большинстве практик семейных врачей. На практике семейных врачей наиболее распространена железодефицитная анемия. Она возникает, когда организму не хватает основного источника гемоглобина — железа. Железодефицитная анемия возникает либо из-за недостаточного потребления железа, либо при возникновении осложнений.
ПРИЗНАКИ НЕДОСТАТКА ЖЕЛЕЗА. ЕСЛИ ВЫ ЗАМЕТИЛИ КАКОЙ-ЛИБО ИЗ НИХ, НУЖНО ОБЯЗАТЕЛЬНО ОБРАТИТЬСЯ К ВРАЧУ, ЧТОБЫ ВОВРЕМЯ ВЫЯСНИТЬ ПРИЧИНУ
• длительная усталость;
• сонливость;
• бледность;
• слабость;
• головокружение;
• подавленное настроение;
• ломкость ногтей и волос;
• у женщин нередки расстройства менструальные цикла.
СЛЕДУЕТ СОБЛЮДАТЬ!
К сожалению, женщины чаще страдают от железодефицитной анемии, потому что она может быть вызвана ежемесячной менструацией, во время которой происходит усиленная кровопотеря, что приводит к истощению запасов железа в организме. Женщины должны обсудить эти вопросы со своим гинекологом или семейным врачом! Если натуральных источников железа — мяса, особенно говядины или телятины, печени, яичного желтка, абрикосов, гранатов и гранатового сока, бобовых, шпината - недостаточно, врач обычно рекомендует препараты железа. Существующая анемия обычно не компенсируется диетой и требует лечения. Лечение анемии требует терпения и времени, так как в среднем это занимает 4-6 месяцев. Обычно лечение начинают с так называемых пероральных средств (таблетки, капсулы, сиропы). Внутривенное введение железа эффективно и требует от 10 до 20 инъекций. Длительное, хотя и умеренное, голодание наносит серьезный ущерб клеткам организма, и они не в состоянии правильно выполнять свои функции.
АНЕМИЯ ОБЫЧНО ВОЗНИКАЕТ, ЕСЛИ:
• повышенное разрушение эритроцитов;
• недостаточное производство эритроцитов;
• происходит потеря крови.
Семейный врач Дарта Микелсоне, Capital Clinic Riga и эндокринолог Гита Эрта
[Влияние анемии на развитие ребенка: отдаленные последствия]
Анемия у детей в возрасте до 3 лет является проблемой общественного здравоохранения в Перу и во всем мире. Считается, что одной из основных причин анемии является дефицит железа. Многочисленные исследования и обзоры показали, что дефицит железа ограничивает психомоторное развитие у детей и что, несмотря на коррекцию анемии, дети с дефицитом железа в долгосрочной перспективе имеют более низкие показатели когнитивного, социального и эмоционального функционирования.Эти результаты были зарегистрированы в обсервационных исследованиях, последующих исследованиях и экспериментальных исследованиях с контрольной группой. Анемия может снизить успеваемость в школе, продуктивность во взрослой жизни, качество жизни и общий доход больных. Здесь мы описываем возможные механизмы, лежащие в основе влияния дефицита железа с анемией или без нее на развитие детей. Вызывает беспокойство высокий уровень анемии в этой возрастной группе. Кроме того, анемию следует предотвращать на первом году жизни, чтобы избежать долгосрочных негативных последствий для индивидуального развития.
Ла анемия en niños menores де tres años эс ип проблема де Salud Pública en эль-Перу у эль mundo. Se estima que la causa main de la anemia, aunque no la única, es la deficiencia de hierro. Existen muchos estudios y reviewes sobre cómo esta carencia en los infantes Impacta negativamente en el desarrollo psicommotor y, pesar de corregirse la анемия, los niños con este antecedente Presentan, a largo plazo, un menor desempeño en las áreas cognitiva, social y emocional.Estos hallazgos, описанный в estudios observacionales, de seguimiento, así como en Experimentes con grupo control. La puede анемии disminuir эль desempeño escolar, y la productividad en la vida Adulta, afectando la calidad de vida, y en general la economía de las personas afectadas. Se описал algunos posibles mecanismos de cómo la deficiencia de hierro, con o sin анемия, podría afectar el desarrollo en la infancia; por ello, causa preocupación la alta prevalencia de anemia que se observa en este grupo de edad.La prevención де ла анемия ан эль праймер año де vida debe сер ла мета пункт evitar consecuencias ан эль desarrollo де ла персона largo plazo.
Дефицит железа у детей: советы по профилактике для родителей
Дефицит железа у детей: советы по профилактике для родителей
Дефицит железа у детей может повлиять на развитие и привести к анемии. Узнайте, сколько железа нужно вашему ребенку, лучшие источники железа и многое другое.
Персонал клиники МайоЖелезо — это питательное вещество, необходимое для роста и развития вашего ребенка, но некоторым детям его не хватает. Узнайте, что вызывает дефицит железа у детей, как его распознать и как предотвратить.
Почему железо важно для детей?
Железо помогает переносить кислород из легких в остальные части тела и помогает мышцам накапливать и использовать кислород. Если в рационе вашего ребенка недостаточно железа, у него может развиться состояние, называемое дефицитом железа.
Дефицит железа у детей является распространенной проблемой. Это может происходить на многих уровнях, от легкого дефицита до железодефицитной анемии — состояния, при котором в крови недостаточно здоровых эритроцитов. Невылеченный дефицит железа может повлиять на рост и развитие ребенка.
Сколько железа нужно детям?
Младенцы рождаются с запасами железа в организме, но постоянное количество дополнительного железа необходимо для обеспечения быстрого роста и развития ребенка.Вот руководство по потребности в железе в разном возрасте:
| Возрастная группа | Рекомендуемое количество железа в день |
|---|---|
| 7-12 месяцев | 11 мг |
| 1–3 года | 7 мг |
| 4-8 лет | 10 мг |
| 9-13 лет | 8 мг |
| 14 — 18 лет, девушки | 15 мг |
| 14-18 лет, мальчики | 11 мг |
Кто подвержен риску дефицита железа?
Младенцы и дети с самым высоким риском дефицита железа включают:
- Дети, рожденные недоношенными или с низкой массой тела при рождении
- Младенцы, которые пьют коровье или козье молоко в возрасте до 1 года
- Дети, находящиеся на грудном вскармливании, которым не дают прикорм, содержащий железо, после 6 месяцев
- Младенцы, которые пьют смесь, не обогащенную железом
- Дети в возрасте от 1 до 5 лет, которые выпивают более 24 унций (710 миллилитров) коровьего, козьего или соевого молока в день
- Дети с определенными заболеваниями, такими как хронические инфекции или ограниченное питание
- Дети, подвергшиеся воздействию свинца
- Дети, которые не едят достаточно продуктов, богатых железом
- Дети с избыточным весом или ожирением
Девочки-подростки также подвержены более высокому риску дефицита железа, поскольку их организм теряет железо во время менструации.
Каковы признаки и симптомы дефицита железа у детей?
Слишком малое количество железа может ухудшить способность вашего ребенка нормально функционировать. Однако большинство признаков и симптомов дефицита железа у детей не проявляются до тех пор, пока не возникнет железодефицитная анемия. Если у вашего ребенка есть факторы риска дефицита железа, поговорите с его врачом.
Признаки и симптомы железодефицитной анемии могут включать:
- Бледная кожа
- Усталость
- Холодные руки и ноги
- Замедление роста и развития
- Плохой аппетит
- Аномально быстрое дыхание
- Поведенческие проблемы
- Частые инфекции
- Необычная тяга к непищевым веществам, таким как лед, грязь, краска или крахмал
Как предотвратить дефицит железа у детей?
Если вы кормите ребенка смесью, обогащенной железом, скорее всего, он или она получает рекомендуемое количество железа.Если вы кормите ребенка грудью, поговорите с лечащим врачом о добавках железа. Добавкой железа могут быть капли железа, которые дают в определенной дозе, или железо, включенное в витаминную добавку.
Вот несколько общих рекомендаций:
- Доношенные дети. Начните давать ребенку препараты железа в возрасте 4 месяцев. Продолжайте давать ребенку пищевую добавку до тех пор, пока он или она не начнет есть две или более порций продуктов, богатых железом, таких как обогащенные железом каши или мясное пюре.Если вы кормите грудью и даете ребенку смесь, обогащенную железом, и большинство кормлений вашего ребенка происходит из смеси, прекратите давать ребенку добавку.
- Недоношенные дети. Начните давать ребенку препараты железа в возрасте 2 недель. Продолжайте давать ребенку добавку до 1 года. Если вы кормите грудью и даете ребенку обогащенную смесь, а большинство кормлений вашего ребенка происходит из смеси, прекратите давать ребенку добавку.
Другие шаги, которые вы можете предпринять для предотвращения дефицита железа, включают:
- Предлагайте продукты, богатые железом. Когда вы начинаете давать ребенку твердую пищу — обычно в возрасте от 4 до 6 месяцев — давайте ему продукты с добавлением железа, такие как обогащенные железом детские каши, мясное пюре и пюре из бобов. Для детей старшего возраста хорошими источниками железа являются красное мясо, курица, рыба, бобы и шпинат.
- Не переусердствуйте с молоком. В возрасте от 1 до 5 лет не позволяйте ребенку выпивать более 24 унций (710 миллилитров) молока в день.
- Повышение впитываемости. Витамин С способствует усвоению пищевого железа.Вы можете помочь своему ребенку усваивать железо, предлагая продукты, богатые витамином С, такие как цитрусовые, дыня, клубника, болгарский перец, помидоры и темно-зеленые овощи.
Должен ли я проверять своего ребенка на дефицит железа?
Дефицит железа и железодефицитная анемия обычно диагностируются с помощью анализов крови. Американская академия педиатрии рекомендует проверять всех детей грудного возраста на железодефицитную анемию, начиная с возраста 9–12 месяцев, а для тех, у кого есть факторы риска дефицита железа, повторно в более позднем возрасте.В зависимости от результатов скрининга врач вашего ребенка может порекомендовать пероральную добавку железа, ежедневный прием поливитаминов или дополнительные анализы.
Дефицит железа у детей можно предотвратить. Чтобы поддерживать рост и развитие вашего ребенка в нужном русле, предлагайте богатые железом продукты во время еды и перекусов и поговорите с врачом вашего ребенка о необходимости скрининга и добавок железа.
Получите самую свежую медицинскую информацию от экспертов Mayo Clinic.
Зарегистрируйтесь бесплатно и будьте в курсе последних научных достижений, советов по здоровью и актуальных тем, связанных со здоровьем, таких как COVID-19, а также экспертных знаний по управлению здоровьем.
Узнайте больше об использовании данных Mayo Clinic.Чтобы предоставить вам наиболее актуальную и полезную информацию, а также понять, какие информация полезна, мы можем объединить вашу электронную почту и информацию об использовании веб-сайта с другая информация о вас, которой мы располагаем.Если вы пациент клиники Майо, это может включать защищенную информацию о здоровье. Если мы объединим эту информацию с вашей защищенной медицинской информации, мы будем рассматривать всю эту информацию как информацию и будет использовать или раскрывать эту информацию только так, как указано в нашем уведомлении о практики конфиденциальности. Вы можете отказаться от получения сообщений по электронной почте в любое время, нажав на ссылка для отписки в письме.
Подписаться!
Спасибо за подписку
Наш электронный информационный бюллетень Housecall будет держать вас в курсе самой последней медицинской информации.
Извините, что-то пошло не так с вашей подпиской
Повторите попытку через пару минут
Повторить попытку
дек.07, 2021 Показать ссылки- Пауэрс Дж. М. и др. Дефицит железа у младенцев и детей младше 12 лет: скрининг, профилактика, клинические проявления и диагностика. https://www.uptodate.com/contents/search. По состоянию на 14 октября 2019 г.
- Железо. Национальные институты здоровья. https://ods.od.nih.gov/factsheets/Iron-HealthProfessional/. По состоянию на 14 октября 2019 г.
- Что такое железодефицитная анемия? Национальный институт сердца, легких и крови. https://www.nhlbi.nih.gov/health-topics/iron-deficiency-anemia.По состоянию на 14 октября 2019 г.
- Каушанский К. и др., ред. Дефицит железа и перегрузки. В: Гематология Уильямса. 9-е изд. Образование Макгроу-Хилл; 2016. https://accessmedicine.mhmedical.com. По состоянию на 14 октября 2019 г.
- Hay WW, et al., ред. Амбулаторная и офисная педиатрия. В кн.: Текущая диагностика и лечение: педиатрия. 24-е изд. Образование Макгроу-Хилл; 2018. https://accessmedicine.mhmedical.com. По состоянию на 14 октября 2019 г.
- Hoecker JL (экспертное заключение). Клиника Майо.21 октября 2019 г.
.
Железодефицитная анемия (для родителей) — Nemours KidsHealth
Что такое железодефицитная анемия?
Железодефицитная анемия — это анемия, возникающая при недостатке железа в организме.
У человека с анемией меньше эритроцитов (эритроцитов), чем обычно. Эритроциты содержат гемоглобин, белок, который переносит кислород по всему телу.Тело нуждается в железе для производства гемоглобина (HEE-muh-glow-bin). Без достаточного количества железа вырабатывается меньше гемоглобина и красных кровяных телец, что приводит к анемии.
Лечение препаратами железа обычно облегчает течение анемии.
Каковы признаки и симптомы железодефицитной анемии?
Сначала у детей с железодефицитной анемией может не быть никаких симптомов. Когда симптомы действительно проявляются, ребенок может:
- выглядеть бледно
- казаться капризным
- очень устал
- быстро устают от упражнений
- чувствовать головокружение или головокружение
- имеют учащенное сердцебиение
- имеют задержки в развитии и проблемы с поведением
- хочется есть лед или непродовольственные товары (пика)
Что вызывает железодефицитную анемию?
Железодефицитная анемия может возникнуть, когда:
- Существует проблема с усвоением железа организмом (например, при глютеновой болезни).
- У кого-то кровопотеря из-за травмы, обильных менструаций или кровотечения внутри кишечника.
- Кто-то не получает достаточного количества железа с пищей. Это может произойти в:
- дети, которые пьют слишком много коровьего молока, и младенцы, получающие коровье молоко в возрасте до 1 года
- вегетарианцев, потому что они не едят мясо, источник железа
- детей на грудном вскармливании, которые не получают добавки железа
- младенцев получали смесь с низким содержанием железа
- младенцев, родившихся преждевременно или маловесных, которым может потребоваться больше железа, чем содержит смесь или грудное молоко
Как диагностируется железодефицитная анемия?
Врачи обычно могут диагностировать железодефицитную анемию по:
- вопросы о симптомах
- спрашивают о диете
- узнать о состоянии пациента история болезни
- делает медицинский осмотр
- делать анализы крови, чтобы:
- посмотреть на эритроциты под микроскопом
- проверить количество гемоглобина и железа в крови
- проверить, как быстро производятся новые эритроциты
- сделать другие анализы крови, чтобы исключить другие виды анемии
Как лечить железодефицитную анемию?
Врачи лечат железодефицитную анемию препаратами железа, принимаемыми в виде жидкости или таблеток в течение не менее 3 месяцев.Чтобы железо усваивалось организмом:
- Избегайте приема железа с антацидами, молоком или чаем, так как они снижают способность организма усваивать железо.
- Принимайте железо перед едой (если это не вызывает расстройство желудка).
Человек с очень тяжелой анемией может получить препараты железа или переливание крови через внутривенный катетер.
Если железодефицитная анемия вызвана чем-то другим, кроме недостатка железа в рационе, лечение также может включать:
- средства для уменьшения кровотечения при обильных менструациях
- уменьшение количества коровьего молока в рационе
- лечение основного заболевания
Чем могут помочь родители?
Если у вашего ребенка железодефицитная анемия:
- Убедитесь, что ваш ребенок принимает железосодержащие добавки точно так, как это предписано.
- Включите в рацион семьи продукты, богатые железом. К хорошим источникам железа относятся:
- злаки, обогащенные железом
- нежирное мясо, птица и рыба
- тофу
- яичные желтки
- бобы
- изюм
- Во время еды подавайте фрукты и овощи с высоким содержанием витамина С или стакан апельсинового сока. Это помогает усваиваться железу.
- Поговорите с диетологом или врачом, если ваш ребенок вегетарианец.Они могут порекомендовать продукты, которые помогут вашему ребенку получить достаточное количество железа.
Для профилактики железодефицитной анемии у детей младшего возраста:
- Не давайте коровье молоко детям до 1 года.
- Ограничьте потребление коровьего молока детьми старше 1 года до менее чем 2 чашек молока в день. Предоставление им большего количества может заставить их чувствовать себя сытыми и уменьшить количество продуктов, богатых железом, которые они едят.
Распространенность и факторы риска анемии у детей в возрасте от 6 до 59 месяцев в Того: анализ данных демографического и медицинского обследования Того, 2013–2014 гг. | BMC Public Health
Данные, использованные в этом исследовании, взяты из третьего обследования населения Того в области демографии и здравоохранения (DHS-III), проведенного в 2013–2014 гг.DHS-III является частью программы DHS, возглавляемой Агентством США по международному развитию (USAID), которое проводит обследования домохозяйств в развивающихся странах с 1984 г. [19]. Подробности исследования можно найти в отчете DHS за 2013–2014 гг. [15]. МДИ регулярно проводятся среди больших выборок домохозяйств, представляющих население каждой страны. Их цель — предоставить правительствам свежую и достоверную информацию о показателях здоровья населения, чтобы можно было адаптировать политику в области здравоохранения.Одним из основных интересов этих обследований является однородность их методологии в разных странах, что позволяет в большинстве случаев сравнивать ситуации и получать глобальное видение [10]. МДИ занимается многими вопросами здравоохранения, включая репродукцию, здоровье детей (грудное вскармливание и питание, вакцинация, анемия, острые респираторные инфекции и диарея), малярию и вирус иммунодефицита человека (ВИЧ) [15].
Согласно отчету DHS за 2013–2014 гг. в Того [15], DHS-III направлен на получение результатов, репрезентативных для всей страны, отдельных городских и сельских районов, из города Ломе (столица Того). ), и из каждого из пяти регионов Того.
Поскольку анемия широко распространена среди детей в возрасте до 5 лет и вызывает серьезные нарушения развития дошкольников, мы ограничили наше исследование возрастной группой от 6 до 59 месяцев. В МДИ Того за 2013–2014 гг. было обследовано 3378 детей в возрасте от 6 до 59 месяцев. Из них 2890 детей имели результаты анализов на анемию и были включены в исследование». Веса обследования использовались в анализе для учета неравной вероятности отбора домохозяйств, вызванной схемой выборки и отсутствием ответов.Подробное объяснение процедуры взвешивания можно найти в отчете «Методология демографического и медицинского обследования» [20].
Переменная результата
Во время DHS-III анемия проверялась путем взятия проб крови в каждом втором домохозяйстве изучаемой популяции. Тесты проводились с использованием портативного прибора для измерения гемоглобина (HemoCue), который менее чем за минуту мог дать уровень гемоглобина в граммах на децилитр крови и, наконец, позволил записать значение в анкету [10].
По данным ВОЗ, у детей в возрасте от 6 мес до 5 лет уровень концентрации гемоглобина ниже 11,0 г/дл соответствует анемии, уровень ниже 7,0 г/дл считается тяжелой анемией, уровень между 7,0 г/дл и 9,9 г/дл считается умеренной анемией, а уровень между 10,0 г/дл и 10,9 г/дл считается легкой анемией [2]. Таким образом, зависимая переменная была закодирована на два уровня. Ребенок классифицировался как анемичный, если его уровень гемоглобина был ниже порога ВОЗ 11.0 г/дл.
Независимые переменные
Переменные, связанные с характеристиками ребенка
Среди выбранных независимых переменных некоторые были связаны с ребенком, такие как пол, возраст (разделены на три категории: 6–23 месяца, 24–42 месяца и 43–59 месяцев). ), прием добавок железа, состояние питания и диагностика малярии.
Состояние питания оценивали по антропометрическим показателям роста и веса ребенка. Для каждого индивидуума его соотношение рост/вес сравнивали со средним значением для популяции.Исходя из этого, статус питания был разделен на три категории. Подробное объяснение процедуры можно найти в Справочном руководстве по индикаторам питания для развития [21]. Таким образом, если у человека было стандартное отклонение ниже - 2, он считался страдающим от недоедания; если стандартное отклонение было между - 2 и 2, он считался нормальным, а если стандартное отклонение было больше 2, он считался избыточным весом.
Диагноз малярии был поставлен с помощью экспресс-теста, который давал либо положительный результат, означающий, что у ребенка малярия, либо отрицательный, если у ребенка малярии не было [10].
Переменные, относящиеся к матери ребенка
Также были отобраны переменные, относящиеся к матери ребенка: анемия (анемическая или нет), уровень образования (без образования, начальное или среднее образование и выше) и экономическая активность (в настоящее время работает или работала) в течение последних 12 месяцев не работает).
Переменные, относящиеся к характеристикам домохозяйства
В статистический анализ были включены доход семьи ребенка, регион проживания, место жительства (город/село) и жив ли его отец.
Статистический анализ
Мы провели описательный анализ данных, чтобы описать основные характеристики нашей подвыборки маленьких тоголезских детей, страдающих анемией. В этих анализах мы выполнили критерий хи-квадрат Рао-Скотта, чтобы определить, существует ли значительная разница между наблюдаемыми и ожидаемыми частотами.
Для оценки влияния каждой из индивидуальных, материнских и контекстуальных характеристик на анемию у детей Того в возрасте от 6 до 59 месяцев модели логистической регрессии использовались для оценки отношения шансов (ОШ) и их 95% доверительных интервалов (95% ДИ ).
Связь между независимыми переменными и анемией у детей была впервые исследована с использованием двумерной логистической регрессии. Все значимые переменные с p -значением критерия Вальда менее 0,20 были включены в многомерную модель. Незначимые переменные двумерного анализа, связь которых с анемией была показана в литературе, также были введены в модели многомерной регрессии. Окончательная модель была получена с использованием метода ручного выбора переменных на основе значения p для получения экономичной модели.
Все анализы проводились с использованием SAS (ПО для статистического анализа) версии 9.4.
Симптомы, типы, причины, риски, лечение и управление
Обзор
Что такое анемия?
Анемия возникает, когда у вас недостаточно эритроцитов. Клетки путешествуют с железом и гемоглобином, белком, который помогает переносить кислород через кровоток к вашим органам по всему телу. Когда у кого-то развивается анемия, его называют «анемичным».Анемия может означать, что вы чувствуете себя более усталым или холодным, чем обычно, или если ваша кожа кажется слишком бледной. Это происходит из-за того, что ваши органы не получают кислорода, необходимого им для выполнения своей работы. Некоторые люди обнаруживают, что у них низкий уровень кислорода. железо, когда идут сдавать кровь
Существуют ли разные виды анемии?
Существует несколько различных типов анемии, но каждый из них вызывает снижение количества эритроцитов в циркуляции. Уровень эритроцитов низкий по одной из следующих причин:
- Ваше тело не может вырабатывать достаточное количество гемоглобина (низкий гемоглобин).
- Ваше тело вырабатывает гемоглобин, но гемоглобин работает неправильно.
- Ваше тело не вырабатывает достаточно эритроцитов.
- Ваше тело слишком быстро расщепляет эритроциты.
Некоторые виды анемии, о которых вы, возможно, слышали, включают железодефицитную анемию и серповидноклеточную анемию.
Насколько распространена анемия?
Анемия затрагивает более двух миллиардов человек во всем мире, что составляет более 30% всего населения. Это особенно распространено в странах с ограниченными ресурсами, но также затрагивает многих людей в промышленно развитых странах.В США анемия является наиболее распространенным заболеванием крови. По оценкам, три миллиона американцев страдают этим расстройством.
У кого чаще всего развивается анемия?
У любого человека может развиться анемия, хотя следующие группы имеют более высокий риск:
- Женщины: Кровопотеря во время месячных и родов может привести к анемии. Это особенно верно, если у вас обильные менструации или такое состояние, как миома.
- Дети в возрасте от 1 до 2 лет: Во время скачков роста организму требуется больше железа.
- Младенцы: Младенцы могут получать меньше железа при переводе их с грудного молока или смеси на твердую пищу. Железо из твердой пищи не так легко усваивается организмом.
- Люди старше 65 лет: Люди старше 65 лет более склонны к бедному железом питанию и некоторым хроническим заболеваниям.
- Люди, принимающие препараты для разжижения крови: Эти лекарства включают такие препараты, как аспирин, клопидогрел (Плавикс®), варфарин (Кумадин®), препараты гепарина, апиксабан (Эликвис®), бетриксабан (БевиксХа®), дабигатран (Прадакса®), эдоксабан ( Савайса®) и ривароксабан (Ксарелто®).
Каковы признаки и симптомы анемии?
При всех типах анемии наблюдается несколько признаков и симптомов, таких как утомляемость, одышка и чувство холода. Другие включают:
- Головокружение или слабость.
- Головная боль.
- Больной язык.
- Бледная кожа, сухая кожа или кожа с легкими синяками.
- Непреднамеренные движения в голени (синдром беспокойных ног).
- Учащенное сердцебиение.
Как анемия влияет на организм?
Анемия может иметь и другие последствия для вашего тела, помимо чувства усталости или холода.Другие признаки того, что вам может не хватать железа, включают ломкие или ложкообразные ногти и возможное выпадение волос. Вы можете обнаружить, что ваше чувство вкуса изменилось, или вы можете почувствовать звон в ушах.
Различные виды анемии могут привести к другим серьезным проблемам. У людей с серповидноклеточной анемией часто возникают осложнения со стороны сердца и легких.
Если у вас анемия, которую не лечат, это может привести к аритмии (нерегулярному сердцебиению), увеличению сердца или сердечной недостаточности.Вы также подвержены большему риску заражения инфекциями и депрессии.
Возможно, вы слышали, что дефицит железа связан с жеванием льда, что действительно происходит. Жевание льда является признаком пикацизма, состояния, которое включает в себя употребление в пищу вещей, которые на самом деле не являются едой, например, мела или грязи. Таким образом, пикацизм также является признаком дефицита железа. Часто наблюдается у детей с анемией.
Как еще анемия влияет на детей?
Для детей важно, чтобы в их рационе было достаточно железа и других питательных веществ, чтобы предотвратить анемию и связанные с ней проблемы с дефицитом внимания, задержкой развития моторики и проблемами с обучением.У детей старшего возраста необходимо уделять больше внимания признакам анемии во время скачков роста и менструальных циклов.
Как анемия влияет на пожилых людей?
У пожилых людей анемия может еще больше влиять на спутанность сознания или депрессию. Слабость может затруднить ходьбу. Анемия может сократить продолжительность вашей жизни, если вы старше и не лечитесь.
Может ли анемия повлиять на мой вес?
Достаточное количество железа также может быть причиной проблем с весом. Исследования показали, что люди с избыточным весом могут похудеть, если они решат проблему низкого содержания железа в крови.Вы можете столкнуться с непреднамеренной потерей веса вместе с анемией, если у вас есть другие заболевания, такие как рак. У людей, перенесших операцию по снижению веса, может развиться анемия из-за дефицита витаминов и минералов.
Как анемия влияет на беременность?
Дефицит железа во время беременности увеличивает вероятность осложнений, таких как преждевременные роды. Исследования показали, что после рождения дети, рожденные женщинами с низким уровнем железа, имеют более высокий риск низкого веса при рождении и проблем с собственным уровнем железа.
Если вы беременны, у вас больше шансов заболеть железодефицитной анемией. Ваш будущий ребенок зависит от вас в плане железа и других питательных веществ. Многие беременные женщины принимают препараты железа для предотвращения анемии. Чтобы убедиться, что у вас достаточно железа для вас и вашего ребенка, ешьте хорошо сбалансированную пищу, включающую продукты, богатые железом, и продукты, содержащие витамины B12 и B9. Следуйте инструкциям вашего лечащего врача по приему витаминов и добавлению железа в свой рацион.
Узнать, что у вас анемия, — это только начало.Обнаружение причины анемии приведет вас к лучшему лечению.
Симптомы и причины
Что вызывает анемию?
Наиболее распространенной причиной анемии является низкий уровень железа в организме. Этот тип анемии называется железодефицитной анемией . Ваше тело нуждается в определенном количестве железа для производства гемоглобина, вещества, которое перемещает кислород по всему телу. Однако железодефицитная анемия — это всего лишь один тип. Другие типы вызваны:
- Диета с недостатком витамина B12, или вы не можете использовать или усваивать витамин B12 (например, пернициозная анемия).
- Диета с недостатком фолиевой кислоты, также называемой фолиевой кислотой, или ваш организм не может правильно использовать фолиевую кислоту (например, фолиево-дефицитная анемия).
- Наследственные заболевания крови (например, серповидноклеточная анемия или талассемия).
- Состояния, при которых эритроциты разрушаются слишком быстро (например, гемолитическая анемия).
- Хронические заболевания, из-за которых в организме не хватает гормонов для образования эритроцитов. К ним относятся гипертиреоз, гипотиреоз, прогрессирующее заболевание почек, волчанка и другие хронические заболевания.
- Потеря крови, связанная с другими состояниями, такими как язва, геморрой или гастрит.
Что вызывает железодефицитную анемию?
Заразиться железодефицитной анемией можно от:
- Кровотечение либо в результате быстрой потери большого количества крови (например, при серьезном несчастном случае), либо в результате потери небольшого количества крови в течение длительного периода времени. С кровопотерей организм теряет больше железа, чем может восполнить с пищей. Это может случиться с женщинами с обильными менструациями или с воспалительными заболеваниями кишечника.
- Недостаточное количество железа в рационе.
- Потребность в большем количестве железа, чем раньше (например, во время беременности или болезни).
Некоторые виды железодефицитной анемии называются другими названиями, связанными с причиной, например, анемия хронического заболевания (также называемая анемией воспаления) или острая анемия кровопотери.
Что вызывает типы анемии, которые не являются железодефицитной анемией?
Пернициозная анемия
Строго говоря, пернициозная анемия возникает, когда у человека отсутствует так называемый внутренний фактор, который позволяет ему усваивать витамин B12.Без витамина B12 организм не может вырабатывать здоровые эритроциты. Другие виды анемии, связанные с недостатком витаминов группы В, таких как В9 (фолиевая кислота), также часто относят к пернициозной анемии. Это название может относиться к другим состояниям, включая анемию из-за дефицита фолиевой кислоты и анемию Аддисона, даже если дефицита внутреннего фактора нет.
Гемолитическая анемия
Этот тип анемии может быть вызван наследственными или приобретенными заболеваниями, которые заставляют организм производить деформированные эритроциты, которые отмирают слишком быстро.(Приобретенное заболевание — это заболевание, которого у вас не было при рождении.) Если это не генетическое заболевание, гемолитическая анемия может быть вызвана вредными веществами или реакцией на определенные лекарства.
Серповидноклеточная анемия
Эта генетическая форма анемии возникает из-за неправильной формы эритроцитов. Они имеют серповидную форму, а это значит, что они могут закупоривать кровеносные сосуды и вызывать повреждения. Гемоглобин работает неправильно. Этот тип анемии чаще всего, но не всегда, встречается у афроамериканцев.
Анемия Даймонда-Блэкфана
Это редкое заболевание крови, которое может передаваться по наследству или приобретаться. При этом типе анемии костный мозг не вырабатывает достаточное количество эритроцитов. Анемия Даймонда-Блэкфана диагностируется в течение первого года жизни почти у 90% больных.
Апластическая анемия
Это тип анемии, вызванный повреждением костного мозга, который не может производить достаточное количество эритроцитов. Он также может быть врожденным или приобретенным.Другое название апластической анемии – аплазия костного мозга (недостаточность). Некоторые люди могут думать об этом заболевании как о раке, но это не так.
Существует нечто, называемое некоторыми людьми миелодиспластической анемией. Однако миелодипластические синдромы (МДС) относятся к реальному раку и являются результатом аномальных клеток в костном мозге.
Анемия Фанкони
Этот тип анемии также встречается редко и является генетическим. Это происходит потому, что костный мозг не вырабатывает достаточное количество эритроцитов.Существуют физические признаки этого состояния, такие как аномальная структура костей и аномальный цвет кожи. Около 50% людей с этим заболеванием диагностируют к тому времени, когда им исполняется 10 лет.
Средиземноморская анемия
Это состояние также известно как анемия Кули и на самом деле относится к большой бета-талассемии. Талассемии — это наследственные состояния, при которых ваше тело не вырабатывает нужное количество гемоглобина. В дополнение к тому, что этих клеток недостаточно, эритроциты живут не так долго, как у кого-то без этого заболевания.
Вегетарианская или веганская анемия
Этот термин относится к идее о том, что людям, которые являются вегетарианцами или веганами, трудно получать достаточное количество железа, потому что они не едят мясо, птицу или морепродукты. Однако тщательное планирование питания делает это утверждение ложным. Есть много способов получить достаточное количество железа с помощью растительной диеты.
Ваш поставщик медицинских услуг может также использовать термины для обозначения анемии, которые относятся к размеру эритроцитов. Эти слова включают такие термины, как макроцитарная анемия (крупнее нормальных клеток) или микроцитарная анемия (мельче нормальных клеток).
Диагностика и тесты
Как диагностируется анемия?
Ваш лечащий врач может провести анализ крови, чтобы определить, есть ли у вас анемия. Основным тестом является общий анализ крови, также называемый CBC. Общий анализ крови может сказать вам, сколько у вас эритроцитов, насколько они велики и какой формы. Анализы крови также могут сказать вам, не хватает ли вам витаминов B12 и B9 и сколько железа хранится в вашем организме.
Тип и количество анализов крови и других анализов будет зависеть от типа анемии, который, по мнению вашего врача, у вас есть.
- Анализы крови и мочи могут указать на гемолитическую анемию.
- Колоноскопия или анализ кала на скрытую кровь могут быть предложены для обнаружения желудочно-кишечного кровотечения.
- В некоторых редких случаях ваш врач может назначить биопсию костного мозга (удаление ткани костного мозга).
Тип анемии и ее причина позволят вашему поставщику медицинских услуг определить правильный вид лечения.
Управление и лечение
Как лечится анемия?
Во-первых, ваш лечащий врач выяснит, вызвана ли анемия неправильным питанием или более серьезной проблемой со здоровьем.Затем можно лечить как анемию, так и ее причину. Железодефицитную анемию лечат:
- Железосодержащие добавки для приема внутрь.
- Продукты с высоким содержанием железа и продукты, помогающие организму усваивать железо (например, продукты с витамином С).
- Железо вводится внутривенно (в/в). (Этот вариант часто выбирают, если у вас хроническое заболевание почек или ХБП.)
- Переливание эритроцитарной массы.
Если ваша анемия вызвана внутренним кровотечением, вашему врачу может потребоваться хирургическое вмешательство для его остановки.Хирургическое лечение используется для лечения анемии у людей с параэзофагеальным типом грыж пищеводного отверстия диафрагмы, с язвами или без них (так называемые язвы Кэмерона).
Другие типы анемии могут потребовать других видов лечения. Например, генетические заболевания (такие как бета-талассемия и серповидноклеточная анемия) могут потребовать трансплантации костного мозга.
Если ХБП вызывает анемию, в дополнение к добавкам железа (перорально или внутривенно) лечение может также включать инъекции эритропоэтина (ЭПО).ЭПО — это гормон, который сообщает костному мозгу производить эритроциты.
В некоторых случаях анемия также связана с раком — как с точки зрения того, что анемия является симптомом, так и с точки зрения лечения рака. Как лучевая, так и химиотерапия могут вызвать анемию. Возможно, потребуется приостановить дальнейшее лечение рака до тех пор, пока анемия не улучшится с помощью препаратов железа, переливаний крови, получения необходимых витаминов группы В и/или получения инъекций препаратов, стимулирующих выработку ЭПО в организме.
Является ли анемия смертельной?
Хотя большинство видов анемии можно лечить, анемия все же может привести к летальному исходу.По данным Центров по контролю и профилактике заболеваний, в 2017 году в США от анемии умирало 1,7 человека на 100 000 человек.
Профилактика
Как я могу предотвратить анемию?
Некоторые виды анемии, например наследственные, предотвратить невозможно. Тем не менее, вы можете предотвратить анемию, вызванную дефицитом железа, дефицитом витамина B12 и дефицитом витамина B9, правильно питаясь. Это включает в себя диету с достаточным количеством продуктов, которые обеспечивают железо и эти витамины, а также источники пищи с витамином С, чтобы помочь с усвоением.Убедитесь, что вы пьете достаточно воды. Некоторые исследования показали, что это помогает поддерживать высокий уровень гемоглобина.
Как справиться с анемией?
В то время как некоторые виды анемии являются кратковременными и легкими, другие могут длиться всю жизнь. Есть несколько способов помочь справиться с анемией, в том числе:
- Соблюдение здорового питания.
- Пить достаточное количество воды, чтобы избежать обезвоживания.
- Регулярные тренировки. Однако, если вы были слабы, вы должны начать тренироваться осторожно.Проконсультируйтесь со своим лечащим врачом о способах безопасного выполнения упражнений.
- Избегать контакта с химическими веществами, вызывающими анемию.
- Часто мойте руки, чтобы не заразиться.
- Правильный уход за зубами и регулярное посещение стоматолога.
- Говорите со своим врачом о любых изменениях симптомов.
- Отслеживайте свои симптомы, записывая их.
Какие продукты следует есть и каких следует избегать, если у меня анемия?
При анемии очень важно правильно выбирать продукты питания.Употребление нездоровой пищи означает, что вы получаете калории без питательных веществ. Вы также должны учитывать другие медицинские условия, которые у вас есть, когда вы делаете свой выбор продуктов питания.
Было показано, что некоторые вещества ухудшают усвоение железа. Не следует одновременно принимать препараты кальция и железа. Кроме того, вы можете исключить или ограничить следующие элементы:
- Продукты, содержащие танин, такие как кофе, чай и некоторые специи.
- Молоко.
- Яичные белки.
- Волокно.(Однако вам не следует полностью исключать клетчатку, потому что прием добавок железа может вызвать запор.)
- Соевый белок.
В общем, вы должны есть продукты, богатые железом, и продукты, содержащие витамины B12, B9 и C. Это означает, что вы можете наслаждаться большим количеством полезной для вас пищи, независимо от того, едите вы мясо или нет. Вы можете получить железо из растительных источников, таких как чечевица, шпинат и фисташки. Вы можете получить железо из источников белка, таких как нежирная говядина и индейка. Цельнозерновые и темные листовые овощи являются хорошими источниками витаминов группы В.Некоторые продукты даже обогащены железом.
Цитрусовые, ягоды и другие продукты, содержащие витамин С, такие как перец и помидоры, улучшают потребление железа. Это хорошая идея, чтобы получить совет от вашего поставщика медицинских услуг или, возможно, от зарегистрированного диетолога о том, как лучше всего есть, когда у вас анемия. Кроме того, убедитесь, что грейпфрут не взаимодействует с какими-либо лекарствами.
Важно знать, что вы можете сделать, чтобы позаботиться о себе как можно лучше.Также важно, чтобы вы и ваш лечащий врач вместе принимали решения о том, что лучше всего подходит для вас. Воспользуйтесь возможностью, чтобы попросить направление к зарегистрированному диетологу, если вы хотите помочь в составлении диеты, чтобы помочь с потреблением железа. Убедитесь, что вы задали все вопросы, которые у вас есть, чтобы вы могли быть уверены в продвижении вперед.
Ресурсы
Существуют ли ресурсы для людей с анемией?
В зависимости от того, какой тип анемии у вас или вы хотите узнать больше, вам могут быть полезны следующие ресурсы.
Отдаленные необратимые последствия дефицита железа
Дефицит железа в младенчестве с анемией или без нее связан с нарушением умственного и психомоторного развития [4][5][8][10][11][12][13][15][18][19][ 20, 21, 22, 23, 24, 25, 26, 28, 30, которые сохраняются, несмотря на длительную терапию препаратами железа [12, 17, 19, 20, 21]. [22][24][25][26][30][31], даже до 19 лет [15][21][25].
Ферритин и объем циркулирующих эритроцитов измеряют гематологические эффекты у младенцев лучше, чем Hct крови.[1][6]
Низкий уровень ферритина в младенчестве связан с изменением слуховой памяти распознавания [3], снижением умственных и психомоторных тестов в возрасте 5 лет [2], изменениями в зрительном внимании и приобретении понятий [7].
Дефицит железа в младенчестве был связан с астмой [9], длительными нарушениями сна [14][19][26], более медленным морганием [16], нарушением двигательных функций верхних конечностей [17], шизофренией во взрослом возрасте [21], нарушение социально-эмоционального поведения [23], долгосрочные измененные реакции пролактина [27], нарушение слуховой и зрительной реакции [31].
Дефицит железа встречается очень часто, даже у детей из развитых стран. [4][5][8].
Отсроченное пережатие пуповины может уменьшить железодефицитную анемию у доношенных детей даже в промышленно развитых странах и предотвратить все эти долгосрочные необратимые последствия [29].
Мы можем ожидать гораздо больше преимуществ от пренатального использования железа, помимо массы тела при рождении.
Ссылки
[1] Переливание. 2003 г., август; 43 (8): 1168-72.
Объем циркулирующих эритроцитов, измеренный с помощью биотинилированных эритроцитов, превосходит Hct для документирования гематологических эффектов отсроченного и немедленного пережатия пуповины у недоношенных новорожденных.
Штраус Р.Г., Мок Д.М., Джонсон К., Мок Н.И., Кресс Г., Кносп Л., Лобас Л., Шмидт Р.Л.
Кафедра патологии, Медицинский колледж Роя Дж. и Люсиль А. Карвер Университета Айовы, Больницы и клиники Университета Айовы, Айова-Сити, Айова 52242, США.
http://www.ncbi.nlm.nih.gov/pubmed/12869126
[2] J Pediatr. 2002 г., февраль; 140(2):165-70.
Концентрация ферритина в сыворотке пуповины и умственное и психомоторное развитие детей в возрасте пяти лет.
Тамура Т., Гольденберг Р.Л., Хоу Дж., Джонстон К.Е., Кливер С.П., Рэми С.Л., Нельсон К.Г.
Департамент наук о питании, Международный исследовательский центр Civitan, Алабамский университет в Бирмингеме, 35294-3360, США.
http://www.ncbi.nlm.nih.gov/pubmed/11865266
[3] Педиатр Рез. 2004 г., июнь; 55 (6): 1034-41.
Дефицит железа изменяет слуховую опознавательную память у новорожденных от матерей с диабетом.
Siddappa AM, Georgieff MK, Wewerka S, Worwa C, Nelson CA, Deregnier RA.
Отделение неонатологии, кафедра педиатрии, Миннесотский университет, Миннесота, 55455, США.
http://www.ncbi.nlm.nih.gov/pubmed/15155871
[4] J Paediatr Child Health. 1998 июнь; 34 (3): 250-3.
Статус железа и потребление железа с пищей у детей в возрасте от 6 до 24 месяцев в Аделаиде.
Оти-Боатенг П., Сешадри Р., Петрик С., Гибсон Р.А., Симмер К.
Департамент педиатрии и детского здоровья, Медицинский центр Флиндерс, Южная Австралия, Австралия.
http://www.ncbi.nlm.nih.gov/pubmed/9633972
[5] Arch Pediatr Adolesc Med. 1997 г., октябрь; 151 (10): 986-8.
Дефицит железа у детей в возрасте от 1 до 3 лет.Педиатрическая неудача?
Иден А.Н., Мир М.А.
Отделение педиатрии, Медицинский центр Вайкофф-Хайтс, Бруклин, Нью-Йорк, США.
http://www.ncbi.nlm.nih.gov/pubmed/9343007
[6] J Fam Pract. 1996 март; 42(3):237-40.
Неспособность гематокрита выявить дефицит железа у младенцев.
Kazal LA Jr.
Национальный фонд здравоохранения навахо, Мемориальный госпиталь Сейдж, Ганадо, Аризона 86505, США.
http://www.ncbi.nlm.nih.gov/pubmed/8636674
[7] Kobe J Med Sci.1995 г., апрель; 41 (1–2): 1–17.
Влияние дефицита железа и умственной стимуляции на когнитивные способности и развитие индонезийских детей.
Соевондо С.
Факультет психологии Индонезийского университета, Джакарта, Индонезия.
http://www.ncbi.nlm.nih.gov/pubmed/74
[8] Arch Fr Pediatr. 1989 авг.-сен.;46(7):487-90.
Тесты дефицита железа и психомоторного развития. Продольное исследование в возрасте от 10 месяцев до 4 лет.
Dommergues JP, Archambeaud MP, Ducot B, Gerval Y, Hiard C, Rossignol C, Tchernia G.
Департамент педиатрии, Госпиталь Бисетр, Ле-Кремлен-Бисетр.
http://www.ncbi.nlm.nih.gov/pubmed/2596947
[9] Лунг Индия. 2010 апр; 27(2):51-3.
Анемия как фактор риска астмы у детей.
Рамакришнан К., Бораде А.
Кафедра педиатрии, Медицинская школа Амрита, Кочи, Индия.
http://www.ncbi.nlm.nih.gov/pubmed/20616934
[10] J Child Neurol. 2011 Aug 29. [Epub перед печатью]
Влияние хронического дефицита железа на нейропсихологические домены у младенцев.
Бельтран-Наварро Б., Матуте Э., Васкес-Гарибай Э., Сарабозо Д.
Институт нейробиологии, Университет Гвадалахары, Гвадалахара, Халиско, Мексика.
http://www.ncbi.nlm.nih.gov/pubmed/21876067
[11] Дж. Нутр. 1 апреля 2011 г .; 141 (4): 740S-746S. Epub 2011 Feb 23.
Ранний дефицит железа оказывает влияние на мозг и поведение, согласующееся с дофаминергической дисфункцией.
Лозофф Б.
Центр человеческого роста и развития и отделение педиатрии и инфекционных заболеваний, Мичиганский университет, Анн-Арбор, MI 48109, США.
http://www.ncbi.nlm.nih.gov/pubmed/21346104
[12] Indian J Pediatr. 2011 Январь; 78(1):58-64. Epub 2010 Oct 15.
Нарушения развития и нейрофизиологические нарушения при дефиците железа у детей.
Мадан Н., Русия У., Сикка М., Шарма С., Шанкар Н.
Отделение патологии, Университетский колледж медицинских наук и больница Гуру Тег Бахадур, Нью-Дели, 110092, Индия.
http://www.ncbi.nlm.nih.gov/pubmed/20953851
[13] Педиатрия. 2010 г., август; 126 (2): e427-34.Epub 2010 Jul 26.
Железодефицитная анемия и когнитивная функция в младенчестве.
Картер Р.К., Джейкобсон Дж.Л., Берден М.Дж., Армони-Сиван Р., Додж Н.К., Анджелилли М.Л., Лозофф Б., Якобсон С.В.
Отделение неотложной медицины, Детская больница Бостона, Гарвардская медицинская школа, Бостон, Массачусетс, США.
http://www.ncbi.nlm.nih.gov/pubmed/20660551
[14] Sleep Med. 2010 авг; 11 (7): 637-42.
Нарушения сна и железодефицитная анемия в младенчестве.
Peirano PD, Algarín CR, Chamorro RA, Reyes SC, Duran SA, Garrido MI, Lozoff B.
Лаборатория функциональной нейробиологии сна, Институт питания и пищевых технологий (INTA), Чилийский университет, Сантьяго, Чили.
http://www.ncbi.nlm.nih.gov/pubmed/20620103
[15] Nutr Neurosci. 2010 апр;13(2):54-70.
Дефицит железа в младенчестве и нейрокогнитивные функции в 19 лет: свидетельство долговременного дефицита исполнительной функции и памяти распознавания.
Луковски А.Ф., Косс М., Берден М.Дж., Джонидес Дж., Нельсон К.А., Качироти Н., Хименес Э., Лозофф Б.
Кафедра психологии и социального поведения, Калифорнийский университет, Ирвин, Калифорния
, США.
http://www.ncbi.nlm.nih.gov/pubmed/20406573
[16] Дж. Нутр. 2010 май; 140(5):1057-61. Epub 2010 Mar 24.
Частота моргания у детей с железодефицитной анемией ниже, чем у детей без анемии с железодефицитом или железодефицитом.
Лозофф Б., Армони-Сиван Р., Качироти Н., Цзин Ю., Голуб М., Якобсон С.В.
Центр человеческого роста и развития и; 4Кафедра педиатрии и инфекционных болезней, Мичиганский университет, Анн-Арбор, MI 48109, США.
http://www.ncbi.nlm.nih.gov/pubmed/20335633
[17] Младенец Behav Dev. 2009 г., декабрь 32(4):366-75. Epub 2009 Jul 9.
Железодефицитная анемия в младенчестве и в развитии.
Shafir T, Angulo-Barroso R, Su J, Jacobson SW, Lozoff B.
Институт молекулярной и поведенческой неврологии (MBNI), Мичиганский университет, 205 Zina Pitcher Pl, Rm 1066, Ann Arbor, MI 48109-0720, USA .
http://www.ncbi.nlm.nih.gov/pubmed/195
[18] Мозг Dev.2010 март; 32(3):213-6. Epub 2009 Mar 26.
Влияние железодефицитной анемии на зрительный вызванный потенциал растущих детей.
Монга М., Валия В., Ганди А., Чандра Дж., Шарма С.
Кафедра физиологии, Всеиндийский институт медицинских наук, Нью-Дели, Индия.
http://www.ncbi.nlm.nih.gov/pubmed/19327925
[19] J Pediatr Gastroenterol Nutr. 2009 март; 48 Приложение 1:S8-15.
Сон и нейрофункции на протяжении всего развития ребенка: длительные последствия раннего дефицита железа.
Peirano PD, Algarín CR, Chamorro R, Reyes S, Garrido MI, Duran S, Lozoff B.
Лаборатория сна и функциональной нейробиологии, Институт питания и пищевых технологий (INTA), Чилийский университет, Сантьяго, Чили.
http://www.ncbi.nlm.nih.gov/pubmed/1
[20] Biochem Soc Trans. 2008 дек; 36 (часть 6): 1267-71.
Роль железа в развитии нервной системы: дефицит железа у плода и развивающийся гиппокамп.
Георгиев М.К.
Кафедра педиатрии, Отделение неонатологии, Медицинский факультет Университета Миннесоты, Миннеаполис, Миннесота 55455, США.
http://www.ncbi.nlm.nih.gov/pubmed/1
[21] Arch General Psychiatry. 2008 г., октябрь; 65 (10): 1136-44.
Дефицит железа у матери и риск шизофрении у потомства.
Insel BJ, Schaefer CA, McKeague IW, Susser ES, Brown AS.
Психиатрический институт штата Нью-Йорк, 1051 Riverside Dr, Unit 23, New York, NY 10032, USA.
http://www.ncbi.nlm.nih.gov/pubmed/18838630
[22] Нейротокс Рез. 2008 авг; 14 (1): 45-56.
Дефицит и избыток железа в головном мозге; когнитивные нарушения и нейродегенерация с вовлечением полосатого тела и гиппокампа.
Юдим МБ.
Ева Топф и Национальный фонд Паркинсона США, Центры передового опыта по исследованию нейродегенеративных заболеваний и отделение фармакологии, Институт семейных исследований Раппапорт, Медицинский факультет Технион, Хайфа, Израиль.
http://www.ncbi.nlm.nih.gov/pubmed/187
[23] J Pediatr. 2008 май; 152(5):696-702, 702.31-3. Epub 2007 Nov 19.
Взаимосвязь доза-реакция между дефицитом железа с анемией или без нее и социально-эмоциональным поведением младенцев.
Лозофф Б., Кларк К.М., Цзин Ю., Армони-Сиван Р., Ангелилли М.Л., Якобсон С.В.
Центр человеческого роста и развития, Мичиганский университет, Анн-Арбор, MI 48109-5406, США.
http://www.ncbi.nlm.nih.gov/pubmed/18410777
[24] Food Nutr Bull. 28 декабря 2007 г. (4 Дополнение): S560-71.
Дефицит железа и развитие ребенка.
Лозофф Б.
Центр человеческого роста и развития, кафедра педиатрии и инфекционных заболеваний, Мичиганский университет, 300 Н. Ингаллс, Анн-Арбор, Мичиган 48109-5406, США.
http://www.ncbi.nlm.nih.gov/pubmed/18297894
[25] Arch Pediatr Adolesc Med. 2006 ноябрь; 160 (11): 1108-13.
Двойное бремя дефицита железа в младенчестве и низкий социально-экономический статус: лонгитюдный анализ результатов когнитивных тестов до 19 лет.
Лозофф Б., Хименес Э., Смит Дж. Б.
Центр роста и развития человека и кафедра педиатрии и инфекционных заболеваний, Мичиганский университет, 300 N. Ingalls, Анн-Арбор, MI 48109, США.
http://www.ncbi.nlm.nih.gov/pubmed/17088512
[26] Food Nutr Bull. 2003 Декабрь; 24 (4 Приложение): S104-10.
Влияние железодефицитной анемии на когнитивные способности и неврологию в младенчестве и детстве.
Уолтер Т.
Институт питания и пищевых технологий Чилийского университета, Сантьяго.
http://www.ncbi.nlm.nih.gov/pubmed/17016952
[27] Педиатр Рез. 2006 ноябрь; 60 (5): 513-7. Epub 2006 Sep 11.
Дефицит железа в младенчестве предсказывает изменение реакции пролактина в сыворотке через 10 лет.
Felt B, Jimenez E, Smith J, Calatroni A, Kaciroti N, Wheatcroft G, Lozoff B.
Центр человеческого роста и развития, кафедра педиатрии и инфекционных заболеваний, Мичиганский университет, Анн-Арбор, MI 48109-0406, США .
http://www.ncbi.nlm.nih.gov/pubmed/16966351
[28] Общественное здравоохранение Азиатско-Тихоокеанского региона. 2005;17(1):19-21.
Железодефицитная анемия и развитие ребенка.
Хокама Т., Гуши Кен М., Носоко Н.
Материнство и дитя и глобальное здоровье, Школа наук о здоровье, Медицинский факультет, Университет Рюкю, Япония.
http://www.ncbi.nlm.nih.gov/pubmed/16044827
[29] Энн Троп Педиатр. 2004 март; 24(1):3-16.
Позднее пережатие пуповины как средство профилактики железодефицитной анемии у доношенных детей в развивающихся и промышленно развитых странах: систематический обзор.
ван Ринен П., Брабин Б.Дж.
Emma Kinderziekenhuis, Академический медицинский центр, Амстердам, Нидерланды.
http://www.ncbi.nlm.nih.gov/pubmed/15005961
[30] J Nutr. 2003 г., май; 133 (5 Дополнение 1): 1468S-72S.
Дефицит железа влияет на развитие и функционирование мозга.
Берд Дж.
Высшая программа по питанию, Государственный университет Пенсильвании, Юниверсити-Парк, Пенсильвания 16802, США.
http://www.ncbi.nlm.nih.gov/pubmed/12730445
[31] Педиатр Рез. 2003 г., февраль; 53 (2): 217–23.
Железодефицитная анемия в младенчестве: длительное влияние на функционирование слуховой и зрительной систем.
Algarín C, Peirano P, Garrido M, Pizarro F, Lozoff B.
Лаборатория сна и функциональной нейробиологии, INTA, Университет Чили, Чили.
http://www.ncbi.nlm.nih.gov/pubmed/12538778
Ранняя детская анемия и легкая или умеренная умственная отсталость | Американский журнал клинического питания
РЕЗЮМЕ
История вопроса: В предыдущих исследованиях была поставлена под сомнение связь между анемией в раннем детстве и нарушением развития ребенка.
Цель: Было проведено популяционное исследование для изучения связи между анемией в раннем детстве и легкой или умеренной задержкой металлов в возрасте 10 лет.
Дизайн: В настоящем исследовании были сопоставлены данные о питании детей раннего возраста, собранные Специальной дополнительной программой для женщин, младенцев и детей (WIC), и школьные записи. Значения гемоглобина использовались для определения связи между анемией в раннем возрасте и помещением детей в специальные учебные классы с легкой или умеренной умственной отсталостью. Все испытуемые были участниками программы WIC. Для связи данных о рождении, WIC и школьных записях использовалась компьютерная программа.
Результаты: Логистическая регрессия показала повышенную вероятность легкой или умеренной умственной отсталости, связанной с анемией, независимо от массы тела при рождении, образования матери, пола, расовой и этнической принадлежности, возраста матери или возраста ребенка на момент поступления в программу WIC. .
Заключение: Эти данные подтверждают предположение о том, что усилия по профилактике легкой и умеренной умственной отсталости должны включать обеспечение детей адекватным питанием в раннем детстве.
Дефицит железа, анемия, умственная отсталость, развитие ребенка, гемоглобин, дети, связь данных, программа WIC, Специальная дополнительная программа для женщин, младенцев и детейВВЕДЕНИЕ
В последние 20 лет стали очевидны возможные отдаленные последствия железодефицитной анемии для развития ребенка. Недавние исследования показали, что тяжелая анемия влияет как на умственное, так и на моторное развитие детей (1–8). Неясно, поддаются ли коррекции дефицит железа и его поведенческие эффекты, особенно в отношении долгосрочных результатов развития.Дефицит железа наиболее распространен в течение первых 2 лет жизни, когда мозг младенца все еще развивается. Тяжелая железодефицитная анемия в этот период может привести к стойкому неврологическому повреждению (9). Биохимические исследования людей и животных позволили предположить наличие основного нервного механизма, связывающего дефицит железа и поведенческие аномалии, и показать, что дефицит железа является биологически вероятной причиной нарушения развития (10–13).
Впервые Oski и Honig сообщили об эффективности лечения внутримышечным введением железа в лечении как дефицита железа, так и поведенческих эффектов этого дефицита (14).Сообщалось также об улучшении показателей умственного развития у младенцев без анемии и дефицита железа после краткосрочного внутримышечного введения железа (15). Некоторое улучшение поведенческих показателей у малышей или детей школьного возраста было обнаружено после лечения пероральными добавками (3, 4). Большинство других исследований, изучающих краткосрочные эффекты, не выявили улучшения (1, 2).
Более поздние исследования показали, что долгосрочные последствия железодефицитной анемии в младенчестве могут быть постоянными (5).Длительный или тяжелый дефицит железа может не реагировать на терапию препаратами железа и может быть связан с более неблагоприятными исходами при длительном наблюдении даже после терапии препаратами железа (2, 6, 7). Аналогичные результаты были получены, когда контролировались образование матери, социальный класс, масса тела при рождении и коэффициент интеллекта родителей (5–8). Некоторые исследования показали, что тяжелый или хронический дефицит железа может быть связан с необратимыми последствиями для развития мозга (2, 6, 7).
В ответ на высокий уровень железодефицитной анемии и плохой рост среди детей с низким доходом в федеральных центрах была начата Специальная дополнительная программа для женщин, младенцев и детей (WIC) по сокращению распространенности дефицита железа. 1973.Одной из целей программы WIC является предоставление пищевых добавок беременным женщинам с низким доходом, их младенцам и детям. Участие в программе WIC привело к улучшению состояния питания и увеличению массы тела при рождении детей из малообеспеченных семей (16). Однако общая эффективность программы еще не ясна (17).
В настоящем исследовании изучались возможные долгосрочные эффекты железодефицитной анемии на успеваемость в выборке детей, подверженных риску недостаточного питания.Информация из записей о рождении и записей программы WIC была связана с необходимостью специального образования из-за легкой или умеренной умственной отсталости.
ПРЕДМЕТЫ И МЕТОДЫ
Субъектов
Мы связали записи участников программы WIC с записями о рождении и школьных записях с помощью автоматизированной компьютерной системы связи. Набор записей о рождении состоял из всех записей о рождении в округе Дейд, штат Флорида, за 1979 и 1980 годы. Набор школьных записей состоял из всех школьных записей округа Дейд за 1990 и 1991 годы.Набор записей WIC содержал записи округа Дейд для детей, родившихся в 1979 или 1980 году и участвовавших в программе WIC в возрасте от рождения до 5 лет. Записи о рождении в округе Дейд за 1979 и 1980 годы были связаны в предыдущем исследовании со школьными записями округа Дейд за 1990 и 1991 годы (18). Эта связь, которую мы будем называть связью рождения и школы, содержала информацию по каждому предмету при рождении и в возрасте 10 лет (<5-го класса). Этот исходный возраст был выбран потому, что уровень образовательных недостатков достигает пика в 10-летнем возрасте (19).Мы связали наборы записей, используя код Информационной системы разведки штата Нью-Йорк для фамилии, имени, даты рождения и пола. Коды и идентификаторы были выбраны в соответствии с теми, которые использовались в предыдущем исследовании (18). Около 93% подходящих школьных записей были связаны с записями о рождении.
Тот же самый метод был использован для связи записей школы рождения с записями WIC по надзору за питанием. Затем на основе этого набора данных был проведен анализ результатов. Эти записи будут называться связью «рождение-школа-питание».После того, как все записи были связаны, идентификаторы были удалены из данных. Таким образом, личность субъекта оставалась конфиденциальной. Записи о 5411 субъектах были найдены во всех 3 источниках данных. Около 69% выборки были черными, 23% — латиноамериканцами и 7% — белыми. Схема передачи данных показана на рис. 1.
РИСУНОК 1.
Описание канала передачи данных.
РИСУНОК 1.
Описание передачи данных.
Переменные
Анемия, вызванная тяжелым дефицитом железа, представляет собой третью стадию дефицита железа, при которой значения гемоглобина или гематокрита на ≥2 СО ниже возрастных и половых норм (9, 20).Недостаточное количество железа в рационе является наиболее частой причиной анемии у детей в США, хотя существуют и другие причины, не связанные с питанием. В больших группах населения в Соединенных Штатах концентрация гемоглобина может служить эффективным показателем статуса питания железом. В этом исследовании низкие концентрации гемоглобина используются для представления третьей стадии дефицита железа.
Переменными, включенными в уравнение регрессии, были гемоглобин, масса тела при рождении, образование матери, пол, расовая и этническая принадлежность, возраст матери и возраст ребенка на момент поступления в программу WIC.Распространенность и средние значения исследуемых переменных показаны в Таблице 1. Концентрации гемоглобина и возраст ребенка сообщались программой WIC и были получены из записей WIC по надзору за питанием. Концентрацию гемоглобина кодировали в граммах на литр. Возраст ребенка на момент включения в программу WIC кодировался в месяцах. Масса тела при рождении, образование матери, пол, раса, этническая принадлежность и возраст матери были получены из записи о рождении. Вес при рождении кодировался как очень низкий (<1500 г), низкий (от 1500 до <2500 г) и нормальный (≥2500 г).Материнское образование было закодировано как низкое (<12 лет), нормальное (12 лет) и высокое (>12 лет). Расово-этническая принадлежность кодировалась как белый, черный или латиноамериканец, а возраст матери кодировался как <18, 18–35 и >35 лет.
ТАБЛИЦА 1Переменные и определения исследования, источники данных и распространенность (или средние значения)
| Переменная и определение . | Источник . | Распространенность или среднее значение . | |||||
|---|---|---|---|---|---|---|---|
| Гемоглобин (г/л) | Карта питания | 115.6 ± 13.3 1 | |||||
| Масса рождения (%) | Рождения Record | ||||||
| 1,1 | |||||||
| Low (1500 до <2500 г ) | 8.6 | ||||||
| Нормальный (≥2500 г) | |||||||
| Материнское образование (%) | Министерства рождения | ||||||
| Low (<12 y) | 48.6 | ||||||
| Нормальный (12 лет) | 40.1 | ||||||
| 11.2 | Мужской секс (%) | Рождения Record | 47.2 | ||||
| Гонка-этническая принадлежность (%) | Рождения Record | ||||||
| 94.1 | |||||||
| Белый | 5.8 | ||||||
| Age Of Mountain (%) | рождаемость | ||||||
| 15.6 | |||||||
| (18-35 y) | 79.7 | ||||||
| (> 35 Y) | 4,6 | ||||||
| Age of Child в въезде в программу WIC (MO) 2 | рекорд питания | 13.13 ± 10.41 | |||||
| Mild или умеренная умственная отсталость ( %) 3 | Школьная книжка | 2 |
| Переменная и определение . | Источник . | Распространенность или среднее значение . | ||
|---|---|---|---|---|
| Record | 115,6 ± 13.3 | 1 | ||
| Масса при рождении (%) | Рождения Record | |||
| Очень низкий (<1500 g) | 1.1 | 1,1 | ||
| Низкая (1500 до <2500 г) | 8,6 | |||
| Нормальный (≥2500 г) | 90.3 | |||
| Материнское образование (%) | рождения | |||
| минимума (<12 y) | 48.6 | |||
| Нормальный (12 лет) | 40.1 | |||
| (> 12 y) | 11.2 | |||
| Мужской секс (%) | Рождения Record | 47.2 | ||
| Race-Enhytify (%) | Рождения Record | |||
| Black | 74.1 | |||
| испаноязычные | 20,1 | |||
| Белый | 5,8 | |||
| Возраст матери (%) | записи о рождении | |||
| (<18 лет) | 15.6 | |||
| (18-35 y) | (18-35 y) | 79.7 | ||
| 4,6 | 4,6 | |||
| Age of Child of Propertain в WiC (MO) 2 | Паспорт питания | 13.13 ± 10.41 | ||
| Мягкая или умеренная умственная отсталость (%) 3 | Школьная запись | 2 | 2 |
Таблица 1
Учебные переменные и определения, источники данных и преобладающие (или средства)
| Переменная и определение . | Источник . | Распространенность или среднее значение . | |||||
|---|---|---|---|---|---|---|---|
| Гемоглобин (г/л) | Карта питания | 115.6 ± 13.3 1 | |||||
| Масса рождения (%) | Рождения Record | ||||||
| 1,1 | |||||||
| Low (1500 до <2500 г ) | 8.6 | ||||||
| Нормальный (≥2500 г) | |||||||
| Материнское образование (%) | Министерства рождения | ||||||
| Low (<12 y) | 48.6 | ||||||
| Нормальный (12 лет) | 40.1 | ||||||
| 11.2 | Мужской секс (%) | Рождения Record | 47.2 | ||||
| Гонка-этническая принадлежность (%) | Рождения Record | ||||||
| 94.1 | |||||||
| Белый | 5.8 | ||||||
| Age Of Mountain (%) | рождаемость | ||||||
| 15.6 | |||||||
| (18-35 y) | 79.7 | ||||||
| (> 35 Y) | 4,6 | ||||||
| Age of Child в въезде в программу WIC (MO) 2 | рекорд питания | 13.13 ± 10.41 | |||||
| Mild или умеренная умственная отсталость ( %) 3 | Школьная книжка | 2 |
| Переменная и определение . | Источник . | Распространенность или среднее значение . | ||
|---|---|---|---|---|
| Record | 115,6 ± 13.3 | 1 | ||
| Масса при рождении (%) | Рождения Record | |||
| Очень низкий (<1500 g) | 1.1 | 1,1 | ||
| Низкая (1500 до <2500 г) | 8,6 | |||
| Нормальный (≥2500 г) | 90.3 | |||
| Материнское образование (%) | рождения | |||
| минимума (<12 y) | 48.6 | |||
| Нормальный (12 лет) | 40.1 | |||
| (> 12 y) | 11.2 | |||
| Мужской секс (%) | Рождения Record | 47.2 | ||
| Race-Enhytify (%) | Рождения Record | |||
| Black | 74.1 | |||
| испаноязычные | 20,1 | |||
| Белый | 5,8 | |||
| Возраст матери (%) | записи о рождении | |||
| (<18 лет) | 15.6 | |||
| (18-35 y) | (18-35 y) | 79.7 | ||
| 4,6 | 4,6 | |||
| Age of Child of Propertain в WiC (MO) 2 | Паспорт питания | 13.13 ± 10.41 | ||
| Мягкая или умеренная умственная отсталость (%) 3 3 | Школьная рекорд | 2 | 2 |
. Переменная результата для анализа была легкой или умеренной умственной отсталостью на основе используемых критериев Департаментом образования Флориды для размещения специального образования. Умственная отсталость легкой или средней степени тяжести определяется как умственно отсталые, поддающиеся обучению, или умственно отсталые, поддающиеся обучению (21). Эта информация была получена из школьной документации.
Процедура
Мы использовали логистическую регрессию для оценки связи между анемией и легкой или умеренной умственной отсталостью с учетом массы тела при рождении, образования матери, пола, расовой и этнической принадлежности, возраста матери и возраста ребенка. Основное влияние каждой переменной на результат оценивалось при контроле всех остальных переменных в уравнении. Анализы проводились с помощью SPSS (SPSS Inc, Чикаго).
Обратная величина концентрации гемоглобина (для сохранения положительной направленности результатов) и возраст ребенка были введены в уравнение регрессии как непрерывные переменные.Показатели гемоглобина были собраны для субъектов во время включения в программу WIC. Это было определено как самая ранняя дата посещения для каждого ребенка, независимо от того, в какой клинике ребенок побывал, и независимо от того, лечился ли этот ребенок в рамках программы. Возраст детей на момент первого визита колебался от 0 до 58,3 мес (x̄ ± SD: 12,7 ± 10,6 мес).
Масса тела при рождении, образование матери, пол, раса, этническая принадлежность и возраст матери были введены как категориальные переменные; использовались простые контрасты.Референтными группами были группы с самым низким риском: нормальный вес при рождении, образование >12 лет, женский, белый и возраст матери <18 лет соответственно.
Анализы сравнивали детей с легкой или умеренной умственной отсталостью с теми, у кого были нормальные достижения; 736 детей с другими типами специального образования, такими как сенсорные или физические недостатки, не были включены. Кроме того, из анализа были исключены 60 детей, для которых отсутствовали данные об образовании матерей, и 848 детей, для которых отсутствовали данные о концентрации гемоглобина.Полные данные были доступны для 3771 ребенка.
РЕЗУЛЬТАТЫ
Предварительные анализы
Предварительный анализ демографического состава связанных групп населения показал, что связанная выборка исследования (рождение-школа-питание) значительно отличалась от выборки рождения-школы по нескольким переменным, различия, которые ожидались, поскольку программа WIC обслуживает малоимущих семьи. В выборке исследования был более высокий процент детей с ограниченными возможностями в обучении, более высокий процент чернокожих и более низкие средние значения массы тела при рождении, гестационного возраста при рождении, уровня образования матери и возраста матери, чем у населения школы рождения.По сравнению с несвязанной популяцией, принимавшей только питание, выборка исследования отличалась по двум переменным: проценту чернокожих и проценту детей с низким уровнем гемоглобина, оба из которых были ниже в выборке исследования (22). Таким образом, выборочная совокупность демографически отличалась от детей, идентифицированных по связи между рождением и школой или по данным только о питании. Статистическое сравнение средней концентрации гемоглобина выборочной популяции с общей популяцией по шкале z было значимым.Однако различия были небольшими; параметры выборки ( x — ± SD: 115,6 ± 13,3 г/л) в целом были аналогичны параметрам популяции (μ = 116,0, σ = 14,3 г/л).
Анализ результатов
В табл. значимо после того, как все ковариаты были введены в уравнение [отношение шансов (OR): 1.28; 95% ДИ: 1,05, 1,60]. Таким образом, при каждом снижении уровня гемоглобина риск легкой или умеренной умственной отсталости увеличивался на 1,28, даже после того, как мы учитывали все другие переменные в уравнении. ТАБЛИЦА 2Коэффициенты регрессии и скорректированные отношения шансов для связи между факторами риска и легкой или умеренной умственной отсталостью 1
| Переменная . | Отношение шансов (95% ДИ) . | |
|---|---|---|
| гемоглобин (г / л) | 1.28 | 2 (1.05, 1.60) |
| веса рождения | ||
| очень низкий | 4,58 2 (1.04, 20.12) | |
| Низкий | 2,50999 3 (1.36, 4.61) | |
| Образование матери | ||
| Low | 11.94 2 (1.63, 88.08) | |
| Нормальный | 8.32 | 8.32 2 (1.12, 62,0) |
| Мужской секс | 2.17 3 (1.33, 3.53) | |
| гонки или этническая принадлежность | ||
| Espanic | 0.39 (0.12, 1.22) | |
| (0.31, 2.02) | ||
| 18-35 y | 2.51 2 (1.11, 5.69) | |
| > 35 y | 4,27 | 2 2 (1.38, 13.2)|
| Возраст ребенка при въезде в программу WIC (в МО) | 1,03 3 (1,01, 1,05) |
| Переменная . | Отношение шансов (95% ДИ) . | |
|---|---|---|
| Гемоглобин (г/л) | 1,28 2 (1.05, 1.60) | |
| Вес рождения | ||
| 458 2 (1.04, 20.12) | ||
| Low | 2,509999 3 (1.36, 4.61) | |
| Образование матери | ||
| Низкий | 11.94 2 (1.63, 88.08) | |
| Normal | 8.32 2 (1.12, 62.0) | |
| мужской секс | 2.17 | 3 (1.33, 3.53) |
| Espanic | 0.39 (0.12, 1.22) | |
| черный | 0.79 (0.31, 2.02) | |
| Age Of Mother | ||
| 18-35 y | 2911 | 2 (1.11, 5.69) |
| > 35 y | 4.27 2 (1.38, 13.2) | |
| Возраст ребенка при входе в программу WIC (в МО) | 1.03 3 (1.01, 1.05) |
Коэффициенты регрессии и скорректированные отношения шансов для связи между факторами риска и легкой или умеренной умственной отсталостью 1
| Переменная . | Отношение шансов (95% ДИ) . | |
|---|---|---|
| гемоглобин (г / л) | 1.28 | 2 (1.05, 1.60) |
| веса рождения | ||
| очень низкий | 4,58 2 (1.04, 20.12) | |
| Низкий | 2,50999 3 (1.36, 4.61) | |
| Образование матери | ||
| Low | 11.94 2 (1.63, 88.08) | |
| Нормальный | 8.32 | 8.32 2 (1.12, 62,0) |
| Мужской секс | 2.17 3 (1.33, 3.53) | |
| гонки или этническая принадлежность | ||
| Espanic | 0.39 (0.12, 1.22) | |
| (0.31, 2.02) | ||
| 18-35 y | 2.51 2 (1.11, 5.69) | |
| > 35 y | 4,27 | 2 2 (1.38, 13.2)|
| Возраст ребенка при въезде в программу WIC (в МО) | 1,03 3 (1,01, 1,05) |
| Переменная . | Отношение шансов (95% ДИ) . | |
|---|---|---|
| Гемоглобин (г/л) | 1,28 2 (1.05, 1.60) | |
| Вес рождения | ||
| 458 2 (1.04, 20.12) | ||
| Low | 2,509999 3 (1.36, 4.61) | |
| Образование матери | ||
| Низкий | 11.94 2 (1.63, 88.08) | |
| Normal | 8.32 2 (1.12, 62.0) | |
| мужской секс | 2.17 | 3 (1.33, 3.53) |
| Espanic | 0.39 (0.12, 1.22) | |
| черный | 0.79 (0.31, 2.02) | |
| Age Of Mother | ||
| 18-35 y | 2911 | 2 (1.11, 5.69) |
| > 35 y | 4.27 2 9002 (1.38, 13.2) | |
| Возраст ребенка при входе в программу WIC (в МО) | 1.03 3 (1.01, 1.05) |
Дети матерей дети с низким уровнем образования и дети матерей с нормальным образованием в 11,94 и 8,32 раза чаще, соответственно, относились к категории слабо или умеренно отсталых, чем дети матерей с высоким образованием. Детей с очень низкой массой тела при рождении и детей с низкой массой тела при рождении было 4.в 58 и 2,50 раза выше вероятность, соответственно, быть классифицированными как дети с легкой или средней степенью умственной отсталости, чем дети с нормальным весом при рождении. Мужчины в 2,17 раза чаще классифицировались как умственно отсталые, чем женщины. Дети матерей в возрасте 18–35 лет в 2,51 раза чаще классифицировались как дети с легкой или умеренной умственной отсталостью, а дети матерей в возрасте старше 35 лет — в 4,27 раза чаще, чем дети матерей моложе 18 лет. Кроме того, чем старше ребенок при поступлении в программу WIC, тем больше вероятность того, что его поместят в специальное учебное заведение из-за умственной отсталости легкой или средней степени тяжести.
ОБСУЖДЕНИЕ
Наши результаты подтверждают положение о том, что дефицит железа, о чем свидетельствует ограниченная выработка гемоглобина, в значительной степени связан с легкой или умеренной умственной отсталостью. Влияние дефицита железа сохраняется в популяции с низким социально-экономическим статусом даже после того, как учитывается влияние массы тела при рождении, образования матери, пола, расовой и этнической принадлежности, возраста матери и возраста ребенка при поступлении в программу WIC. Эти данные показывают, что риск легкой или умеренной умственной отсталости увеличивается с увеличением тяжести анемии.
Эти выводы имеют несколько следствий.
Уменьшение дефицита железа в раннем детстве может помочь уменьшить бремя неспособности к обучению в более позднем детстве.
Усилия, направленные на уменьшение дефицита железа у населения, такие как программа WIC, могут иметь долгосрочные преимущества.
Долгосрочная академическая успеваемость и стоимость услуг специального образования являются важными факторами при изучении последствий дефицита железа.
Обобщение результатов за пределами популяции WIC должно производиться с осторожностью. Как и ожидалось, результаты предварительного анализа в предыдущем исследовании (22), сравнивающем набор связанных данных с наборами несвязанных данных, показали различия между связанными группами населения. Поскольку анализы были рассчитаны с использованием данных о населении WIC в округе Дейд, которое демографически отличается от населения в целом, результаты не могут быть обобщены за пределами выборки.Выборка исследования в целом подвергалась большему риску неблагоприятных исходов, чем население округа Дейд в целом. Результаты показывают, что существует значительная связь между дефицитом железа и легкой или умеренной умственной отсталостью в выборке с высоким риском. Размер эффекта может быть другим в выборке с более низким риском.
Наши результаты могут быть использованы для демонстрации связи между концентрацией железа в раннем детстве и развитием, но не являются доказательством причинно-следственной связи. Чтобы обсудить, влияют ли низкие концентрации гемоглобина непосредственно на когнитивные функции, необходимо предположить, и это предположение часто вызывает споры (23, 24).Используемый нами метод позволил предположить наличие связи между фактором риска (в данном случае концентрацией железа) и исходом (в данном случае помещением в обучаемое или обучаемое специальное учебное заведение для умственно отсталых). Представленные здесь данные указывают на то, что когнитивные последствия тяжелого дефицита железа теоретически можно облегчить с помощью лечения и профилактики тяжелого дефицита железа в младенчестве и раннем детстве. Наблюдаемое отношение обеспечивает поддержку причинного аргумента.Однако, чтобы окончательно установить причинно-следственную связь, необходимо было бы разработать эксперимент, в котором младенцы и дети с дефицитом железа были бы случайным образом распределены по группам лечения, альтернатива, которую невозможно было исследовать с использованием набора архивных данных, доступных для настоящего исследования.
Некоторые промежуточные переменные могут быть причиной неблагоприятного исхода. Например, дети с дефицитом железа могут быть более восприимчивы к отравлению свинцом (25), которое может вызвать некоторые из тех же побочных эффектов, что и дефицит железа (26).Однако эпидемиологические исследования токсичности свинца показали, что концентрация свинца у детей в южной Флориде низкая (27). Различия в реакции на терапию препаратами железа могут быть связаны с несвязанными заболеваниями (28) или дефицитом витамина А (29). Низкая масса тела при рождении может быть индикатором недостаточности питания матери, что, в свою очередь, может также играть роль в недостаточности питания младенцев, дефиците железа и когнитивном развитии (30).
Другие факторы окружающей среды, работающие или возникающие вместе, также могут оказывать влияние на развитие ребенка.Как и в предыдущих исследованиях, факторы риска, такие как низкая масса тела при рождении, низкий уровень образования матери и мужской пол ребенка, создавали значительный дополнительный риск неблагоприятного исхода (31). Важно отметить результаты, полученные при изучении возраста матерей. Подростковое материнство часто является фактором риска неблагоприятного исхода для ребенка; однако в этой выборке WIC матери-подростки подвергались наименьшему риску. Анализ имеющихся данных выходит за рамки имеющихся данных, чтобы проанализировать, какие факторы способствовали такому выводу. Одно из объяснений может заключаться в критериях участия в программе WIC.По сравнению с пожилыми матерями, матери-подростки могут легче соответствовать требованиям низкого дохода с меньшими дополнительными характеристиками риска. Однако этот вывод может также быть статистическим артефактом, поскольку в логистической регрессии учитывались другие факторы риска, такие как низкий уровень образования, связанный с возрастом матери (32).
Другие исследования пытались контролировать факторы питания, социально-экономический статус, низкий вес при рождении и другие факторы окружающей среды, которые, как считается, связаны с поведенческим развитием.Согласно мультисистемной теории, эти переменные естественным образом встречаются в окружающей среде вместе. Поэтому, поскольку эти переменные взаимодействуют, становится все труднее определить их индивидуальные эффекты (33). Экологически эти «контрольные» переменные сосуществуют с дефицитом железа и могут действовать совместно с ним, препятствуя оптимальному развитию ребенка. Важно учитывать, что исследования, в которых предпринимаются попытки отделить показатели недостаточности питания, такие как дефицит железа, от других видов неблагоприятного воздействия окружающей среды, могут неадекватно разделять факторы, которые встречаются вместе естественным образом и поэтому не могут быть дифференцированы.Усилия по вмешательству могут быть наиболее эффективными, если они направлены на детей с множественными факторами риска, включая дефицит железа. Четкая связь, которую мы обнаружили между степенью дефицита железа и потребностью ребенка в специальном обучении из-за легкой или умеренной умственной отсталости, поддерживает усилия по обеспечению надлежащего питания матерей, младенцев и детей младшего возраста.
Мы благодарим Джорджа Шмидта из Департамента здравоохранения и реабилитационных служб за помощь в реализации этого проекта, а также глубоко признательны Кэрол Бусси и Клеантису Гузису за их работу над первоначальной связью данных о школе рождения.Мы также благодарим Рэя Йипа, Марсию Скотт, Рика Урбано, Гвен Вурм и Пьера Декуфле за их интерес и предложения по подготовке этой статьи.
ССЫЛКИ
1Lozoff
B
,BRINTORHAM
,GM
,GM
,Vitei
Fe
,Wolf
AW
,Urrutia
JJ
.Влияние краткосрочной пероральной терапии препаратами железа на нарушения развития у новорожденных с железодефицитной анемией
.J Pediatr
1982
;100
:351
–7
.2Вальтер
Т
.Младенчество: умственное и двигательное развитие
.Am J Clin Nutr
1989
;50
:655
—655
—66
.3Pollitt
E
,Leibel
RL
,Greenfield
дБ
.Дефицит железа и результаты когнитивных тестов у детей дошкольного возраста
.Нутр Бехав
1983
;1
:137
—46
.4 —46
.4Aukett
MA
,Parks
Ya
,Scott
pH
,Wharton
BA
.Лечение препаратами железа увеличивает прибавку в весе и психомоторное развитие
.Arch Dis Child
1986
;61
:849
–57
.5Палти
Н
,Мейер
А
,А
,2 Адлер
Учебные достижения и поведение в школе анемичных и неанемичных младенцев
.Early Hum Dev
1985
;10
:217
—217
—217
—23
.6Lozoff
B
,Brittenham
GM
,Wolf
AW
, et al.Влияние железодефицитной анемии и терапии препаратами железа на результаты тестов на развитие младенцев
.Педиатрия
1987
;79
:981
–95
.7Лозофф
B
,Хименес
E
,Вольф
AW
.Отдаленные последствия развития детей раннего возраста с дефицитом железа
.N Engl J Med
1991
;325
:687
–94
.8Лозофф
Б
.Методологические вопросы изучения поведенческих эффектов железодефицитной анемии у детей раннего возраста
.Am J Clin Nutr
1989
;50
(доп.
):641
–54
.9Скримшоу
СЗ
.Функциональные последствия дефицита железа
.J Nutr Sci Витаминол
1984
;30
:47
–63
.10Youdim
MBH
,Зеленый
AR
.Дефицит железа и синтез и функция нейротрансмиттеров
.Proc Nutr Soc
1978
;37
:173
:173
—9
.11Youdim
MBH
,Woods
HF
,Mitchell
B
, et al.Активность моноаминоксидазы тромбоцитов человека при железодефицитной анемии
.Clin Sci Mol Med
1975
;48
:289
–9
.12Маклер
B
,Персона
F
, 0 0 30 30 LRМиллер 90
Дефицит железа у крыс: биохимические исследования метаболизма головного мозга
.Pediatr Res
1978
;12
:217
–20
.13Voorhess
ML
,Stuart
MJ
,Stockman
JA
, et al.Дефицит железа и повышенная экскреция норадреналина с мочой
.J Pediatr
1975
;86
:542
–7
.14Oski
FA
,Honig
AS
.Влияние терапии на показатели развития детей грудного возраста с дефицитом железа
.J Pediatr
1978
;92
:21
—4
.15 —4
.15Oski
FA
,Honig
AS
,Heleu
B
,Howanitz
P
.Влияние терапии препаратами железа на поведение детей без анемии и дефицита железа
.Педиатрия
1983
;71
:877
:877
—877
—80
.16yip
R
,Binkin
NJ
,TROWBRIDGE
FL
.Снижение распространенности анемии среди детей из малообеспеченных семей в США
.ДЖАМА
1987
;258
:1619
–23
.17Чемлимский
Е
.Оценка эффективности Специальной дополнительной программы для женщин, младенцев и детей (WIC)
.Детская Молодежная Служба Ред.
1984
;6
:219
–26
.18Бусси
CA
.Сравнение ручных и компьютерных записей.
Кандидатская диссертация
.Университет Майами
,1992
.19Скотт
KG
,Карран
DT
.Выявление и направление младенцев-инвалидов: интеграция исследований по отдельным вопросам в образование детей-инвалидов.
Таллахасси, Флорида
:Департамент образования, Управление специальных образовательных программ
,1985
.20Ип
Р
.Дефицит железа: современные научные проблемы и международные программные подходы
.Дж Нутр
1994
;124
:1479S
–90S
.21Государственные школы округа Дейд
.Специальные программы и процедуры для выдающихся учащихся 1990–1991 гг.
Майами
:Управление исключительного образования студентов, Учебное руководство Бюро специальных программ
,1990
.(Публикация № 6Gx13–6A-1.331
.)22Krieger
EH
.Долгосрочные последствия дефицита железа в младенчестве и раннем детстве.
Магистерская диссертация
.Университет Майами
,1993
.23Ротман
KJ
.Современная эпидемиология.
Бостон
:Литтл, Браун
,1986
.24МакМахон
Б
,Пью
TF
.Эпидемиология: принципы и методы.
BOSTON
:Little, Brown
,1970
.25yip
R
,
Norris
TN
,Anderson
AS
.Статус железа у детей с повышенным содержанием свинца в крови
.J Pediatr
1981
;98
:922
–5
.26Руттер
М
.Повышенный уровень свинца и нарушение когнитивных/поведенческих функций: обзор доказательств
.Dev Med Child Neurol
1980
;22
(Surrey
):1
—26
.27 —26
.27Hobkins
R
,Quimbo
R
,WATKINS
S
.Повышенная распространенность свинца в крови двухлетних детей во Флориде
.J Fla Med Assoc
1995
;82
:193
—7
.28de Vizia
de Vizia
B
,POGGI
V
,VAJRO
P
,CUCCHIARA
S
,ACAMPORA
A
.Мальабсорбция железа при лямблиозе
.J Pediatr
1985
;107
:75
–8
.29Mejia
LA
,Chew
F
.Гематологический эффект добавок витамина А у детей с анемией отдельно и в сочетании с железом
.Am J Clin Nutr
1988
;48
:595
–600
.30Чтение
MS
.Недоедание и поведение
.Appl Res Ment Retard
1982
;3
:279
–91
.31Клауссен
AH
,Бусси
CA
9.0003 ,
СкоттВес при рождении и образование матери как предикторы нарушений развития: Флоридский проект по охране здоровья и развитию детей
. В:26-я ежегодная Гатлинбургская конференция по умственной отсталости и нарушениям развития, Гатлинбург, Теннесси, 1993.Лоуренс, Канзас: Программный комитет Гатлинбургской конференции по исследованиям и теории в области умственной отсталости и нарушений развития
,Университет Канзаса
,1993
.32Гордон
T
.Опасности при использовании логистической функции
.J Chronic Dis
1974
;27
:97
–102
.33Барретт
DE
,Франк
DA
.Влияние недоедания на поведение детей.
Нью-Йорк
:Gordon and Breach Science Publishers
,1987
.© Американское общество клинического питания, 1999 г.
.