кишечная палочка в мазке при беременности — 25 рекомендаций на Babyblog.ru
Сразу после выписки из роддома вы не могли нарадоваться на своего малыша: такой спокойный, веселый, гладенький. Он подолгу спал и с аппетитом ел, а стул у него по запаху и консистенции напоминал густую сметанку. Но неожиданно стул испортился, стал водянистым, зеленым и пенистым, в нем появились кусочки слизи или кровяные прожилки. Даже с кожей творится что-то неладное: сначала появилась краснота вокруг ануса, но уже через пару дней вся попка покрылась какой-то коростой и стала напоминать ошпаренный помидор. Да и сосать стал плохо: уже через пару секунд начинает извиваться, плакать, отказывается от груди. Что же случилось? Скорее всего, у вашего крохи дисбактериоз.Ребенок рождается со стерильным кишечником, в котором отсутствуют какие-либо бактерии. Но, уже проходя по родовым путям, он начинает собирать мамину флору. В течение первых десяти дней его кишечник заселяется бифидум, лакто и колибактериями. А затем, в течение полугода эта флора совершенствуется и нарастает.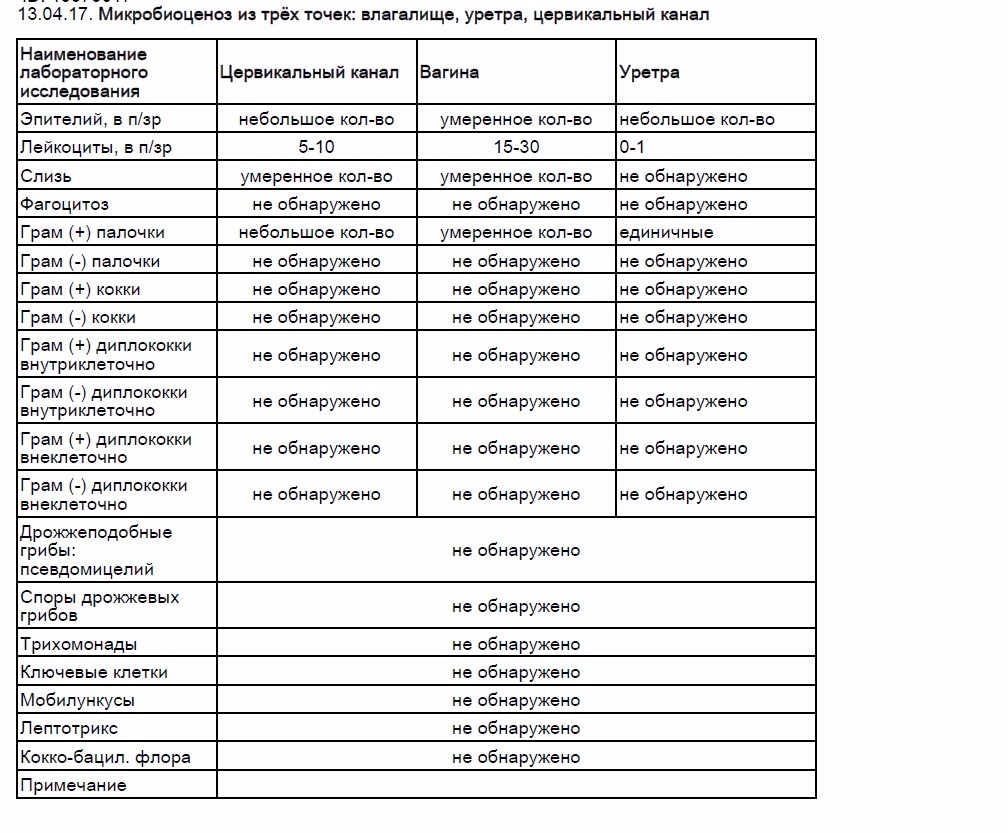
Бифидумбактерии вырабатывают молочную кислоту, которая создает в кишечнике кислую среду, защищающую от микробов и помогающую выработке витаминов некоторых групп: группа В (B1 влияет на нервную систему, сердце, мышцы, В3 регулирует клеточное дыхание, В6 — обмен аминокислот и жирных кислот, В12 — синтез белка), К (влияет на свертываемость крови), С (формирует иммунитет), и D (способствует усвоению кальция и фосфора, дефицит этого витамина приводит к рахиту).
Лактобактерии защищают кишечник от патогенной флоры и вирусов
Колибактерии (кишечные палочки) вырабатывают ферменты, помогающие переваривать, расщеплять и всасывать пищу.
Нетрудно заметить, что отсутствие или недостаток даже одного из видов бактерий приводит не только к расстройству работы кишечника, но и к нарушению иммунитета, обмена веществ, рахиту. Если у ребенка запущенный дисбактериоз, то к трем месяцам, сколько бы вы не давали ему витамина D, рахит практически неизбежен, потому что нарушается всасывание.
Поэтому так важно постараться не допустить дисбактериоза. Прежде всего, маме нужно проводить профилактику во время беременности. а лучше еще до ее наступления. Если у мамы перед родами было какое-нибудь влагалищное заболевание: молочница или какое-то другое нарушение флоры половых путей, то ребенок, кроме нормальной флоры получит и патологическую, и к концу десятых суток у него будет дисбактериоз.
Чтобы этого не произошло, о состоянии половых путей нужно начинать заботиться с первых месяцев беременности. Если обнаружили молочницу — лечите молочницу, если плохие вагинальные мазки — ставите свечи с лактобактерином, а недели за 2-3 до родов сдаете повторные мазки. За месяц до родов стоит почистить кишечник.
Если ребеночек не рожден кесаревым сечением, дисбактериоз, как правило, никогда не является первичным заболеванием. Он развивается на фоне какого-то основного заболевания, например, воспаления кишечника или ферментной патологии, если у малыша недостаточно развиты ферментные системы.
Сейчас у детей уже в первые месяцы жизни часто бывает лактазная недостаточность: фермент лактаза, которая переваривает молочный сахар, не вырабатывается в нужном количестве. Если уровень лактазы в норме, при переваривании молока должна выделяться молочная кислота, при этом в желудке создается кислая среда. При лактазной недостаточности молоко разлагается, выделяя при этом продукты брожения. Среда кишечника из кислой превращается в щелочную, и в ней активно размножаются патогенные микробы. Если после каждого кормления или между кормлениями у ребенка несколько раз бывает жидкий, обильный пенистый стул с большим количеством жидкости и при этом малыш плохо прибавляет в весе, необходимо срочно сдать анализ на копрологию, чтобы выявить лактазную недостаточность и как можно скорее начать лечение, пока у ребенка не начался дисбактериоз.
Часто дисбактериоз развивается из-за непереносимости белков коровьего молока. Обычно кормящим женщинам рекомендуют есть вволю молочных продуктов и пить побольше молока. Но случается, что, кишечник ребенка не усваивает белки коровьего молока, у него появляются симптомы, похожие на аллергию: кожа на щечках, вокруг ануса, на коленях и локтях краснеет, становится сухой и шершавой. И чем больше мама ест молочных продуктов, тем сильнее эти признаки выражены. То же самое происходит и с кишечником: его поверхность раздражается, воспаляется, и на нее садятся болезнетворные микробы, которые активно размножаются, вытесняя нормальную флору.
Но случается, что, кишечник ребенка не усваивает белки коровьего молока, у него появляются симптомы, похожие на аллергию: кожа на щечках, вокруг ануса, на коленях и локтях краснеет, становится сухой и шершавой. И чем больше мама ест молочных продуктов, тем сильнее эти признаки выражены. То же самое происходит и с кишечником: его поверхность раздражается, воспаляется, и на нее садятся болезнетворные микробы, которые активно размножаются, вытесняя нормальную флору.
К дисбактериозу приводит и гипоксическое поражение кишечника. Если ребеночек перенес в родах гипоксию, родился переношенным, если воды были зеленые, если у него было снижено сердцебиение, то из-за недостатка кислорода страдает и кишечник. На его стенках образуются маленькие трещинки, через которые просачивается кровь, в которой начинают активно размножаться патогенные микробы..
Какие же бактерии поселяются в кишечнике малыша. вытесняя оттуда полезную флору? Чаще всего дисбактериоз вызывают стафилококки. Они бывают разных видов, особенно злостный — золотистый стафилококк.
Следующая по частоте — кандида, или, в просторечии, молочница.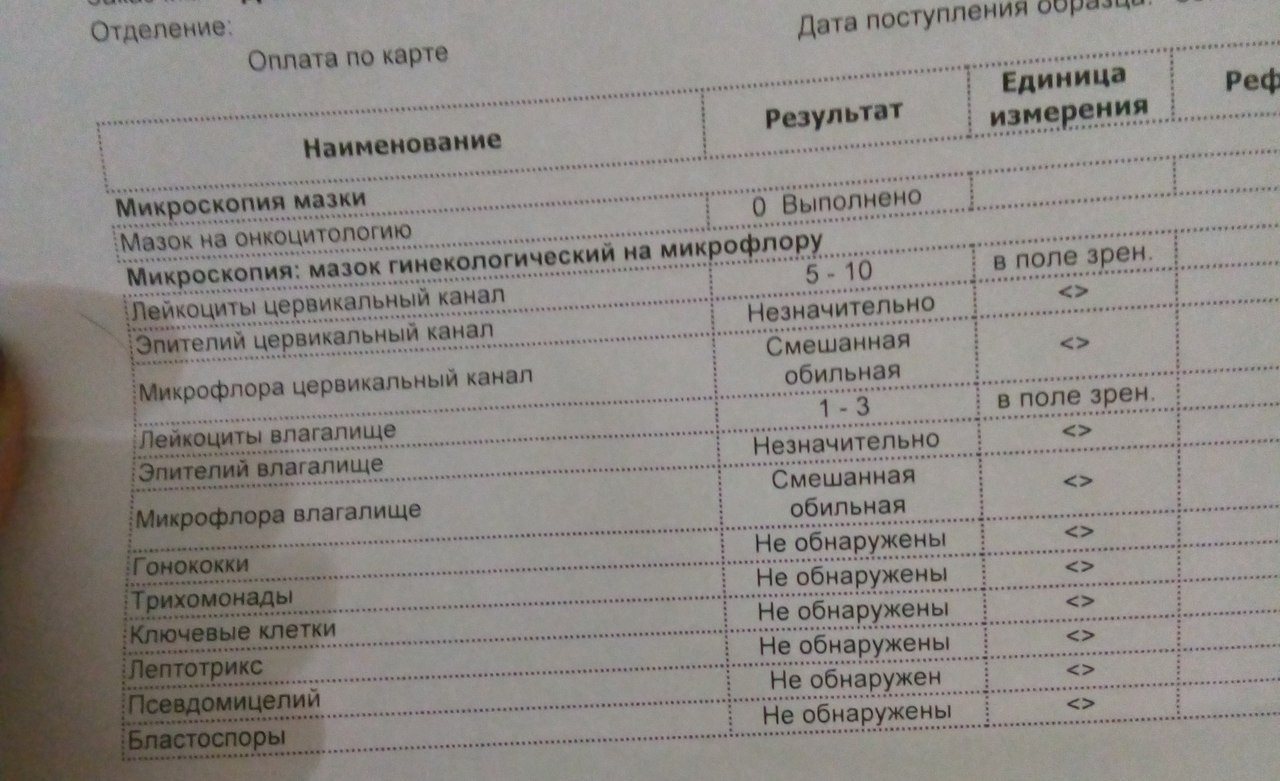 Ее главный признак — серо-белые пленочки, которые появляются во рту у малыша, главным образом, на слизистой щечек, и с трудом снимаются. Такие же пленочки появляются и в кишечнике у малыша, а у девочек и во влагалище. Молочница может вызывать и поражение кожи, внешне похожее на аллергию. Реже встречается ряд других бактерий.
Ее главный признак — серо-белые пленочки, которые появляются во рту у малыша, главным образом, на слизистой щечек, и с трудом снимаются. Такие же пленочки появляются и в кишечнике у малыша, а у девочек и во влагалище. Молочница может вызывать и поражение кожи, внешне похожее на аллергию. Реже встречается ряд других бактерий.
Каковы же симптомы дисбактериоза? Главное — изменение стула и состояния кожи. В норме стул у новорожденного может быть достаточно разнообразным по частоте, и по внешнему виду. Выделения должны быть однородными, с приятным творожным запахом, цвет варьируется от светло-желтого до коричневого. Могут встречаться белые крупинки молока. Возможна совсем небольшая примесь зелени и немного слизи. Если у стула резкий неприятный запах, если он зеленого цвета, если в нем много слизи или появляются прожилки крови или в нем очень много жидкости или весь стул пенистый, значит необходимо срочно сдать анализы.
Кроме анализа кала на дисбактериоз надо сдать анализ на копрологию, чтобы посмотреть, как переваривается молоко, нет ли слизи и крови, нету ли лейкоцитов, которые указывают на воспаление кишечника, а если стул жидкий или пенистый, нужно сдать еще и анализ на углеводы (лактазную недостаточность). По результатам анализов выделяют четыре стадии заболевания.
По результатам анализов выделяют четыре стадии заболевания.
1. Снижение нормальной флоры: никакого возбудителя еще нет, просто уровень бифидум или лактобактерий снижается в 10, 100 или 1000 раз. Как правило, дисбактериоз первой степени никак не проявляется: ни болями, ни нарушение стула. может наблюдаться лишь незначительное отставание в весе. Такой дисбактериоз лечить не нужно, просто необходимо укреплять иммунитет, закаливать малыша, купать его в специальных травяных сборах. К примеру, можно взять по столовой ложке тысячелистника, календулы и зверобоя, завяжите в марлю и залейте кипятком. Дайте настояться полчаса, вылейте настой в детскую ванночку. Купать ребенка минут 10-15.
2. Кроме недостатка микрофлоры появляется в небольшом количестве какой-либо один патологический микроб: гемолизирующая кишечная палочка, стафилококк или клебсиела. У ребенка появляются боли во время еды, малыш становится беспокойным. Меняется характер стула, он может стать пенистым, приобрести зеленую окраску.
3. Снижается нормальная микрофлора, появляются два или больше патогенных микробов: стафилококк с кандидой, или клебсиела с гемолизирующей палочкой. У ребенка начинаются сильные поносы, боли во время еды. Дети меньше спят, плохо едят, могут не прибавлять в весе и на какое-то время даже терять вес. Если показать такого ребенка невропатологу, он, скорее всего, найдет у него те или иные неврологические нарушения.
4. Выраженное серьезное заболевание, когда страдает весь организм. Страдает не только флора кишечника, поражается стенка кишечника и желудка. Болезнь поражает и нервную систему. Из-за того, что нарушается всасывание витаминов и микроэлементов, у ребенка ярко выражен авитаминоз. Страдают и внутренние органы: печень селезенка, поджелудочная железа.
Лечение и профилактика. Лучшая профилактика дисбактериоза — раннее прикладывание к груди, это помогает заселить кишечник иммуноглобулинами и уникальными защитными элементами, которые присутствуют лишь в молозиве. Прикладывайте новорожденного к груди так часто, как он просит, потому что такие маленькие дети не в состоянии усвоить сразу большое количество грудного молока. Пища должна в эти недолгие дни поступать буквально по капелькам, по полчайной ложечки, и чем чаще, тем лучше. Кроме того, в первые десять дней жизни ребенка мама должна по возможности максимально ограничить прием любых лекарств, поскольку в это время формируется нормальная кишечная флора. Нельзя есть никаких продуктов с консервантами: колбас, консервированных компотов, газированных напитков, продуктов, которые могли бы вызвать раздражение кишечника: шоколад, клубнику, белокочанную капусту, редиску, горох, грибы, морепродукты, орехи. Если во время беременности вы курили и не собираетесь бросать, не курите хотя бы первые несколько недель жизни ребенка. Это относится и к отцам: если вы курите, не подходите к ребенку в течение часа после курения. Дело в том, что никотин вызывает спазм кишечника и происходит то же самое, что и при внутриутробном кислородном голодании: на стенках кишечника появляются ранки, язвочки, на них размножаются вредные микробы, которые потом начинают вытеснять полезную флору.
Прикладывайте новорожденного к груди так часто, как он просит, потому что такие маленькие дети не в состоянии усвоить сразу большое количество грудного молока. Пища должна в эти недолгие дни поступать буквально по капелькам, по полчайной ложечки, и чем чаще, тем лучше. Кроме того, в первые десять дней жизни ребенка мама должна по возможности максимально ограничить прием любых лекарств, поскольку в это время формируется нормальная кишечная флора. Нельзя есть никаких продуктов с консервантами: колбас, консервированных компотов, газированных напитков, продуктов, которые могли бы вызвать раздражение кишечника: шоколад, клубнику, белокочанную капусту, редиску, горох, грибы, морепродукты, орехи. Если во время беременности вы курили и не собираетесь бросать, не курите хотя бы первые несколько недель жизни ребенка. Это относится и к отцам: если вы курите, не подходите к ребенку в течение часа после курения. Дело в том, что никотин вызывает спазм кишечника и происходит то же самое, что и при внутриутробном кислородном голодании: на стенках кишечника появляются ранки, язвочки, на них размножаются вредные микробы, которые потом начинают вытеснять полезную флору.
Если вы подозреваете, что у ребенка есть риск заболеть дисбактериозом, скажем, после планового кесарева сечения, если у вас не вылечена молочница, если по каким-то причинам не было возможности приложить ребенка к груди в первые часы или дни жизни (к примеру, вы или ребенок попали сразу после родов в больницу), если вы или ваш малыш сразу после родов получали антибиотики и т.д., — нужно, ничего не дожидаясь, сразу после рождения подавать ребенку препараты нормальной кишечной флоры: лактобактерин и бифидумбактерин в профилактических дозах. Утром — лактобактерин, вечером — бифидумбактерин по две дозы.
При дисбактериозе лечение нужно начинать как можно скорее, чтобы заболевание не начало прогрессировать, ведь тогда вылеячить его будет гораздо тружнее. Поэтому в ожидании результатов анализов (они будут готовы только через десять дней), сразу же начинайте давать малышу препарат бактисуптил, он практически не имеет противопоказаний не может навредить ребенку. Это сушеные споры микроба, который не приживается в кишечнике, но, находясь там, выживает всю патогенную флору. Новорожденному дают по 1/3капсулы три раза в день, ребенку 2-3 месяцев — по 1 капсуле три раза в день.
Новорожденному дают по 1/3капсулы три раза в день, ребенку 2-3 месяцев — по 1 капсуле три раза в день.
Если дисбактериоз запущенный, нарушается выработка ферментов печени и поджелудочной железы и пища плохо переваривается и начинает гнить в кишечнике, среда меняется с кислой на щелочную, где хорошо развиваются различные патогенные микробы. Значит, если ребенок болен давно, ему необходимо давать ферменты, например, креон, фермент поджелудочной железы, у него практически нет побочных эффектов и его можно принимать даже новорожденным. Его нужно давать с каждым приемом пищи, чтобы она нормально переваривалась. Привыкание он не вызывает, но его надо отменять постепенно. В течение 5-7 дней его дают в нормальной дозе, а затем дозу постепенно уменьшают: на вторую неделю — вдвое, а на третью препарат постепенно снижают и отменяют. Вместо креона можно давать абомин или панкеатин. Дозировку вам индивидуально подберет врач в зависимости от веса ребенка.
Следующим компонентом лечения являются биопрепараты в различных видах и различных лекарственных формах. Удобнее давать жидкие биопрепараты: жидкий бифидумбактерин и жидкий лактобактерин. Начинают лечение с лактобактерина, который сам по себе убивает и замещает патогенную флору. Во вторую очередь дается бифидумбактерин, потому что он способствует росту любой флоры, и хорошей, и плохой. Чаще всего утром и днем дают лактобактерин, а вечером — бифибумбактерин, но в особо тяжелых случаях ребенка сначала в течение долгого времени лечат только лактобактерином и лишь потом назначают бифидумдактерин. В любом случае, этот вопрос должен решать лечащий врач. Лактобактерин продается в виде жидкого жидкого экстракта, в виде порошка или в виде препаратов линекс, ацелакт, ацепол. Бифидумбактерин бывает сухой, жидкий и в виде препарата бифидумбактерин форте. Бифидумбактерин форте — это бифидобактерии, носителем которых является активированный уголь, то есть, он работает еще и как адсорбент: собирает на себя токсины, газы, микробные и вирусные тела. Если у ребенка понос, повышенное газообразование, если врач или вы сами подозреваете лактазную недостаточность, нельзя давать малышу сухие бифидум и лактобактерин, это может усугубить лактазную недостаточность.
Удобнее давать жидкие биопрепараты: жидкий бифидумбактерин и жидкий лактобактерин. Начинают лечение с лактобактерина, который сам по себе убивает и замещает патогенную флору. Во вторую очередь дается бифидумбактерин, потому что он способствует росту любой флоры, и хорошей, и плохой. Чаще всего утром и днем дают лактобактерин, а вечером — бифибумбактерин, но в особо тяжелых случаях ребенка сначала в течение долгого времени лечат только лактобактерином и лишь потом назначают бифидумдактерин. В любом случае, этот вопрос должен решать лечащий врач. Лактобактерин продается в виде жидкого жидкого экстракта, в виде порошка или в виде препаратов линекс, ацелакт, ацепол. Бифидумбактерин бывает сухой, жидкий и в виде препарата бифидумбактерин форте. Бифидумбактерин форте — это бифидобактерии, носителем которых является активированный уголь, то есть, он работает еще и как адсорбент: собирает на себя токсины, газы, микробные и вирусные тела. Если у ребенка понос, повышенное газообразование, если врач или вы сами подозреваете лактазную недостаточность, нельзя давать малышу сухие бифидум и лактобактерин, это может усугубить лактазную недостаточность. Врач выписывает либо жидкие формы, либо бифидумбактерин форте. Существуют еще комплексные биопрепараты, которые содержат и лакто и бифидумбактерии, например, линекс, примадофилус. Их можно пить профилактически несколько раз в год и давать для восстановления нормальной микрофлоры, не сдавая анализы (при слабом дисбактериозе). Есть препараты кишечной палочки, которые до полугода нельзя давать вообще, а детям до трех лет — только по строгим показаниям по результатам анализов, поскольку у маленьких детей кишечная палочка может перерасти в мутантные формы. Это препараты бификол и колибактерин.
Врач выписывает либо жидкие формы, либо бифидумбактерин форте. Существуют еще комплексные биопрепараты, которые содержат и лакто и бифидумбактерии, например, линекс, примадофилус. Их можно пить профилактически несколько раз в год и давать для восстановления нормальной микрофлоры, не сдавая анализы (при слабом дисбактериозе). Есть препараты кишечной палочки, которые до полугода нельзя давать вообще, а детям до трех лет — только по строгим показаниям по результатам анализов, поскольку у маленьких детей кишечная палочка может перерасти в мутантные формы. Это препараты бификол и колибактерин.
Существует еще такой замечательный препарат, как хилак форте, который не содержит живых бифидум и лактобактерий, а только продукты их жизнедеятельности: те кислоты и витамины. которые вырабатываются бифидобактериями и факторы защиты, которые вырабатывается лактобактериями. Все это на углеводах, но углеводы уже расщепленные, так что этот препарат можно давать и детям с лактазной недостаточностью. Его применяют и при профилактике, и при лечении дисбактериоза, особенно во время повторного курса.
Его применяют и при профилактике, и при лечении дисбактериоза, особенно во время повторного курса.
Еще есть комплексный иммуноглобулиновый препарат КИП, в котором содержатся те же иммуноглобулины. что и в грудном молоке и антитела, которые живут на слизистой и создают барьер для патогенной флоры. Его назначает только врач очень короткими курсами. Особенно он полезен при искусственном вскармливании а также если в грудном молоке много патогенных микробов, если малыш перенес гипоксию или если у него воспален кишечник.
Если в анализах есть срытая кровь или прожилки крови и у вас нет возможности срочно попасть к врачу (например, на даче), без вреда для ребенка можно подавать тыквеол, облепиховое масло (1 капля 3 раза в день) или каратолин по 1 мл 3 раза в день. Можно давать солкосерил или актовегин в ампулах, это препараты из крови телят, они хорошо восстанавливают слизистую.
Как сдавать анализы.
Анализ на дисбактериоз. Кал надо собирать в стерильную посуду. Для этого баночку из-под детского питания нужно прокипятить вместе с крышкой в течение 20 минут. Простерилизованную банку нужно закрыть крышкой и поставить в холодильник. Так ее можно хранить в ожидании нужного момента в течение 24 часов. Собранный анализ нужно доставить в лабораторию в течение трех часов. Объем может быть очень маленьким, достаточно ½ чайной ложки. Кал, собранный с памперса или пеленки не годится. Вымойте клеенку или горшок с мылом и обдайте кипятком. Желательно собирать верхний слой, которые не соприкасался с поверхностью клеенки или горшка. Анализ будет готов через 7-10 дней. Делают его в специализированных лабораториях.
Простерилизованную банку нужно закрыть крышкой и поставить в холодильник. Так ее можно хранить в ожидании нужного момента в течение 24 часов. Собранный анализ нужно доставить в лабораторию в течение трех часов. Объем может быть очень маленьким, достаточно ½ чайной ложки. Кал, собранный с памперса или пеленки не годится. Вымойте клеенку или горшок с мылом и обдайте кипятком. Желательно собирать верхний слой, которые не соприкасался с поверхностью клеенки или горшка. Анализ будет готов через 7-10 дней. Делают его в специализированных лабораториях.
Анализ на копрологию. Его можно доставить в лабораторию в течение суток с момента сбора, но объем чем больше, тем лучше (как минимум 1/3 майонезной банки), потому что потребуется много разных исследований. Анализ готовится в течение 3 дней. Сдать его можно в районной поликлинике. Проследите, чтобы в направлении на анализ было написано, что кал нужно проверить на кислотность. Наличие эритроцитов указывает, что а стенках кишечника есть трещинки и ранки, а наличие лейкоцитов свидетельствует о воспалительном процессе.
Анализ на углеводы. Надо привезти в лабораторию в течение 6-12 часов. Нельзя перед сдачей анализов давать ребенку биопрепараты, т.к. все они на углеводах.
Продукты, которые нормализуют состояние кишечника
сухофрукты: курага, чернослив и инжир нормализуют перистальтику. Для грудного ребенка курагу с черносливом заливают холодной водой для детского питания и оставляют на ночь. Утром дают малышу пить водичку.
проросшие злаки, после 6 месяцев добавляют в пищу. Ближе к году можно давать ребенку зерновой подсушенный хлеб.
если у ребенка щелочная среда в кишечнике, ему дают раствор яблочного уксуса. 1 чайную ложку разводят в стакане воды и дают по капле несколько раз в течение дня.
также нормализует состояние кишечника медовая вода, приготовленная из цветочного, липового или акациевого меда. он убирает гнилостную флору, газы. спазмы и боли в животе.! чайную ложку растворяют в стакане кипяченой воды. Перед первым приемом дайте ребенку одну капельку, чтобы убедиться, что у него нет аллергии.
чесночная вода убивает стафилококк, повышает иммунитет. Кроме того, это отличная профилактика глистов. Ползубчика чеснока натирают и настаивают в небольшом количестве воды в течение часа, доливают водой до полулитра и дают по капле 2-3 раза в течение дня.
E. coli – это бактерия, обычно обнаруживаемая в нижних отделах кишечника теплокровных организмов.
Обзор
Бактерия Escherichia coli (E. coli), продуцирующая шигатоксин часто обнаруживается в кишечнике людей и теплокровных животных. Большинство штаммов E. coli безвредны. Однако некоторые штаммы, такие как энтерогеморрагическая E. coli (STEC), могут вызывать тяжелые болезни пищевого происхождения. Эта бактерия передается человеку, главным образом, при потреблении зараженных пищевых продуктов, таких как сырые или не прошедшие достаточную тепловую обработку продукты из мясного фарша, сырое молоко и загрязненные сырые овощи и ростки.
STEC производит токсины, известные как шига токсины, названные так из-за их сходства с токсинами, производимыми Shigella dysenteriae. Количество бактерий STEC может увеличиваться при температуре от 7°C до 50°С (оптимальная температура 37°С). Количество некоторых бактерий STEC может расти в кислых продуктах с показателем pH вплоть до 4,4, а также в продуктах с минимальной активностью воды (aw) на уровне 0,95.
Количество бактерий STEC может увеличиваться при температуре от 7°C до 50°С (оптимальная температура 37°С). Количество некоторых бактерий STEC может расти в кислых продуктах с показателем pH вплоть до 4,4, а также в продуктах с минимальной активностью воды (aw) на уровне 0,95.
Бактерии погибают при тщательной тепловой обработке пищевых продуктов — до тех пор, пока все части продуктов не достигнут температуры 70°С или выше. Наиболее значимым для общественного здравоохранения серотипом STEC является E. Coli O157:H7; однако возбудителями спорадических случаев и вспышек заболеваний часто являются и другие серотипы.
Симптомы
Симптомы болезней, вызываемых бактериями STEC, включают абдоминальные спазмы и диарею, которая в некоторых случаях может переходить в кровавую диарею (геморрагический колит). Возможны также лихорадка и рвота. Инкубационный период длится от 3 до 8 дней, при средней продолжительности 3-4 дня. Большинство пациентов выздоравливает в течение 10 дней, но у незначительного числа пациентов (особенно детей раннего возраста и пожилых людей) инфекция может приводить к развитию такой представляющей угрозу для жизни болезни, как гемолитический уремический синдром (ГУС). Для ГУС характерны острая почечная недостаточность, гемолитическая анемия и тромбоцитопения (низкий уровень тромбоцитов в крови).
Для ГУС характерны острая почечная недостаточность, гемолитическая анемия и тромбоцитопения (низкий уровень тромбоцитов в крови).
Люди, страдающие от кровавой диареи или тяжелых абдоминальных спазмов, должны обращаться за медицинской помощью. Антибиотики не являются составной частью лечения пациентов с болезнью, вызванной STEC, и могут повышать риск развития ГУС.
По оценкам, ГУС может развиваться у 10 % пациентов с инфекцией STEC, а коэффициент летальности составляет от 3 до 5 %. Во всем мире ГУС является самой распространенной причиной острой почечной недостаточности у детей раннего возраста. Он может приводить к неврологическим осложнениям (таким как конвульсии, инсульт и кома) у 25 % пациентов и к хроническим заболеваниям почек, обычно нетяжелым, примерно у 50 % выживших пациентов.
Источники и передача инфекции
Имеющаяся о STEC информация относится, в основном, к серотипу O157:H7, так как с биохимической точки зрения его можно легко дифференцировать от других штаммов E. coli. Резервуаром этого патогенного микроорганизма является, в основном, крупный рогатый скот. Кроме того, значительными резервуарами считаются другие жвачные животные (такие как овцы, козы и олени), обнаруживаются и другие инфицированные млекопитающие (такие как свиньи, лошади, кролики, собаки, кошки) и птицы (такие как куры и индейки).
coli. Резервуаром этого патогенного микроорганизма является, в основном, крупный рогатый скот. Кроме того, значительными резервуарами считаются другие жвачные животные (такие как овцы, козы и олени), обнаруживаются и другие инфицированные млекопитающие (такие как свиньи, лошади, кролики, собаки, кошки) и птицы (такие как куры и индейки).
E. coli O157:H7 передается человеку, главным образом, в результате потребления в пищу зараженных пищевых продуктов, таких как сырые или не прошедшие достаточную тепловую обработку продукты из мясного фарша и сырое молоко. Загрязнение фекалиями воды и других пищевых продуктов, а также перекрестное загрязнение во время приготовления пищи (через продукты из говядины и другого мяса, загрязненные рабочие поверхности и кухонные принадлежности) также могут приводить к инфицированию. Примеры пищевых продуктов, явившихся причиной вспышек E. coli O157:H7, включают не прошедшие надлежащую тепловую обработку гамбургеры, копченую салями, непастеризованный свежевыжатый яблочный сок, йогурт и сыр, приготовленный из сырого молока.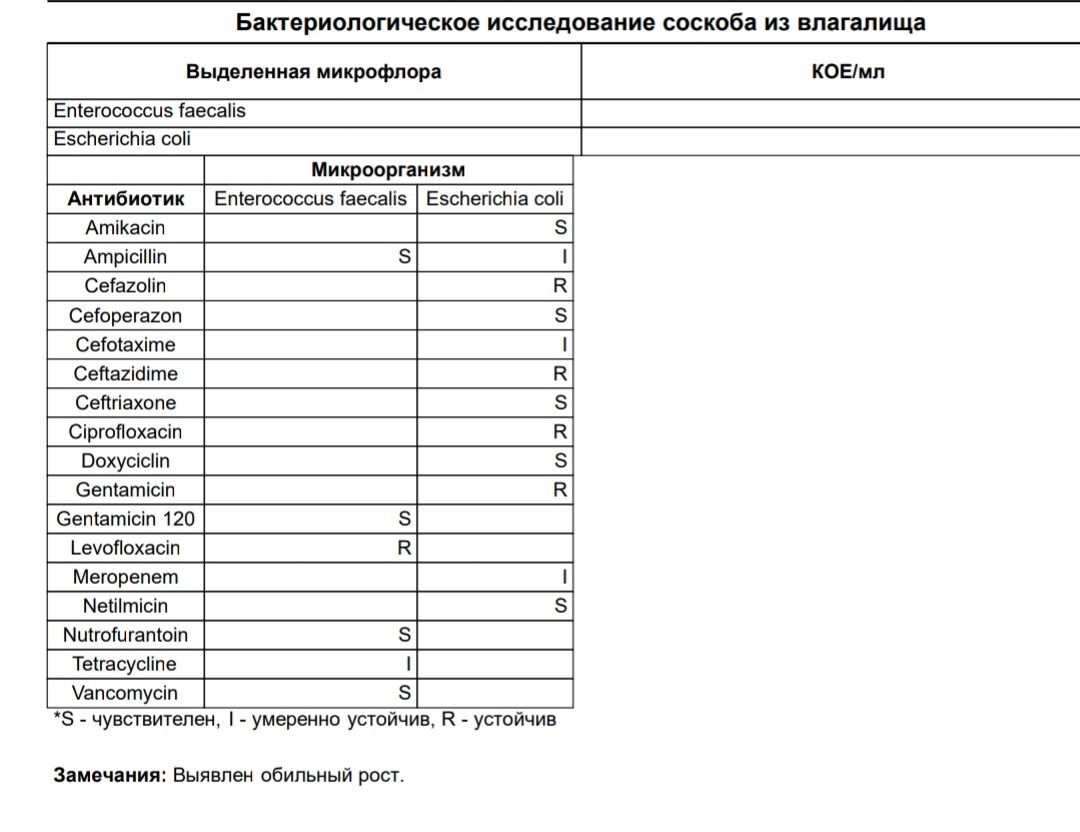
Все большее число вспышек болезни связано с потреблением в пищу фруктов и овощей (включая ростки, шпинат, латук, капусту и салат), заражение которых может происходить в результате контакта с фекалиями домашних или диких животных на какой-либо стадии их выращивания или обработки. Бактерии STEC обнаруживаются также в водоемах, (таких как пруды и реки), колодцах и поилках для скота. Они могут оставаться жизнеспособными в течение нескольких месяцев в навозе и осадочных отложениях на дне поилок. Так же была зарегистрирована передача инфекции как через зараженную питьевую воду, так и через воды для рекреационного использования.
Близкие контакты людей являются одним из основных путей передачи инфекции (орально-фекальный путь заражения). Были зарегистрированы бессимптомные носители, то есть лица, у которых не проявляются клинические симптомы болезни, но которые способны инфицировать других людей. Период выделения бактерий STEC у взрослых людей длится примерно одну неделю или менее, а у детей этот период может быть более длительным. В числе значительных факторов риска инфицирования STEC отмечается также посещение ферм и других мест содержания сельскохозяйственных животных, где возможен прямой контакт с ними.
В числе значительных факторов риска инфицирования STEC отмечается также посещение ферм и других мест содержания сельскохозяйственных животных, где возможен прямой контакт с ними.
Профилактика
Для профилактики инфекции необходимо соблюдать контрольные меры на всех стадиях продовольственной цепи – от производства сельскохозяйственной продукции на фермах до переработки, обработки и приготовления пищевых продуктов как на коммерческих предприятиях, так и в домашних условиях.
В промышленных условиях
Число случаев заболевания можно уменьшить благодаря проведению разнообразных стратегий по снижению риска в отношении мясного фарша (например, обследование животных перед убоем для предотвращения попадания большого количества патогенных микроорганизмов в места для убоя скота). Надлежащая практика убоя скота и соблюдение гигиены снижают уровень загрязнения туш фекалиями, но не гарантируют отсутствия бактерий STEC в продуктах. Для сведения к минимуму микробиологического заражения крайне важно проводить обучение гигиеническим навыкам при обращении с пищевыми продуктами среди работников ферм, скотобоен и предприятий по производству пищевых продуктов. Единственным эффективным способом уничтожения бактерий STEC в пищевых продуктах является бактерицидная обработка, такая как нагревание (например, тепловая обработка или пастеризация) или облучение.
Единственным эффективным способом уничтожения бактерий STEC в пищевых продуктах является бактерицидная обработка, такая как нагревание (например, тепловая обработка или пастеризация) или облучение.
В домашних условиях
Меры для профилактики инфекции E. coli O157:H7 схожи с мерами, рекомендуемыми для профилактики других болезней пищевого происхождения. Основные практические методики надлежащей гигиены пищевых продуктов, приводимые в «Пяти принципах повышения безопасности пищевых продуктов» ВОЗ, могут способствовать предотвращению передачи патогенных микроорганизмов, вызывающих многие болезни пищевого происхождения, а также защищать от болезней пищевого происхождения, вызываемых STEC.
Пятью важнейшими принципами обеспечения более безопасных пищевых продуктов являются:
Эти рекомендации необходимо выполнять во всех случаях, особенно рекомендацию в отношении «надлежащей тепловой обработки продуктов», при которой температура в середине продуктов достигает, по меньшей мере, 70°C. Необходимо тщательно мыть фрукты и овощи, особенно если они употребляются в пищу в сыром виде. По возможности овощи и фрукты следует чистить. Уязвимым группам населения (таким как дети и пожилые люди) следует избегать потребления в пищу сырых или не прошедших надлежащую тепловую обработку мясных продуктов, сырого молока и продуктов, приготовленных из сырого молока.
Необходимо тщательно мыть фрукты и овощи, особенно если они употребляются в пищу в сыром виде. По возможности овощи и фрукты следует чистить. Уязвимым группам населения (таким как дети и пожилые люди) следует избегать потребления в пищу сырых или не прошедших надлежащую тепловую обработку мясных продуктов, сырого молока и продуктов, приготовленных из сырого молока.
Настоятельно рекомендуется регулярное мытье рук, в частности перед приготовлением пищи, едой и после посещения туалета, особенно для людей, ухаживающих за детьми раннего возраста, пожилыми людьми и людьми с ослабленным иммунитетом, так как бактерия может передаваться не только через пищевые продукты, воду и при прямых контактах с животными, но и от человека человеку.
Некоторое количество инфекций STEC возникает в результате контакта с водами для рекреационного использования. Поэтому, важно также защищать такие водоемы, равно как и источники питьевой воды, от попадания в них экскрементов животных.
Производители фруктов и овощей
Публикация ВОЗ «Пять важнейших принципов выращивания более безопасных фруктов и овощей», предназначаемая для сельскохозяйственных работников, выращивающих свежие фрукты и овощи для себя, своих семей и для продажи на местных рынках, содержит основные практические методики для предотвращения микробного загрязнения свежей продукции во время посадки, выращивания, сбора урожая и хранения.
Пятью важнейшими принципами выращивания более безопасных фруктов и овощей являются:
- Соблюдение надлежащей личной гигиены.
- Защита полей от загрязнения фекалиями животных.
- Использование обработанных фекальных отходов.
- Оценка рисков, связанных с использованием ирригационной воды, и управление этими рисками.
- Содержание оборудования и помещений для сбора и хранения урожая в чистоте и сухости.
Деятельность ВОЗ
ВОЗ проводит научные оценки для контроля пищевых продуктов на присутствие STEC. Эти оценки служат основанием для международных стандартов на пищевые продукты, руководящих принципов и рекомендаций, разрабатываемых Комиссией Кодекс Алиментариус.
В отношении профилактики ВОЗ разработала глобальную стратегию для уменьшения бремени болезней пищевого происхождения. ВОЗ разработала информационное сообщение «Пять основных правил для обеспечения более безопасных пищевых продуктов». Эти пять правил и связанные с ними учебные пособия являются материалами для стран, которые легко использовать, воспроизводить и адаптировать к различным целевым аудиториям.
ВОЗ способствует укреплению систем безопасности пищевых продуктов путем продвижения надлежащей практики производства и просвещения розничных торговцев и потребителей в отношении надлежащего обращения с пищевыми продуктами и предотвращения их загрязнения.
Во время вспышек E. coli, таких как вспышки, имевшие место в Европе в 2011 году, ВОЗ осуществляет поддержку координации в области обмена информацией и сотрудничества с помощью Международных медико-санитарных правил и в рамках Международной сети органов по безопасности пищевых продуктов (ИНФОСАН) во все мире; ВОЗ осуществляет тесное сотрудничество с национальными органами здравоохранения и международными партнерами, обеспечение технической помощи и предоставление последней информации о вспышках болезни.
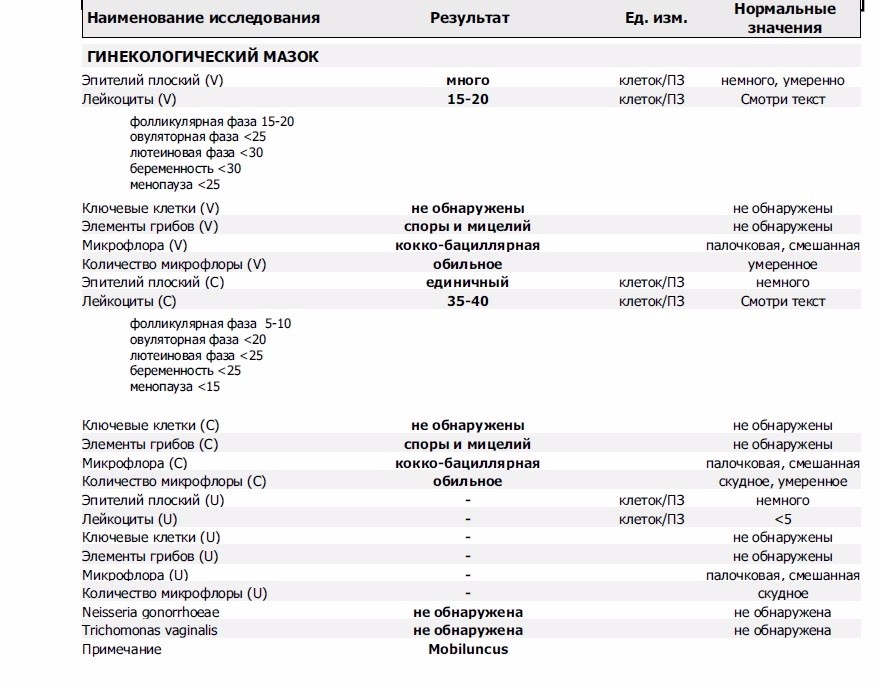
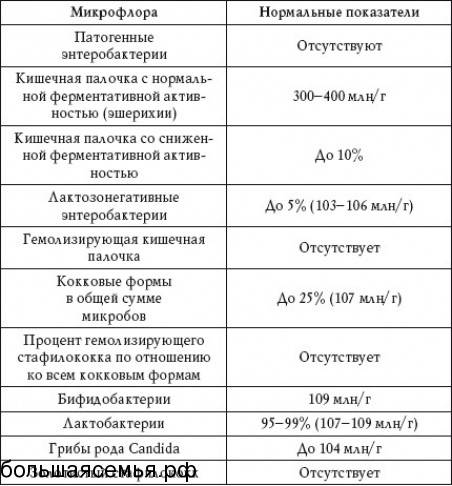
Кишечная палочка при беременности — Вопрос гинекологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.
Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 74 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского онколога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, липидолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, подолога, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.44% вопросов.
Оставайтесь с нами и будьте здоровы!
Бактериальный вагиноз: новые перспективы в лечении
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!
А.А. ХРЯНИН, д.м.н., профессор, Новосибирский государственный медицинский университет Минздрава России; вице-президент РОО «Ассоциация акушеров-гинекологов и дерматовенерологов», Новосибирск,
О.В. РЕШЕТНИКОВ, д.м.н., в.н.с., Научно-исследовательский институт терапии и профилактической медицины, Новосибирск
Бактериальный вагиноз — это инфекционный невоспалительный синдром, характеризующийся заменой обычной микрофлоры (преимущественно лактобактерий) на полимикробные ассоциации анаэробов и Gardnerella vaginalis. В последние годы использование методов молекулярной биологии показало, что существует гораздо большее разнообразие микроорганизмов, ассоциированных с бактериальным вагинозом, чем считалось ранее. Клиндамицин зарекомендовал себя как эффекивный и безопасный препарат в лечении бактериального вагиноза в современных условиях.
Клиндамицин зарекомендовал себя как эффекивный и безопасный препарат в лечении бактериального вагиноза в современных условиях.
Влагалищная флора — это многокомпонентная микроэкологическая система, обеспечивающая защиту всех репродуктивных органов женщин как в обычных условиях, так и при патологии. Основными представителями микрофлоры влагалища в норме являются лактобактерии разных видов (Lactobacillus spp.) и в меньшей степени бифидобактерии и коринебактерии, а также анаэробные грамотрицательные палочки рода Fusobacterium и грамотрицательные кокки рода Veillonella. У здоровых женщин репродуктивного возраста ведущее место в вагинальном микроценозе занимают лактобактерии (анаэробного и аэробного происхождения), объединенные под общим названием «палочки Дедерлейна», которые составляют более 95% всей микрофлоры влагалища. Бифидобактерии, так же как и лактобактерии, защищают слизистую оболочку влагалища от воздействия не только патогенных, но и условно-патогенных микроорганизмов, их токсинов, препятствуют распаду секреторного IgА, стимулируют образование интерферона и выработку лизоцима. У здоровых женщин анаэробная микрофлора превалирует над аэробной в соотношении 10 : 1 [1, 2].
У здоровых женщин анаэробная микрофлора превалирует над аэробной в соотношении 10 : 1 [1, 2].
Лактобациллы перерабатывают гликоген, который в большом количестве содержат эпителиальные клетки влагалища женщин репродуктивного возраста, в молочную кислоту, повышая кислотность влагалища. Кроме того, лактобациллы продуцируют перекись водорода. В результате кислая среда влагалища и перекись водорода подавляют рост условно-патогенных микробов (стафилококков, стрептококков, кишечной палочки, анаэробных бактерий, Gardnerella vaginalis, Mobiluncus spp.), которые в небольшом количестве выявляются во влагалище подавляющего большинства женщин. Если доля лактобацилл снижается, их место в экосистеме занимают условно-патогенные микробы (в первую очередь Gardnerella vaginalis). Таким образом, кислая среда влагалищного содержимого, лактобациллы и факторы защиты, которые они продуцируют, образуют мощнейший естественный барьер на пути проникновения патогенных бактерий, защищая верхние отделы полового тракта женщины.
Особенностью микрофлоры влагалища является ее изменчивость под действием как экзогенных (использование тампонов, частые влагалищные души и спринцевания, смена полового партнера), так и эндогенных факторов (нейроэндокринные заболевания, сахарный диабет, гипотиреоз). На микроценоз оказывают влияние физиологические и гормональные изменения (пубертатный период, беременность, менопауза), фазы менструального цикла, различные нарушения менструальной функции [3]. Играет также роль использование некоторых медикаментозных препаратов (антибиотики, гормоны) и хирургические вмешательства.
Бактериальный вагиноз (БВ) (прежнее название – вагинальный дисбактериоз) представляет собой общий инфекционный невоспалительный синдром, связанный с дисбиозом влагалища и сопровождающийся чрезмерно высокой концентрацией облигатно и факультативно анаэробных условно-патогенных микроорганизмов в сочетании с резким снижением количества или отсутствием молочнокислых бактерий в отделяемом влагалища (табл.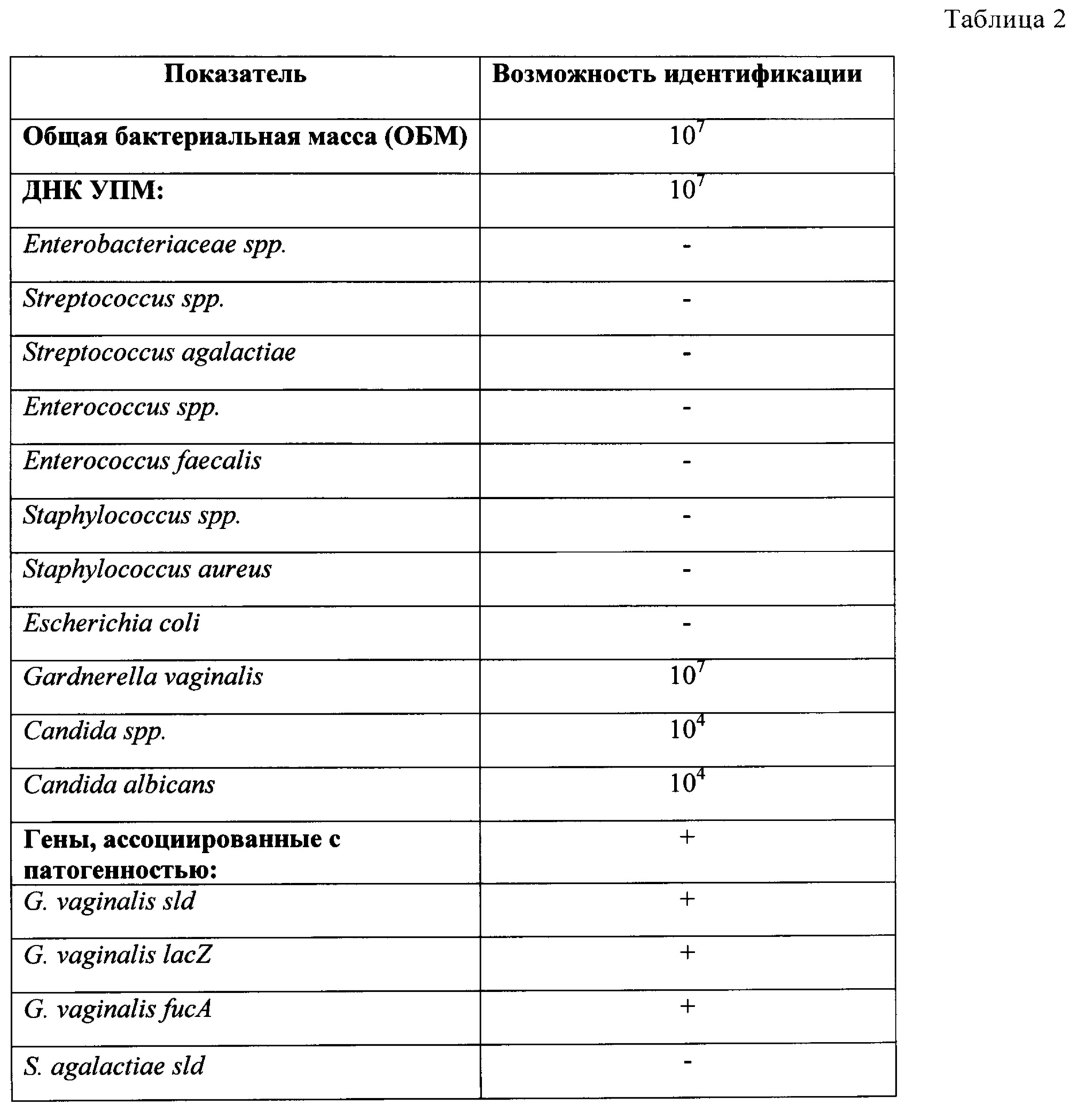 1).
1).
|
Таблица 1. Экосистема влагалища |
||
| Микроорганизм | Здоровые женщины | Женщины с БВ |
| Общее количество микроорганизмов |
<107 микроорганизмов/г |
>109 микроорганизмов/г |
| Соотношение аэробы : анаэробы | От 1 : 2 до 1 : 10 | Достигает 1 : 100 |
|
Lactobacilli |
Преобладают | Незначительное количество |
| Gardnerella vaginalis | Наличие в 5—25% | Наличие в 71—92% |
| Mycoplasma hominis | Наличие в 15—30% | Наличие в 63% |
Mobiluncus spp.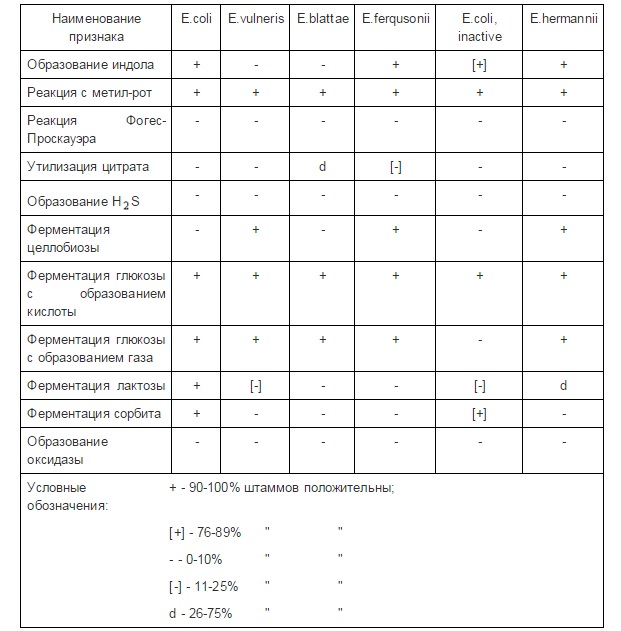 (факультативный анаэроб) (факультативный анаэроб) |
Наличие в 0—5% |
Наличие в 50—70% |
|
Bacteroides spp. (анаэроб) |
Наличие в 52% | Наличие до 100% |
|
Peptococcus spp. (анаэроб) |
Наличие в 26% | Наличие до 100% |
При бактериальном вагинозе происходит элиминация лактобацилл, сопровождающаяся колонизацией влагалища анаэробами: Fusobacterium, Mobiluncus, Peptostreptococcus, Gardnerella vaginalis. Несмотря на то что БВ характеризуется своей полимикробной природой, основным запускающим процесс микроорганизмом является Gardnerella vaginalis, факультативно-анаэробная грамотрицательная палочка; именно она определяет главную симптоматику БВ.
Дело в том, что G. vaginalis обладает уникальной способностью формировать на поверхности урогенитальной слизистой так называемую биопленку.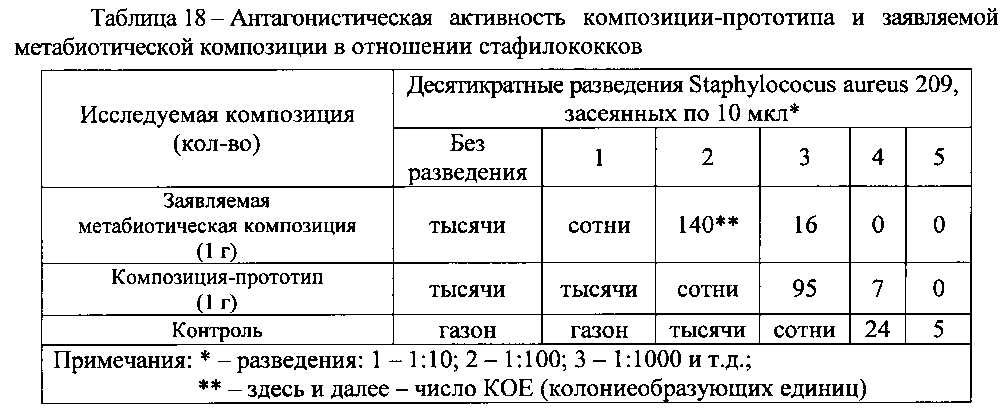 Биопленка (biofilm) — это конгломерат микроорганизмов, расположенных на какой-либо поверхности, клетки которых прикреплены друг к другу. Обычно клетки погружены в выделяемое ими внеклеточное полимерное вещество (внеклеточный матрикс) — слизь. Считается, что 95—99% всех микроорганизмов в естественной среде существуют в виде биопленки. Микроорганизмы образуют биопленку под влиянием ряда факторов, включая клеточное распознавание мест прикрепления к поверхности и наличие питательных или агрессивных веществ, кислорода и т. д. В режиме образования биопленки клетка меняет свое поведение, что обусловливается регуляцией экспрессии генов.
Биопленка (biofilm) — это конгломерат микроорганизмов, расположенных на какой-либо поверхности, клетки которых прикреплены друг к другу. Обычно клетки погружены в выделяемое ими внеклеточное полимерное вещество (внеклеточный матрикс) — слизь. Считается, что 95—99% всех микроорганизмов в естественной среде существуют в виде биопленки. Микроорганизмы образуют биопленку под влиянием ряда факторов, включая клеточное распознавание мест прикрепления к поверхности и наличие питательных или агрессивных веществ, кислорода и т. д. В режиме образования биопленки клетка меняет свое поведение, что обусловливается регуляцией экспрессии генов.
Именно эта биопленка как цемент или клей притягивает к себе другие микроорганизмы, образуя конгломерат бактерий, в большинстве своем обладающих патогенным, или, по крайней мере, опасным для человека эффектом. Биопленки, как было установлено, состоят в основном из Gardnerella vaginalis, в то время как Atopobium vaginae присутствовал в 80% случаев и составил 40% от массы биопленки. Другие бактерии встречаются намного реже, в т. ч. бактерии, принадлежащие к родам Bacteroides, Corynebacterium, Lactobacillus, Veillonella, Ruminococcus и Streptococcus [4].
Другие бактерии встречаются намного реже, в т. ч. бактерии, принадлежащие к родам Bacteroides, Corynebacterium, Lactobacillus, Veillonella, Ruminococcus и Streptococcus [4].
К факторам, способствующим развитию БВ относят:
— Иммунодефицитные состояния организма (хронические стрессы, заболевания, массивное лечение антибиотиками и цитостатиками, лучевая терапия, сахарный диабет, авитаминоз).
— Гормональная дисфункция яичников, в т. ч. возрастные гормональные изменения, гормонотерапия.
— Угнетение факторов местного иммунитета и лактобацилл (влагалищные спринцевания, инородные тела, внутриматочные контрацептивы, использование спермицидов, контрацептивные свечи и кремы, содержащие 9-ноноксинол (Патентекс Овал, Ноноксинол)
— Массивное инфицирование влагалища, промискуитивные связи.
Распространенность БВ
Определить истинную частоту встречаемости БВ не представляется возможным в связи с тем, что у 1/3 женщин это заболевание протекает бессимптомно. В немногочисленных исследованиях установлена распространенность БВ в диапазоне от 3,14% у бессимптомных женщин в возрасте от 18 до 72 лет (скрининг в Нидерландах) до 49% у женщин в возрасте от 13 до 65 лет пациенток кабинета кольпоскопии в США. Большой разброс в представленных показателях распространенности может быть связан с включением различных групп пациентов, демографических вариациях и разных диагностических критериев. В целом по результатам 21 исследования общая распространенность БВ составила 27,1%, при этом особо не отличаясь в развитых (28,0%) и развивающихся (23,5%) странах [5].
В немногочисленных исследованиях установлена распространенность БВ в диапазоне от 3,14% у бессимптомных женщин в возрасте от 18 до 72 лет (скрининг в Нидерландах) до 49% у женщин в возрасте от 13 до 65 лет пациенток кабинета кольпоскопии в США. Большой разброс в представленных показателях распространенности может быть связан с включением различных групп пациентов, демографических вариациях и разных диагностических критериев. В целом по результатам 21 исследования общая распространенность БВ составила 27,1%, при этом особо не отличаясь в развитых (28,0%) и развивающихся (23,5%) странах [5].
В процессе выполнения Human Microbiome Project методы молекулярной биологии показали, что существует гораздо большее разнообразие микроорганизмов, ассоциированных с БВ, чем это было очевидно с использованием методов культивирования. Для примера приведем список микроорганизмов, ранее неизвестных при БВ: Atopobium vaginae, БВ-ассоциированные бактерии (BVAB-1, BVAB-2 и BVAB-3) из порядка Clostridiales, Megasphaera spp, Leptotrichia spp, Dialister spp, Chloroflexi spp, Olsenella spp, Streptobacillus spp, Shuttleworthia spp, Porphyromonas asaccharolytica [6].
Эти разнообразные организмы аккумулируются, формируя различные сообщества или профили, которые свидетельствуют, что БВ не единое целое, а синдром переменного состава, вызывающий разнообразие симптомов, различные фенотипические исходы и приводящий к вариабельности ответов на различные схемы антибиотиков. Некоторые организмы или комбинации организмов обладают высокой специфичностью для БВ, так что в будущем использование молекулярного количественного анализа позволит лучше диагностировать каждый подтип BV и подбирать индивидуализированную терапию. Расовая принадлежность женщины и географический регион, а также различные расовые группы в том же географическом регионе имеют существенные различия в том, какой микроорганизм является доминирующим в среде влагалища. В большинстве популяций L. crispatus является доминирующим изолятом, а у белых женщин L. crispatus и/или L. jensenii более распространены, чем любые другие виды Lactobacillus [6].
Среди афроамериканок в США недавно обнаружено превалирование при БВ грамотрицательных бактерий BVAB1, которые ранее ошибочно воспринимались как Mobiluncus spp.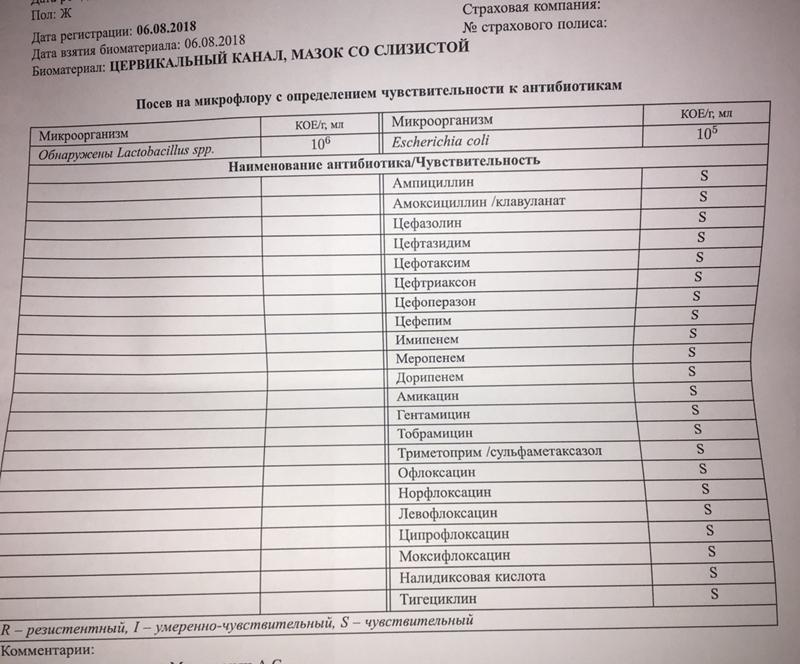 [7].
[7].
В недавнем метаанализе, включившем более 10 000 женщин, доказана связь между БВ и предраковыми состояниями, а именно цервикальной интраэпителиальной неоплазией/дисплазией [5]. Поскольку лишь у меньшинства пациенток, ифицированных ВПЧ, развивается дисплазия шейки матки, изучение цервикального канцерогенеза должно включать наличие дополнительного фактора, способствующего ему. Этим фактором и является БВ. Биохимические изменения в вагинальных выделениях женщин с БВ включают образование продуктов метаболизма, таких как пропионат и бутират, способные повреждать эпителиальные клетки. Кроме того, БВ-ассоциированные анаэробы выделяют летучие амины (особенно путресцин, триметиламин и кадаверин), которые появляются в вагинальной среде после преобразования аминокислот, полученных из-за обилия анаэробов, и формируют в сочетании с нитритами (производимые из нитратов бактерий) нитрозамины. Эти канцерогенные соединения способны образовывать аддукты ДНК и, следовательно, мутагенные события. Локальное накопление нитрозаминов во время эпизодов БВ может способствовать клеточной трансформации в эпителии шейки матки в комплексе с другими онкогенными агентами, такими как ВПЧ-инфекция. Кроме того, у пациенток с БВ и дисплазией отмечен измененный профиль местного иммунитета шейки, а именно оксид азота (NO) и концентрации цитокинов (ИЛ-6, ИЛ-8 и ИЛ-10). Наконец, еще одним важным дополнительным кофактором цервикального канцерогенеза может быть относительное отсутствие перекиси водорода (h3O2), в норме производимой лактобактериями. Это препятствует селективной индукции апоптоза, которая представляет собой ключевой элемент стимулируемой лактобактериями противоопухолевой защиты [5].
Локальное накопление нитрозаминов во время эпизодов БВ может способствовать клеточной трансформации в эпителии шейки матки в комплексе с другими онкогенными агентами, такими как ВПЧ-инфекция. Кроме того, у пациенток с БВ и дисплазией отмечен измененный профиль местного иммунитета шейки, а именно оксид азота (NO) и концентрации цитокинов (ИЛ-6, ИЛ-8 и ИЛ-10). Наконец, еще одним важным дополнительным кофактором цервикального канцерогенеза может быть относительное отсутствие перекиси водорода (h3O2), в норме производимой лактобактериями. Это препятствует селективной индукции апоптоза, которая представляет собой ключевой элемент стимулируемой лактобактериями противоопухолевой защиты [5].
У небеременных женщин наличие БВ связано с повышенным риском инфицирования верхних половых путей неполовыми инфекциями и ИППП, а также ВИЧ-инфекции. При беременности БВ увеличивает риск постабортного сепсиса, раннего выкидыша, привычных выкидышей, позднего выкидыша, преждевременного разрыва мембран, спонтанных преждевременных схваток и преждевременных родов, гистологического хориоамнионита и послеродового эндометрита.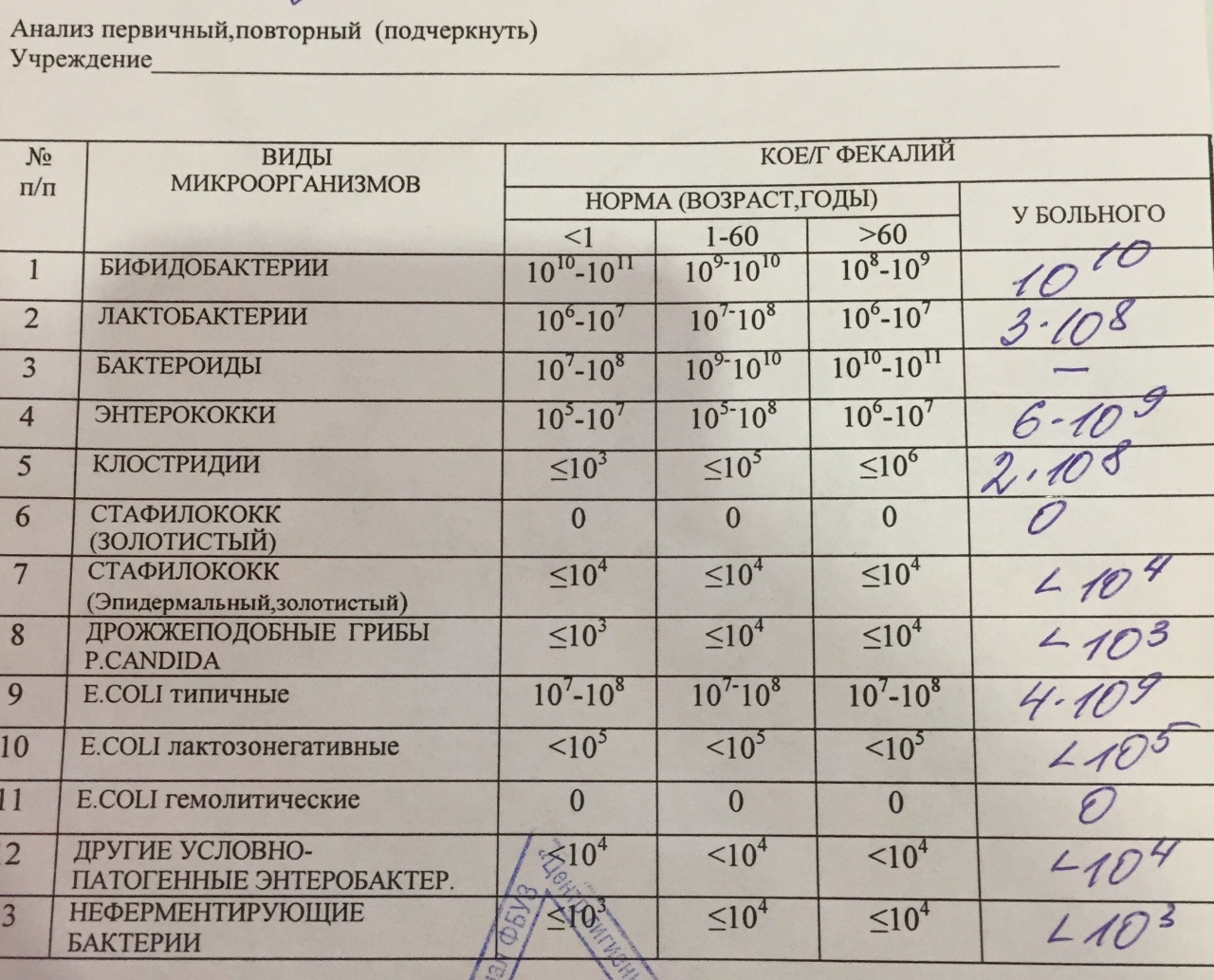 В результате аномальная вагинальныя флора может предрасполагать к возрастанию колонизации половых путей, инфильтрации плодных оболочек, микробной инвазии амниотической полости и повреждению плода [6].
В результате аномальная вагинальныя флора может предрасполагать к возрастанию колонизации половых путей, инфильтрации плодных оболочек, микробной инвазии амниотической полости и повреждению плода [6].
При тщательном наблюдении за 49 женщинами (вагинальные образцы забирали еженедельно во время беременности и ежемесячно после родов) отмечено, что с риском преждевременных родов связано сравнительно большее разнообразие представленных в родовых путях микроорганизмов, а максимальный риск оказался у женщин, в вагинальных выделениях которых было мало лактобактерий, а также микроорганизмов вида Gardnerella spp и Ureaplasma spp. У большинства женщин выявлены послеродовые нарушения вагинальной микробиоты со снижением Lactobacillus spp и увеличением различных анаэробов, таких как Peptoniphilus, Prevotella и Anaerococcus видов. Это нарушение не было связано с гестационным возрастом при родах и сохраняется до 1 года после родов. Полученные данные имеют важные последствия для прогнозирования преждевременного родоразрешения и для понимания потенциального воздействия стойких изменений послеродовой микробиоты на состоянии здоровья матерей, в том числе исходов последующих беременностей в случае короткого интервала между ними [8].
Лабораторная диагностика БВ
БВ может быть диагностирован клинически или с использованием комплекса клинических критериев, микроскопических, энзимологических, хроматографических методов, а также с использованием качественных или полуколическтвенных культуральных методов [6].
В мировой медицинской практике пользуются клинико-лабораторными критериями, предложеными Amsel R. (1983 г.), указанные в таблице 2 [9]. Диагноз бактериального вагиноза считается подтвержденным при наличии трех или четырех признаков из предложенных критериев:
|
Таблица 2. Клинико-лабораторные критерии бактериального вагиноза [9] |
|||
| Критерии |
№ |
Определение |
Признак БВ |
| Клинический |
I |
Осмотр влагалища зеркалом, кольпоскопия | Обильные гомогенные, бело-серые с неприятным запахом выделения |
| Клинико-лабораторный |
II |
Определение рН влагалища индикаторной полоской | рН > 4,5 |
|
III |
Тест КОН (whiff test) — добавление к выделениям из влагалища в пробирке 10% КОН | Появление специфического запаха | |
| Лабораторный |
IV |
Микроскопия мазка из выделений из влагалища как нативного препарата или окрашенного по Граму | Обнаружение «ключевых клеток»* |
Примечание: *«Ключевые клетки» — это зрелые эпителиальные клетки с адгезированными на них микроорганизмами (гарднереллой, мобилункусом, грамположительными кокками). Можно получить ложные положительные результаты, выявив эпителиальные клетки с адгезированными на них лактобактериями; в этом случае необходимо произвести микроскопию влагалищных мазков, окрашенных по Граму. Можно получить ложные положительные результаты, выявив эпителиальные клетки с адгезированными на них лактобактериями; в этом случае необходимо произвести микроскопию влагалищных мазков, окрашенных по Граму.
|
|||
Диагностически значимым считается наличие хотя бы 3 положительных признаков из 4:
1. Клинические проявления.
2. Повышение pH отделяемого влагалища > 4,5.
3. Положительный аминовый тест (усиление запаха гнилой рыбы при реакции с 10% КОH).
4. Критерии микроскопии мазка по Граму: слущенный эпителий в большом количестве, «ключевые клетки» составляют 20% от всех эпителиальных, лейкоциты единичные.
Самой высокой чувствительностью и специфичностью в диагностике бактериального вагиноза обладает культуральный метод. Его высокая информативность обусловлена качественно-количественными показателями состава микробиоценоза влагалища. Соответственно, при бактериальном вагинозе наблюдается уменьшение количества лактобацилл и повышение содержания условно-патогенной флоры. Недостатки метода: относительная дороговизна и длительность выполнения. Исследование ДНК гарднерелл в соскобах из мест поражения методом ПЦР является важным дополнительным критерием БВ.
Недостатки метода: относительная дороговизна и длительность выполнения. Исследование ДНК гарднерелл в соскобах из мест поражения методом ПЦР является важным дополнительным критерием БВ.
1. Преобладание эпителиальных клеток над лейкоцитами (не более 30 в поле зрения).
2. Отсутствие визуальных признаков воспаления.
3. Наличие не менее 20% ключевых клеток.
4. Обнаружение при иммерсионной микроскопии менее 5 лактобацилл в поле зрения.
5. Полимикробная картина мазка (обильная полимикробная кокковая и палочковая Г-/ Г+ флора.
6. Повышение бактериальной обсемененности в цитологическом препарате.
Критерии Нугента (Ньюджента)
Невысокая чувствительность критериев Амселя и наличие бессимптомных форм бактериального вагиноза заставило искать другие методы и критерии подтверждения диагноза. В конце 80-х гг. Spiegel предложил использовать балльную систему для диагностики бактериального вагиноза с учетом соотношения морфотипов лактобацилл и вагинальной гарднереллы при микроскопии окрашенного по Граму мазка из влагалища.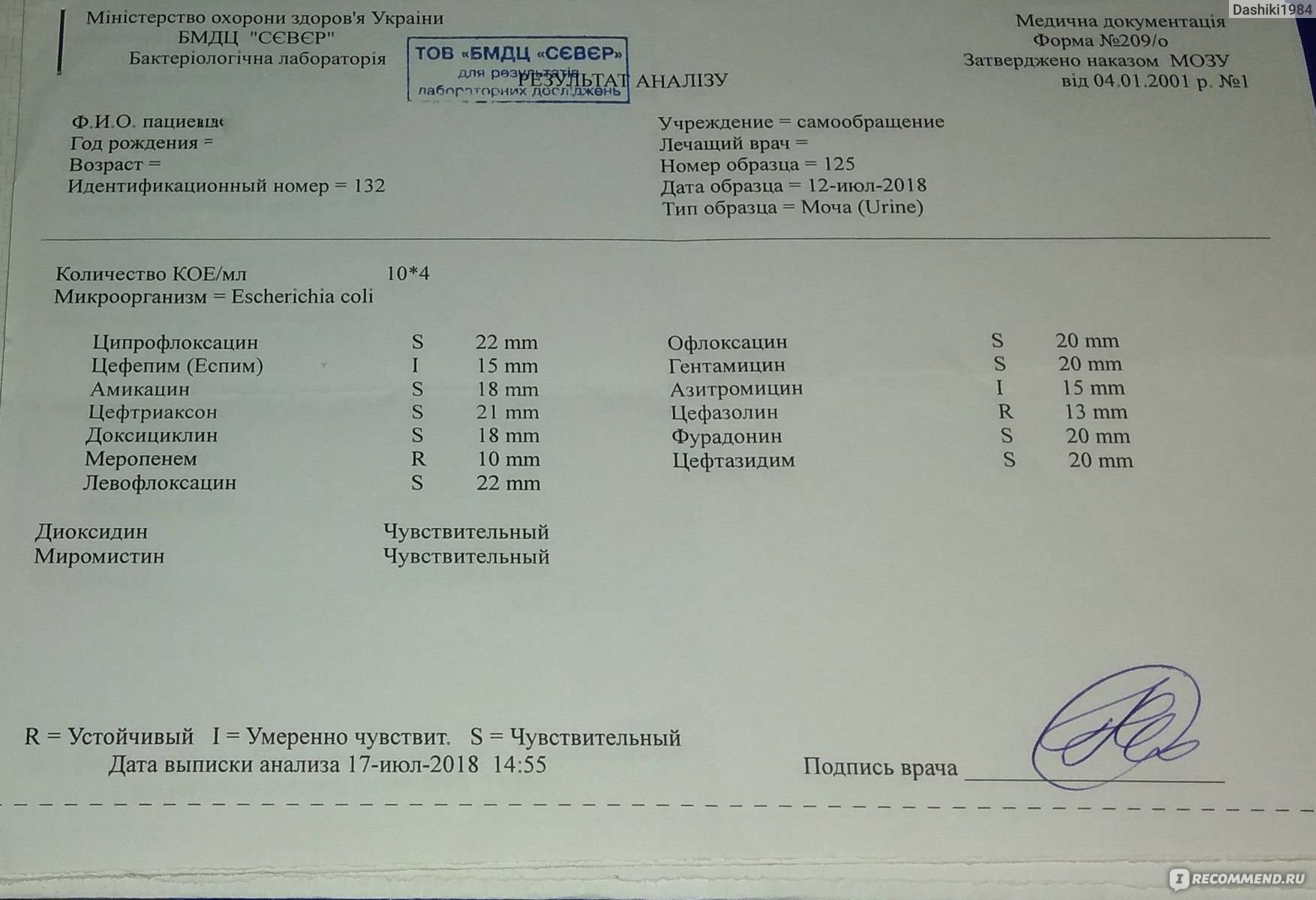 Однако система не прижилась, и только в 1991 г. Nugent RP и соавт. предложили свои лабораторные критерии диагностики бактериального вагиноза (Nugent’s Diagnostic Criteria for Bacterial Vaginosis), которыми до сих пор широко пользуются в мировой медицине [10]. В основе лежит система баллов (очков) от 0 до 7 и их комбинация для диагностики и оценки степени бактериального вагиноза по оценке трех бактериальных морфотипов влагалища (табл. 3):
Однако система не прижилась, и только в 1991 г. Nugent RP и соавт. предложили свои лабораторные критерии диагностики бактериального вагиноза (Nugent’s Diagnostic Criteria for Bacterial Vaginosis), которыми до сих пор широко пользуются в мировой медицине [10]. В основе лежит система баллов (очков) от 0 до 7 и их комбинация для диагностики и оценки степени бактериального вагиноза по оценке трех бактериальных морфотипов влагалища (табл. 3):
А — Лактобациллы — большие грампозитивные палочки (Lactobacillus acidophilus: large gram-positive rods)
B — Вагинальная гарднерелла и бактероиды — мелкие грамвариабельные и грамотрицательные кокки (Gardnerella vaginalis and Bacteroides species :small gram-variable or gram-negative rods)
C — Мобилункус — изогнутые грамвариабельные палочки (Mobiluncus species:curved gram-variable rods)
Таблица 3. Мазок из влагалища окрашивают по Граму и считают отдельно количество выявленных морфотипов под иммерсионной системой микроскопа Мазок из влагалища окрашивают по Граму и считают отдельно количество выявленных морфотипов под иммерсионной системой микроскопа |
|||
| Баллы |
A Lactobacilli |
B Gardnerella |
C Mobiluncus |
|
0 |
более 30 морфотипов |
нет морфотипов |
нет морфотипов |
|
1 |
5—30 морфотипов | один морфотип | один морфотип |
|
2 |
1—4 морфотипа |
1—4 морфотипа |
1—4 морфотипа |
|
3 |
один морфотип |
5—30 морфотипов |
5—30 морфотипов |
|
4 |
нет морфотипов |
более 30 морфотипов | более 30 морфотипов |
Количество полученных баллов суммируют (A + B + C). 0—3 балла: нормальная микрофлора; 4—6 баллов: промежуточная микрофлора; => 7 баллов: бактериальный вагиноз [10]. 0—3 балла: нормальная микрофлора; 4—6 баллов: промежуточная микрофлора; => 7 баллов: бактериальный вагиноз [10].
|
|||
B недавнем исследовании проведено сопоставление критериев Amsel и Nugent, в результате оказалось, что критерии Amsel несколько менее информативны, однако в условиях отсутствия специализированной лаборатории могут быть использованы [11].
В последние годы мировым научным сообществом разработаны критерии дифференциальной клинико-лабораторной диагностики БВ и других подобных или ассоциированных с ним состояний (заболеваний). Существуют неспецифические проявления, которые могут быть зафиксированы гинекологом с последующим более точным лабораторным анализом (табл. 4) [12].
|
Таблица 4. Дифференциальная диагностика синдрома вагинальных выделений (бактериальный вагиноз, вульвовагинальный кандидоз, трихомониаз) [12] |
|||
| Показатели |
БВ |
ВВК |
Трихомониаз |
|
Выделения |
Бело-серого цвета, обильные |
Творожистые или сметанообразные белого цвета |
Пенистые, желто-зеленого цвета, обильные |
|
Запах |
Да |
Нет |
Да |
| Зуд, жжение, раздражение |
Нет |
Да |
Да |
|
Отек, гиперемия |
Нет |
Да |
Да |
| Диспареуния |
Нет |
Да |
Да |
| pH | > 4,5 | ≤ 4,5 | > 4,5 |
| Количество лейкоцитов |
Норма |
Повышенное |
Повышенное |
| Микроскопия мазка по Граму | Ключевые клетки | Грибы | Трихомонады |
|
Культуральный метод |
Не проводится |
Грибы рода Candida |
Трихомонады |
Примечание.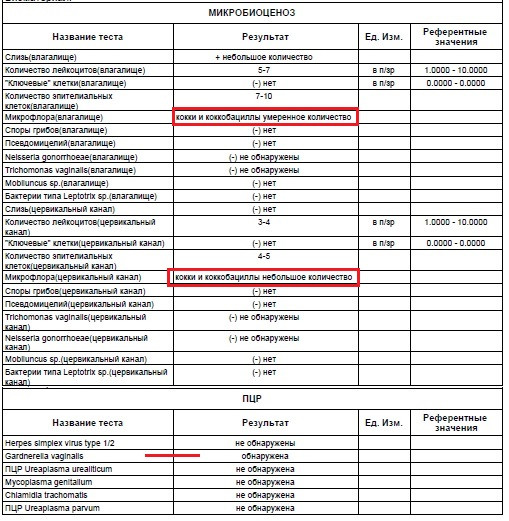 БВ — бактериальный вагиноз, ВВК — вульвовагинальный кандидоз. БВ — бактериальный вагиноз, ВВК — вульвовагинальный кандидоз. |
|||
Лечение
Признание важности БВ и его связи с ИППП и с неблагоприятным репродуктивным прогнозом привело к поиску наилучших и более всеобъемлющих вариантов лечения. Существует широкий круг дифференциальной диагностики при вагинальных выделениях, и успех лечения часто зависит от правильного диагноза, тем не менее большому проценту пациентов терапия проводится без дополнительных специфических тестов.
Наличие широкого спектра терапевтических возможностей, диагностирующих основные причины вагинита, и отсутствие четкого диагноза у 30% больных даже после дополнительного дорогостоящего обследования, объясняет, почему многие гинекологи используют эти препараты. Неправильный диагноз или отказ диагностировать другие инфекции, связанные главным образом в случаях БВ и инфицировании T. vaginalis, может привести к неадекватному лечению, новому обострению и повторному заражению.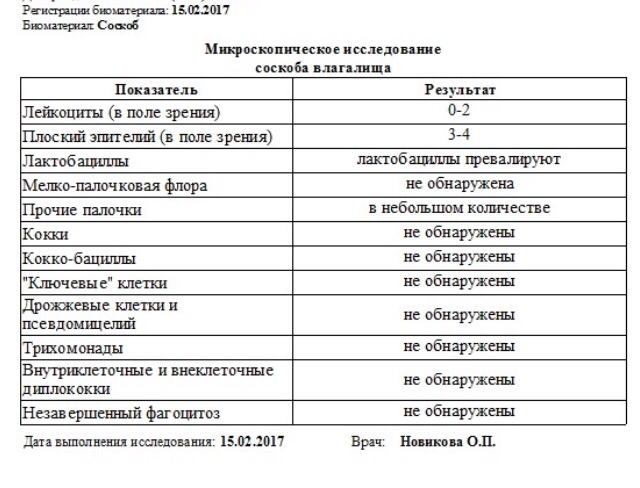
У небеременных женщин лечение не только устранит вагинальные выделения, но и снизит вероятность возникновения инфекционных осложнений после возможных у каждой женщины аборта и/или операции по удалению матки. Кроме того, лечение БВ за счет восстановления кислой рН во влагалище уменьшает риск инфицирования вирусом иммунодефицита, другими заболеваниями, передающимися половым путем.
У беременных женщин лечение БВ, наряду с вышеназванными эффектами, способствует снижению риска развития осложнений беременности, а именно преждевременного отхождения околоплодных вод, начала родовой деятельности (схваток) и собственно родов, а также послеродового воспаления внутренней поверхности матки (эндометрита). Лечению должны подвергаться и беременные с бессимптомным течением БВ, особенно в случае наличия угрозы преждевременных родов.
Препаратом выбора в лечении БВ является клиндамицин
Это антибиотик группы линкозамидов для местного применения в гинекологии. Механизм действия препарата связан с нарушением внутриклеточного синтеза белка в микробной клетке на уровне 50S-субъединицы рибосом. Оказывает бактериостатическое действие, а в более высоких концентрациях в отношении некоторых микроорганизмов — бактерицидное. Обладает широким спектром действия. Активен в отношении микроорганизмов, вызывающих бактериальные вагинозы:
Оказывает бактериостатическое действие, а в более высоких концентрациях в отношении некоторых микроорганизмов — бактерицидное. Обладает широким спектром действия. Активен в отношении микроорганизмов, вызывающих бактериальные вагинозы:
• Mobiluncus spp.
• Bacteroides spp.
• Mycoplasma hominis.
• Peptostreptococcus spp.
Клиндамицин (Далацин). Форма выпуска: крем вагинальный и суппозитории вагинальные. 5 г крема (1 доза) вагинального 2% и один вагинальный суппозиторий содержат: клиндамицина фосфат 100 мг.
Фармакокинетика. После однократного интравагинального введения 100 мг клиндамицина в среднем 4% от введенной дозы подвергается системной абсорбции. Cmax в плазме крови составляет в среднем 20 нг/мл.
Клинических исследований по применению клиндамицина у женщин в I триместре беременности не проводилось, поэтому применение Клиндацина в I триместре беременности возможно только в том случае, когда ожидаемая польза для матери превышает риск для плода. Применение во II и III триместрах беременности возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода (адекватных и строго контролируемых исследований у беременных женщин не проводили, клиндамицин проходит через плаценту и может концентрироваться в печени плода, однако осложнений у человека не зарегистрировано). В результате исследований не установлено, снижает ли лечение бактериального вагиноза риск таких неблагоприятных исходов беременности, как преждевременный разрыв плодных оболочек, преждевременное начало родов или преждевременное родоразрешение. Категория действия на плод по FDA – B.
Применение во II и III триместрах беременности возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода (адекватных и строго контролируемых исследований у беременных женщин не проводили, клиндамицин проходит через плаценту и может концентрироваться в печени плода, однако осложнений у человека не зарегистрировано). В результате исследований не установлено, снижает ли лечение бактериального вагиноза риск таких неблагоприятных исходов беременности, как преждевременный разрыв плодных оболочек, преждевременное начало родов или преждевременное родоразрешение. Категория действия на плод по FDA – B.
В исследовании, проведенном в Швейцарии, были обследованы 5 377 беременных с симптомами потенциальных акушерских осложнений при сроке 25—37 нед. беременности. Женщины с симптомами были тестированы при помощи культурального исследования на наличие Mycoplasma hominis и Ureaplasma spp. и пролечены клиндамицином в случае положительного результата. В результате лечения существенно уменьшился процент преждевременных родов и респираторных осложнений у новорожденных [13].
Наши коллеги из Бельгии провели поиск в базах данных PubMed и Web of Science для того, чтобы найти новые подходы в профилактике, лечении и предупреждении рецидивов БВ. В результате оказалось, что основными препаратами в лечении БВ остаются клиндамицин и метронидазол. Интенсивно изучаются другие медикаменты, такие как тинидазол, рифаксимин, нитрофуран, декалинума хлорид, аскорбиновая кислота (витамин С) и молочная кислота. Предполагают, что перспективно использование комбинированного режима, чередующегося и долговременного приема для предупреждения рецидивов. Несомненна и польза параллельного назначения пробиотиков [14].
В мультицентровом рандомизированном двойном слепом исследовании, проведенном в Германиии, Австрии и Швейцарии, сопоставлены эффективность и переносимость 2% вагинально крема клиндамицина (5 г на ночь в течение 7 дней) и перорального метронидазола (500 мг орально в течение 7 дней) в ведении БВ. Пациентов наблюдали через 5—10 дней и 25—39 дней после завершения лечения. В результате излечение или улучшение было отмечено через 1 месяц у 83% пациентов в группе клиндамицина против 73% в группе метронидазола, побочные эффекты отмечены с равной частотой (12%) в обеих группах [15].
В результате излечение или улучшение было отмечено через 1 месяц у 83% пациентов в группе клиндамицина против 73% в группе метронидазола, побочные эффекты отмечены с равной частотой (12%) в обеих группах [15].
Недавно в мировой литературе появилось понятие аэробного вагинита. Аэробный вагинит — воспалительное заболевание влагалища, вызванное аэробной микрофлорой при резком снижении или отсутствиии нормальной лактофлоры влагалища. Ранее под термином «аэробный вагинит» подразумевался бактериальный вагинит. В основе аэробного вагинита, как и при бактериальном вагинозе, лежит снижение или отсутствие нормальной лактофлоры влагалища и замена ее на аэробные бактерии. Точные причины и механизм развития аэробного вагинита пока неизвестен. Также неизвестно, почему в одних случаях происходит размножение анаэробной микрофлоры и развитие бактериального вагиноза, а в других заселение влагалища аэробными микроорганизмами и развитие аэробного вагинита. Наиболее часто встречающиеся этиологические агенты аэробного вагинита (Escherichia coli, Enterococcus sp. , бета-гемолитический стрептококк группы А, золотистый стафилококк). В решении этого противоречия оказалось, что вагинальные суппозитории, содержащие канамицин или клиндамицин, показали высокую эффективность в купировании аэробного вагинита у небеременных женщин. Кроме того, клиндамицин (вагинальные суппозитории) в сочетании с пробиотиками оказались лучшим выбором для беременных с аэробным вагинитом, чем метронидазол [16].
, бета-гемолитический стрептококк группы А, золотистый стафилококк). В решении этого противоречия оказалось, что вагинальные суппозитории, содержащие канамицин или клиндамицин, показали высокую эффективность в купировании аэробного вагинита у небеременных женщин. Кроме того, клиндамицин (вагинальные суппозитории) в сочетании с пробиотиками оказались лучшим выбором для беременных с аэробным вагинитом, чем метронидазол [16].
Бактериальный вагиноз — давно известное патологическое состояние женской половой сферы с хорошо разработанными критериями клинической диагностики (Амсела и Нугента). Новые возможности молекулярной диагностики постоянно расширяют наши представления о различных видах свойственной организму и чужеродной микрофлоры, свидетельствуя о разнообразии вагинальной микробиоты у каждой отдельной женщины. При этом выбор оптимального препарата предусматривает клиническую эффективность в отношении большинства патогенных микроорганизмов. Таким препаратом может служить клиндамицин, значимость которого в лечении бактериального вагиноза не вызывает сомнения в последних научных публикациях.
1. Anderson MR, Klink K, Cohrssen A. Evaluation of vaginal complaints. JAMA, 2004, 291:11:1368–1379.
2. Mitchell H. Vaginal discharge – causes, diagnosis, and treatment. BMJ, 2004, 328:7451:1306–1308.
3. Хрянин А.А., Решетников О.В. Бактериальный вагиноз: новые представления о микробном биосоциуме и возможности лечения. Медицинский совет, 2014, 17: 128-133.
4. Verstraelen H, Swidsinski A. The biofilm in bacterial vaginosis: implications for epidemiology, diagnosis and treatment. Curr Opin Infect Dis, 2013, 26: 86–89.
5. Gillet E, Meys JFA, Verstraelen H et al. Association between bacterial vaginosis and cervical intraepithelial neoplasia: Systematic review and meta-analysis. Plos One, 2012, 7, Issue 10 e45201.
6. Lamont RF, Sobel JD, Akins RA et al. The vaginal microbiome: New information about genital tract flora using molecular based techniques BJOG, 2011, 118(5): 533–549.
7. Muzny CA, Sunesara IR, Griswold ME et al. Association between BVAB1 and high Nugent scores among women with bacterial vaginosis. Diagn Microbiol Infect Dis., 2014 December, 80(4): 321–323.
Muzny CA, Sunesara IR, Griswold ME et al. Association between BVAB1 and high Nugent scores among women with bacterial vaginosis. Diagn Microbiol Infect Dis., 2014 December, 80(4): 321–323.
8. Di Giulio DB, Callahan BJ, McMurdie PJ et al. Temporal and spatial variation of the human microbiota during pregnancy Proceedings of the National Academy of Sciences 2015/ www.pnas.org/cgi/doi/10.1073/pnas.1502875112.
9. Amsel R, Totten PA, Spiegel CA, et al. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am J Med, 1983, 74(1): 14–22.
10. Nugent RP, Krohn MA, Hillier SL. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of gram stain interpretation. J Clin Microbiol, 1991, 29(2): 297–301.
11. Mohammadzadeh F, Dolatian M, Jorjani M, Alavi Majd H. Diagnostic value of Amsel’s clinical criteria for diagnosis of bacterial vaginosis. Glob J Health Sci., 2014 Oct 29, 7(3): 8-14.
12. Workowski KA. Sexually transmitted diseases treatment guidelines, 2010. MMWR Recommend Rep 2010; 59:61–63.
13. Vouga M, Greub G, Prodhom G, et al. Treatment of genital mycoplasma in colonized pregnant women in late pregnancy is associated with a lower rate of premature labour and neonatal complications. Clin Microbiol Infect, 2014 Oct, 20(10): 1074-9.
14. Donders GG, Zodzika J, Rezeberga D. Treatment of bacterial vaginosis: what we have and what we miss. Expert Opin Pharmacother, 2014 Apr, 15(5): 645-57.
15. Fischbach F, Petersen EE, Weissenbacher ER, et al. Efficacy of clindamycin vaginal cream versus oral metronidazole in the treatment of bacterial vaginosis. Obstet Gynecol, 1993 Sep, 82(3): 405-10.
16. Han C, Wu W, Fan A, Wang Y, Zhang H, Chu Z, Wang C, Xue F. Diagnostic and therapeutic advancements for aerobic vaginitis. Arch Gynecol Obstet, 2015 Feb, 291(2): 251-7.
Кишечная инфекция в матке
Воспаление матки — инфекционно-воспалительный процесс, затрагивающий слизистую и/или мышечную оболочку. Может сопровождаться выраженными клиническими симптомами или протекать хронически с периодами обострений и ремиссий. Причиной воспаления является инфекция (кишечная палочка, микоплазмы, хламидии, энтеробактерии, анаэробные бактерии, вирусы), проникшие в матку. Путь заражения, как правило, восходящий — из нижерасположенных половых органов.
Может сопровождаться выраженными клиническими симптомами или протекать хронически с периодами обострений и ремиссий. Причиной воспаления является инфекция (кишечная палочка, микоплазмы, хламидии, энтеробактерии, анаэробные бактерии, вирусы), проникшие в матку. Путь заражения, как правило, восходящий — из нижерасположенных половых органов.
Причины развития кишечной инфекции в матке
Микроорганизм Escherichia coli является нормальными обитателем прямой кишки. При попадании во влагалище, а затем в маточную полость кишечная палочка вызывает воспаление. Это может произойти вследствие:
- неправильной техники подмывания;
- недостаточной гигиены половых органов;
- ношения тесного синтетического белья, стрингов;
- совмещения анального и вагинального секса;
- смены полового партнера.
Проникновению и размножению кишечной палочки в матке способствует низкий иммунитет, резкие перепады температуры, менопауза, эндокринные нарушения в организме. Заселение патогенной микрофлорой может быть связано со спринцеваниями, длительным приемом антибактериальных средств, хроническими инфекциями (общими и половыми).
Заселение патогенной микрофлорой может быть связано со спринцеваниями, длительным приемом антибактериальных средств, хроническими инфекциями (общими и половыми).
Предпосылками занесения бактерии могут оказаться инструментальные медицинские манипуляции, выскабливание, гистеросальпингография, гистероскопия, введение внутриматочной спирали, травмы родовых путей при родах.
Мы подготовили для Вас список исследований, которые помогут разобраться с данной проблемой:
30 рабочиx дней
Микробиом кишечника
12000 ₽
ПодробнееСимптомы кишечной инфекции в матке
Воспаление возникает в месте повреждения слизистого слоя, из-за отека он утолщается, становится рыхлым. При слабой иммунной защите кишечная инфекция может распространиться в мышечный слой матки. Признаки воспаления появляются через 3–4 дня после инфицирования эндометрия:
- субфебрильная или высокая температура;
- озноб;
- общее ухудшение самочувствия;
- боли внизу живота, отдающие в поясницу или область паха;
- выделения из влагалища гнойно-серозного характера, возможно с примесями сукровицы.

При хроническом воспалении в матке, вызванном кишечной инфекцией, женщины жалуются на нерегулярные менструации, постоянные ноющие тазовые боли, межменструальные мажущие кровянистые выделения.
Лабораторная диагностика позволяет выявить инфекцию и определить ее чувствительность к антибиотикотерапии. Тяжесть воспалительного процесса определяют по клиническому анализу крови. УЗИ позволяет подтвердить воспаление.
Лечение при кишечной инфекции в матке
Целями терапии являются:
- ликвидация кишечной палочки;
- предотвращение хронического воспаления;
- восстановление менструального цикла;
- сохранение репродуктивной функции женщины.
Как острый, так и хронический воспалительный процесс в матке, вызванный кишечной инфекцией, требует антибактериальной терапии. В целях симптоматического лечения применяют обезболивающие, общеукрепляющие и иммуностимулирующие средства, пробиотики с лактобактериями.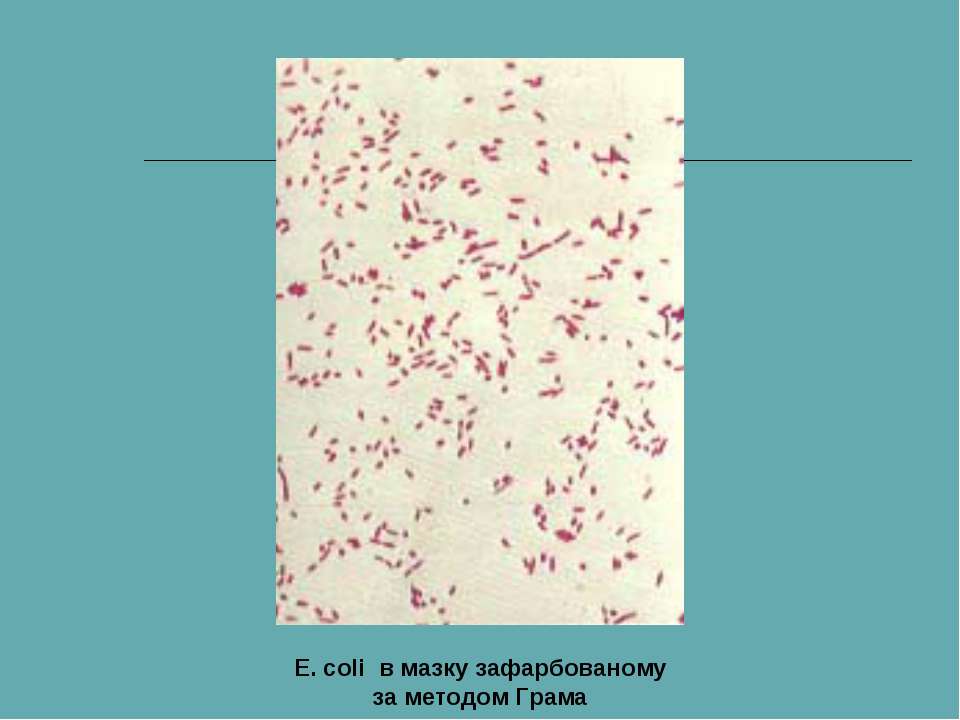 Для терапии поврежденного эндометрия и восстановления цикла менструации используют физиотерапию.
Для терапии поврежденного эндометрия и восстановления цикла менструации используют физиотерапию.
Профилактика кишечной инфекции в матке
Поскольку основной путь заражения восходящий, важно не допускать проникновение Escherichia coli во влагалище. Для предупреждения попадания кишечной инфекции во влагалище, а затем в матку рекомендуется:
- подмываться спереди назад;
- не злоупотреблять спринцеваниями;
- поддерживать интимную зону в чистоте и сухости;
- подмываться после мочеиспускания, полового акта;
- отказаться от использования дезодорированных средств интимной гигиены;
- избегать незащищенных половых контактов.
В медико-генетическом центре «Геномед» можно пройти исследования на склонность к заболеваниям внутренних органов и обнаружить предпосылки к дисфункциям иммунной системы.
Антибиотики при бактериальной инфекции в моче во время беременности при отсутствии симптомов
В чем суть проблемы?
Может ли применение антибиотиков во время беременности у женщин с мочевой инфекцией, но с отсутствием симптомов, улучшить исходы у женщин и их детей?
Почему это важно?
Бактериальная инфекция в моче без каких-либо характерных симптомов, связанных с инфекцией мочевыводящих путей (асимптоматическая/бессимптомная бактериурия), происходит в ряде случаев (от 2% до 15%) беременностей. Из-за изменений, происходящих в организме, у беременных женщин чаще развивается почечная инфекция (пиелонефрит), если у них есть инфекция мочевыводящих путей. Инфекция может также способствовать преждевременному рождению ребенка (до 37 недель) или рождению ребенка с низкой массой тела (менее 2500 г (5,5 фунтов)).
Из-за изменений, происходящих в организме, у беременных женщин чаще развивается почечная инфекция (пиелонефрит), если у них есть инфекция мочевыводящих путей. Инфекция может также способствовать преждевременному рождению ребенка (до 37 недель) или рождению ребенка с низкой массой тела (менее 2500 г (5,5 фунтов)).
Какие доказательства мы нашли?
Мы обнаружили 15 рандомизированных контролируемых исследований с участием более 2000 беременных женщин с бессимптомными инфекциями мочевыводящих путей. Антибиотики могут быть эффективными в снижении частоты инфекции почек у матери (12 исследований, 2017 женщин) и санации [очищении] мочи от инфекции (четыре исследования, 596 женщин). Они также могут снизить частоту преждевременных родов (три исследования, 327 женщин) и рождения детей с низкой массой тела (шесть исследований, 1437 младенцев). Ни в одном из исследований не были адекватно оценены какие-либо неблагоприятные эффекты антибиотикотерапии у матери или ее ребенка, и часто способ проведения исследования не был описан должным образом.
Мы оценили три основных исхода с помощью подхода GRADE и обнаружили доказательства низкой определенности, что лечение антибиотиками может предотвратить развитие пиелонефрита, преждевременные роды и рождение детей с массой тела менее 2500 г.
Что это значит?
Антибактериальная терапия может снизить риск инфекций почек у беременных женщин с бессимптомной мочевой инфекцией. Антибиотики могут также уменьшить вероятность рождения ребенка на слишком ранних сроках или с низкой массой тела при рождении. Однако из-за низкой определенности доказательств сделать выводы сложно; необходимы дополнительные исследования.
заболевание, симптомы, лечение, причины, диагностика
Советы будущим папам.
Когда пара пытается зачать малыша, большая часть внимания сосредоточена на женщине, но ведь мужчина в равной степени участвует в событии. Если вы планируете, стать отцом, прочитайте, что можно сделать еще до зачатия, чтобы обеспечить своей второй половине здоровую беременность.
С чего же нужно начинать подготовку к беременности, кроме самого желания родителей иметь ребенка?
При планировании беременности консультацию у врачей должна проходить не только будущая мать, но и отец. Это очень важно для здоровья будущего малыша. Некоторых врачей семейная пара должна посетить вместе, а некоторых — по отдельности. Например, женщине совершенно необходима консультация гинеколога, а мужчине — консультация уролога-андролога.
Основные методы диагностики перед зачатием ребенка.
На первичном приеме врач-уролог проводит общий опрос мужчины с целью выявления хронических заболеваний, перенесенных ранее половых инфекций, аллергических реакций, операций, травм органов мошонки и др.
Во время общего осмотра на приеме уролога врач определяет гормональный статус пациента, оценивает развитие наружных половых органов и вторичных половых признаков.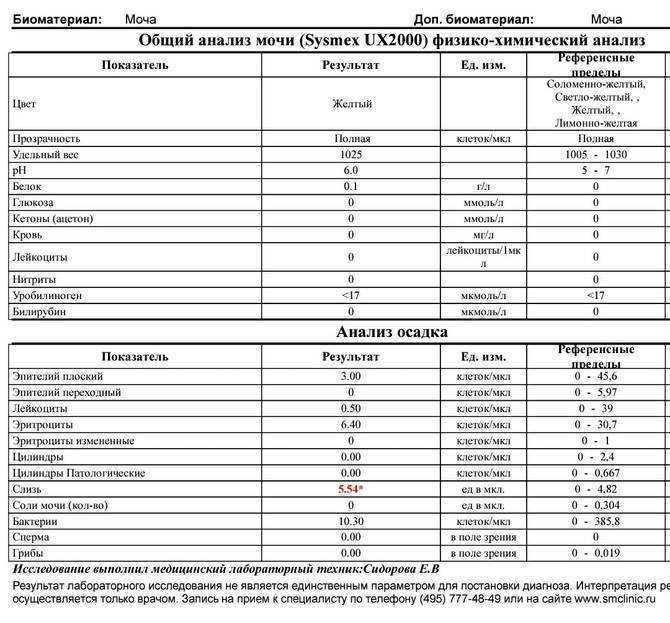 Если объем яичек меньше нормы – это свидетельствует о недостатке мужских половых гормонов (чаще тестостерона). На это же указывают неправильный рост и расположение лобковых волос, а также их отсутствие. С целью выявления патологических изменений кавернозных тел проводится осмотр и обследование полового члена. После опроса и общего осмотра, доктор проводит пальцевое ректальное исследование предстательной железы и взятие секрета простаты на анализ для исключения в ней воспаления (простатита). Затем проводится определение половых рефлексов.
Если объем яичек меньше нормы – это свидетельствует о недостатке мужских половых гормонов (чаще тестостерона). На это же указывают неправильный рост и расположение лобковых волос, а также их отсутствие. С целью выявления патологических изменений кавернозных тел проводится осмотр и обследование полового члена. После опроса и общего осмотра, доктор проводит пальцевое ректальное исследование предстательной железы и взятие секрета простаты на анализ для исключения в ней воспаления (простатита). Затем проводится определение половых рефлексов.
Для определения способности к оплодотворению мужчины диагностическое обследование начинается в первую очередь со сдачи спермограммы и определения антиспермальных антител в крови и сперме (MAR-тест). В спермограмме оценивают общее количество сперматозоидов, их подвижность и жизнеспособность, наличие патологических форм и др.
Большое значение отводится диагностике половых инфекций, в том числе и скрытой, которая может протекать бессимптомно. Помимо сдачи анализа крови на ВИЧ, сифилис и вирусные гепатиты. Выполняется мазок из мочеиспускательного канала на ПЦР (ДНК-исследование) и бактериологическое исследование мочеполовых инфекций. Нельзя забывать о том, что выявленные у одного из партнеров половые инфекции — это показание к обследованию и лечению (может быть, профилактическому) обоих супругов. В случае заражения будущей мамы половой инфекцией возможны различные осложнения беременности, что негативно повлияет на общее здоровье будущей мамы и развитие плода. Важно отметить, что лечение половых инфекций антибиотиками во время беременности, также негативно влияет на развитие плода. Вот почему многие специалисты обращают на это особое внимание и рекомендуют заблаговременно выполнить анализы на половые инфекции перед зачатием. Кроме того многие возбудители половых инфекций могут стать причинами бесплодия, плохой спермограммы и развития воспалительных заболеваний у мужчин: простатита, воспаления придатков и яичек.
Помимо сдачи анализа крови на ВИЧ, сифилис и вирусные гепатиты. Выполняется мазок из мочеиспускательного канала на ПЦР (ДНК-исследование) и бактериологическое исследование мочеполовых инфекций. Нельзя забывать о том, что выявленные у одного из партнеров половые инфекции — это показание к обследованию и лечению (может быть, профилактическому) обоих супругов. В случае заражения будущей мамы половой инфекцией возможны различные осложнения беременности, что негативно повлияет на общее здоровье будущей мамы и развитие плода. Важно отметить, что лечение половых инфекций антибиотиками во время беременности, также негативно влияет на развитие плода. Вот почему многие специалисты обращают на это особое внимание и рекомендуют заблаговременно выполнить анализы на половые инфекции перед зачатием. Кроме того многие возбудители половых инфекций могут стать причинами бесплодия, плохой спермограммы и развития воспалительных заболеваний у мужчин: простатита, воспаления придатков и яичек.
Сводная таблица выявления возбудителей инфекционных заболеваний в сперме у мужчин с патологическими отклонениями в спермограмме.
C. Keck Seminal tract infection (Human Reproduction Update 1998 г.)
Заболевание и инфекционный возбудитель | Частота выявления при нарушенном спермообразовании |
Хламидиоз Chlamydia trachomatis | 22% |
Уреаплазмоз Ureaplasma urealyticum | 22% |
Вирус папилломы человека Human papillomavirus | 9% |
Цитомегаловирус Cytomegalovirus | 9% |
Энтерококки Enterococci | 31% |
Кишечная палочка Escherichia coli | 13% |
Анаэробные бактерии | 23% |
Вирус герпеса Herpes simplex ½ | 4% |
Вирус Эпштейна-Барр Epstein-Barr virus | 3% |
В случае выявления патологических изменений в спермограмме, не связанных с наличием половых инфекций врач уролог-андролог может назначить дополнительное обследование:
• Иммуноферментный анализ на наличие антител к сперматозоидам.
Определение выработки организмом мужчины антител к тканям собственных яичек и сперматозоидам (антиспермальные антитела) при различных патологических состояниях половых органов.
• УЗИ предстательной железы и органов мошонки.
Выполняется для оценки состояния органов репродукции, проходимости семявыносящих протоков и выявления воспалительных изменений (простатита), варикоцеле, объемных образований и аномалий развития половых органов.
Варикоцеле — варикозное расширение вен яичек. Отток венозной крови через расширенные вены затруднен, поэтому развиваются застойные явления, нарушается кровоснабжение и функция яичек угнетается. В основном варикоцеле поражает левое яичко, но со временем процесс переходит и на второе здоровое яичко. В результате функция обеих яичек значительно угнетается и продукция сперматозоидов снижается.
Крипторхизм — нарушение опущения яичек в мошонку, является фактором риска бесплодия и развития рака яичка, является наиболее частой аномалией развития и причиной патологических изменений в спермограмме.
Нарушение проходимости семявыносящих протоков приводит к азооспермии (полное отсутствие в сперме сперматозоидов). Причины данного нарушения чаще приобретенные заболевания: воспаление придатков и яичек, воспаление предстательной железы и семенных пузырьков, травмы и операции на мочеполовых органах.
• Определение уровня гормонов (гормональный статус).
Гормональные нарушения, приводящие к патологическим изменениям в спермограмме: врожденная или приобретенная недостаточность яичек, недостаточность функции гипоталамуса и гипофиза, гипогонадизм, гиперпролактинемия, нарушения функции щитовидной железы, сахарный диабет. При снижении концентрации тестостерона в крови, наступает угнетение спермообразующей функции яичек. Это объясняется тем, что данный гормон активно участвует в регуляции формирования новых сперматозоидов.
• Генетическое обследование.
Различные генетические аномалии — не редкая причина патологических изменений в спермограмме у мужчин. Знание возможных генетических причин является сейчас обязательными, поскольку позволяет не только установить причину нарушения, но и с осторожностью относиться к применению методов искусственного оплодотворения, которые в таких случаях могут оказаться неэффективными и способствовать передачи детям различных генетических дефектов.
Знание возможных генетических причин является сейчас обязательными, поскольку позволяет не только установить причину нарушения, но и с осторожностью относиться к применению методов искусственного оплодотворения, которые в таких случаях могут оказаться неэффективными и способствовать передачи детям различных генетических дефектов.
Основные методы лечения патологических нарушений в спермограмме.
При определении точных причин нарушения фертильности (способности оплодотворения) применяется рациональное лечение, направленное на устранение причины патологических изменений в спермограмме. При гипогонадизме (снижении гонадотропных гормонов, отвечающих за сперматогенез), гиперпролактинемии (повышение пролактина, негативно влияющего на сперматогенез), нарушениях семяизвержения и других причинах нарушений в спермограмме обычно эффективна медикаментозная гормональная терапия. Возможна терапия, основанная на механизмах нарушения качества спермы – стимуляция сперматогенеза при помощи восстановления гормонального баланса в мужском организме.
Ведущее место в развитии патологических изменений спермограммы занимают инфекционно-воспалительные заболевания половых органов: воспаление предстательной железы, семенных пузырьков, яичек и их придатков. При выявлении у мужчины воспаления показано назначение антибиотиков, хотя применение их может временно ухудшить качество спермы. В данном случае лечение направлено на устранение возбудителя инфекционно-воспалительного процесса в половых органах. Его проводят в соответствии с результатами микробиологического исследования с определением чувствительности к антибиотикам (посев секрета простаты и спермы) для определения возбудителя патологического процесса в семявыносящих путях и подбора наиболее эффективного лекарственного препарата.
На основании подтвержденных нарушений в спермограмме необходимо оказать общеукрепляющее действие и стимулирующее влияние на спермообразующую функцию семенных канальцев, нормализовать минеральный обмен, устранить недостаточность ткани яичек, улучшить питание сперматозоидов в придатках яичек, ускорить рассасывание воспалительных изменений.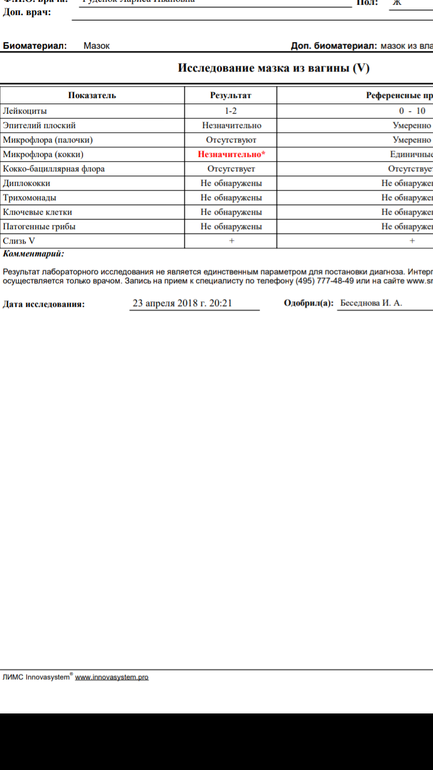 Традиционная медикаментозная терапия при хронических воспалительных заболеваниях органов репродуктивной системы далеко не всегда нормализует показатели спермограммы, что вынуждает искать альтернативные, в частности немедикаментозные, методы восстановления репродуктивной функции у мужчин. В этом случае используется физиотерапевтическое лечение: лазеротерапия, внутривенное лазерное облучение крови, магнитотерапия, электростимуляция динамическими токами. Физиотерапию успешно применяют при снижении подвижности и общего количества сперматозоидов. После воздействия физиотерапии достоверно увеличивается подвижность сперматозоидов, количество морфологически нормальных форм, численность жизнеспособных сперматозоидов.
Традиционная медикаментозная терапия при хронических воспалительных заболеваниях органов репродуктивной системы далеко не всегда нормализует показатели спермограммы, что вынуждает искать альтернативные, в частности немедикаментозные, методы восстановления репродуктивной функции у мужчин. В этом случае используется физиотерапевтическое лечение: лазеротерапия, внутривенное лазерное облучение крови, магнитотерапия, электростимуляция динамическими токами. Физиотерапию успешно применяют при снижении подвижности и общего количества сперматозоидов. После воздействия физиотерапии достоверно увеличивается подвижность сперматозоидов, количество морфологически нормальных форм, численность жизнеспособных сперматозоидов.
Рекомендуемый образ жизни для мужчин перед зачатием.
Мужское здоровье очень чувствительно ко многим вредным факторам образа жизни. Их надо выявить, так как они непосредственно контролируются пациентом. Во время планирования ребенка нужно избегать воздействия этих факторов, чтобы улучшить репродуктивное и общее здоровье мужчины.
• Курение. Отказ от курения — это простое конкретное действие, которое может помочь появлению ребенка;
• Частое употребление алкоголя сопровождается атрофией яичек, снижением уровня мужских половых гормонов;
• Стресс. При хроническом стрессе снижается количество сперматозоидов;
• Умеренные регулярные упражнения являются эффективным методом снижения стресса. Не рекомендуются упражнения связанные с поднятием тяжестей, так как это может привести к расширению вен семенного канатика;
• Питание. Рекомендуются различные диеты для лиц с избыточным весом, ожирением. Избыточная жировая ткань приводит к увеличению в организме женских половых гормонов, что вызывает снижение способности к оплодотворению;
• Тепло — враг мужских половых желез. Постоянное воздействие тепла приводит к ухудшению фертильных свойств спермы. При планируемой беременности рекомендуется избегать саун и горячих ванн.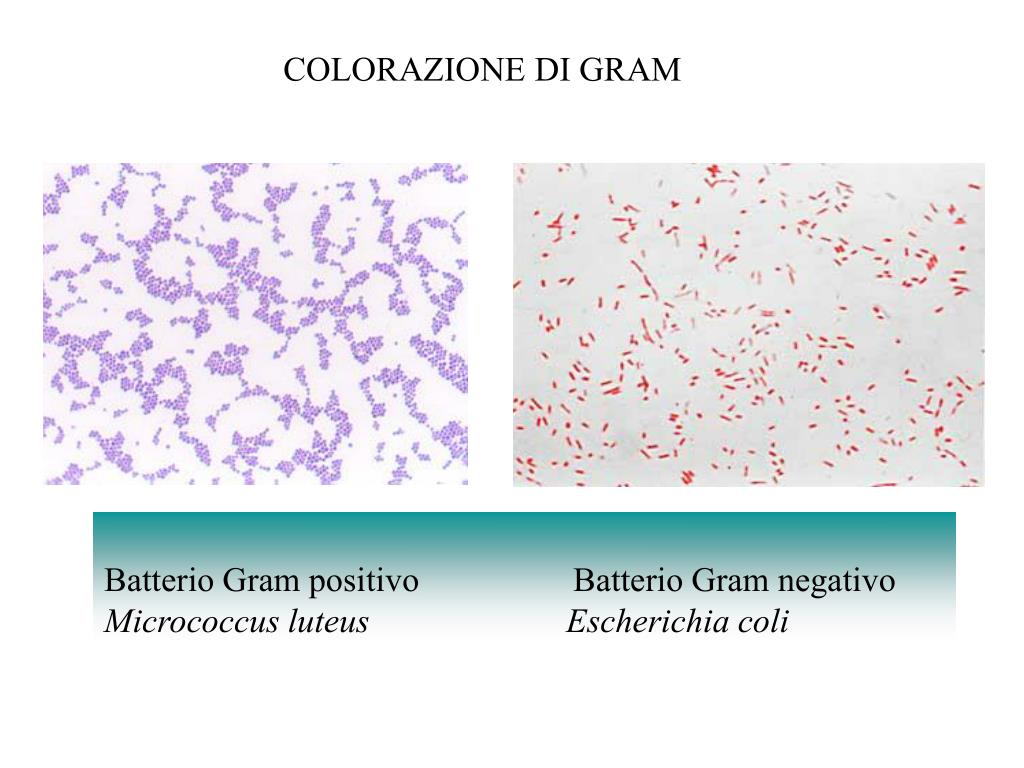 Нельзя носить тесное нижнее белье;
Нельзя носить тесное нижнее белье;
• По возможности не часто пользоваться мобильными телефонами, они негативно влияют на количество и качество спермы;
• Токсичными для яичек являются различные наркотические вещества, промышленные растворители и химические препараты;
• Необходимо предохраняться от заражения инфекциями, передающимися половым путем.
Как правильно собирать сперму на исследование?
Перед получением спермы на исследование необходимо половое воздержание в течение 3-5 дней. Сдавать анализ необходимо в условиях медицинского учреждения в специальный стерильный контейнер.
Основной рекомендованный метод получения спермы для исследования — мастурбация. При заборе спермы на анализ необходимо собрать всю сперму, выделившуюся при семяизвержении, включая самую первую и самую последнюю порции, в стерильный пластиковый контейнер с широким горлышком. Достоверность исследования спермы напрямую зависит как от времени, через которое контейнер со спермой был доставлен в лабораторию, так и условий транспортировки.
Достоверность исследования спермы напрямую зависит как от времени, через которое контейнер со спермой был доставлен в лабораторию, так и условий транспортировки.
Необходимо на контейнере указать точное время, когда произошло семяизвержение. Контейнер со спермой следует оберегать от перепада температур. При транспортировке контейнер со спермой помещается в специальный термос для поддержания температуры, приближенной к температуре тела человека.
Не рекомендуется получать сперму для исследования посредством (1) прерванного полового акта, (2) орального полового акта, (3) полового акта в латексном презервативе. Влагалищные выделения, слюна и компоненты латекса презерватива могут негативно повлиять на качество спермы, приводя к искажению результата исследования.
Преимущества услуги
Удобный график работы
Работаем до позднего вечера, чтобы вам было удобно заняться своим здоровьем после работы
Отсутствие очередей
Система записи пациентов отлажена за много лет работы и действует так, что вас примут точно в выбранное время
Уютный интерьер
Нам важно, чтобы пациенты чувствовали себя комфортно в стенах клиники, и мы сделали все, чтобы окружить вас уютом
Внимание к пациенту
К вашим услугам – внимательный персонал, который ответит на любой вопрос и поможет сориентироваться
Устойчивость к противомикробным препаратам и профиль генетической вирулентности
PLoS One. 2016; 11(1): e0146531.
2016; 11(1): e0146531.
Эмма Саес-Лопес
1 Отделение микробиологии, больничная клиника – Университет Барселоны, Барселона, Испания
2 ISGlobal, Барселона Ctr.Междунар. Здоровье Рез. (CRESIB), Hospital Clinic – Universitat de Barcelona, Барселона, Испания
Elisabet Guiral
1 Отделение микробиологии, больничная клиника – Университет Барселоны, Барселона, Испания
2 ISGlobal, Барселона Ctr. Междунар. Здоровье Рез. (CRESIB), больница-клиника Университета Барселоны, Барселона, Испания
Междунар. Здоровье Рез. (CRESIB), больница-клиника Университета Барселоны, Барселона, Испания
Дитмар Фернандес-Орт
2 ISGlobal, Барселона Ctr. Междунар. Здоровье Рез. (CRESIB), Hospital Clinic – Universitat de Barcelona, Барселона, Испания
Соня Вильянуэва
2 ISGlobal, Барселона Ctr.Междунар. Здоровье Рез. (CRESIB), Больница-клиника – Университет Барселоны, Барселона, Испания
Анна Гонсе
3 BCNatal-Barcelona Центр материнско-фетальной и неонатальной медицины (Клиника и больница Сан-Жоан-де-Деу), Барселона, Испания
4 Institut D´Investigacions Biomèdiques August Pi I Sunyer (DIBAPS), Барселона, Испания
5 Университет Барселоны, Барселона, Испания
6 Центр биомедицинских исследований редких заболеваний (CIBER-ER), Барселона, Испания
Marta López
3 BCNatal-Barcelona Центр материнско-фетальной и неонатальной медицины (Клиника и больница Сан-Жоан-де-Деу), Барселона, Испания
4 Institut D´Investigacions Biomèdiques August Pi I Sunyer (DIBAPS), Барселона, Испания
5 Университет Барселоны, Барселона, Испания
6 Центр биомедицинских исследований редких заболеваний (CIBER-ER), Барселона, Испания
Irene Teixidó
3 BCNatal-Barcelona Центр материнско-фетальной и неонатальной медицины (Клиника и больница Сан-Жоан-де-Деу), Барселона, Испания
4 Institut D´Investigacions Biomèdiques August Pi I Sunyer (DIBAPS), Барселона, Испания
5 Университет Барселоны, Барселона, Испания
6 Центр биомедицинских исследований редких заболеваний (CIBER-ER), Барселона, Испания
Анна Перико
3 BCNatal-Barcelona Центр материнско-фетальной и неонатальной медицины (Клиника и больница Сан-Жоан-де-Деу), Барселона, Испания
4 Institut D´Investigacions Biomèdiques August Pi I Sunyer (DIBAPS), Барселона, Испания
5 Университет Барселоны, Барселона, Испания
6 Центр биомедицинских исследований редких заболеваний (CIBER-ER), Барселона, Испания
Francesc Figueras
3 BCNatal-Barcelona Центр материнско-фетальной и неонатальной медицины (Клиника и больница Сан-Жоан-де-Деу), Барселона, Испания
4 Institut D´Investigacions Biomèdiques August Pi I Sunyer (DIBAPS), Барселона, Испания
5 Университет Барселоны, Барселона, Испания
6 Центр биомедицинских исследований редких заболеваний (CIBER-ER), Барселона, Испания
Montse Palacio
3 BCNatal-Barcelona Центр материнско-фетальной и неонатальной медицины (Клиника и больница Сан-Жоан-де-Деу), Барселона, Испания
4 Institut D´Investigacions Biomèdiques August Pi I Sunyer (DIBAPS), Барселона, Испания
5 Университет Барселоны, Барселона, Испания
6 Центр биомедицинских исследований редких заболеваний (CIBER-ER), Барселона, Испания
Тереза Кобо
3 BCNatal-Barcelona Центр материнско-фетальной и неонатальной медицины (Клиника и больница Сан-Жоан-де-Деу), Барселона, Испания
4 Institut D´Investigacions Biomèdiques August Pi I Sunyer (DIBAPS), Барселона, Испания
5 Университет Барселоны, Барселона, Испания
6 Центр биомедицинских исследований редких заболеваний (CIBER-ER), Барселона, Испания
Jordi Bosch
1 Отделение микробиологии, больничная клиника – Университет Барселоны, Барселона, Испания
2 ISGlobal, Барселона Ctr. Междунар. Здоровье Рез. (CRESIB), Клиника больницы – Университет Барселоны, Барселона, Испания
Междунар. Здоровье Рез. (CRESIB), Клиника больницы – Университет Барселоны, Барселона, Испания
Сара М. Сото
1 Отделение микробиологии, больничная клиника – Университет Барселоны, Барселона, Испания
2 ISGlobal, Барселона Ctr. Междунар. Здоровье Рез. (CRESIB), Hospital Clinic – Universitat de Barcelona, Барселона, Испания
Марсия Эдилайн Лопес Консоларо, редактор
1 Отделение микробиологии, больничная клиника – Университет Барселоны, Барселона, Испания
2 ISGlobal, Барселона Ctr.Междунар. Здоровье Рез. (CRESIB), Больница-клиника – Университет Барселоны, Барселона, Испания
3 BCNatal-Barcelona Центр материнско-фетальной и неонатальной медицины (Клиника и больница Сан-Жоан-де-Деу), Барселона, Испания
4 Institut D´Investigacions Biomèdiques August Pi I Sunyer (DIBAPS), Барселона, Испания
5 Университет Барселоны, Барселона, Испания
6 Центр биомедицинских исследований редких заболеваний (CIBER-ER), Барселона, Испания
State University of Maringá/Universidade Estadual de Maringá, БРАЗИЛИЯ
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Автор идеи и дизайн эксперимента: SMS JB AG ML. Выполняли опыты: ЭСЛ ЭГ СВ. Проанализированы данные: ДФО СМС ЖБ. Предоставленные реагенты/материалы/инструменты анализа: SMS. Написал статью: SMS ESL JB AG ML IT AP FF MP TC.
Поступила в редакцию 27 окт. 2015 г.; Принято 19 декабря 2015 г.
Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.Эта статья была процитирована другими статьями в PMC.Abstract
Вагинальный Escherichia coli Колонизация связана с акушерскими инфекциями и последующим развитием инфекций у новорожденных. Резистентность к ампициллину среди E . coli увеличивается, что является основным выбором для эмпирического лечения многих акушерских и неонатальных инфекций. Вагинальный E . coli штаммы очень похожи на внекишечные патогенные штаммы E . coli по факторам вирулентности и принадлежности к филогруппе В2. Мы изучили устойчивость к противомикробным препаратам и профиль генетической вирулентности 82 E . coli изолятов из 638 вагинальных образцов и 63 выделенных из аспирата эндометрия, образцов плаценты и амниотической жидкости от беременных женщин с акушерскими инфекциями. Распространенность E . coli в вагинальных пробах составляла 13%, что было значимым среди женщин с сопутствующими факторами риска во время беременности, особенно преждевременным преждевременным излитием плодных оболочек (р<0.0001). Шестьдесят пять процентов штаммов были устойчивы к ампициллину. Е . Изоляты coli , вызывающие акушерские инфекции, показали более высокие уровни резистентности, чем вагинальные изоляты, особенно к гентамицину (p = 0,001). Наиболее распространенными генами фактора вирулентности были гены, связанные с системами усвоения железа, что выявило четкие цели для вмешательств.
coli по факторам вирулентности и принадлежности к филогруппе В2. Мы изучили устойчивость к противомикробным препаратам и профиль генетической вирулентности 82 E . coli изолятов из 638 вагинальных образцов и 63 выделенных из аспирата эндометрия, образцов плаценты и амниотической жидкости от беременных женщин с акушерскими инфекциями. Распространенность E . coli в вагинальных пробах составляла 13%, что было значимым среди женщин с сопутствующими факторами риска во время беременности, особенно преждевременным преждевременным излитием плодных оболочек (р<0.0001). Шестьдесят пять процентов штаммов были устойчивы к ампициллину. Е . Изоляты coli , вызывающие акушерские инфекции, показали более высокие уровни резистентности, чем вагинальные изоляты, особенно к гентамицину (p = 0,001). Наиболее распространенными генами фактора вирулентности были гены, связанные с системами усвоения железа, что выявило четкие цели для вмешательств. Более 50% изолятов принадлежали к вирулентной группе В2, обладающей наибольшим количеством генов факторов вирулентности. Устойчивые к ампициллину изоляты имели большое количество факторов вирулентности, прежде всего связанных с островками патогенности, и замечательную устойчивость к гентамицину у E . coli , изолируется от женщин с акушерскими инфекциями, следует тщательно выбирать наиболее подходящее эмпирическое лечение и клиническое ведение беременных женщин и новорожденных. С учетом восприимчивости хозяина гетерогенность E . coli в связи с эволюцией во времени и географическим районом, характеристика E . Изоляты coli , колонизирующие влагалище и вызывающие акушерские инфекции в различных регионах, могут помочь разработать меры и избежать этиологической связи между материнским носительством и акушерскими и последующими послеродовыми инфекциями.
Более 50% изолятов принадлежали к вирулентной группе В2, обладающей наибольшим количеством генов факторов вирулентности. Устойчивые к ампициллину изоляты имели большое количество факторов вирулентности, прежде всего связанных с островками патогенности, и замечательную устойчивость к гентамицину у E . coli , изолируется от женщин с акушерскими инфекциями, следует тщательно выбирать наиболее подходящее эмпирическое лечение и клиническое ведение беременных женщин и новорожденных. С учетом восприимчивости хозяина гетерогенность E . coli в связи с эволюцией во времени и географическим районом, характеристика E . Изоляты coli , колонизирующие влагалище и вызывающие акушерские инфекции в различных регионах, могут помочь разработать меры и избежать этиологической связи между материнским носительством и акушерскими и последующими послеродовыми инфекциями.
Введение
Escherichia coli считается одним из наиболее распространенных микроорганизмов, обнаруживаемых в половых путях небеременных (9–28%) и беременных женщин (24–31%). Вагинальный E . Штаммы coli (VEC) считаются резервуаром вагинальной и/или эндоцервикальной колонизации у беременных женщин и важным этапом в развитии инфекций мочевыводящих путей, интраамниотических и послеродовых инфекций через фекально-вагинально-мочевые/неонатальные инфекции. передача [1,2].Гистологически, субклинически или клинически диагностированный хориоамнионит представляет собой акушерскую инфекцию, вызываемую в основном восходящими микроорганизмами из влагалища, которая может привести к осложнениям у матери или плода, включая послеродовой эндометрит, бактериемию или сепсис. Е . coli считается обычно вовлеченным в эти инфекции, несмотря на их полимикробную чувствительность [3].
Вагинальный E . Штаммы coli (VEC) считаются резервуаром вагинальной и/или эндоцервикальной колонизации у беременных женщин и важным этапом в развитии инфекций мочевыводящих путей, интраамниотических и послеродовых инфекций через фекально-вагинально-мочевые/неонатальные инфекции. передача [1,2].Гистологически, субклинически или клинически диагностированный хориоамнионит представляет собой акушерскую инфекцию, вызываемую в основном восходящими микроорганизмами из влагалища, которая может привести к осложнениям у матери или плода, включая послеродовой эндометрит, бактериемию или сепсис. Е . coli считается обычно вовлеченным в эти инфекции, несмотря на их полимикробную чувствительность [3].
Наиболее частым антибиотиком при преждевременном излитии плодных оболочек, подозрении на хориоамнионит или неонатальный сепсис и бактериальный менингит является ампициллин плюс аминогликозид, обычно гентамицин, тогда как при послеродовом эндометрите назначают клиндамицин или ампициллин плюс гентамицин. Тем не менее, наблюдалось увеличение случаев неэффективности лечения из-за высокого процента резистентности к ампициллину, обнаруженной среди E . coli [4].
Тем не менее, наблюдалось увеличение случаев неэффективности лечения из-за высокого процента резистентности к ампициллину, обнаруженной среди E . coli [4].
Состояние иммунной системы и восприимчивость хозяина играют важную роль в исходе инфекции и прогрессировании заболевания [5]. Однако внекишечная инфекция связана с широким спектром факторов вирулентности (ФВ), включая, среди прочего, адгезины, токсины, сидерофоры и инвазины [6–8]. Штаммы VEC имеют общий профиль факторов вирулентности с внекишечными патогенными изолятами E . coli (ExPEC), которые отличаются от комменсальной флоры и позволяют им колонизировать, избегать защитных механизмов и вызывать внекишечные инфекции [1], [5,6], [9].
Большинство ExPEC относятся к вирулентной филогенетической группе B2, за которой следует группа D, в то время как группы A и B1 часто связаны с комменсальными штаммами на основе старой классификации, созданной Clermont et al. [10]. Аналогичные результаты наблюдались для E . coli изоляты, вызывающие бактериемию у беременных женщин и инфекции мочевыводящих путей (ИМП) по пересмотренному методу [11–13]
coli изоляты, вызывающие бактериемию у беременных женщин и инфекции мочевыводящих путей (ИМП) по пересмотренному методу [11–13]
Из-за селективного давления в местах обитания, комменсалы E . coli могут превращаться в вирулентные и резистентные штаммы [14]. Изоляты ВЭК от беременных женщин могут быть связаны с акушерскими инфекциями и последующим развитием инфекций у новорожденных. Кроме того, эти штаммы могут быть устойчивыми к эмпирическому лечению, что приводит к неэффективности терапии. Поэтому целью данного исследования было охарактеризовать и сравнить 145 E . coli изолятов из вагинальных проб (колонизация) и проб женщин с акушерскими инфекциями с точки зрения устойчивости к противомикробным препаратам, филотипа и профиля вирулентности с целью определения их потенциала вирулентности.
Материалы и методы
Сбор и выделение клинических образцов
E . coli Два типа изолятов были собраны у беременных женщин в родильном отделении фетальной медицины больничной клиники Барселоны (). С одной стороны, во время одного из дородовых посещений с февраля 2011 г. по июнь 2013 г. было собрано в общей сложности 638 вагинальных образцов. Эти вагинальные образцы включали (A) 603 образца у беременных женщин с нормальной беременностью и (B) 35 образцов у беременных женщин с ассоциированным риском при родах (преждевременный разрыв плодных оболочек или преждевременные роды).С другой стороны, 63 E . Изоляты coli были собраны из аспирата эндометрия, амниотической жидкости или плаценты беременных женщин с акушерскими инфекциями, включая послеродовой эндометрит и клиническую или субклиническую интраамниотическую инфекцию, с февраля 2011 г. по декабрь 2014 г. Больничная клиника Барселоны, созданная доктором Бегоньей Лопес Перес и доктором Хоаном Альбертом Барбера Мир, одобрила проект (Ref. 2010/5720), и все женщины дали информированное подписанное согласие.Все образцы наносили на агар МакКонки и инкубировали при 37°С в течение ночи. Предполагаемые колонии были подтверждены MALDI-TOF.
С одной стороны, во время одного из дородовых посещений с февраля 2011 г. по июнь 2013 г. было собрано в общей сложности 638 вагинальных образцов. Эти вагинальные образцы включали (A) 603 образца у беременных женщин с нормальной беременностью и (B) 35 образцов у беременных женщин с ассоциированным риском при родах (преждевременный разрыв плодных оболочек или преждевременные роды).С другой стороны, 63 E . Изоляты coli были собраны из аспирата эндометрия, амниотической жидкости или плаценты беременных женщин с акушерскими инфекциями, включая послеродовой эндометрит и клиническую или субклиническую интраамниотическую инфекцию, с февраля 2011 г. по декабрь 2014 г. Больничная клиника Барселоны, созданная доктором Бегоньей Лопес Перес и доктором Хоаном Альбертом Барбера Мир, одобрила проект (Ref. 2010/5720), и все женщины дали информированное подписанное согласие.Все образцы наносили на агар МакКонки и инкубировали при 37°С в течение ночи. Предполагаемые колонии были подтверждены MALDI-TOF.
*PROM: Преждевременный разрыв плодных оболочек; **pPROM: преждевременный выпускной.
Устойчивость к противомикробным препаратам
Профили устойчивости определяли с использованием стандартного дисково-диффузионного метода Кирби-Бауэра. Испытанные противомикробные агенты включали ампициллин (AMP), амоксициллин/клавулановую кислоту (AMC), цефуроксим (CXM), цефотаксим (CTX), цефтазидим (CAZ), имипенем (IPM), тетрациклин (TET), триметоприм/сульфаметоксазол (SXT), амикацин (AMK), гентамицин (GEN), ципрофлоксацин (CIP), хлорамфеникол (CHL) и фосфомицин (FOF).Кроме того, был проведен подтверждающий тест на бета-лактамазу расширенного спектра (ESBL) с использованием CTX, AMC и CAZ [15]. Результаты интерпретировались в соответствии с рекомендациями Института клинических и лабораторных стандартов [16] и E . Штамм coli ATCC25922 использовали в качестве контроля.
Распространенность генов факторов вирулентности
Профиль вирулентности анализировали с помощью ПЦР с использованием геноспецифических праймеров для 13 генов, кодирующих детерминанты вирулентности, обычно связанные с внекишечными E .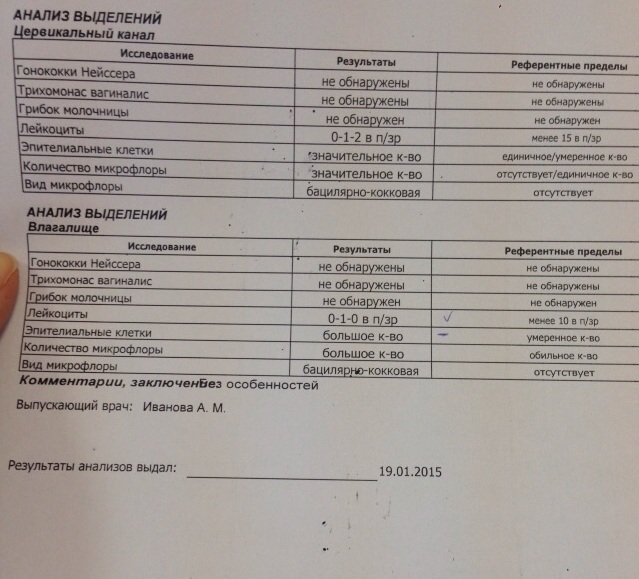 coli штаммы. Изучены гены: гемолизина ( hly А), цитотоксического фактора некроза ( cnf 1), аутотрансферотоксина ( sat 1), Р-фимбрии ( pap А, — EF, — С). ), фимбрии типа 1-С ( foc G), термостойкий гемагглютинин ( hra ), иерсиниабактин ( fyu A), сидерофоры ( iut A и iro N), аэробактин ( iuc 20301 iuc C) и инвазии эндотелиального фактора головного мозга ( ibe A) [17].ПЦР проводили в следующих условиях: начальная денатурация при 94°С в течение 3 мин, затем 25 циклов денатурации при 94°С в течение 30 с, соответствующая температура отжига (55–63°) в течение 30 с, удлинение при 72°С. °С в течение 1 мин и 30 с, финальная элонгация при 72°С в течение 7 мин. Продукты амплификации разделяли в 1,5% агарозных гелях и окрашивали Syber Safe. В качестве маркера молекулярного размера в каждом геле использовали ДНК-лестницу длиной 100 п.н. В качестве положительных контролей использовали несколько штаммов, ранее охарактеризованных с точки зрения вирулентности в нашей лаборатории.
coli штаммы. Изучены гены: гемолизина ( hly А), цитотоксического фактора некроза ( cnf 1), аутотрансферотоксина ( sat 1), Р-фимбрии ( pap А, — EF, — С). ), фимбрии типа 1-С ( foc G), термостойкий гемагглютинин ( hra ), иерсиниабактин ( fyu A), сидерофоры ( iut A и iro N), аэробактин ( iuc 20301 iuc C) и инвазии эндотелиального фактора головного мозга ( ibe A) [17].ПЦР проводили в следующих условиях: начальная денатурация при 94°С в течение 3 мин, затем 25 циклов денатурации при 94°С в течение 30 с, соответствующая температура отжига (55–63°) в течение 30 с, удлинение при 72°С. °С в течение 1 мин и 30 с, финальная элонгация при 72°С в течение 7 мин. Продукты амплификации разделяли в 1,5% агарозных гелях и окрашивали Syber Safe. В качестве маркера молекулярного размера в каждом геле использовали ДНК-лестницу длиной 100 п.н. В качестве положительных контролей использовали несколько штаммов, ранее охарактеризованных с точки зрения вирулентности в нашей лаборатории.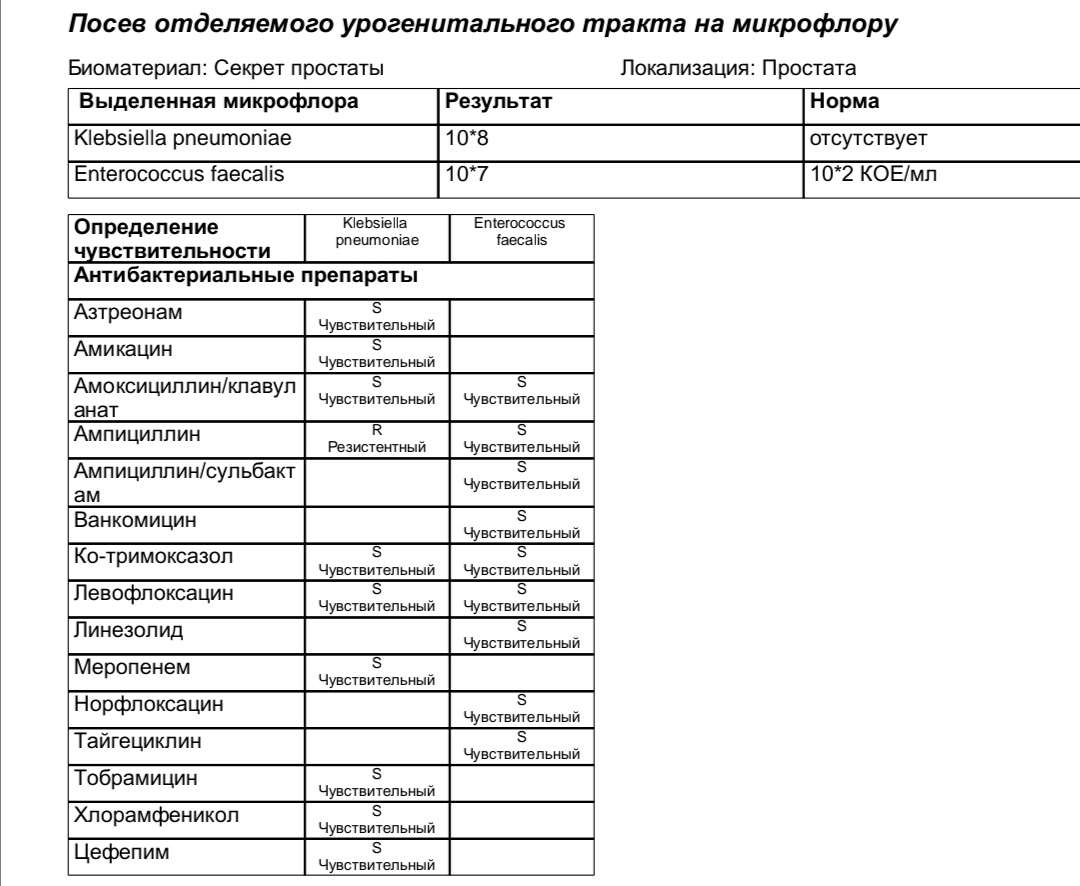 Результаты считались положительными, если продукт амплификации был подобен ожидаемому размеру молекулы.
Результаты считались положительными, если продукт амплификации был подобен ожидаемому размеру молекулы.
Филогенетический анализ
Новый и улучшенный E . coli метод филотипирования с несколькими модификациями, описанный Clermont at al. [13] был использован для идентификации E . coli изолятов, принадлежащих к восьми филогруппам (B2, D, B1, A, E, нетипируемые, F, C и E клад 1). Метод симплексной ПЦР использовали для определения arp A, chu A, yja A и TspE4.C2 и концентрация праймеров 5 мкМ вместо квадруплекс-ПЦР с концентрацией 20 мкМ.
Статистический анализ
Статистический анализ был выполнен с использованием программного обеспечения IBM SPSS Statistics для Windows, версия 20.0. Сравнение ассоциаций между чувствительностью к антибиотикам, филогенетической группой и наличием генов факторов вирулентности (VFG) проводили с использованием критерия хи-квадрат, когда все ожидаемые частоты клеток были ≥ 5, хи-квадрат с поправкой Йейтса, когда количество ожидаемые случаи были между 3 (включительно) и 5 и точный критерий Фишера, когда количество ожидаемых случаев было ниже 3 хотя бы в одной группе.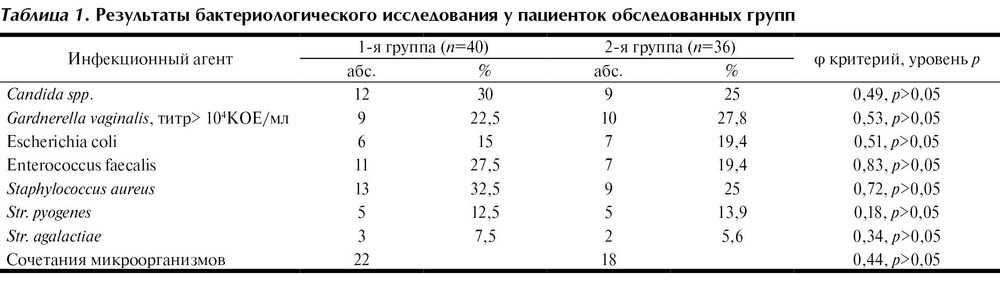 Значение p ниже 0,05 считалось статистически значимым, а значение p ниже 0,01 считалось высоко значимым.
Значение p ниже 0,05 считалось статистически значимым, а значение p ниже 0,01 считалось высоко значимым.
Результаты
Распространенность
E . coli среди вагинальных образцовСреди 638 собранных вагинальных образцов 82 изолята (13%) были положительными на E . coli , и это было статистически или высокозначимо среди женщин, принадлежащих к группе В по сравнению с группой А (n = 13, 37% против , n = 69, 11% соответственно; p = 0.0001) (). Кроме того, преждевременный преждевременный разрыв плодных оболочек (pPROM) был наиболее распространенным фактором риска (n = 12, 92%) среди беременных с инфекцией E . кишечная палочка .
Таблица 1
Распространенность Escherichia coli среди вагинальных образцов беременных женщин с нормальной беременностью (A) и некоторыми рисками при рождении (B).
| Беременные женщины | Наличие E .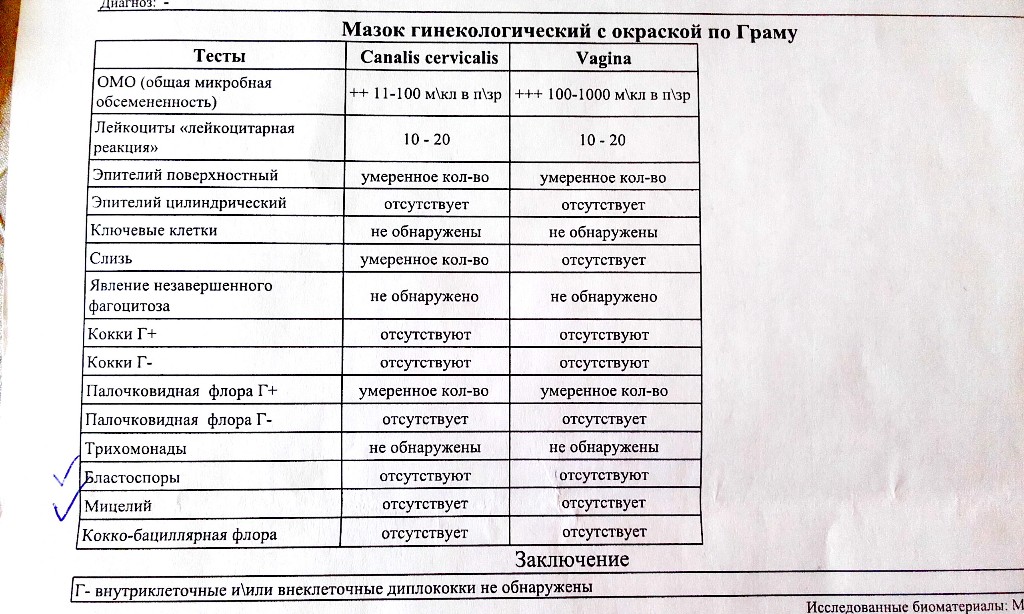 coli coli | Отсутствие E . Coli | Всего | |
|---|---|---|---|---|
| (а) с нормальным беремером | 69 (11) | 534 (89) | 603 | |
| (b) с некоторыми рисками при рождении | 13 37) ** | 22 (63) | 35 | |
| Всего | 82 (13) | 556 (87) | 556 (87) | 638 |
Superimrobial Hexceptible
шестнадцать акушерской инфекции E .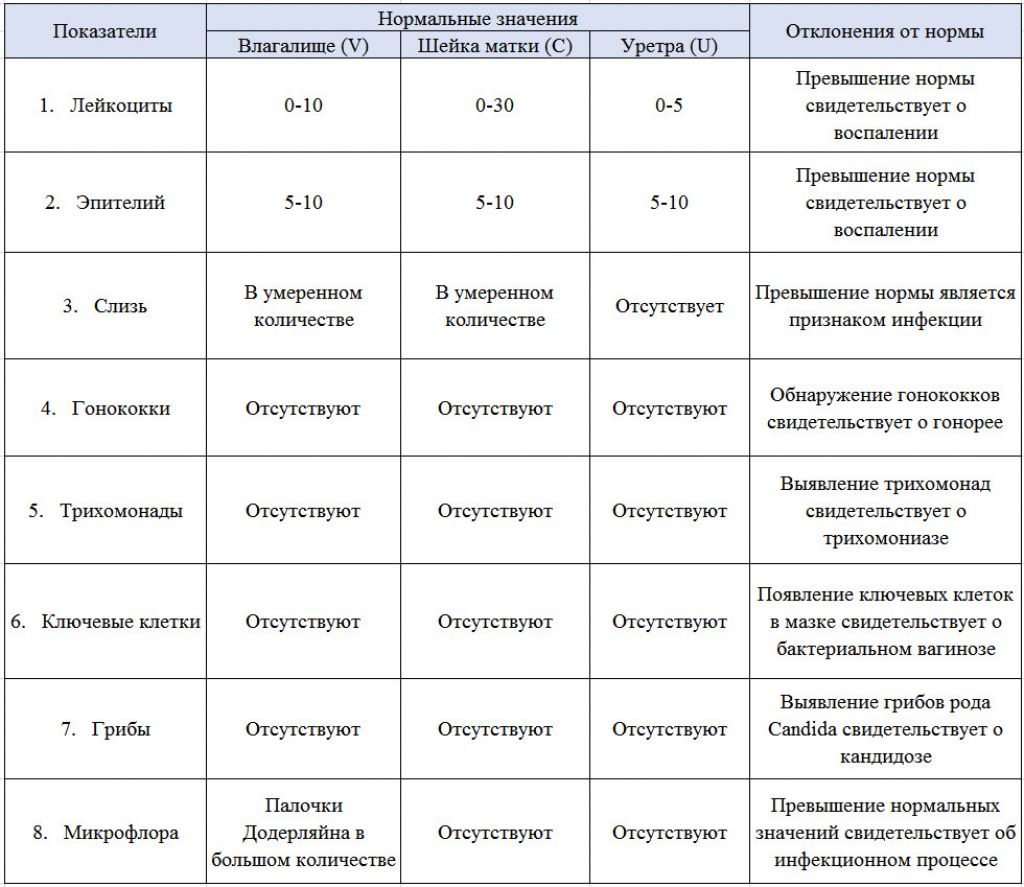 coli (акушерский IEC) (25%) и 29 изолятов VEC (5%) были чувствительны ко всем протестированным противомикробным агентам. Девяносто пять (65,5%) всех изолятов были устойчивы к ампициллину. Акушерские изоляты IEC показали более высокий процент устойчивости ко всем антибиотикам, чем изоляты VEC, за исключением имипенема (только один вагинальный устойчивый изолят), который был очень значимым для гентамицина (22,2% против 3,7% соответственно; p = 0,001) (). Наличие БЛРС было обнаружено только в одном изоляте от беременной женщины с послеродовым эндометритом, содержащим фермент СТХ-М-15.
coli (акушерский IEC) (25%) и 29 изолятов VEC (5%) были чувствительны ко всем протестированным противомикробным агентам. Девяносто пять (65,5%) всех изолятов были устойчивы к ампициллину. Акушерские изоляты IEC показали более высокий процент устойчивости ко всем антибиотикам, чем изоляты VEC, за исключением имипенема (только один вагинальный устойчивый изолят), который был очень значимым для гентамицина (22,2% против 3,7% соответственно; p = 0,001) (). Наличие БЛРС было обнаружено только в одном изоляте от беременной женщины с послеродовым эндометритом, содержащим фермент СТХ-М-15.
Изоляты ВЭК: вагинальные Изоляты Escherichia coli ; Акушерские изоляты IEC: акушерская инфекция Изоляты Escherichia coli . АМП, ампициллин; АМС, амоксициллин/клавулановая кислота; CXM, цефуроксим, CTX, цефотаксим; CAZ, цефтазидим; ИПМ, имипенем; ТЕТ, тетрациклин, SXT, триметоприм/сульфаметоксазол; АМК, амикацин; GEN, гентамицин; ХЛ, хлорамфеникол; CIP, ципрофлоксацин и FOF, фосфомицин. (**р-значение = 0,001).
(**р-значение = 0,001).
Преобладание генов факторов вирулентности
Среди всех изолятов наиболее распространены VFG, связанные с системами усвоения железа: fyu A (79,3%), iuc C (55,9%) и iut A ( 53,8%) (). Между акушерскими изолятами IEC и VEC не было обнаружено существенных различий, за исключением инвазина ibe A, который чаще обнаруживался среди изолятов VEC (n = 13, 15,9% по сравнению с , n = 2, 3,2%, p = 0,014). Во всех изолятах реже обнаруживали VFG foc G (VEC: 11%, акушерский IEC: 6%).
Таблица 2
Распространенность генов факторов вирулентности (VFG) в зависимости от типа изолята.
| Тип изолята | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| VFGS A | VEC B (N = 82) | Окунировка IEC C (N = 63) | Всего (N = 145) | |||||||||
| HLY A | 19 (23) | 19 (23) | 12 (21) | 31 (21) | ||||||||
| CNF 1 | 18 (22) | 16 (25) | 34 (23) | |||||||||
| SAT 1 | 29 (35) | 27 (43) | 56 (39) | PAP A | 23 (28) | 28 ( 44) | 51 (35) | PAP EF | 21 (26) | 17 (27) | 38 (26) | |
| PAP C | 20 (24) | 24 (38) | 44 (30) | |||||||||
| фок G | 9 (11) | 4 (6) | 13 (9) | |||||||||
| HRA | 29 (35) | 22 (35) | 22 (35) | 51 (35) | ||||||||
| FYU A | 66 (80) | 48 (76) | 114 (79) | |||||||||
| иут А | 37 (45) | 40 (63. 5) 5) | 77 (53) | 97 (53)|||||||||
| IRO N | 29 (35) | 23 (37) | (37) | 52 (36) | ||||||||
| IUC C | 41 (50) | 39 (62) | 90 (55)||||||||||
| IBE A | 13 (16) * | 5 2 (3) 2 (3) 15 (10) | | |||||||||
Филогенетическая группа распределение
Семьдесят шесть (52%) всех изолятов принадлежали к группе В2 и в меньшей степени к группам А и Е (15% и 12% соответственно) (). Присутствие других филогрупп было ниже и составляло 21% от остальных филогрупп. Значимые различия были обнаружены при сравнении филогруппы В2 со всеми остальными по отдельности (p<0,01 во всех случаях), но между изолятами ВЭК и акушерскими ИЭК различий не наблюдалось.
Присутствие других филогрупп было ниже и составляло 21% от остальных филогрупп. Значимые различия были обнаружены при сравнении филогруппы В2 со всеми остальными по отдельности (p<0,01 во всех случаях), но между изолятами ВЭК и акушерскими ИЭК различий не наблюдалось.
Распределение филогенетических групп среди изолятов.
Взаимосвязь между филогенетической группой, факторами вирулентности и антимикробной резистентностью
Выявлены статистически значимые различия по наличию ВФГ среди изолятов, принадлежащих к филогенетической группе В2, которые составляют hly A (p<0.0001), cnf 1 (p<0,0001), pap A (p = 0,003), pap C (p = 0,011), foc G (p = 0,002), hra (p = 09 ), fyu A (p<0,0001) и ibe A (p = 0,001) наиболее представительные в этой группе по всем изолятам, тогда как iut A и iuc C чаще наблюдались среди не- группы В2 ().
Таблица 3
Распространенность генов факторов вирулентности (VFG) среди филогенетических групп и тип изолятов в зависимости от их устойчивости к ампициллину.
| ампициллин х | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Филогенетических группы | VEC б изолят | акушерского МЭК с изолят | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| VFGs A | В2 | Других D | AMP-S | AMP-S | AMP-S | AMP-S | 6 9059 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (n = 75) | (n = 70) | (n = 31) | (n = 51) | (n = 44) | (n = 44) | (n = 19) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| HLY | 29 (39) ** | 2 (3) | 1 (3) | 18 (35) ** | **8 (21) | 4 (21) | 4 (21) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CNF 1 | 31 (41) ** | 3 (4) | 1 (3 ) | 17 (33) ** | 11 (25) | 5 (26) | 5 (26) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SAT 1 | 27 (36) | 29 (41) | 11 ( 35. |  5) 5) 18 (35) | 16 (36) | 11 (58) | Papa | 35 (47) ** | 16 (23) | 7 (23) | 16 (31) | 16 (36) | 12 (63) | 9 EF | 24 (32) | 14 (20) | 3 (10) | 18 (35) ** | 12 (27) | 6 (32) | 6 (32) | | 30 (40) ** | 14 (20) | 5 (16) | 15 (29) | (29) | 15 (34) | 9 (47) | DOC г | 12 (16) ** | 1 1) | 1 (3) | 8 (16) | 2 (4. |  5) 5) 2 (10.5) | HRA | 34 (45) ** | 17 (24) | 5 (16) | 24 (47) ** | 15 (34) | (34) | 7 (37) | FYU A | 71 (95) ** | 43 (61 ) | 19 61) | 47 (92) ** | 5 (75) (75) | 15 (79) | IUT A | 34 (45) | 43 (61) | 12 (39) | 25 (49) | 28 (34) | 12 (63) | IRO N | 33 (44) * | 19 (27) | 3 (10) | 26 (51) ** | 17 (39) | 6 (32) | 9 0301 IIC C | 34 (45) | 46 (66) * * | 13 (42) | 28 (55) | 30 (68) | 9 (47) | ibe A | 14 (19) ** | 1 (1) | 5 (16) | 6 (52619) 8 05) | 0 | |
Ампициллинрезистентные изоляты ВЭК показали большее количество ФЖ по сравнению с ампициллиночувствительными изолятами, высокодостоверное для hly A (p = 0,001), cnf 1 = 0,001), pap EF (p = 0,01), hr a (p = 0,005), fyu A (p = 0,001) и iro N (p<0,001) генов. Тем не менее, VFG, как правило, чаще встречались среди чувствительных к ампициллину акушерских изолятов IEC. Системы получения железа, такие как fyu A и iro N, также были значительно более распространены среди устойчивых к тетрациклину изолятов VEC, чем их чувствительные аналоги ( fyu A: p = 0.023 и и N: p = 0,008). Тем не менее, устойчивые к тетрациклину изоляты от акушерской инфекции показали меньше VF, что было значимо для hly A (p = 0,009), cnf 1 (p = 0,019), pap A (p = 0,005) и pap C (р = 0,014). Кроме того, ген синтеза аэробактина iuc C достоверно чаще обнаруживался среди устойчивых к тетрациклину, триметоприму/сульфаметоксазолу, гентамицину и хлорамфениколу изолятов по сравнению с чувствительными изолятами.Высокозначимых различий в распределении филотипа и антимикробных препаратов не обнаружено.
Тем не менее, VFG, как правило, чаще встречались среди чувствительных к ампициллину акушерских изолятов IEC. Системы получения железа, такие как fyu A и iro N, также были значительно более распространены среди устойчивых к тетрациклину изолятов VEC, чем их чувствительные аналоги ( fyu A: p = 0.023 и и N: p = 0,008). Тем не менее, устойчивые к тетрациклину изоляты от акушерской инфекции показали меньше VF, что было значимо для hly A (p = 0,009), cnf 1 (p = 0,019), pap A (p = 0,005) и pap C (р = 0,014). Кроме того, ген синтеза аэробактина iuc C достоверно чаще обнаруживался среди устойчивых к тетрациклину, триметоприму/сульфаметоксазолу, гентамицину и хлорамфениколу изолятов по сравнению с чувствительными изолятами.Высокозначимых различий в распределении филотипа и антимикробных препаратов не обнаружено.
Обсуждение
Распространенность вагинального E . coli , обнаруженный в этом исследовании, был на 13% похож на результаты предыдущих исследований [17,18], но ниже, чем в других [19]. Кроме того, обращает на себя внимание процент материнских E . coli предполагает, что вагинальные носители E . Колонизация coli является фактором риска pPROM и преждевременных родов [20,21], а также отправной точкой для прогрессирования тяжелой инфекции [11].
Кроме того, обращает на себя внимание процент материнских E . coli предполагает, что вагинальные носители E . Колонизация coli является фактором риска pPROM и преждевременных родов [20,21], а также отправной точкой для прогрессирования тяжелой инфекции [11].
Может потребоваться пересмотр текущего эмпирического лечения, учитывая высокую распространенность резистентности к ампициллину и гентамицину в E . coli , собранные у женщин с послеродовым эндометритом и интраамниотической инфекцией, в соответствии с предыдущими сообщениями [18], [22]. Поэтому использование цефалоспоринов в качестве терапии первой линии для лечения матерей и новорожденных может быть эффективным из-за высокого процента восприимчивости [7], [23] и хороших результатов, показанных при лечении перипартального сепсиса [24].Тем не менее, географический район также следует принимать во внимание из-за особого роста инфекций, вызванных ESBL-продуцирующими организмами во всем мире [18], [25], особенно в развивающихся странах [26].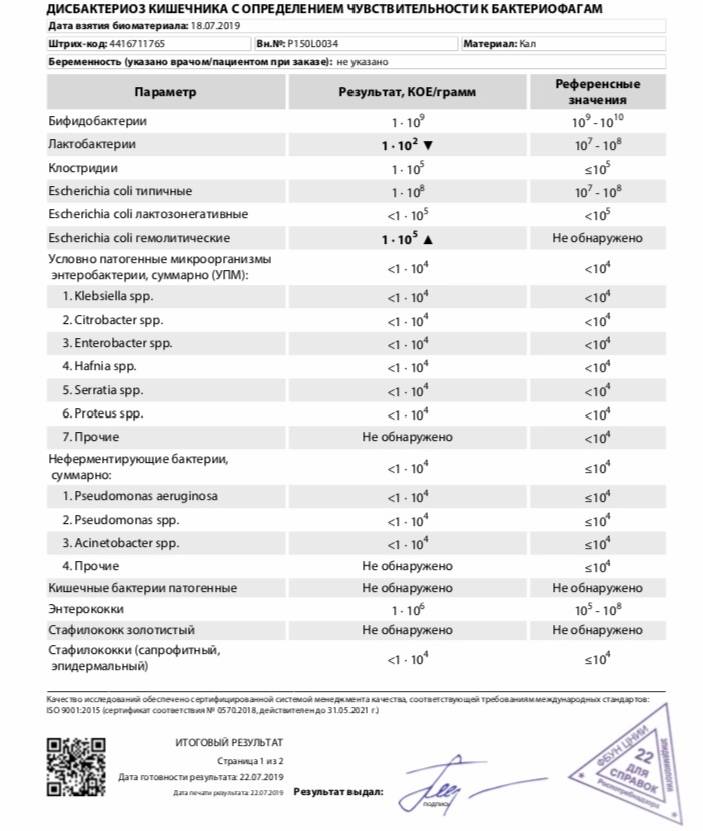
Примечательно высокое присутствие систем усвоения железа среди изолятов, при этом иерсиниабактин ( fyu A) был наиболее распространенным VFG среди всех изолятов (VEC: 80%, акушерский IEC: 76%), в отличие от более ранних акушерских ИЭК выделяют из той же больницы (всего 18%) [22].Прямые связи со средой с ограниченным содержанием железа [27] и вирулентность, а также инвазивность ранее были подтверждены исследованиями бактериемии E . coli [6]. Было продемонстрировано, что железо, полученное через системы усвоения железа, такие как гем, аэробактин, иерсиниабактин или сидерофоры, необходимо при ИМП, и эти системы проявляют специфические функции в зависимости от анатомического участка [28] и могут быть мишенями для вмешательств, таких как вакцины. [29,30].
Более высокий процент генов, связанных с островками патогенности (PAI), таких как гены hly A, cnf 1 и pap- [31], наблюдался среди изолятов от инфекций кожи и мягких тканей (ИКМТ) [7], вызывающих неонатальный сепсис [32], а также от больных с различными источниками бактериемии [8]. Относительно низкая частота этих генов в нашем исследовании аналогична частоте VEC из Восточной Японии, но ниже, чем у штаммов из Западной Японии [1], США [33], Словении [34] или Барселоны [17], что свидетельствует о неоднородность E . coli к географическому району. Однако распространенность токсина cnf 1 была выше, чем в предыдущих акушерских изолятах IEC из нашей больницы (25% против ,9%) [22]. В отличие от других исследований [1], [8], [32], [35], наименее распространенными VFG были foc G и ibe A, обнаруженные менее чем в 10% изолятов акушерской инфекции.В отличие от предыдущих акушерских изолятов IEC, изоляты, вызывающие сепсис, в этом исследовании содержали тот же процент инвазина ibe A, что и VEC [22].
Относительно низкая частота этих генов в нашем исследовании аналогична частоте VEC из Восточной Японии, но ниже, чем у штаммов из Западной Японии [1], США [33], Словении [34] или Барселоны [17], что свидетельствует о неоднородность E . coli к географическому району. Однако распространенность токсина cnf 1 была выше, чем в предыдущих акушерских изолятах IEC из нашей больницы (25% против ,9%) [22]. В отличие от других исследований [1], [8], [32], [35], наименее распространенными VFG были foc G и ibe A, обнаруженные менее чем в 10% изолятов акушерской инфекции.В отличие от предыдущих акушерских изолятов IEC, изоляты, вызывающие сепсис, в этом исследовании содержали тот же процент инвазина ibe A, что и VEC [22].
Как и в других исследованиях, более половины изолятов в настоящем исследовании принадлежали к группе вирулентности B2 [11], [17]. Релевантный статистический процент штаммов, принадлежащих к группе А, значительно отличался от того, о котором сообщают Iranpour et al. [12]. Удивительно, но группа E и нетипируемые штаммы часто наблюдались по сравнению с результатами Clermont et al.[13], что может быть связано с большим разнообразием, крайним своеобразием или рекомбинацией между филогруппами среди E . coli штаммы.
[12]. Удивительно, но группа E и нетипируемые штаммы часто наблюдались по сравнению с результатами Clermont et al.[13], что может быть связано с большим разнообразием, крайним своеобразием или рекомбинацией между филогруппами среди E . coli штаммы.
Группа B2 показала наибольшее количество ФЖ среди всех штаммов, что согласуется с другими исследованиями, проведенными на штаммах, выделенных из внекишечных участков [5], [7], [36]. В отличие от предыдущих результатов, штаммы, устойчивые к ципрофлоксацину, не принадлежали к филогенетическим группам, отличным от B2, и они также не демонстрировали потерю VFs, связанную с PAI [7], [37–39]. Однако более низкое присутствие этих VFG среди тетрациклиновых резистентных изолятов, вызывающих акушерские инфекции, согласуется с результатами Soto et al.[39]. Кроме того, Petkovsek et al. ранее показал селекцию ампициллин-резистентных штаммов с высокой частотой ФВ. [7]. Независимо от экологических и зависящих от хозяина факторов в отношении тяжести инфекции [6], [34], было показано, что эти штаммы вызывают акушерские и неонатальные инфекции и могут иметь серьезные клинические последствия [4], [40].
Настоящее исследование имеет некоторые ограничения, поскольку данные по характеристике вагинальных и акушерских инфекций E . coli немногочисленны, и многие сравнения проводятся с использованием других типов внекишечных изолятов. Однако, помимо профиля вирулентности VEC, напоминающего профиль вирулентности изолятов ExPEC, наши результаты полезны для выработки соответствующих гипотез по этой малоизвестной теме из-за связи широкого спектра VF и противомикробных агентов с новым филогенетическим анализом.
В заключение, вагинальный E . Колонизация coli может быть фактором риска осложнений во время беременности, особенно если эти штаммы устойчивы к ампициллину и проявляют множество факторов вирулентности, приводящих к неэффективности лечения или инфекциям.Поэтому важно знать резистентность и вирулентность, связанные с E . coli из разных анатомических областей [2], чтобы определить вероятность и тяжесть инфекции, которую эти штаммы могут вызывать.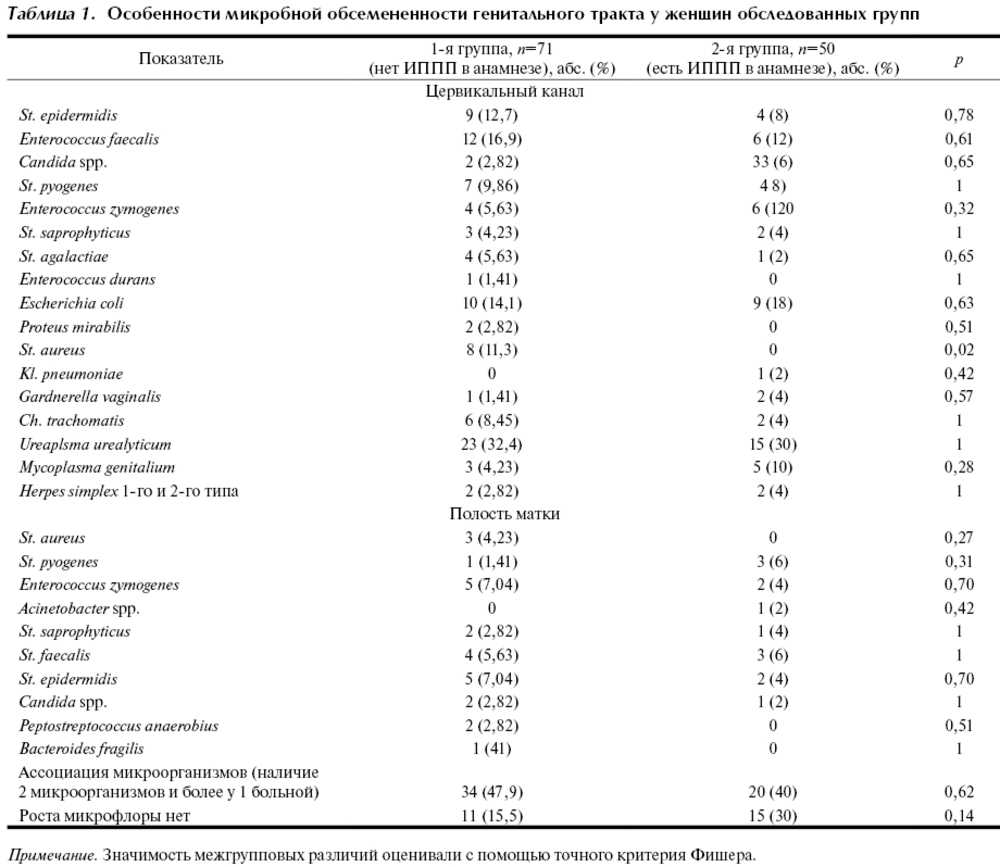 Характеристика E . Изоляты coli , которые колонизируют влагалище и вызывают акушерские инфекции, могут особенно помочь в разработке вмешательств и во избежание причинно-следственной связи между материнским носительством и акушерскими и последующими послеродовыми инфекциями.
Характеристика E . Изоляты coli , которые колонизируют влагалище и вызывают акушерские инфекции, могут особенно помочь в разработке вмешательств и во избежание причинно-следственной связи между материнским носительством и акушерскими и последующими послеродовыми инфекциями.
Благодарности
Мы благодарны Оливье Клермону, который любезно предоставил некоторые из ссылок E . coli штаммы для филогенетического анализа
Заявление о финансировании
Сара М. Сото является стипендиатом программы I3 Института Салуда Карлоса III (ISCIII, www.isciii.es). Этот материал основан на работе, поддержанной «Фондом санитарных исследований» (PI10/01579 и PI13/00137), интегрированной в «Plan Nacional de I+D+I» и совместно финансируемой «ISCIII-Subdirección General de Evaluación». ” и “Fondo Europeo de Desarrollo Regional (FEDER)”.
Доступность данных
Все соответствующие данные находятся в документе.
Ссылки
1. Obata-Yasuoka M, Ba-Thein W, Tsukamoto T, Yoshikawa H, Hayashi H. Вагинальные Escherichia coli имеют общие профили факторов вирулентности, серотипы и филогению с другими внекишечными E . кишечная палочка . Микробиология. 2002; 148: 2745–2752. [PubMed] [Google Scholar]2. Watt S, Lanotte P, Mereghetti L, Moulin-schouleur M, Picard B, Quentin R. Штаммы Escherichia coli от беременных женщин и новорожденных: внутривидовое генетическое распространение и распространенность факторов вирулентности.Дж. Клин Микробиол. 2003 г.; 41:1929–1935. [Бесплатная статья PMC] [PubMed] [Google Scholar]3. Эдвардс РК. Хориоамнионит и роды. Клиники акушерства и гинекологии Северной Америки. 2005. С. 287–296. 10.1016/j.ogc.2004.12.002
[PubMed] [CrossRef] [Google Scholar]4. Саес-Лопес Э., Гирал Э. Сото С.М. Бактериальный сепсис новорожденных: большая проблема для детей. Clin Microbiol Открытый доступ. Группа ОМИКС; 2012;02. [Google Академия]5. Пикард Б., Гарсия Дж. С., Гуриу С.
Obata-Yasuoka M, Ba-Thein W, Tsukamoto T, Yoshikawa H, Hayashi H. Вагинальные Escherichia coli имеют общие профили факторов вирулентности, серотипы и филогению с другими внекишечными E . кишечная палочка . Микробиология. 2002; 148: 2745–2752. [PubMed] [Google Scholar]2. Watt S, Lanotte P, Mereghetti L, Moulin-schouleur M, Picard B, Quentin R. Штаммы Escherichia coli от беременных женщин и новорожденных: внутривидовое генетическое распространение и распространенность факторов вирулентности.Дж. Клин Микробиол. 2003 г.; 41:1929–1935. [Бесплатная статья PMC] [PubMed] [Google Scholar]3. Эдвардс РК. Хориоамнионит и роды. Клиники акушерства и гинекологии Северной Америки. 2005. С. 287–296. 10.1016/j.ogc.2004.12.002
[PubMed] [CrossRef] [Google Scholar]4. Саес-Лопес Э., Гирал Э. Сото С.М. Бактериальный сепсис новорожденных: большая проблема для детей. Clin Microbiol Открытый доступ. Группа ОМИКС; 2012;02. [Google Академия]5. Пикард Б., Гарсия Дж. С., Гуриу С. , Дурьез П., Брахими Н., Бинген Э. и др.
Связь между филогенезом и вирулентностью при внекишечной инфекции Escherichia coli .Заразить иммун. 1999; 67: 546–553. [Бесплатная статья PMC] [PubMed] [Google Scholar]6. Джонсон Дж. Р., Стелл А. Л. Расширенные генотипы вирулентности штаммов Escherichia coli от пациентов с уросепсисом в отношении филогении и компрометации хозяина. J заразить Dis. 2000; 181: 261–272. [PubMed] [Google Scholar]7. Петковсек З., Элерсич К., Губина М., Згур-Берток Д., Старчич Эрявец М. Потенциал вирулентности изолятов Escherichia coli при инфекциях кожи и мягких тканей. Дж. Клин Микробиол. 2009; 47: 1811–1817 гг.10.1128/JCM.01421-08
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]8. Джонсон Дж. Р., Брайан ТТО, Кусковски М., Маслоу Дж. Н. Продолжающаяся горизонтальная и вертикальная передача генов вирулентности и аллелей papA среди изолятов крови Escherichia coli от пациентов с бактериемией из разных источников. Заразить иммун.
, Дурьез П., Брахими Н., Бинген Э. и др.
Связь между филогенезом и вирулентностью при внекишечной инфекции Escherichia coli .Заразить иммун. 1999; 67: 546–553. [Бесплатная статья PMC] [PubMed] [Google Scholar]6. Джонсон Дж. Р., Стелл А. Л. Расширенные генотипы вирулентности штаммов Escherichia coli от пациентов с уросепсисом в отношении филогении и компрометации хозяина. J заразить Dis. 2000; 181: 261–272. [PubMed] [Google Scholar]7. Петковсек З., Элерсич К., Губина М., Згур-Берток Д., Старчич Эрявец М. Потенциал вирулентности изолятов Escherichia coli при инфекциях кожи и мягких тканей. Дж. Клин Микробиол. 2009; 47: 1811–1817 гг.10.1128/JCM.01421-08
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]8. Джонсон Дж. Р., Брайан ТТО, Кусковски М., Маслоу Дж. Н. Продолжающаяся горизонтальная и вертикальная передача генов вирулентности и аллелей papA среди изолятов крови Escherichia coli от пациентов с бактериемией из разных источников. Заразить иммун. 2001 г.; [Бесплатная статья PMC] [PubMed] [Google Scholar]9. Руссо Т.А., Джонсон Дж.Р. Предложение по новому всеобъемлющему обозначению внекишечных патогенных изолятов Escherichia coli : ExPEC.J заразить Dis. 2000; 181: 1753–1754. [PubMed] [Google Scholar] 10. Клермон О., Бонакорси С., Бинген Э. Быстрое и простое определение филогенетической группы Escherichia coli . Appl Environ Microbiol. 2000; 66: 4555–4558. [Бесплатная статья PMC] [PubMed] [Google Scholar]11. Lefort A, Mentr F. Бактериемия Escherichia coli у беременных женщин опасна для жизни плода. Клин Микробиол Инфект. 2014;20:01035–41. [PubMed] [Google Scholar] 12. Иранпур Д., Хассанпур М., Ансари Х., Таджбахш С., Хамисипур Г., Наджафи А.Филогенетические группы штаммов Escherichia coli от пациентов с инфекцией мочевыводящих путей в Иране на основе нового метода филотипирования Клермона. Стажер-исследователь Биомед. 2015; 2015: 5–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]13. Клермон О., Кристенсон Дж.
2001 г.; [Бесплатная статья PMC] [PubMed] [Google Scholar]9. Руссо Т.А., Джонсон Дж.Р. Предложение по новому всеобъемлющему обозначению внекишечных патогенных изолятов Escherichia coli : ExPEC.J заразить Dis. 2000; 181: 1753–1754. [PubMed] [Google Scholar] 10. Клермон О., Бонакорси С., Бинген Э. Быстрое и простое определение филогенетической группы Escherichia coli . Appl Environ Microbiol. 2000; 66: 4555–4558. [Бесплатная статья PMC] [PubMed] [Google Scholar]11. Lefort A, Mentr F. Бактериемия Escherichia coli у беременных женщин опасна для жизни плода. Клин Микробиол Инфект. 2014;20:01035–41. [PubMed] [Google Scholar] 12. Иранпур Д., Хассанпур М., Ансари Х., Таджбахш С., Хамисипур Г., Наджафи А.Филогенетические группы штаммов Escherichia coli от пациентов с инфекцией мочевыводящих путей в Иране на основе нового метода филотипирования Клермона. Стажер-исследователь Биомед. 2015; 2015: 5–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]13. Клермон О., Кристенсон Дж. К., Денамур Э., Гордон Д. М. Новый взгляд на метод филотипирования Clermont Escherichia coli : улучшение специфичности и обнаружение новых филогрупп. Environ Microbiol Rep. 2013; 5: 58–65. 10.1111/1758-2229.12019
[PubMed] [CrossRef] [Google Scholar] 14.Браун Н.Ф., Уикхем М.Е., Кумбс Б.К., Финлей Б.Б. Пересечение черты: отбор и эволюция признаков вирулентности. PLoS Патог. 2006;2(5):e42
[Бесплатная статья PMC] [PubMed] [Google Scholar]15. Kałużna E. Zalas-Więcek P, Gospodarek E. Сравнение методов обнаружения бета-лактамаз расширенного спектра в штаммах Escherichia coli
Postey Hig Med Dosw (онлайн). 2014.
68:808–13 [PubMed] [Google Scholar]16. Институт клинических и лабораторных стандартов (CLSI). Стандарты эффективности для тестирования чувствительности к противомикробным препаратам.Двадцать четвертое информационное приложение, М100-С24, вып. 34, нет. 1. 2014.
Институт клинических и лабораторных стандартов, Уэйн, Пенсильвания. Т. [Google Scholar] 17. Гирал Э., Бош Дж., Вила Дж.
К., Денамур Э., Гордон Д. М. Новый взгляд на метод филотипирования Clermont Escherichia coli : улучшение специфичности и обнаружение новых филогрупп. Environ Microbiol Rep. 2013; 5: 58–65. 10.1111/1758-2229.12019
[PubMed] [CrossRef] [Google Scholar] 14.Браун Н.Ф., Уикхем М.Е., Кумбс Б.К., Финлей Б.Б. Пересечение черты: отбор и эволюция признаков вирулентности. PLoS Патог. 2006;2(5):e42
[Бесплатная статья PMC] [PubMed] [Google Scholar]15. Kałużna E. Zalas-Więcek P, Gospodarek E. Сравнение методов обнаружения бета-лактамаз расширенного спектра в штаммах Escherichia coli
Postey Hig Med Dosw (онлайн). 2014.
68:808–13 [PubMed] [Google Scholar]16. Институт клинических и лабораторных стандартов (CLSI). Стандарты эффективности для тестирования чувствительности к противомикробным препаратам.Двадцать четвертое информационное приложение, М100-С24, вып. 34, нет. 1. 2014.
Институт клинических и лабораторных стандартов, Уэйн, Пенсильвания. Т. [Google Scholar] 17. Гирал Э., Бош Дж., Вила Дж. , Сото С.М. Распространенность Escherichia coli среди образцов, взятых из половых путей у беременных и небеременных женщин: связь с вирулентностью. FEMS Microbiol Lett. 2011; 314: 170–173. 10.1111/j.1574-6968.2010.02160.x
[PubMed] [CrossRef] [Google Scholar] 18. Вильяр Х.Э., Обер В., Басерни М.Н., Юго М.Б. Материнское носительство изолятов Escherichia coli, продуцирующих бета-лактамазы расширенного спектра действия, в Аргентине.Джей Чемотер. 2013; 25: 324–327. 10.1179/1973947813Y.0000000081
[PubMed] [CrossRef] [Google Scholar] 19. Тамелене Р., Барчайте Э., Стонене Д., Буйнаускене Ю., Маркунене Э., Кудревичене А. и др.
Колонизация кишечной палочки у новорожденных: распространенность, перинатальная передача, чувствительность к противомикробным препаратам и факторы риска. Медицина (Каунас). 2012; 48: 71–6. [PubMed] [Google Scholar] 20. Крон М., Твин С.С., Рабе Л.К., Браун З., Хиллиер С.Л. Колонизация влагалища кишечной палочкой как фактор риска родов с очень низкой массой тела при рождении и других перинатальных осложнений.
, Сото С.М. Распространенность Escherichia coli среди образцов, взятых из половых путей у беременных и небеременных женщин: связь с вирулентностью. FEMS Microbiol Lett. 2011; 314: 170–173. 10.1111/j.1574-6968.2010.02160.x
[PubMed] [CrossRef] [Google Scholar] 18. Вильяр Х.Э., Обер В., Басерни М.Н., Юго М.Б. Материнское носительство изолятов Escherichia coli, продуцирующих бета-лактамазы расширенного спектра действия, в Аргентине.Джей Чемотер. 2013; 25: 324–327. 10.1179/1973947813Y.0000000081
[PubMed] [CrossRef] [Google Scholar] 19. Тамелене Р., Барчайте Э., Стонене Д., Буйнаускене Ю., Маркунене Э., Кудревичене А. и др.
Колонизация кишечной палочки у новорожденных: распространенность, перинатальная передача, чувствительность к противомикробным препаратам и факторы риска. Медицина (Каунас). 2012; 48: 71–6. [PubMed] [Google Scholar] 20. Крон М., Твин С.С., Рабе Л.К., Браун З., Хиллиер С.Л. Колонизация влагалища кишечной палочкой как фактор риска родов с очень низкой массой тела при рождении и других перинатальных осложнений. J заразить Dis. 1997; 175: 606–10. [PubMed] [Google Scholar] 21. Рани С., Мехра Р., Гупта В., Хурия А., Чандер Дж. Вагинальная флора при преждевременном преждевременном разрыве плодных оболочек и их чувствительность к обычно используемым антибиотикам. Азиатский журнал медицинских наук. 2014;5: 58–60. [Google Академия] 22. Гирал Э., Саес-Лопес Э., Бош Дж., Гонсе А., Лопес М., Санс С. и др.
Устойчивость к противомикробным препаратам и характеристика вирулентности среди клинических изолятов Escherichia coli , вызывающих тяжелые акушерские инфекции у беременных.Дж. Клин Микробиол. 2015;53: 1745–1747. 10.1128/JCM.00487-15
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23. Ван ден Хуген А., Джерардс Л.Дж., Вербун-Мациолек М.А., Флеер А., Кредиет Т.Г. Многолетние тенденции в эпидемиологии неонатального сепсиса и антибиотикочувствительности возбудителей. Неонатология. 2010; 97: 22–28. 10.1159/000226604
[PubMed] [CrossRef] [Google Scholar] 24. Канкури Э., Курки Т., Карлсон П.
J заразить Dis. 1997; 175: 606–10. [PubMed] [Google Scholar] 21. Рани С., Мехра Р., Гупта В., Хурия А., Чандер Дж. Вагинальная флора при преждевременном преждевременном разрыве плодных оболочек и их чувствительность к обычно используемым антибиотикам. Азиатский журнал медицинских наук. 2014;5: 58–60. [Google Академия] 22. Гирал Э., Саес-Лопес Э., Бош Дж., Гонсе А., Лопес М., Санс С. и др.
Устойчивость к противомикробным препаратам и характеристика вирулентности среди клинических изолятов Escherichia coli , вызывающих тяжелые акушерские инфекции у беременных.Дж. Клин Микробиол. 2015;53: 1745–1747. 10.1128/JCM.00487-15
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23. Ван ден Хуген А., Джерардс Л.Дж., Вербун-Мациолек М.А., Флеер А., Кредиет Т.Г. Многолетние тенденции в эпидемиологии неонатального сепсиса и антибиотикочувствительности возбудителей. Неонатология. 2010; 97: 22–28. 10.1159/000226604
[PubMed] [CrossRef] [Google Scholar] 24. Канкури Э., Курки Т., Карлсон П. , Хиилесмаа В. Заболеваемость, лечение и исход перипартального сепсиса. Acta Obstet Gynecol Scand.2003; 82: 730–735. [PubMed] [Google Scholar] 26. Шарифф В.А.Р., Шеной М.С., Ядав Т., М.Р. Модели чувствительности к антибиотикам уропатогенной кишечной палочки с особым упором на фторхинолоны. J Clin Diagn Res. 2013;7: 1027–1030. 10.7860/JCDR/2013/4917.3038
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]27. Hancock V, Ferrières L, Klemm P. Железный рецептор поглощения иерсиниабактина FyuA необходим для эффективного образования биопленки инфекционным кишечной палочкой мочевыводящих путей в моче человека.Микробиология. 2008; 154: 167–175. 10.1099/мик.0.2007/011981-0
[PubMed] [CrossRef] [Google Scholar] 28. Гарсия Э.К., Брамбо А.Р., Мобли ХЛТ. Избыточность и специфичность систем получения железа Escherichia coli при инфекции мочевыводящих путей. Заразить иммун. 2011;79: 1225–35. 10.1128/ИАИ.01222-10
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]29.
, Хиилесмаа В. Заболеваемость, лечение и исход перипартального сепсиса. Acta Obstet Gynecol Scand.2003; 82: 730–735. [PubMed] [Google Scholar] 26. Шарифф В.А.Р., Шеной М.С., Ядав Т., М.Р. Модели чувствительности к антибиотикам уропатогенной кишечной палочки с особым упором на фторхинолоны. J Clin Diagn Res. 2013;7: 1027–1030. 10.7860/JCDR/2013/4917.3038
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]27. Hancock V, Ferrières L, Klemm P. Железный рецептор поглощения иерсиниабактина FyuA необходим для эффективного образования биопленки инфекционным кишечной палочкой мочевыводящих путей в моче человека.Микробиология. 2008; 154: 167–175. 10.1099/мик.0.2007/011981-0
[PubMed] [CrossRef] [Google Scholar] 28. Гарсия Э.К., Брамбо А.Р., Мобли ХЛТ. Избыточность и специфичность систем получения железа Escherichia coli при инфекции мочевыводящих путей. Заразить иммун. 2011;79: 1225–35. 10.1128/ИАИ.01222-10
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]29. Бауэр Х.В., Шамс Х., Бауэр Р.М. Вакцинация против инфекций мочевыводящих путей, вызванных кишечной палочкой. 2013; 2013: 487–492. [Google Академия] 30.Поршерон Г., Гарено А., Пру Ж., Сабри М., Дозуа К.М. Транспорт и регуляция железа, меди, цинка и марганца у патогенных энтеробактерий: корреляции между штаммами, местом заражения и относительной важностью различных систем транспорта металлов для вирулентности. Front Cell Infect Microbiol. 2013;3:90
10.3389/fcimb.2013.00090
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]32. Сото С.М., Бош Дж., Хименес де Анта М.Т., Вила Дж. Сравнительное исследование признаков вирулентности клинических изолятов Escherichia coli , вызывающих ранний и поздний неонатальный сепсис.Дж. Клин Микробиол. 2008; 46: 1123–1125. [Бесплатная статья PMC] [PubMed] [Google Scholar]33. Кук С.В., Хэммилл Х.А., Халл Р.А. Факторы вирулентности кишечной палочки, выделенной при инфекциях женских половых путей и неонатальном сепсисе. Infect Dis Obstet Gynecol.
Бауэр Х.В., Шамс Х., Бауэр Р.М. Вакцинация против инфекций мочевыводящих путей, вызванных кишечной палочкой. 2013; 2013: 487–492. [Google Академия] 30.Поршерон Г., Гарено А., Пру Ж., Сабри М., Дозуа К.М. Транспорт и регуляция железа, меди, цинка и марганца у патогенных энтеробактерий: корреляции между штаммами, местом заражения и относительной важностью различных систем транспорта металлов для вирулентности. Front Cell Infect Microbiol. 2013;3:90
10.3389/fcimb.2013.00090
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]32. Сото С.М., Бош Дж., Хименес де Анта М.Т., Вила Дж. Сравнительное исследование признаков вирулентности клинических изолятов Escherichia coli , вызывающих ранний и поздний неонатальный сепсис.Дж. Клин Микробиол. 2008; 46: 1123–1125. [Бесплатная статья PMC] [PubMed] [Google Scholar]33. Кук С.В., Хэммилл Х.А., Халл Р.А. Факторы вирулентности кишечной палочки, выделенной при инфекциях женских половых путей и неонатальном сепсисе. Infect Dis Obstet Gynecol. 2001; 9: 203–207. [Бесплатная статья PMC] [PubMed] [Google Scholar]34. Биросова Э., Зигфрид Л., Кметова М., Макара, Остро, Гресова и др.
Выявление факторов вирулентности у альфа-гемолитических штаммов Escherichia coli , выделенных из различного клинического материала.Клин Микробиол Инфект. 2004; 10: 569–73. [PubMed] [Google Scholar] 35. Гирал Э., Бош Дж., Вила Дж., Сото С.М. Антимикробная резистентность штаммов Escherichia coli, вызывающих неонатальный сепсис в период с 1998 по 2008 год. Химиотерапия. 2012; 58: 123–8. 10.1159/000337062
[PubMed] [CrossRef] [Google Scholar] 36. Escobar-Páramo P, Clermont O, Blanc-Potard AB, Bui H, Le Bouguénec C, Denamur E. Для приобретения и экспрессии факторов вирулентности в Escherichia coli требуется определенный генетический фон.Мол Биол Эвол. 2004; 21: 1085–1094. [PubMed] [Google Scholar] 37. Джонсон Дж. Р., Кусковски М. А., О’Брайан Т. Т., Колоднер Р., Раз Р. Генотип вирулентности и филогенетическое происхождение в отношении профиля устойчивости к антибиотикам среди изолятов мочи Escherichia coli от израильских женщин с острым неосложненным циститом.
2001; 9: 203–207. [Бесплатная статья PMC] [PubMed] [Google Scholar]34. Биросова Э., Зигфрид Л., Кметова М., Макара, Остро, Гресова и др.
Выявление факторов вирулентности у альфа-гемолитических штаммов Escherichia coli , выделенных из различного клинического материала.Клин Микробиол Инфект. 2004; 10: 569–73. [PubMed] [Google Scholar] 35. Гирал Э., Бош Дж., Вила Дж., Сото С.М. Антимикробная резистентность штаммов Escherichia coli, вызывающих неонатальный сепсис в период с 1998 по 2008 год. Химиотерапия. 2012; 58: 123–8. 10.1159/000337062
[PubMed] [CrossRef] [Google Scholar] 36. Escobar-Páramo P, Clermont O, Blanc-Potard AB, Bui H, Le Bouguénec C, Denamur E. Для приобретения и экспрессии факторов вирулентности в Escherichia coli требуется определенный генетический фон.Мол Биол Эвол. 2004; 21: 1085–1094. [PubMed] [Google Scholar] 37. Джонсон Дж. Р., Кусковски М. А., О’Брайан Т. Т., Колоднер Р., Раз Р. Генотип вирулентности и филогенетическое происхождение в отношении профиля устойчивости к антибиотикам среди изолятов мочи Escherichia coli от израильских женщин с острым неосложненным циститом. Противомикробные агенты Chemother. 2005; 49: 26–31. [Бесплатная статья PMC] [PubMed] [Google Scholar]38. Moreno E, Prats G, Sabaté M, Pérez T, Johnson JR, Andreu A. Устойчивость к хинолонам, фторхинолонам и триметоприму/сульфаметоксазолу в отношении детерминант вирулентности и филогенетического фона среди уропатогенных Escherichia coli .J Антимикробная химиотерапия. 2006; 57: 204–11. [PubMed] [Google Scholar] 39. Soto SM, De Anta MTJ, Vila J. Хинолоны вызывают частичную или полную потерю островков патогенности в уропатогенных Escherichia coli SOS-зависимыми или независимыми путями соответственно. Противомикробные агенты Chemother. 2006; 50: 649–53.
[Бесплатная статья PMC] [PubMed] [Google Scholar]40. Харт А., Новицкий Б.Дж., Рейснер Б., Павелчик Э., Голушко П., Урвил П. и соавт.
Ампициллин-резистентный Escherichia coli при гестационном пиелонефрите: повышенная частота и связь с фактором колонизации Dr-адгезином.J заразить Dis. 2001; 183: 1526–1529. [PubMed] [Google Scholar]
Противомикробные агенты Chemother. 2005; 49: 26–31. [Бесплатная статья PMC] [PubMed] [Google Scholar]38. Moreno E, Prats G, Sabaté M, Pérez T, Johnson JR, Andreu A. Устойчивость к хинолонам, фторхинолонам и триметоприму/сульфаметоксазолу в отношении детерминант вирулентности и филогенетического фона среди уропатогенных Escherichia coli .J Антимикробная химиотерапия. 2006; 57: 204–11. [PubMed] [Google Scholar] 39. Soto SM, De Anta MTJ, Vila J. Хинолоны вызывают частичную или полную потерю островков патогенности в уропатогенных Escherichia coli SOS-зависимыми или независимыми путями соответственно. Противомикробные агенты Chemother. 2006; 50: 649–53.
[Бесплатная статья PMC] [PubMed] [Google Scholar]40. Харт А., Новицкий Б.Дж., Рейснер Б., Павелчик Э., Голушко П., Урвил П. и соавт.
Ампициллин-резистентный Escherichia coli при гестационном пиелонефрите: повышенная частота и связь с фактором колонизации Dr-адгезином.J заразить Dis. 2001; 183: 1526–1529. [PubMed] [Google Scholar]E.
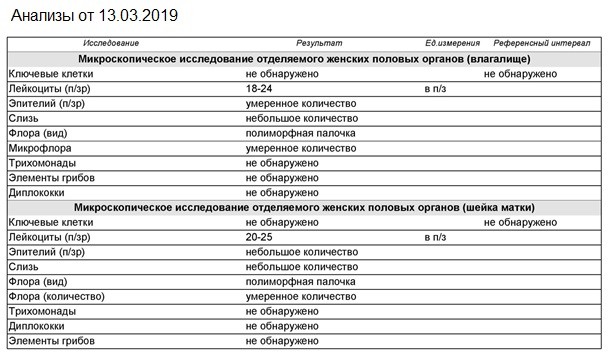 Coli (кишечная палочка) при беременности: причины, симптомы и лечение Наша цель FirstCry Parenting — предоставить вам самую актуальную, точную и актуальную информацию.
Coli (кишечная палочка) при беременности: причины, симптомы и лечение Наша цель FirstCry Parenting — предоставить вам самую актуальную, точную и актуальную информацию.Каждая статья, которую мы публикуем, соответствует строгим правилам и включает в себя несколько уровней рецензирования, как нашей редакционной группы, так и экспертов. Мы приветствуем ваши предложения по тому, как сделать эту платформу более полезной для всех наших пользователей. Напишите нам в родительский комитет[email protected]
Последнее обновление
Escherichia coli — это тип бактерий, которые обычно вызывают инфекции у детей и взрослых. Эта инфекция обычно проходит в течение недели, но беременные женщины могут быть более восприимчивы к ее симптомам. Важно заботиться о личной гигиене, а также о чистоте окружающего пространства. Давайте подробно рассмотрим эти бактерии и то, как они могут повлиять на беременность.
Что такое
Escherichia coli инфекция?E. coli, или Escherichia coli, — это бактерия, которая естественным образом обитает во влагалище и кишечнике. Как правило, это безвредно, но если бактерия попадет в такие места, как почки или желудок, возникнут проблемы. Существуют различные штаммы бактерий E. coli , некоторые из которых известны как опасные. Эти штаммы E. coli могут вызывать инфекции и другие проблемы во время беременности.
Каковы источники
E. coli ?В то время как некоторые типы E. coli естественным образом присутствуют в вашем организме, другие виды попадают в ваш организм через различные среды. Некоторые источники E. coli перечислены ниже:
- Немытые овощи и фрукты
- Сырое мясо
- Фекалии человека или животных
- Неочищенная или загрязненная водопроводная вода, особенно при контакте с сельскохозяйственными или сточными водами
- Вода в плавательных бассейнах, не прошедшая очистку или обработку хлором
- Непастеризованные фруктовые соки
- Непастеризованное молоко
Э.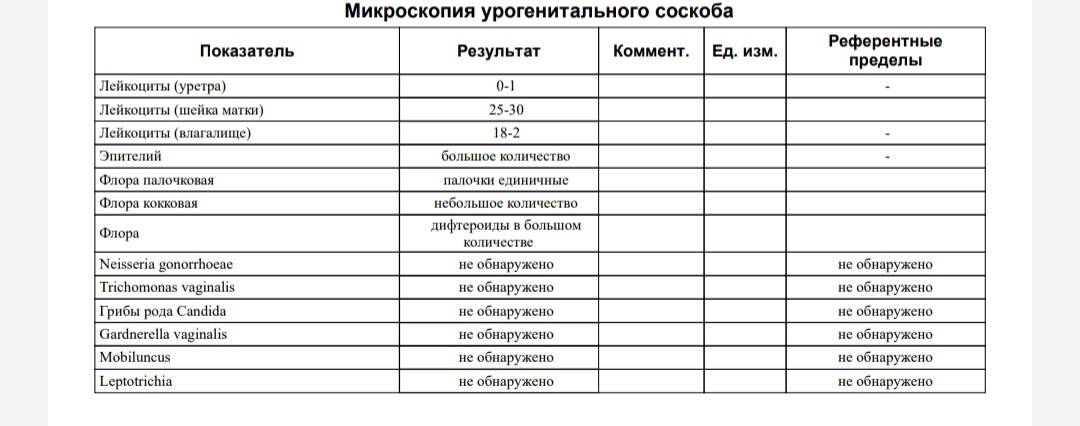 coli также может передаваться прикосновением. Если человек, имеющий на руке бактерию E. coli , прикасается к вам, велика вероятность того, что вы заразитесь.
coli также может передаваться прикосновением. Если человек, имеющий на руке бактерию E. coli , прикасается к вам, велика вероятность того, что вы заразитесь.
Симптомы инфекции
E. coli во время беременностиНекоторые из симптомов инфекции Escherichia coli во время беременности:
1. Тошнота
Это наиболее распространенный симптом инфекции E. coli . Проявляется неприятным ощущением в желудке или неприятным ощущением в задней части горла.
2. Спазмы в животе
Другим симптомом является боль в области живота.
3. Диарея
— это состояние, при котором фекалии часто выделяются в жидком состоянии. У вас также может быть мягкий водянистый стул (диарея) или сильный стул с примесью крови.
4. Рвота
Это еще один симптом. Вы можете почувствовать тошноту перед рвотой.
5. Усталость
Вы также можете чувствовать усталость из-за других симптомов инфекции или потому, что ваше тело прилагает усилия для борьбы с болезнью.
6. Обезвоживание
Обезвоживание может быть вызвано диареей или рвотой из-за болезни.
7. Газ
Инфекция, вызванная бактериями E. coli , поражает желудочно-кишечный тракт, вызывая повышенное газообразование.
8. Кровь в моче
В редких случаях кровь может появиться в моче, если инфекция не диагностирована вовремя, или если выяснится, что у вас также недиагностированная инфекция мочевыводящих путей.
9. Лихорадка
Инфекция также может вызвать у вас высокую температуру.Беременные женщины должны быть особенно осторожны, если у них жар. В общей практике считается, что у человека нет жара, пока температура тела не поднимется выше 100,4 F.
10. Бледная кожа
Это может быть вызвано обезвоживанием, усталостью или недостаточным питанием во время болезни. Если у вас инфекция E. coli , врач сможет порекомендовать вам диету, безопасную для кишечника.
11. Кровоподтеки на коже
В некоторых случаях вы можете заметить темные пятна на коже.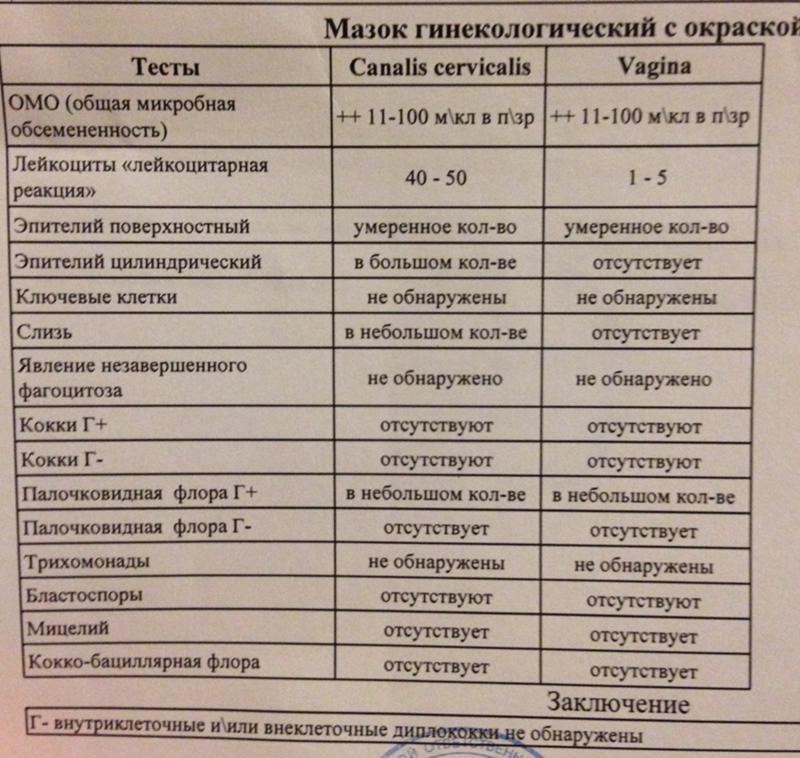
Влияет ли инфекция
E. coli на беременность?Инфекция E. coli у беременной женщины может повлиять на течение беременности, увеличивая количество различных осложнений:
- E. coli может вызывать диарею, которая приводит к потере жидкости организмом и обезвоживанию организма. Это может привести к таким проблемам, как низкий уровень амниотической жидкости.
- В редких случаях у беременной женщины может начаться сильное кровотечение. В случае тяжелой инфекции может возникнуть вероятность преждевременного разрыва плодных оболочек, выкидыша, преждевременных родов или мертворождения.
- Также сообщается, что инфекция E. coli может привести к низкой массе тела при рождении.
Как лечить
E. coli Инфекцию во время беременности Беременным женщинам может быть назначен курс антибиотиков для лечения инфекции E. coli . Обязательно проконсультируйтесь с врачом, безопасны ли антибиотики для плода. Некоторые антибиотики, которые можно принимать для лечения инфекции E. coli , — это нитрофурантоин и цефалоспорины, если врач скажет, что это необходимо.
Некоторые антибиотики, которые можно принимать для лечения инфекции E. coli , — это нитрофурантоин и цефалоспорины, если врач скажет, что это необходимо.
Большинство здоровых людей выздоравливают от E. coli в течение нескольких дней, не принимая никаких лекарств.
Примечание: Вы должны принимать антибиотики только после получения рецепта от медицинского работника.
Как предотвратить заражение
E. coli во время беременности?Чтобы избежать бактериальной инфекции E. coli во время беременности, вы можете принять следующие меры предосторожности:
- Обязательно обрабатывайте руки дезинфицирующим средством после прикосновения к сырому мясу.
- Всегда мойте руки водой с мылом после использования или чистки туалета, обращения с грязным бельем и полотенцами, смены подгузников и прикосновения к животным. Это связано с тем, что E. coli обнаруживается в моче и фекалиях.

- Тщательно проварите мясо до полной готовности.
- Очистите любую поверхность, соприкасающуюся с сырым мясом, отбеливателем или дезинфицирующим средством.
- Пейте только пастеризованное молоко и сок.
- Перед употреблением замочите или вымойте все фрукты и овощи в емкости с подсоленной водой.
- Вам следует избегать плавания, особенно в общественных бассейнах, так как вода может быть загрязнена.
Если вы считаете, что у вас может быть инфекция E. coli , как можно раньше обратитесь к своему лечащему врачу. Легко лечится, если вовремя диагностировать. Один из лучших способов предотвратить заражение инфекцией E. coli — следить за чистотой вокруг, соблюдать правила личной гигиены и есть хорошо приготовленную пищу.
Читайте также: Пищевое отравление во время беременности
границ | Аэробный вагинит, вызванный инфекцией Escherichia coli во время беременности, может привести к неблагоприятным исходам беременности через путь IL-4/JAK-1/STAT-6
Введение
Человеческий микробиом привлек значительное внимание в последние несколько лет (Lloyd-Price et al. , 2016). Вагинальный микробиом, в котором обычно преобладают конспецифические Lactobacillus , как жизненно важный компонент микробиома человека, все чаще признается научными исследователями (Fettweis et al., 2019). Если вагинальные лактобациллы отсутствуют, но полимикробная флора (например, бактерии родов Gardnerella , Prevotella , PepeTostrelleptococcus , Mobiluncus , Snathia , Leptotrichia , или MyCoplasma ) возникает бактериальный вагиноз (Onderdonk et al., 2016). Если преобладающие организмы разрушены и управляются аэробными бактериями, такими как Escherichia coli ( E. coli ), группа B Streptococci или Staphylococcus aureus , возникает тревожное состояние, называемое «аэробным вагинитом» (AV). (Дондерс и др., 2002, 2011, 2017). Клинические жалобы пациенток с АВ обычно включают вязкие и желтые выделения из влагалища, ощущение покалывания, жжения и даже диспареунию (Donders et al., 2017). Поэтому АВ заслуживает повышенного внимания.
, 2016). Вагинальный микробиом, в котором обычно преобладают конспецифические Lactobacillus , как жизненно важный компонент микробиома человека, все чаще признается научными исследователями (Fettweis et al., 2019). Если вагинальные лактобациллы отсутствуют, но полимикробная флора (например, бактерии родов Gardnerella , Prevotella , PepeTostrelleptococcus , Mobiluncus , Snathia , Leptotrichia , или MyCoplasma ) возникает бактериальный вагиноз (Onderdonk et al., 2016). Если преобладающие организмы разрушены и управляются аэробными бактериями, такими как Escherichia coli ( E. coli ), группа B Streptococci или Staphylococcus aureus , возникает тревожное состояние, называемое «аэробным вагинитом» (AV). (Дондерс и др., 2002, 2011, 2017). Клинические жалобы пациенток с АВ обычно включают вязкие и желтые выделения из влагалища, ощущение покалывания, жжения и даже диспареунию (Donders et al., 2017). Поэтому АВ заслуживает повышенного внимания.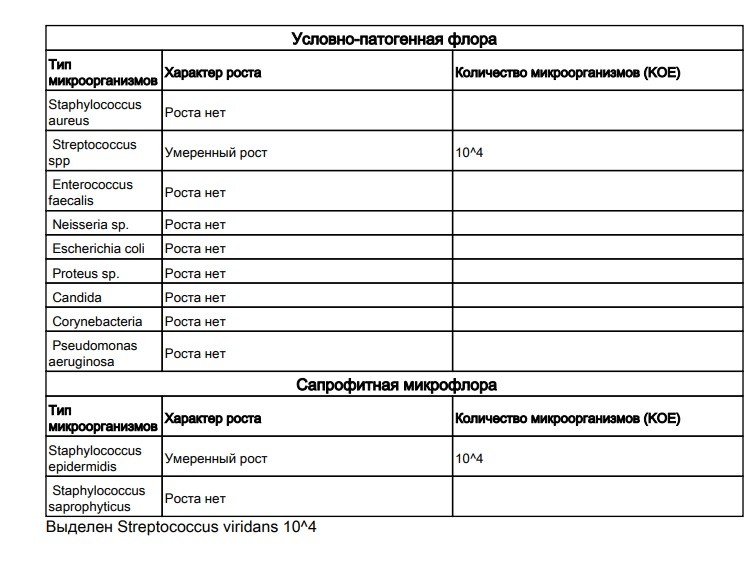
Инфекция, включая АВ, обычно означает реакции в местных тканях и системную воспалительную реакцию, вызванную инвазией бактерий, грибков, вирусов, паразитов или других патогенов. Иммунные реакции, вызванные инфекциями, могут оказывать негативное влияние на исход беременности, например, внутриутробное инфицирование, аборт, преждевременные роды или внематочная беременность (Smith and Ravel, 2017). Более того, повышенный риск заражения возникает во время беременности (Sacerdoti et al., 2018). Габриэль и Арк (2014) указали, что по сравнению с небеременными женщинами беременные в семь раз чаще госпитализируются из-за гриппа и в два раза чаще умирают.Эти явления могут быть результатом изменения уровня гормонов. Высокий уровень эстрогена во время беременности оказывает противовоспалительное действие, но заставляет Т-клетки смещаться в сторону Т-хелперов (Th)1, что вредно для беременности (Gabriel and Arck, 2014). Эта сложная взаимосвязь делает инфекцию во время беременности более трудноизлечимой.
Точный патогенез АВ до сих пор неизвестен, и исследования сосредоточены в основном на местных иммунологических изменениях. В предыдущей статье сообщалось, что уровни интерлейкина (ИЛ)-1β, ИЛ-6 и ИЛ-8 были значительно повышены в образцах вагинальных смывов у пациенток с АВ (Marconi et al., 2013). Другие исследования связывают упомянутые выше воспалительные факторы с преждевременными родами, неонатальным сепсисом и другими неблагоприятными исходами беременности (Dörtbudak et al., 2005; Simonsen et al., 2014; Gomez-Lopez et al., 2019).
Незнание точного патогенеза АВ затрудняет поиск акушерами эффективных терапевтических методов как для беременных, так и для небеременных пациенток. Кроме того, рецидив АВ и неэффективные лекарства усугубляют сложность лечения АВ (Donders et al., 2011; Хан и др., 2019). Более того, препараты, используемые во время беременности, вызывают споры (Bailey et al., 2018; Halpern et al., 2019). Все эти факторы вызывают многочисленные трудности у пациентов и акушеров.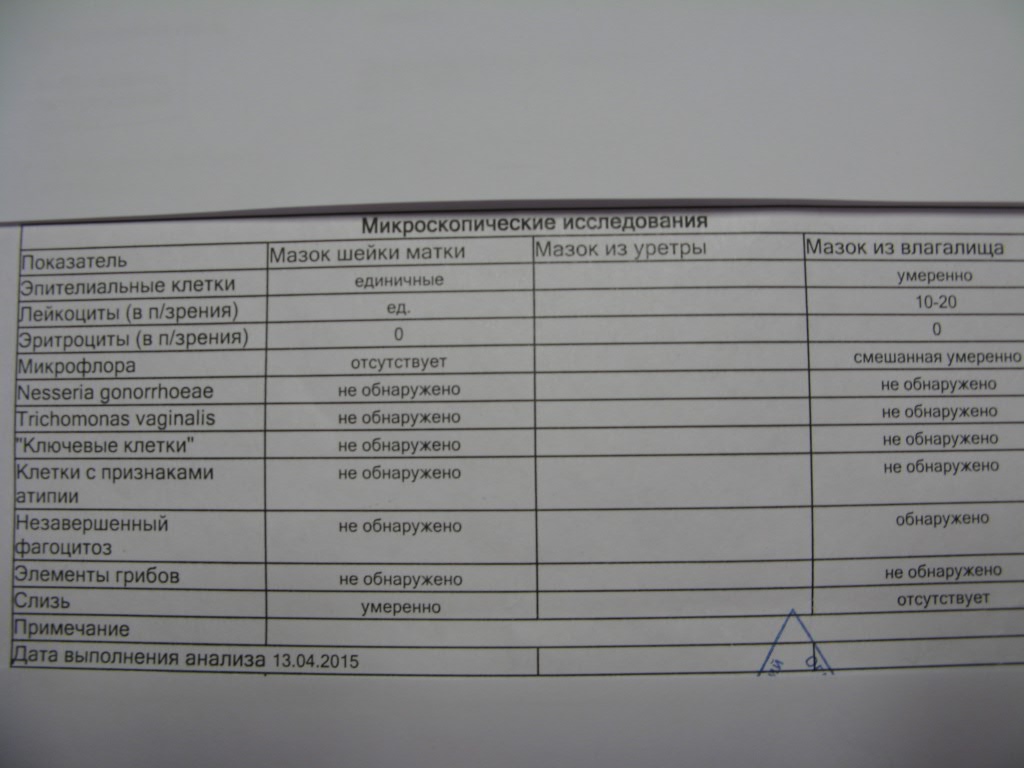 Таким образом, необходимо провести углубленное исследование для облегчения дискомфорта пациентов с АВ и улучшения текущего положения беременных женщин, страдающих АВ.
Таким образом, необходимо провести углубленное исследование для облегчения дискомфорта пациентов с АВ и улучшения текущего положения беременных женщин, страдающих АВ.
В текущем исследовании была создана мышиная модель инфекции AV base E. coli во время беременности, и наблюдалось воздействие на мать и плод.Впоследствии были исследованы основные механизмы действия вагинальных инфекций, вызванных инфекцией E. coli , на исход беременности. Мы также исследовали, восходят ли вагинальные инфекции к плаценте.
Материалы и методы
Препарат
Escherichia coli Escherichia coli штамм CTL5034 был получен из Микробиологической лаборатории больницы Нанкин Драм Тауэр (Нанкин, Китай). Он был криоконсервирован в 15% глицерине при -80°С.Подробные методы культивирования и сохранения E. coli соответствовали описанным в нашей предыдущей работе (Jiang et al., 2019). Для приготовления суспензий E. coli , E. coli мягко расплавляли на льду, а затем смешивали со сконфигурированной средой Луриа-Бертани (LB) в соотношении 1 к 50 в пробирке, которую медленно встряхивали.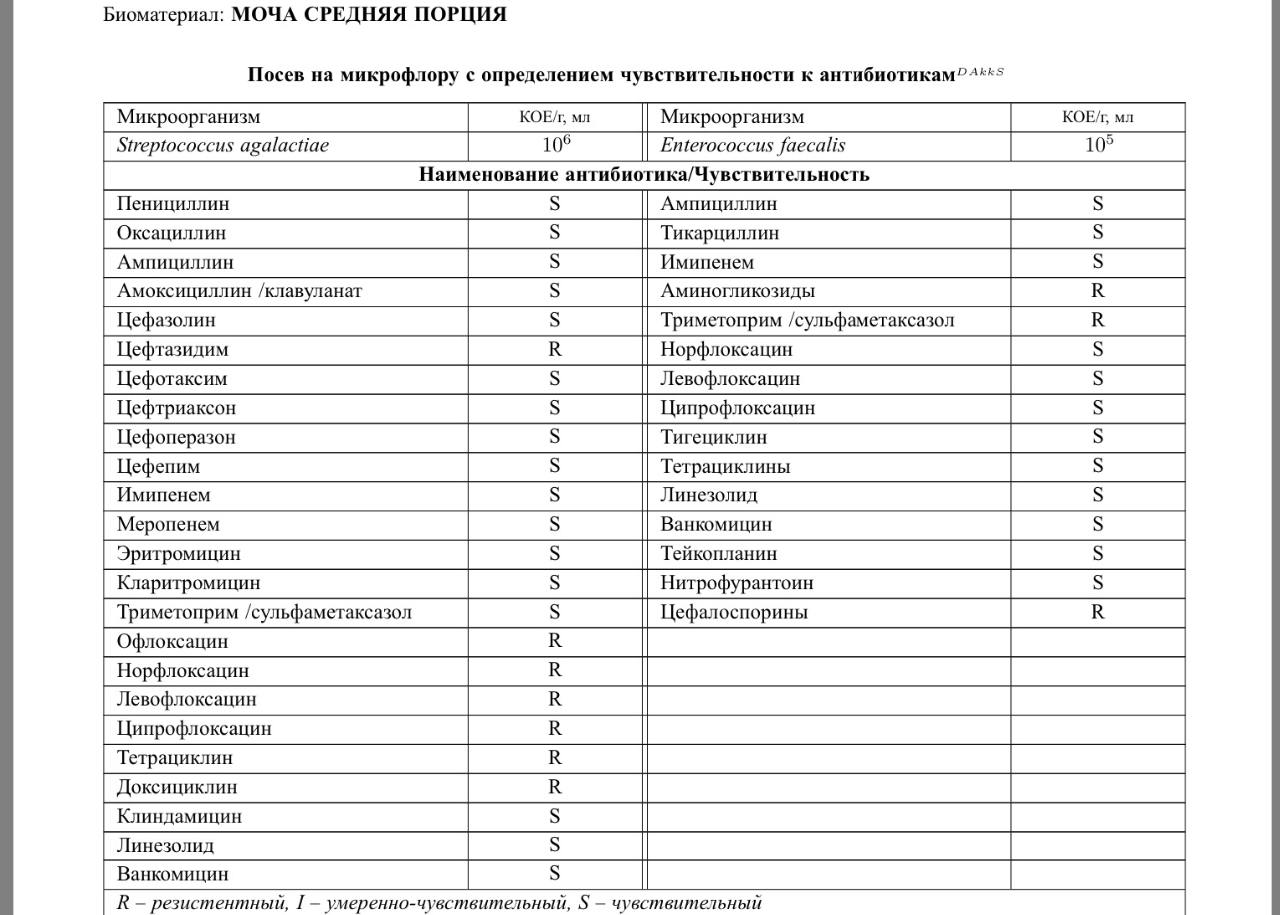 Затем пробирку помещали в инкубатор с постоянной температурой на шейкере со скоростью 220 оборотов в минуту (об/мин) на 12-16 часов.
Затем пробирку помещали в инкубатор с постоянной температурой на шейкере со скоростью 220 оборотов в минуту (об/мин) на 12-16 часов.
Эксперименты на животных
Все процедуры на животных были одобрены (IACUC-2008043) Советом по этике исследований на животных Нанкинского медицинского университета (Нанкин, Китай).Все самцы и самки мышей BALB/c (6-8 недель) были приобретены у Beijing Vital River Laboratory Animal Technology (Пекин, Китай). Они были выращены в лабораторной среде, свободной от специфических патогенов (SPF), в Центре ухода за животными Нанкинского медицинского университета.
Самец мыши сожительствовал с двумя самками во второй половине дня. Вагинальную пробку проверяли на следующий день, и беременных мышей регистрировали как «эмбриональный день 0,5» (E0,5). Затем самок мышей случайным образом делили на исследуемую и контрольную группы.
Мы вводили 20 мкл суспензии культуры E. coli (доза составляла около 2 × 10 7 КОЕ) и эквивалентный фосфатно-солевой буфер (PBS) во влагалище на ст. Е4.5 в основной и контрольной группах. группа соответственно. Мышей помещали в удобное положение для введения E. coli или PBS во влагалище. После инокуляции мышей удерживали в одном и том же положении более 3 мин. Затем мы спринцевали влагалище мышей в общей сложности 30 мкл PBS (3 × 10 мкл) в разные моменты времени.Затем мы собрали промывную жидкость влагалища (VLF) в асептические пробирки Eppendorf (EP) на E8.5, E11.5 и E18.5. Мы также провели кесарево сечение и собрали необходимые ткани на Э8.5, Э11.5 и Э18.5 в стерильных условиях. Одновременно с кесаревым сечением вес плодов и плаценты регистрировали на Е18,5. Также был задокументирован вес мышей на E0.5, E4.5, E8.5, E11.5 и E18.5.
Е4.5 в основной и контрольной группах. группа соответственно. Мышей помещали в удобное положение для введения E. coli или PBS во влагалище. После инокуляции мышей удерживали в одном и том же положении более 3 мин. Затем мы спринцевали влагалище мышей в общей сложности 30 мкл PBS (3 × 10 мкл) в разные моменты времени.Затем мы собрали промывную жидкость влагалища (VLF) в асептические пробирки Eppendorf (EP) на E8.5, E11.5 и E18.5. Мы также провели кесарево сечение и собрали необходимые ткани на Э8.5, Э11.5 и Э18.5 в стерильных условиях. Одновременно с кесаревым сечением вес плодов и плаценты регистрировали на Е18,5. Также был задокументирован вес мышей на E0.5, E4.5, E8.5, E11.5 и E18.5.
Культура жидкости для вагинального лаважа
Жидкость вагинального лаважа разбавляли в серии концентраций стерильным PBS вокруг спиртовки на чистом столе.Затем 10 мкл разбавленного VLF равномерно наносили на приготовленную твердую среду для планшетов LB с помощью стеклянной палочки с покрытием Bioclean. После этого планшетную среду помещали в шкаф с постоянной температурой при 37°C.
После этого планшетную среду помещали в шкаф с постоянной температурой при 37°C.
Окрашивание по Граму
Процедуры окрашивания по Граму включали подготовку и окрашивание мазков, включая первичное окрашивание, морилку, обесцвечивание и контрастное окрашивание. Сначала посевную петлю стерилизовали в пламени спиртовки докрасна, а затем давали остыть естественным путем в течение ∼30 с.Затем мы выбрали одну подходящую колонию с помощью инокуляционной петли на предметном стекле и равномерно покрыли ее, а затем мягко, но быстро пропустили предметное стекло через пламя три раза, чтобы зафиксировать мазки. После фиксации мазка наносили на мазок одну каплю раствора кристаллического фиолетового примерно на 1 мин для достижения первичного окрашивания. Для окрашивания мазок покрывали раствором йода по Граму примерно на 1 мин. Затем к предметному стеклу добавляли 95% этанол для обесцвечивания пятна не более чем на 30 с. Наконец, мы покрыли предметное стекло сафранином на 1 мин.После промывки и сушки на воздухе мы наблюдали результаты окрашивания под микроскопом (Carl Zeiss, Йена, Германия). Фиолетовым обозначены грамположительные бактерии, а розовым – грамотрицательные бактерии.
Фиолетовым обозначены грамположительные бактерии, а розовым – грамотрицательные бактерии.
Окрашивание гематоксилин-эозином (H&E)
Перед окрашиванием были созданы срезы ткани, залитые парафином. Вкратце, свежую вагинальную ткань фиксировали 4% раствором параформальдегида более 24 часов. Затем ткань обрезали скальпелем. Затем в автоматическом тканевом процессоре проводили обезвоживание и диафанизацию.Затем ткань заливали парафином и делали срезы. Затем приготовленные парафиновые срезы толщиной 4 мкм депарафинизировали ксилолом и градиентными концентрациями этанола. После депарафинизации и промывки срезы окрашивали гематоксилином (3–8 мин) и эозином (1–3 мин) по очереди. Срезы помещали в разные концентрации этанола и ксилола для обезвоживания. После сушки на воздухе мы поместили срезы в синтетическую смолу, а затем наблюдали результаты окрашивания под микроскопом.Ядро отображается синим цветом, а цитоплазма — красным.
Массив полимеразной цепной реакции (ПЦР)
The Mouse Cytokines and Chemokines RT 2 Profiler PCR Array (QIAGEN, Дюссельдорф, Германия) использовали в этом испытании.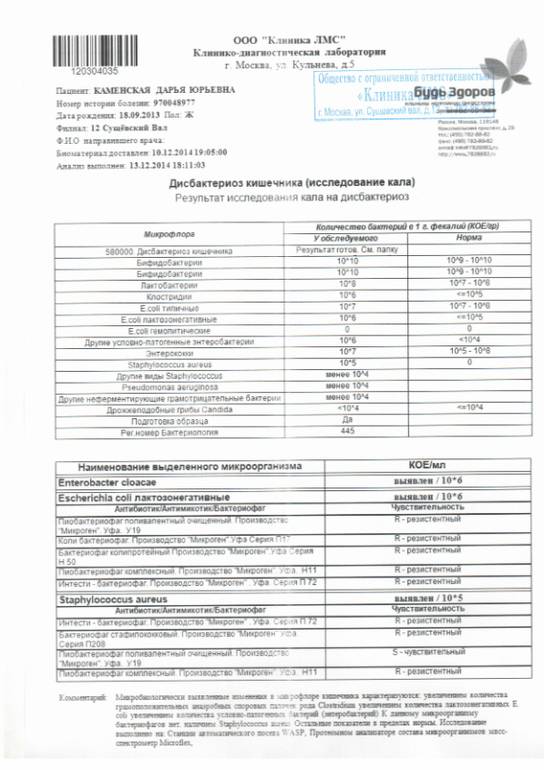 В соответствии с инструкциями производителя в каждую лунку 384-луночного реакционного планшета переносили по 10 мкл реакционной смеси. Последующие условия реакции были следующими: цикл нагревания в течение 10 мин при 95°С, 40 циклов сбора данных флуоресценции в течение 15 с при 95°С и 30 с при 60°С.
В соответствии с инструкциями производителя в каждую лунку 384-луночного реакционного планшета переносили по 10 мкл реакционной смеси. Последующие условия реакции были следующими: цикл нагревания в течение 10 мин при 95°С, 40 циклов сбора данных флуоресценции в течение 15 с при 95°С и 30 с при 60°С.
Разделение и культивирование клеток
Образцы ткани матки и плаценты были получены путем кесарева сечения на Е11.5 и немедленно промыты до прозрачности PBS. Затем 10 мМ 4-(2-гидроксиэтил)пиперазин-1-этансульфоновой кислоты (HEPES), 1% коллагеназы типа IV и 0,5% альбумина бычьей сыворотки растворяли в среде RPMI-1640, содержащей 10% эмбриональной бычьей сыворотки (FBS), а затем раствором отсоединения. Затем ткань разрезали на кусочки с использованием приготовленного отслаивающего раствора и эти кусочки помещали в центрифужную пробирку.Затем добавляли от 10 до 15 мл раствора для отщепления и помещали пробирку на шейкер-инкубатор при 150 об/мин на 30 мин при 37°С. Далее клеточную взвесь переносили в новую центрифужную пробирку и вновь отслаивали осадок 10 мл отщепляющего раствора на шейкере-инкубаторе при 150 об/мин в течение 20 мин при 37°С. Затем клеточную суспензию собирали в старую центрифужную пробирку, выдерживали ~15 мин на льду, а затем центрифугировали при 2000 об/мин в течение 10 мин при 4°С. Супернатант удаляли, а осадок снова центрифугировали после ресуспендирования в PBS.Затем осадок ресуспендировали с 3 мл 40% перколла, и суспендированную жидкость очень медленно добавляли к 2 мл 70% перколла с последующим центрифугированием в градиенте при 2500 об/мин в течение 10 мин при 20°С. После этого лейкоцитарную пленку в середине переносили в новую центрифужную пробирку и заполняли стерильным PBS. После центрифугирования при 2000 об/мин в течение 10 мин при 4°С супернатант удаляли, а осадок клеток ресуспендировали с 1 мл PBS. Буфер для лизиса эритроцитов применяли, когда можно было отчетливо наблюдать эритроциты.Наконец, разделенные клетки делили на две части и к одной из частей добавляли ИЛ-4. Обе части культивировали на среде RPMI-1640, содержащей 10 % FBS, при 37°C во влажном инкубаторе в атмосфере 5 % CO 2 .
Затем клеточную суспензию собирали в старую центрифужную пробирку, выдерживали ~15 мин на льду, а затем центрифугировали при 2000 об/мин в течение 10 мин при 4°С. Супернатант удаляли, а осадок снова центрифугировали после ресуспендирования в PBS.Затем осадок ресуспендировали с 3 мл 40% перколла, и суспендированную жидкость очень медленно добавляли к 2 мл 70% перколла с последующим центрифугированием в градиенте при 2500 об/мин в течение 10 мин при 20°С. После этого лейкоцитарную пленку в середине переносили в новую центрифужную пробирку и заполняли стерильным PBS. После центрифугирования при 2000 об/мин в течение 10 мин при 4°С супернатант удаляли, а осадок клеток ресуспендировали с 1 мл PBS. Буфер для лизиса эритроцитов применяли, когда можно было отчетливо наблюдать эритроциты.Наконец, разделенные клетки делили на две части и к одной из частей добавляли ИЛ-4. Обе части культивировали на среде RPMI-1640, содержащей 10 % FBS, при 37°C во влажном инкубаторе в атмосфере 5 % CO 2 .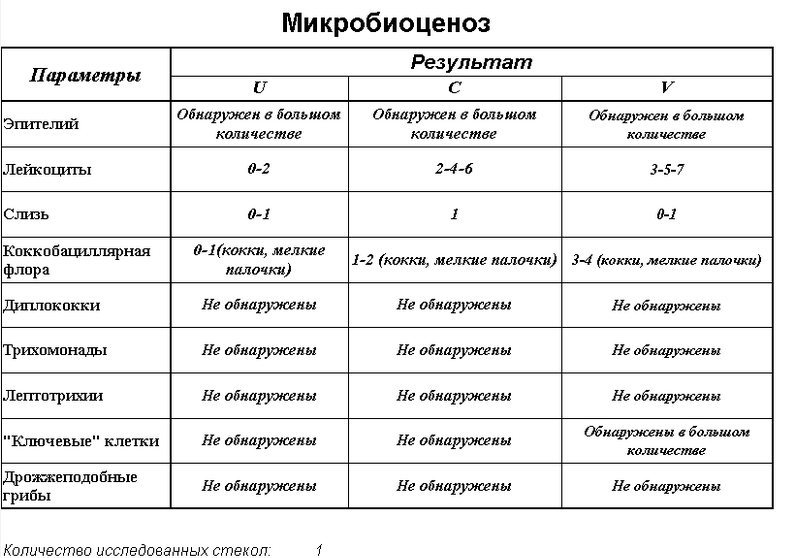
Проточная цитометрия
Отделенные децидуальные макрофаги (DM) мышей стимулировали в течение 5 ч форболом 12-миристат-13-ацетатом (PMA), иономицином (Ion) и брефельдином A (BFA). Далее ДМ собирали в пробирки для ФП и центрифугировали при 1000 об/мин в течение 5 мин при 4°С.Затем супернатант удаляли, а клеточный осадок ресуспендировали с использованием PBS. После повторного центрифугирования 100 мкл жидкости сохраняли и герметизировали 5 мкл сыворотки в течение 30 мин в темноте при 4°С. Затем к клеточной суспензии добавляли 1 мкл антитела (0,2 мг/мл) и инкубировали в темноте в течение 30 мин при 4°С. Наконец, анализ методом проточной цитометрии был проведен на BD FACSAria TM Special Order Research Product (BD Bioscience, Сан-Хосе, Калифорния, США).
Выделение тотальной РНК и количественная полимеразная цепная реакция с обратной транскрипцией в реальном времени (RT-qPCR)
Выделение РНК проводили на льду. Образцы ткани матки или плаценты лизировали путем добавления соответствующего количества (1 мл реагента TRIzol ® не более чем на 100 мг ткани) реагента TRIzol ® (Invitrogen, Карлсбад, Калифорния, США) в течение 10 мин. . После добавления к гомогенату 1/5 объема хлороформа образец интенсивно перемешивали в течение 10 с и оставляли на 5 мин при комнатной температуре.После центрифугирования собирали верхний слой (прозрачный) и добавляли половину объема изопропанола. После повторного центрифугирования супернатант осторожно удаляли и к белому осадку добавляли 1 мл 75%-ного этанола. После еще одного цикла центрифугирования супернатант отбрасывали. После сушки на воздухе в вытяжном шкафу добавляли 40 мкл диэтилпирокарбоната для растворения экстракции. Наконец, измеряли концентрацию выделенной РНК.
. После добавления к гомогенату 1/5 объема хлороформа образец интенсивно перемешивали в течение 10 с и оставляли на 5 мин при комнатной температуре.После центрифугирования собирали верхний слой (прозрачный) и добавляли половину объема изопропанола. После повторного центрифугирования супернатант осторожно удаляли и к белому осадку добавляли 1 мл 75%-ного этанола. После еще одного цикла центрифугирования супернатант отбрасывали. После сушки на воздухе в вытяжном шкафу добавляли 40 мкл диэтилпирокарбоната для растворения экстракции. Наконец, измеряли концентрацию выделенной РНК.
Для выделения РНК из экстрагированных децидуальных макрофагов после двукратной промывки PBS 0.В каждую лунку 12-луночного планшета добавляли по 5 мл реагента TRIzol ® . После продувки клеток и добавления одной пятой объема хлороформа последующие этапы были такими же, как при выделении РНК из образцов ткани матки или плаценты.
RT-qPCR проводили с использованием PrimeScript TM RT Reagent Kit с gDNA Eraser (TaKaRa Bio Inc. , Токио, Япония), SYBR ® Premix Ex Taq II (Tli RNaseH Plus) (TaKaRa Bio Inc., Tokyo , Япония) и систему ViiA TM 7 для ПЦР в реальном времени (Thermo Fisher Scientific, Уолтем, Массачусетс, США).Наборы праймеров показаны в дополнительной таблице 1.
, Токио, Япония), SYBR ® Premix Ex Taq II (Tli RNaseH Plus) (TaKaRa Bio Inc., Tokyo , Япония) и систему ViiA TM 7 для ПЦР в реальном времени (Thermo Fisher Scientific, Уолтем, Массачусетс, США).Наборы праймеров показаны в дополнительной таблице 1.
Иммуноферментный анализ (ELISA)
Сначала мы добавили подготовленные стандарты (100 мкл) и образцы (100 мкл) на лунку в микротитровальный планшет, затем закрыли планшет и инкубировали в течение 90 мин при 37°C. Затем планшет четыре раза промывали промывочным буфером и добавляли рабочий раствор биотинилированного антитела (100 мкл/лунку). После повторного закрытия планшета и инкубации в течение 60 мин при 37°С свободные ингредиенты удаляли четырехкратной промывкой промывочным буфером.Затем в каждую лунку добавляли по 100 мкл ферментсвязывающей рабочей жидкости. Планшет запечатывали и инкубировали в течение 30 мин при 37°С. После этого несвязанные соединения промывали четыре раза, как указано выше, и в каждую лунку добавляли по 100 мкл хромогенного агента. После инкубации в темноте в течение 10–20 мин при 37°C добавляли стоп-раствор (100 мкл/лунку). После однородного перемешивания сразу же измеряли оптическую плотность при 450 нм.
После инкубации в темноте в течение 10–20 мин при 37°C добавляли стоп-раствор (100 мкл/лунку). После однородного перемешивания сразу же измеряли оптическую плотность при 450 нм.
Выделение микробной геномной ДНК из ткани плаценты и ПЦР
Экстракцию микробной геномной ДНК из ткани плаценты проводили с помощью набора QIAamp ® PowerFecal ® Pro DNA Kit (QIAGEN, Дюссельдорф, Германия).После этого проводили ПЦР, как описано ниже. Вкратце, 0,1 мкг матричной ДНК, 0,8 мкл обратного праймера, 0,8 мкл прямого праймера и 10 мкл Taq Master Mix (Vazyme Biotech Co., Ltd., Нанкин, Китай) добавляли в чистую пробирку в соответствии с инструкцией производителя. инструкции. Затем мы добавили бидистиллированную воду, чтобы получить общий объем реакционной смеси 20 мкл. Затем смесь подвергали ПЦР в течение 35 циклов следующим образом: денатурация в течение 15 с при 95°С, отжиг в течение 15 с при 58°С и удлинение в течение 60 с при 72°С.Бактериальные праймеры 16S рРНК приведены в дополнительной таблице 1.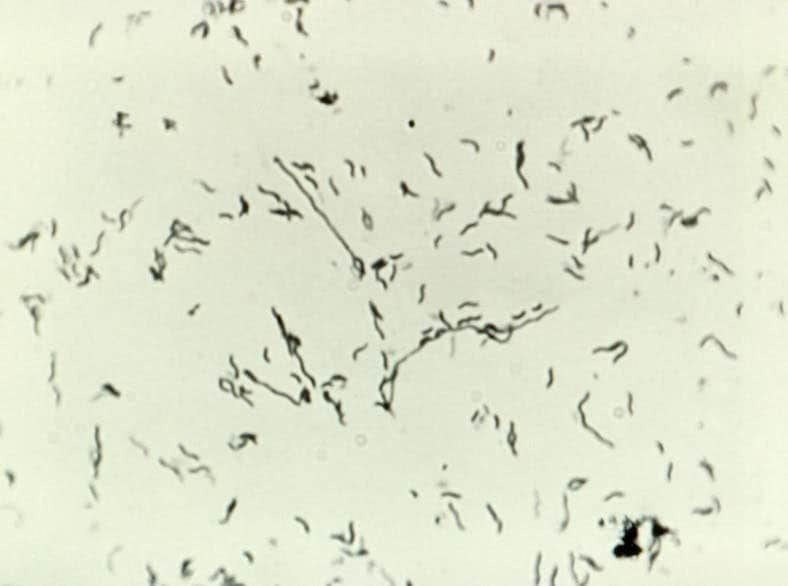
Электрофорез в агарозном геле
Однопроцентные гели готовили путем добавления 0,5 г агарозы и 50 мл буфера 1×ТАЕ. Перед охлаждением добавляли 2,5 мкл окрашивающего красителя Gold View TM . После приготовления геля в каждую лунку осторожно добавляли 5 мкл образца и 1 мкл буфера для 6-кратной загрузки, а также 6 мкл ДНК-маркера. Затем проводили электрофорез и наблюдали полосу электрофореза на системе FluorChem TM (ProteinSimple, Сан-Хосе, Калифорния, США).
Статистический анализ
Что касается непрерывных данных, тест на нормальность оценивался с использованием теста Шапиро-Уилка. Критерий Стьюдента t использовали для данных с нормальным распределением. Критерий Манна-Уитни U применяли для данных с ненормальным распределением. Все результаты были представлены как среднее ± стандартное отклонение (SD). Анализы PCR Array были реализованы с использованием веб-сайта в Интернете, предоставленного QIAGEN. Экспрессию генов-мишеней рассчитывали по методу 2 -ΔΔCT . Для визуализации данных и статистического анализа применяли программное обеспечение GraphPad Prism 8.0.1 (GraphPad Software, Сан-Диего, Калифорния, США) и SPSS 25.0 (SPSS Inc., Чикаго, Иллинойс, США). Во всех сравнениях значение P <0,05 считалось статистически значимым.
Для визуализации данных и статистического анализа применяли программное обеспечение GraphPad Prism 8.0.1 (GraphPad Software, Сан-Диего, Калифорния, США) и SPSS 25.0 (SPSS Inc., Чикаго, Иллинойс, США). Во всех сравнениях значение P <0,05 считалось статистически значимым.
Результаты
Создание модели вагинальной инфекции
E. coli у мышейПосле исследования вагинальных пробок мы вводили бактериальный раствор или PBS во влагалище мышей на E4.5 в исследуемой группе и контрольной группе (рис. 1А). Впоследствии VLF был приобретен и культивирован на E8.5, E11.5 и E18.5 для следующей серии исследований, и результаты показаны на дополнительной фигуре 1A. Бактериальные колонии наблюдали на культуральной среде LB в группе E. coli . Количество бактериальных колоний достигло пика на E8.5. Разница в количестве бактериальных колоний между Е11.5 и Е18.5 была небольшой, однако в контрольной группе бактериальных скоплений обнаружить не удалось.
Рисунок 1.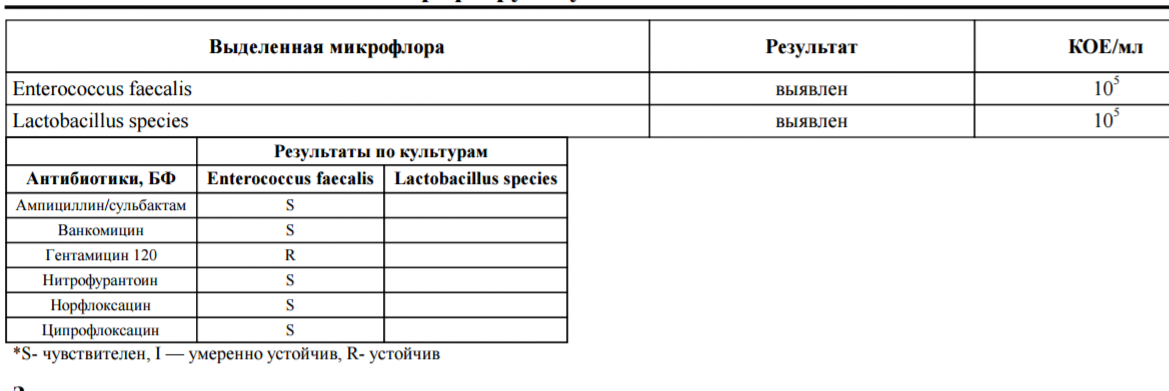 Конструирование животных моделей вагинальной инфекции, индуцированной E. coli . (A) Ход экспериментов на животных в этом исследовании. (B) Окрашивание H&E вагинальной ткани в исследуемой группе и контрольной группе мышей на E8.5, E11.5 и E18.5. Увеличение используемого микроскопа для исследования составляло 100×.
Конструирование животных моделей вагинальной инфекции, индуцированной E. coli . (A) Ход экспериментов на животных в этом исследовании. (B) Окрашивание H&E вагинальной ткани в исследуемой группе и контрольной группе мышей на E8.5, E11.5 и E18.5. Увеличение используемого микроскопа для исследования составляло 100×.
было проведено для просмотра морфологии бактерий, и результаты показали, что культивируемые бактерии были грамотрицательными бациллами (дополнительная фигура 1B), что соответствует характеристике E.палочка . Затем было выполнено окрашивание вагинальной ткани H&E с целью понимания возможных гистологических изменений. Увеличение исследования под микроскопом, которое мы использовали в этом исследовании, составляло 100 × (рис. 1В). В группе с вагинальной инфекцией были видны инфильтрация воспалительных клеток в вагинальный эпителий, а также образование лимфоидных фолликулов. Кроме того, в исследуемой группе увеличилось количество слоев вагинального эпителия, а вагинальный эпителий был более неравномерным. После окрашивания гематоксилин-эозином в группе E. coli изменения воспаления влагалища не были очевидными с течением времени. Все эти результаты показывают, что мыши, подвергшиеся воздействию E. coli , страдали вагинальной инфекцией.
После окрашивания гематоксилин-эозином в группе E. coli изменения воспаления влагалища не были очевидными с течением времени. Все эти результаты показывают, что мыши, подвергшиеся воздействию E. coli , страдали вагинальной инфекцией.
Влияние вагинальной инфекции
E. coli на фенотипы мышей и их потомства Было полученоизображения плода и плаценты (дополнительная фигура 2). Изображения показали, что эмбриональный рост мышей еще не был ясен на E8.5, но плоды выглядели крупнее, чем плоды в контрольной группе. На Е11.5 все более отчетливо становилось развитие конечностей плодов, в это же время происходили и аборты. Затем на Е18.5 плоды выглядели полностью развитыми внешне и крупнее, чем в контрольной группе. Кроме того, в группе E. coli были отчетливо видны выкидыши у материнских мышей.
Характеристики беременных мышей и их плодов показаны на рисунке 2. Мы использовали 17 беременных мышей в контрольной группе и 18 беременных мышей в группе E. группа coli . Кесарево сечение выполняли во все моменты времени, и количество мышей, использованных в каждый момент времени в контрольной группе на E8.5, E11.5 и E18.5, составляло шесть, пять и шесть соответственно. Точно так же количество мышей, использованных в каждый момент времени в группе E. coli на E8.5, E11.5 и E18.5, составляло шесть, шесть и шесть соответственно. Вес беременных мышей на E0,5 был принят за 0, и на рисунке 2А показано, что вес беременных мышей увеличивался с увеличением количества эмбриональных дней.Средняя прибавка веса беременных мышей на Э4.5, Э8.5, Э11.5 и Э18.5 в контрольной группе составила 0,44 ± 0,65 г, 1,86 ± 0,61 г, 3,87 ± 1,06 г и 16,57 ± 3,70 г, соответственно. Соответствующее значение веса в группе E. coli составило 0,69 ± 0,73 г, 1,94 ± 0,59 г, 3,52 ± 0,79 г и 12,15 ± 2,13 г соответственно. Последующие статистические данные показали, что значительная разница в весе беременных мышей была отмечена на E18.5 между контрольной группой и группой E.
группа coli . Кесарево сечение выполняли во все моменты времени, и количество мышей, использованных в каждый момент времени в контрольной группе на E8.5, E11.5 и E18.5, составляло шесть, пять и шесть соответственно. Точно так же количество мышей, использованных в каждый момент времени в группе E. coli на E8.5, E11.5 и E18.5, составляло шесть, шесть и шесть соответственно. Вес беременных мышей на E0,5 был принят за 0, и на рисунке 2А показано, что вес беременных мышей увеличивался с увеличением количества эмбриональных дней.Средняя прибавка веса беременных мышей на Э4.5, Э8.5, Э11.5 и Э18.5 в контрольной группе составила 0,44 ± 0,65 г, 1,86 ± 0,61 г, 3,87 ± 1,06 г и 16,57 ± 3,70 г, соответственно. Соответствующее значение веса в группе E. coli составило 0,69 ± 0,73 г, 1,94 ± 0,59 г, 3,52 ± 0,79 г и 12,15 ± 2,13 г соответственно. Последующие статистические данные показали, что значительная разница в весе беременных мышей была отмечена на E18.5 между контрольной группой и группой E. coli ( P = 0.030). Частота выкидышей у беременных мышей показана на рисунке 2B. Детали выживания плода каждой беременной мыши в контрольной группе на E11.5 следующие: 10 живых и 0 мертвых плодов, шесть живых и один мертвый плод, восемь живых и 0 мертвых плодов, шесть живых и 0 мертвых плодов и восемь живых и один мертвый плод. Точно так же детали выживания плода каждой беременной мыши в группе E. coli на E11.5 следующие: восемь живых и один мертвый плод, шесть живых и два мертвых плода, восемь живых и 0 мертвых плодов, девять живых и о мертвые зародыши, восемь живых и один мертвый зародыш, шесть живых и один мертвый зародыш.Детали выживаемости плода каждой беременной мыши в контрольной группе на E18.5 следующие: 11 живых и 0 мертвых плодов, 10 живых и 0 мертвых плодов, девять живых и 0 мертвых плодов, восемь живых и 0 мертвых плодов, семь живых и один мертвый плод, а также шесть живых и 0 мертвых плодов. Подробная информация о выживании плода каждой беременной мыши в группе E.
coli ( P = 0.030). Частота выкидышей у беременных мышей показана на рисунке 2B. Детали выживания плода каждой беременной мыши в контрольной группе на E11.5 следующие: 10 живых и 0 мертвых плодов, шесть живых и один мертвый плод, восемь живых и 0 мертвых плодов, шесть живых и 0 мертвых плодов и восемь живых и один мертвый плод. Точно так же детали выживания плода каждой беременной мыши в группе E. coli на E11.5 следующие: восемь живых и один мертвый плод, шесть живых и два мертвых плода, восемь живых и 0 мертвых плодов, девять живых и о мертвые зародыши, восемь живых и один мертвый зародыш, шесть живых и один мертвый зародыш.Детали выживаемости плода каждой беременной мыши в контрольной группе на E18.5 следующие: 11 живых и 0 мертвых плодов, 10 живых и 0 мертвых плодов, девять живых и 0 мертвых плодов, восемь живых и 0 мертвых плодов, семь живых и один мертвый плод, а также шесть живых и 0 мертвых плодов. Подробная информация о выживании плода каждой беременной мыши в группе E. coli на E18.5 следующая: шесть живых и два мертвых плода, семь живых и один мертвый плод, семь живых и один мертвый плод, три живых и 0 мертвых плодов, семь живых и 0 мертвых плодов, семь живых и два мертвых плода.Ни в одной из групп на E8.5 не было абортов, но они произошли с E11.5. Средняя частота выкидышей в контрольной группе составила 4,23% на Е11.5 и 2,38% на Е18.5 одновременно, 10,25% на Е11.5 и 12,04% на Е18.5 в группе E. coli . Хотя не было статистически значимой разницы в частоте выкидышей, явления аборта можно было наблюдать невооруженным глазом в группе E. coli . Более того, средний вес плодов (рис. 2С) на E18,5 в контрольной группе (1.15 ± 0,06 г) было выше, чем в группе E. coli (0,97 ± 0,09 г, P < 0,0001). Напротив, вес плаценты (рис. 2D) был ниже в контрольной группе (0,13 ± 0,02 г), чем в группе E. coli (0,14 ± 0,02 г, P = 0,018). Эти последствия предполагают, что вагинальная инфекция E. coli привела к неблагоприятным исходам беременности.
coli на E18.5 следующая: шесть живых и два мертвых плода, семь живых и один мертвый плод, семь живых и один мертвый плод, три живых и 0 мертвых плодов, семь живых и 0 мертвых плодов, семь живых и два мертвых плода.Ни в одной из групп на E8.5 не было абортов, но они произошли с E11.5. Средняя частота выкидышей в контрольной группе составила 4,23% на Е11.5 и 2,38% на Е18.5 одновременно, 10,25% на Е11.5 и 12,04% на Е18.5 в группе E. coli . Хотя не было статистически значимой разницы в частоте выкидышей, явления аборта можно было наблюдать невооруженным глазом в группе E. coli . Более того, средний вес плодов (рис. 2С) на E18,5 в контрольной группе (1.15 ± 0,06 г) было выше, чем в группе E. coli (0,97 ± 0,09 г, P < 0,0001). Напротив, вес плаценты (рис. 2D) был ниже в контрольной группе (0,13 ± 0,02 г), чем в группе E. coli (0,14 ± 0,02 г, P = 0,018). Эти последствия предполагают, что вагинальная инфекция E. coli привела к неблагоприятным исходам беременности.
Рисунок 2. Характеристики матери и плода у мышей в исследовании ( E.coli ) и контрольная группа. (A) Увеличение веса беременных мышей в исследуемой группе и контрольной группе на E0.5, E4.5, E8.5, E11.5 и E18.5. Количество мышей, использованное для расчета прибавки веса беременных мышей в контрольной группе на E4.5, E8.5, E11.5 и E18.5, составляло 17, 17, 11 и 6 соответственно. Количество мышей, использованных для расчета прибавки массы тела беременных мышей в исследуемой группе на E4.5, E8.5, E11.5 и E18.5, составляло 18, 18, 12 и 6 соответственно. (B) Частота выкидышей в основной и контрольной группах на E8.5, Е11.5 и Е18.5. Количество мышей, используемых для расчета частоты выкидышей в контрольной группе на E8.5, E11.5 и E18.5, составляет 6, 5 и 6 соответственно. Количество мышей, используемых для расчета частоты выкидышей в исследуемой группе на E8.5, E11.5 и E18.5, составляет 6, 6 и 6 соответственно. (C) Масса плода в основной и контрольной группах при кесаревом сечении ( n = 12). (D) Масса плаценты в основной и контрольной группах при кесаревом сечении ( n = 12).Данные представлены как среднее ± стандартное отклонение. Непарный t -критерий использовали для двухгрупповых сравнений прибавки массы тела, массы плода и массы плаценты. Критерий Манна-Уитни U использовали для двухгруппового сравнения частоты невынашивания беременности. * P < 0,05, **** P < 0,0001.
Вопрос о том, восходят ли вагинальные инфекции к плаценте, остается спорным. Поэтому мы использовали гель-электрофорез для изучения этого спорного вопроса (дополнительная фигура 3).Для исключения непредвиденных обстоятельств были сконструированы три пары праймеров, которые противопоставлялись бактериальной 16S рРНК. При этом для каждой пары праймеров использовали по четыре образца геномной ДНК, выделенной из плацент обеих групп. Ампликоны бактериальных последовательностей гена 16S рРНК не были обнаружены с помощью гель-электрофореза, что свидетельствовало об отсутствии бактерий в плаценте.
Пути механизма скрининга и предварительной проверки вагинальной инфекции
E. coli у мышейПосле гель-электрофореза мы определили, что восходящие инфекции отсутствуют.Затем был разработан PCR Array для дальнейшего изучения механизма неблагоприятных исходов беременности. Для неблагоприятных исходов беременности, которые произошли на E11.5 (что представляет позднюю стадию развития конечностей), мы выбрали ткань на E11.5 для последующего изучения механизма действия. Для сравнения каждого гена в массиве ПЦР между исследуемой и контрольной группой использовали точечную диаграмму (рис. 3А) и кластерограмму (рис. 3В), а также тепловую карту (рис. 3С), помогающую визуализировать.Наконец, пять генов со значительной активацией и 15 генов с пониженной экспрессией были подвергнуты скринингу, и подробные данные о значительно экспрессированных генах, определенных как экспрессия гена, экспрессия которой была увеличена или снижена более чем в 2 раза, представлены в дополнительной таблице 2.
Рисунок 3. Изменения экспрессии генов в исследуемой группе ( E. coli ) по сравнению с таковой в контрольной группе по данным ПЦР-массива. (A) Диаграмма рассеяния результатов экспрессии каждого гена. Центральная диагональная линия указывает на неизменную экспрессию гена, а внешние диагональные линии указывают на выбранный порог регуляции фолда.Красные точки обозначают гены с повышенной экспрессией, а синие точки — гены с пониженной экспрессией. Черные точки обозначают гены с неизмененной экспрессией. (B) Кластерограмма генов со значительно повышенной или пониженной экспрессией. Каждый столбец представляет группу, а каждая строка представляет ген. Различные цвета отображают величину экспрессии гена, а степень экспрессии гена от минимума до максимума отображается от зеленого до красного. (C) Тепловая карта результатов экспрессии каждого гена.Разные цвета показывают разные уровни экспрессии генов. Цвета от синего до желтого означают пониженную или усиленную экспрессию генов.
Между тем, из отчетов PCR Array, в сочетании с общими и подробными литературными консультациями, интерлейкин (IL)-4 и IL-13 были выбраны для дальнейшего исследования. Затем мы использовали RT-qPCR для первичной проверки IL-4 и IL-13 (рис. 4А). Судя по результатам, экспрессия мРНК IL-4 в группе E. coli по сравнению с контрольной группой значительно снизилась до 18.5%, однако экспрессия мРНК IL-13 не показала существенной разницы между двумя группами.
Рисунок 4. Валидация результатов скрининга дифференциально экспрессируемых генов. (A) Проверка проверенных дифференциально экспрессируемых генов с помощью ПЦР. Использовали по четыре образца каждой группы. Опыт проводили в трехкратной повторности и повторяли два раза. (B) Концентрация экспрессии IL-4 в крови мышей в исследуемой группе ( E. coli ) на E8.5, E11.5 и E18.5 ( n = 6). Данные представлены как среднее ± стандартное отклонение. Для двухгрупповых сравнений использовали непарный t -критерий. ∗ P < 0,05, ∗∗ P < 0,01.
Для дальнейшего подтверждения экспрессии IL-4 мы провели ELISA с использованием плазмы мыши. Данные ИФА (рис. 4Б) показали, что не было существенной разницы в концентрации ИЛ-4 в плазме на Е8.5, но у мышей в исследуемой группе было обнаружено значительно сниженную концентрацию ИЛ-4 в плазме по сравнению с таковой в группе мышей. мышей контрольной группы на Е11.5 (61,13 ± 14,61 и 85,79 ± 8,17 соответственно) и E18,5 (80,41 ± 10,74 и 97,46 ± 13,86 соответственно). Кроме того, уровень ИЛ-4 значительно увеличился на Е18,5 по сравнению с таковым на Е11,5 в исследуемой группе.
Экспрессия пути IL-4/JAK-1/STAT-6 у мышей, инфицированных
E. coliПосле первичной проверки результатов PCR Array предполагалось, что IL-4 играет ключевую роль во вагинальной инфекции, вызванной E. coli . Для поиска потенциальных механизмов, которые должны отвечать за это явление, была проведена RT-qPCR в реальном времени.Хемокиновый (cc-мотив) лиганд (CCL)-17, CCL-22, CCL-24, IL-4, янус-киназа (JAK)-1, преобразователь сигнала и активатор транскрипции-(STAT)-6 и GATA-3 мРНК экспрессия всех продемонстрировала значительное снижение экспрессии в тканях плаценты в исследуемой группе по сравнению с контрольной группой на E11,5 (рис. 5A), а кратность изменения в группе E. coli снизилась до 22,4, 12,2, 39,1, 57,2, 54,9, 56,2 и 22,4% соответственно. На E11.5 в тканях матки тенденции значимой экспрессии генов соответствовали тенденциям в плаценте (рис. 5B), а кратность изменения в исследуемой группе уменьшилась до 35.9, 42,3, 42,8, 59,3, 45,8, 71,6 и 68,5% соответственно.
Рисунок 5. Экспрессия пути IL-4/JAK-1/STAT-6 у мышей с аэробным вагинитом, вызванным инфекцией E. coli . (A) Относительная экспрессия пути IL-4/JAK-1/STAT-6 в плаценте мышей, инфицированных E. coli на E11.5. (B) Относительная экспрессия пути IL-4/JAK-1/STAT-6 в матке мышей, инфицированных E. coli на E11.5. Использовали по четыре образца каждой группы.Эксперимент проводили в трех лунках и повторяли трижды. Данные представлены как среднее ± стандартное отклонение. Для двухгрупповых сравнений использовали непарный t -критерий. ∗ P < 0,05, ∗∗ P < 0,01, ∗∗∗ P < 0,001.
Децидуальные макрофаги преобразовали больше в макрофаги M1 у мышей, инфицированных
E. coli , и эта трансформация может быть обращена вспять добавлением IL-4ИЛ-4 играет защитную роль, связанную с улучшением сосудистой функции и снижением воспалительных факторов при успешной беременности (Chatterjee et al., 2014; Коттрелл и др., 2019). В последнее время ИЛ-4 постепенно связывают с СД, которые являются вторым по величине типом лейкоцитарной популяции на границе матери и плода, а также основными подтипами антигенпрезентирующих клеток во время беременности (Erlebacher, 2013; Tang et al., 2015).
Для дальнейшего изучения роли IL-4 во время беременности у мышей с вагинальной инфекцией мы выделили DM из материнско-плодового контакта и добавили IL-4 к изолированным DM группы E. coli .Мы рассчитали соотношение макрофагов M1 и M2: среднее соотношение в контрольной группе и группе E. coli составило 1,071 ± 0,018 и 1,328 ± 0,099 соответственно (рис. 6А). Эти результаты показали, что больше макрофагов M1 было обнаружено в группе E. coli . После добавления IL-4 в чашку Петри группы E. coli все извлеченные клетки показали снижение количества макрофагов M1 и увеличение количества макрофагов M2 (фиг. 6B). Другими словами, макрофаги М1 постепенно превращались в макрофаги М2 после обработки ИЛ-4.
Рисунок 6. Первичные децидуальные макрофаги, выделенные из области контакта мать-плод у мышей. (A) Соотношение макрофагов M1 и M2, выделенных из материнско-плодового контакта между исследуемой группой ( E. coli ) и контрольной группой ( n = 6). (B) Соотношение макрофагов M1 и M2 до и после добавления IL-4 к макрофагам, выделенным из материнско-плодового интерфейса в исследуемой группе ( n = 6). (C) Относительная экспрессия пути IL-4/JAK-1/STAT-6 в первичных децидуальных макрофагах, выделенных из материнско-плодового интерфейса на E11.5. Использовали по четыре образца каждой группы. Опыт проводили в трех лунках и повторяли два раза. Данные представлены как среднее ± стандартное отклонение. Для двухгрупповых сравнений использовали непарный t -критерий. ∗ P < 0,05, ∗∗ P < 0,01, ∗∗∗ P < 0,001.
Затем мы провели экстракцию РНК из изолированных первичных DM, чтобы исследовать изменение экспрессии мРНК после введения IL-4.По сравнению с группой E. coli , на которую не воздействовали IL-4, экспрессия мРНК CCL-17, CCL-22, CCL-24, IL-4, JAK-1, STAT-6 и GATA-3 в группа лечения увеличилась до 278, 247, 227, 268, 160, 167 и 281% соответственно (рис. 6С).
Обсуждение
Инфекции, всегда являющиеся источником беспокойства, возникающие во время беременности, повышают риск задержки внутриутробного развития плода, преждевременных родов, хориоамнионита и даже выкидыша или мертворождения (Giakoumelou et al., 2016; Расико и Мор, 2017 г.; Ворнхаген и др., 2017). Беременные женщины более восприимчивы к инфекциям, чем небеременные женщины (Sacerdoti et al., 2018; Vojtek et al., 2018). Кроме того, неблагоприятные последствия инфекции могут усугубляться беременностью. Среди этих инфекций выделяется вагинальная инфекция, поскольку влагалище действует как полость для родов, и могут возникать восходящие инфекции. С тех пор, как Дондерс и его коллеги в 2002 году выдвинули новое состояние, названное АВ, АВ вошла в общественное сознание и постепенно стала тщательно изучаться (Donders et al., 2002). В некоторых исследованиях E. coli указан как общий патоген для большого количества различных патогенных бактерий (Tempera et al., 2004, 2006). Предыдущее исследование показало, что инфекция E. coli может привести к неблагоприятным осложнениям для матери и плода, включая задержку внутриутробного развития, неонатальный гемолитико-уремический синдром, самопроизвольный аборт и даже гибель плода (Sacerdoti et al., 2018). Burdet и его коллеги сообщили, что выработка простагландинов в матке может регулировать активность миометрия во время беременности и родов (Burdet et al., 2010).
Мы разработали мышиную модель вагинальной инфекции, индуцированной E. coli для обозначения АВ после беременности. Мы обнаружили, что вагинальная инфекция E. coli во время беременности может вызвать неблагоприятные исходы беременности, такие как потеря веса у матери и плода. Последующие механистические исследования показали, что макрофаги, расположенные на границе раздела матери и плода, могут оказывать решающее влияние и в дальнейшем влиять на исходы беременности через сигнальный путь IL-4/JAK-1/STAT-6 у беременных мышей, прививаемых вагинально E.coli (рис. 1А и рис. 7).
Рис. 7. Реакции на границе раздела мать-плод во время беременности у мышей. Во время нормальной беременности DM больше поляризуются к макрофагам типа M2, после чего рекрутируются некоторые хемокины. Затем повышается экспрессия генов нижестоящих IL-4, JAK-1, STAT-6 и GATA-3, и беременность приближается к нормальной. Когда мышей вагинально заражают E. coli , DM больше трансформируются в макрофаги M1, что приводит к неблагоприятным исходам беременности.
IL-4 является каноническим цитокином Th3 и в основном происходит из клеток Th3 (Maier et al., 2012). Сообщаемые эффекты IL-4 включают стимулирование созревания дендритных клеток, усиление иммунного ответа против кокцидий и усиление реакции окислительного взрыва (Wang and Secombes, 2015). ИЛ-4 можно тестировать на всех стадиях беременности на границе между матерью и плодом, и он играет защитную роль, которая включает улучшение сосудистой функции, уменьшение воспалительных агентов и является мощной функцией при успешной беременности (Chatterjee et al., 2014; Коттрелл и др., 2019). Следовательно, продукция ИЛ-4 повышается в течение всего периода беременности. Соответственно, наши данные показали снижение экспрессии IL-4 у беременных мышей, инфицированных штаммом E. coli , по сравнению с контрольной группой. Для дальнейшего обсуждения основных применений ИЛ-4 мы добавили умеренные количества ИЛ-4 к DM, полученным из интерфейса матери и плода мыши, и задокументировали постепенное преобразование макрофагов M1 в макрофаги M2 после добавления IL-4 с последующим повышенная экспрессия нижележащих генов.Таким образом, ИЛ-4 может быть кандидатом для лечения вагинальных инфекций, вызванных E. coli во время беременности. Конечно, терапевтического направления в клеточных экспериментах далеко не достаточно, но это все же дает нам уверенность в изучении методов управления. Следующее разумное животное для изучения, а также крупные клинические исследования должны быть разработаны и проведены в ближайшем будущем. Кроме того, на беременность, сложный процесс, влияют различные факторы (Bonney, 2001).Менон и его коллеги считают, что активация митоген-активируемой протеинкиназы p38 (MAPK) при преждевременных родах является ключевым фактором неблагоприятной беременности (Menon and Papaconstantinou, 2016). Лионг и его коллеги объясняют, что подавление гиперэкспрессии гомолога вирусного онкогена крысиной саркомы Кирстена 2 (K-Ras) в плаценте помогает предотвратить неблагоприятные исходы для плода (Liong et al., 2018). Чжоу и его коллеги сообщают, что фосфорилированная протеинкиназа B (p-AKT) обладает противовоспалительным свойством и что усиление экспрессии p-AKT может улучшить неблагоприятные исходы беременности (Zhou et al., 2017). Все эти статьи раскрывают сложность течения беременности и показывают, что ведение неблагоприятных исходов беременности следует рассматривать всесторонне с разных точек зрения.
Децидуальные макрофаги составляют 20% от общего числа лейкоцитов, являются второй по величине популяцией лейкоцитов и представляют собой видную подгруппу антигенпрезентирующих клеток во время беременности (Erlebacher, 2013; Tang et al., 2015). При нормальной беременности СД демонстрируют М2-подобный фенотип, который играет противовоспалительную роль (Sica and Mantovani, 2012; Erlebacher, 2013; Ander et al., 2019). Тем не менее, накапливаются исследования, рассматривающие процесс беременности как воспалительную реакцию (Romero et al., 2007). В этом текущем исследовании мы выделили DM из материнско-плодового интерфейса беременных мышей, идентифицировали и классифицировали их с помощью проточной цитометрии. Более поляризованный фенотип М1 наблюдался в группе E. coli по сравнению с контрольной группой. Это наблюдение указывает на то, что большее количество макрофагов дифференцируется в подтип М1 у беременных мышей, страдающих вагинальной инфекцией, вызванной E.coli , и данные, которые соответствуют предыдущим исследованиям, в которых сообщалось об инфекциях во время беременности (Li et al., 2017; Zhang et al., 2019). Однако повышенное количество макрофагов фенотипа M1, которые индуцируются различными патогенными факторами, такими как фактор некроза опухоли, интерферон-γ и патогенная инфекция (Jena et al., 2019), было связано с некоторыми аномальными осложнениями беременности (Zhang et al. др., 2019). Результаты ПЦР тканей матки и тканей плаценты показали небольшое количество макрофагов фенотипа М2 во влагалищных путях мышей в исследуемой группе по сравнению с таковыми в контрольной группе, за которыми следовали соответствующие хемокины, охватывающие CCL-17, CCL-22 и CCL-24. что были сокращены.После этого нижележащая экспрессия генов IL-4, JAK-1, STAT-6 и GATA-3 значительно снизилась на разных уровнях.
Другими сигнальными молекулами, заслуживающими внимания в этой работе, являются STAT-6 и GATA-3, и их потенциальные эффекты были изложены. IL-4 связывается со своим рецептором (IL-4Rα), и, таким образом, экспрессия JAK-1 увеличивается, за чем следует активация экспрессии p-STAT6. Затем p-STAT6 активирует экспрессию GATA-3, и IL-4 снова активируется (Yue et al., 2018). STAT-6 важен для формирования и поддержания толерантности матери к плоду, а также усиления иммунного ответа (Zhao et al., 2009; Мэн и др., 2017). GATA-3 играет решающую роль в развитии и дифференцировке нервной системы и Т-клеточных лимфоцитов, регулировке плацентарной функции и синтезе плацентарных гормонов (Mirkovic et al., 2015). Снижение экспрессии STAT-6 и GATA-3, вызванное снижением экспрессии IL-4, может быть причиной неблагоприятных исходов для матери и плода. В этом исследовании мы обнаружили, что экспрессия STAT-6 и GATA-3 в матке и плаценте была снижена у штамма E.группа coli . В связи с более низким уровнем экспрессии IL-4 мы посчитали, что эти несбалансированные молекулы могут привести к последующим неблагоприятным исходам беременности в нашей модели на животных. Конечно, в будущем необходимо разработать больше сигнальных путей.
Различные периоды беременности выполняют разные функции. У мышей наличие вагинальной пробки свидетельствует об образовании оплодотворенной яйцеклетки и обычно устанавливается как E0,5. E4.5 представляет собой начало эмбрионального развития на стадии поздней бластоцисты, а также инициацию имплантации бластоцисты, тогда как E8.5 представляет начало органогенеза и развития внеклеточной и амниотической полостей (Yockey et al., 2016). Более того, E11.5 отражает позднюю стадию развития конечностей, тогда как E18.5 обозначает рождение плода. Мы выбрали вагинальную инфекцию E. coli на E4.5 для исследования и обнаружили, что неблагоприятные исходы беременности (например, выкидыш) появляются с E11.5. Дальнейшее исследование показало изменения на границе между матерью и плодом и что неблагоприятные исходы беременности могут быть вызваны этими изменениями, которые должны были стать мишенью с целью улучшения исходов беременности.
Плацента участвует в транспортировке питательных веществ и газов к плоду и удалении продуктов жизнедеятельности плода (Maltepe and Fisher, 2015; Sacerdoti et al., 2018). Принято считать, что плацента является стерильной средой, о чем свидетельствует серия экспериментов даже при аномальной беременности (Leiby et al., 2018; Segata, 2019; Theis et al., 2019; Kuperman et al., 2020). Однако некоторые исследования показали, что в плаценте присутствуют несколько типов бактерий (Aagaard et al., 2014; Дойл и др., 2014). Это разногласие вызвало у нас интерес, и мы обсудили противоречие в нашем исследовании. Были сконструированы три пары специфических праймеров для бактерий и проведен электрофорез в агарозном геле. Результаты показали, что в плаценте не было обнаружено никаких бактерий, и даже вагинальные инфекции оставались тяжелыми. Это показало, что обнаруженные нами неблагоприятные исходы беременности могли не быть прямым результатом восходящих инфекций. Более того, беременные мыши, возможно, смогли защитить свой плод от травм, активировав некоторые пути, которые еще не были обнаружены.В новаторской литературе этот вопрос изучался — Ворнхаген и его коллеги предположили, что воспаление матки, вызванное вагинальными инфекциями, может устранить восходящие бактерии, чтобы не вызывать преждевременных родов (Vornhagen et al., 2016). Эта точка зрения не соответствовала традиционным представлениям, но совпадала с нашей идеей о том, что мать так или иначе защищает свой плод. В другой статье обобщены несколько механизмов, с помощью которых плацента может предотвращать инфекции при контакте с патогенами: отчетливый защитный слой, секреция антитоксических молекул, транспорт защитных антител и барьер врожденного иммунитета (Ander et al., 2019). Конечно, еще предстоит изучить более подробные защитные механизмы. Что касается плаценты, мы обнаружили, что масса плаценты на E18.5 была значительно ниже в контрольной группе, чем в группе E. coli . Масса плаценты связана с сердечно-сосудистыми заболеваниями, диабетом, инсультом и даже продолжительностью жизни у взрослых (De Paepe et al., 2015). Обычно, чем выше масса плаценты или соотношение массы плаценты и плода, тем выше риск заболевания. Точно так же наши результаты подтверждают эту точку зрения.Мы предполагаем, что беременные мыши могут бороться с воспалением, используя различные реакции на стресс. После инфицирования и легкого набухания в плаценте могут иметь место другие типы реакций увеличения веса, невидимые глазу.
Хотя в настоящем исследовании мы получили значимые данные, ограничения были неизбежны. Во-первых, мы использовали беременных мышей, инфицированных E. coli , для наших экспериментов. Тем не менее, патогены различаются, индуцированная инфекция различается, и результаты могут меняться.Таким образом, наши результаты, возможно, демонстрируют только эффекты вагинальной инфекции, вызванной E. coli посредством вагинальной инъекции у матери и плода мыши, но могут не подходить для других типов инфекций или патогенов. Тем не менее, наша работа предлагает возможный метод исследования механизма некоторых заболеваний, особенно инфекций во время беременности. Наши методы исследования бактерий, относящиеся к E. coli , также показывают способ обнаружения воздействия различных патогенов на хозяина.Во-вторых, мы заразили мышей только один раз во время беременности. Рецидивирующие инфекции распространены в клинической работе, но в этом исследовании не было возможности провести глубокое исследование. Таким образом, необходимо провести сопоставимое исследование, включая частоту инфицирования, время инфицирования, методы диагностики и другие подробные вопросы о рецидивирующих инфекциях.
Заключение
В заключение мы создали модель беременных мышей с AV, инфицированных E. coli , и обнаружили, что вагинальная инфекция, вызванная E.coli во время беременности у мышей может привести к: (i) снижению веса матери и плода и неблагоприятным исходам беременности; (ii) снижение экспрессии хемокинов, таких как CCL-17, CCL-22 и CCL-24, путем трансформации макрофагов M1 в макрофаги M2; и (iii) значительное снижение экспрессии сигнального пути IL-4/JAK-1/STAT-6 и нижележащего гена GATA-3. Более того, в этом испытании плацента оказалась стерильной. Наше исследование предлагает потенциальный механизм для будущих исследований ведения аортального клапана во время беременности.Необходимо провести более подробные исследования, чтобы способствовать развитию лечения вагинальной инфекции.
Заявление о доступности данных
Оригинальные материалы, представленные в исследовании, включены в статью/дополнительный материал, дальнейшие запросы можно направлять соответствующим авторам.
Заявление об этике
Исследование на животных было рассмотрено и одобрено Советом по этике исследований на животных Нанкинского медицинского университета.
Вклад авторов
CF, CR и YD проводили испытания на животных.CF, CR, LZ и YF завершили статистический анализ. CF, LZ, XW и TL написали рукопись. ZD и WH вместе помогли завершить эксперименты. PL, QL и XZ задумали и разработали исследование, а также предложили финансовую поддержку. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Эта работа была поддержана Национальным фондом естественных наук Китая (№№ 81671410, 81871474, 82071602 и 82073392), Проектом шести талантов в провинции Цзянсу (WSY-119 и WSW-120), Нанкинским центром развития медицинской науки и техники. Фонд (QRX17072) и Фонд науки и технологий Нанкинского медицинского университета (NMUB2018070).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmicb.2021.651426/full#supplementary-material
.Сноски
Каталожные номера
Аагард, К., Ма, Дж., Энтони, К.М., Гану, Р., Петросино, Дж., и Версалович, Дж. (2014). Плацента содержит уникальный микробиом. науч. Перевод Мед. 6:237ra265. doi: 10.1126/scitranslmed.3008599
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бейли, Х., Заш, Р., Раси, В., и Торн, К. (2018). Лечение ВИЧ во время беременности. Ланцет ВИЧ 5, e457–e467. doi: 10.1016/s2352-3018(18)30059-6
Полнотекстовая перекрестная ссылка | Академия Google
Бурдет, Дж., Zotta, E., Cella, M., Franchi, A.M., и Ibarra, C. (2010). Роль оксида азота в индуцированных шига-токсином-2 преждевременных родах мертвых плодов у крыс. PLoS One 5:e15127. doi: 10.1371/journal.pone.0015127
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чаттерджи, П., Чиассон, В.Л., Баундс, К.Р., и Митчелл, Б.М. (2014). Регуляция противовоспалительных цитокинов интерлейкина-4 и интерлейкина-10 во время беременности. Фронт. Иммунол. 5:253.doi: 10.3389/fimmu.2014.00253
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Cottrell, J.N., Amaral, L.M., Harmon, A., Cornelius, D.C., Cunningham, M.W. Jr., Vaka, V.R., et al. (2019). Добавка интерлейкина-4 улучшает патофизиологию гипертонии в ответ на плацентарную ишемию у крыс RUPP. утра. Дж. Физиол. Регул. интегр. Комп. Физиол. 316, Р165–Р171. doi: 10.1152/ajpregu.00167.2018
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Де Паэпе, М.Э., Шапиро С., Янг Л. Э. и Люкс Ф. И. (2015). Масса плаценты, масса тела при рождении и соотношение массы плода и плаценты при дихориальной и монохориальной двойне в зависимости от гестационного возраста, типа прикрепления пуповины и плацентарной перегородки. Плацента 36, 213–220. doi: 10.1016/j.placenta.2014.11.009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дондерс Г.Г., Верекен А., Босманс Э., Декеерсмакер А., Салембир Г. и Шпиц Б. (2002).Определение типа патологической вагинальной флоры, отличной от бактериального вагиноза: аэробный вагинит. БЙОГ 109, 34–43. doi: 10.1111/j.1471-0528.2002.00432.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дондерс Г.Г.Г., Беллен Г., Гринцевичене С., Рубан К. и Виейра-Баптиста П. (2017). Аэробный вагинит: больше не чужой. Рез. микробиол. 168, 845–858. doi: 10.1016/j.resmic.2017.04.004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дёртбудак, О., Эберхардт, Р., Ульм, М., и Перссон, Г.Р. (2005). Пародонтит, маркер риска преждевременных родов при беременности. Дж. Клин. Пародонтол. 32, 45–52. doi: 10.1111/j.1600-051X.2004.00630.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дойл Р.М., Альбер Д.Г., Джонс Х.Е., Харрис К., Фитцджеральд Ф., Пиблз Д. и др. (2014). Срочные и преждевременные роды связаны с различными структурами микробного сообщества в плацентарных оболочках, которые не зависят от способа родоразрешения. Плацента 35, 1099–1101. doi: 10.1016/j.placenta.2014.10.007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Fettweis, J.M., Serrano, M.G., Brooks, J.P., Edwards, D.J., Girerd, P.H., Parikh, H.I., et al. (2019). Вагинальный микробиом и преждевременные роды. Нац. Мед. 25, 1012–1021. doi: 10.1038/s41591-019-0450-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Джакумелу, С., Уилхаус, Н., Кушьери, К., Энтрикан, Г., Хоуи, С.Э., и Хорн, А.В. (2016). Роль инфекции в невынашивании беременности. Гул. Воспр. Обновление 22, 116–133. дои: 10.1093/humupd/dmv041
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гомес-Лопес Н., Мотомура К., Миллер Д., Гарсия-Флорес В., Галаз Дж. и Ромеро Р. (2019). Инфламмасомы: их роль при нормальной и осложненной беременности. Дж. Иммунол. 203, 2757–2769. doi: 10.4049/jimmunol.11
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Халперн, Д.Г., Вайнберг, Ч.Р., Пиннелас, Р., Мехта-Ли, С., Экономика, К.Е., и Валенте, А.М. (2019). Использование лекарств от сердечно-сосудистых заболеваний во время беременности: современный обзор JACC. Дж. Ам. Сб. Кардиол. 73, 457–476. doi: 10.1016/j.jacc.2018.10.075
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хан, К., Ли, Х., Хань, Л., Ван, К., Ян, Ю., Ци, В., и др. (2019). Аэробный вагинит на поздних сроках беременности и исходы беременности. евро. Дж. Клин.микробиол. Заразить. Дис. 38, 233–239. doi: 10.1007/s10096-018-3416-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Йена, М.К., Наяк, Н., Чен, К., и Наяк, Н.Р. (2019). Роль макрофагов при беременности и связанных с ней осложнениях. Арх. Иммунол. тер. Эксп. 67, 295–309. doi: 10.1007/s00005-019-00552-7
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Цзян Л., Чжан Л., Жуй С., Лю С., Мао З., Ян Л., и другие. (2019). Роль оси miR1976/CD105/интегрин αvβ6 в вагините, вызванном инфекцией Escherichia coli у мышей. науч. Респ. 9:14456. doi: 10.1038/s41598-019-50902-w
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Куперман А.А., Циммерман А., Хамадия С., Зив О., Гуревич В., Фихтман Б. и соавт. (2020). Глубокий микробный анализ нескольких плацент не показывает признаков плацентарного микробиома. БЙОГ 127, 159–169.дои: 10.1111/1471-0528.15896
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лейби, Дж. С., Маккормик, К., Шерил-Микс, С., Кларк, Э. Л., Кесслер, Л. Р., Тейлор, Л. Дж., и соавт. (2018). Отсутствие обнаружения микробиома плаценты человека в образцах от преждевременных и срочных родов. Микробиом 6:196. doi: 10.1186/s40168-018-0575-4
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ли, З., Чжао, М., Ли, Т., Чжэн, Дж., Лю, X., Jiang, Y., et al. (2017). Функциональная поляризация децидуальных макрофагов во время аномальной беременности, вызванной токсоплазмой гондии: роль LILRB4. Фронт. Иммунол. 8:1013. doi: 10.3389/fimmu.2017.01013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Маркони, К., Дондерс, Г.Г., Беллен, Г., Браун, Д.Р., Парада, К.М., и Сильва, М.Г. (2013). Активность сиалидазы при аэробном вагините соответствует уровню при бактериальном вагинозе. евро. Дж. Обст.Гинекол. Воспр. биол. 167, 205–209. doi: 10.1016/j.ejogrb.2012.12.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Meng, Y.H., Zhou, W.J., Jin, L.P., Liu, L.B., Chang, K.K., Mei, J., et al. (2017). RANKL-опосредованный гармоничный диалог между плодом и матерью гарантирует гладкую беременность, индуцируя поляризацию децидуальных макрофагов M2. Сотовый. Смерть Дис. 8:e3105. doi: 10.1038/cddis.2017.505
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Менон, Р.и Папаконстантину, Дж. (2016). p38 Митоген-активируемая протеинкиназа (MAPK): новая терапевтическая мишень для снижения риска неблагоприятных исходов беременности. Экспертное заключение. тер. Цели 20, 1397–1412. дои: 10.1080/14728222.2016.1216980
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Миркович Дж., Элиас К., Драпкин Р., Барлетта Дж. А., Куэйд Б. и Хирш М. С. (2015). Экспрессия GATA3 в гестационных трофобластических тканях и опухолях. Гистопатология 67, 636–644.doi: 10.1111/his.12681
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ромеро Р., Готч Ф., Пинелес Б. и Кусанович Дж. П. (2007). Воспаление при беременности: его роль в репродуктивной физиологии, акушерских осложнениях и травмах плода. Нутр. Ред. 65, S194–S202. doi: 10.1111/j.1753-4887.2007.tb00362.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сачердоти, Ф., Скализ, М. Л., Бурдет, Дж., Амарал, М.М., Франки А.М. и Ибарра К. (2018). Шига-токсин-продуцирующие инфекции Escherichia coli во время беременности. Микроорганизмы 6:111. doi: 10.3390/микроорганизмы6040111
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тан, М. Х., Ху, X. Х., Лю, З. З., Квак-Ким, Дж., и Ляо, А. Х. (2015). Какова роль макрофагов и моноцитов при беременности человека? J. Репрод. Иммунол. 112, 73–80. doi: 10.1016/j.jri.2015.08.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Темпера, Г., Аббадесса Г., Бонфильо Г., Каммарата Э., Чианчи А., Корселло С. и др. (2006). Канамицин для местного применения: эффективный терапевтический вариант при аэробном вагините. Дж. Чемотер. 18, 409–414. doi: 10.1179/joc.2006.18.4.409
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Темпера Г., Бонфильо Г., Каммарата Э., Корселло С. и Чианчи А. (2004). Микробиологические/клинические характеристики и валидация местной терапии канамицином при аэробном вагините: экспериментальное исследование. Междунар. Дж. Антимикроб. Агенты 24, 85–88. doi: 10.1016/j.ijantimicag.2003.12.013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Theis, K.R., Romero, R., Winters, A.D., Greenberg, J.M., Gomez-Lopez, N., Alhousseini, A., et al. (2019). Есть ли микробиота в плаценте человека, родившейся в срок? результаты культивирования, количественная ПЦР в реальном времени, секвенирование гена 16S рРНК и метагеномика. утра. Дж. Обст. Гинекол. 220:267. doi: 10.1016/j.ajog.2018.10.018
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Войтек, И., Дьюссарт, И., Доэрти, Т.М., Франк, В., Ханссенс, Л., Миллер, Дж., и соавт. (2018). Иммунизация матерей: где мы сейчас и как двигаться дальше? Энн. Мед. 50, 193–208. дои: 10.1080/07853890.2017.1421320
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ворнхаген, Дж., Адамс Уолдорф, К.М., и Раджагопал, Л. (2017). Перинатальная группа В Стрептококковые инфекции : факторы вирулентности, иммунитет и стратегии профилактики. Тенденции микробиол. 25, 919–931. doi: 10.1016/j.tim.2017.05.013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Vornhagen, J., Quach, P., Boldenow, E., Merillat, S., Whidbey, C., Ngo, L.Y., et al. (2016). Бактериальная гиалуронидаза способствует восходящей инфекции GBS и преждевременным родам. mBio 7, e716–e781. doi: 10.1128/mBio.00781-16
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Йоки Л.Дж., Варела Л., Rakib, T., Khoury-Hanold, W., Fink, S.L., Stutz, B., et al. (2016). Вагинальное воздействие вируса Зика во время беременности приводит к инфекции головного мозга плода. сотовый 166, 1247–1256. doi: 10.1016/j.cell.2016.08.004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Юэ, Х., Ян, В., Цзи, X., Чжан, Ю., Ли, Г., и Сан, Н. (2018). Воздействие NO(2) на мать повышает чувствительность дыхательных путей к аллергенам у мышей BALB/c посредством пути JAK-STAT6. Хемосфера 200, 455–463.doi: 10.1016/j.chemosphere.2018.02.116
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Zhang, D., Ren, L., Zhao, M., Yang, C., Liu, X., Zhang, H., et al. (2019). Роль Tim-3 в функциональной поляризации децидуальных макрофагов при аномальной беременности с инфекцией токсоплазмой гондии. Фронт. Иммунол. 10:1550. doi: 10.3389/fimmu.2019.01550
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжао, Дж., Лэй, З., Лю, Ю., Ли, Б., Zhang, L., Fang, H., et al. (2009). Беременность человека активирует Tim-3 в клетках врожденного иммунитета для системного иммунитета. Дж. Иммунол. 182, 6618–6624. doi: 10.4049/jimmunol.0803876
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжоу Дж., Мяо Х., Ли Х., Ху Ю., Сунь Х. и Хоу Ю. (2017). Куркумин ингибирует воспаление плаценты, чтобы улучшить неблагоприятные исходы беременности, вызванные ЛПС, у мышей за счет усиления фосфорилированного Akt. Воспаление. Рез. 66, 177–185. doi: 10.1007/s00011-016-1004-4
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Практические основы, обзор, стрептококк группы B
Автор
Дарвин Скотт Смит, доктор медицины, магистр наук, DTM&H Адъюнкт-адъюнкт-профессор кафедры микробиологии и иммунологии Медицинской школы Стэнфордского университета; Заведующий отделением инфекционных болезней и географической медицины, отделение внутренней медицины, Kaiser Permanente Medical Group
Дарвин Скотт Смит, доктор медицины, магистр наук, DTM&H является членом следующих медицинских обществ: Американская медицинская ассоциация, Американское общество тропической медицины и гигиены, Инфекционное Американское общество болезней, Международное общество медицины путешествий
Раскрытие информации: Нечего раскрывать.
Соавтор (ы)
Маниш Басиста, MPH, MS, CIC, CWS, CASP, FACCWS, HACP Старший менеджер программы профилактики и контроля инфекций, больница Kaiser Foundation в Редвуд-Сити
Маниш Басиста, MPH, MS, CIC, CWS, CASP, FACCWS, HACP является членом следующих медицинских обществ: Академия общего образования, Американский колледж специалистов по клиническим ранам, Американский колледж эпидемиологии, Ассоциация профессионалов в области инфекционного контроля и эпидемиологии, Международная федерация инфекционного контроля, Общество эпидемиологии здравоохранения Америки
Раскрытие информации: Нечего раскрывать.
Редакционная коллегия специалистов
Франсиско Талавера, PharmD, PhD Адъюнкт-профессор Фармацевтического колледжа Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получал зарплату от Medscape за трудоустройство. для: Медскейп.
Карл В. Смит, доктор медицины Выдающийся Крис Дж. и Мари А. Олсон, кафедра акушерства и гинекологии, профессор кафедры акушерства и гинекологии, старший заместитель декана по клиническим вопросам Медицинского центра Университета Небраски
Карл В. Смит, доктор медицины член следующих медицинских обществ: Американский колледж акушеров и гинекологов, Американский институт ультразвука в медицине, Ассоциация профессоров гинекологии и акушерства, Центральная ассоциация акушеров и гинекологов, Общество материнско-фетальной медицины, Совет университетских кафедр акушерства и гинекологии, Медицинская ассоциация Небраски
Раскрытие информации: Нечего раскрывать.
Главный редактор
Карл В. Смит, доктор медицины Выдающийся Крис Дж. и Мари А. Олсон, кафедра акушерства и гинекологии, профессор кафедры акушерства и гинекологии, старший заместитель декана по клиническим вопросам Медицинского центра Университета Небраски
Карл В. Смит, доктор медицины член следующих медицинских обществ: Американский колледж акушеров и гинекологов, Американский институт ультразвука в медицине, Ассоциация профессоров гинекологии и акушерства, Центральная ассоциация акушеров и гинекологов, Общество материнско-фетальной медицины, Совет университетских кафедр акушерства и гинекологии, Медицинская ассоциация Небраски
Раскрытие информации: Нечего раскрывать.
Дополнительные участники
Стефани А. Невинс Научный сотрудник отдела генетики, лаборатория Снайдера, Медицинская школа Стэнфордского университета
Раскрытие информации: не требуется раскрытия информации.
Благодарности
Leonard B Berkowitz, MD Начальник отдела инфекционных заболеваний и ВИЧ/СПИДа Бруклинского больничного центра; Клинический доцент, медицинский факультет, Государственный университет Нью-Йорка в Бруклине
Леонард Б. Берковиц, доктор медицинских наук, является членом следующих медицинских обществ: Американского колледжа врачей, Американского общества микробиологии, Американского общества инфекционных заболеваний и Phi Beta Kappa
.Раскрытие: Нечего раскрывать.
Хайзал Хамза, MD Штатный врач, отделение внутренних болезней, клиника Fairview Ridges
Раскрытие: Нечего раскрывать.
Fauzia Khattak, MD Врач-резидент, отделение внутренних болезней, Brooklyn Hospital Center, Weill Cornell Medical College
Раскрытие: Нечего раскрывать.
Heather Comer Yun, MD Директор программы, стипендия по инфекционным заболеваниям, Консорциум санитарного просвещения силовых структур Сан-Антонио (SAUSHEC)
Хизер Комер Юн, доктор медицинских наук, является членом следующих медицинских обществ: Alpha Omega Alpha, Американского колледжа врачей, Американского общества внутренних болезней, Общества инфекционных заболеваний вооруженных сил и Американского общества инфекционных заболеваний
.Раскрытие: Нечего раскрывать.
Инфекции во время беременности
Фарм. 2013;38(9):HS12-HS16.
ВЫДЕРЖКА: Во время беременность. Общие инфекции включают заболевания, передающиеся половым путем. (сифилис, гонорея, хламидиоз, герпес), инфекции мочевыводящих путей, стрептококковая инфекция группы В, листериоз и токсоплазмоз. Число Схемы антимикробной терапии могут применяться во время беременности. Фармацевты играют ключевую роль в улучшении исходов для беременных женщин с любой из этих инфекций через рекомендации по противомикробным терапия, мониторинг побочных эффектов, профилактика взаимодействия и консультирование по вопросам приверженности.Консультационные пункты для беременных женщин включают соответствующие профилактические меры, такие как модификации образа жизни.
Инфекция, возникшая во время беременности, может нанести вред не только матери, но может также поражать ее плод (или новорожденного) или ее партнера. 1 В этой статье основное внимание уделяется отдельным инфекциям, которые могут возникнуть во время беременность, включая заболевания, передающиеся половым путем (ЗППП), мочевыводящих путей инфекции (ИМП), стрептококковая инфекция группы В (GBSD), листериоз, и токсоплазмоз.
ЗППП
Сифилис: Бактериальная инфекция, вызываемая Treponema pallidum , сифилис поражает около 2 миллионов беременных женщин во всем мире. 2 При отсутствии лечения во время беременности сифилис может вызвать самопроизвольный аборт. поздние мертворождения, низкая масса тела при рождении, неонатальная смерть или врожденные болезнь. 2
Поскольку раннее выявление инфекции необходимо для предотвращения вреда и осложнений, рекомендуется всем беременным рутинно проводят серологический тест на сифилис при первом пренатальный визит с повторным тестированием в третьем триместре и в роды для тех, кто остается в группе повышенного риска заражения. 1
Парентеральный пенициллин G (PCG) является единственным препаратом с задокументированным Эффективность против сифилиса во время беременности. Поэтому все беременные женщин с сифилисом следует лечить с помощью ПКГ в зависимости от стадии инфекции ( ТАБЛИЦА 1 ). Десенсибилизация рекомендуется пациентам с аллергией на пенициллин. 1 Реакция Яриша-Герксгеймера (лихорадка, озноб, миалгия, головная боль, артериальная гипотензия и тахикардия) встречается примерно у 45% беременных женщин, лечившихся от сифилиса. 3 Хотя эта реакция обычно начинается в течение нескольких часов после лечения и проходит через 24–36 часов. может вызвать сильные сокращения матки, преждевременные роды или дистресс во второй половине беременности. 2,3 Следовательно, беременным женщинам следует рекомендовать немедленно обратиться за медицинской помощью после лечения сифилиса, если лихорадка, схватки или снижение активности плода развивается движение. 1
Гонорея и хламидиоз: Гонорея, бактериальная инфекция, вызываемая Neisseria gonorrhoeae , ежегодно поражает около 13 000 беременных женщин. 4 Хламидиоз, вызываемый бактерией Chlamydia trachomatis , ежегодно вызывает инфекции примерно у 100 000 беременных женщин. 4 При отсутствии лечения во время беременности эти инфекции могут вызвать преждевременное роды, внутриутробная инфекция или врожденная инфекция в виде конъюнктивит, пневмония или диссеминированное заболевание. 4,5
Для предотвращения осложнений и неонатальной инфекции рекомендуется проводить рутинное обследование всех беременных женщин на C trachomatis и скрининг беременных на N gonorrhoeae . во время первого дородового визита с повторным тестированием во время третьего триместре — при хламидиозе у пациентов в возрасте 25 лет и младше, а также при хламидиоза и гонореи у тех, кто остается в группе повышенного риска инфекционное заболевание. 1
Поскольку пациенты, инфицированные N gonorrhoeae , часто коинфицируются C trachomatis , пациенты, получающие лечение от гонококковой инфекции, также должны получать препарат, обладающий активностью против хламидий. 1 Рекомендуемая схема лечения беременных с неосложненным гонорея — однократная доза цефтриаксона 250 мг внутримышечно (в/м) или цефиксим 400 мг перорально в комбинации с азитромицином 1 г перорально однократно (рекомендуемое лечение хламидиоза во время беременность).Все пациенты должны быть обследованы на эрадикацию хламидий 3 недель после завершения лечения. 1,5
Генитальный герпес: Генитальный герпес, вирусный Инфекция, вызванная вирусом простого герпеса типов 1 и 2, поражает более более 800 000 беременных женщин ежегодно в Соединенных Штатах. 6,7 Более чем в 90% случаев неонатального герпеса (поражающего кожу, глаз, рта или центральной нервной системы или вызывает диссеминированную инфекцию), младенец заражается во время вагинальных родов, когда контакт с инфицированными выделениями в половых путях матери.Следовательно, для предотвращения неонатальной инфекции рекомендуется кесарево сечение (CD). для женщин с активными поражениями половых органов или продромальными симптомами подозрение на генитальный герпес во время родов. 7 Кроме того, в третьем триместре у женщин без генитального герпеса следует воздерживаться от половых контактов с партнерами, о которых известно или подозревается генитальный герпес и воздержаться от восприимчивого орального секса с партнерами известный или подозреваемый на наличие оролабиального герпеса. 1
Безопасность ацикловира, валацикловира и фамцикловира при герпесе лечения во время беременности не установлено, и ни один из этих средства разрешены к применению во время беременности. 1,8 Нет повышенный риск серьезных врожденных дефектов при применении ацикловира во время беременность и прием ацикловира между 36-й неделей беременности и родоразрешение снижает частоту рецидивов заболевания и потребность в КОМПАКТ ДИСК. 1,8,9 Таким образом, рекомендации CDC по лечению ЗППП рекомендуют использовать ацикловир вместо других противовирусных препаратов во время беременности. 1 В ТАБЛИЦЕ 2 перечислены общие схемы перорального дозирования ацикловира. Ацикловир внутривенно можно использовать при тяжелых инфекциях. 1
ИМП
ИМП — как бессимптомные, так и симптоматические — являются наиболее распространенными бактериальная инфекция во время беременности, встречающаяся примерно в 20% случаев пациенты. 10,11 Бессимптомная бактериурия (ББС) – наличие более 100 000 колониеобразующих единиц бактерий на мл мочи из двух последовательных посевов мочи при отсутствии ИМП симптомы. 12 Цистит обычно проявляется императивными позывами к мочеиспусканию и/или частота, дизурия или гематурия, тогда как пиелонефрит обычно включает системные симптомы, такие как лихорадка, реберно-позвоночный угол болезненность, боль в боку, тошнота и рвота в дополнение к циститу симптомы. 10,13
Из 2–10 % беременных женщин с БСБ у 15–45 % разовьется пиелонефрит, если его не лечить. 11 Это связано с тем, что во время беременности происходят многие физиологические изменения, которые в конечном итоге приводит к застою мочи в мочеточниках или мочевом пузыре, увеличивая риск заражения. 11 Важно предотвратить пиелонефрит во время беременности, так как он может вызвать у матери или перинатальные осложнения (например, преждевременные роды, низкий вес при рождении или гибель плода). 11,14,15 Следовательно, пациенты должны проходить скрининг на бактериурию с помощью посева мочи хотя бы один раз на ранних сроках беременности (обычно на 12-16 неделе беременности или при первом пренатальном посещении), с лечение антибиотиками в случае положительного результата. 12,14 Некоторые эксперты выступают за повторный скрининг мочи в каждом триместре, чтобы улучшить выявление БСБ. 10,13
Наиболее распространенной микробной этиологией ИМП при беременности является Escherichia coli . 10 Дополнительные патогены включают другие грамотрицательные палочки семейства Enterobacteriaceae и стрептококки группы B (GBS). 10,13 Количественный посев мочи является золотым стандартом диагностики ИМП. во время беременности, но если он недоступен, местные модели резистентности следует использовать для выбора антибиотика с активностью против E coli . 10,11 Обычно используемые противомикробные схемы для БСБ или цистита включают 3- к 7-дневному курсу нитрофурантоина и применению первого поколения цефалоспорины, такие как цефалексин. 10,11,12 Разовая доза можно также рассмотреть возможность применения фосфомицина, хотя опыт ограничен. при применении этого средства во время беременности. 12
Исторически пиелонефрит лечили госпитализация для внутривенного введения жидкостей и внутривенного введения антибиотиков (обычно с пенициллин или цефалоспорин, активный в отношении E coli ), с последующим 2-недельный курс пероральных антибиотиков. Аминогликозид можно использовать отдельно или в сочетании с ампициллином в тяжелых случаях; однако этот агент классифицируется как беременность категории C и может вызвать ототоксичность плода. Последние данные свидетельствуют о том, что беременные женщины с пиелонефритом, находятся на сроке беременности менее 24 недель, в остальном здоровы, не наличие рецидивирующих инфекций и отсутствие лихорадки, тошноты, рвоты или признаки сепсиса могут быть рассмотрены для амбулаторного лечения.Пациент соответствие этим критериям можно контролировать в течение периода наблюдения в отделение неотложной помощи, во время которого берутся лабораторные показатели и Вводят в/в гидратацию и в/м дозу цефтриаксона. Терпение должен пройти контрольный визит через 24 часа, и в это время вводят дозу цефтриаксона и оценивают клиническое состояние. Если клиническое состояние пациентки улучшилось, она может получать пероральные терапия. Обычно используется цефалексин по 500 мг четыре раза в день. на 10 дней.Для пациентов, у которых сохраняются симптомы, может быть назначено в/м введение цефтриаксона. ежедневно в течение максимум 5 дней. 11,15
После завершения любого курса антибиотиков для лечения пиелонефрит, необходимо провести посев мочи для подтверждения разрешение бактериурии. Ежемесячный посев мочи рекомендуется для целей наблюдения. 11 При рецидивирующем пиелонефрите встречается у 6-8% беременных женщин, антибиотикопрофилактика с нитрофурантоин 100 мг перорально в день или цефалексин 250-500 мг перорально ежедневно рекомендуется всем пациенткам в течение всего срока беременности через 4-6 недель после родов. 11,15
ГБСД
GBSD является основной инфекционной причиной неонатальной заболеваемости и смертности в США. Основной микробной этиологией GBSD является Streptococcus agalactiae , грамположительный микроорганизм, который бессимптомно колонизирует влагалище или прямую кишку. S агалактии встречается примерно у 10-30% беременных женщин. Ежегодно, ГБС вызывает около 1200 случаев инвазивных заболеваний (особенно сепсис и пневмония), как правило, в течение первых 24–48 часов после жизнь. 16
Первичным фактором риска СГБ у младенцев является интранатальный СГБ. колонизация у матери. Новорожденный заражается через воздействие GBS, который может попасть в амниотическую жидкость. ребенок может также подвергаться воздействию СГБ во время прохождения через родовые пути. 16
Для предотвращения GBSD у новорожденных рекомендуются две основные стратегии: плановое обследование женщин на поздних сроках беременности и использование антибиотиков во время родов. 17 Все пациентки в сроке беременности от 35 до 37 недель должны быть обследованы на колонизацию СГБ с помощью вагинального или ректального мазка. 16 Интранатальная антибиотикопрофилактика рекомендуется пациентам с положительный скрининговый тест и для тех, кто ранее рожал младенца с GBSD или бактериурией GBS во время текущей беременности. Это также рекомендуется пациентам с неизвестным статусом колонизации GBS, которые доставляют новорожденный в сроке гестации менее 37 недель, имеет температуру не ниже 100,4 ° F во время родов или разрыв плодных оболочек в течение 18 часов или более. В/в ПКГ в дозировке 5 млн ЕД однократно, затем 2.от 5 до 3 миллионов ед. каждые 4 ч до родов, рекомендуется терапия первой линии. IV ампициллин в дозировке 2 г однократно, затем по 1 г каждые 4 часа до доставки, считается приемлемой альтернативой ПКГ. Пациенты с нетяжелая аллергия на пенициллины в анамнезе может быть устранена с помощью цефазолин, в то время как те, у кого тяжелая реакция на пенициллины, могут лечение клиндамицином или ванкомицином в зависимости от возбудителя восприимчивость микроорганизмов. 16
Листериоз
Листериоз вызывается Listeria monocytogenes , грамположительной бактерией, которая обычно встречается в почве и воде. 18 Эта инфекция возникает в основном у пожилых людей или пациентов с ослабленным иммунитетом, новорожденных и беременных женщин. 18,19 Беременные женщины с листериозом могут протекать бессимптомно или иметь просто усталость или мышечные боли. Инфекция может передаться плоду через плаценту или при прохождении через родовые пути, потенциально вызывая выкидыш, мертворождение, преждевременные роды или неонатальный менингит. 18,20
Основным путем передачи листериоза является употребление внутрь продукты питания, зараженные бактерией.Все беременные должны быть рекомендуется есть только полностью приготовленное мясо, тщательно вымытые овощи, или пастеризованное молоко, а также избегать некоторых сыров (см. ТАБЛИЦА 3 для получения более подробной информации). 19,21
Токсоплазмоз
Токсоплазмоз вызывается паразитом Toxoplasma gondii . Хотя беременные женщины с этой инфекцией могут протекать бессимптомно, инфекция может передаваться плоду через плаценту, потенциально вызывая врожденное заболевание, ведущее к детской смерти или уродству, умственная отсталость, глухота или слепота (либо при рождении, либо позже в жизнь). 22,23
Беременная женщина может заразиться токсоплазмозом через воздействие пищевого происхождения, воздействие окружающей среды или передача через животных. 22,24 При пищевом отравлении основным путем заражения является употребление в пищу мяса, содержащего тканевые цисты паразита. Так как кисты немедленно погибают при 67°C, беременным женщинам следует рекомендовать избегать употребления недоваренного мяса или мяса, которое может быть заражено посуда или разделочные доски, которые были в контакте с сырым или зараженное мясо. 24 Ооцистные формы паразита могут быть присутствует в окружающей среде. Человек также может заразиться после случайное заглатывание почвы, загрязненной ооцистными формами паразит. Поэтому беременным женщинам следует надевать перчатки во время в саду, мыть руки после работы в саду и мыть фрукты, травы и овощи перед употреблением. 22,24
Кошки играют важную роль в передаче инфекции человеку. После того, как кошка съела грызуна или другое мелкое животное, зараженное токсоплазмоз, ооцистная форма паразита выделяется с фекалиями в течение до 3 недель после заражения. 22 Следовательно, беременная женщина можно заразиться токсоплазмозом, случайно прикоснувшись к ней рот после смены лотка. 23 Пациенты должны быть рекомендуется держать собственных кошек в помещении; кормить свою кошку коммерческим сухим или консервы, а не сырое или недоваренное мясо; избегать бездомных кошек; и избегать приобретения новой кошки во время беременности. По возможности пациент следует избегать смены кошачьего туалета; если это невозможно, она должна носить одноразовые перчатки во время работы и мыть руки с мылом и водой сразу после этого. 23,24 Так как паразит не становятся заразными в течение 1-5 дней после выделения с фекалиями кошки, ежедневная смена лотка предотвратит распространение инфекции. 23
Заключение
Инфекции распространены во время беременности. Фармацевты в ключе положение для улучшения исходов как для матери, так и для плода путем консультирование матери по соответствующим профилактическим мерам, рекомендации оптимальные схемы антимикробной терапии и мониторинг нежелательных явлений. последствия.Фармацевты должны активно работать с пациентами и здравоохранением поставщиков для обеспечения надлежащей профилактики и лечения инфекций во время беременности.
ССЫЛКИ 1. Ворковски К.А., Берман С. Руководство по лечению заболеваний, передающихся половым путем, 2010. MMWR Recomm Rep. 2010;59:1-110.
2. Де Сантис М., Де Лука С., Маппа И. и соавт. Заражение сифилисом во время беременности: риски для плода и клиническое ведение. Infect Dis Obstet Gynecol. 2012;2012:430585.
3. Осваль С., Лайонс Г. Сифилис у беременных. Contin Educ Anaesth Crit Care Pain . 2008;8:224-227.
4. Блатт А.Дж., Либерман Дж.М., Гувер Д.Р., Кауфман Х.В. Тестирование на хламидии и гонококки во время беременности в США. Am J Акушер-гинеколог. 2012;207:55.e1-e8.
5. Ruhl C. Новые данные о скрининге на хламидиоз и гонорею во время беременности. Нурс Женское здоровье. 2013;17:143-146.
6. ЦКЗ. ЗППП и беременность — информационный бюллетень CDC.
www.cdc.gov/std/pregnancy/STDs-and-pregnancy-fact-sheet-February2012.пдф.
По состоянию на 1 мая 2013 г.
7. Гарделла С., Браун З.А. Ведение инфекций генитального герпеса во время беременности. Cleve Clin J Med. 2007;74:217-224.
8. Straface G, Selmin A, Zanardo V, et al. Заражение вирусом простого герпеса при беременности. Infect Dis Obstet Gynecol. 2012;2012:385697.
9. Sheffield JS, Hollier LM, Hill JB, et al. Профилактика ацикловиром
предотвратить рецидив вируса простого герпеса при родах: систематический
обзор. Акушер-гинеколог. 2003;102:1396-1403.
10. Schnarr J, Smaill F. Бессимптомная бактериурия и симптоматические инфекции мочевыводящих путей при беременности. евро J Clin Invest. 2008;38(доп.2):50-57.
11. Torres M, Moayedi S. Гинекологические и другие инфекции при беременности. Emerg Med Clin North Am. 2012;30:869-884.
12. Lumbiganon P, Laopaiboon M, Thinkhamrop J. Скрининг и лечение бессимптомной бактериурии при беременности. Curr Opin Obstet Gynecol. 2010;22:95-99.
13. Ле Дж., Бриггс Г.Г., МакКаун А., Бустилло Г.Инфекции мочевыводящих путей во время беременности. Энн Фармакотер. 2004; 38:1692-1701.
14. Николь Л.Э., Брэдли С., Колган Р. и соавт. Инфекционные заболевания
Рекомендации Американского общества по диагностике и лечению
бессимптомная бактериурия у взрослых. Clin Infect Dis. 2005;40:643-654.
15. Джолли Дж.А., Крыло Д.А. Пиелонефрит во время беременности: обновленные варианты лечения для достижения оптимальных результатов. Наркотики. 2010;70:1643-1655.
16. Верани Дж.Р., МакГи Л., Шраг С.Дж.Профилактика перинатального стрептококкового заболевания группы В — пересмотренные рекомендации CDC, 2010 г. MMWR Recomm Rep. 2010; 59:1-36.
17. ЦКЗ. Стрептококк группы B (GBS). Профилактика у новорожденных. www.cdc.gov/groupbstrep/about/prevention.html. По состоянию на 1 мая 2013 г.
18. ЦКЗ. Listeria (листериоз). Определение. www.cdc.gov/listeria/definition.html. По состоянию на 1 мая 2013 г.
19. ЦКЗ. Листериоз (листериоз) и беременность. www.cdc.gov/pregnancy/infections-Listeria.html. По состоянию на 1 мая 2013 г.
20. Bubonja-Sonje M, Mustac E, Brunn A, et al. Листериоз беременных: клинический случай и ретроспективное исследование. J Matern Fetal Neonatal Med. 2013;26:321-323.
21. Служба безопасности и инспекции пищевых продуктов Министерства сельского хозяйства США. Защитите своего ребенка и
себя от листериоза.
www.fsis.usda.gov/wps/portal/fsis/topics/food-safety-education/get-answers/food-safety-factsheets/foodborne-illness-and-disease/protect-your-baby-and- себя от листериоза/CT_Index.
По состоянию на 1 мая 2013 г.
22.Ди Марио С., Басеви В., Гальотти С. и др. Пренатальное обучение при врожденном токсоплазмозе. Cochrane Database Syst Rev. 2013;(2):CD006171.
23. ЦКЗ. Паразиты – токсоплазмоз (инфекция Toxoplasma ). Беременные женщины. www.cdc.gov/parasites/toxoplasmosis/gen_info/pregnant.html. По состоянию на 1 мая 2013 г.
24. Робер-Ганно Ф., Дарде М.Л. Эпидемиология и диагностические стратегии токсоплазмоза. Clin Microbiol Rev. 2012; 25:264-296.
Чтобы прокомментировать эту статью, свяжитесь с rdavidson@uspharmacist.ком.
Enterobacteriaceae, продуцирующие бета-лактамазы расширенного спектра действия, среди беременных женщин в Норвегии: распространенность и передача от матери к новорожденному
Abdel-Hady H, Hawas S, El-Daker M, El-Kady R . Бета-лактамазы расширенного спектра действия, продуцирующие Klebsiella pneumoniae , в отделении интенсивной терапии новорожденных. Ж Перинатол 2008; 28 : 685–690.
КАС Статья Google Scholar
Реттедаль С., Лор И.Х., Натас О., Гиске К.Г., Сундсфьорд А., Оймар К. .Первая вспышка Klebsiella pneumoniae , продуцирующей бета-лактамазы расширенного спектра действия, в отделении интенсивной терапии новорожденных в Норвегии; связаны с зараженным грудным молоком и разрешены строгой когортой. АПМИС 2012; 120 : 612–621.
Артикул Google Scholar
Stone PW, Gupta A, Loughrey M, Della-Latta P, Cimiotti J, Larson E и др. . Приписываемые затраты и продолжительность пребывания в отделении интенсивной терапии новорожденных в связи со вспышкой Klebsiella pneumoniae , продуцирующей бета-лактамазы расширенного спектра действия. Infect Control Hosp Epidemiol 2003; 24 : 601–606.
Артикул Google Scholar
Cantey JB, Sreeramoju P, Jaleel M, Trevino S, Gander R, Hynan LS и др. . Оперативная борьба со вспышкой, вызванной продуцирующей бета-лактамазы расширенного спектра Klebsiella pneumoniae , в отделении интенсивной терапии новорожденных. J Pediatr 2013; 163 : e671–e673.
Артикул Google Scholar
Woerther PL, Burdet C, Chachaty E, Andremont A .Тенденции фекального носительства бета-лактамаз расширенного спектра у людей в обществе: к глобализации CTX-M. Clin Microbiol, ред. , 2013 г.; 26 : 744–758.
Артикул Google Scholar
Denkel LA, Schwab F, Kola A, Leistner R, Garten L, von Weizsacker K и др. . Мать как наиболее важный фактор риска колонизации младенцев с очень низкой массой тела при рождении (VLBW) энтеробактериями, продуцирующими бета-лактамазы расширенного спектра действия (ESBL-E). J Antimicrob Chemother 2014; 69 : 2230–2237.
КАС Статья Google Scholar
Дюбуа В., Де Барбейрак Б., Роуг А.М., Арпин С., Куланж Л., Андре С. и др. . Escherichia coli , продуцирующая CTX-M, в родильном отделении: вероятный завоз в сообществе и свидетельство передачи инфекции от матери новорожденному. J Antimicrob Chemother 2010; 65 : 1368–1371.
КАС Статья Google Scholar
Чудин-Суттер С., Фрей Р., Баттегай М., Хосли И., Видмер А.Ф.Escherichia coli, продуцирующая бета-лактамазы расширенного спектра, в отделении неонатальной помощи. Emerg Infect Dis 2010; 16 : 1758–1760.
КАС Статья Google Scholar
Сил Дж, Миллар М . Перинатальная вертикальная передача устойчивых к антибиотикам бактерий: систематический обзор и предлагаемая стратегия исследования. БЖОГ 2014; 121 : 923–928.
КАС Статья Google Scholar
Чиполла Д., Джуффре М., Маммина С., Корселло Г. .Профилактика внутрибольничных инфекций и наблюдение за возникающей резистентностью в отделениях интенсивной терапии. J Matern Fetal Neonatal Med 2011; 24 : 23–26.
Артикул Google Scholar
Бененсон С., Левин П.Д., Блок С, Адлер А., Эргаз З., Пелег О. и др. . Непрерывное наблюдение для снижения колонизации бета-лактамазами расширенного спектра Klebsiella pneumoniae в отделении интенсивной терапии новорожденных. Неонатология 2013; 103 : 155–160.
КАС Статья Google Scholar
Рыбчинска Х., Меландер Э., Йоханссон Х., Лундберг Ф. . Эффективность программы скрининга один раз в неделю для контроля бактерий, продуцирующих бета-лактамазы расширенного спектра, в отделении интенсивной терапии новорожденных. Scand J Infect Dis 2014; 46 : 426–432.
Артикул Google Scholar
Giske CG, Sundsfjord AS, Kahlmeter G, Woodford N, Nordmann P, Paterson DL et al .Новое определение бета-лактамаз расширенного спектра действия: баланс между наукой и клинической необходимостью. J Antimicrob Chemother 2009; 63 : 1–4.
КАС Статья Google Scholar
Проверка ECoAS. Таблицы клинических точек останова версии 2.0. 2012 [цит.]. Доступно на http://www.eucast.org.
Birkett CI, Ludlam HA, Woodford N, Brown DF, Brown NM, Roberts MT и др. . ПЦР TaqMan в реальном времени для быстрого обнаружения и типирования генов, кодирующих бета-лактамазы расширенного спектра CTX-M. J Med Microbiol 2007; 56 : 52–55.
КАС Статья Google Scholar
Sundsfjord A, Simonsen GS, Haldorsen BC, Haaheim H, Hjelmevoll SO, Littauer P et al . Генетические методы выявления устойчивости к противомикробным препаратам. АПМИС 2004; 112 : 815–837.
КАС Статья Google Scholar
Бролунд А., Визелл К.Т., Эдквист П.Дж., Эльфстрем Л., Уолдер М., Гиске К.Г.Разработка ПЦР-анализа SYBRGreen в реальном времени для быстрого обнаружения приобретенного AmpC у Enterobacteriaceae. J Microbiol Methods 2010; 82 : 229–233.
КАС Статья Google Scholar
Стандартная рабочая процедура для PulseNet PFGE Escherichia coli O157:H7, Escherichia coli non-O157 (STEC), серотипы Salmonella, Shigella sonnei и Shigella flexneri. [цитируется]. Доступно на http://www.cdc.gov/pulsenet/PDF/ecoli-shigella-salmonella-pfge-protocol-508c.pdf.
Tenover FC, Arbeit RD, Goering RV, Mickelsen PA, Murray BE, Persing DH и др. . Интерпретация рестрикционных паттернов хромосомной ДНК, полученных с помощью гель-электрофореза в пульсирующем поле: критерии типирования бактериальных штаммов. J Clin Microbiol 1995; 33 : 2233–2239.
КАС пабмед ПабМед Центральный Google Scholar
NORM/NORM-VET 2013 Использование противомикробных препаратов и возникновение устойчивости к противомикробным препаратам в Норвегии .Tromsø: Oslo, 2014.
Hansen DS, Schumacher H, Hansen F, Stegger M, Hertz FB, Schonning K et al . Бета-лактамазы расширенного спектра (ESBL) в датских клинических изолятах Escherichia coli и Klebsiella pneumoniae : распространенность, распределение бета-лактамаз, филогруппы и корезистентность. Scand J Infect Dis 2012; 44 : 174–181.
КАС Статья Google Scholar
Бролунд А., Эдквист П.Дж., Макитало Б., Олссон-Лильеквист Б., Содерблом Т., Виселл К.Т. и др. .Эпидемиология штамма Escherichia coli , продуцирующего бета-лактамазы расширенного спектра действия, в Швеции, 2007–2011 гг. Clin Microbiol Infect 2014; 20 : O344–O352.
КАС Статья Google Scholar
Остхольм-Балхед А., Тарнберг М., Нильссон М., Нильссон Л.Е., Ханбергер Х., Халлгрен А. и др. . Связанная с путешествиями фекальная колонизация энтеробактериями, продуцирующими БЛРС: заболеваемость и факторы риска. J Antimicrob Chemother 2013; 68 : 2144–2153.
Артикул Google Scholar
Патхак А., Чандран С.П., Махадик К., Макаден Р., Лундборг К.С. Частота и факторы, связанные с носительством комменсала Escherichia coli с множественной лекарственной устойчивостью среди женщин, посещающих дородовые женские консультации в центральной Индии. BMC Infect Dis 2013; 13 : 199.
Артикул Google Scholar
Виллар Х.Э., Обер В., Басерни М.Н., Юго М.Б.Материнское носительство изолятов Escherichia coli , продуцирующих бета-лактамазы расширенного спектра действия, в Аргентине. J Chemother 2013; 25 : 324–327.
КАС Статья Google Scholar
Lopez-Cerero L, Jiménez C, Luna S, Vera C, Rodríguez-Baño J, Pascual A Распространенность БЛРС, продуцирующих Enterobacteriaceae; колонизация матери и передача инфекции от матери новорожденному. Конференция ECCMID, Барселона, 2014 г.
Викрамасингх Н.Х., Сюй Л., Юстас А., Шабир С., Салуджа Т., Хоуки П.М. Высокая частота фекального носительства CTX-M ESBL-продуцирующей Escherichia coli в определенной группе населения в Бирмингеме, Великобритания. J Antimicrob Chemother 2012; 67 : 1108–1113.
КАС Статья Google Scholar
Лор И.Х., Реттедал С., Натас О.Б., Насир У., Оймар К., Сундсфьорд А. . Длительное фекальное носительство у младенцев и внутридомовая передача Klebsiella pneumoniae, продуцирующей CTX-M-15, после нозокомиальной вспышки. J Antimicrob Chemother 2013; 68 : 1043–1048.
Артикул Google Scholar
Вальверде А, Гриль Ф, Коке ТМ, Пинтадо В, Бакеро Ф, Кантон Р и др. . Высокая частота колонизации кишечника микроорганизмами, продуцирующими бета-лактамазы расширенного спектра, при бытовых контактах с инфицированными внебольничными пациентами. J Clin Microbiol 2008; 46 : 2796–2799.
Артикул Google Scholar
Родригес-Бано Х., Лопес-Сереро Л., Наварро М.Д., Диас де Альба П., Паскуаль А. .Фекальное носительство штамма Escherichia coli , продуцирующего бета-лактамазы расширенного спектра: распространенность, факторы риска и молекулярная эпидемиология. J Antimicrob Chemother 2008; 62 : 1142–1149.
КАС Статья Google Scholar
Лейстнер Р., Мейер Э., Гастмайер П., Пфайфер Ю., Эллер С., Дем П. и др. . Факторы риска, связанные с внебольничной колонизацией бета-лактамазами расширенного спектра (БЛРС), положительными Escherichia Coli .предварительное исследование случай-контроль. PLoS One 2013 г.; 8 : e74323.
КАС Статья Google Scholar
Лауш К.Р., Фюрстед К., Ларсен К.С., Сторгаард М. . Колонизация полирезистентными энтеробактериями у госпитализированных датских пациентов с историей недавних поездок: перекрестное исследование. Travel Med Infect Dis 2013; 11 : 320–323.
Артикул Google Scholar
Тангден Т., Карс О., Мелхус А., Лоудин Э. .Поездки за границу являются основным фактором риска колонизации штаммом Escherichia coli , продуцирующим бета-лактамазы расширенного спектра типа CTX-M: проспективное исследование с участием шведских добровольцев. Противомикробные агенты Chemother 2010; 54 : 3564–3568.
Артикул Google Scholar
Laupland KB, Church DL, Vidakovich J, Mucenski M, Pitout JD . Бета-лактамазы расширенного спектра действия (ESBL), продуцирующие Escherichia coli : важность международных поездок. J Infect 2008; 57 : 441–448.
Артикул Google Scholar
Тэм Дж., Оденхольт И., Уолдер М., Бролунд А., Аль Дж., Меландер Э. . Продуцирующая бета-лактамазы расширенного спектра Escherichia coli у пациентов с диареей путешественников. Scand J Infect Dis 2010; 42 : 275–280.
КАС Статья Google Scholar
Пейрано Г., Лаупланд К.Б., Грегсон Д.Б., Питут Д.Д.Колонизация вернувшихся путешественников штаммом , продуцирующим CTX-M, Escherichia coli . J Travel Med 2011; 18 : 299–303.
Артикул Google Scholar
Кеннеди К., Колиньон П. Колонизация штаммом Escherichia coli , устойчивым к «критически важным» антибиотикам: высокий риск для международных путешественников. Eur J Clin Microbiol Infect Dis 2010; 29 : 1501–1506.
КАС Статья Google Scholar
Роджерс Б.А., Кеннеди К.Дж., Сиджабат Х.Е., Джонс М., Коллинон П., Патерсон Д.Л. Длительное носительство резистентной E. coli вернувшимися путешественниками: клональность, факторы риска и характеристики бактерий. Eur J Clin Microbiol Infect Dis 2012; 31 : 2413–2420.
КАС Статья Google Scholar
Тумбарелло М., Трекаричи Э.М., Бассетти М., Де Роса Ф.Г., Спану Т., Ди Меко Э. и др. .Выявление пациентов с энтеробактериями, продуцирующими расширенный спектр бета-лактамаз, при поступлении в больницу: создание и проверка системы оценки. Противомикробные агенты Chemother 2011; 55 : 3485–3490.
КАС Статья Google Scholar
Soraas A, Sundsfjord A, Sandven I, Brunborg C, Jenum PA . Факторы риска внебольничных инфекций мочевыводящих путей, вызванных энтеробактериями, продуцирующими БЛРС, — исследование случай-контроль в стране с низкой распространенностью. PLoS One 2013 г.; 8 : e69581.
Артикул Google Scholar
Бен-Ами Р., Родригес-Бано Дж., Арслан Х., Питу Дж.Д., Квентин С., Кальбо Э.С. и др. . Многонациональное исследование факторов риска инфицирования энтеробактериями, продуцирующими бета-лактамазы расширенного спектра, у негоспитализированных пациентов. Clin Infect Dis 2009; 49 : 682–690.
Артикул Google Scholar
Датта Н., Файерс М.С., Ривз Д.С., Брамфитт В., Орсков Ф., Орсков И.Р.Факторы Escherichia coli в фекалиях после пероральной химиотерапии в общей практике. Ланцет 1971; 1 : 312–315.
КАС Статья Google Scholar
Домингес-Белло М.Г., Костелло Э.К., Контрерас М., Магрис М., Идальго Г., Фиерер Н. и др. . Способ родоразрешения определяет приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci U S A 2010; 107 : 11971–11975.
Артикул Google Scholar
Бирджи А., Мариани-Куркджян П., Биде П., Дойт С., Женель Н., Курру С и др. . Характеристика штаммов Escherichia coli , продуцирующих бета-лактамазы расширенного спектра, участвующих в колонизации матери и плода: распространенность E. coli ST131. J Clin Microbiol 2013; 51 : 1727–1732.
Артикул Google Scholar
Стренгер В., Файерл Г., Реш Б., Зарфель Г., Гризольд А., Масуд-Ландграф Л. и др. .Фекальное носительство и внутрисемейное распространение энтеробактерий, продуцирующих бета-лактамазы расширенного спектра, после колонизации в отделении интенсивной терапии новорожденных. Pediatr Crit Care Med 2013; 14 : 157–163.
Артикул Google Scholar
Что такое инфекция кишечной палочки? Симптомы, причины, диагностика, лечение и профилактика
Маленькие дети, пожилые люди и люди с ослабленной иммунной системой более склонны к тяжелым симптомам STEC или развитию ГУС, согласно прошлым исследованиям. Осложнения, вызванные ГУС При ГУС токсины E. coli разрушают эритроциты в процессе, называемом гемолизом. Поврежденные эритроциты образуют сгустки и могут засорить систему фильтрации почек, что может привести к опасной для жизни почечной недостаточности. ГУС поражает примерно от 5 до 10 процентов пациентов с STEC. Как правило, ГУС развивается примерно через семь дней после появления первых симптомов инфекции E. coli и после того, как диарея начинает стихать. Дополнительные симптомы включают:- Уменьшение частоты мочеиспускания
- Крайняя усталость
- Потеря цвета щек
- Маленькие необъяснимые синяки
- Отек лица, рук, ног или тела, по данным Mayo Clinic
- Потеря цвета внутри нижних век
- Менингит у новорожденных An Инфекция E. coli является одной из наиболее частых причин неонатального бактериального менингита, инфекции оболочек, окружающих головной и спинной мозг ребенка.Он обнаруживается в 30 процентах всех ранних инфекций. Согласно статье, опубликованной в марте 2015 года в журнале Clinics in Perinatology , матери передают E.