ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННОГО — ГБУЗ ЯНАО
Почти каждый второй новорожденный ребенок имеет физиологическую желтушку — это не опасное явление. Однако желтеть кожные покровы малышей могут и по другой причине – вследствие так называемой гемолитической болезни новорожденных-последствия у которой зачастую оказываются значительно серьезнее .Если вашему малышу поставили этот диагноз — не отчаивайтесь!
При своевременном оказании медицинской помощи все процессы в его маленьком организме быстро придут в норму и риск поражения нервной системы будет устранен.
Чтобы понять каковы же будут последствия гемолитической болезни, для начала надо понять, что из себя представляет данное заболевание и почему его срочно нужно лечить .Остановимся на примере гемолитической болезни новорожденных при групповой несовместимости , т.к. она встречается чаще и протекает несколько легче, чем при резус-конфликте. В данном случае мама имеет первую группу крови 0 (I), а плод – другую, чаще вторую А(II) или третьюВ(III).
Будущая мать имея первую группу крови -не имеет антигенов. Обозначим на картинке организм матери знаком «минус». А будущий ребенок, т.е. плод имеет вторую группу крови, т.е. в его крови есть антиген. На картинке обозначим плод знаком «плюс».При наличии антигена у плода иммунная система матери начнет считать этот антиген как чужеродный агент-враг и начнет вырабатывать против этого антигена защитные антитела(JgG). Эти антитела могут начать вырабатываться рано — еще во время беременности, а могут появиться практически в процессе родов. Чем меньше срок беременности, при котором начали вырабатываться антитела, тем больше их накапливается и тем вероятнее более тяжелое заболевание малыша. Эти антитела устремляются в кровь к плоду через плаценту, оседают на эритроцитах ребенка и начинают их разрушать. Их разрушается очень много, из разрушенных эритроцитов высвобождается большое количество пигмента билирубина.
Почему непрямой билирубин является токсичным? Потому что он повреждает клетки сердца, печени и в большей степени клетки мозга, возникает билирубиновая интоксикация, характеризующаяся вялостью, срыгиваниями, рвотой, патологическим зеванием, снижением мышечного тонуса.
Яркость желтушного оттенка зависит от количества этого пигмента в организме новорожденного. Желтуха может возникать рано (возможно, даже в первые сутки жизни ребенка) и сохраняется в течение длительного времени. Характерно увеличение печени и селезенки, Цвет кожи ребенка — ярко-желтый, могут быть прокрашены склеры — белки глаз. Если есть анемия, а она обязательно есть, т.к. эритроциты погибают, то малыш будет бледным и желтуха может казаться не такой яркой.
Лечение при легких и средних формах тяжести данного конфликта часто проводится консервативно.
При поздно начатом лечении последствия гемолитической болезни могут быть опасными – от гибели малыша до тяжелых неврологических расстройств с признаками детского церебрального паралича, задержки психофизического развития, глухоты, нарушения речи.
Легкие и средние формы патологии редко( до10%) могут оставлять легкую задержку моторного развития при удовлетворительном состоянии умственных способностей; расстройство поведения; нарушение функций движения, косоглазие, нарушение слуха и речи. Дети с перенесенной ГБН плохо переносят прививки, склонны к развитию тяжелых аллергий и часто и длительно могут болеть инфекционными заболеваниями; зубы часто подвержены разрушению эмали и кариесу.
 к. через грудное молоко антитела (JgG) будут поступать к ребенку и желтуха будет усиливаться. Через 15-20 дней ,после исчезновения антител из молока, женщина может кормить грудью. Для мамы новорожденного очень важна диета. Правильное питание женщины обеспечит поступление витаминов и исключит воздействие вредных химических добавок. Обязательный рацион должен содержать овощи и фрукты, рыбу, печень. Главное, чтобы продукты были свежими и натуральными.
к. через грудное молоко антитела (JgG) будут поступать к ребенку и желтуха будет усиливаться. Через 15-20 дней ,после исчезновения антител из молока, женщина может кормить грудью. Для мамы новорожденного очень важна диета. Правильное питание женщины обеспечит поступление витаминов и исключит воздействие вредных химических добавок. Обязательный рацион должен содержать овощи и фрукты, рыбу, печень. Главное, чтобы продукты были свежими и натуральными. Дети , перенесшие ГБН, должны наблюдаться врачом- невропатологом в поликлинике и получать реабилитационное лечение.
И в заключении хочу сказать, что даже поняв самую малость из выше описанного мною, любой разумный человек, в том числе тот, кто по роду деятельности далек от медицины, способен понять последствия гемолитической болезни.
Статью подготовила Кононова Наталья Федоровна заведующая отделением организации медицинской помощи детям в образовательных организациях ГБУЗ ЯНАО «Губкинская городская больница».
Паренхиматозная желтуха – диагностика, симптомы, причины и лечение в клинике Медскан
Возможные причины паренхиматозной желтухи
Спровоцировать паренхиматозную желтуху могут различные патологические состояния, которые нарушают способность гепатоцитов захватывать, связывать и превращать желчь в билирубин. Заболевание может быть как врожденным, так и приобретенным. Среди основных причин паренхиматозной желтухи выделяют следующие факторы:
Заболевание может быть как врожденным, так и приобретенным. Среди основных причин паренхиматозной желтухи выделяют следующие факторы:
- Инфекционные гепатиты. Спровоцировать гибель гепатоцитов могут гепатиты А, B, C, D, Е. Подобное происходит из-за опосредованного цитотоксического эффекта этих вирусных возбудителей. Также причиной паренхиматозной желтухи может выступать герпетическая, аденовирусная или энтеровирусная инфекции, инфекционный мононуклеоз, сепсис, лептоспироз;
- Токсическое влияние. Разрушить печеночную ткань и спровоцировать паренхиматозную желтуху способны различные гепатотропные яды. К ним относят окислители на основе окислов азота, гидразин, хлорэтан, этиленгликоль. Также токсически влияет на печень алкоголь;
- Перерождение печеночной паренхиматозной ткани. Из-за фиброза, цирроза печени, склерозирующего холангита функциональная ткань печени заменяется соединительной. Это также происходит при печеночной недостаточности, гепатоцеллюлярных карциномах и других формах первичного рака печени;
-
Аутоиммунное поражение гепатоцитов.
 Подобное происходит из-за повышения титра аутоантител. Спровоцировать его могут ревматоидный артрит, болезнь Шегрена, гломерулонефрит, аутоиммунный тиреоидит;
Подобное происходит из-за повышения титра аутоантител. Спровоцировать его могут ревматоидный артрит, болезнь Шегрена, гломерулонефрит, аутоиммунный тиреоидит; - Внутрипеченочный холестаз. Причиной разрушения гепатоцитов может выступать нарушение проницаемости печеночных мембран. Это характерно для беременных, пациентов с холестазом, холестатическим гепатитом, муковисцидозом;
-
Наследственные заболевания. Паренхиматозная желтуха может возникнуть и как врожденный дефект. Чаще всего такая форма диагностируется при синдроме Жильбера, Криглера-Найяра, Дабина-Джонсона, Ротора;
Методы диагностики паренхиматозной желтухи
Основной признак, по которому врач может заподозрить паренхиматозную желтуху, — это изменение цвета кожи. Лицо таких пациентов приобретает красноватый, шафрановый оттенок. Печень при пальпации становится плотной, увеличенной. В некоторых случаях увеличивается в размерах и селезенка. Обычно для диагностики паренхиматозной желтухи достаточно общего и биохимического анализов крови. В их определяется:
Лицо таких пациентов приобретает красноватый, шафрановый оттенок. Печень при пальпации становится плотной, увеличенной. В некоторых случаях увеличивается в размерах и селезенка. Обычно для диагностики паренхиматозной желтухи достаточно общего и биохимического анализов крови. В их определяется:
- Повышенный уровень общего, прямого и непрямого билирубина;
- Увеличение показателей повреждения печени – АЛТ, АСТ, щелочной фосфатазы, тимоловой пробы;
- Уменьшение концентрации альбуминов, фибриногена.
В общем анализе мочи обнаруживаются желтые пигменты. Исследование кала определяет пониженное содержание стеркобилиногена в нем. Дополнительно проводятся инструментальные методы диагностики:
- УЗИ печени – определяет размер и структуру этого органа, выявляет любые изменения в его тканях. Позволяет на начальных стадиях диагностировать фиброзные очаги;
- МРТ органов брюшной полости – позволяет определить возможную причину паренхиматозной желтухи, выявляет степень тяжести патологического процесса, возможные осложнения;
-
Непрямая ультразвуковая эластометрия – оценивает механические свойства печеночной ткани.
 Выявляет начальные стадии фиброза.
Выявляет начальные стадии фиброза.
В некоторых случаях диагностика паренхиматозной желтухи требует проведения чрескожной пункционной биопсии. Процедура выполняется под контролем УЗИ. Врач аккуратно забирает часть печеночной ткани и отправляет ее на гистологическое исследование.
Лечение паренхиматозной желтухи
Основная цель лечения паренхиматозной желтухи – устранение причины возникновения этого заболевания и стабилизация самочувствия пациента. Врачи делают все возможное, чтобы восстановить функции гепатоцитов и устранить патологические признаки, вызванные повышением уровня билирубина в крови. Схема лечения при паренхиматозной желтухе зависит от возраста пациента, наличия сопутствующих заболеваний, уровня нарушения. Стандартно назначаются следующие лекарственные препараты:
- Антибиотики – устраняют инфекционных агентов, которые могли вызвать паренхиматозную желтуху;
- Противовирусные средства – подавляет активность вирусов, способствующих повреждению печеночной ткани;
- Иммуномодуляторы – повышают защитные способности организма, дают ему силы бороться;
- Кортикостероиды – купируют воспалительный синдром, избавляют от острых болезненных ощущений;
- Цитостатики – противоопухолевые препараты, которые нарушают процесс роста;
-
Химиотерапевтические средства – снижают вероятность развития таких осложнений, как печеночная карцинома или рак печени.

При появлении признаков интоксикации проводится инфузионная терапия. Если произошло токсическое поражение печени, назначаются специфические антидоты. Чтобы нормализовать работу печени, назначаются гепатопротекторы. Они стимулируют регенерацию клеток печени, стабилизируют их мембраны. Улучшить обменные процессы в желчном пузыре способна урсодезоксихолевая кислота.
Чтобы минимизировать риск склерозирования тканей, пациентам с паренхиматозной желтухой назначают препараты группы периферических вазодилататоров. Они способствуют расширению сосудов, за счет чего улучшается кровоснабжение печени.
Если уровень прямого билирубина в крови экстремально высок, проводится фототерапия. С ее помощью удается расщепить его на более простые соединения. Они легко растворяются в воде и выводятся почками. Также на время лечения пациенту необходимо соблюдать специальную диету, которая предполагает сокращение животных жиров.
В редких случаях паренхиматозная желтуха протекает тяжело. При развитии серьезных нарушений показаны плазмаферез, гемосорбция, При массивной деструкции гепатоцитов печени необходима пересадка этого органа от донора.
При развитии серьезных нарушений показаны плазмаферез, гемосорбция, При массивной деструкции гепатоцитов печени необходима пересадка этого органа от донора.
Прогноз
Обычно печени удается самостоятельно справиться с паренхиматозной желтухой. Также возможно длительное скрытое течение болезни: когда клинические признаки патологии есть, но симптомы – отсутствуют. Такое состояние долгое время пагубно влияет на печень, способствует развитию множественных осложнений. Среди них печеночная недостаточность, гепатоцеллюлярная карцинома, рак печени.
На начальных стадиях паренхиматозная желтуха хорошо поддается лечению и не вызывает каких-либо осложнений. Грамотно подобранная терапия и строгое соблюдение всех предписаний врача позволяет оперативно избавиться от патологии и предотвратить развитие осложнений со стороны печени.
Если паренхиматозная желтуха возникла у ребенка, формируется острое нарушение кровообращения во всех органах и системах.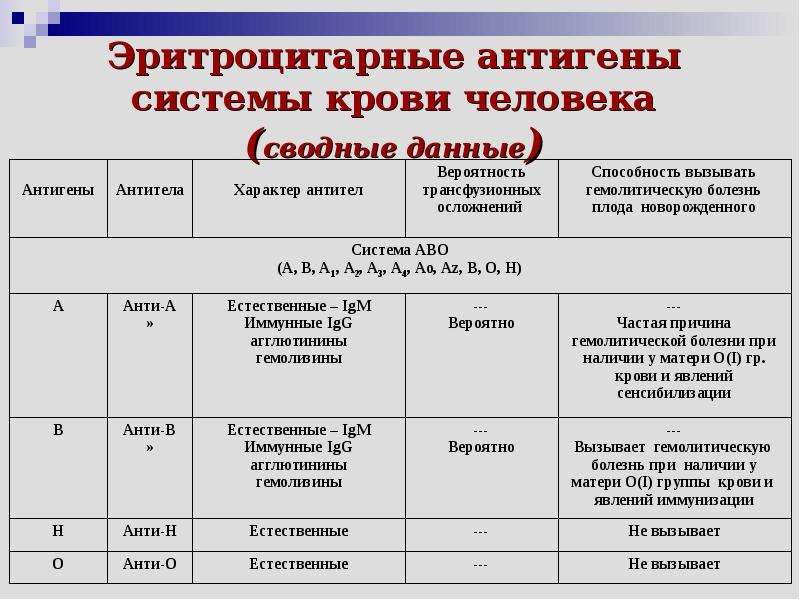 Это вызывает нарушение их умственного развития. Запущенные формы паренхиматозной желтухи, сопровождаемые повышенным уровнем билирубина в крови, приводят к общей интоксикации организма. Также болезнь вызывает значительное повреждение нервной системы: пациенты жалуются на судороги, ухудшение слуха, паралич. Возможен летальный исход.
Это вызывает нарушение их умственного развития. Запущенные формы паренхиматозной желтухи, сопровождаемые повышенным уровнем билирубина в крови, приводят к общей интоксикации организма. Также болезнь вызывает значительное повреждение нервной системы: пациенты жалуются на судороги, ухудшение слуха, паралич. Возможен летальный исход.
Профилактика
Защититься от паренхиматозной желтухи можно, если сделать все возможное для недопущения болезней, которые ее вызывают. Врачи рекомендуют соблюдать следующие правила:
- Не занимайтесь самолечением – любые препараты принимайте только после консультации со специалистом;
- Откажитесь от употребления спиртных напитков;
- Не допускайте обострения хронических болезней;
- Соблюдайте меры личной гигиены;
- Следите за массой тела;
- Ведите здоровый и активный образ жизни;
- Правильно и сбалансированно питайтесь;
- Соблюдайте меры безопасности при работе с химическими препаратами;
-
Ежегодно сдавайте анализы крови и мочи, проходите УЗИ брюшной полости.

Если вы заподозрили у себя признаки паренхиматозной желтухи или же пытаетесь от нее избавиться, обязательно обратитесь в медицинский центр Медскан. Опытные врачи назначат необходимое обследование и разработают индивидуальный план лечения. С ними вы сможете избавиться от паренхиматозной желтухи и минимизировать риск возможных осложнений.
Группа крови (Blood group, АВ0)
Метод определенияФильтрация проб крови сквозь гель, импрегнированный моноклональными реагентами — агглютинация + гель-фильтрация (карточки, перекрестный метод). При необходимости (обнаружение А2-подтипа) проводится дополнительное тестирование с использованием специфических реактивов.
Исследуемый материал Цельная кровь (с ЭДТА)
Доступен выезд на дом
Онлайн-регистрацияСинонимы: Анализ крови на определение группы; Группа крови АВ0; Группа крови по системе АВО; Определение группы крови. ABO Grouping, Blood Typing, Blood Group, Blood Type.
ABO Grouping, Blood Typing, Blood Group, Blood Type.
Краткое описание исследования Группа крови
Группа крови — это генетически наследуемый признак, не изменяющийся в течение жизни. Определение групповой принадлежности крови используется в клинической практике при переливании крови и ее компонентов, в гинекологии и акушерстве при планировании и ведении беременности. Система групп крови AB0 является основной системой, определяющей совместимость (или несовместимость) переливаемой крови, так как эти антигены наиболее иммуногенны. Особенностью системы АВ0 является то, что в плазме у неиммунных людей имеются естественные антитела к отсутствующему на эритроцитах антигену. Систему групп крови АВ0 составляют два групповых эритроцитарных антигена − агглютиногены А и В, и два соответствующих антитела − агглютинины плазмы α (анти-А) и β (анти-В). Различные сочетания антигенов и антител образуют четыре группы крови:
- группа 0αβ (I) − на эритроцитах отсутствуют групповые агглютиногены, в плазме крови присутствуют агглютинины α и β;
- группа Aβ (II) − эритроциты содержат только агглютиноген А, в плазме крови присутствует агглютинин β;
- группа Bα (III) − эритроциты содержат только агглютиноген В, в плазме крови содержится агглютинин α;
- группа AB (IV) − на эритроцитах присутствуют агглютиногены А и В, плазма крови агглютининов не содержит.

Определение групп крови проводят путем идентификации специфических антигенов и антител (двойной метод или перекрестная реакция).
Несовместимость крови наблюдается, если эритроциты крови донора (реципиента) несут агглютиногены (А или В), а в плазме крови реципиента (донора) содержатся соответствующие агглютинины (α или β), при этом происходит реакция агглютинации. Переливать эритроциты, плазму крови и особенно цельную кровь от донора к реципиенту нужно строго соблюдая групповую совместимость. Лучше всего переливать кровь, эритроциты и плазму той же группы, которая определена у реципиента. В экстренных случаях эритроциты группы 0 (но не цельную кровь!) можно переливать реципиентам с другими группами крови; эритроциты группы А можно переливать реципиентам с группой крови А и АВ, а эритроциты от донора группы В − реципиентам группы В и АВ.
Варианты групповой несовместимости (агглютинация обозначена знаком +)
Кровь донора | Кровь реципиента | |||
0αβ (I) | Aβ (II) | Bα (III) | AB (IV) | |
0αβ (I) | — | + | + | + |
Aβ (II) | + | — | + | + |
Bα (III) | + | + | — | + |
AB (IV) | + | + | + | — |
Эритроциты донора | Кровь реципиента | |||
0αβ (I) | Aβ (II) | Bα (III) | AB (IV) | |
0 (I) | — | — | — | — |
A (II) | + | — | + | — |
B (III) | + | + | — | — |
AB (IV) | + | + | + | — |
Антигены системы АВ0 выявляются не только на эритроцитах, но и на клетках других тканей. Они развиваются на ранних стадиях внутриутробного развития и у новорожденного уже находятся в существенном количестве. Кровь новорожденных детей имеет возрастные особенности − в плазме крови могут отсутствовать характерные групповые агглютинины, которые начинают вырабатываться позже (постоянно обнаруживаются после десяти месяцев), и определение группы крови в этом случае проводится только по наличию антигенов системы АВ0.
Они развиваются на ранних стадиях внутриутробного развития и у новорожденного уже находятся в существенном количестве. Кровь новорожденных детей имеет возрастные особенности − в плазме крови могут отсутствовать характерные групповые агглютинины, которые начинают вырабатываться позже (постоянно обнаруживаются после десяти месяцев), и определение группы крови в этом случае проводится только по наличию антигенов системы АВ0.
Трудности при определении группы крови вследствие подавления реакции гемагглютинации возникают также после введения плазмозаменителей, переливания крови, трансплатации, септицемии и пр.
Наследование групп крови В основе закономерностей наследования групп крови системы АВ0 лежат следующие понятия. В локусе гена АВ0 возможны три варианта (аллеля) − 0, A и B, которые экспрессируются по аутосомно-кодоминантному типу. Это означает, что у лиц, унаследовавших гены А и В, экспрессируются продукты обоих этих генов, что приводит к образованию фенотипа АВ (IV группа крови). Фенотип А (II группа крови) может быть у человека, унаследовавшего от родителей или два гена А (генотип АА), или гены А и 0 (генотип А0). Соответственно, фенотип В (III группа крови) − при наследовании или двух генов В (генотип ВВ), или В и 0 (генотип В0). Фенотип 0 (I группа крови) проявляется в случае наследования двух генов 0 (генотип 00). Это объясняет, почему в том случае, если оба родителя имеют II группу крови (с возможным генотипом А0), кто-то из их детей может иметь первую группу (генотип 00), или в случае, если у одного из родителей группа крови A (II) (с возможным генотипом А0), а у другого B (III) (с возможным генотипом В0), дети могут иметь не только группы крови А (II) и B (III), но и 0 (I) и АВ (IV).
Фенотип А (II группа крови) может быть у человека, унаследовавшего от родителей или два гена А (генотип АА), или гены А и 0 (генотип А0). Соответственно, фенотип В (III группа крови) − при наследовании или двух генов В (генотип ВВ), или В и 0 (генотип В0). Фенотип 0 (I группа крови) проявляется в случае наследования двух генов 0 (генотип 00). Это объясняет, почему в том случае, если оба родителя имеют II группу крови (с возможным генотипом А0), кто-то из их детей может иметь первую группу (генотип 00), или в случае, если у одного из родителей группа крови A (II) (с возможным генотипом А0), а у другого B (III) (с возможным генотипом В0), дети могут иметь не только группы крови А (II) и B (III), но и 0 (I) и АВ (IV).
С какой целью определяют Группу крови
Помимо ситуаций, связанных с необходимостью переливания крови, определение группы крови, резус-принадлежности, определение наличия аллоиммунных (изоиммунных) антиэритроцитарных антител должно проводиться при планировании или во время беременности для выявления вероятности иммунологического конфликта матери и ребенка, который может приводить к гемолитической болезни новорожденных (см. тест № 140).
тест № 140).Гемолитическая болезнь новорожденных – гемолитическая желтуха новорожденных, обусловленная иммунологическим конфликтом между матерью и плодом из-за несовместимости по эритроцитарным антигенам. Болезнь обусловлена несовместимостью плода и матери по D-резус- или АВО-антигенам, реже имеет место несовместимость по другим резус- (С, Е, с, d, e) или М-, М-, Kell-, Duffy-, Kidd-антигенам. Любой из указанных антигенов (чаще D-резус-антиген), проникая в кровь резус-отрицательной матери, вызывает образование в ее организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Предрасполагают к развитию гемолитической болезни новорожденных нарушение проницаемости плаценты, повторные беременности, медицинские аборты, выкидыши, внематочные беременности, инвазивные диагностические и лечебные вмешательства (биопсия ворсин хориона, амниоцентез, кордоцентез и др.), кровотечения во время беременности, ретрохориальная гематома, абдоминальные травмы и переливания крови женщине без учета резус-фактора и др. При раннем проявлении заболевания иммунологический конфликт может быть причиной преждевременных родов или выкидышей.
При раннем проявлении заболевания иммунологический конфликт может быть причиной преждевременных родов или выкидышей.
Гемолитическая желтуха: причины, лечение, симптомы
Гемолитическая желтуха – форма желтушного синдрома, развивающаяся на фоне массового разрушения эритроцитов. Кожные покровы пациента бледнеют и приобретают желтоватый оттенок, развиваются гемолитические кризы.
Общие сведения
Патология проявляется при повышении в организме пациента уровня свободного билирубина. Это явление становится следствием ускоренного разрушения эритроцитов (стандартный срок их жизнедеятельности снижается до 25-30 дней). Печень обладает функциональными резервами для выведения из организма человека избытков билирубина, превышающих норму в 3-4 раза. Массовое разрушение красных клеточных элементов крови приводит к преодолению этого барьера. Билирубин накапливается в крови ребенка или взрослого и откладывается в тканях.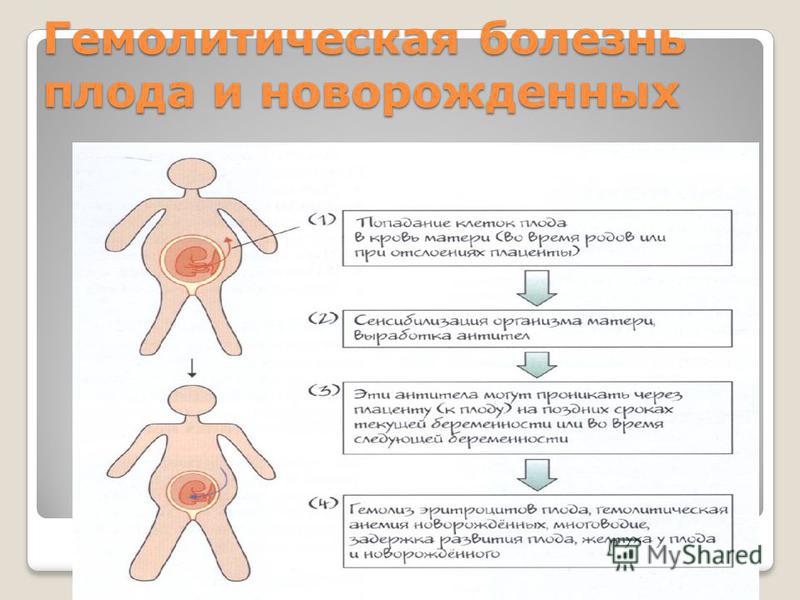
Механизм развития патологии
Основной причиной проявления симптомов гемолитической желтухи у пациента становится образование значительного количества непрямого билирубина. Гастроэнтерологи выделяют несколько факторов, которые могут способствовать этому:
- наследственные дефекты эритроцитов и гемоглобина;
- присутствие в организме пациента токсинов или патогенов;
- обширные инфаркты или кровоизлияния;
- механическое повреждение эритроцитов в сосудах.
Существенное влияние на жизнеспособность красных клеточных элементов крови оказывают злокачественные патологии. Часто гемолитическая желтуха развивается на фоне системных патологий соединительной ткани или лучевой болезни.
Классификация заболевания
Клинические рекомендации Минздрава содержат описание трех основных форм гемолитической желтухи. Подробная информация представлена в таблице.
| Гемолитическая желтуха | Описание |
|
Корпускулярная |
Развивается из-за дефицита или малой активности ферментных систем, дефектов гемоглобина. |
|
Экстракорпускулярная |
Нарушение целостности эритроцитов происходит под действием внешних факторов: токсинов, ядов, механических нагрузок. Лечение предполагает устранение причин повреждения красных клеточных элементов крови |
|
Постгеморрагическая |
Становится следствием массового распада эритроцитов в местах кровоизлияния из-за тяжелых травм. Основной задачей врачей при лечении пациента становится купирование неотложных состояний |
Симптоматика патологии
Гемолитические желтухи проявляются одинаково интенсивно у представителей разных возрастных групп. Распространенный симптомы – бледность кожи при появлении лимонно-желтого оттенка на ее поверхности. Пациенты сталкиваются с потемнением мочи и каловых масс. Болевой синдром умеренный, локализован в нижней части живота. Периодически проявляются приступы тошноты, после приема пищи возникает интенсивная отрыжка. В редких случаях возникает диарея.
Пациенты сталкиваются с потемнением мочи и каловых масс. Болевой синдром умеренный, локализован в нижней части живота. Периодически проявляются приступы тошноты, после приема пищи возникает интенсивная отрыжка. В редких случаях возникает диарея.
Гемолитический криз в острой фазе заболевания сопровождается:
- фебрильной лихорадкой;
- головными болями;
- увеличением селезенки;
- ощущением тяжести в левом подреберье.
На фоне отравлений химическими агентами или лекарственными средствами пациент может впасть в кому. Появляются признаки тахикардии, артериальное давление снижается. Дыхание становится прерывистым, ребенку или взрослому может потребоваться искусственная вентиляция легких.
Осложнения заболевания
Гемолитическая желтуха становится причиной застойных явлений в желчном пузыре. На фоне этого происходит обструкция желчевыводящих протоков. Не менее распространенным осложнением остается токсическая нефропатия, сопровождаемая острой почечной недостаточностью.
Отсутствие медицинской помощи может спровоцировать у пациента печеночную недостаточность. Угнетение функций печени приводит к нарушению значительной части метаболических процессов в организме человека. Интоксикация головного мозга билирубином приводит к билирубиновой энцефалопатии.
Диагностические процедуры
Постановка диагноза не вызывает затруднений у врачей: клиническая картина патологии специфична. Бледность кожных покровов и их желтушный оттенок при отсутствии зуда свидетельствуют о развитии у пациента гемолитической желтухи. Ребенку или взрослому назначаются лабораторные и аппаратные тесты:
- общий и биохимический анализы крови;
- ультразвуковое исследование брюшной полости.
Скрининги, выполняемые в лаборатории, позволяют выявить существенное снижение количества эритроцитов и гемоглобина в крови пациента. На фоне этого растет концентрация свободного билирубина. Его количество становится основанием для определения формы желтухи – легкой, средней или тяжелой.
УЗИ демонстрирует врачам увеличение селезенки при нормальных размерах печени. Сонография позволяет обнаружить осложнения, которые становятся следствием гемолитической желтухи: желчнокаменную болезнь, холецистит, изменения структуры печеночных сосудов.
Лечение патологии
Терапия при гемолитической желтухе обладает комплексным характером. Пациенту назначается диетотерапия в сочетании с несколькими группами препаратов:
- кортикостероидами;
- антибиотиками;
- индукторами ферментов печени.
Инфузионная терапия проводится при токсических поражениях организма пациента. При осложненном течении заболевания выполняется обменное переливание крови. Эта мера позволяет восполнить дефицит эритроцитов у ребенка или взрослого и снизить концентрацию свободного билирубина.
Радикальное лечение предполагает удаление селезенки. Подобный вариант применяется при тяжелом течении патологии у пациентов с наследственными ферментопатиями или мембранопатиями.
Прогноз и профилактика
Полное выздоровление наблюдается у пациентов без вторичных патологий и осложнений. Неблагоприятный прогноз формируется при необратимых нарушениях функций печени. Вероятность выздоровления определяется степенью поражения прилежащих органов. Риск летального исхода высок при билирубиновой энцефалопатии.
Врачи не выработали комплекса профилактических мер, направленных на предупреждение гемолитической желтухи. Пациентам с отягощенным семейным анамнезом рекомендуется систематически проходить осмотры у гастроэнтеролога.
Вопросы и ответы
В каком возрасте наиболее вероятно развитие гемолитической желтухи?
Патология может проявиться у человека любого возраста. Группу риска составляют мужчины и женщины, работающие с токсичными веществами. Разрушение эритроцитов может стать следствием хронических заболеваний печени и селезенки.
Способствует ли диета предупреждению развития гемолитической желтухи?
Диетотерапия назначается заболевшим пациентам. Здоровый человек со сбалансированным рационом может столкнуться с гемолитической желтухой на фоне отравления или травм. В этих случаях диета не играет значимой роли в формирования прогноза.
Здоровый человек со сбалансированным рационом может столкнуться с гемолитической желтухой на фоне отравления или травм. В этих случаях диета не играет значимой роли в формирования прогноза.
Отделение анестезиологии и реанимации новорожденных — Заменное переливание крови (без стоимости препарата крови) рядом с домом
Запись в 1 кликОперация заменного переливания крови
Операция заменного переливания крови проводится детям, страдающим угрозой развития гемолитической болезни — несовместимость по группе крови или резус-фактору между матерью и новорожденным. У младенцев в таком состоянии развивается гипербилирубинемия (молниеносное нарастание желтухи), анемия (резкое снижение гемоглобина и эритроцитов крови), отечный синдром (отечность всего тела).
Основным методом, решающим эту глобальную проблему, является операция заменного переливания крови (ОЗПК). Методика выполнения манипуляции сложная, требует задействования нескольких медицинских служб: врачи неонатологи-реаниматологи, «служба крови», врачи-трансфузиологи, медицинские специалисты-консультанты, лабораторная служба.
Методика выполнения манипуляции сложная, требует задействования нескольких медицинских служб: врачи неонатологи-реаниматологи, «служба крови», врачи-трансфузиологи, медицинские специалисты-консультанты, лабораторная служба.
Данная манипуляция заключается в двух-кратном обмене объема циркулирующей крови новорожденного на аналогичный объем донорской крови. Предшествует этой операции ряд специализированных действий — забор образца крови у новорожденного и его матери, определение групповой и резус принадлежности, подбор объема крови для заменного переливания в специализированном центре — станции переливания крови (подбор образца крови по множествам групповых и резус факторам).
Новорожденные, страдающие гемолитической болезнью, имеют тяжелое состояние, нуждаются в проведении — инфузионной терапии, фототерапии, многократного лабораторного обследования, респираторной поддержке (кислородо-терапия, искусственная вентиляция легких).
Операция заменного переливания крови проводится новорожденному в условиях детской палаты реанимации и интенсивной терапии под контролем высококвалифицированных и опытных врачей-реаниматологов.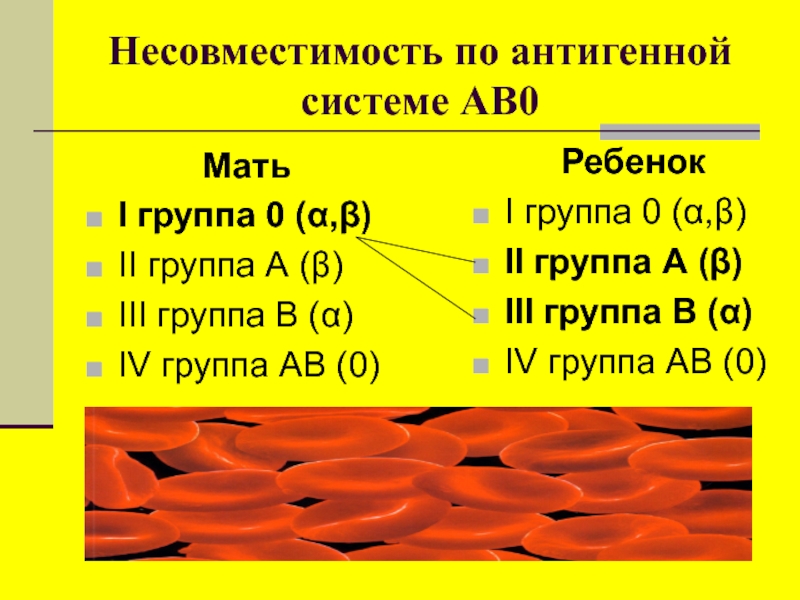 Новорожденные дети в таком состоянии нуждаются в специализированных условиях выхаживания, находятся под пристальным вниманием врачей реаниматологов-неонатологов и «следящей» аппаратуры.
Новорожденные дети в таком состоянии нуждаются в специализированных условиях выхаживания, находятся под пристальным вниманием врачей реаниматологов-неонатологов и «следящей» аппаратуры.
Как правило, данную манипуляцию выполняют в первые двое суток жизни новорожденного, с последующим вспомогательным лечением в условиях палаты детской палаты реанимации и интенсивной терапии.
Запись в 1 кликИнтермедикал | Группа крови, резус фактор
Определяет принадлежность к определённой группе крови по системе АВО.
Группы крови — это генетически наследуемые признаки, не изменяющиеся в течение жизни при естественных условиях. Группа крови представляет собой определённое сочетание поверхностных антигенов эритроцитов (агглютиногенов) системы АВО.
Определение групповой принадлежности широко используется в клинической практике при переливании крови и её компонентов, в гинекологии и акушерстве при планировании и ведении беременности.
Система групп крови AB0 является основной системой, определяющей совместимость и несовместимость переливаемой крови, т. к. составляющие её антигены наиболее иммуногенны. Особенностью системы АВ0 является то, что в плазме у неиммунных людей имеются естественные антитела к отсутствующему на эритроцитах антигену. Систему группы крови АВ0 составляют два групповых эритроцитарных агглютиногена (А и В) и два соответствующих антитела — агглютинины плазмы альфа (анти-А) и бета (анти-В).
Различные сочетания антигенов и антител образуют 4 группы крови:
- Группа 0 (I) — на эритроцитах отсутствуют групповые агглютиногены, в плазме присутствуют агглютинины альфа и бета;
- Группа А (II) — эритроциты содержат только агглютиноген А, в плазме присутствует агглютинин бета;
- Группа В (III) — эритроциты содержат только агглютиноген В, в плазме содержится агглютинин альфа;
- Группа АВ (IV) — на эритроцитах присутствуют антигены А и В, плазма агглютининов не содержит.

Определение групп крови проводят путём идентификации специфических антигенов и антител (двойной метод или перекрёстная реакция).
Несовместимость крови наблюдается, если эритроциты одной крови несут агглютиногены (А или В), а в плазме другой крови содержатся соответствующие агглютинины (альфа- или бета), при этом происходит реакция агглютинации. Переливать эритроциты, плазму и особенно цельную кровь от донора к реципиенту нужно строго соблюдая групповую совместимость. Чтобы избежать несовместимости крови донора и реципиента, необходимо лабораторными методами точно определить их группы крови. Лучше всего переливать кровь, эритроциты и плазму той же группы, которая определена у реципиента. В экстренных случаях эритроциты группы 0, но не цельную кровь!, можно переливать реципиентам с другими группами крови; эритроциты группы А можно переливать реципиентам с группой крови А и АВ, а эритроциты от донора группы В — реципиентам группы В и АВ.
Карты совместимости групп крови (агглютинация обозначена знаком «+»)
Эритроциты донора | Кровь реципиента | |||
A (II) | B (III) | |||
0 (I) | — | — | ||
A (II) | + | — | ||
B (III) | — | + | ||
AB (IV) | + | + | ||
Групповые агглютиногены находятся в строме и оболочке эритроцитов. Антигены системы АВО выявляются не только на эритроцитах, но и на клетках других тканей или даже могут быть растворёнными в слюне и других жидкостях организма. Развиваются они на ранних стадиях внутриутробного развития, у новорожденного уже находятся в существенном количестве. Кровь новорожденных детей имеет возрастные особенности — в плазме могут ещё не присутствовать характерные групповые агглютинины, которые начинают вырабатываться позже (постоянно обнаруживаются после 10 месяцев) и определение группы крови у новорождённых в этом случае проводится только по наличию антигенов системы АВО.
Антигены системы АВО выявляются не только на эритроцитах, но и на клетках других тканей или даже могут быть растворёнными в слюне и других жидкостях организма. Развиваются они на ранних стадиях внутриутробного развития, у новорожденного уже находятся в существенном количестве. Кровь новорожденных детей имеет возрастные особенности — в плазме могут ещё не присутствовать характерные групповые агглютинины, которые начинают вырабатываться позже (постоянно обнаруживаются после 10 месяцев) и определение группы крови у новорождённых в этом случае проводится только по наличию антигенов системы АВО.
Помимо ситуаций, связанных с необходимостью переливания крови, определение группы крови, резус-фактора, а также наличия аллоиммунных антиэритроцитарных антител должно проводиться при планировании или во время беременности для выявления вероятности иммунологического конфликта матери и ребёнка, который может приводить к гемолитической болезни новорожденных.
Гемолитическая болезнь новорождённых — гемолитическая желтуха новорожденных, обусловленная иммунологическим конфликтом между матерью и плодом из-за несовместимости по эритроцитарным антигенам. Болезнь обусловлена несовместимостью плода и матери по D-резус- или АВО-антигенам, реже имеет место несовместимость по другим резус- (С, Е, с, d, e) или М-, М-, Kell-, Duffy-, Kidd-антигенам. Любой из указанных антигенов (чаще D-резус-антиген), проникая в кровь резус-отрицательной матери, вызывает образование в её организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Болезнь обусловлена несовместимостью плода и матери по D-резус- или АВО-антигенам, реже имеет место несовместимость по другим резус- (С, Е, с, d, e) или М-, М-, Kell-, Duffy-, Kidd-антигенам. Любой из указанных антигенов (чаще D-резус-антиген), проникая в кровь резус-отрицательной матери, вызывает образование в её организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Предрасполагают к развитию гемолитической болезни новорожденных нарушение проницаемости плаценты, повторные беременности и переливания крови женщине без учёта резус-фактора и др. При раннем проявлении заболевания иммунологический конфликт может быть причиной преждевременных родов или выкидышей. Существуют разновидности (слабые варианты) антигена А (в большей степени) и реже антигена В. Что касается антигена А, имеются варианты: сильный А1 (более 80%), слабый А2 (менее 20%), и еще более слабые (А3, А4, Ах — редко). Это теоретическое понятие имеет значение для переливания крови и может вызвать несчастные случаи при отнесении донора А2 (II) к группе 0 (I) или донора А2В (IV) — к группе В (III), поскольку слабая форма антигена А иногда обуславливает ошибки при определении группы крови системы АВO. Правильное определение слабых вариантов антигена А может требовать повторных исследований со специфическими реагентами.
Правильное определение слабых вариантов антигена А может требовать повторных исследований со специфическими реагентами.
Снижение или полное отсутствие естественных агглютининов альфа и бета иногда отмечается при иммунодефицитных состояниях:
- новообразования и болезни крови — болезнь Ходжкина, множественная миелома, хроническая лимфатическая лейкемия;
- врождённые гипо- и агаммаглобулинемия;
- у детей раннего возраста и у пожилых;
- иммуносупрессивная терапия;
- тяжёлые инфекции.
Трудности при определении группы крови вследствие подавления реакции гемагглютинации возникают также после введения плазмозаменителей, переливания крови, трансплатации, септицемии и пр.
Наследование групп крови. В основе закономерностей наследования групп крови лежат следующие понятия. В локусе гена АВО возможны три варианта (аллеля) — 0, A и B, которые экспрессируются по аутосомно-кодоминантному типу. Это означает, что у лиц, унаследовавших гены А и В, экспрессируются продукты обоих этих генов, что приводит к образованию фенотипа АВ (IV). Фенотип А (II) может быть у человека, унаследовавшего от родителей два гена А или гены А и 0. Соответственно фенотип В (III) — при наследовании двух генов В или В и 0. Фенотип 0 (I) проявляется при наследовании двух генов 0. Таким образом, если оба родителя имеют II группу крови (генотипы AА или А0), кто-то из их детей может иметь первую группу (генотип 00). Если у одного из родителей группа крови A (II) с возможным генотипом АА и А0, а у другого B (III) с возможным генотипом BB или В0 — дети могут иметь группы крови 0 (I), А (II), B (III) или АВ (IV).
Фенотип А (II) может быть у человека, унаследовавшего от родителей два гена А или гены А и 0. Соответственно фенотип В (III) — при наследовании двух генов В или В и 0. Фенотип 0 (I) проявляется при наследовании двух генов 0. Таким образом, если оба родителя имеют II группу крови (генотипы AА или А0), кто-то из их детей может иметь первую группу (генотип 00). Если у одного из родителей группа крови A (II) с возможным генотипом АА и А0, а у другого B (III) с возможным генотипом BB или В0 — дети могут иметь группы крови 0 (I), А (II), B (III) или АВ (IV).
Желтухи новорожденных
Каждый педиатр, в своей повседневной работе, встречается с желтухой у маленьких детей.
Почти каждая мама столкнется или уже столкнулась с этим явлением у своего ребенка. Что же это такое?
Желтухой называют любое окрашивание кожи и слизистых оболочек в желтый цвет.
Она может встречаться в норме, т.е. быть физиологической, а может являться признаком заболевания, т.е. быть патологической.
Физиологическая желтуха наблюдается у новорожденных детей и является одним из переходных состояний.
Возникают эти переходные состояния из-за того, что ребенок попадает в совершенно другие, по сравнению с внутриутробными, условия существования. Эти состояния отражают процесс приспособления организма ребенка к новым условиям жизни и называются переходными или пограничными, или транзиторными, или физиологическими.
Кроме желтухи к переходным состояниям новорожденного относят еще несколько. Это небольшая потеря первоначальной массы тела ребенка, изменения кожных покровов младенца (покраснение и шелушение кожи), гормональный или половой криз (нагрубание молочных желез, половых органов).
Для всех этих состоянии характерно то, что они появляются во время родов и после рождения и затем сравнительно быстро проходят. Лечения не требуют. Следует отметить, что не все пограничные состояния развиваются у каждого ребенка.
Транзиторное повышение уровня билирубина крови (гипербилирубинемия) развивается у всех новорожденных в связи с особенностями его обмена у только что родившегося ребенка. Желтизна же кожных покровов встречается лишь у 60-70% детей.
Желтизна же кожных покровов встречается лишь у 60-70% детей.
Появление физиологической транзиторной гипербилирубинемии и желтухи объясняется следующими факторами. Эритроциты плода (красные кровяные тельца, которые переносят кислород) живут меньше, чем эритроциты новорожденного ребенка и, следовательно, быстрее разрушаются. При этом образуется большее количество билирубина. Кроме того, в связи с функциональной незрелостью печени билирубин не успевает «перерабатываться». Поэтому организм придумал откладывать лишний билирубин в коже, для того, чтобы потом, постепенно его утилизировать.
Физиологическая желтуха новорожденных наблюдается со второго или третьего дня жизни ребенка, длится не более десяти дней, при этом размеры печени и селезенки остаются нормальными и анализы также соответствуют возрастной норме. В связи с тем, что эта желтуха является физиологической (т.е. нормальной), она проходит самостоятельно и лечения не требует.
Если желтушность кожных покровов появляется в первые сутки после рождения, если она длится более 10 дней, если сопровождается увеличением печени и селезенки, если цифры билирубина очень высокие, то такая желтуха называется патологической и является признаком какого-либо заболевания.
В данной ситуации необходимо в первую очередь исключить гемолитическую болезнь новорожденных. Она встречается при несовместимости крови матери и плода. Например, если у матери резус-фактор отрицательный, а плода положительный развивается резус-конфликт. Это значит, что в организме беременной женщины вырабатываются антитела, которые, проникая в организм плода, вызывают разрушение его эритроцитов, распознавая их, как чужие. Это, в свою очередь сопровождается образованием огромного количества билирубина, что приводит к билирубиновому отравлению организма.
Развитие гемолитической болезни новорожденных сопровождается ухудшением самочувствия ребенка, изменениями в анализах крови, увеличением печени и селезенки.
Лечение гемолитической болезни новорожденных осуществляют в больнице. Направлено оно на скорейшее удаление из организма новорожденного большого количества билирубина и других токсических продуктов распада эритроцитов, а также на удаление материнских антител.
Профилактикой гемолитической болезни новорожденных является детальное обследование беременной женщины. При наличии у матери резус-отрицательной крови а у отца резус-положительной крови необходимо исследовать кровь женщины на наличие резус-антител и определение их количества в течение всей беременности.
При наличии у матери резус-отрицательной крови а у отца резус-положительной крови необходимо исследовать кровь женщины на наличие резус-антител и определение их количества в течение всей беременности.
При своевременно поставленном диагнозе и правильно проведенном лечении дети, перенесшие гемолитическую болезнь новорожденных, хорошо растут и развиваются, не отставая от сверстников.
Кроме того, желтуха встречается при вирусных гепатитах, когда поражаются клетки печени. Пораженные клетки не могут правильно функционировать и перерабатывать нормальные количества билирубина. Сопровождается такая желтуха наличием увеличенной и плотной печени, а также выделением из крови вируса гепатита.
При механической задержке желчи в желчевыделительных протоках развивается механическая патологическая желтуха. Она встречается при аномалиях развития желчных протоков. Для нее характерно наличие обесцвеченного кала и интенсивно окрашенной мочи.
Все эти заболевания требуют детального обследования для уточнения диагноза, наблюдения и лечения в стационаре.
Но очень часто мама сталкивается с тем, что ребенок чувствует себя хорошо, хорошо прибавляет в весе, развивается по возрасту, веселый, активный, а желтуха не проходит ни на одиннадцатый день, ни на двенадцатый. Взволнованная, она обращается за помощью к педиатру, но после детального обследования педиатр не выявляет патологии.
В каких же случаях, не требующих специального лечения, желтушность кожных покровов может затягиваться больше, чем на десять дней?
Прежде всего, это желтуха у недоношенных детей. У них желтуха встречается чаще, чем у доношенных, проявляется ярче и держится более длительно, что связано с еще большей незрелостью всех органов и систем организма.
Кроме того, если во время беременности или во время родов маме вводились какие-то лекарства, то желтуха у новорожденного ребенка также может сохраняться чуть дольше. Это связано с тем, что печень младенца сначала должна обезвредить именно чужеродные лекарства, а свой, менее вредный билирубин, может чуть-чуть подождать.
То же самое наблюдается и в том случае, если женское молоко содержит очень много женских гормонов эстрогенов. Их надо выводить в первую очередь, а билирубин – на потом.
Для того чтобы малыш легче и быстрее приспособился к жизни вне маминого животика, чтобы справился со всеми трудностями, чтобы рос счастливым и здоровым, маме надо быть всегда рядом, держать свою кроху на ручках, обнимать, целовать, гладить, называть нежными словами и, обязательно, кормить маминым молочком.
P.S. Если ваш, уже чуть подросший ребенок, очень любит морковку, тыкву, персиковый и абрикосовый соки и ест эти блюда несколько раз в день, не удивляйтесь, когда увидите, что носик, щеки, ладошки у него стали желтыми. Это каротиновая желтуха. Она не имеет никакого отношения к обмену билирубина. Но тыкву и морковку лучше пока не давать. До тех пор, пока кожа снова не станет обычного цвета.
Гемолитическая болезнь новорожденных – Группы крови и антигены эритроцитов
Гемолитическая болезнь новорожденных (ГБН) раньше была основной причиной потери плода и
смертность среди новорожденных. Считается, что первое описание HDN датируется 1609 годом.
французская акушерка, которая родила близнецов — один ребенок распух и вскоре умер
после рождения у другого ребенка развилась желтуха, и через несколько дней он умер. Для
последующие 300 лет было описано множество подобных случаев, когда новорожденные не
выживать.
Считается, что первое описание HDN датируется 1609 годом.
французская акушерка, которая родила близнецов — один ребенок распух и вскоре умер
после рождения у другого ребенка развилась желтуха, и через несколько дней он умер. Для
последующие 300 лет было описано множество подобных случаев, когда новорожденные не
выживать.
Только в 1950-х годах была выяснена основная причина ГБН; а именно, красные кровяные тельца (эритроциты) новорожденного подвергаются атаке антител из мама.Приступ начинается, когда ребенок еще находится в утробе матери, и вызван несовместимость крови матери и ребенка.
К 1960-м годам испытания в США и Великобритании проверили использование
терапевтические антитела, которые могли бы удалить антитела, вызывающие ГБН, из
кровообращение матери. Испытания показали, что введение терапевтических антител женщинам
во время их беременности в значительной степени предотвратили развитие ГБН (1). К 1970-м годам рутинная дородовая помощь включала
скрининг всех будущих матерей для выявления тех, чья беременность может быть под угрозой
ГБН и соответствующее профилактическое лечение. Это привело к драматическому
снижение частоты ГБН, особенно тяжелых случаев, которые были причиной
для мертворождения и неонатальной смерти.
Это привело к драматическому
снижение частоты ГБН, особенно тяжелых случаев, которые были причиной
для мертворождения и неонатальной смерти.
В этой главе обсуждаются причины ГБН и методы лечения или свести к минимуму, если не предотвратить полностью.
Материнские антитела проникают через плаценту и атакуют эритроциты плода
Во время беременности некоторые материнские антитела транспортируются через плаценту и попадают в кровоток плода. Это необходимо, потому что к моменту рождения новорожденные имеют только примитивную иммунную систему, и постоянное присутствие материнские антитела помогают им выжить, пока их иммунная система созревает.Недостатком этой защиты является то, что, воздействуя на фетальные эритроциты, материнские антитела также могут вызывать ГБН.
Основной причиной ГБН является несовместимость резус-группы крови матери
и плод. Чаще всего гемолитическая болезнь вызывается антигеном D, хотя
другие антигены Rh, такие как c, C, E и e, также могут вызывать проблемы.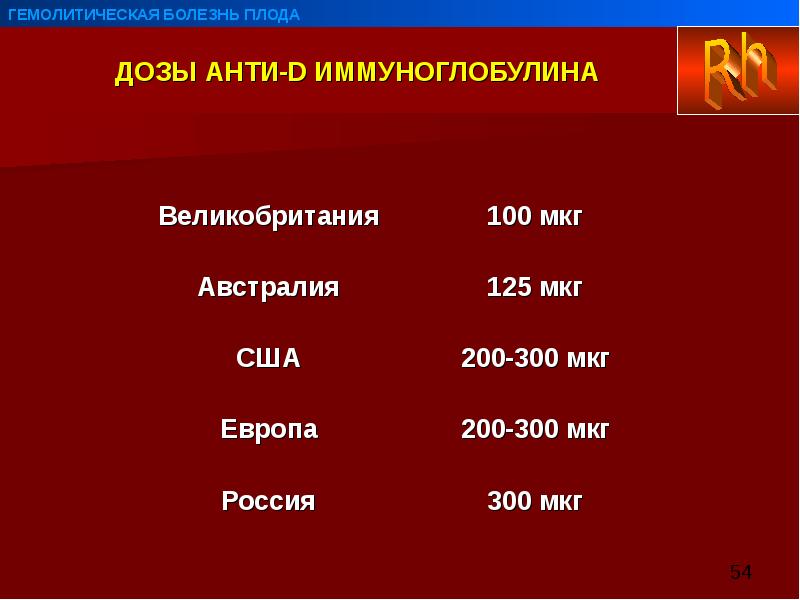
Беременность с риском HND – это беременность, при которой резус-отрицательная мать становится беременных резус-положительным ребенком (ребенок, унаследовавший антиген D от отец).Иммунный ответ матери на антиген D плода должен сформироваться антитела к нему (анти-D). Эти антитела обычно относятся к типу IgG. тип, который транспортируется через плаценту и, следовательно, доставляется к плоду обращение.
ГБН также может быть вызвана несовместимостью группы крови ABO. Оно возникает, когда мать с группой крови 0 беременеет плодом с другой группой крови (тип А, В или АВ). Сыворотка матери содержит встречающиеся в природе анти-А и анти-В, которые, как правило, относятся к классу IgG и поэтому могут проникать через плаценту и гемолиз фетальных эритроцитов.
ГБН из-за несовместимости по системе ABO обычно менее тяжелая, чем резус-несовместимость. Один
Причина в том, что эритроциты плода экспрессируют меньше антигенов групп крови системы АВО по сравнению с
взрослые уровни. Кроме того, в отличие от резус-антигенов группа крови АВО
антигены экспрессируются различными тканями плода (и взрослого человека), уменьшая
вероятность связывания анти-А и анти-В антигенов-мишеней на эритроцитах плода.
Кроме того, в отличие от резус-антигенов группа крови АВО
антигены экспрессируются различными тканями плода (и взрослого человека), уменьшая
вероятность связывания анти-А и анти-В антигенов-мишеней на эритроцитах плода.
Менее распространенные причины ГБН включают антитела, направленные против антигенов Келл группа крови (т.g., анти-K и анти-k), группу крови по Кидду (например, анти-Jka и анти-k). анти-Jkb), группу крови Даффи (например, анти-Fya) и антитела MNS и s группы крови. На сегодняшний день антитела, направленные против групп крови Р и Льюис, не обнаружены. связанные с ГБН.
Сенсибилизация происходит во время первой беременности
Сенсибилизация к антигену возникает, когда иммунная система сталкивается с антигеном для
первый раз и вызывает иммунный ответ. В случае ГБН, вызванной Rh
несовместимости, резус-D-отрицательная мать может сначала столкнуться с D-антигеном, в то время как
при беременности резус-положительным ребенком или при переливании крови
Резус-положительная кровь. После сенсибилизации матери к D-антигену ее сыворотка
будет содержать анти-D. Прямой тест Кумбса (см. ниже) подтверждает наличие
анти-D и, следовательно, мать была сенсибилизирована.
После сенсибилизации матери к D-антигену ее сыворотка
будет содержать анти-D. Прямой тест Кумбса (см. ниже) подтверждает наличие
анти-D и, следовательно, мать была сенсибилизирована.
Лишь небольшое количество крови плода должно попасть в кровоток матери для иметь место сенсибилизация. Как правило, это происходит во время родов первенца. Rh D-положительный ребенок. Кровотечение у плода и матери часто встречается во время родов и увеличивается во время затяжных или осложненных родов, что, в свою очередь, увеличивает риск сенсибилизации.Сенсибилизация может произойти и на ранних сроках беременности, например во время внутриутробного кровотечения или выкидыша. Это также может произойти во время медицинских процедуры, такие как прерывание беременности или взятие проб ворсин хориона.
Риск сенсибилизации к антигену Rh D снижается, если плод относится к группе ABO
несовместимый. Это связано с тем, что любые эмбриональные клетки, попадающие в материнскую
быстро разрушаются мощными материнскими анти-А и/или анти-В, уменьшая
вероятность контакта матери с антигеном D.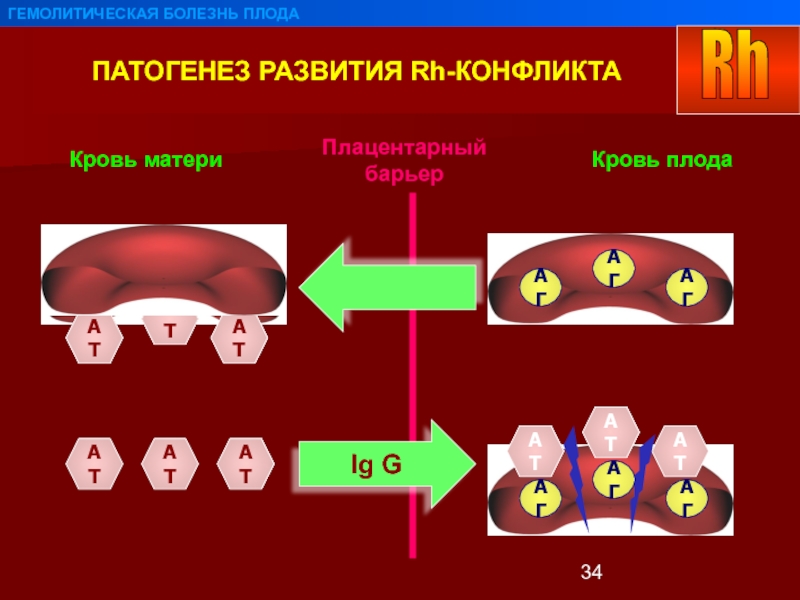
ГБН возникает при последующих беременностях
Первоначально материнские анти-D, которые образуются во время сенсибилизации IgM типа, которые не могут проникать через плаценту. При последующих беременностях повтор встреча с антигеном Rh D стимулирует быструю выработку анти-D типа IgG, которые могут транспортироваться через плаценту и попадать в кровоток плода. Один раз в кровотоке плода анти-D прикрепляются к антигенам RhD, обнаруженным на плодах. эритроцитов, помечая их как подлежащие уничтожению.
Скорость гемолиза определяет, является ли ГБН легкой, умеренной или тяжелая форма. В легких случаях небольшое увеличение скорости гемолиза переносится больными. плод. При рождении и в период новорожденности симптомы включают легкую анемию. и желтуха, которые могут пройти без лечения.
В случаях, когда имеется большее увеличение скорости гемолиза, уровень
билирубин может оставаться низким во время беременности из-за способности
плаценты для выведения билирубина из кровотока плода. Однако после рождения
незрелая печень новорожденного не способна метаболизировать повышенное количество билирубина
который вместо этого накапливается в его или ее крови. В течение 24 часов после рождения уровень
билирубин может резко возрасти. Если уровень продолжает повышаться, билирубин может попасть в
головного мозга, чтобы вызвать ядерную желтуху, потенциально смертельное состояние, которое оставляет навсегда
неврологические нарушения у выживших детей.
Однако после рождения
незрелая печень новорожденного не способна метаболизировать повышенное количество билирубина
который вместо этого накапливается в его или ее крови. В течение 24 часов после рождения уровень
билирубин может резко возрасти. Если уровень продолжает повышаться, билирубин может попасть в
головного мозга, чтобы вызвать ядерную желтуху, потенциально смертельное состояние, которое оставляет навсегда
неврологические нарушения у выживших детей.
Еще более быстрое и продолжительное разрушение эритроцитов приводит к тяжелой анемии в
плод.Печень, селезенка и другие органы увеличивают выработку эритроцитов до
компенсировать их потерю. Стремление производить эритроциты заставляет печень и селезенку
увеличение размеров (гепатоспленомегалия) и нарушение функции печени. Незрелый
Эритроциты (эритробласты) попадают в кровоток, отсюда и альтернативное название
этого заболевания, эритробластоз плода. Осложнением тяжелой ГБН является водянка.
fetalis, при котором ткани плода становятся отечными (отечными). Это условие
обычно со смертельным исходом, внутриутробно или вскоре после рождения.
Это условие
обычно со смертельным исходом, внутриутробно или вскоре после рождения.
Реакция Кумбса для выявления резус-несовместимости между матерью и плодом
Для выявления ГБН необходимо определить наличие у матери анти-Rh IgG. В vivo эти антитела разрушают Rh D-положительные эритроциты плода, но в vitro , они не лизируют клетки и даже не вызывают агглютинацию, делая их трудно определить. Поэтому используется тест Кумбса. В этом тесте используются антитела которые связываются с анти-D-антителами. Тест назван в честь Робина Кумбса, который первым разработали методику использования антител, направленных против других антитела.
Прямой тест Кумбса: диагностика ГБН
Прямой тест Кумбса выявляет материнские анти-D-антитела, которые уже связались к эритроцитам плода.
Сначала образец фетальных эритроцитов промывают для удаления любых несвязанных антител (Ig). Когда
добавляют тестовые антитела (анти-Ig), они агглютинируют любые эритроциты плода до
какие материнские антитела уже связаны.
Этот тест называется прямым тестом Кумбса, поскольку анти-Ig связывается «напрямую» с материнские анти-D Ig, покрывающие эритроциты плода при ГБН.
Непрямой тест Кумбса: используется для профилактики ГБН
Непрямой тест Кумбса обнаруживает анти-D-антитела в сыворотке крови матери. Если эти должны были вступить в контакт с эритроцитами плода, они вызывали их гемолиз и, следовательно, вызвать ГБН. Обнаружив материнский анти-D до того, как эритроциты плода подверглись атаке, Лечение может быть назначено для предотвращения или ограничения тяжести ГБН.
Для этого теста сыворотку матери инкубируют с Rh D-положительными эритроцитами. Если есть анти-D присутствуют в сыворотке матери, они будут связываться с клетками.Клетки затем промывают для удаления всех свободных антител. Когда анти-Ig антитела Кроме того, они будут агглютинировать любые эритроциты, с которыми связаны материнские антитела.
Это называется непрямой реакцией Кумбса, потому что анти-Ig находит «непрямую»
наличие вредных материнских антител, требующих добавления фетальных эритроцитов к
показывают способность материнского анти-D связываться с эритроцитами плода.
См. схему прямого и непрямого тестов Кумбса в Janeway & Траверс Иммунобиология
Профилактика ГБН
Определение резус-статуса матери
В рамках плановой дородовой или дородовой помощи определяется группа крови матери (система ABO и Rh) определяется по анализу крови.Тест на наличие атипичных антител в сыворотке крови матери. В настоящее время RhD несовместимость является единственной причиной ГБН, для которой скрининг является рутинным.
В США частота Rh D-отрицательного статуса колеблется примерно от 17% у европеоидов примерно до 7% у латиноамериканцев и чернокожих. Частота намного ниже у лиц азиатского происхождения (включая выходцев из Китая, Индии и Японии), в среднем около 2% (2).
Если мать не сенсибилизирована, снизить риск сенсибилизации в будущем D проводится непрямой тест Кумбса (см. выше).Если анти-D не обнаружен в сыворотке матери вполне вероятно, что она не была сенсибилизирована к резус-фактору D. антиген.
Риск будущей сенсибилизации может быть значительно снижен, если
несенсибилизированные матери анти-D Ig, которые «вытирают» любые фетальные эритроциты, которые могут иметь
просачивается в материнский кровоток, снижая риск первого контакта
к антигену D.
Обычно резус-отрицательные матери получают инъекцию анти-D Ig примерно в 28 лет. недель беременности, то есть примерно в то время, когда эритроциты плода начинают экспрессировать D антиген, и матери получают еще одну дозу примерно в 34 недели, за несколько недель до начинаются роды, во время которых высок риск фетоматеринского кровотечения.Финал доза анти-D Ig вводится после родов. Кроме того, анти-D Ig назначают для покрытия других событий во время беременности, которые могут привести к сенсибилизация, например, дородовые кровотечения и преэклампсия.
Этот профилактический режим против резус-сенсибилизации эффективен. Тем не мение, в настоящее время не существует рутинной профилактики ГБН, вызванной несовместимостью антигены других групп крови.
Если мать сенсибилизирована, определите, находится ли плод в группе риска, и контролировать соответственно
Как только наличие материнского анти-D было подтверждено, следующим шагом будет
определить, являются ли эритроциты плода мишенью, т. е.д., подтвердите резус-статус
плод. Если отец гомозиготен по аллелю D (D/D), плод будет
Д положительный. Однако, если отец гетерозиготен (D/d), вероятность 50:50
что плод D-положительный, и единственный способ точно узнать группу крови
заключается в тестировании образца клеток плода, взятого из амниотической жидкости или пуповины.
шнур.
е.д., подтвердите резус-статус
плод. Если отец гомозиготен по аллелю D (D/D), плод будет
Д положительный. Однако, если отец гетерозиготен (D/d), вероятность 50:50
что плод D-положительный, и единственный способ точно узнать группу крови
заключается в тестировании образца клеток плода, взятого из амниотической жидкости или пуповины.
шнур.
Если плод резус-положительный, беременность тщательно контролируется на наличие признаков HDN. Мониторинг включает регулярное УЗИ плода и мониторинг количество анти-D в сыворотке крови матери.На активный гемолиз указывает рост анти-D. Если анализ крови плода подтверждает анемию плода, в зависимости от ее степени тяжести можно сделать переливание крови внутриутробно для замены лизированные фетальные эритроциты.
Переливание крови также может потребоваться для коррекции анемии в период новорожденности.
В этот период также может наблюдаться резкий подъем уровня билирубина в
у новорожденных, который можно снизить с помощью фототерапии и обменных трансфузий.
Каталожные номера
- 1.
- Урбаниак С.Дж., Грейсс М.А. RhD-гемолитическая болезнь плода и новорожденного. Blood Rev. 2000; 14:44–61. [PubMed: 10805260]
- 2.
- Гарратти Г., Глинн С.А., Макинтайр Р. Частоты фенотипов ABO и Rh(D) разных расовые/этнические группы в США. Переливание. 2004;44:703–6. [PubMed: 15104651]
ГЕМОЛИЗ И ГИПЕРБИЛИРУБИНЕМИЯ У НОВОРОЖДЕННЫХ ПО ГЕТЕРОСПЕЦИФИЧЕСКОЙ ГРУППЕ КРОВИ
J Pediatr. Авторская рукопись; доступно в PMC 2011 1 ноября.
Опубликовано в окончательной редакции как:
PMCID: PMC2951500
NIHMSID: NIHMS209003
Michael Kaplan, MB, ChB, Cathy Hammerman, MD, Hendrik KnScen, PhD, David B, and Ronald J Wong , доктор медицинских наук.Отделение неонатологии Медицинского центра Шааре Цедек и медицинский факультет Еврейского университета, Иерусалим, Израиль; Кафедра педиатрии, Медицинский факультет Стэнфордского университета, Стэнфорд, Калифорния
Для корреспонденции: д-р Майкл Каплан, кафедра неонатологии, Медицинский центр Шааре Цедек, а/я 3235, Иерусалим, Израиль. Телефон: 972-2-655 5643, факс: 972-2-655 5998, li.ca.ijuh.cc@nalpakОкончательная редакция этой статьи, опубликованная издателем, доступна по адресу J Pediatr См. другие статьи в PMC, в которых цитируется опубликованная статья.
Телефон: 972-2-655 5643, факс: 972-2-655 5998, li.ca.ijuh.cc@nalpakОкончательная редакция этой статьи, опубликованная издателем, доступна по адресу J Pediatr См. другие статьи в PMC, в которых цитируется опубликованная статья.Резюме
Цель
Мы провели количественную оценку гемолиза и определили частоту гипербилирубинемии у новорожденных с положительным титром прямого антиглобулина (DAT), гетероспецифических по системе АВО, и сравнили переменные в подгруппах О-А и О-В. Дизайн исследования Общий билирубин плазмы (ПТБ) определяли перед выпиской и чаще, если это было клинически обосновано, у новорожденных с положительной реакцией на DAT, группы крови А или В от матерей группы О.Катаболизм гема (и, следовательно, производство билирубина) индексировали по карбоксигемоглобину крови с поправкой на вдыхаемый монооксид углерода (COHbc). Гипербилирубинемия определялась как любая концентрация PTB> 95-го процентиля на номограмме билирубина, специфичной для каждого часа жизни.
Результаты
Из 164 новорожденных 111 были O-A и 53 O-B. В целом, у 85 (51,8%) развилась гипербилирубинемия, которая, как правило, была более распространена у новорожденных с О-В, чем у новорожденных с О-А (62,3% против 46,8% соответственно, p = 0,053). Важно отметить, что у большего количества новорожденных с О-В, чем у новорожденных с О-А, гипербилирубинемия развивалась менее чем через 24 часа (93.9% против 48,1%, р<0,0001). Значения COHbc были глобально выше, чем наши ранее опубликованные значения для новорожденных. Младенцы, у которых развилась гипербилирубинемия, имели более высокие значения COHbc, чем уже высокие значения у детей без гипербилирубинемии, а новорожденные с OB, как правило, имели более высокие значения, чем сверстники с O-A.
Выводы
DAT положительный, гетероспецифичность системы ABO связана с повышенным гемолизом и высокой частотой неонатальной гипербилирубинемии. Гетероспецифичность OB имеет тенденцию приводить к еще более высокому риску, чем аналоги O-A.
Ключевые слова: Прямой антиглобулиновый титр, билирубин, гетероспецифичность АВО, гемолиз, гипербилирубинемия, карбоксигемоглобин . Гемолиз возникает, когда антитела анти-А или анти-В материнского иммуноглобулина G проникают через плаценту и прикрепляются к соответствующему антигенному участку на неонатальных эритроцитах. Результирующий катаболизм гема увеличивает продукцию билирубина.На каждую полученную молекулу билирубина образуется эквимолекулярное количество окиси углерода (СО). Количественное определение карбоксигемоглобина (COHb) может указывать на скорость образования билирубина (2).
Прямой тест на титр антиглобулинов (DAT) считается краеугольным камнем диагностики иммуногемолитической болезни новорожденных (1). В некоторых сообщениях предполагается, что этот тест может быть лишь слабым предиктором тяжелой гипербилирубинемии (3,4) и лишь изредка встречается у младенцев, повторно госпитализированных по поводу желтухи (5).Однако эти сообщения контрастируют с известными случаями гетероспецифичности системы АВО в недавних сообщениях о тяжелой гипербилирубинемии и/или билирубиновой энцефалопатии (6–9). Кроме того, несовместимость группы крови с положительным DAT указана Подкомитетом по гипербилирубинемии Американской академии педиатрии (AAP) как основной фактор риска развития тяжелой гипербилирубинемии, а также как фактор риска нейротоксичности (10,11). Таким образом, гетероспецифичность системы АВО может иметь серьезные последствия.
Кроме того, несовместимость группы крови с положительным DAT указана Подкомитетом по гипербилирубинемии Американской академии педиатрии (AAP) как основной фактор риска развития тяжелой гипербилирубинемии, а также как фактор риска нейротоксичности (10,11). Таким образом, гетероспецифичность системы АВО может иметь серьезные последствия.
Для регистрации динамики билирубина в первые дни жизни для определения гипербилирубинемии использовали 95 90 147 th 90 148 перцентиль на часовой специфической номограмме жизни (12–15). Кроме того, концентрация общего билирубина выше этого процентиля может указывать на тяжелую гипербилирубинемию. Нашей целью было переоценить вклад положительной АВО-гетероспецифичности DAT в неонатальную гипербилирубинемию путем оценки частоты желтухи с использованием этого нового определения гипербилирубинемии.Далее мы оценили частоту возникновения гипербилирубинемии менее 24 часов, что может свидетельствовать о гемолизе (10), и сравнили риск гемолиза и гипербилирубинемии между подгруппами О-А и О-В. Мы количественно определили степень гемолиза путем измерения COHb в крови с поправкой на вдыхаемый (окружающий) CO (COHbc) (2).
Мы количественно определили степень гемолиза путем измерения COHb в крови с поправкой на вдыхаемый (окружающий) CO (COHbc) (2).
МЕТОДЫ
Исследование было одобрено Институциональным наблюдательным советом Медицинского центра Шаарей Цедек. Из-за доброкачественного характера исследования, которое не включало рандомизацию или введение исследуемого препарата, требовалось только устное согласие родителей.Клиническое крыло исследования проводилось в детских дошкольных учреждениях Медицинского центра Шаарей Цедек с января 2006 г. по апрель 2007 г. Образец последовательных (за исключением условий, указанных ниже) детей с положительной группой крови А или В, которые были родившиеся на сроке гестации ≥37 недель от матерей с группой крови О, были отобраны для включения в исследование вскоре после рождения и. Чтобы избежать какой-либо систематической ошибки включения, пациенты были включены до того, как стали доступны какие-либо результаты общего билирубина плазмы (ПТБ). Новорожденные с любым очевидным состоянием, которое может усилить желтуху, за исключением несовместимости по системе АВО, например, тяжелые кровоподтеки, сепсис, синдром Дауна, дефицит глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) или положительный результат DAT по любой причине, кроме изоиммунизации по системе АВО , были исключены. Точно так же DAT-положительные, гетероспецифические по системе ABO новорожденные, которые также были Rh-положительными и рождены от резус-отрицательных матерей, были исключены из-за сложности дифференциации положительного DAT, вызванного Rh-изоиммунизацией, от такового, вызванного ABO-гетероспецифичностью. Новорожденных не привлекали к исследованию в выходные, светские или религиозные праздники.
Точно так же DAT-положительные, гетероспецифические по системе ABO новорожденные, которые также были Rh-положительными и рождены от резус-отрицательных матерей, были исключены из-за сложности дифференциации положительного DAT, вызванного Rh-изоиммунизацией, от такового, вызванного ABO-гетероспецифичностью. Новорожденных не привлекали к исследованию в выходные, светские или религиозные праздники.
Ранее было описано рутинное ведение младенцев, рожденных от матерей с группой крови O в Медицинском центре Шааре Цедек (16). Тесты группы крови и DAT регулярно проводились на пуповинной крови всех детей, рожденных от матерей с группой крови O.Результаты были доступны в течение 24 часов после родов, а часто и раньше.
Новорожденных визуально оценивали на наличие желтухи при поступлении в родильное отделение и впоследствии не реже одного раза за смену кормящих. Тестирование PTB проводилось у любого новорожденного с желтухой, появляющейся в течение первых 24 часов и после этого периода времени, как это было клинически оправдано. Во время рутинного метаболического скрининга перед выпиской у младенцев, положительных на DAT, определяли ПТБ.
Во время рутинного метаболического скрининга перед выпиской у младенцев, положительных на DAT, определяли ПТБ.
Все результаты PTB наносились на номограмму билирубина по часам жизни, определялись процентиль и категория риска.Фототерапия для DAT-позитивных младенцев была назначена в соответствии с рекомендациями AAP 2004 г. для новорожденных с факторами риска (10). После выписки при необходимости в нашей больнице в амбулаторных условиях проводилось последующее определение ПТБ. Показания к последующему наблюдению были основаны на категории риска, определяемой концентрацией PTB перед выпиской, в соответствии с рекомендациями Израильского неонатального общества по ведению неонатальной гипербилирубинемии и профилактике ядерной желтухи (17).
Забор крови для определения COHb был выполнен перед выпиской во время рутинного метаболического скрининга.Одновременно с отбором проб COHb была взята проба воздуха из детской комнаты, в которой находился ребенок, для анализа CO. Время метаболического скрининга соответствовало выборке COHb у новорожденных от курящих матерей, потому что через 48 часов курение больше не должно было влиять на концентрацию COHb у новорожденных (18).
COHb
Кровь для определения COHb (150 мкл) собирали в специально подготовленные капиллярные пробирки, содержащие гепарин и сапонин, предоставленные Стэнфордским университетом.Заполненные пробирки запечатывали, содержимое перемешивали, хранили при температуре -18°C и отправляли на влажном льду в Стэнфордский университет. COHb определяли в процентах от общего гемоглобина (tHb) в одной партии методом газовой хроматографии (18). Последний уровень tHb измеряли в том же образце крови методом цианметгемоглобина (18). Коэффициенты внутридневной и междневной вариации для этого метода для эталонных образцов крови составляют 3% и 8% соответственно. Содержание СО в пробах окружающего воздуха измеряли в Медицинском центре Шааре Зедек с помощью анализатора СО, предоставленного для этой цели Стэнфордским университетом, и измеряли значения СОHb с поправкой на CO вдыхаемого воздуха для получения СОHbc, как описано (18).
Ранее опубликованные значения COHbc и tHb для новорожденных из этого роддома, которые были проанализированы с использованием той же методологии и в лаборатории Стэнфордского университета, предоставлены для сравнения. У контрольных новорожденных не было DAT-позитивных или дефицитных G-6-PD (19,20).
У контрольных новорожденных не было DAT-позитивных или дефицитных G-6-PD (19,20).
DAT и группа крови
Тестирование DAT проводилось в плановом порядке в банке крови Медицинского центра Шаарей Цедек на пуповинной крови с использованием метода агглютинации и оценивалось по шкале от ± до ++++ [DiaMed-IDMicroTyping System, ID -Карта «LISS/Coombs» (DiaMed AG, Cressier s/Morat, Швейцария)].Типирование групп крови проводилось рутинно по пуповинной крови с использованием стандартных методов банка крови.
Общий билирубин плазмы
Обычные тесты на ПТБ измеряли на гепаринизированных, центрифугированных образцах капиллярных трубок по поглощению билирубина при 455 нм (NEO BIL Model A2 [Digital and Analog Systems, Rome, Italy]).
Анализ данных
Гипербилирубинемия определялась как любое значение PTB >95 th процентиля на номограмме по часам жизни (12).
Значения COHbc, tHb и факторы, относящиеся к гипербилирубинемии, сравнивались между подгруппами O-A и O-B, а также внутри подгрупп между новорожденными с гипербилирубинемией и без нее. Категориальные переменные сравнивались с использованием анализа χ 2 . Непрерывные переменные с нормальным распределением сравнивались с использованием критерия Стьюдента t , а в других случаях использовался критерий суммы рангов Манна-Уитни. Частоту гипербилирубинемии сравнивали путем расчета относительного риска (95% доверительный интервал), в этом случае значимость определялась как 95% доверительный интервал, не включающий 1.Для других сравнений значимость определялась как значение р<0,05.
Категориальные переменные сравнивались с использованием анализа χ 2 . Непрерывные переменные с нормальным распределением сравнивались с использованием критерия Стьюдента t , а в других случаях использовался критерий суммы рангов Манна-Уитни. Частоту гипербилирубинемии сравнивали путем расчета относительного риска (95% доверительный интервал), в этом случае значимость определялась как 95% доверительный интервал, не включающий 1.Для других сравнений значимость определялась как значение р<0,05.
РЕЗУЛЬТАТЫ
В период с января 2006 г. по апрель 2007 г. были зарегистрированы 164 новорожденных с положительной реакцией на DAT, группы крови A или B, рожденные от матерей с группой крови O (). В целом, у 85 (51,8%) значение PTB> 95-го процентиля для часа жизни в любой момент времени. Возраст первого ПТБ > 95-го процентиля составлял 19 ± 11 часов (диапазон 1–48 часов, еще один новорожденный был повторно госпитализирован в возрасте 80 часов) с соответствующим ПТБ 9,9 ± 2,5 мг/дл (диапазон 5. 1–17,8 мг/дл). Ранняя гипербилирубинемия (ПТБ >95-го процентиля в течение первых 24 часов) была отмечена у 56 (34,1% когорты, 66,7% лиц с гипербилирубинемией) и у 27/56 (48,2%) ПТБ >95-го процентиля было зарегистрировано в течение первых 12 часов. часы. Среднее значение (SD) PTB для первого показания >95 th процентиль для группы ≤24 часов составило 8,9 ± 1,9 мг/дл, а для подгруппы ≤12 часов — 8,4 ± 1,9 мг/дл. Из оставшихся 29 новорожденных с гипербилирубинемией у всех, кроме 1, гипербилирубинемия развилась в период от 25 до 48 часов (31 ± 6 часов).Фототерапия проводилась 80 новорожденным всей группы при средней концентрации ПТБ 10,6 ± 3,0 мг/дл в среднем возрасте 22 ± 17 часов. Из 53 пациентов с гипербилирубинемией в возрасте ≤24 часов фототерапия была назначена 51 (средний PTB 9,2 ± 2,0 мг/дл в возрасте 13 ± 8 часов). Все новорожденные ответили на фототерапию. Никто не нуждался во внутривенной инфузии иммуноглобулина или обменном переливании крови.
1–17,8 мг/дл). Ранняя гипербилирубинемия (ПТБ >95-го процентиля в течение первых 24 часов) была отмечена у 56 (34,1% когорты, 66,7% лиц с гипербилирубинемией) и у 27/56 (48,2%) ПТБ >95-го процентиля было зарегистрировано в течение первых 12 часов. часы. Среднее значение (SD) PTB для первого показания >95 th процентиль для группы ≤24 часов составило 8,9 ± 1,9 мг/дл, а для подгруппы ≤12 часов — 8,4 ± 1,9 мг/дл. Из оставшихся 29 новорожденных с гипербилирубинемией у всех, кроме 1, гипербилирубинемия развилась в период от 25 до 48 часов (31 ± 6 часов).Фототерапия проводилась 80 новорожденным всей группы при средней концентрации ПТБ 10,6 ± 3,0 мг/дл в среднем возрасте 22 ± 17 часов. Из 53 пациентов с гипербилирубинемией в возрасте ≤24 часов фототерапия была назначена 51 (средний PTB 9,2 ± 2,0 мг/дл в возрасте 13 ± 8 часов). Все новорожденные ответили на фототерапию. Никто не нуждался во внутривенной инфузии иммуноглобулина или обменном переливании крови.
Таблица 1
Демографические данные о новорожденных, указанные для всей группы и подгрупп O-A и OB.
| Всего | OA | OB | OA | значение OA против OB|||
|---|---|---|---|---|---|---|
| Количество новорожденных (N) | 164 | 111 (67,7%) | 53 (32,3%) | |||
Вес при рождении (GM. Среднее ± SD) Среднее ± SD) | 3401 ± 425 | 3434 ± 450 | 3434 ± 450 | 3342 ± 359 | p = 0,2 | |
| Гестационный возраст (WKS) | 39 ± 1 | 39 ± 1 | 39 ± 1 | p=1 | ||
| Самцы (%) | 44 | 47 | 41 | 6 90. 6 6 | ||
| Cesesaran Section (%) | 10 | 9 | 11 | P = 0,9 | ||
| Кормление грудью (эксклюзивный или частичный) (%) | 88 | 89 | 85 | P = 0.6 | ||
| Материнское курение (%) | 4 | 4 | 6 | p = 0,8 | ||
| еврейский: араб (N) | 150 (92%): 14 (8%) | 104 (93%): 7 (7%) | 46 (87%): 7 (13%) | р=0. 7 7 |
Сравнение между подгруппами O-A и OB представлено в . Хотя в подгруппе OB наблюдалась тенденция к более высокому риску развития гипербилирубинемии в целом, у значительно большего числа новорожденных с OB развилась гипербилирубинемия в течение 1 ч 24 часов, чем в группе O-A. Возраст, в котором было отмечено первое значение PTB> 95 th процентилей, был более ранним у новорожденных OB. Точно так же существовала тенденция к более раннему началу фототерапии у OB новорожденных.
Таблица 2
Сравнение гипербилирубинемии и потребности в фототерапии у новорожденных с гетероспецифичностью O-A и O-B.
| категория | OA | OB | | |
|---|---|---|---|---|
| Количество младенцев | 111 | 53 | ||
| Гипербилирубинемия (N) (относительный риск, 95% доверительный интервал) | 52 (46,8%) | 33 (62,3%) | РУБ 1. 34, 95% CI 0,99-1.77, p = 0,053 99-1.77, p = 0,053 99-1.77, p = 0,053 99-1.77 34, 95% CI 0,99-1.77, p = 0,053 99-1.77, p = 0,053 99-1.77, p = 0,053 99-1.77 | |
| Возраст на 1 st PTB> 95 -й Кредил (H) (среднее ± SD) | 20,6-11,5 | 15,3 ± 9,8 * | p = 0,035 | |
| Гипербилирубинемия в пределах 1 ST 24 HR (N) | 25/52 (48,1%) | 31/33 (93,9%) * | P <0.0001 | |
| 1 ST PTB >95 th центиль (мг/дл) | 10,2 ± 2,6 | 9,3 ± 1,9 | р=0. 17 17 | |
| Фототерапия (N) | 48 (43,2%) | 33 (62,3%) | P = 0,14 | |
| Возраст, на которой начался фототерапия (H) [медиана (межступный диапазон)] | 21,5 (12-32) | 17 (7-27) | 17 (7-27) | p = 0,07 |
| PTB на начало фототерапии (мг / дл) | 11,2 ± 3,2 | 9,8 ± 2.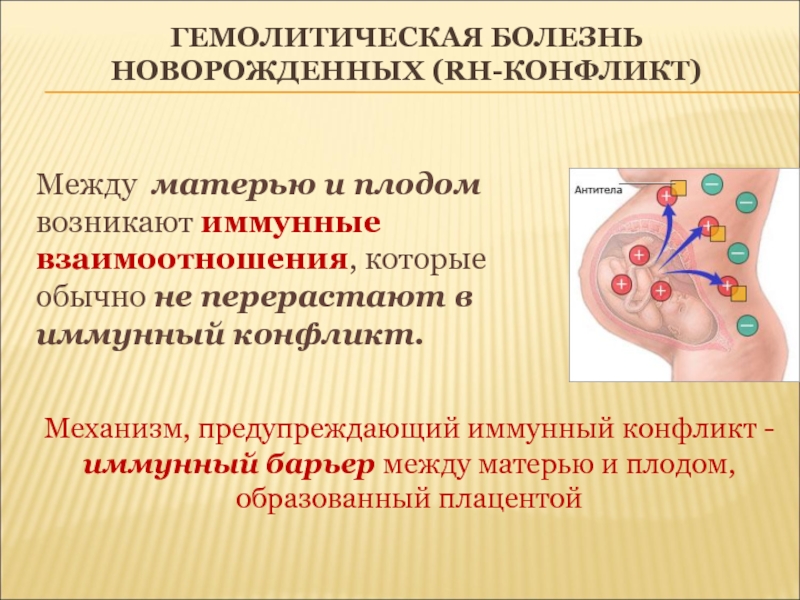 4 * 4 * | p = 0,04 |
Исследования COHbc для всей когорты, а также для подгрупп OA и OB представлены в .В целом значения COHbc были значительно выше, чем у ранее зарегистрированной когорты новорожденных (19). Как во всей когорте, так и в подгруппах О-А и О-В у тех, у кого развилась гипербилирубинемия, были более высокие значения COHbc, чем и без того высокие значения у тех, у кого не было документально подтвержденного значения PTB >95 th процентиль. Кроме того, процент новорожденных, у которых развилась гипербилирубинемия, увеличивался в тандеме с увеличением процентильных значений COHbc (). Для подгруппы O-B наблюдалась тенденция к тому, что значения COHbc были выше, чем уже высокие уровни подгруппы O-A.
Частота гипербилирубинемии, определяемая как любое значение общего билирубина в плазме >95 й процентиль на номограмме удельного билирубина по часам жизни, классифицированное по скорректированному значению процентиля карбоксигемоглобина (COHbc).
Диапазоны процентилей COHbc (% tHb): <50 th процентили, 0,54–1,19; 50–74 -й -й процентиль, 1,20–1,44; 75–90 -й -й процентиль, 1,45–1,76; >90 й процентиль, 1,79–2,62
Таблица 3
Значения карбоксигемоглобина в крови, с поправкой на СО вдыхаемого воздуха (COHbc) для всей гетероспецифической группы АВО и для подгрупп О-А и ОВ в отдельности.Для справки включены значения COHbc для ранее зарегистрированных здоровых новорожденных без гемолиза (19).
| COHBC (% THB) | целый ABO Group | OA | OA | OB | Reference Group | ||
|---|---|---|---|---|---|---|---|
| N = | 111 | 53 | 131 | ||||
| COHbc (среднее ± стандартное отклонение) | 1. 24 ± 0,40* 24 ± 0,40* | 1,20 ± 0,38 | 1,32 ± 0,44 1 | 0,77 ± 0,19 | *p<0,0001, вся группа по сравнению с контрольной группой; 1 p = 0,07, ob vs. oa | ||
| 9 | |||||||
| N = | 85 | 52 | 33 | ||||
| COHBC | 1. 42 ± 0,39 42 ± 0,39 | 1,40 ± 0,36 | 1,45 ± 0.45 | ||||
| N = | 98 | 59 | 9 | ||||
| COHBC | 1,00 ± 0,25 | 0. 99 ± 0.26 99 ± 0.26 | 1.04 ± 0.24 | ||||
| Главное | P <0.001 | p <0,001 | p = 0,002 | ||||
Значения THB были 17.4 ± 2,9 г/дл для когорты. Они были ниже наших ранее зарегистрированных референтных значений (19,0 ± 2,4 г/дл, p<0,001) (20). В гетероспецифической когорте ABO значения tHb у новорожденных с гипербилирубинемией были ниже, чем у новорожденных без гипербилирубинемии (16,9 ± 2,9 г/дл против 18,2 ± 2,7 г/дл, p = 0,007). Даже у тех гетероспецифических по системе АВО новорожденных, у которых не развилась гипербилирубинемия, значения tHb были ниже, чем в контрольной группе. Несмотря на то, что значения tHb были несколько ниже у новорожденных OB, разница между ними и группой O-A была незначительной (17.0 ± 3,1 г/дл против 17,7 ± 2,8 г/дл, p = 0,2).
В гетероспецифической когорте ABO значения tHb у новорожденных с гипербилирубинемией были ниже, чем у новорожденных без гипербилирубинемии (16,9 ± 2,9 г/дл против 18,2 ± 2,7 г/дл, p = 0,007). Даже у тех гетероспецифических по системе АВО новорожденных, у которых не развилась гипербилирубинемия, значения tHb были ниже, чем в контрольной группе. Несмотря на то, что значения tHb были несколько ниже у новорожденных OB, разница между ними и группой O-A была незначительной (17.0 ± 3,1 г/дл против 17,7 ± 2,8 г/дл, p = 0,2).
ОБСУЖДЕНИЕ
Среди новорожденных, доставленных в Медицинский центр Шаарей Цедек, 21% составляют новорожденные с группой крови А или В, рожденные от матерей с группой О, из которых 15% являются DAT-позитивными (16). В настоящем исследовании мы зафиксировали 52% случаев гипербилирубинемии в подгруппе с положительным результатом на DAT. Эта заболеваемость явно во много раз выше, чем у других групп населения, изучаемых с использованием идентичного определения гипербилирубинемии. Например, в многоцентровом многонациональном исследовании 1370 новорожденных 8.у 8% развилась гипербилирубинемия (13). В когорте афроамериканцев гипербилирубинемия была зарегистрирована у 6,7% из 436 нормальных, контрольных новорожденных с Г-6-ФД и у 21,9% из 64 новорожденных с дефицитом Г-6-ФД (14). Еще одним дополнением к высокому риску у этих детей является высокая частота гипербилирубинемии, возникающей в течение первых 24 часов. Однако почти у всех детей, у которых развилась гипербилирубинемия, она развилась в течение первых 48 часов, что подразумевает небольшой риск последующей гипербилирубинемии у тех, кто был выписан после этого периода времени.Многие дети имели сочетание состояний, перечисленных ААР как основные факторы риска развития тяжелой гипербилирубинемии: уровень билирубина перед выпиской в зоне высокого риска; гемолиз из-за несовместимости группы крови с положительным DAT; желтуха, появляющаяся в течение первых 24 часов, и исключительно грудное вскармливание (10).
Например, в многоцентровом многонациональном исследовании 1370 новорожденных 8.у 8% развилась гипербилирубинемия (13). В когорте афроамериканцев гипербилирубинемия была зарегистрирована у 6,7% из 436 нормальных, контрольных новорожденных с Г-6-ФД и у 21,9% из 64 новорожденных с дефицитом Г-6-ФД (14). Еще одним дополнением к высокому риску у этих детей является высокая частота гипербилирубинемии, возникающей в течение первых 24 часов. Однако почти у всех детей, у которых развилась гипербилирубинемия, она развилась в течение первых 48 часов, что подразумевает небольшой риск последующей гипербилирубинемии у тех, кто был выписан после этого периода времени.Многие дети имели сочетание состояний, перечисленных ААР как основные факторы риска развития тяжелой гипербилирубинемии: уровень билирубина перед выпиской в зоне высокого риска; гемолиз из-за несовместимости группы крови с положительным DAT; желтуха, появляющаяся в течение первых 24 часов, и исключительно грудное вскармливание (10).
Соответственно большое количество новорожденных соответствовало требованиям фототерапии. Мы не можем предсказать динамику билирубина, если бы фототерапия не была назначена при низких концентрациях PTB в соответствии с рекомендациями AAP.Возможно, что у некоторых новорожденных концентрация билирубина в сыворотке стабилизировалась и не соответствовала критериям фототерапии в более позднем возрасте (3,21).
Мы не можем предсказать динамику билирубина, если бы фототерапия не была назначена при низких концентрациях PTB в соответствии с рекомендациями AAP.Возможно, что у некоторых новорожденных концентрация билирубина в сыворотке стабилизировалась и не соответствовала критериям фототерапии в более позднем возрасте (3,21).
Учитывая, что ядерная желтуха встречается редко, а обменное переливание крови в настоящее время редкость, неудивительно, что, несмотря на высокую частоту гипербилирубинемии, мы не встретили случаев такого рода. Хотя наши результаты согласуются с предыдущими отчетами, демонстрирующими, что лишь немногие новорожденные с положительной реакцией на DAT, гетероспецифические по системе АВО, будут соответствовать критериям обменного переливания крови (3,5), новорожденные с такими комбинациями крови действительно проявляются заметно в недавних сериях тяжелой гипербилирубинемии и ядерной желтухи (6–6). 9).Кажущийся легкий характер заболевания не должен вызывать самоуспокоенности в отношении гемолитической болезни АВО.
Возможно усиление влияния гемолитических состояний на развитие неврологической дисфункции, вызванной билирубином (22,23). Наши повышенные результаты COHbc, совместимые с ранее опубликованными данными (13, 24–26), подтверждают гемолитическую природу DAT-положительной ABO-гетероспецифичности в целом и подчеркивают высокий риск у этих новорожденных. Несмотря на общий высокий уровень гемолиза, не у всех младенцев в нашей серии, у которых развилась гипербилирубинемия, был высокий уровень COHbc.Процент новорожденных с гипербилирубинемией увеличивался вместе с увеличением процентилей COHbc. Мы предполагаем, что в группах нижнего процентиля различная степень незрелости системы конъюгации билирубина или наличие промоторного варианта (TA) 7 гена UGT1A1, связанного с синдромом Жильбера, наряду с умеренно повышенным катаболизмом гема, могут иметь значение. способствовал гипербилирубинемии (27). Однако у новорожденных с самым высоким уровнем COHbc у всех детей развилась гипербилирубинемия.В этой последней группе степень гемолиза должна была быть достаточно высокой, чтобы подавить даже самый эффективный процесс конъюгации.
Литература противоречива в отношении степени гемолиза, частоты и тяжести гипербилирубинемии между подгруппами O-A и OB. Некоторым исследователям не удалось показать какой-либо разницы в клинической тяжести гемолитической болезни новорожденных при ОА и ОЖ, хотя в первом отчете отмечалась тенденция к более частому выполнению обменного переливания крови в течение первых 24 часов у новорожденных в ОЖ по сравнению с новорожденными с ОА (28-28 лет). 30).Точно так же ретроспективный анализ гемолитической болезни по системе АВО не выявил значимой взаимосвязи между группой крови младенцев и клиническим исходом (31). Sisson (32) и Kaplan (33) не сообщили о существенных различиях в тяжести или реакции на терапию между двумя группами крови. Младенец с группой крови А с такой же вероятностью будет страдать гемолитической болезнью АВО, как и младенец с группой крови В (34). Тем не менее, Bakkeheim и соавт. обнаружили значительно повышенную частоту инвазивных методов лечения, включая внутривенную иммуноглобулиновую терапию и обменное переливание крови, у новорожденных с OB по сравнению с O-A (35).В двух исследованиях задокументирована более высокая потребность в обменном переливании крови у новорожденных с OB, чем с O-A (36, 37).
Причины, по-видимому, усиления выраженности желтухи в подгруппе О-Б не ясны. Материнские факторы, включая различные уровни IgG анти-А или анти-В, могут влиять на степень гемолиза, а вариации в распределении подгрупп IgG могут изменять индуцированный макрофагами клиренс эритроцитов. Количество полностью развитых антигенных участков А или В на эритроцитах плода может быть разным, как и разбавляющий эффект других тканей, несущих эти поверхностные антигены (38).
Сравнение этих исследований затруднено, поскольку критерии включения, определения, терапевтические показания и временные периоды отличались от исследования к исследованию. Напротив, мы классифицировали наших пациентов, используя современное определение гипербилирубинемии, которое учитывает динамику билирубина в первые дни жизни (12). Использовались стандартизированные критерии лечения (10), а скорость катаболизма гема оценивалась современным методом (2). Предвзятости отбора удалось избежать, включив всех DAT-положительных гетероспецифических новорожденных ABO при рождении и до того, как у них разовьется желтуха.Хотя не все наши сравнения достигли статистической значимости, гетероспецифические новорожденные с O-B, по-видимому, подвергались более высокому риску, чем подгруппа с O-A. Гипербилирубинемия действительно возникала раньше у новорожденных с OB, и у большего числа новорожденных с OB развилась гипербилирубинемия в течение первых 24 часов. Это различие было связано с умеренным, хотя и не статистически значимым, повышенным гемолизом. Однако отсутствие статистической значимости не исключает эффекта умеренного увеличения гемолиза, приводящего к увеличению продукции билирубина.В сочетании с незрелостью системы конъюгации билирубина умеренно повышенный гемолиз может привести к более высокой частоте гипербилирубинемии. Недостатком нашего исследования была зависимость от визуального распознавания ранней желтухи и отсутствие фиксированного протокола определения ПТБ в течение первых 24 часов.
Таким образом, наше исследование предоставляет информацию о частоте, тяжести и механизме желтухи у новорожденных с гетероспецифической системой ABO. Высокая скорость гемолиза является отличительной чертой положительности DAT с результирующей высокой частотой гипербилирубинемии и особенно ранней гипербилирубинемии.Эти факторы могут повышать риск тяжелой гипербилирубинемии и нейротоксичности билирубина. Кроме того, акушерские гетероспецифические новорожденные, по-видимому, подвергаются более высокому риску, чем их сверстники с остеоартрозом Исследовательский фонд Л. Джонсона. Авторы заявляют никакого конфликта интересов.
Собещения
- AAP
- Американская академия педиатрики
- CO
- CO
- COHB
- CARBOXYHEMOGLOBIN
- CARBOXYHEMOGLOBIN
- COHBC
- CARBOXYHEMOGLOBIN Исправлено для вдохновленного CO
- DAT
- Direct Antiglobulin Titer
- G-6- PD
- глюкоза-6-фосфат дегидрогеназа
- PTB
- PTB
- Plasma Total BiliRUBIN
- RBC
- RBC
- THB
- Total Hemolobin
Сноски
Отказ от ответственности
Ссылки
2. Времан Х.Дж., Махони Дж.Дж., Стивенсон Д.К. Угарный газ и карбоксигемоглобин. Adv Педиатр.1995; 42: 303–334. [PubMed] [Google Scholar]3. Ozolek JA, Watchko JF, Mimouni F. Распространенность и отсутствие клинического значения несовместимости групп крови у матерей с группой крови A или B. J Pediatr. 1994; 125:87–91. [PubMed] [Google Scholar]4. Меберг А, Йохансен К.Б. Скрининг неонатальной гипербилирубинемии и аллоиммунизация АВО во время тестирования на фенилкетонурию и врожденный гипотиреоз. Акта Педиатр. 1998; 87: 1269–1274. [PubMed] [Google Scholar]5. Maisels MJ, Kring E. Риск сепсиса у новорожденных с тяжелой гипербилирубинемией.Педиатрия. 1992; 90: 741–743. [PubMed] [Google Scholar]6. Джонсон Л., Бутани В.К., Карп К., Сивьери Э.М., Шапиро С.М. Клинический отчет пилотного регистра ядерной желтухи США (1992–2004 гг.) J Perinatol. 2009; 29 (Приложение 1): S25–45. [PubMed] [Google Scholar]8. Мэннинг Д., Тодд П., Максвелл М., Джейн Платт М. Проспективное исследование тяжелой гипербилирубинемии у новорожденных в Великобритании и Ирландии. Arch Dis Child Fetal Neonatal Ed. 2007; 92: F342–346. [Бесплатная статья PMC] [PubMed] [Google Scholar]9. Бьерре Дж.В., Петерсен Дж.Р., Эббесен Ф.Эпиднадзор за крайней гипербилирубинемией в Дании. Способ идентификации новорожденных. Акта Педиатр. 2008;97:1030–1034. [PubMed] [Google Scholar] 10. Подкомитет Американской академии педиатрии по гипербилирубинемии. Лечение гипербилирубинемии у новорожденных в возрасте 35 и более недель гестации. Педиатрия. 2004; 114: 297–316. [PubMed] [Google Scholar] 11. Maisels MJ, Bhutani VK, Bogen D, Newman TB, Stark AR, Watchko JF. Гипербилирубинемия у новорожденных > или = 35 недель беременности: обновление с разъяснениями.Педиатрия. 2009; 124:1193–1198. [PubMed] [Google Scholar] 12. Бутани В.К., Джонсон Л., Сивьери Э.М. Прогностическая способность часового билирубина сыворотки перед выпиской для последующей значительной гипербилирубинемии у здоровых доношенных и доношенных новорожденных. Педиатрия. 1999; 103:6–14. [PubMed] [Google Scholar] 13. Стивенсон Д.К., Фанарофф А.А., Майзелс М.Дж., Янг Б.В., Вонг Р.Дж., Времан Х.Дж. и др. Прогнозирование гипербилирубинемии у доношенных и доношенных детей. Педиатрия. 2001; 108:31–39. [PubMed] [Google Scholar] 14.Каплан М., Гершель М., Хаммерман С., Хойер Д.Д., Стивенсон Д.К. Гипербилирубинемия среди афроамериканцев, новорожденных с дефицитом глюкозо-6-фосфатдегидрогеназы. Педиатрия. 2004; 114:e213–219. [PubMed] [Google Scholar] 15. Бутани В.К., Джонсон Л.Х., Джеффри Майзелс М., Ньюман Т.Б., Фиббс С., Старк А.Р., Йергин-Аллсопп М. Ядерная желтуха: эпидемиологические стратегии ее предотвращения с помощью системных подходов. Дж. Перинатол. 2004; 24: 650–662. [PubMed] [Google Scholar] 16. Каплан М., Наамад М., Кенан А., Руденски Б., Хаммерман С., Времан Х.Дж. и др.Неспособность предсказать гемолиз и гипербилирубинемию по подклассу IgG у детей с группой крови А или В, рожденных от матерей с группой О. Педиатрия. 2009; 123:e132–137. [PubMed] [Google Scholar] 17. Каплан М., Мерлоб П., Регев Р. Израильские рекомендации по ведению неонатальной гипербилирубинемии и профилактике ядерной желтухи. Дж. Перинатол. 2008; 28: 389–397. [PubMed] [Google Scholar] 18. Олден Э.Р., Линч С.Р., Веннберг Р.П. Определение карбоксигемоглобина в оценке неонатальной желтухи. Am J Dis Чайлд. 1974; 127: 214–217.[PubMed] [Google Scholar] 19. Каплан М., Мурака М., Хаммерман С., Рубалтелли Ф.Ф., Вилей М.Т., Времан Х.Дж. и др. Дисбаланс между продукцией и конъюгацией билирубина: фундаментальная концепция механизма неонатальной желтухи. Педиатрия. 2002;110(4):e47. [PubMed] [Google Scholar] 20. Каплан М., Хаммерман С., Ренбаум П., Леви-Лахад Э., Времан Х.Дж., Стивенсон Д.К. Различный патогенез перинатальной билирубинемии у новорожденных с дефицитом глюкозо-6-фосфатдегидрогеназы по сравнению с нормальными новорожденными. Педиатр Рез. 2001; 50: 532–537.[PubMed] [Google Scholar] 21. Осборн Л.М., Ленарский С., Оукс Р.С., Рейфф М.И. Фототерапия у доношенных детей с гемолитической болезнью на фоне АВО-несовместимости. Педиатрия. 1984; 74: 371–374. [PubMed] [Google Scholar] 22. Кузневич М., Ньюман Т.Б. Взаимодействие гемолиза и гипербилирубинемии на исходы развития нервной системы в совместном перинатальном проекте. Педиатрия. 2009; 123:1045–1050. [PubMed] [Google Scholar] 23. Ньюман Т.Б., Лильестранд П., Джереми Р.Дж., Ферриеро Д.М., Ву Ю.В., Худес Э.С. и соавт. Группа по изучению желтухи и грудного вскармливания.Исходы среди новорожденных с уровнем общего билирубина сыворотки 25 мг/дл и более. N Engl J Med. 2006; 354:1889–1900. [PubMed] [Google Scholar] 24. Fällström SP, Bjure J. Эндогенное образование окиси углерода у новорожденных. 3. АВО-несовместимость. Acta Pediatr Scand. 1968; 57: 137–144. [PubMed] [Google Scholar] 25. Herschel M, Karrison T, Wen M, Caldarelli L, Baron B. Маловероятно, что изоиммунизация может быть причиной гемолиза у новорожденных, несовместимых с ABO, но имеющих прямой антиглобулиновый тест.Педиатрия. 2002; 110:127–130. [PubMed] [Google Scholar] 26. Уэтани Ю., Накамура Х., Окамото О., Ямадзаки Т., Времан Х.Дж., Стивенсон Д.К. Измерения карбоксигемоглобина в диагностике гемолитической болезни системы АВО. Acta Pediatr Jpn. 1989; 31: 171–176. [PubMed] [Google Scholar] 27. Каплан М., Хаммерман С., Ренбаум П., Кляйн Г., Леви-Лахад Э. Синдром Гилберта и гипербилирубинемия у новорожденных с несовместимостью по системе АВО. Ланцет. 2000; 356: 652–653. [PubMed] [Google Scholar] 28. Kanto WP, Jr, Marino B, Godwin AS, Bunyapen C. Гемолитическая болезнь ABO: сравнительное исследование клинической тяжести и отсроченной анемии.Педиатрия. 1978; 62: 365–369. [PubMed] [Google Scholar] 29. Пиви К.Дж., Уайзман Х.Дж. Гемолитическая болезнь новорожденных по системе АВО: оценка лечения и выявление расовых и антигенных факторов. Педиатрия. 1978; 61: 475–478. [PubMed] [Google Scholar] 30. Бринк С. Лабораторное исследование несовместимости групп крови А-В-О и неонатальной желтухи. S Afr Med J. 1969; 43: 1047–1050. [PubMed] [Google Scholar] 31. Дюфур Д.Р., Моноган В.П. Гемолитическая болезнь новорожденных по системе АВО. Ретроспективный анализ 254 случаев.Ам Джей Клин Патол. 1980; 73: 369–373. [PubMed] [Google Scholar] 32. Сиссон ТР. Ответ Пилдес Р.С. Фототерапия при несовместимости по системе АВО. J Педиатр. 1972; 80: 1063–1064. [PubMed] [Google Scholar] 33. Каплан Э. Ответ Пилдес Р.С. Фототерапия при несовместимости по системе АВО. J Педиатр. 1972; 80: 1063–1064. [PubMed] [Google Scholar] 34. Чан-Шу С.Ю., Блэр О. Гемолитическая болезнь новорожденных по системе АВО. Ам Джей Клин Патол. 1979; 71: 677–679. [PubMed] [Google Scholar] 35. Баккехайм Э., Бергеруд У., Шмидт-Мелбай А.С., Аккок К.А., Листёль К., Фугельсет Д. и др.Титры материнских IgG анти-А и анти-В позволяют прогнозировать исход АВО-несовместимости у новорожденного. Акта Педиатр. 2009; 98: 1896–1901. [PubMed] [Google Scholar] 36. Клиффорд Дж. Х., Мэтьюз П., Рейквам К. В., Палмер Х. Д. Скрининг гемолитической болезни новорожденных с помощью теста Кумбса пуповинной крови — анализ пятилетнего опыта. Клин Педиатр (Фила) 1968; 7: 465–469. [PubMed] [Google Scholar] 37. Фаррелл АГ. А-В-О несовместимость и гемолитическая болезнь новорожденных. S Afr Med J. 1970; 44: 211–213. [PubMed] [Google Scholar] 38.Рамесету Дж., Любан НЛК. В кн.: Аутоиммунная гемолитическая болезнь новорожденных. Лучтман М.А., Бейтлер Э., Киппс Т.Дж., Селигсон Ю., Каушанский К., Прчал Дж.Т., редакторы. Гематология Уильяма, медицинский издательский отдел McGraw-Hill; Нью-Йорк: 2006. стр. 751–765. [Google Scholar]Неонатальная гемолитическая желтуха: морфологические особенности эритроцитов, которые помогут вам диагностировать основное состояние — Полный текст — Неонатология 2014, Том. 105, № 4
Аннотация
Справочная информация: Во многих случаях тяжелой неонатальной гипербилирубинемии причина желтухи никогда не определяется четко.Таким образом, говорят, что у них «идиопатическая» тяжелая неонатальная желтуха. Тем не менее, обнаружение точной причины, если это генетическое заболевание, может обеспечить информированное упреждающее руководство в отношении будущих эпизодов гемолиза, анемии или билирубиновой желчнокаменной болезни. Цель: Секвенирование генов «следующего поколения» часто может выявить мутации, ответственные за тяжелую неонатальную гипербилирубинемию, но разумное использование этой новой технологии предполагает выборочное применение, применяя это тестирование только в том случае, если недорогая технология не может выявить диагноз. Методы: В этом обзоре мы показываем и обсуждаем пять типов морфологических аномалий эритроцитов, которые помогли нам классифицировать случаи гемолитической желтухи новорожденных. Результаты: В качестве подспорья для применения недорогой технологии мы рассматриваем морфологические аномалии эритроцитов, которые легко выявляются в мазке крови. При обнаружении эти аномалии могут быть важными ключами к основному гемолитическому состоянию, вызывающему неонатальную желтуху. Выводы: Применение этих простых и недорогих методов может помочь врачам-неонатологам в уходе за новорожденными с гемолитической желтухой. Мы прогнозируем, что при использовании этих принципов термин «идиопатическая» неонатальная желтуха станет менее распространенным по мере выявления основных причин.
© 2014 S. Karger AG, Базель
Введение
Тяжелая желтуха является наиболее распространенным состоянием, требующим повторной госпитализации в течение первой недели после рождения [1,2].К сожалению, у большинства новорожденных с выраженной гипербилирубинемией не диагностирована основная этиология, объясняющая их желтуху. Например, мы обнаружили, что у 66% новорожденных с общим билирубином в сыворотке (TSB) >30 мг/дл этиология не была установлена, и их назвали «идиопатической» неонатальной желтухой [3]. Это сравнимо с отчетом из регистра ядерной желтухи США, где у 55% новорожденных с ядерной желтухой не было сообщений об этиологии [4].
Наверняка у каждого новорожденного с критически повышенным TSB есть основные причины крайней желтухи.Мы предполагаем, что гемолиз лежит в основе многих случаев, которые в настоящее время называют идиопатическими. Это подтверждается исследованиями Kaplan et al. [5] и Майзелс и Кринг [6]. Последний показал значительно повышенные концентрации моноксида углерода в конце выдоха у новорожденных с TSB> 75-го процентиля для данного возраста. В некоторых случаях гемолиз ограничивается периодом новорожденности, в то время как в других он является частью пожизненного заболевания, такого как дефицит глюкозо-6-фосфатдегидрогеназы (G6PD) [7], дефицит пируваткиназы (PK) [8] или дефект мембраны эритроцитов [9].Когда новорожденным требуется неотложное лечение тяжелой желтухи, возможно, акцент на снижении TSB до безопасного уровня иногда затмевает необходимость выяснить, почему он стал таким высоким в первую очередь, и, следовательно, неадекватные усилия прилагаются к диагностическим усилиям.
Ранняя диагностика причины тяжелой желтухи может иметь большое значение. Например, обнаружение дефицита G6PD вызывает предупреждения о том, что следует избегать окислительных стрессоров в виде продуктов питания, лекарств или вирусных инфекций. Поскольку гипербилирубинемия у новорожденных с дефицитом Г6ФД часто возникает без явных причин, вызывающих нарушение, простое знание о существовании этого состояния может потребовать тщательного наблюдения и выжидательной тактики.Кроме того, при установлении диагноза хронической гемолитической желтухи могут быть даны упреждающие указания относительно вероятности развития анемии в детском возрасте и ранней билирубиновой желчнокаменной болезни.
Основное состояние, вызывающее неонатальный гемолиз, можно найти с помощью функциональных анализов, а точные мутации можно определить с помощью секвенирования генов «следующего поколения» [10]. Однако простое исследование мазка крови может быть недорогим и быстрым начальным шагом, что иногда делает ненужным более дорогостоящее тестирование.Чтобы помочь неонатологам в этом, мы составили этот обзор распространенных морфологических аномалий эритроцитов, вызывающих гемолитическую желтуху новорожденных. Когда морфологические данные сочетаются с семейным анамнезом и базовой лабораторной оценкой, можно распознать большинство случаев гемолитической желтухи и классифицировать причину. В этом обзоре мы не будем рассматривать все морфологические нарушения эритроцитов, такие как наследственный стоматоцитоз/ксероцитоз или состояния, связанные с избытком клеток-мишеней или акантоцитов.Читатели могут ознакомиться с прекрасными обзорами этих аномалий [11,12].
Рассмотрение гемолиза как причинного механизма (таблица 1)
Гемолиз следует рассматривать в первую очередь, когда гипербилирубинемия возникает «на раннем этапе», а именно, когда TSB превышает 95-й процентиль часового значения номограммы в первый день после рождения [1]. Простые способы подтверждения диагноза гемолиза включают обнаружение гемоглобина без эритроцитов в моче при стандартном анализе мочи и обнаружение розовой сыворотки при визуальном исследовании образца крови.Кроме того, отсутствие гаптоглобина в сыворотке можно быстро и недорого проверить и подтвердить диагноз гемолиза [13,14]. Однако уровни гаптоглобина могут быть низкими у новорожденных без гемолиза, поэтому сам по себе анализ гаптоглобина может быть ненадежным параметром для оценки неонатального гемолиза.
Таблица 1
Морфологические аномалии эритроцитов новорожденных с необъяснимой тяжелой желтухой как руководство к обнаружению основной причины гемолиза .Хотя клинический инструмент для этого у новорожденных и детей, неспособных сделать форсированный выдох, коммерчески недоступен, многообещающий инструмент CoSense от Capnia, Inc. (Пало-Альто, Калифорния, США) недавно был одобрен в США и получил сертификат CE. отмечен в Европе и изучается у новорожденных нашей группой и другими (clinicaltrials.gov/show/NCT01848691).
В случаях тяжелого неонатального гемолиза с отрицательным прямым тестом Кумбса (DAT), если переливание необходимо срочно, мы настоятельно рекомендуем неонатологам взять кровь в пробирку с антикоагулянтом EDTA перед переливанием для морфологического анализа и специализированного гематологического исследования.При осмотре квалифицированным специалистом морфология эритроцитов в обычном или прижизненно окрашенном мазке крови может дать важную информацию о причине гемолиза. Технолог должен определить и записать эти отклонения в разделе комментариев СВС. Тем не менее, неонатологи могут сами исследовать мазок крови или обратиться к детскому гематологу за помощью в изучении мазка в поисках этих морфологических находок. Ниже мы приводим иллюстрации и описания, которые мы считаем особенно информативными.
Микросфероциты
Сфероциты (рис. 1) идентифицируются по отсутствию центральной зоны бледности, характерной для нормальных эритроцитов. Сфероциты потеряли часть клеточной мембраны и характеризуются низким средним корпускулярным объемом (MCV) при нормальном содержании гемоглобина, что приводит к повышенной средней концентрации гемоглобина в корпускулярных единицах (MCHC) [15]. Когда в мазке новорожденного с тяжелой желтухой наблюдаются обильные сфероциты, следует учитывать два основных состояния; Гемолитическая болезнь системы АВО и наследственный сфероцитоз (НС).Хотя DAT обычно положительный в первом случае и отрицательный во втором, редко может быть желтушный новорожденный с гемолитической болезнью АВО с отрицательной пробой Кумбса из-за недостаточности материнских антител, чтобы сделать пробу Кумбса положительной, но все же достаточной, чтобы привести к некоторым степень гемолиза [16]. Кроме того, DAT иногда отрицательный, но непрямой Кумбс положительный.
Рис. 1
Микросфероциты. a Новорожденный с гемолитической болезнью АВО. b Новорожденный с HS.
Сфероцитоз при гемолитической болезни системы АВО уменьшится в течение первых недель и должен полностью исчезнуть через 1 или 2 месяца после рождения. Напротив, сфероциты у новорожденных с HS сохраняются. Если у матери группа О, у ребенка А или В, положительный тест на DAT и у ребенка ранняя гипербилирубинемия, для постановки диагноза может не потребоваться мазок крови. Однако недавно у нас был случай O/B гемолитической желтухи, когда гипербилирубинемия была настолько тяжелой (TSB 41,7 мг/дл), что мы сочли необходимым дополнительное исследование, и действительно также был обнаружен HS из-за мутации в SLC4A1 [17]. .Поиск был вызван тем, что было обнаружено очень большое количество сфероцитов, что обычно не бывает при изолированной гемолитической желтухе системы ABO.
Около 65-70% новорожденных с HS наследуют состояние по аутосомно-доминантному типу, таким образом, родитель несет этот диагноз. Однако иногда родитель с СГ не знает о своем диагнозе СГ [11]. Это чаще встречается при легком фенотипе или у родителей, у которых тяжелая желтуха была только в неонатальном периоде. Из оставшихся 30-35% случаев HS некоторые являются мутациями de novo, а некоторые — аутосомно-рецессивными вариантами [11,18].
Мы не рекомендуем проводить тест на осмотическую хрупкость эритроцитов для подтверждения HS у новорожденных. Этот тест может быть дорогим и часто бывает отрицательным (нормальным) у новорожденных с HS, но становится положительным (повышенная хрупкость) после нескольких месяцев жизни. Объяснение частого ложноотрицательного теста у новорожденных связано с физиологически сниженной осмотической хрупкостью эритроцитов, характерной для неонатального периода, поскольку эритроциты более эластичны и способны расширяться в гипотонической среде без лизиса [11].Поэтому «нормальный» результат теста на осмотическую хрупкость у новорожденного с HS является обычным явлением. Если необходим подтверждающий тест на HS, мы предпочитаем либо (1) подождать 3-4 месяца для проведения теста на осмотическую хрупкость, (2) провести тест на лизис подкисленного глицерина [19] или (3) провести тест на эозин-5- поток малеимида (ЕМА), который включает стехиометрическое связывание красителя эозина с Band-3 на поверхности эритроцитов. Используя проточную ЭМА-цитометрию, новорожденных с HS можно идентифицировать по характеру связывания вне нормального «отпечатка» [17,20].
Можно определить точную мутацию у новорожденных в HS. Однако это дорого и обычно мало что добавляет к клинической помощи. Мы тестируем точную мутацию только в атипичных или особенно тяжелых неонатальных случаях HS [17,18,21].
Эллиптоциты
Эритроциты овальной или эллиптической формы (рис. 2) обычно встречаются как аутосомно-доминантно наследуемое состояние, с различными генотипами и фенотипами от полностью бессимптомной до умеренно тяжелой гемолитической анемии [22].Мутации, вызывающие это состояние, приводят к определенному типу нестабильности цитоскелета эритроцитов. Эритроциты постоянно находятся под действием деформирующих сил, так как они пересекают капиллярные пространства, диаметр которых уже, чем они сами. Они деформируются, чтобы пройти через это пространство, но превращаются в двояковогнутые диски, когда пересекают капилляр. Однако при наследственном эллиптоцитозе (HE) деформация делает клетку постоянно эллиптической, и эти клетки аномальной формы могут быть отбракованы селезенкой, что сокращает их выживаемость [22].
Рис. 2
В отличие от новорожденных с HS, у новорожденных с HE отсутствуют отличительные показатели эритроцитов, и они выявляются только при исследовании мазка крови. Большинство новорожденных с HE не имеют выраженной желтухи или анемии, и это состояние обычно остается незамеченным в неонатальном периоде. Однако важное исключение, часто приводящее к тяжелой неонатальной желтухе, возникает, когда новорожденный наследует мутацию HE от одного родителя, а также наследует другой дефект мембраны эритроцитов от другого родителя, подобно аутосомно-рецессивному состоянию.Недавно мы подробно описали такого новорожденного [23] с состоянием, называемым пиропойкилоцитозом.
Клетки для укусов и волдырей
Эти термины хорошо описывают; клетка укуса, кажется, имеет укус в форме рта. Пузырчатые клетки часто встречаются в компании укусных клеток (рис. 3). Это клетка, которая потеряла небольшую часть содержимого гемоглобина, оставив пустое пространство, покрытое тонкой наружной мембраной, напоминающей волдырь на поверхности эритроцитов [24,25].Когда в мазке новорождённого с тяжёлой желтухой обнаруживаются клетки укусов и волдырей, можно сделать вывод, что гемоглобин осаждался на мембране или вблизи неё и что преципитат (тельца Гейнца) удалялся ретикулоэндотелиальными клетками. Состояния, приводящие к неонатальному укусу и волдырям, включают острый гемолиз, вызванный нестабильными гемоглобинами (такими как гемоглобин F Poole — мутация γ-глобина или гемоглобин Hasharon — мутация α-глобина) [26]. Клетки укусов и волдырей также могут образовываться при дефиците G6PD или (гораздо реже) других ферментов того же пути, что приводит к гемолитическому кризу [27].Этого не происходит при дефиците ферментов гликолитического пути (например, при дефиците ФК), которые имеют свои собственные характерные морфологические признаки.
Рис. 3
Клетки укусов или волдырей. a Пузырчатые клетки новорожденного с дефицитом G6PD. b Тельца Хайнца у новорожденного с дефицитом G6PD.
При обнаружении клеток укуса и волдырей в первую очередь следует рассмотреть дефицит G6PD, особенно если новорожденный является мужчиной и имеет экваториальное происхождение.Однако в большинстве случаев дефицита Г6ФД у новорожденных отсутствуют клетки укуса или волдыря. Мы выступаем за измерение ферментативной активности G6PD во всех случаях необъяснимой тяжелой неонатальной гипербилирубинемии. Следует иметь в виду, что, в зависимости от серьезности дефекта, значительно повышенное количество ретикулоцитов может сделать ферментативный анализ G6PD ложноотрицательным, поскольку ретикулоциты обладают богатой активностью G6PD. Следовательно, погранично низкая ферментативная активность Г6ФД у новорожденного с выраженным ретикулоцитозом и клетками укуса и/или волдырей следует интерпретировать как возможный дефицит Г6ФД, и это может быть подтверждено позже, когда количество ретикулоцитов будет нормальным.Самок нельзя исключать из рассмотрения из-за «лионизации» [28].
Эхиноциты
Эхиноциты, как показано на рисунке 4, представляют собой сморщенные и обезвоженные клетки с многочисленными довольно однородными спикулами. Иногда эхиноциты в мазке крови являются артефактом, но когда в крови новорожденного с гемолитической желтухой имеется несколько эхиноцитов в поле зрения при большом увеличении по всему мазку крови, что связано с полихромазией, результат обычно значителен. Когда эритроцитам не хватает достаточного количества АТФ для работы ионообменных насосов на поверхности клетки, клетки могут стать зазубренными, что приведет к появлению некоторых сморщенных клеток со спикулами [8,11].По нашему опыту, дефицит PK является наиболее распространенным состоянием у новорожденных с желтухой, приводящим к образованию этих клеток. Менее распространенные причины энергетической недостаточности, такие как дефицит глюкозо-фосфатизомеразы и фосфофруктокиназы, также могут вызывать выраженный эхиноцитоз [8].
Рис. 4
Эхиноциты новорожденного с недостаточностью ФК.
Ферментативная активность ФК эритроцитов может быть недорого определена количественно с использованием небольшого количества крови. Дефицит ПК является аутосомно-рецессивным заболеванием; как правило, новорожденный является сложной гетерозиготой, наследующей одну мутацию гена PK от одного родителя и другую мутацию в том же гене от другого родителя [8].Исключения составляют кровнородственные родственники, где одна и та же мутация наследуется от бессимптомной матери и бессимптомного отца, поэтому новорожденный является гомозиготным по мутации [29]. В целом, мы не стремимся идентифицировать точную мутацию (мутации), ответственную за новорожденных с недостаточностью ФК. Исключения бывают в рамках эпидемиологических исследований и при особо тяжелом фенотипе [29].
Шистоциты
Фрагменты эритроцитов, как показано на рисунке 5, называются шистоцитами.Это предполагает механическое разрушение эритроцитов в сосудистой сети. Шистоциты неравномерны по размеру или форме, часто имеют небольшой и зубчатый вид и лишены центральной бледности. У новорожденных с тяжелой желтухой шистоциты в мазке крови могут быть артефактом. Однако, если несколько шистоцитов видны в поле зрения при большом увеличении по всему мазку крови, сопровождающему нормальные эритроциты, вероятно микроангиопатическое состояние. Нити внутрисосудистого фибрина, которые могут возникать при синдроме диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), или большие гемангиомы могут вызывать шистоцитоз, когда циркулирующие эритроциты подвергаются травматическому механическому разрушению.
Рис. 5
Шистоциты новорожденного с ДВС-синдромом, связанным с асфиксией при рождении.
Рекомендован автоматический или ручной дифференциальный подсчет шистоцитов, но он еще не применяется повсеместно, а контрольные интервалы недоступны для новорожденных [30]. Согласно общим рекомендациям, если >1% эритроцитов в мазке крови доношенного новорожденного являются шистоцитами, или если >5% шистоцитов обнаружено у недоношенного ребенка, термин «шистоцитоз» подходит.Конкретные формы клеток, подходящие для включения в термин «шистоцит», включают следующие:
• Небольшие фрагменты с острыми углами или шипами (треугольными) и прямыми или искаженными цитоплазматическими границами; обычно окрашивание темное, иногда бледное.
• Микрополумесяцы, похожие на треугольные формы, но с круглым контуром на одной стороне.
• Клетки-шлемы с ампутированной зоной цитоплазмы с прямой границей и острыми углами.
• Кератоциты с выступающими спикулами, окружающими вогнутую границу.
• Микросфероциты (маленькие темноокрашенные сферы без бледности в центре) следует считать шистоцитами только в присутствии других форм шистоцитов.
Основная ценность количественного определения шистоцитов у новорожденного с желтухой заключается в подтверждении наличия микроангиопатического состояния. При обнаружении тромбоцитопении у новорожденного с желтухой и шистоцитозом следует учитывать несколько клинических состояний: (1) ДВС-синдром, который может сопровождать перинатальную асфиксию, сепсис или другие инфекции [31]; (2) врожденная форма тромботической тромбоцитопенической пурпуры из-за дефицита протеазы, расщепляющей фактор фон Виллебранда ADAMTS13 [31,32,33,34]; (3) дефицит гомозиготного протеина С [35]; (4) неонатальный гемолитико-уремический синдром [36,37,38,39] и (5) гигантская гемангиома или сосудистые опухоли [40].
Заключение
Улучшение качества здравоохранения достигается не только тогда, когда открытия улучшают результаты, но и когда затраты на лечение ограничиваются или снижаются [41]. Применение новых медицинских технологий может улучшить определенные результаты, но если эти технологии имеют очень высокую стоимость, не следует поощрять их неразборчивое и расточительное использование, предполагая, что доступны недорогие альтернативы для достижения тех же целей.
Навык анализа мазка крови, который когда-то был рутинной частью тщательного медицинского осмотра, в настоящее время не может преподаваться или практиковаться, как это было раньше [42].Исследование мазка крови является не только средством выявления гематологического заболевания, вызывающего гемолитическую желтуху, но также может стать существенной мерой по снижению затрат при постановке правильного диагноза. Генетическая диагностика причин гемолитической желтухи с помощью высокопроизводительного секвенирования скоро станет настолько информативной и убедительной, что потенциально сделает устаревшим исследование мазка крови. С верой в то, что самое разумное использование любой новой технологии включает в себя сдержанность и сосредоточенность, мы утверждаем, что простой анализ мазка крови, поиск морфологических результатов, описанных в этом обзоре, приведет к диагностике многих новорожденных с желтухой, которые в настоящее время считаются «идиопатическими».Кроме того, этот подход может ограничить неизбирательное использование дорогостоящих тестов, тем самым сделав шаг к повышению ценности медицинских услуг.
Заявление о раскрытии информации
У авторов нет конфликта интересов, о котором следует сообщать.
Каталожные номера
- Bhutani VK, Stark AR, Lazzeroni LC, Poland R, Gourley GR, Kazmierczak S, Meloy L, Burgos AE, Hall JY, Stevenson DK: Первоначальная оценка клинических испытаний и оценка риска для универсального скрининга на гипербилирубинемию Исследовательская группа.Скрининг тяжелой неонатальной гипербилирубинемии перед выпиской выявляет младенцев, нуждающихся в фототерапии. J Pediatr 2013;162:477-482.e1.
- Бутани В.К., Стивенсон Д.К.: Необходимость технологий для предотвращения синдрома неврологической дисфункции, вызванной билирубином. Семин Перинатол 2011;35:97-100.
- Christensen RD, Lambert DK, Henry E, Eggert LD, Yaish HM, Reading NS, Pchal JT: необъяснимая крайняя гипербилирубинемия среди новорожденных в многобольничной системе здравоохранения. Клетки крови Мол Дис 2013;50:105-109.
- Джонсон Л., Бутани В.К., Карп К., Сивьери Э.М., Шапиро С.М.: Клинический отчет из экспериментального реестра ядерной желтухи США (с 1992 по 2004 год).Дж. Перинатол 2009; 29: S25-S45.
- Каплан М., Мурака М., Хаммерман С., Рубалтелли Ф.Ф., Вилей М.Т., Времан Х.Дж., Стивенсон Д.К.: Дисбаланс между производством и конъюгацией билирубина: фундаментальная концепция механизма неонатальной желтухи. Педиатрия 2002; 110:e47-e49.
- Maisels MJ, Kring E: Вклад гемолиза в раннюю желтуху у нормальных новорожденных.Педиатрия 2005;118:276-279.
- Каплан М., Мурака М., Времан Х.Дж., Хаммерман С., Вилей М.Т., Рубалтелли Ф.Ф., Стивенсон Д.К.: Неонатальный дисбаланс продукции-конъюгации билирубина: влияние дефицита глюкозо-6-фосфатдегидрогеназы и пограничная недоношенность. Arch Dis Child Fetal Neonatal Ed 2005;90:F123-F127.
- Занелла А., Бьянки П., Фермо Е. Дефицит пируваткиназы. Гематология 2007;92:721-723.
- Мохандас Н., Галлахер П.Г.: Мембрана эритроцитов: прошлое, настоящее и будущее.Кровь 2008; 112:3939-3948.
- Christensen RD, Nussenzveig RH, Yaish HM, Henry E, Eggert LD, Agarwal AM: Выявление причин значительной гипербилирубинемии у новорожденных с использованием секвенирования генов «следующего поколения». 2013 г., подано.
- Gallagher PG, Glader B: Наследственный сфероцитоз, наследственный эллиптоцитоз и другие нарушения, связанные с аномалиями мембраны эритроцитов; in Greer JP, Foerster J, Rodgers GM, Paraskevas F, Glader B, Arber DA, Means RT Jr (eds): Wintrobe’s Clinical Hematology, ed 12.Филадельфия, Липпинкотт/Уильямс и Уилкинс, 2009 г., стр. 911-932.
- Брюс Л.Дж.: Наследственный стоматоцитоз и эритроциты с утечкой катионов — последние разработки. Клетки крови Мол Дис 2009;42:216-222.
- Чавес-Буэно С., Бизли Дж. А., Голдбек Дж. М., Брайт Б. К., Мортон Д. Д., Уитби П. В., Стулл Т. Л.: Концентрация гаптоглобина у недоношенных и доношенных новорожденных.Дж. Перинатол 2011; 31:500-503.
- Чакмак А., Чалик М., Атас А., Хирфаноглу И., Эрел О.: Может ли гаптоглобин быть индикатором ранней диагностики желтухи новорожденных? J Clin Lab Anal 2008; 22: 409-414.
- Yaish HM, Henry E, Baer VL, Bennett ST, Christensen RD: Простой метод скрининга новорожденных на наследственный сфероцитоз.J Appl Hematol 2013;4:27-32.
- Herschel M, Karrison T, Wen M, Caldarelli L, Baron B: Маловероятно, что изоиммунизация может быть причиной гемолиза у новорожденных, несовместимых с системой АВО, но с отрицательным тестом на антиглобулин. Педиатрия 2002;110:127-130.
- Christensen RD, Yaish HM, Nussenzveig RH, Reading NS, Agarwal AM, Eggert LD, Pchal JT: Острая ядерная желтуха у новорожденного с несовместимостью группы крови O/B и мутацией в SLC4A1.Педиатрия 2013;132:e531-e534.
- Yaish HM, Christensen RD, Agarwal A: Новорожденный с Кумбс-отрицательной гемолитической желтухой со сфероцитами, но нормальными индексами эритроцитов: редкий случай аутосомно-рецессивного наследственного сфероцитоза из-за дефицита α-спектрина. Дж. Перинатол 2013; 33:404-406.
- Hoffmann JJ, Swaak-Lammers N, Breed WP, Strengers JL: Диагностическая ценность предварительно инкубированного теста на лизис подкисленного глицерина при гемолитической и негемолитической анемиях. Eur J Haematol 1991;47:367-370.
- Кар Р., Мишра П., Пати Х.П.: Оценка проточной цитометрии эозина-5-малеимида в диагностике наследственного сфероцитоза.Int J Lab Hematol 2010;32:8-16.
- Кристенсен Р.Д., Генри Э.: Наследственный сфероцитоз у новорожденных с гипербилирубинемией. Педиатрия 2010;125:120-125.
- King MJ, Zanella A: Наследственные нарушения мембран эритроцитов и лабораторные диагностические исследования.Int J Lab Hematol 2013;35:237-243.
- Кристенсен Р.Д., Нуссензвейг Р.Х., Рединг Н.С., Агарвал А.М., Прчал Дж.Т., Яиш Х.М.: Изменения как α-спектрина (SPTA1), так и β-спектрина (SPTB) у новорожденного с длительной желтухой в семье, где девять человек имели наследственный эллиптоцитоз.Неонатология 2014;105:1-4.
- Yoo D, Lessin LS: Лекарственно-ассоциированная гемолитическая анемия «укусных клеток». Am J Med 1992; 92: 243-248.
- Мишрики Ю.Ю.: Что ест эти эритроциты? Лекарственно-индуцированная гемолитическая анемия типа «укус клеток».Постград Мед 1998;104:45-46.
- Бендер Дж. В., Рейли М. П., Асакура Т.: Молекулярная стабильность и функция гемоглобинов Хашарон (α 2 47 (CD5) Asp-His-β 2 ) и Хашарон (α 2 47 (CD5) Asp-His-δ 2 ). Гемоглобин 1984;8:61-73.
- Кристенсен Р.Д., Яиш Х.М., Видмайер С.Е., Рединг Н.С., Пишер Т.Дж., Палмер К.А., Прчал Д.Т.: Было обнаружено, что неонатальная смерть, предположительно вызванная сепсисом, была ядерной желтухой с дефицитом Г6ФД.Педиатрия 2013;132:e1694-e1698.
- Каплан М., Бейтлер Э., Времан Х.Дж., Хаммерман С., Леви-Лахад Э., Ренбаум П., Стивенсон Д.К.: Неонатальная гипербилирубинемия у гетерозигот с дефицитом глюкозо-6-фосфатдегидрогеназы. Педиатрия 1999;104:68-74.
- Christensen RD, Yaish HM, Johnson CB, Bianchi P, Zanella A: Шесть детей с дефицитом пируваткиназы из одного маленького городка: молекулярная характеристика гена PK-LR.Дж. Педиатр 2011; 159:695-697.
- Зини Г., д’Онофрио Г., Бриггс С., Эрбер В., Джоу Дж. М., Ли С. Х., Макфадден С., Вивес-Корронс Д. Л., Ютака Н., Лесесве Д. Ф.; Международный совет по стандартизации в гематологии (ICSH): рекомендации ICSH по идентификации, диагностической ценности и количественному определению шистоцитов.Int J Lab Hematol 2012; 34:107-116.
- Motta M, Del Vecchio A, Radicioni M: Клиническое использование свежезамороженной плазмы и криопреципитата в отделении интенсивной терапии новорожденных. J Matern Fetal Neonatal Med 2011; 24 (дополнение 1): 129–131.
- Лотта Л.А., Гараджола И., Палла Р., Каиро А., Пейванди Ф.: Мутации и полиморфизмы ADAMTS13 при врожденной тромботической тромбоцитопенической пурпуре.Хум Мутат 2010; 31:11-19.
- Schiff DE, Roberts WD, Willert J, Tsai HM: Тромбоцитопения и тяжелая гипербилирубинемия в неонатальном периоде, вторичная по отношению к врожденной тромботической тромбоцитопенической пурпуре и дефициту ADAMTS13. J Pediatr Hematol Oncol 2004;26:535-538.
- Camilleri RS, Scully M, Thomas M, Mackie IJ, Liesner R, Chen WJ, Manns K, Machin SJ: Корреляция фенотип-генотип мутаций ADAMTS13 у пациентов с врожденной тромботической тромбоцитопенической пурпурой, получавших лечение в Соединенном Королевстве.Дж. Тромб Хемост 2012; 10:1792-1801.
- Салонваара М., Куисманен К., Мононен Т., Рииконен П.: Диагностика и лечение новорожденного с дефицитом гомозиготного протеина С. Acta Paediatr 2004; 93:137-139.
- Fallahpour M, Hafizi A, Fouladgar A, Rajabian B: Неонатальный атипичный гемолитико-уремический синдром может вызвать внутриутробную асфиксию.Arch Iran Med 2012; 15:729-730.
- Бесбас Н., Гулхан Б., Карпман Д., Топалоглу Р., Дузова А., Коркмаз Е., Озалтин Ф. Атипичный гемолитико-уремический синдром у новорожденных успешно лечили экулизумабом. Педиатр Нефрол 2013;28:155-158.
- Menni F, Testa S, Guez S, Chiarelli G, Alberti L, Esposito S: Неонатальный атипичный гемолитико-уремический синдром из-за метилмалоновой ацидурии и гомоцистинурии.Pediatr Nephrol 2012;27:1401-1405.
- Лоуренс Дж.: Диагностика атипичного гемолитико-уремического синдрома: обзор тематических исследований. Clin Adv Hematol Oncol 2012;10(дополнение 17):9-11.
- Yohannan MD, Abdulla AM, Patel PJ: Неонатальная гемангиоэндотелиома печени: проявления с желтухой и микроангиопатической гемолитической анемией.Eur J Pediatr 1990;149:804-805.
- Cosgrove DM, Fisher M, Gabow P, Gottlieb G, Halvorson GC, James BC, Kaplan GS, Perlin JB, Petzel R, Steele GD, Toussaint JS: Десять стратегий снижения затрат, улучшения качества и вовлечения пациентов: взгляд ведущих руководители системы здравоохранения. Health Aff (Миллвуд) 2013;32:321-327.
- Перкинс С.Л.: Исследование мазка крови; in Greer JP, Foerster J, Rodgers GM, Paraskevas F, Glader B, Arber DA, Means RT Jr (eds): Wintrobe’s Clinical Hematology, ed 12. Philadelphia, Lippincott/Williams & Wilkins, 2009, стр. 9-10.
Автор Контакты
Др.Robert D. Christensen
Клиническая программа для женщин и новорожденных
Intermountain Healthcare
4401 Harrison Blvd, Ogden, UT 84403 (США)
Электронная почта [email protected]
Информация о статье / публикации
Предварительный просмотр первой страницы
Получено: 07 октября 2013 г.
Принято: 13 ноября 2013 г.
Опубликовано онлайн: 08 февраля 2014 г.
Дата выпуска выпуска: июнь 2014 г.
Количество печатных страниц: 7
Количество фигурок: 5
Количество столов: 1
ISSN: 1661-7800 (печать)
eISSN: 1661-7819 (онлайн)
Для получения дополнительной информации: https://www.karger.com/NEO
Авторское право / Дозировка препарата / Отказ от ответственности
Авторское право: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или любую систему хранения и поиска информации, без письменного разрешения издателя. .
Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством.
Отказ от ответственности: заявления, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и участникам, а не издателям и редакторам.Появление рекламы и/или ссылок на продукты в публикации не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор(ы) отказываются от ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в содержании или рекламе.
Гемолитическая болезнь новорожденных вследствие аллоиммунизации эритроцитов матери
Джон А.Widness, MD
Статус независимой экспертизы: Внутренняя экспертная оценка
Историческая перспектива и обзор
Гемолитическая болезнь новорожденных становится все менее и менее распространенным состоянием, в основном благодаря улучшенным профилактическим мерам, таким как введение матерям резус-иммуноглобулина в начале 3-го триместра и в ближайшем послеродовом периоде. За редким исключением, в настоящее время можно пренатально выявить все плоды, не пораженные АВО, путем тестирования на антитела в материнской крови.
В последнее время кордоцентез плода используется с растущим успехом для выявления и лечения анемии плода, т. е. внутрисосудистое переливание, при беременности, выявленной пренатально, перинатальная смертность и заболеваемость значительно снизились. Младенцы, наблюдаемые в акушерской службе высокого риска в Университете Айовы, чаще всего рождаются близко к сроку, не имеют легкой или легкой анемии и не имеют желтухи в первые 24 часа. Наиболее распространенной проблемой новорожденных сегодня является анемия, развивающаяся после выписки.
Диагностика
Несовместимость группы крови по системе АВО:
Поскольку группа крови обычно не проверяется при рождении, диагноз почти всегда ставится после того, как будет установлено, что у младенца желтуха. У этих младенцев редко бывает выраженная анемия, и очень редко у них при рождении возникает водянка. Диагноз ставится, когда младенец относится к группе А, В или АВ и имеет положительный прямой тест Кумбса и положительный непрямой результат Кумбса на антитела анти-А или анти-В. У матери будет отсутствовать антиген А или В, который положителен в непрямом тесте Кумбса.
Несовместимость по резус-фактору и другим «малым» группам крови:
Из-за материнского скрининга на это состояние эти младенцы почти распознаются до родов. Положительный прямой тест Кумбса в крови новорожденных с идентификацией специфических сывороточных антител, которые, как известно, связаны с гемолитической болезнью (некоторые антигены групп крови, например, Льюиса), позволяют поставить диагноз.
Менеджмент
Несовместимость группы крови по системе АВО:
Хотя следует искать анемию, гипербилирубинемия является основной заболеваемостью, связанной с несовместимостью группы крови ABO.Лечение этого состояния следует описанному в другом месте данного руководства (см. раздел «Лечение гипербилирубинемии в период новорожденности»). Вероятность того, что это произойдет снова при будущих беременностях, непредсказуема.
Несовместимость по резус-фактору и другим «малым» группам крови
Перед поставкой
- получить тщательный анамнез прошлого и настоящего акушерского анамнеза и анамнез предыдущих неонатальных исходов, включая
- Исход предыдущих беременностей, т.е.д., внутриутробная и неонатальная смертность, недоношенность и т. д.
- Внутриутробное переливание эритроцитов в анамнезе и в настоящем
- прошлых и настоящих водянок и
- предыдущих неонатальных обменных трансфузий по поводу гипербилирубинемии.
- В случаях, когда ожидается рождение ребенка с тяжелым поражением и анемией (редкость в последние годы), должна быть доступна упакованная Rh-кровь типа O, перекрестная совместимость с материнской сывороткой для возможного немедленного повторного переливания (см. Руководство по процедурам банка крови новорожденных).
При поставке
- Тяжело пораженные младенцы: Сразу после рождения у тяжело пораженного младенца могут возникнуть проблемы с сердечно-сосудистой и дыхательной недостаточностью из-за интранатальной депрессии и анемии, а не из-за интоксикации билирубином. К счастью, это редкое явление при современном акушерском ведении. При наличии асцита может возникнуть затруднение дыхания, и следует рассмотреть возможность проведения парацентеза. Также могут возникать легочные проблемы, сходные с новорожденными с депрессией новорожденных и/или РДС.После начальной стабилизации ребенка следует перевести в отделение интенсивной терапии. В редких случаях, когда подозревается тяжелая анемия и основная проблема младенца, может быть показано небольшое обменное переливание эритроцитарной массы в дозе 20-40 мл/кг в родильном зале.
- Младенцы с легкой и средней степенью поражения: если оценка новорожденных в родильном зале показывает, что у младенца нет серьезных поражений, но все еще есть некоторые тревожные признаки, таких младенцев следует перевести в отделение интенсивной терапии новорожденных (или в отделение интенсивной терапии, если это применимо).
- Младенцы без признаков клинического заболевания или желтухи: эти младенцы могут быть отправлены в обычный ясли, если они соответствуют другим критериям для поступления в этот ясли.
- Лабораторные определения пуповинной крови: до того, как пуповинная кровь сгустится, следует немедленно взять образец крови с помощью иглы большого диаметра и шприца из плацентарной части пуповины и поместить в пробирку с антикоагулянтом ЭДТА (лиловая верхняя часть) и пробирку с красной верхней частью. . Эти образцы должны быть отправлены в лабораторию больницы для определения группы крови и прямого теста Кумбса.
В детской:
- Младенцы с тяжелым поражением: после перевода в отделение интенсивной терапии новорожденных с наиболее тяжелым заболеванием требуется введение пупочного или периферического артериального катетера для мониторинга артериального давления, рН и газов крови. Как отмечалось выше, при наличии тяжелой анемии может быть показано небольшое обменное переливание эритроцитарной массы, 20–40 мл/кг. Инфузию D10W с поддерживающими электролитами следует начинать через артериальную линию или периферическую внутривенно.Полный двухобъемный обмен при гипербилирубинемии следует отложить на несколько часов, пока не стабилизируется исходное состояние ребенка (см. ниже). Если кровь не требуется для лечения анемии, гипотонию можно скорректировать с помощью Plasmanate®.
- Младенцы с легкой и средней степенью поражения: Лечение детей с менее тяжелым поражением начинается с коррекции гипотензии и ацидоза. Если позволяют клиническое состояние и гестационный возраст, оральное питание следует начинать в первые четыре часа жизни.
- Все пораженные младенцы, т.е.е., те, которые положительны по Кумбсу:
- Лабораторные определения:
Билирубин: Частота лабораторных определений будет зависеть от тяжести гемолитической болезни, предшествующих значений и терапии. Данные, имеющиеся в образце пуповинной крови, также будут полезны для прогнозирования этих потребностей. В первые 12-24 часа новорожденным с тяжелой желтухой и/или анемией следует начинать фототерапию и измерять уровень общего билирубина в сыворотке каждые 2-4 часа, чтобы установить тенденцию в скорости его повышения.Младенцев с менее выраженным поражением и внешне нормальных детей можно лечить без фототерапии, но им следует измерять уровень билирубина в сыворотке каждые четыре-шесть часов в течение первых 24 часов жизни. Измерение прямого билирубина должно быть однократным, желательно в течение первых суток. Младенцам, у которых обнаружен повышенный прямой билирубин в пуповинной крови, следует проводить определение ферментов печени и повторять его еженедельно.Значения гемоглобина и гематокрита следует определять в возрасте 8-12 часов, до и после каждого обменного переливания и ежедневно до стабилизации состояния.Поскольку у младенцев с тяжелым поражением часто наблюдается гиперплазия ß-клеток, их следует наблюдать и лечить так же, как младенцев от матерей с диабетом. Кроме того, следует контролировать уровень глюкозы в крови через 1 и 2 часа после каждого обменного переливания, при котором используется кровь CPDA-1.
- Фототерапия:
Фототерапию следует начинать в течение первых 4 часов жизни в зависимости от уровня билирубина в пуповине и последующей скорости повышения концентрации билирубина в сыворотке.Это может избежать необходимости обменного переливания крови. Крайне важно, чтобы у младенца продолжали контролировать уровень билирубина в сыворотке во время фототерапии. - Обменные переливания крови:
Необходимость и сроки обменных переливаний должны быть согласованы с лечащим врачом. Критерии обменного переливания не меняются из-за фототерапии. После обменного переливания уровень билирубина в сыворотке крови следует измерять химическим методом через 2-4 часа после обмена, а затем каждые 4-6 часов. - Внутривенная иммуноглобулиновая терапия
Хотя смертность при обменном переливании крови, вероятно, ниже 1%, такие методы лечения, как эффективные, но менее инвазивные и сопряженные с меньшим риском, будут привлекательными. Один из таких методов лечения, по-видимому, развивается. Антитела
Rh не фиксируют комплемент и не вызывают внутрисосудистый гемолиз. Механизм разрушения сенсибилизированных антителами эритроцитов, вероятно, заключается в антителозависимых клеточных цитотоксических эффектах, опосредованных клетками РЭ системы.Таким образом, разрушение эритроцитов сходно с разрушением сенсибилизированных антителами тромбоцитов при неонатальной изоиммунной тромбоцитопении. Было показано, что при этом последнем заболевании терапия высокими дозами внутривенного иммуноглобулина может оказывать благотворное влияние. Соответственно, казалось правдоподобным, что подобная терапия может изменить ход образования билирубина и снизить частоту обменных трансфузий у младенцев с резус-изоиммунизацией. Результаты недавнего исследования, в ходе которого была проверена эта гипотеза, пришли к выводу, что, хотя механизмы еще не известны, действительно, внутривенная терапия высокими дозами иммуноглобулинов (500 мг/кг и.v. в течение 2-3 часов, как только установлена резус-несовместимость), снижал уровень билирубина в сыворотке и потребность в переливаниях крови у детей с резус-гемолитической болезнью (J PEDIATR 1992; 121:93-7). Оптимальную дозу внутривенного иммуноглобулина, наиболее эффективное количество инфузий и лучший препарат еще предстоит определить. Несомненно, ответы на некоторые из этих вопросов находятся в ходе испытаний, которые в настоящее время продолжаются. Мы приветствуем постоянный диалог персонала стационара с неонатологами для выяснения текущего состояния этого лечения.
- Лабораторные определения:
При выписке: План послебольничного ухода
- Родители: родители должны знать, что больные младенцы, которые могут быть или не быть анемичными при рождении (особенно те, кто получил одно или несколько внутриутробных переливаний эритроцитов), подвергаются значительному риску развития клинически значимой анемии в течение первых 3-4 лет. месяцев жизни. Их новорожденным следует еженедельно проводить подсчет гематокрита и ретикулоцитов и проводить простые переливания эритроцитарной упаковки (20–25 мл/кг PRBC), если появляются клинические симптомы, если уровень Hb падает ниже 6–7 г/дл без признаков ретикулоцитоза, т.е.е., количество ретикулоцитов <1% или <100 000 на мкл. Хотя младенцы могут стать достаточно анемичными, чтобы развить застойную сердечную недостаточность, чаще у них проявляются признаки плохого кормления или отсутствия активности. Угрожающие жизни клинические признаки могут возникать при наличии наложенных острых заболеваний, т. е. вирусных инфекций.
- Местный врач: необходимо связаться с ним/ней и предоставить ту же информацию, что и родителям, а также предложить возможность в будущем проконсультироваться по телефону с неонатологом из штата отделения интенсивной терапии интенсивной терапии (Dr.Уиднесс или Белл особенно заинтересованы в том, чтобы проследить за этими младенцами).
Каталожные номера:
Миллард Д.Д., Гиддинг С.С., Сокол М.Л. и др. Влияние внутрисосудистых, внутриматочных трансфузий на пренатальный и постнатальный гемолиз и эритропоэз при тяжелой изоиммунизации плода. Дж. Педиатр 1990; 117:447-454.
Weiner CP, Williamson RA, Wenstrom KD, Sipes S, Grant SS, Widness JA. Лечение гемолитической болезни плода с помощью кордоцентеза: I. Прогнозирование анемии плода.Am J Obstet Gynecol 1991;165:546-553.
Несовместимость групп крови гемолитическая болезнь новорожденных
Введение
Гемолитическая болезнь новорожденных (ГБН) относится к аллоиммунному гемолизу плода или новорожденного, вызванному антителами к эритроцитам из-за несовместимости групп крови матери и плода или новорожденного. Распространенность зависит от группы крови. 1,2 Несовместимость по системе ABO — наиболее частая причина ГБН; 3,5 Антиген Rh (D) является вторым по распространенности, и иногда возникает несовместимость антигена Rh (C, c, E, e). 5–7 Сообщалось также о связи некоторых других аллоантител с гемолитическими заболеваниями, включая MNS, Kidd, Diego, Duffy, Kell и Anti-Mur. 9–14 Однако большая часть литературы по этим заболеваниям была опубликована в виде историй болезни. Таким образом, проявления гемолитических заболеваний, связанных с различными несовместимостями малых групп крови, изучены недостаточно. Здесь был проведен ретроспективный анализ новорожденных с гемолитической болезнью малой группы крови, поступивших в один медицинский центр за последние 6 лет, для повышения осведомленности и перинатального ведения населения Китая.
Материалы и методы
Эта тема исследования была одобрена советом по этике институциональных исследований Детской больницы Университета Фудань. Все случаи были выявлены из электронной базы данных и соответствовали критериям включения: новорожденные, поступившие в неонатальное отделение Детской больницы Университета Фудань с диагнозом неонатальной аллоиммунной гемолитической болезни вследствие незначительной несовместимости групп крови в период с 1 января 2013 г. по 31 декабря 2013 г. 2019. Вся электронная информация об этих случаях была проверена, чтобы исключить одиночную группу ABO или Rh, включая несовместимость групп крови D, E, e, C и c, а также другие причины гемолиза, такие как G6PD и мембраны эритроцитов. дефекты, такие как наследственный сфероцитоз, в качестве критериев исключения.Мы получили письменные информированные согласия от родителей всех случаев и получили разрешение на публикацию всех деталей случая.
Ключевыми диагностическими критериями были определены серологические тесты, показывающие положительную реакцию Кумбса и антитела родственной системы групп крови, обнаруженные в сыворотке новорожденных и/или матерей. Другие признаки гемолиза, такие как общий анализ крови, уровень гемоглобина, количество ретикулоцитов и уровень билирубина в сыворотке, соответствовали гемолитической болезни.Во всех случаях были проведены подтвержденные диагностические тесты в Шанхайском центре крови, а образцы крови были отправлены при поступлении или сразу после рождения. Тесты групп крови ABO и RhD проводили с пробиркой стандартными методами для каждого образца, используя моноклональные анти-А, анти-В и анти-D (Shanghai Blood Biomedicine Co., Ltd.). Другие фенотипы эритроцитов (эритроцитов) определяли с использованием моноклональных анти-Е, анти-С, анти-с, анти-е, анти-М, анти-N (Shanghai Blood Biomedicine Co., Ltd.), анти- Dia, анти-Dib, анти-JKa и анти-JKb антитела (Sanquin Reagents B.В.) соответственно. Клетки спектра, использованные для идентификации антител группы крови, были приобретены у Shanghai Blood Biomedicine Co., Ltd. и Sanquin Reagents BV DAT (прямой антиглобулиновый тест) проводили с помощью пробирки с использованием мультиспецифических антиглобулиновых реагентов, моноспецифического антитела-IgG и моноспецифического антитела-C3d. (Шанхайская компания по биомедицине крови, ООО). IAT (непрямой тест на человеческий глобулин, включающий тест на свободные антитела и тест на высвобождение антител) выполняли в пробирке с использованием мультиспецифических антиглобулиновых реагентов и методом колоночной агглютинации с использованием гелевых карт (Bio-Rad Laboratories).
Результаты
Сбор и обобщение данных
Всего было зарегистрировано семь случаев, в том числе три случая гемолитической болезни ПНВ, три случая несовместимости по Диего и один случай Кидда в сочетании с несовместимостью группы крови анти-RhE. Были просмотрены и собраны все электронные карты семи случаев, включая антенатальную и постнатальную информацию, такую как история матери, история рождения, пол, гестационный возраст, лабораторные анализы, включая группы крови матери и ребенка, количество клеток крови, уровень гемоглобина, ретикулоциты, билирубин. , и тест Кумбса.Также были собраны данные о лечении, включая использование фототерапии, ВВИГ, переливании крови или обменном переливании крови, а также результаты. Фототерапию и обменное переливание крови проводили в соответствии с критериями Руководства по клинической практике Американской ассоциации педиатрии для фототерапии и обменного переливания крови у госпитализированных новорожденных со сроком гестации 35 и более недель. 15
Результат
В ходе нашего поиска было обнаружено, что с гемолитической болезнью связаны в общей сложности три различных второстепенных группы крови, включая группы крови MNS, Diego и Kidd.Мы суммировали все случаи в отдельные категории следующим образом (таблица 1).
Таблица 1 Клинические характеристики беременных и новорожденных с гемолитической болезнью малой группы крови |
Три случая гемолитической болезни ПНВ
Случай 1. Мужчина, рожденный путем кесарева сечения в сроке 39 +1 недель с массой тела при рождении 3950 г от здоровой 32-летней матери (G1P1), поступил в отделение интенсивной терапии на 3-й день в связи с желтухой и анемией. со 2 дня жизни.Пробу Кумбса выполняли сразу по клинической картине. ДАТ (прямая реакция агглютинации) была отрицательной, а ИАТ (непрямая антиглобулиновая реакция) — положительной, в сыворотке новорожденного были обнаружены анти-М антитела. В период госпитализации получал только фототерапию, без переливания крови, так как в дальнейшем гемоглобин не ухудшался. Это был первый ребенок матери, зачатый с помощью ЭКО, и у матери был результат скрининга антител анти-М и титры 1:512 IgM и 1:256 IgG на 35 неделе беременности.Все клинические характеристики приведены в таблице 1.
Случай 2, младенец мужского пола, родившийся через естественные родовые пути в возрасте 37 90 147 +6 90 148 недель с массой тела при рождении 3000 г от здоровой 23-летней матери (G2P2), поступил в отделение интенсивной терапии на 4-й день из-за желтухи, возникшей со дня 2 жизни. После поступления к пациенту с отрицательным ДАТ и положительным ИАТ выполняли пробу Кумбса, в сыворотке новорожденного были обнаружены анти-М антитела. Он получил фототерапию для лечения. Эта мать получала регулярную дородовую помощь во время беременности, но скрининговый тест на антитела не проводился.Ее первым ребенком была здоровая четырехлетняя девочка без желтухи при рождении.
Случай 3: младенец мужского пола был госпитализирован в отделение интенсивной терапии на 27-й день с подтвержденным диагнозом анти-М ГБН при рождении в родильном доме, где у него были положительные результаты ИАТ и отрицательные результаты ДАТ, и он получил одно переливание крови, одно внутривенное иммуноглобулин и множественные фототерапия. Поступление в отделение интенсивной терапии было связано с тяжелой анемией. И DAT, и IAT были отрицательными, но скрининговый тест на антитела к анти-М был положительным на 27-й день.После госпитализации было проведено 2-е переливание крови. Этот ребенок был недоношенным ребенком G5P1 с гестационным возрастом 34 +1 недель и массой тела при рождении 2345 г, рожденным путем кесарева сечения из-за связанной с МН ГБН у плода и повышенной пиковой систолической скорости в средней мозговой артерии плода (СМА). -ПСВ) на УЗИ. 16 У этой 33-летней матери был очень сложный материнский анамнез: четыре предыдущие неудачные беременности, в том числе одна внутриутробная смерть и три спонтанных аборта, два из которых были подтверждены водянкой плода.У этой пациентки была беременность 5 лет, и положительный результат скрининга на антитела к анти-М был обнаружен на 20-й неделе беременности во время этой беременности. Плод дважды получил внутриматочную трансфузию (ВМУ) с О-RhD- и М-эритроцитами в 30 и 32 +6 недель гестации соответственно. Кордоцентез был выполнен во время первого ВМИ, и из образца пуповинной крови были элюированы алло-анти-М антитела, что свидетельствовало о наличии у плода ГБПН, связанной с ЗН.
Все три из этих случаев гемолитической болезни группы крови MN имеют один и тот же тип антител, который является анти-M.Группы крови МН у матерей и новорожденных были одинаковыми, а именно МН у матери и НН у новорожденного. Желтуха возникла в течение первых двух дней во всех трех случаях. Уровень билирубина был невысоким, так как все больные были отправлены из родильных домов, а фототерапию начинали сразу после появления желтухи. У двух новорожденных была разная степень анемии, а минимальные значения гемоглобина в случаях 1 и 3 были ниже 93 г/л и 49,2 г/л соответственно. В случае 3 пациентке потребовалось два цикла ВМИ и два цикла переливания эритроцитарной крови после рождения, а также ВВИГ, что является наиболее радикальной терапией.Пренатальное обследование выявило положительные скрининговые тесты на антитела в двух случаях, а последующее пренатальное наблюдение за MCA-PSV помогло диагностировать наиболее тяжелый случай (случай 3).
Три случая гемолитической болезни Диего
Случай 4 и случай 5 были монохориальными диамниотическими (МД) близнецами, родившимися в гестационном возрасте 37 +4 недель, и оба были госпитализированы в отделение интенсивной терапии на 4-й день. Эти два новорожденных мужского пола были G5P2 и G5P3, рожденные путем кесарева сечения. с массой тела при рождении 2700 г и 2200 г у здоровой матери 37 лет.Они были переведены из-за выраженной желтухи со 2-го дня жизни без анемии и подозрения на гемолиз в местную больницу. G1P1 этой матери была здоровой девочкой без истории желтухи в периоде новорожденности, но другие беременности матери дважды закончились искусственными родами и один раз идиопатическим самопроизвольным абортом. Во время беременности она не проходила скрининговый тест на антитела. Пробы Кумбса были проведены в роддоме для близнецов в связи с ранним началом желтухи.Оба теста DAT были положительными, но лаборатория не смогла подтвердить тип антител. Мы отправили все образцы крови матери и близнецов в Шанхайский центр крови для повторения тестов Кумбса, и положительные результаты как для DAT, так и для IAT были подтверждены как анти-Dib. Группа крови матери была A+, Di(a+b-), и оба близнеца имели одинаковую группу крови, O+, Di(a+b+). Оба близнеца получали ВВИГ, альбумин и фототерапию в качестве лечения. Первоначальная плановая гемотрансфузия была отменена из-за отсутствия Di(b-) PRBC в первый день, после чего гипербилирубинемия хорошо контролировалась.
Случай 6, недоношенный новорожденный мальчик, родился у 44-летней матери (G4P2) на сроке беременности 32 +1 недель путем кесарева сечения из-за подозрения на водянку плода на УЗИ с массой тела при рождении 2380 г. Этот плод получил внутриутробное переливание (ВМУ) шесть раз с 24 недель гестационного возраста до рождения с O RhD-, Di(a-) эритроцитами после подтвержденного материнского положительного теста на антитела к анти-Dia и повышенной пиковой систолической скорости в среднем мозге плода. артерия (MCA-PSV) на УЗИ.Мать была переведена из местной больницы из-за положительного результата скрининга на антитела с неясным типом антител. Младенцу потребовалась поддержка CPAP вскоре после родов из-за неонатального респираторного дистресс-синдрома (NRDS). У него не было значительной водянки после полной оценки при рождении, но у него была тяжелая анемия с минимальным значением гемоглобина всего 57 г / л, когда он был госпитализирован в наше отделение интенсивной терапии в течение 24 часов жизни, снизился со 116 г / л при рождении. Его лечили однократным переливанием крови после рождения, тремя дозами ВВИГ, однократным переливанием эритроцитов и многократной фототерапией.До этой беременности у матери был один здоровый ребенок и два идиопатических самопроизвольных аборта.
Все эти три случая (№ 4, 5 и 6) были расценены как гемолитическая болезнь из-за несовместимости группы крови Диего. У близнецов (случаи 4 и 5) на 2-й день отмечалась желтуха от умеренной до тяжелой степени, а пиковые уровни общего билирубина составляли 430 мкмоль/л и 356,7 мкмоль/л соответственно. Однако только у одного из близнецов была легкая анемия с уровнем гемоглобина 144 г/л и ретикулярным счетом 8,8%. В обоих случаях диагноз был подтвержден положительными тестами DAT, IAT и анти-Dib-антителами.Пациенты выздоровели с помощью фототерапии, ВВИГ и переливания альбумина. Случай 6 был еще одним случаем гемолитической болезни из-за несовместимости Диего, вызванной анти-Dia-антителом. В этом случае наблюдалась тяжелая ГБПН с начала третьего триместра. Хотя гипербилирубинемия не была особенно значительной, с пиковым значением TSB 223,5 мкмоль/л после рождения, у него была тяжелая анемия, требующая обменного переливания крови и переливания эритроцитарной массы даже после шести ВМИ.
Один случай гемолитической болезни из-за сочетания несовместимости групп крови по Кидду и резус-фактору
Случай 7. Женщина родилась в возрасте 38 90 147 +4 90 148 недель вагинальными родами от здоровой 28-летней матери (G2P2).Первым ребенком матери был здоровый мальчик без желтухи при рождении и без осложнений беременности. Однако во время этой беременности у нее был положительный результат скрининга на антитела в местной больнице без определения типа антител. Она была направлена в больницу третичного уровня для дородового наблюдения и родовспоможения. У новорожденного в течение 24 часов после рождения развилась тяжелая гипербилирубинемия с пиковым значением билирубина 444,2 мкмоль/л и минимальным значением гемоглобина 117 г/л. Тесты Кумбса, проведенные Шанхайским центром крови, дали положительный результат на DAT и IAT, с положительным скринингом на антитела к E и JKa и DAT/IAT.Диагноз комбинированных антител также появляется в другой литературе. 17 Было проведено полное лечение ГБН, включая переливание крови, ВВИГ и фототерапию.
Все семь пациентов прошли официальные тесты Кумбса для диагностики в Шанхайском центре крови. Тесты, проводимые в больничных лабораториях, сообщают о положительном результате DAT и/или IAT и положительном скрининге на антитела, но не подтверждают группу крови, ответственную за гемолитическую болезнь. Некоторые матери были переведены из местных больниц за пределами Шанхая из-за положительного скрининга антител в сыворотке матери с неясным типом антител (случай 7).Антенатальная диагностика проводилась в Шанхайском центре крови в некоторых случаях (случаи 1, 3 и 6) на основании скрининговых тестов материнской крови на антитела.
Во всех зарегистрированных случаях была разная степень желтухи, а уровень гемоглобина колебался от 49,2 до 207 г/л, что может отражать вариабельность тяжести гемолиза. В самом тяжелом из трех случаев ПНВ группа крови имела IUT и тяжелую анемию, но в двух других случаях была только легкая анемия и умеренная желтуха, требующая фототерапии.То же самое произошло с группой крови Диего.
Также было замечено, что все случаи MNS группы крови имели положительный IAT и отрицательный DAT. У двух пациентов, перенесших IUT, были отрицательные результаты DAT. Однако еще в двух случаях несовместимости по Диего были положительные DAT и IAT.
Состояние всех семи пациентов улучшилось, и они были выписаны. Все они прошли МРТ головного мозга и БАЭП перед выпиской для оценки потенциального повреждения головного мозга из-за ранней гипербилирубинемии и анемии. В случае 7 были аномальные сигналы МРТ правой теменной доли и правого хвостатого ядра, которые были диагностированы как инфаркты головного мозга неясной причины.Случай 3 и случай 6, как недоношенные дети, имели признаки недоношенности на МРТ головного мозга. Ни у одного из детей не было выявлено значимых признаков билирубиновой энцефалопатии на МРТ. Результаты слухового вызванного потенциала ствола головного мозга (ССВП) показали, что в случае 1 нарушение было на левой стороне с порогом слышимости 45 дБ, а в случаях 6 и 7 — на обеих сторонах с легкой степенью потери слуха. Остальные четыре младенца прошли это обследование перед выпиской. Случаи 1, 6 и 7 прошли BAEP во время последующего наблюдения. Все семь случаев наблюдались в разном возрасте.Самый старший возраст наблюдения составил три года для случая 3; большинство других случаев наблюдались до двухлетнего возраста. Самое короткое последующее наблюдение было за пациенткой 7, которую в последний раз видели в нашей клинике в возрасте 6 месяцев. Ни одному из пациентов не потребовалось переливание эритроцитов после выписки, а некоторые получали препараты железа. Ни у одного из них не было долгосрочных проблем со слухом, моторным развитием или зубной эмалью, а также экстрапирамидных симптомов или атетоза.
Дискуссия
Дискуссия
В Китае ГБН чаще всего вызывается несовместимостью группы крови по системе АВО, за которой следует несовместимость группы крови по резус-фактору.Сообщалось, что на ABO HDN приходится 85,3%, а на резус-фактор гораздо меньше, чем 14,6% от общего числа случаев в Китае. 18 Другие несовместимости систем групп крови, такие как MNS, Diego и Kidd, встречаются относительно редко. Пренатальное обнаружение гемолитической болезни, вызванной несовместимостью малой группы крови, недостаточно во всем Китае. Отсутствие подтвержденного антенатального диагноза может представлять проблему для неонатологов, поскольку клиническая тяжесть этих состояний различна. Клиническая картина и лабораторные характеристики ГБН по системе АВО и Rh понятны большинству акушеров и неонатологов, 19–21 , но это не относится ко всем этим ГБН минорной группы крови. 22 Последовательное антенатальное и послеродовое ведение важно как для акушеров, так и для неонатологов. При ранней желтухе с положительной пробой Кумбса, ДАТ или ИАТ, а также необъяснимыми антителами в течение первых нескольких дней необходимо исключить все типы гемолитических заболеваний малых групп крови.
Мы также заметили четыре случая с положительным скринингом на антитела во время дородового наблюдения в наших случаях. Скрининг на антитела во время беременности рекомендуется для антенатальной диагностики. Для беременных женщин с положительными результатами дальнейшее наблюдение в сочетании с определением пиковой систолической скорости средней мозговой артерии плода (СМА-ПСВ) на УЗИ является протоколом, предложенным для выявления тяжелого внутриутробного гемолиза. 23 Поскольку случаи 3 и 6 в нашем исследовании получили пользу от этого скрининга, и у матерей в обоих случаях было более одного идиопатического самопроизвольного аборта в предыдущих беременностях, гибель плода из-за тяжелого гемолиза могла быть причиной предыдущих абортов. . Тяжелые симптомы гемолиза были замечены после положительного скрининга на антитела во время беременности, и для спасения использовались внутриматочные переливания (ВМС). 24 Даже в случаях без внутриутробных вмешательств антенатальный скрининг помогает акушерам и неонатологам более тщательно отслеживать тяжесть гемолиза у новорожденных, и может быть проведен ранний перевод или лечение, как в случаях 1 и 7.Поэтому антенатальный скрининг необходим для выявления тяжелых случаев и после внутриутробного вмешательства. 25
АнтителоAnti-M является вторым наиболее распространенным антителом, не относящимся к RhD, идентифицируемым у беременных женщин, 26 , но оно не считается важной причиной ГБН, особенно у представителей европеоидной расы и чернокожего населения. 8,27 Причина в том, что анти-М-антитела были идентифицированы как встречающиеся в природе антитела, 28 и в ретроспективных исследованиях были зарегистрированы анти-М-антитела IgM и IgG среди населения США и Нидерландов, 8 ,29 без случаев ГБН легкой или тяжелой степени.Кроме того, анти-М были обнаружены в сыворотке крови лиц, не контактировавших с эритроцитами человека. Однако сообщается об увеличении числа случаев ГБН, вызванных анти-М, особенно у японцев, китайцев и других азиатских народов. 30–32 Анти-М также было наиболее частым антителом в нашем исследовании, и все случаи были вызваны одним и тем же анти-М антителом системы групп крови MNS. Один случай был первой беременностью матери, а два других случая были второй и пятой беременностью, что аналогично картине, наблюдаемой для ABO HDN, поскольку анти-М-антитела могут встречаться естественным образом. 26 Тяжесть этой ГБН весьма вариабельна, о чем также сообщалось в предыдущих исследованиях. 33,34 Все случаи были отрицательными для DAT, который отличается от других минорных групп крови и Rh HDN. Это важный момент, помогающий клиницистам идентифицировать анти-М ГБН, поскольку большинство случаев ГБН имеют положительный DAT, за исключением ГБН группы ABO. 4 Если результат DAT отрицательный, большинство клиницистов исключают болезнь гемолиза с незначительной группой крови, и если у пациента наблюдается гемолиз, будет проведена IAT по системе ABO, что может привести к ошибочному диагнозу анти-M-гемолиза.
Таким образом, мы предлагаем проводить тесты DAT и IAT всем пациентам с подозрением на гемолиз. Для случаев с положительными DAT и IAT лучше определить тип антител к эритроцитам. Поскольку заболевания гемолизом с малыми группами крови встречаются редко у населения, этот полный лабораторный тест со всеми стандартными эритроцитами для всех групп крови экономически нецелесообразно проводить во всех местных больницах, но необходимо, чтобы одна лаборатория в районе имела возможность идентифицировать эти антитела, чтобы редкие образцы можно было отправить на диагностику.Другим решением является организация центральных центров крови, оснащенных лабораторным оборудованием для определения большинства антител к малым группам крови, и нескольких медицинских центров третичного уровня, которые могут проводить дородовое лечение, такое как внутриматочное переливание (ВМУ). Тогда беременную можно будет переводить при подозрении на несовместимость малой группы крови, как в некоторых наших случаях.
Остальные типы, Diego 35,36 и Kidd, 37,38 , обычно проявлялись желтухой, анемией после рождения и положительными результатами DAT и IAT, что помогло поставить подтвержденный диагноз.В единственном случае с отрицательным ДАТ было несколько ВМИ, что, вероятно, указывает на то, что лабораторные результаты группы крови плода и новорожденного, ДАТ и ВИТ могут измениться после ВМИ.
Комплекс анти-E и JKa-антител возник в случае 7, и у пациента были выраженные симптомы гемолиза, требующие либо обменного переливания крови, либо переливания эритроцитарной массы. По результатам лабораторных исследований титры двух типов антител были одинаковыми, поэтому трудно определить, какая из них является основной причиной.Однако смешанные антитела из разных групп крови могут сделать симптомы гемолиза более серьезными. 17
Общее ведение для всех семи случаев в нашем проекте представляло собой рутинную клиническую помощь, включая мониторинг билирубина, фототерапию, обменное переливание, ВВИГ, переливание эритроцитов и оценку центральной нервной системы. 15 Хотя время анемии и гипорегенерации эритробластов варьируется, тяжесть гемолиза может различаться в зависимости от типа, поэтому необходимы тщательный мониторинг и последующее наблюдение.Все семь пациентов в этой серии случаев выжили. Это указывает на то, что лечение и последующее наблюдение за ГБН в настоящее время хорошо проводится в Китае, но раннее уточнение диагноза влияет на лечение, что может помочь предотвратить ранние роды или аборт и водянку плода.
Заключение
Существует более 30 видов гемолиза малых групп крови, и у нас было 7 таких случаев, в том числе три разных группы крови в одном центре. Характеристики этих трех типов варьируют, и мы подчеркиваем, что антенатальный скрининговый тест на антитела является простым тестом первой линии для беременных женщин.Исследование пиковой систолической скорости в средней мозговой артерии плода (СМА-ПСВ) на УЗИ помогает выявить тяжелые случаи. Необходим полный тест Кумбса, включающий как DAT, так и IAT для новорожденных с подозрением. Ненадежно проверять только DAT теста Кумбса для диагностики ГБН малой группы крови, поскольку DAT может быть изменен внутриутробным вмешательством и отрицательным для гемолиза MNS. Доступ к беспрепятственной региональной системе передачи образцов крови и пациентов в тяжелых случаях необходим для учреждений, не имеющих полных диагностических возможностей.Четкие результаты типирования аллоантител важны для подготовки к обменным трансфузиям и/или переливаниям эритроцитарной массы (эритроцитарной массы) в тяжелых случаях и последующем наблюдении.
Вклад авторов
Линь Минчунь: сбор и анализ данных, написание статьи.
Лю Мэйсю: сбор и анализ данных.
Чжан Шулянь: сбор данных, интерпретация данных.
Чен Чао: окончательное утверждение версии.
Ван Цзинь: дизайн исследования, доработка и окончательное утверждение проекта.
Все авторы, внесшие свой вклад в статью, согласовали журнал, в который будет отправлена статья, дали окончательное одобрение версии для публикации и соглашаются нести ответственность за все аспекты работы.
Финансирование
Это исследование не получило специального гранта от финансирующих агентств в государственном, коммерческом или некоммерческом секторах.
Раскрытие информации
Все авторы сообщили об отсутствии конфликта интересов.
Каталожные номера
1.де Хаас М., Турик Ф.Ф., Колевейн Дж.М., ван дер Шут С.Э. Гемолитическая болезнь плода и новорожденного. Вокс Санг . 2015;109(2):99–113. doi:10.1111/vox.12265
2. Ma X, Chen FZ, Hong Q. [Анализ результатов скрининга 501 новорожденного с гемолитической болезнью]. Чжунго Ши Янь Сюэ Е Сюэ За Чжи . 2019;27(1):192–196. Китайский язык. doi:10.7534/j.issn.1009-2137.2019.01.031
3. Дойл Б., Куигли Дж., Ламберт М. и соавт. Взаимосвязь между тяжелой гемолитической болезнью плода и группой крови новорожденного и матери. Трансфус Мед . 2014;24(4):239–243. doi:10.1111/tme.12132
4. Herschel M., Karrison T., Wen M., Caldarelli L., Baron B. Маловероятно, что изоиммунизация может быть причиной гемолиза у новорожденных, несовместимых с АВО, но с отрицательным тестом на антиглобулин. Педиатрия . 2002; 110 (1 часть 1): 127–130.
5. Rath ME, Smits-Wintjens VE, Lindenburg IT, et al. Постнатальный исход у новорожденных с тяжелым резус-фактором с по сравнению с гемолитической болезнью резуса-D. Переливание .2013;53(7):1580–1585. doi:10.1111/j.1537-2995.2012.03937.x
6. Тевари В.В., Кумар А., Сингхал А. и др. Оценка резус-гемолитической болезни у новорожденных и лечение с помощью ранней интенсивной фототерапии в отделении интенсивной терапии новорожденных. J Trop Pediatr . 2020;66(1):75–84. дои: 10.1093/тропей/FMZ033
7. Алтунюрт С., Окяй Э., Саатли Б., Джанбахишов Т., Демир Н., Озкан Х. Неонатальные исходы плодов, получающих внутриутробное переливание по поводу тяжелой водянки, осложненной резус-гемолитической болезнью. Int J Gynaecol Obstet . 2012;117(2):153–156. doi:10.1016/j.ijgo.2011.12.013
8. Koelewijn JM, Vrijkotte TG, van der Schoot CE, Bonsel GJ, de Haas M. Влияние скрининга на антитела к эритроцитам, отличные от анти-D, для выявления гемолитической болезни плода и новорожденного: популяционное исследование в Нидерланды. Переливание . 2008;48(5):941–952.
9. Katsuragi S, Ohto H, Yoshida A, et al. Анемическое заболевание новорожденных с небольшим увеличением гемолиза и эритропоэза из-за материнских анти-Jr(a): тематическое исследование и обзор литературы. TRANSFUS MED REV . 2019;33(3):183–188. doi:10.1016/j.tmrv.2019.03.002
10. Gu S, Wang HX, Yang CY, et al. Клинический анализ семи случаев редкой гемолитической болезни новорожденных. Чжунхуа Эр Кэ За Чжи . 2018;56(5):369–372. Китайский язык. doi: 10.3760/cma.j.issn.0578-1310.2018.05.012
11. Wei CT, Al-Hassan FM, Naim N, Knight A, Joshi SR. Распространенность антигена группы крови Диего и антител в трех этнических группах населения в долине Кланг в Малайзии. Азиатский J Transfus Sci . 2013;7(1):26–28. дои: 10.4103/0973-6247.106725
12. Bakhtary S, Gikas A, Glader B, Andrews J. Anti-Mur как наиболее вероятная причина легкой формы гемолитической болезни новорожденных. Переливание . 2016;56(5):1182–1184. doi:10.1111/trf.13552
13. Weiner CP, Widness JA. Снижение эритропоэза плода и гемолиза при гемолитической анемии Келла. Am J Obstet Gynecol . 1996;174(2):547–551. дои: 10.1016/S0002-9378(96)70425-8
14.Лечение гипербилирубинемии у новорожденных. 35 и более недель беременности. Педиатрия. 2004;114(1):297–316. doi:10.1542/peds.114.1.297
15. Мари Г., Детер Р.Л., Карпентер Р.Л. и др. Неинвазивная диагностика с помощью ультразвуковой допплерографии анемии плода вследствие аллоиммунизации эритроцитов матери. Совместная группа по допплеровской оценке скорости кровотока у анемичных плодов. N Английский J Med . 2000;342(1):9–14. дои: 10.1056/NEJM200001063420102
16.Маркхэм К.Б., Росси К.К., Нагараджа Х.Н., О’Шонесси Р.В. Гемолитическая болезнь плода и новорожденного, обусловленная множественными материнскими антителами. Am J Obstet Gynecol . 2015;213(1):61–68. doi:10.1016/j.ajog.2015.01.049
17. Ян ЗЫСТ. Значение скринингового теста на антитела в женской консультации для профилактики ГБН. Приложение одного случая с анти-М неонатальной гемолизной болезнью. Чин Дж. Иммунол . 2017;2(33):278–279.
18. Christensen RD, Baer VL, MacQueen BC, O’Brien EA, Ilstrup SJ.Гемолитическая болезнь плода и новорожденного по системе АВО: данные тринадцати лет после внедрения универсальной программы скрининга и лечения билирубина. J ПЕРИНАТОЛ . 2018;38(5):517–525. дои: 10.1038/s41372-018-0048-4
19. Луи Д., Мор К., Оберой С., Шах П.С. Внутривенный иммуноглобулин при изоиммунной гемолитической болезни новорожденных: обновленный систематический обзор и метаанализ. Arch Dis Child Fetal Neonatal Ed . 2014;99(4):F325–31. дои: 10.1136/archdischild-2013-304878
20.Кристенсен Р.Д., Яиш Х.М. Гемолиз у недоношенных новорожденных. Клин Перинатол . 2016;43(2):233–240. doi:10.1016/j.clp.2016.01.002
21. Мойзе К.Дж. Анти-D-антитела при аллоиммунизации эритроцитов. Eur J Obstet Gynecol Reprod Biol . 2000;92(1):75–81. дои: 10.1016/S0301-2115(00)00428-0
22. Lee CK, Ma ES, Tang M, Lam CC, Lin CK, Chan LC. Распространенность и специфичность клинически значимых аллоантител к эритроцитам у китайских женщин во время беременности — обзор случаев с 1997 по 2001 год. Трансфус Мед . 2003;13(4):227–231. doi:10.1046/j.1365-3148.2003.00445.x
23. Кастильо Л. Обновление системы групп крови MNS. Иммуногематология . 2019;35(2):61–62. doi:10.21307/иммуногематология-2020-014
24. Slootweg YM, Walg C, Koelewijn JM, Van Kamp IL, De Haas M. Знание, отношение и практика поставщиков акушерских услуг в отношении иммунизации матери красными кровяными тельцами во время беременности. Вокс Санг . 2020;115(3):211–220. дои: 10.1111/голос.12883
25. Рейд М.Е. Система групп крови MNS: обзор. Иммуногематология . 2009;25(3):95–101.
26. Де Янг-Оуэнс А., Кеннеди М., Роуз Р.Л., Бойл Дж., О’Шонесси Р. Анти-М изоиммунизация: управление и результаты в Университете штата Огайо с 1969 по 1995 год. Obstet Gynecol . 1997; 90(6):962–966. дои: 10.1016/S0029-7844(97)00476-6
27. Хассан М.Н., Мохд Н.Н., Йохан Н.С., Сукри С.А., Мустафа Р., Люк А.Х. Гемолитическая болезнь плода и новорожденного, вызванная материнскими аллоантителами к эритроцитам в малайской популяции. Азиатский J Transfus Sci . 2014;8(2):113–117. дои: 10.4103/0973-6247.137449
28. Li S, Mo C, Huang L, et al. Гемолитическая болезнь плода и новорожденного, вызванная аллоанти-М: три китайских клинических случая и обзор литературы. Переливание . 2019;59(1):385–395. doi:10.1111/trf.15054
29. Стетсон Б., Скрейп С., Маркхэм К.Б. Аллоиммунизация анти-М: ведение и исход в одном учреждении. Представитель AJP . 2017;7(4):e205–10. дои: 10.1055/s-0037-1607028
30.Мохд Н.Х., Нур Х.М., Шафини М.Ю., Нур САА, Рапиа М., Ван З.А. Anti-M индуцировал тяжелую гемолитическую болезнь плода и новорожденного у малайской женщины с невынашиванием беременности. Малайцы Дж. Патол . 2017;39(1):73–76.
31. Yasuda H, Ohto H, Nollet KE, et al. Гемолитическая болезнь плода и новорожденного с поздней анемией, вызванной анти-М: отчет о клиническом случае и обзор японской литературы. Transfus Med Rev . 2014;28(1):1–6. doi:10.1016/j.tmrv.2013.10.002
32.Гао XY, Хуан Х, Ли ЛД. [Гемолитическая болезнь новорожденных, вызванная анти-М: отчет об одном случае и обзор отчетов о 21 случае]. Чжунхуа Эр Кэ За Чжи . 2009;47(9):648–652. Китайский язык.
33. Арора С., Дода В., Мария А., Котвал У., Гоял С. Гемолитическая болезнь новорожденных, индуцированная материнским анти-М, с последующей длительной анемией у новорожденных близнецов. Азиатский J Transfus Sci . 2015;9(1):98–101. дои: 10.4103/0973-6247.150968
34. Викман А., Эднер А., Грифельт Г., Йонссон Б., Хентер Дж.И.Гемолитическая анемия плода и внутриутробная смерть, вызванная анти-М иммунизацией. Переливание . 2007;47(5):911–917. doi:10.1111/j.1537-2995.2007.01209.x
35. Lenkiewicz B, Zupanska B. Первый пример анти-Diego(b) обнаружен у польки с фенотипом Di(a+b-) и гемолитической болезнью новорожденного, не требующей лечения. Трансфус Мед . 2003;13(3):161–163. doi:10.1046/j.1365-3148.2003.00437.x
36. О Э.Дж., Джекарл Д.В., Джанг Х.С. и др. Тяжелая гемолитическая болезнь новорожденного, вызванная анти-Di b, лечилась фототерапией и внутривенным иммуноглобулином. Научная лаборатория Энн Клин . 2008;38(1):80–82.
37. Гамильтон Дж.Р. Система групп крови Кидда: обзор. Иммуногематология . 2015;31(1):29–35.
38. Лавицки С., Ковин Р.Б., Пауэрс А.А. Система групп крови Кидда (Дж.К.). Transfus Med Rev . 2017;31(3):165–172. doi:10.1016/j.tmrv.2016.10.003
Ведение беременности с несовместимостью по системе АВО
Назад к результатам поиска01.09.2011
Автор: Майкл Т.Меннути, MD
Редактор: Сириша Редди, MD
Зарегистрированные пользователи также могут загрузить PDF-файл или прослушать подкаст этой жемчужины.
Войдите сейчас или создайте бесплатную учетную запись, чтобы получить доступ к бонусным функциям Pearls.
Несовместимость по системе АВО является наиболее распространенной несовместимостью групп крови матери и плода и наиболее частой причиной гемолитической болезни новорожденных (ГБН). Несовместимость по системе АВО чаще наблюдается у новорожденных с группой крови А из-за более высокой частоты группы А по сравнению с группой В в большинстве популяций.Чаще встречается у лиц африканского или латиноамериканского происхождения. АВО-несовместимость у новорожденных обычно проявляется желтухой новорожденных из-за гемолитической анемии с положительной реакцией Кумбса и встречается у 0,5–1% новорожденных. В отличие от тяжелой внутриутробной или неонатальной гемолитической анемии, связанной с резус-сенсибилизацией, клинически значимая неонатальная анемия вследствие несовместимости по системе АВО возникает нечасто. Основной клинической проблемой ГБН из-за несовместимости по системе АВО является желтуха.
Было предложено несколько причин, объясняющих отсутствие внутриутробного гемолиза из-за несовместимости по системе АВО.К ним относятся менее развитые антигены А и В на эритроцитах плода для стимуляции продукции материнских антител и повсеместное распространение антигенов А и В в других тканях, что приводит к меньшему количеству антител, проникающих через плаценту для связывания с антигенами на эритроцитах плода. Наиболее важной причиной того, что несовместимость по системе АВО не вызывает водянку плода, является то, что встречающиеся в природе анти-А и анти-В антитела представляют собой IgM и не проникают через плаценту.
Менее 1 % матерей с типом О имеют клинически значимые антитела анти-А или анти-В, представляющие собой IgG.Несовместимость по системе АВО с трансплацентарным переносом антител IgG анти-А или, чаще, антител анти-В редко сообщалась в связи с внутриутробным гемолизом, приводящим к водянке плода. Другие причины неиммунной водянки плода систематически не исключались в этих сообщениях о случаях. Наиболее вероятным объяснением этих редких случаев является то, что контакт с антигенами, подобными антигенам А или В, может происходить из источников, отличных от плода, и стимулирует выработку IgG у матери.Например, антиген, подобный антигену В, обнаружен в E.coli, и воздействие этого организма может стимулировать выработку антител IgG анти-В у людей с типом О.
В отличие от резус-несовместимости, которая имеет тенденцию усугубляться с каждой последующей резус-положительной беременностью, несовместимость по системе АВО не имеет какой-либо постоянной закономерности. Таким образом, первый потомок пациента может иметь клинически значимую гемолитическую болезнь новорожденного из-за несовместимости по системе АВО, в то время как последующие новорожденные могут быть не затронуты или поражены очень слабо.Из-за редкости тяжелого внутриутробного гемолиза из-за несовместимости по системе АВО оценка внутриутробной анемии плода не рекомендуется на основании наличия у матери группы крови О. Измерение антител IgG анти-А и анти-В может рассматриваться как часть оценки необъяснимых признаков анемии плода, таких как асцит или водянка, когда у матери группа крови О. Сбор образца пуповинной крови при рождении для определения группы крови и прямого тестирования на антитела следует рассматривать, когда у матери тип О, а у предыдущего ребенка была гемолитическая болезнь новорожденного из-за несовместимости по системе АВО.
Дополнительная литература:
Американский колледж акушеров и гинекологов (ACOG), Практический бюллетень ACOG № 192: Управление аллоиммунизацией во время беременности. Акушер-гинеколог. 2018 март; 131(3):e82-e90. doi: 10.1097/AOG.0000000000002528.
Koelewijn JM, Vrijkotte TG, van der Schoot CE, Bonsel GJ, et al. Влияние скрининга на антитела к эритроцитам, кроме анти-D, для выявления гемолитической болезни плода и новорожденного: популяционное исследование в Нидерландах. Переливание. 2008 май; 48(5):941-52. doi: 10.1111/j.1537-2995.2007.01625.x. Epub 2008, 1 февраля. PMID: 18248570.
Мойзе К.Дж. младший, Арготи П.С. Ведение и профилактика аллоиммунизации эритроцитов во время беременности: систематический обзор. Акушер-гинеколог. 2012 ноябрь; 120(5):1132-9. doi: 10.1097/aog.0b013e31826d7dc1. PMID: 230
Первоначальное утверждение, сентябрь 2011 г.; Пересмотрено в январе 2017 г. Пересмотрено в мае 2018 г. Подтверждено в ноябре 2019 г.
********** Уведомление об использовании ************
Общество академических специалистов по общему акушерству и гинекологии, Inc.(«SASGOG») стремится к точности и будет постоянно проверять и проверять все Жемчужины, чтобы отражать текущую практику.
Этот документ предназначен для оказания помощи практикующим врачам в обеспечении надлежащей акушерско-гинекологической помощи. Рекомендации основаны на руководящих принципах основных обществ и высококачественных доказательствах, если они доступны, и дополнены мнением автора и редакционной коллегии, когда это необходимо. Его не следует истолковывать как диктующий эксклюзивный курс лечения или процедуры, которой необходимо следовать.
Внесение изменений в практику может быть оправдано, когда, по разумному суждению лечащего врача, такой курс действий показан состоянием пациента, ограниченностью доступных ресурсов или достижениями в знаниях или технологиях. SASGOG регулярно просматривает статьи; однако его публикации могут не отражать самые последние данные. Несмотря на то, что мы прилагаем все усилия для предоставления точной и надежной информации, эта публикация предоставляется «как есть» без каких-либо явных или подразумеваемых гарантий точности, надежности или иных обстоятельств.SASGOG не гарантирует и не поддерживает продукты или услуги какой-либо фирмы, организации или лица. Ни SASGOG, ни ее соответствующие должностные лица, директора, члены, сотрудники или агенты не несут ответственности за любые убытки, ущерб или претензии в отношении любых обязательств, включая прямые, специальные, косвенные или косвенные убытки, понесенные в связи с этой публикацией или доверие представленной информации.
Copyright 2021 Общество академических специалистов в области общего акушерства и гинекологии, Inc.Все права защищены. Запрещается перепечатывать, дублировать или размещать без предварительного письменного согласия.
Назад к результатам поиска
Гемолитическая болезнь плода и новорожденного: ведение матери, плода и новорожденного | Гематология, Образовательная программа ASH
По оценкам, в США регистрируется от 3/100 000 до 80/100 000 случаев ГБПН в год. 1 Антитела материнской группы крови, вызывающие ГБПН, могут быть естественными антителами АВО (изогемагглютининами) или развиваться после контакта с чужеродными эритроцитами; последние называются аллоантителами группы крови.Для возникновения ГБПН плод должен быть антиген-положительным (унаследованным по отцовской линии), а мать должна быть антиген-отрицательной. В нескольких исследованиях изучалась распространенность эритроцитарной сенсибилизации. В большой серии из 22 102 женщин в США у 254 (1,15%) женщин были обнаружены аллоантитела к эритроцитам, из которых 18% имели более одного аллоантитела. 2 В Нидерландах распространенность аллоантител к эритроцитам, обнаруженных в первом триместре, составила 1,2%. 3
Наиболее частая причина несовместимости групп крови связана с системой групп крови АВО, при этом несовместимость присутствует у 20% младенцев. 4 Однако, поскольку анти-АВО антитела относятся преимущественно к классу IgM, большинство из них не эффективно транспортируются через плаценту. Кроме того, антигены А и В плохо развиты в эритроцитах плода. В совокупности это приводит к низкой частоте клинически тяжелой ГБПН из-за совместимости по системе ABO, хотя частота более легкой формы заболевания варьируется от 1:150 до 1:3000, в зависимости от параметров, используемых для определения случая, таких как уровень билирубина или неонатальный анемия. 1 Поскольку материнские АВО-антитела присутствуют без предшествующей сенсибилизации, ГБПН из-за АВО-антител может возникать при первой беременности и имеет частоту рецидивов до 87%. 1 Это чаще всего наблюдается у матерей группы О с детьми группы А (европейское происхождение) или детей группы В (африканского происхождения).
Наиболее клинически значимые формы ГБПН вызываются аллоантителами материнской группы крови подклассов IgG1 и IgG, которые вызывают гемолиз более эффективно, чем другие подклассы IgG. IgG1 и IgG3 транспортируются через плаценту Fc-рецептором, начиная со второго триместра. 5 Попав в кровоток плода, антитело связывает антиген-позитивные эритроциты плода, которые затем удаляются селезенкой плода. Свободный гемоглобин метаболизируется в билирубин, который конъюгируется материнской печенью. По мере усугубления анемии увеличивается кроветворение плода, что называется «эритробластозом плода», и могут увеличиваться органы, участвующие в синтезе эритроцитов (печень, селезенка). В наиболее тяжелых случаях портальная гипертензия и сниженный печеночный синтез альбумина приводят к низкому онкотическому давлению плазмы, отекам и асциту.«Hydrops fetalis» относится к состоянию распространенного выпота и связанной с ним сердечной недостаточности с высоким выбросом и смерти. 6 Крупное популяционное исследование, проведенное в Швеции, показало, что наличие антител к эритроцитам матери в значительной степени связано с неблагоприятными исходами, с относительным риском преждевременных родов в 1,4–2,4 и относительным риском мертворождения в 1,5–2,6 у матерей с красным аллосенсибилизация клеток по сравнению с таковыми без нее. 7
После родов пассивное антитело группы крови может продолжать воздействовать на эритроциты новорожденного, вызывая постоянную анемию, до тех пор, пока материнское антитело не перестанет присутствовать, что может происходить через несколько недель или месяцев после рождения.При ранней неонатальной анемии билирубин в результате разрушения эритроцитов может быстро повышаться, поскольку метаболический аппарат печени плода недостаточно развит. Очень высокие уровни несвязанного билирубина могут приводить к билирубиновой энцефалопатии, которая клинически проявляется остро как вялость и может включать неврологические и мышечные проявления, такие как гипотония, гипертония, слабое сосание, судороги и/или кома. Хронические и постоянные последствия ядерной желтухи, которая представляет собой необратимое повреждение нейронов из-за гипербилирубинемии, включают церебральный паралич, слуховую дисфункцию, умственные или другие нарушения. 6 У младенцев также может наступить гипопролиферативная фаза анемии из-за подавления эритропоэтического костного мозга материнскими антителами, а также внутриутробного и простого переливания крови (таблица 1). 8 Низкая выработка эритропоэтина младенцем также может быть причиной низкого уровня гемоглобина. 9 Поздний гемолиз может продолжать вызывать низкие показатели крови и повышенный билирубин.
Таблица 1.Неонатальные проявления анемии ГБПН по времени возникновения
Материнская аллоиммунизация возникает в результате воздействия чужеродных эритроцитов во время предыдущей или текущей беременности, предыдущих переливаний крови или трансплантации органов. Во время беременности происходит спонтанное смешение кровообращения плода и матери (плодо-материнское кровотечение; FMH). Смешивание увеличивается на протяжении всей беременности; 3%, 12% и 45% в I, II и III триместрах соответственно, хотя количество крови плода в материнском кровотоке обычно очень мало.Гемолитическая болезнь плода и новорожденного, вызванная аллоантителами к эритроцитам, редко возникает при первой беременности, потому что самый высокий риск FMH приходится на более поздние сроки беременности, особенно при родах, а новые аллоантитела с большей вероятностью образуются после родов. Любое физическое нарушение плода или плаценты в утробе матери также увеличивает риск FMH, например, травма, аборт, внематочная беременность, амниоцентез или многоплодная беременность. 10 После воздействия материнская иммунная система может реагировать или не реагировать на чужеродные антигены эритроцитов. 11 Иммунный ответ на антигены эритроцитов сложен и до конца не изучен. Ясно, что антиген RhD является наиболее мощным иммуногеном из всех антигенов эритроцитов; 85% RhD-отрицательных людей будут сенсибилизироваться (образовать анти-D) после переливания 200 мл эритроцитов, хотя более свежие данные показывают, что этот показатель намного ниже. 12 Хотя всего от 0,1 до 1 мл RhD-положительных эритроцитов может стимулировать выработку антител, объемы FMH обычно невелики, что способствует относительно низкой частоте аллоиммунизации при беременности.До введения Rh(D)-иммунопрофилактики в 1968 г. у 16% АВО-совместимых D-отрицательных матерей с D-положительными детьми вырабатывались анти-D-антитела. Однако гораздо меньшее количество (≤2%) вырабатывало анти-D в парах мать/плод, которые были несовместимы по системе АВО из-за опосредованного АВО-антитела клиренса эритроцитов плода из кровотока матери. 13
Хотя RhD остается наиболее распространенной причиной HDFN из-за аллосенсибилизации, известно, что другие антигены эритроцитов обычно являются этиологическими (таблица 2).Другие антитела, о которых сообщалось реже, включают E, k, Kp a , Kp b , Ku, Ge, M, Js a , Js b , Jk a , Fy a , Fy. b , S, s и U. 4 В голландском исследовании случай-контроль с использованием национальной базы данных 900 беременных женщин с сенсибилизацией эритроцитов к не-RhD эритроцитарным антителам были перечислены факторы риска материнской аллосенсибилизации. Факторами, связанными с аллосенсибилизацией эритроцитов у женщин, были предшествующая серьезная операция, переливание эритроцитов или тромбоцитов, многоплодие, наличие в прошлом ребенка мужского пола и оперативное удаление плаценты. 14
Таблица 2. Специфичность антител к эритроцитамв исследованиях женской популяции
Все беременные женщины должны пройти тестирование, в том числе определение группы крови (ABO, RhD) и тест на определение антител (непрямой антиглобулиновый тест), который выявляет антитела IgG. 15 Для пациентов с эритроцитарной сенсибилизацией определяется специфичность антител и проводится первоначальная стратификация риска.Определенные антитела группы крови, такие как анти-I, -P1, -Le a и -Le b , можно игнорировать, поскольку соответствующие (родственные) антигены не полностью развиты при рождении, антитела обычно не являются IgG, и клинический опыт установил редкость их причин HDFN. 4 Женщин с сенсибилизацией эритроцитов к клинически значимым антигенам эритроцитов (таким как D, E, c, K и т. д.) следует проводить более интенсивное диагностическое тестирование и мониторинг.Если установлено отцовство, группа крови отца обычно определяется для прогнозирования риска наследования антигена плода, против которого направлено материнское антитело. Для большинства систем групп крови достаточно серологического тестирования группы крови отца, чтобы предсказать гомозиготность или гетерозиготность антигена. Например, анти-K- и анти-k-антисыворотки могут обнаруживать K- и k-антигены соответственно и обеспечивать точное предсказание риска наследования антигена группы крови плодом. Для RhD серологическое тестирование само по себе не может предсказать количество генов RhD, которые несет отец, потому что нет антитетического аллеля для гена RhD.Таким образом, в случае материнской анти-D сенсибилизации рекомендуется отцовское генотипирование для определения числа копий гена RhD. 16 Плоды могут нести 50%-ный риск наследования антигена, если тестирование выявляет гетерозиготность отца по рассматриваемому антигену. Прямое генотипирование плода может определить экспрессию группы крови плода в этих условиях и обеспечить точное предсказание риска развития HDFN у плода у сенсибилизированных матерей. Генотипирование эритроцитов может быть выполнено с помощью генетического тестирования амниоцитов плода (полученного с помощью амниоцентеза или забора ворсин хориона) или с использованием ДНК плода, полученной из материнской сыворотки. 17 Последняя методика нашла широкое применение благодаря неинвазивному подходу. 18
Для беременных с риском ГБПН из-за аллоиммунизации матери и возможной экспрессии родственного антигена в эритроцитах плода рекомендуется дородовое наблюдение врачей-акушеров-фетологов. Подробный материнский анамнез полезен для определения исходов предыдущих беременностей, особенно мертворождений или отечных потерь плода в прошлом, а также потенциальной этиологии вызывающих нарушение антител к эритроцитам.Дополнительно показано УЗИ плода для определения срока беременности и отсутствия асцита. 19
Титр или сила антител к эритроцитам помогает при дальнейшей стратификации, хотя следует всегда помнить об относительно субъективном характере этих анализов. 20,21 Традиционно серийные титры антител используются для выявления продолжающейся сенсибилизации, а произвольные пороговые значения увеличения силы антител используются для обозначения продолжающейся и усиливающейся иммунной стимуляции, предположительно из-за присутствия антигена эритроцитов плода.Если ранее была беременность с патологией, тренд титра не будет надежным показателем повышения сенсибилизации. Кроме того, лаборатории переливания крови устанавливают критические титры антител, при которых сила антител достигает уровня, который может привести к выраженной анемии плода (обычно используются титры 1:16-32). 4 Однако, поскольку антигены группы крови Kell присутствуют на ранних предшественниках эритроцитов, материнские анти-K с относительно низким титром, например 8, могут привести к тяжелой гипопролиферативной анемии. 22 Использование других методов определения силы антител, таких как проточная цитометрия, может быть более точным, чем определение титра антител. 23
При сроке беременности от 16 до 24 недель или при достижении критического титра антител (в зависимости от наличия у матери в анамнезе ранее пораженных беременностей) анемию плода контролируют с помощью доплеровского измерения скорости головного мозга каждые 2 недели для стратификации риска (рис. 1). . 19,24 Корреляционные исследования подтверждают, что использование неинвазивной допплеровской методики СМА в качестве суррогатного измерения для оценки анемии плода. 19 Допплеровские показания, которые >1,5 кратны среднему значению (МоМ), очень чувствительны, с 12% ложноположительными показателями, поэтому важен тренд. Также часто проводится еженедельный мониторинг плода, такой как ультразвуковое исследование и мониторинг частоты сердечных сокращений плода).
Рисунок 1.
Схема допплерометрии средней мозговой артерии плода. Адаптировано из Moise 42 с разрешения.
Рисунок 1.
Схема допплерометрии средней мозговой артерии плода. Адаптировано из Moise 42 с разрешения.
Когда анемия плода становится от умеренной до тяжелой, о чем свидетельствуют измерения MoM в допплеровском режиме, превышающие 1,5, проводится инвазивное тестирование с помощью кордоцентеза для определения гематокрита плода.Если плод не достиг приемлемого гестационного возраста для родоразрешения, а уровень гематокрита <30%, обычно показано внутриутробное переливание крови. Продукты крови для переливания плоду должны быть готовы в начале процедуры для немедленного использования. Внутриматочная трансфузия (ВМУ) выполняется путем введения иглы в пупочную вену под ультразвуковым контролем и инфузии эритроцитов при заданном уровне гематокрита. Выбор продуктов эритроцитов для внутриматочной трансфузии, как правило, относится к группе O, Rh D-отрицательному (или -положительному, в зависимости от антител к группе крови матери), лейкоцитарно сниженному, гемоглобин S-отрицательному, ЦМВ-безопасному (ЦМВ серонегативному или лейкоцитарно сниженному), облученных и антиген-отрицательных по материнским эритроцитарным антителам/антителам.Поскольку авторы сообщают о риске дополнительного образования материнских эритроцитарных антител после ВМИ, в некоторых центрах принято проводить трансфузии проспективно совместимых Rh C, c, E, e и K-совместимых трансфузий. 25 Несмотря на это, есть доказательства того, что у женщин, перенесших Rh- и K-совместимые ВМИ, все еще образуются дополнительные аллоантитела [к антигенам группы крови Даффи (FY), Кидда (JK) и (MNS) S]. 26 После одной или нескольких процедур ВМУ кровообращение плода состоит в основном из донорских эритроцитов, поскольку продукция костного мозга плода подавляется, а оставшиеся циркулирующие эритроциты разрушаются. 27 Процедура внутриматочной трансфузии сопряжена с 1-3% риском нежелательных явлений для плода, таких как инфекция или разрыв плодных оболочек; результаты процедуры в начале второго триместра неблагоприятные. 28-30
Небольшая группа пациентов исследовала использование материнского лечения с плазмаферезом и/или внутривенным иммуноглобулином (ВВИГ) для притупления эффекта материнского антитела на эритроциты плода с некоторым успехом. 31 Американское общество афереза относит плазмаферез в этой ситуации к категории II (терапия второй линии) со слабым уровнем доказательности. 32 Окончательное решение о родах принимается лечащим врачом, и стандартом является сохранение беременности до тех пор, пока плод не достигнет безопасного гестационного возраста. Для плодов с тяжелым поражением риск продолжительного наблюдения и внутриматочного переливания уравновешивается этим, и в большинстве случаев предлагается родоразрешение на сроке 37–38 недель, хотя при тяжелой ГБПН могут быть оправданы более ранние роды. 24
При рождении связь с материнским кровотоком разрывается, и риск неонатальной гипербилирубинемии значительно возрастает из-за незрелого развития метаболического пути расщепления билирубина в неонатальной печени. Хотя в большинстве случаев желтуха у новорожденных носит доброкачественный характер, лечение гипербилирубинемии имеет решающее значение в неонатальном периоде из-за риска билирубин-индуцированной энцефалопатии. 33 Пораженным младенцам может потребоваться фототерапия для окисления неконъюгированного билирубина, чтобы обеспечить его выделение с мочой. Для пациентов с установленной ГБПН необходимо тщательное наблюдение за уровнями билирубина и гемоглобина, чтобы определить, необходимы ли неонатальные обменные переливания крови для вымывания билирубина и материнских антител, и/или показаны ли переливания для поддержания способности переноса кислорода к тканям. 8 Введение ВВИГ новорожденным используется для снижения потребности в обменных переливаниях крови и фототерапии, но это не влияет на потребность в завершающих переливаниях, и Кокрановский обзор предполагает, что необходимы дополнительные исследования для определения наилучшего использования ВВИГ в этих условиях. 8 Когда уровни билирубина достигают критического уровня, показано обменное переливание крови (таблица 3). Выбор продукта крови аналогичен выбору IUT, однако, поскольку цельная кровь младенцев также удаляется, единица эритроцитов обычно смешивается с единицей плазмы для создания восстановленной цельной крови. После двухобъемного обменного переливания примерно 90% эритроцитов замещаются, а 50% билирубина удаляется. После обменного переливания следует провести подсчет тромбоцитов для выявления ятрогенной тромбоцитопении.
Таблица 3.Рекомендации по обменному переливанию крови у новорожденных с гестационным возрастом 35 и более недель
Гипорегенеративная анемия может продолжаться в течение многих недель после рождения (табл. 1). Младенцы должны находиться под тщательным наблюдением на предмет клинических признаков продолжающейся анемии, которая, скорее всего, проявляется плохим кормлением, наиболее аэробной активностью новорожденных. У них также может увеличиться сон по мере ухудшения анемии.При продолжающейся анемии продукция ретикулоцитов костным мозгом плода может быть снижена, и могут быть затронуты другие клеточные линии, такие как нейтрофилы. Еженедельный мониторинг ретикулоцитов и гематокрита поможет принять решение о переливании крови, а также обеспечит уверенность в том, что костный мозг восстанавливается.
Профилактику ГБПН можно разделить на первичные и вторичные меры; международных стандартов не существует, поэтому страны различаются по профилактическим мерам, включая дозировку и схемы дозирования RhIg, а также подход к переливанию крови.Первичная профилактика направлена на предотвращение аллоиммунизации матери при первой беременности. Это охватывается политикой, используемой некоторыми службами переливания крови или банками крови, для проведения переливаний эритроцитарной массы женщинам детородного возраста, которые являются более подходящими, чем стандартные переливания, для предотвращения вызванной переливанием сенсибилизации эритроцитов. Например, в некоторых европейских странах К-отрицательные единицы эритроцитов предоставляются женщинам моложе 45-50 лет. Другие страны обеспечивают дополнительное соответствие по антигенам, таким как c и E. 34 В ретроспективном обзоре, проведенном в Хорватии, 48% из 214 беременностей с материнской сенсибилизацией к E, K или c имели в анамнезе переливание крови, что позволяет предположить, что сопоставление этих антигенов может быть защитным, однако антигенный статус отца не сообщался . 35 Исследование, проведенное в Нидерландах, показало, что часть сенсибилизации матерей к группам крови без резус-фактора у потомства с клиническими заболеваниями была связана с внутриутробным переливанием крови. 26 Таким образом, эти меры могут быть эффективными для снижения заболеваемости ГБПН; однако необходимы дальнейшие сравнительные исследования.
Вторичная профилактика ГБПН направлена на RBC-антиген RhD, учитывая, что RhD-иммуноглобулин (RhIg) доступен для предотвращения синтеза анти-D-антитела резус-отрицательными иммунными системами после воздействия небольших количеств RhD-антигена. Риск аллосенсибилизации резус-отрицательной матери может быть снижен с 16% до <0,1% за счет соответствующего введения RhIg. 13 В настоящее время не существует других фармацевтических препаратов, которые могут предотвратить сенсибилизацию группы крови к антигенам других групп крови.Лаборатория службы переливания крови играет важнейшую роль в руководстве терапией RhIg. Беременным женщинам с отрицательным резус-фактором RhIg обычно вводят 2 раза в течение беременности. Первая доза вводится на 28-й неделе беременности, как это рекомендовано Американским колледжем акушеров и гинекологов (ACOG), потому что большая часть аллосенсибилизации, по-видимому, происходит после этого момента времени, а вторая доза — после рождения RhD-положительного ребенка. 36 28-недельная доза снижает уровень аллосенсибилизации к RhD с 1.5% (только дородовое введение) до 0,1%. Как отмечалось выше, любая процедура или травма, которые увеличивают частоту фетоматеринских кровотечений, должны вызывать введение дополнительной дозы RhIg. Антенатальную дозу RhIg увеличивают, когда объем плодно-материнского кровотечения по тесту Кляйхауэра-Бетке определяется как ≥10 мл. Хотя тест Клейхауэра-Бетке использовался в течение многих лет, он оказался неточным, и в последнее время внимание было сосредоточено на новых технологиях, таких как проточная цитометрия, для обеспечения более точной количественной оценки объема FMH 37
По мере того, как молекулярное тестирование развивается во всей области медицины, расширяется и применение определения групп крови с использованием молекулярных методов.У некоторых пациентов серологические реагенты не позволяют точно определить тип RhD. Наиболее распространенные генетические фоны, которые объясняют эту проблему серологического типирования, называются слабыми фенотипами D. Недавно авторы рекомендовали использовать генетическое тестирование RhD для пациентов со слабым фенотипом D, чтобы получить точные и действенные результаты для определения группы крови RhD и введения RhIg. 38,39 Необходимы дальнейшие научные исследования для выяснения клинической значимости различных генотипов RhD в различных этнических группах и факторов риска неудачи RhIg. 40 Точное определение RhD-типирования плода получило широкое признание в Европе и улучшило возможность выбора RhIg-терапии. 18
Таким образом, HDFN является многогранным заболеванием, которое имеет различные технические аспекты в течение нескольких критических периодов развития плода и новорожденного. Достижения в области медицины матери и плода, такие как изобретения RhIg, IUT и неинвазивного генетического тестирования плода, привели к значительному улучшению результатов HDFN и предотвращению материнской аллосенсибилизации.

 Подобное происходит из-за повышения титра аутоантител. Спровоцировать его могут ревматоидный артрит, болезнь Шегрена, гломерулонефрит, аутоиммунный тиреоидит;
Подобное происходит из-за повышения титра аутоантител. Спровоцировать его могут ревматоидный артрит, болезнь Шегрена, гломерулонефрит, аутоиммунный тиреоидит; Выявляет начальные стадии фиброза.
Выявляет начальные стадии фиброза.
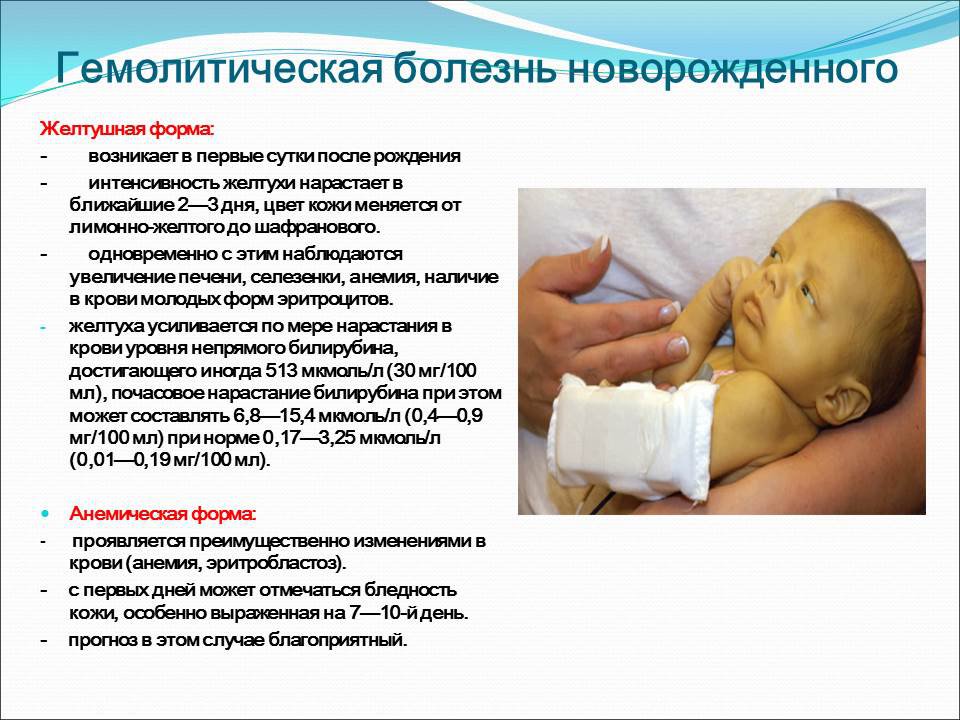

 Причиной становятся генетические аномалии. Терапевтический курс призван купировать основные симптомы патологии
Причиной становятся генетические аномалии. Терапевтический курс призван купировать основные симптомы патологии
