Вирус герпеса человека 6 типа, впг 6 типа у детей
Вирус герпеса человека 6 типа (ВГЧ-6) – ДНК–содержащий вирус семейства Herpesviridae подсемейства Betaherpesvirinae рода Roseolavirus. ВГЧ-6 был впервые выделен в 1986 г. из В-лимфоцитов периферической крови больных неходжкинскими лимфомами, которые возникают у больных ВИЧ-инфекцией. Вирус относится к подсемейству бета-герпес-вирусов, является ближайшим генетическим родственником ЦМВ, выделяют два варианта: ВГЧ-6А и ВГЧ-6В.
Репликация вируса в мононуклеарах периферической крови происходит относительно медленно и сопровождается лизисом клетки-хозяина. Для ВГЧ-6, как и для других герпес-вирусов, характерна способность к персистенции и латенции в организме инфицированного человека. Вирус проявляет тропизм к широкому спектру клеток хозяина: его обнаруживали в лимфатических узлах, лимфоцитах периферической крови, моноцитах, макрофагах, клетках почек, в слюнных железах, мозге.
Инфекция ВГЧ-6 – антропоноз. Источник инфекции – человек, страдающий манифестной или латентной формой инфекции, а также вирусоносители. Пути передачи инфекции – воздушно-капельный, контактно-бытовой, парентеральный, трансплацентарный. Факторы передачи – слюна, мокрота, кровь. Инфекция отличается всеобщей восприимчивостью.
Показана высокая патогенетическая значимость ВГЧ-6: он может вызывать острые поражения кожи у детей раннего возраста (внезапная экзантема новорожденных), лихорадку новорожденных с судорожным синдромом, синдром хронической усталости (в то же время последние работы придают большее значение в развитии данной патологии ВГЧ-7), мононуклеозоподобный синдром; у иммунокомпрометированных лиц – быть причиной лихорадки, пневмонии, гепатита, поражения ЦНС.
Верификация диагноза ВГЧ-6 инфекции осуществляется только при положительных результатах лабораторных исследований.
Дифференциальная диагностика. Энтеро- и аденовирусная инфекция, корь, краснуха, скарлатина, пневмония, средний отит, острый пиелонефрит, менингит, пневмококковая бактериемия, аллергические высыпания.
Показания к обследованию
- Пятнисто-папулезная сыпь (экзантема) в сочетании с лимфаденопатией после непродолжительной лихорадки;
- увеличение затылочных, заднешейных и/или околоушных лимфатических узлов;
- исследование после контакта с больным внезапной экзантемой или другой инфекцией, вызванной ВГЧ-6 или с подозрением на данные нозологические формы;
- дифференциальная диагностика экзантемных заболеваний;
- иммунодефицитные состояния;
- хроническая усталость и снижение работоспособности более чем на 50% с длительностью около 6 месяцев при отсутствии других заболеваний, вызывающих аналогичные признаки;
- симптоматика врожденной инфекции, пороки развития у новорожденных.

Этиологическая лабораторная диагностика включает выявление возбудителя в культуре клеток, обнаружение ДНК вируса, определение специфических АТ IgM, IgG к антигенам ВГЧ-6.
Материал для исследования
- Плазма крови, СМЖ, лейкоцитарная фракция крови, слюна – выделение ДНК, выявление возбудителя в культуре клеток;
- сыворотка крови – определение АТ.
Сравнительная характеристика методов лабораторной диагностики. Выявление возбудителя в культуре клеток в настоящее время для рутинной диагностики инфекции, вызываемой вирусом ВГЧ-6, не применяются ввиду трудоемкости, длительности исполнения и необходимости определенных условий проведения исследований.
Основным методом дифференциальной диагностики инфекции является детектирование и определение концентрации ДНК ВГЧ-6 методом ПЦР. При исследовании цельной крови для диагностики инфекции предпочтительно количественное определение ДНК, которое позволит дифференцировать латентную и активную инфекцию, поскольку вирус может присутствовать в лейкоцитах здоровых лиц. Обнаружение ДНК вируса в плазме крови, но не в цельной крови подтверждает наличие активной инфекции. Результаты определения ДНК ВГЧ-6 в количественном формате позволяют провести динамическое наблюдение: на основании увеличения концентрации в периферической крови, лейкоцитах, СМЖ, слюне установить активность инфекционного процесса, выявить реактивацию, оценить эффективность проводимой терапии.
Обнаружение ДНК вируса в плазме крови, но не в цельной крови подтверждает наличие активной инфекции. Результаты определения ДНК ВГЧ-6 в количественном формате позволяют провести динамическое наблюдение: на основании увеличения концентрации в периферической крови, лейкоцитах, СМЖ, слюне установить активность инфекционного процесса, выявить реактивацию, оценить эффективность проводимой терапии.
Для выявления специфических АТ IgM, IgG к АГ ВГЧ-6 используют преимущественно ИФА. Определение АТ IgG может быть выполнено в качественном и количественном формате. Обнаружение АТ IgM позволяет установить диагноз текущей первичной ВГЧ-6-инфекции, результаты определения АТ IgG в количественном формате – провести динамическое наблюдение, оценить состояние постинфекционного иммунитета к ВГЧ-6.
Показания к применению различных лабораторных исследований (герпес 6 типа – анализ). Индикаторами активной инфекции служат наличие ДНК ВГЧ-6 и АТ IgM. АТ IgM появляются в крови на 4–7 сутки от начала болезни и сохраняются в течение нескольких месяцев. АТ IgG появляются в крови на 7–10 сутки болезни и сохраняются в течение всей жизни, поэтому для установления факта первичного инфицирования необходимо количественное определение АТ IgG в динамике. Определение вирусоспецифических АТ IgG может быть использовано в скрининговых исследованиях для определения наличия иммунитета к ВГЧ-6.
АТ IgG появляются в крови на 7–10 сутки болезни и сохраняются в течение всей жизни, поэтому для установления факта первичного инфицирования необходимо количественное определение АТ IgG в динамике. Определение вирусоспецифических АТ IgG может быть использовано в скрининговых исследованиях для определения наличия иммунитета к ВГЧ-6.
Особенности интерпретации результатов лабораторных исследований. Выявление специфического фрагмента ДНК ВГЧ-6 в образцах биоматериала пациента (плазма крови, СМЖ, соскобы со слизистой оболочки ротоглотки) позволяет при однократном тестировании подтвердить факт инфицирования ВГЧ 6 типа.
Обнаружение специфических АТ IgМ, маркеров острой фазы заболевания, свидетельствует о первичном инфицировании или реактивации инфекции. Однократное обнаружение АТ IgG не является однозначным свидетельством первичной инфекции.
Вирус герпеса 6 типа (качественное определение ДНК)
Вирус герпеса 6 типа
 Вирус имеет 2 подтипа – А и В, подтип В является основной причиной внезапной экзантемы (детской розеолы), одной из детских инфекций, протекающей с высокой температурой и сыпью.
Вирус имеет 2 подтипа – А и В, подтип В является основной причиной внезапной экзантемы (детской розеолы), одной из детских инфекций, протекающей с высокой температурой и сыпью.Для вируса герпеса 6 типа характерны те же особенности, как для других типов герпесвируса: пожизненное и часто бессимптомное носительство. Отличительной особенностью этого вируса является выраженное проявление у детей. Сегодня учёные считают, что наиболее часто этот вирус передаётся через слюну, и потому маленькие дети инфицируются этим вирусом почти с первых дней контакта с матерью или другими людьми, являющимися переносчиками вируса.
Однако в первые несколько месяцев жизни заражение ребёнка вирусом герпеса 6 типа не приводит ни к каким последствиям: переданный от матери врождённый иммунитет уверенно подавляет вирусные частицы. Только в том случае, если этого вируса у матери нет, а ребёнок заражается от другого человека, типичные симптомы герпеса 6 типа могут возникнуть у младенца уже с первых месяцев жизни. Обычно же герпесом дети переболевают в возрасте от 4 до 13 месяцев. Если вирус герпеса 6 типа попадает во взрослый организм впервые, он вызывает примерно те же симптомы, что и у детей: лихорадку и высыпания на коже.
Обычно же герпесом дети переболевают в возрасте от 4 до 13 месяцев. Если вирус герпеса 6 типа попадает во взрослый организм впервые, он вызывает примерно те же симптомы, что и у детей: лихорадку и высыпания на коже.
Основной путь передачи вируса герпеса 6 типа – контактный. Редко регистрируется передача вируса от матери ребёнку непосредственно во время родов. В результате проведенных исследований выяснилось, что у 2% рожениц вирус герпеса присутствует в вагинальном секрете, а ещё у 1% – в крови в пуповине. Не удивительно, что при родах герпес легко может попасть в организм ребёнка через микротравмы и царапины.
Главным симптомом заболевания, вызываемого вирусом герпеса 6 типа, являются обширные мелкие высыпания на коже у ребёнка, которые часто именуют детской розеолой. По всему телу ребёнка распространяются небольшие высыпания, немного приподнятые над кожей и обычно не вызывающие зуда.
Всегда за несколько дней до появления высыпаний у ребёнка наблюдается повышение температуры, характерное для лихорадки. Однако даже при такой температуре тела ребёнок сохраняет активность. Высокая температура держится в течение 4-5 дней, после чего резко падает и ребёнка обсыпает.
Однако даже при такой температуре тела ребёнок сохраняет активность. Высокая температура держится в течение 4-5 дней, после чего резко падает и ребёнка обсыпает.
Случается, что болезнь протекает без высыпаний
Если же высыпания у ребёнка появились, то держатся они на коже недолго: в некоторых случаях они проходят уже через несколько часов, иногда же могут сохраняться в течение нескольких дней. Параллельно с ними у ребёнка пропадает аппетит, он становится малоподвижным и раздражительным, иногда у него происходит увеличение лимфатических узлов.
Более серьёзными проявлениями первичного заражения герпесом 6 типа являются:
- менингоэнцефалиты
- миокардит
- фульминантный гепатит
- тромбоцитопеническая пурпупа
- мононуклеозоподобный синдром
- различные пневмонии.
Очень важно помнить, что сам герпес зачастую проявляется в качестве спутника других заболеваний.
Диагностика инфекции, вызванной основывается вирусом герпеса 6 типа, основана на определении ДНК вируса и определении антител класса G. В популяции взрослых людей IgG антитела к данному вирусу выявляются у 70 — 90% людей. IgG-антитела появляются на 7-й день лихорадки, достигая максимума через 2 — 3 недели, далее их концентрация снижается, но определяются они на протяжении всей жизни. При рождении в крови детей могут обнаруживаться материнские IgG-антитела, титр которых снижается к 5 месяцам.
После перенесения в детстве заболевания, вызванного вирусом герпеса типа 6, организм вырабатывает пожизненный иммунитет, и у взрослых HHV-6 сам по себе никак не проявляется. Несмотря на то, что он достаточно часто переживает рецидив, когда с помощью анализа крови можно определить его наличие в организме, у людей с нормальным иммунитетом такие рецидивы происходят бессимптомно.
ВыявлВыявление ДНК с помощью ПЦР в режиме «реал-тайм» возможно уже с первых дней заболевания. Исследуют соскоб эпителиальных клеток с задней стенки глотки или кровь. При реактивации инфекции обнаружение ДНК случит диагностическим подтверждающим маркером.
Исследуют соскоб эпителиальных клеток с задней стенки глотки или кровь. При реактивации инфекции обнаружение ДНК случит диагностическим подтверждающим маркером.
Показания к исследованию:
- Дифференциальная диагностика детских инфекций, сопровождающихся лихорадкой и пятнисто-папулезной сыпью
- Увеличение лимфатических узлов, сопровождающееся лихорадкой
- Часто болеющие дети (более 3 раз в год)
- Снижение иммунитета
- Обследование до и после трансплантации тканей и органов
Педиатр Михаил Никольский: Герпес – лечить или не лечить — СМИ о нас
Александра Петровская: Добрый день. Это программа для самых больших. С нами в студии врач-педиатр и кандидат медицинских наук Михаил Никольский. Михаил Андреевич, здравствуйте.
Михаил Никольский: Добрый день.
А.П.: Мы сегодня собрались здесь по поводу вашей научной работы, посвященной герпесу 6 и 7 типа. Давайте попытаемся объяснить слушателям, что это такое, а, самое главное, откуда эти типы взялись, и какие еще типы – первый, второй, третий и так далее – идут до 6 и 7.
Давайте попытаемся объяснить слушателям, что это такое, а, самое главное, откуда эти типы взялись, и какие еще типы – первый, второй, третий и так далее – идут до 6 и 7.
М.Н.: В общей сложности выделяют 8 или 9 типов герпеса, смотря как считать. Первый и второй типы – это обычный герпес, который вызывает простуду на губах. Третий тип – это вирус герпес зостер, который вызывает ветрянку или опоясывающий лишай у взрослых людей.
А.П.: То есть то, что мы называем ветрянкой, это, на самом деле, тот же самый герпес?
М.Н.: Не тот же самый, это совершенно другой герпес, но тоже герпес.
А.П.: По какому принципу они все объединены под этим названием?
М.Н.: Это сложно. Когда ученые изучали ДНК этих вирусов, выяснилось, что у всех у них имеются похожие родственные черты. Четвертый тип, вирус Эпштейна-Барр, вызывает инфекционный мононуклеоз инфекционный. Пятый тип – это то, что все знают как цитомегаловирус. Это тоже часто инфекции, причем преимущественно детские.
И, наконец, 6 и 7 тип – это то, чем я занимаюсь. Чаще всего они вызывают у детей розеолу – трехдневную лихорадку или внезапную экзантему. Далее идет восьмой тип герпеса, он встречается при саркоме Капоши. Это тяжелое заболевание, которое преимущественно встречается у ВИЧ-инфицированных пациентов.
А.П.: Что, помимо общего названия и некого сходства ДНК, их еще объединяет? Может, есть общие методы терапии или сходные последствия воздействия вируса на организм?
М.Н.: Во-первых, в отличие от многих других вирусов, против герпесов есть лекарство. Это во многом отличает эти вирусы от других, потому что от огромного числа вирусов нет никаких лекарств.
А.П.: А как же все эти модные противовирусные, которые везде рекламируют?
М.Н.: Все, что рекламируют по телевизору — это, к сожалению, скорее фейки.
А.П.: Фейки запрещены.
М.Н.: Фейки запрещены, но, видимо, реклама лекарств без доказанной эффективности разрешена.
А.П.: Это тема для отдельной программы.
М.Н.: Это беда нашей страны, потому что у нас фейки влезли даже в клинические рекомендации. И мы лечим людей всеми этими «фуфломицинами». Более того, мы ими обязаны лечить, потому что у нас есть соответствующие клинические рекомендации.
А.П.: Это кто-то лоббирует?
М.Н.: Конечно, это лоббируется, это проплачено. А что взять, если, уж извините меня, у нас один из членов Российской академии наук — гомеопат.
А.П.: В этих словах чувствуется Ваше презрение к гомеопатии.
М.Н.: С точки зрения клинического врача в какой-то степени это да, презрение, это правда.
Вернемся к герпесам. У них есть уникальная особенность. После того, как человек заболел первичной герпесной инфекцией, эти вирусы не уходят из организма человека. Все герпесы, с которыми человек столкнулся в жизни, остаются в нем навсегда.
А.П.: Я встречалась с утверждением, что трудно встретить на Земле человека старше 10 лет, который не имел бы антител к тому или иному виду герпеса.
М.Н.: И не только антител, но даже и самих герпесов. Практически у всех людей после определенного возраста в слюне, в крови или в других тканях можно найти те или иные герпесы. С этим и связана проблема их диагностики — врачи очень часто путаются. Коллеги по незнанию, но из лучших побуждений назначают часто болеющим пациентам, предположим, анализы слюны на вирус Эпштейна-Барр, на цитомегаловирус, на герпес 6 типа, 7 типа, и находят их в слюне. А это является нормой.
А.П.: А они начинают лечить?
М.Н.: Да, совершенно верно. Пациент-то не знает, что это норма. Он видит, что у него «страшный» анализ, что нашли такое-то количество этих герпесов, и врач, скорее всего, сам по незнанию, по непониманию этой проблемы начинает лечить нормальное носительство герпесов. А чем он лечит? Теми же фуфломицинами и лечит. И ничего не происходит.
А.П.: Итог – герпес лечить не надо?
М.Н.: Надо, если он вызвал тяжелое заболевание – а все герпесы в определенных случаях могут вызывать тяжелые заболевания. Например, герпес 6-го типа – частая причина тяжелых состояний у пациентов после пересадки костного мозга. Если герпес после пересадки костного мозга обострился на фоне снижения, фактического уничтожения собственного иммунитета, то терапия обязательно требует мощных противовирусных средств.
Например, герпес 6-го типа – частая причина тяжелых состояний у пациентов после пересадки костного мозга. Если герпес после пересадки костного мозга обострился на фоне снижения, фактического уничтожения собственного иммунитета, то терапия обязательно требует мощных противовирусных средств.
Да вот взять ветрянку – казалось бы, безобидное заболевание. Но после 11 лет оно тяжело проходит и может иметь последствия. Поэтому считается, что если пациент младше 11 лет, то оно часто проходит само по себе. А если старше 11 лет, то лучше не рисковать, а назначить ацикловир.
А.П.: Это препарат с доказанной эффективностью?
М.Н.: Да, он действует именно на вирус ветрянки.
А.П.: Выходит, что герпес, который всегда находится в организме, в какой-то момент обостряется. Я, например, слышала про герпес 6-го типа, что это характерное заболевание для детей до 2-3 лет. Выходит, что нет.
М.Н.: Дело в том, что герпес 6-го типа – это та самая наиболее частая инфекция, которая вызывает всегда внезапную экзантему или трехдневную лихорадку или розеолу. В принципе, очень понятная инфекция: три дня у ребенка высокая температура, потом появляется типичная пятнисто-папулезная сыпь. В течение двух дней она исчезает сама по себе, и человек выздоравливает.
В принципе, очень понятная инфекция: три дня у ребенка высокая температура, потом появляется типичная пятнисто-папулезная сыпь. В течение двух дней она исчезает сама по себе, и человек выздоравливает.
Само заражение может произойти хоть через обычный поцелуй, как это и происходит со многими герпесами. То есть в организм ребенка вирус может попасть через контакт со слюной матери, бабушки, любого взрослого человека, которые обычно и являются носителем всех герпесов. И вот ребенок переносит эту первичную инфекцию через вирус герпеса человека 6-го типа, и после этого герпес человека 6-го типа остается в этом ребенке навсегда. И никуда он не денется, и никак от него не избавиться.
Но лечить его надо только в одной ситуации – если он вызвал какое-то тяжелое заболевание, что у здоровых людей практически никогда не встречается. Только при тяжелых иммунодефицитах, которые обычно возникают при трансплантации органов и тканей. Вот там бывают ситуации, когда требуется интенсивное лечение герпеса 6-го типа.
Во всех остальных случаях ударно лечить его не надо. И надо иметь в виду, что герпесы – это очень модная сейчас тема. Вирус герпеса 6-го типа легко найти, а, значит, его можно предъявить практически при любой болезни в качестве возможного диагноза. И многие врачи этим пользуются. Например: «Я не знаю, что с вами. Давайте поищем у вас то, что точно есть». И тут герпес 6-го типа — он точно есть, и он находится.
А.П.: Еще такой момент. Какие другие заболевания могут быть связаны с вирусами герпеса, которые присутствуют в организме?
М.Н.: Как я уже сказал, герпесы 6-го и 7-го типа «классически» вызывают розеолу у детей. Еще герпес 6-го и иногда, но редко, 7-го типа ассоциированы с фебрильными судорогами у детей. Есть исследования, которые показывают связь определенных видов эпилепсии с вирусом герпеса человека 6-го типа. Так что получается, что герпес 6-го типа фактически вызывает одну из разновидностей эпилепсии.
А.П.: Присутствует этот вирус в организме почти каждого, а эпилепсия при этом далеко не у всех. То есть это говорит о том, что какой-то прямой связи нет, есть и другие факторы, влияющие на появление этого заболевания?
То есть это говорит о том, что какой-то прямой связи нет, есть и другие факторы, влияющие на появление этого заболевания?
М.Н.: Конечно, тут много факторов. Например, два человека подхватили одну и ту же инфекцию: но у одного насморк, а у второго менингит. А инфекция одна и та же. Конечно, тут задействовано много факторов.
Также проводилось исследование, которое ассоциировало вирусы герпеса человека 6-го и 7-го типов с другими заболеваниями, предположив связь с рассеянным склерозом. Но это не доказано. Это уже область науки, то у нас нет четких указаний на то, герпесы — это именно то самое, что вызывает рассеянный склероз.
А.П.: В ходе программы мы с вами коротко поговорили обо всех герпесах, обозначили все важные моменты. И, завершая беседу, хочу вернуться к началу. Какие вопросы в этой области сегодня стоят перед наукой?
М.Н.: Кстати, забыл сказать, что особой формой герпеса человека 6-го типа является хромосомная интегрированная форма этого вируса, когда герпес 6-го типа внедряется в хромосому человека и начинает передаваться по наследству всем поколениям.
Сейчас мы в Петербурге получили грант. Мы проводим бесплатные обследования всех желающих по определенным показаниям на наличие хромосомно-интегрированного герпеса человека 6-го типа. Как раз-таки наличие хромосомно-интегрированного герпеса человека 6-го типа, возможно, дает связи с некоторыми болезнями. Оказывается, что чуть ли не 1% населения земного шара имеет встроенный в свой геном хромосомно-интегрированный вирус.
А.П.: Хорошо. Вспоминая мои студенческие годы, какая гипотеза стоит у вас в этом научном исследования? Если что – то что?
М.Н.: Мы пока набираем референсную группу, мы ищем людей, их обследуем. Меня лично сейчас больше всего интересует, есть ли клинические проявления хромосомной интеграции герпеса человека 6-го типа у новорожденных детей. На мой взгляд, это самая интересная концепция, еще никто в мире это направление не разрабатывал. Пока что есть предварительные результаты, но я их еще не готов озвучивать.
А.П.: У нас в гостях был Михаил Никольский, врач-педиатр и кандидат медицинских наук. Спасибо и хорошего всем дня!
Спасибо и хорошего всем дня!
ДНК ВГЧ-6 – прямой маркер инфицирования вирусом герпеса 6 типа. Вирус герпеса человека 6 типа (ВГЧ-6) – ДНК–содержащий вирус семейства Herpesviridae, рода Roseolavirus. Для ВГЧ-6, как и для других герпес-вирусов, характерна способность к сохранению в латентной (скрытой) форме в организме инфицированного человека. Источник инфекции – человек, страдающий манифестной или латентной формой инфекции, а также вирусоносители. Факторы передачи – слюна, мокрота, кровь. Наиболее вероятный путь заражения – воздушно-капельный, со слюной, также не исключена передача инфекции от матери к ребенку во время беременности. ВГЧ-6 может вызывать острые поражения кожи у детей раннего возраста (внезапную экзантему новорожденных), лихорадку новорожденных с судорожным синдромом, синдром хронической усталости, мононуклеозоподобный синдром. Может быть причиной лихорадки, пневмонии, гепатита, поражения ЦНС у иммунокомпрометированных лиц. Первый раз заражение практически всегда происходит в возрасте от 4 до 24 месяцев. В большинстве случаев ВГЧ-6 протекает бессимптомно, а если проявляется, то чаще всего как внезапная экзантема и быстро развивающаяся сильная лихорадка, продолжающаяся 3-4 дня. Через несколько часов после нормализации температуры появляются эритематозные пятна или пятнисто-папулезная сыпь. Сходство внезапной экзантемы с симптомами кори или краснухи зачастую приводит к постановке ошибочного диагноза. Основным методом дифференциальной диагностики инфекции является детектирование и определение концентрации ДНК ВГЧ-6 методом ПЦР. При исследовании предпочтительно количественное определение ДНК, которое позволит дифференцировать латентную и активную инфекцию, поскольку вирус может присутствовать в лейкоцитах здоровых лиц. Обнаружение ДНК вируса в плазме, но не в цельной крови, подтверждает наличие активной инфекции. Результаты определения ДНК ВГЧ-6 в количественном формате позволяют провести динамическое наблюдение: на основании увеличения концентрации в лейкоцитах, слюне установить активность инфекционного процесса, выявить реактивацию, оценить эффективность проводимой терапии. |
Лечение герпеса 6 типа в Санкт-Петербурге. Лечение вируса герпеса у детей и взрослых.
До недавних пор крайне редко появлявшаяся среди диагнозов педиатров стран бывшего Союза детская розеола — реакция организма малыша на проникновение вируса герпеса, только в 2012 году классифицированного как отдельный шестой тип. Впервые заболевание, как это случается обычно, протекает как ОРВИ, и лечение герпеса 6 типа в этом случае носит симптоматический характер.
Однако есть одна особенность, которую до сих пор недооценивают как родители, так и некоторые педиатры. После лихорадки с очень высокими значениями показателей температуры,сопровождающейся выраженными катаральными явлениями и воспалением лимфоузлов, на теле появляется розовая сыпь без зуда, до недавнего времени чаще всего принимвшаяся за аллергическую реакцию на лекарства.
В этой ситуации лечение герпеса 6 типа у детей и взрослых включает антигистаминные препараты, а также средства, позволяющие подавить активность вируса, снять воспаление.
Лечение вируса герпеса 6 типа у детей и взрослых
На самом деле этот тип изучен недостаточно хорошо — ученым известно, что зачастую он «работает» в паре с вирусом 7 типа и оба они считаются если не виновниками, то участниками развития синдрома хронической усталости, а также некоторых онкологических заболеваний. Вирус традиционно для этого семейства «засыпает» в клетках лимфатической системы, и лечение вируса герпеса 6 типа, позволяющее полностью от него избавиться, пока не найдено.
- У деток острая форма заболевания лечится симптоматически, а после постановки точного диагноза, что становится возможным с появлением характерной сыпи, либо на основании лабораторных исследований, в терапию включаются противогерпетические препараты, а также средства, позволяющие укрепить иммунитет.
- Взрослым людям имеет смысл обратиться к инфекционисту, если вы постоянно ощущаете усталость, апатию, регулярно поднимается невысокая температура, вы обратили внимание на увеличенные лимфоузлы.
 Все это может быть признаками синдрома хронической усталости или некоторых других вирусных заболеваний. Но точную диагностику и лечение герпеса 6 типа в СПб можно получить в специализированных клиниках, имеющих возможность проводить специальные тесты и использовать в терапии данные самых последних научных исследований.
Все это может быть признаками синдрома хронической усталости или некоторых других вирусных заболеваний. Но точную диагностику и лечение герпеса 6 типа в СПб можно получить в специализированных клиниках, имеющих возможность проводить специальные тесты и использовать в терапии данные самых последних научных исследований.
Если вам необходимо пройти лечение герпеса 6 типа в Приморском районе, вы можете обратиться в наш центр, и вам помогут высококвалифицированные инфекционисты и иммунологи, по праву считающиеся одними из лучших специалистов Санкт-Петербурга.
Лабораторная диагностика герпеса в СЗЦДМ
Герпес ― это вирус семейства герпесвирусов. Их существует свыше 100 видов, но только 8 из них поражают человека. Преимущественно заражение происходит в раннем детстве. По данным ВОЗ, около 13% населения инфицировано вирусом HSV-2 и около 67% HSV-1, из них 90% не подозревают о наличии инфекции. У подавляющего большинства вирус находится в латентном состоянии. Активизируется в периоды стрессов, при ослаблении иммунитета.
Активизируется в периоды стрессов, при ослаблении иммунитета.
Герпесвирусы семейства Herpesviridae, инфицирующие человека:
-
Альфа-герпесвирусы ― это наиболее распространенные типы HSV-1 (ротовой герпес), HSV-2 (генитальный герпес) и ветряная оспа. Отличительной особенностью группы является быстрое разрушение инфицированных клеток.
-
Бета-герпесвирусы ― это наиболее патогенные инфекционные агенты герпеса 6 типа, 7 типа и цитомегаловируса. Они вызывают менее выраженные дегенеративные изменения в клетках,
-
Гамма-герпесвирусы ― это герпес 8 типа и вирус Эпштейна-Барр. Они способны инфицировать системы мононуклеарных макрофагов (иммунных клеток), вызывая процессы клеточной гибели.
Вирус невозможно удалить из клеток хозяина, он пожизненно сохраняются в организме. Лечение направлено на уменьшение проявлений симптоматики, сопутствующих заболеваний, облегчение жизни пациента. Вакцина разрабатывается.
Лечение направлено на уменьшение проявлений симптоматики, сопутствующих заболеваний, облегчение жизни пациента. Вакцина разрабатывается.
Этот вид вируса вызывает цитомегаловирусную инфекцию (ЦМВИ, цитомегалия). Имеет крупный ДНК-геном и относительно низкую патогенность. Развивается без повреждения клетки. Образующиеся новые вирусные частицы уже внутри организма инфицируют макрофаги, эпителии, миелоидные клетки. В них вирус переходит в латентную фазу. Считается, что из-за цитомегалии у человека с возрастом начинают развиваться патологические воспалительные процессы.
Источник заражения ― инфицированный человек. Цитомегаловирус передается воздушно-капельным путем и через все существующие жидкости: половые выделения, кровь, слюна, материнское молоко.
Вирус, медленно распространяясь по организму, провоцирует изменение инфицированных клеток с увеличением размера. У здоровых людей цитомегалия протекает легко или бессимптомно. Особую опасность представляет для лиц с патологией иммунной системы, у маленьких детей и у беременных женщин из-за риска заражения плода. У пациентов с иммунодефицитами ЦМВ-инфекция является одной из причин болезней и смертей.
Особую опасность представляет для лиц с патологией иммунной системы, у маленьких детей и у беременных женщин из-за риска заражения плода. У пациентов с иммунодефицитами ЦМВ-инфекция является одной из причин болезней и смертей.
Приобретенная цитомегалия имеет симптомы схожие с сезонными простудами. Врожденная (внутриутробная), может стать причиной выкидыша, привести к патологии плода. У детей до 3 месяцев и у взрослых с патологией иммунной системы или онкологией цитомегаловирусная инфекция может проходить в тяжелой форме. Среди осложнений поражение легких, вирусный энцефалит, изменение печени, почек, органов ЖКТ.
Вирус Эпштейна – Барр (EBV)
Относится к 4 группе герпесвируса (Herpesviridae). Выглядит как двуспиральная молекула ДНК. Не встраивается в клеточный геном инфицированной клетки, а пребывает в ядре. Существует два типа вируса Эпштейна ― Барра: EBV-1 и EBV-2. Они одинаково распространены, имеют схожую симптоматику. Отличаются способностями к трансформированию и характеристиками латентного течения. Вирус реплицируется в лимфоцитах, эпителии, разрушение не вызывает.
Отличаются способностями к трансформированию и характеристиками латентного течения. Вирус реплицируется в лимфоцитах, эпителии, разрушение не вызывает.
Источник заражения ― инфицированный человек с манифестной и скрытой формой. Инфекция распространяется воздушно-капельным способом.
Заболевание при сильном иммунитете почти всегда протекает без симптомов. У иммунокомпрометированных больных проявляется инфекционным мононуклеозом. При манифестной (активной) форме EBV-инфекции возрастает уровень ЦИК, а активность лейкоцитов, наоборот, снижается. Это может привести к неблагоприятным иммунопатологическим реакциям.
При иммунодефиците вирус Эпштейна – Барр может спровоцировать развитие лимфопролиферативных расстройства, запустить онкологию. У людей с аутоиммунными заболеваниями влияет на общее самочувствие, вызывая синдром хронической усталости.
Инфекционный мононуклеоз
Острая болезнь, вызываемая вирусом Эпштейна – Барр. Развивается на фоне ослабленного иммунитета, в основном у детей и взрослых в возрасте до 40 лет. Может протекать в легкой, среднетяжелой и тяжелой форме.
Развивается на фоне ослабленного иммунитета, в основном у детей и взрослых в возрасте до 40 лет. Может протекать в легкой, среднетяжелой и тяжелой форме.
Среди часто встречающихся клиники лихорадка, поражение ротовой полости, лимфоаденопатия. Реже значительное увеличение селезенки, приводящее к разрывам. Атипичная форма мононуклеоза также может вызвать острую полиорганную недостаточность, миокардит, менингит.
Висцеральная форма течения болезни характеризуется серьезными полиорганными поражениями. В патологические процессы вовлекаются центральная и периферическая нервные системы, органы сердечно-сосудистой системы, почки, надпочечники и другие жизненно важные органы.
Вирус герпеса 6 типа (ВГЧ-6)
В основном вирус реплицируется в Т-лимфоцитах, но иногда его выявляют в В-лимфоцитах, системе мононуклеарных макрофагов, гепатоцитах и иных клетках. Источник ― инфицированный человек. Герпесвирус передается воздушно-капельным способом и прямым путем ребенку от матери.
Герпесвирус передается воздушно-капельным способом и прямым путем ребенку от матери.
Список заболеваний, вызываемых ВГЧ-6 достаточно широк. Чаще патологии возникают у людей с подавленной иммунной системой. В остальных случаях симптоматики нет.
У новорожденных на фоне инфекции возникают экзантемы, первая в жизни лихорадка. У взрослых и детей постарше заболевание протекает как мононуклеоз. У носителей ВГЧ-6 возрастает риск развития злокачественной лимфомы, гистиоцитарного лимфаденита, Т-клеточную лейкемии и В-клеточной лимфомы. У иммунно иммунокомпрометированных лиц инфицирование проходит более тяжело. В некоторых случаях приводит к пневмонии, гепатиту, энцефалиту.
Вирус герпеса 7 типа
ВГЧ-7, как правило, обнаруживают вместе с ВГЧ-6. Они незначительно отличаются друг от друга ― массой тела и количеством пар оснований. Вирус герпеса 7 типа в основном локализуется в CD4+ Т-клетках. Он подавляет CD4, а также оказывает влияние на синцитий, вызывает незапрограммированную гибель клеток, изменяет уровень цитокинов.
Особенности воздействия ВГЧ 7 типа отдельно от ВГЧ-6 пока недостаточно изучены. Однако, известно, что этот тип воздействует на CD4, как и ВИЧ-инфекция, а значит, оказывает негативное воздействие на течение зимеющихся заболеваний. Способена поддерживать существование латентных инфекций.
Вирус герпеса 8 типаВирус HHV-8 ― герпесвирус саркомы Капоши (KSHV) стимулирует синтез лимфоидных, дендритных, эпителиальных клеток и секрецию эпителии простаты. Наличие ВГЧ-8 в организме увеличивает риск развития опухолевых заболеваний.
Основные способы инфицирования: половой, гематогенный (переливания крови), горизонтальный (со слюной), трансплацентарный (плод заражается во время беременности). Наибольшее число копий вируса находится в слюне.
Вирус герпеса 8 типа может стимулировать возникновение новообразований:
-
саркома Капоши;
-
лимфома;
-
множественная миелома;
-
болезнь Кастельмана.

Патологии возникают на фоне старения, иммунодефицита и при ВИЧ-инфекции. Почти у половины ВИЧ-инфицированных ВПЧ-8 в течение 10 лет после заражения развивается саркома Капоши. У всех ВИЧ-инфицированных с саркомой Капоши определяется вирус герпеса 8 типа.
Выживаемость 72% при раннем диагностировании и проведение терапевтических процедур. Однако, HHV-8 сложнее остальных типов поддается лечению. В настоящий момент достаточно эффективных медикаментов не разработано.
Как правило, симптоматика проявляется только у маленьких детей или у взрослых с патологией иммунной системы, ВИЧ-инфицированных, принимающих медикаменты подавляющие иммунитет. Может возникнуть после перенесенных серьезных заболеваний, трансплантации и иных хирургических вмешательства. Симптоматика достаточно обширна, но чаще выражается в лихорадке и сыпи на коже и слизистых.
Цитомегаловирусная инфекция
-
При приобретенной форме наблюдается:
-
Повышение температуры.

-
Общее недомогание, слабость.
-
Головные боли.
-
Увеличение лимфоузлов шеи, боль в горле.
Редко возникают осложнения в виде пневмонии, артритов, отмечаются симптомы гепатита.
Врожденная выражается в следующих симптомах:
-
Гепатоспленомегалия ― увеличение селезёнки и печени.
-
Микроцефалия ― значительное уменьшение размера черепа и, соответственно, головного мозга.
-
Желтуха кожных покровов и склер.
-
Петехии ― геморрагическая сыпь, возникающая из-за повреждения внутрикожных капилляров.
-
Неврологические аномалии.
Заражение цитомегаловирусом во время беременности может привести к гибели эмбриона и к патологическим поражения плода. Сред них геморрагический синдром, поражения нервной системы. Чаще наблюдается нейросенсорная тугоухость и расстройство равновесия, реже ― интеллектуальные расстройства, эпилепсия, ДЦП, нарушение зрения, микроцефалия.
Сред них геморрагический синдром, поражения нервной системы. Чаще наблюдается нейросенсорная тугоухость и расстройство равновесия, реже ― интеллектуальные расстройства, эпилепсия, ДЦП, нарушение зрения, микроцефалия.
Вирус Эпштейна – Барр
Для первичного инфицирования характерны:
-
Катаральная ангина.
-
Заложенность носа.
-
Увеличение лимфоузлов.
-
Умеренное увеличение лимфоцитов.
Манифестная форма ― инфекционный мононуклеоз сопровождается:
-
лихорадкой;
-
общим недомоганием;
-
головной болью;
-
ангиной;
-
увеличением шейных лимфоузлов, болезненностью;
-
спленомегалей;
-
гепатомегалией;
-
желтухой.

Инфекционный мононуклеоз:
-
Высокая температура.
-
Головная боль.
-
Воспаление зева и миндалин.
-
Увеличение и болезненность лимфоузлов.
-
Увеличение печени и селезенки.
При тяжелой форме заболевания могут возникнуть осложнения в виде отита, синусита, гепатита, паратонзиллярного абсцесса, пневмонии.
Вирус герпеса ВГЧ-6
Обладает широкой симптоматикой, наиболее часто отмечают следующие признаки:
-
температура до +40 °С;
-
симптомы интоксикации;
-
эритематозная или папулезная сыпь;
-
неяркая гиперемия зева.

Если у человека сильная иммунная система, без патологий, то ГЧ-6 протекает бессимптомно.
Вирус герпеса ВГЧ-7
Симптомы не выявлены. У лиц с иммунодефицитом может вызвать псевдокраснуху, лихорадку, розовый лишай, судороги, синдром хронической усталости.
Вирус герпеса ВГЧ-8 (HHV-8, саркома Капоши)
Клинические проявления наблюдаются только при иммунодепрессии. Они выражены в появлении сосудистых уплотнений, образуются на коже и во рту. Это множественные геморрагические новообразования злокачественного характера. Со временем вирус может дать осложнение на легкие, желчный пузырь, желчевыводящие пути и иные внутренние органы.
Диагностирование инфекций, вызванных герпесвирусами основывается на лабораторных анализах. Используют методы полимеразной цепной реакции, выполняемые в режиме реального времени.
ПЦР ― это самый точный способ обнаружения всех видов герпеса. Он также один из самых быстрых в производстве, позволяет выявить возбудителя на ранней стадии заболевания. Для получения результат достаточно небольшого количества искомого материала.
Особенностью ПРЦ-метода заключена в копировании специфичного для возбудителя участка ДНК. Он воспроизводится такое количества раз, которое увеличивает образец до приемлемого для диагностики размера.
В качестве образца подойдет любой биологический материал:
-
венозная кровь;
-
семенная жидкость;
-
выделения из влагалища;
-
слюна;
-
ликвор;
-
биоптат и иное.
Среди других методов диагностики герпеса молекулярно-биологические исследования биоптатов кожи для диагностики Саркомы Капоши. Исследуют волосяные фолликулы для подтверждения или исключения ВГЧ-6. Метод цифровой капельной ПЦР помогает выявить хромосомно-интегрированные и наследуемые формы вируса 6 типа. При тканево-инвазивной ЦМВ отдают предпочтение гистологическим и иммуногистохимическим исследованиям.
Исследуют волосяные фолликулы для подтверждения или исключения ВГЧ-6. Метод цифровой капельной ПЦР помогает выявить хромосомно-интегрированные и наследуемые формы вируса 6 типа. При тканево-инвазивной ЦМВ отдают предпочтение гистологическим и иммуногистохимическим исследованиям.
Когда назначают анализ на герпесвирусы
-
При наличии симптоматики, указывающей на заболевания, вызываемые вирусами герпеса.
-
Для дифференцирования герпесвирусных и других инфекций.
-
При планировании беременности и при наличии патологии беременности.
-
При комплексном обследовании ВИЧ-пациентов и людей с иммунодефицитом.
-
Перед проведением иммуносупрессивной терапии.
-
Для контроля за эффективностью терапевтических мероприятий.

Необходимо пройти анализ на герпес пациентам с гемобластозами, лимфопролиферативными болезнями. Показано исследование перед трансплантацией и после ее проведения.
Поскольку вирус герпеса встраивается в геном клетки человека, удалить его невозможно. Терапевтические мероприятия направлены на заболевания, вызываемые герпесвирусами. Для лечения назначают этиотропных препараты и средства для снятия симптоматики. Выбор медикаментов, дозировка и метод лечения выбирают индивидуально, исходят из состояния больного, наличия осложнений и сопутствующих заболеваний.
Вирусы герпеса активизируются на фоне подавленного иммунитета, большинство пациентов ВИЧ-инфицированные. При этом лечение показано при иммунологически благоприятном состоянии, в этом случае риск осложнений меньше, шансы на излечение выше. Тем не менее, больные с плохим прогнозом тоже проходят индивидуальное, не всегда систематическое лечение.
Анализы
перейти к анализам
Human Herpes Virus 7, ДНК [ПЦР]
Исследование биоматериала для обнаружения генетического материала (ДНК) вируса герпеса 7 типа (ВГЧ-7) с помощью метода полимеразной цепной реакции в реальном времени (реал-тайм ПЦР).
Синонимы русские
Вирус герпеса 7 типа, герпес-вирус, ВГЧ-7, РТ-ПЦР.
Синонимы английские
HHV-7, DNA [Real-time PCR].
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь, ликвор, слюну, биоптат.
Общая информация об исследовании
Герпес-вирус человека 7-го типа (ВГЧ-7) впервые был выделен относительно недавно, в 1990 г. К настоящему времени установлено, что он широко распространен и встречается более чем у 90 % взрослого населения планеты. ВГЧ-7 обычно заражаются в детском возрасте, хотя проявляется он несколько позже, чем ВГЧ-6, и в более широком возрастном диапазоне: большинство людей инфицируется к 6-10-му году жизни. В первые месяцы жизни ВГЧ-7 встречается относительно редко.
ВГЧ-7 обычно заражаются в детском возрасте, хотя проявляется он несколько позже, чем ВГЧ-6, и в более широком возрастном диапазоне: большинство людей инфицируется к 6-10-му году жизни. В первые месяцы жизни ВГЧ-7 встречается относительно редко.
ВГЧ-7 постоянно обитает и размножается только в Т-лимфоцитах (CD4+ Т-хелперах), но может быть выявлен и в других клетках – в ткани слюнных желез, мозга, печени, эндотелии.
С учетом того, что ВГЧ-7-инфекция в латентной форме распространена практически повсеместно, очень важно своевременно устанавливать характер ее течения – активный/неактивный. Активация любой вирусной инфекции начинается с размножения (репликации) вируса в клетке-хозяине. Далее в большинстве случаев клетки-хозяева погибают, а новые вирусы выходят в межклеточное пространство (внутритканевую жидкость) для заражения новых клеток. Отсюда вирусные частицы попадают в различные биологические жидкости (кровь, мочу, ликвор) и железистые секреты, где могут быть обнаружены с помощью ПЦР. Наличие вирусных нуклеиновых кислот (ДНК/РНК) в бесклеточных образцах биологических жидкостей или железистых секретах является стопроцентным признаком активной вирусной инфекции.
Наличие вирусных нуклеиновых кислот (ДНК/РНК) в бесклеточных образцах биологических жидкостей или железистых секретах является стопроцентным признаком активной вирусной инфекции.
Установлено, что ВГЧ-7 является причиной следующих заболеваний у лиц с нескомпрометированной иммунной системой: у детей – псевдокраснухи, острых лихорадочных состояний, лихорадочных судорог, у взрослых – розового лишая, цитомегаловирусных инфекций при трансплантации почек.
Кроме того, ВГЧ-7 в ассоциации с ВГЧ-6 считается причиной синдрома хронической усталости (СХУ) у взрослых и ассоциируется с некоторыми лимфопролиферативными заболеваниями.
СХУ как самостоятельное заболевание был выделен в 1988 году. Есть несколько критериев, на основании которых ставится диагноз. Вот некоторые из них: беспричинная слабость, постоянная усталость и снижение работоспособности, нарушение сна, наутро – чувство разбитости, температура 37-38 °С в течение 6 месяцев, увеличение лимфатических узлов (шейных, затылочных, подмышечных), ухудшение памяти, внимания, быстрое снижение массы тела, снижение аппетита – при отсутствии других заболеваний со сходными симптомами./ST70/Untitled-6.gif)
Если в течение полугода и более присутствует несколько данных признаков, то можно заподозрить синдром хронической усталости, вызванный ВГЧ-7. Следует сказать, что «СХУ» ставится обычно как «диагноз исключения»: после полного обследования пациента и исключения у него таких патологий, как ВИЧ-инфекция, онкологические заболевания, различные заболевания крови, психиатрические и нервные болезни. Заболеванию подвержены люди любого возраста, однако замечено, что чаще им страдают женщины в возрасте 25-49 лет.
ВГЧ-7 часто ассоциируется с клиническими случаями Эпштейна – Барр – вирусной инфекции, например мононуклеозом, гепатитом, энцефалитом. Также есть указания, что он играет роль в развитии лекарственной непереносимости (гиперчувствительности).
С помощью ПЦР ВГЧ-7 обнаруживается в слюне, лимфоцитах и моноцитах периферической крови и других биологических жидкостях.
Наиболее вероятный путь передачи инфекции – воздушно-капельный, со слюной, потенциально возможна вертикальная передача от матери к ребёнку во время беременности и родов.
По разным данным, в генитальном тракте ВГЧ-7-серопозитивных женщин вирус обнаруживается у 3 % обследуемых, при этом прослеживается тенденция большей частоты генитального вирусоносительства при беременности (больше в последнем триместре). В ряде исследований ВГЧ-7 обнаруживали в цервикальных мазках, при этом его ассоциация с вирусом папилломы человека (ВПЧ) достоверно повышает риск рака шейки матки у таких лиц. Однако в литературе не описаны женские генитальные заболевания, ассоциированные с ВГЧ-7. Таким образом, присутствие ВГЧ-7 в женских половых путях может иметь значение при передаче вируса половым путем и плоду во время беременности или родов.
У 60-70 % взрослых мужчин, не инфицированных ВИЧ, в нормальной и бесплодной сперме обнаруживается ВГЧ-6, однако ВГЧ-7 в этом биоматериале до сих пор не найдено. Поэтому считается, что ВГЧ-7 не связан с развитием олиго-, панспермии и бесплодия у мужчин и мужчины не передают его половым путем. Но в одном исследовании у 11,1 % ВИЧ-инфицированных мужчин ВГЧ-7 был обнаружен в генитальном тракте.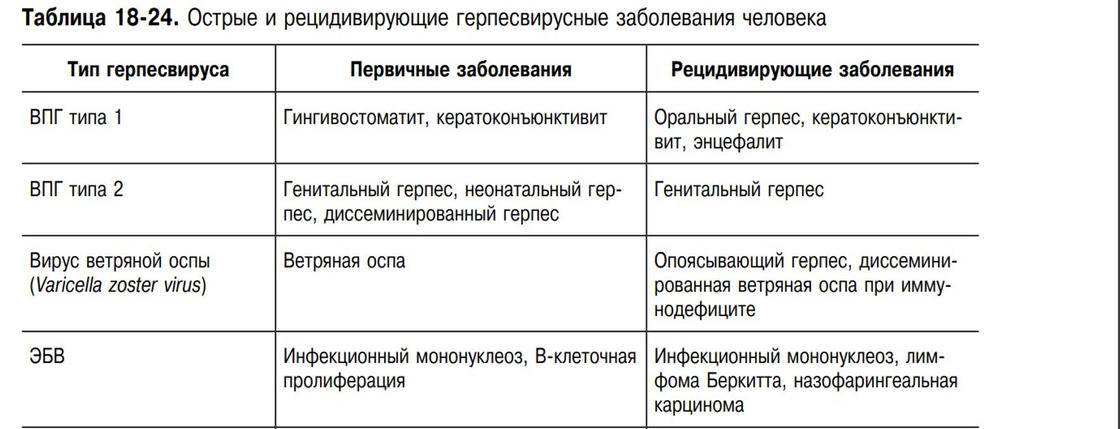 Достоверных данных об ассоциации ВГЧ-7 с известными заболеваниями мужской репродуктивной системы нет. Однако у реципиентов почечных трансплантатов (мужчин и женщин) при развитии цитомегаловирусных инфекций на фоне иммунодепрессивной терапии в моче часто обнаруживается ВГЧ-7 (нередко еще до клинических проявлений ЦМВ-инфекции).
Достоверных данных об ассоциации ВГЧ-7 с известными заболеваниями мужской репродуктивной системы нет. Однако у реципиентов почечных трансплантатов (мужчин и женщин) при развитии цитомегаловирусных инфекций на фоне иммунодепрессивной терапии в моче часто обнаруживается ВГЧ-7 (нередко еще до клинических проявлений ЦМВ-инфекции).
Для чего используется это исследование?
- Позволяет установить инфицирование обследуемых лиц вирусом герпеса человека 7-го типа.
Когда назначается исследование?
- При подозрении на инфекционное заболевание, возбудителем которого может быть вирус герпеса человека 7 типа: 1) при дифференциальной диагностике детских инфекций, протекающих с высокой температурой и сыпью, нередко с судорогами; 2) при диагностике синдрома хронической усталости.
-
При подозрении на инфекционное заболевание центральной нервной системы, возбудителем которого может быть вирус герпеса 7-го типа.

Что означают результаты?
Референсные значения: отрицательно.
Причины положительного результата:
- активная ВГЧ-7 инфекция.
Причины отрицательного результата:
- возможное отсутствие активной ВГЧ-7 инфекции, нуждается в дополнительном подтверждении с помощью ретроспективных исследований вирусоспецифических IgG-антител.
Вирус герпеса типа 6 — StatPearls
Непрерывное обучение
Хотя наиболее частым проявлением вируса герпеса человека 6 (ВГЧ-6) является субитумная сыпь, также называемая детской розеолой, ВГЧ-6, как известно, вызывает более опасную инфекции у лиц с ослабленным иммунитетом. Члены межпрофессиональной бригады должны признать, что дальнейшая оценка этого состояния оправдана, когда у пациента с ослабленным иммунитетом наблюдаются изменения поведения с сыпью или без нее.Раннее распознавание приведет к ускоренному лечению, улучшению ухода за пациентами и предотвращению неблагоприятных исходов. В этом упражнении рассматривается диагностика, ведение и лечение вируса герпеса человека 6, а также подчеркивается роль межпрофессиональной команды в уходе за больными пациентами.
В этом упражнении рассматривается диагностика, ведение и лечение вируса герпеса человека 6, а также подчеркивается роль межпрофессиональной команды в уходе за больными пациентами.
Цели:
Опишите патофизиологию вируса герпеса человека 6.
Опишите типичную клиническую картину пациента с вирусом герпеса человека 6.
Краткий обзор рекомендаций по лечению пациентов, инфицированных вирусом герпеса 6 типа.
Объясните важность улучшения координации помощи между межпрофессиональной командой для улучшения оказания помощи пациентам, инфицированным вирусом герпеса человека 6, особенно тем, кто подвержен риску более тяжелой инфекции.
Введение
Вирус герпеса человека 6 (HHV-6) первоначально был обнаружен в лимфоцитах крови взрослых с лимфопролиферативными заболеваниями или СПИДом и был назван В-лимфотропным вирусом человека. Дальнейшие исследования выявили HHV-6 в лимфоцитах CD4+ и в составе вирусов герпеса. Поскольку это был шестой выделенный герпесвирус, впоследствии он был переименован в человеческий герпесвирус 6. Известно, что HHV-6, типичный для вируса герпеса, вызывает острую, непрекращающуюся и постоянную инфекцию.
Дальнейшие исследования выявили HHV-6 в лимфоцитах CD4+ и в составе вирусов герпеса. Поскольку это был шестой выделенный герпесвирус, впоследствии он был переименован в человеческий герпесвирус 6. Известно, что HHV-6, типичный для вируса герпеса, вызывает острую, непрекращающуюся и постоянную инфекцию.
HHV-6 — собирательное название двухцепочечных ДНК-вирусов HHV-6A и HHV-6B. HHV-6A и HHV-6B официально признаны отдельными вирусами, а не вариантами внутри семейства герпесвирусов.Хотя о HHV-6A известно гораздо меньше, он чаще встречается у хозяина с ослабленным иммунитетом. Напротив, исследования определили, что HHV-6B является этиологическим агентом детской экзантемы (детская розеола) [1]. Приобретение HHV-6B довольно часто встречается у молодых людей и часто наблюдается в отделениях неотложной помощи по всему миру. HHV-6B является вездесущим вирусом, которым более 90% населения инфицировано в течение первых 3 лет жизни.
Этиология
HHV-6A, HHV-6B и HHV-7 имеют определенный уровень гомологии с цитомегаловирусом человека (CMV), единственным другим бета-герпесвирусом человека. [1] И HHV-6A, и HHV-6B реплицируются в Т-клетках. Однако они различаются по рецепторам, используемым для входа в клетку. В отличие от человеческой кластерной дифференцировки 46 (CD46), используемой вирусом HHV-6A, исследования показывают, что кластерная дифференцировка 134 (CD134) является первичным рецептором для HHV-6B.[2] CD134 экспрессируется только на активированных Т-клетках.[3] Подобно HHV-8, также известному как вирус герпеса, ассоциированный с саркомой Капоши (KSHV), и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус является онкогенным и разрушительным для аутоиммунных клеток.После связывания с соответствующим рецептором HHV-6 устанавливает латентное состояние в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
[1] И HHV-6A, и HHV-6B реплицируются в Т-клетках. Однако они различаются по рецепторам, используемым для входа в клетку. В отличие от человеческой кластерной дифференцировки 46 (CD46), используемой вирусом HHV-6A, исследования показывают, что кластерная дифференцировка 134 (CD134) является первичным рецептором для HHV-6B.[2] CD134 экспрессируется только на активированных Т-клетках.[3] Подобно HHV-8, также известному как вирус герпеса, ассоциированный с саркомой Капоши (KSHV), и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус является онкогенным и разрушительным для аутоиммунных клеток.После связывания с соответствующим рецептором HHV-6 устанавливает латентное состояние в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
Во взрослом возрасте более 95% населения являются серопозитивными в отношении HHV-6A, HHV-6B или обоих вариантов. Существующие серологические методы неэффективны для выделения одного варианта от другого [4]. В настоящее время хорошо известно, что HHV-6 является основной причиной детской розеолы. HHV-6B в первую очередь поражает младенцев и является основной причиной реактивации вируса как у иммунокомпетентных, так и у иммунокомпрометированных хозяев.[1] В общей популяции подавляющее большинство взрослых с хроническим ВГЧ-6 остаются бессимптомными. Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией ВГЧ-6 имели ДНК вируса в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги.[5] Напротив, другие исследователи определили распространенность ДНК HHV-6 в спинномозговой жидкости детей с фебрильными судорогами и пациентов со СПИДом с неврологическими симптомами только от 0% до 4%.[5] Эти вирусы связаны с заболеваниями у пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований.
В настоящее время хорошо известно, что HHV-6 является основной причиной детской розеолы. HHV-6B в первую очередь поражает младенцев и является основной причиной реактивации вируса как у иммунокомпетентных, так и у иммунокомпрометированных хозяев.[1] В общей популяции подавляющее большинство взрослых с хроническим ВГЧ-6 остаются бессимптомными. Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией ВГЧ-6 имели ДНК вируса в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги.[5] Напротив, другие исследователи определили распространенность ДНК HHV-6 в спинномозговой жидкости детей с фебрильными судорогами и пациентов со СПИДом с неврологическими симптомами только от 0% до 4%.[5] Эти вирусы связаны с заболеваниями у пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований. [4] Кроме того, успешные исследования выявили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом.[6]
[4] Кроме того, успешные исследования выявили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом.[6]
Эпидемиология
Исследователи идентифицировали HHV-6B как этиологический патоген, ответственный за большинство инфекций HHV-6, проявляющихся симптомами.Хотя исследования подтверждают, что большинство людей были инфицированы ВГЧ-6 в какой-то момент своей жизни, первичное заражение ВГЧ-6 происходит в течение первых 2 лет. В этой возрастной группе это обычно связано с недифференцированным лихорадочным заболеванием, хотя у части детей будут проявляться классические проявления детской розеолы. В нескольких отчетах об исследованиях зафиксировано снижение серопозитивности с увеличением возраста [4]. Хотя первичная инфекция ВГЧ-6 у взрослых встречается редко, реактивация может произойти в любом возрасте.Инфекция HHV-6 не имеет склонности к половой жизни и может встречаться у людей всех рас.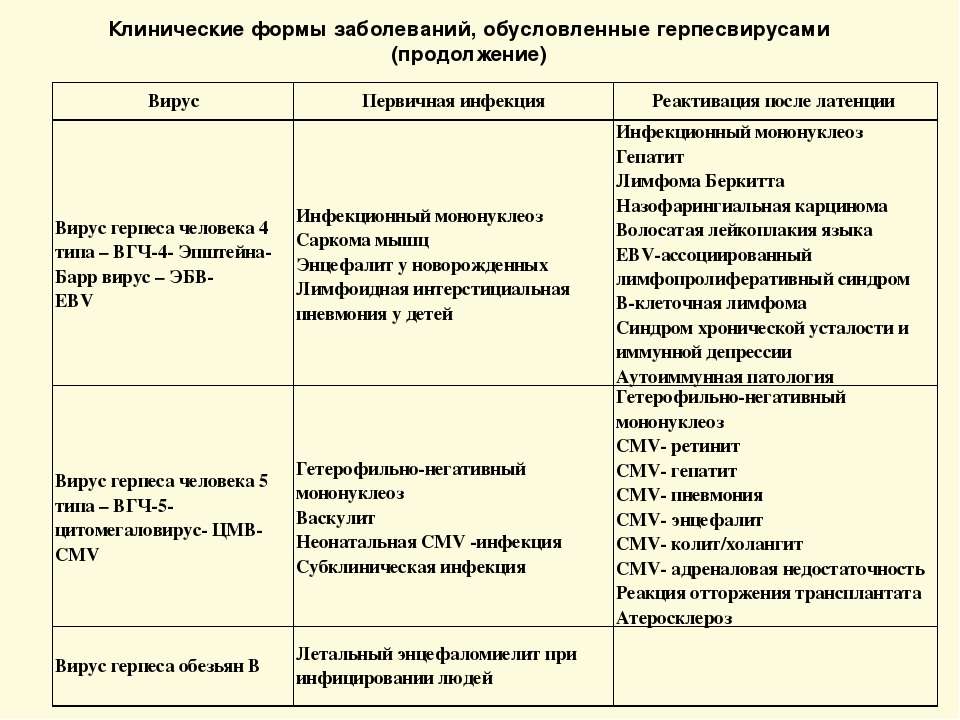
HHV-6 — это повсеместно распространенный вирус, встречающийся во всем мире. В крупном проспективном исследовании североамериканских детей пиковый возраст заражения HHV-6 приходился на возраст от 6 до 9 месяцев.[1] Как и в Соединенных Штатах, в Великобритании и Японии от 97 до 100 % первичных инфекций связаны с HHV-6B. Хотя эпидемиологические отчеты о HHV-6A ограничены, исследования показывают, что инфекция HHV-6A приобретается в более позднем возрасте и что первичная инфекция этим конкретным вариантом часто протекает бессимптомно.[7] Тем не менее, несколько групп зарегистрировали HHV-6A у детей с симптомами из Африки и США. Кроме того, HHV-6A был идентифицирован как преобладающая форма вируса, выделенного у ВИЧ-позитивных младенцев в эндемичном регионе Африки к югу от Сахары.[7] Среди разных популяций серопревалентность резко различается. Задокументировано 20 % серопревалентности среди беременных марокканских женщин и 100 % среди бессимптомных взрослых китайцев. Серопревалентность колебалась примерно от 39 до 80% среди этнически разнообразного взрослого населения Танзании, Малайзии, Таиланда и Бразилии. [4]
[4]
Патофизиология
В целом, первичная инфекция HHV-6 является одной из наиболее распространенных причин острых лихорадочных заболеваний у детей раннего возраста. Это также является важной причиной обращений в отделение неотложной помощи, госпитализаций и фебрильных судорог [1]. HHV-6 принадлежит к подсемейству Betaherpesvirinae и роду Roseolovirus . Частица вириона имеет характерную структуру герпесвируса с центральным ядром, содержащим вирусную ДНК, капсидом и богатым белком покровным слоем, окруженным мембраной.
Основной клеткой-мишенью для HHV-6 является зрелая Т-клетка CD4+.[1] Вирус продемонстрировал плейотропное действие на иммунную систему, включая модуляцию функции естественных клеток-киллеров. In vivo HHV-6 в первую очередь инфицирует и реплицируется в лимфоцитах CD4 после прикрепления к клеточному рецептору CD46. Через опосредованный рецептором эндоцитоз HHV-6 проникает в клетки с последующей репликацией вируса (Ablashi). После первичного заражения ДНК вируса живет в мононуклеарных клетках периферической крови (МКПК). [1]
[1]
В то время как точный механизм передачи HHV-6 все еще находится в стадии изучения, несколько исследований выявили передачу вируса через слюну. По-видимому, наиболее распространенным путем является передача через слюну от матери к ребенку. В нескольких ранних отчетах описывалось, что инфекционный ВГЧ-6 присутствует в слюне почти каждого человека, прошедшего тестирование.[4] Кроме того, образцы слюны 90% обследованных лиц содержали ДНК ВГЧ-6, в то время как в другом исследовании, основанном на ПЦР, только 3% людей были положительными, хотя 63% образцов биопсии слюнных желез были положительными.[4] Геном HHV-6 также был обнаружен в спинномозговой жидкости детей во время первичных и латентных инфекций, а также в мозговом веществе нормальных взрослых при вскрытии, что позволяет предположить, что как ЦНС, так и слюнные железы являются резервуаром вирусной латентности и персистирующей инфекции. .[1][4]
Анамнез и медицинский осмотр
Хотя различные клинические проявления и заболевания, связанные с ВГЧ-6, все еще находятся в стадии изучения, исследования уже подтверждают, что ВГЧ-6 играет важную роль в заболеваниях центральной нервной системы и у лиц с ослабленным иммунитетом, включая реципиентов трансплантатов. [8] Инфекция ВГЧ-6 обычно протекает доброкачественно и проходит самостоятельно. Лица с симптомами, как правило, младенцы или взрослые с ослабленным иммунитетом, у которых наблюдается реактивация болезни.
[8] Инфекция ВГЧ-6 обычно протекает доброкачественно и проходит самостоятельно. Лица с симптомами, как правило, младенцы или взрослые с ослабленным иммунитетом, у которых наблюдается реактивация болезни.
ВГЧ-6В является возбудителем экзантемы субитум (также известной как детская розеола), детского заболевания, характеризующегося высокой температурой и легкой кожной сыпью, на долю которого приходится от 10 до 17% обращений детей в отделение неотложной помощи с острой лихорадкой до 36 месяцев.[9] На первичную инфекцию ВГЧ-6 приходится более 36% всех случаев острой лихорадки у детей в возрасте от 12 до 15 месяцев, и почти исключительно она вызывается ВГЧ-6В, а не ВГЧ-6А.[9][8][10]
Диагноз детской розеолы устанавливается клинически. Это часто провоцируется внезапным началом высокой лихорадки с температурой, достигающей 40 ° C (104 F) в течение трех-пяти дней. Во время начальной лихорадочной фазы у некоторых детей наблюдается периорбитальный отек, конъюнктивит или воспаление барабанной перепонки, в то время как многие другие будут активны и здоровы. [9] Другие симптомы у детей включают лимфаденопатию, желудочно-кишечные (ЖКТ) симптомы, включая дисфункцию печени и гепатит, а также выбухание родничков.[11] У взрослых часто встречаются гепатит и симптомы, характерные для энцефалита.[9] У реципиентов трансплантата симптомы часто включают лихорадку, реакцию «трансплантат против хозяина» (РТПХ), симптомы отторжения трансплантата, интерстициальный пневмонит, миелит и сыпь.[12]
[9] Другие симптомы у детей включают лимфаденопатию, желудочно-кишечные (ЖКТ) симптомы, включая дисфункцию печени и гепатит, а также выбухание родничков.[11] У взрослых часто встречаются гепатит и симптомы, характерные для энцефалита.[9] У реципиентов трансплантата симптомы часто включают лихорадку, реакцию «трансплантат против хозяина» (РТПХ), симптомы отторжения трансплантата, интерстициальный пневмонит, миелит и сыпь.[12]
Результаты физикального обследования обычно соответствуют ранее описанным симптомам. У детей при снижении лихорадки часто наблюдается побледнение макуло-папулезной сыпи розово-розового цвета размером примерно 2–5 мм с ореолом вокруг.Сыпь обычно сохраняется в течение одного-двух дней и часто распространяется центробежно. Однако есть задокументированные случаи лихорадки без сыпи.[13] Воспаление барабанной перепонки и признаки инфекции верхних или нижних дыхательных путей часто встречаются у детей, в то время как у взрослых при физикальном обследовании может быть лихорадка, гепатоспленомегалия и лимфаденопатия. [12]
[12]
Оценка
Вирус герпеса человека 6 (HHV-6) можно диагностировать с помощью полимеразной цепной реакции (ПЦР), серологии или вирусных культур, причем ПЦР является преобладающим методом.[12] Однако маловероятно, что лабораторные исследования будут проведены у иммунокомпетентных лиц из-за самокупирующегося характера заболевания. Слюна является основным резервуаром для передачи вируса, так как он часто выделяется в слюнных железах. Хотя сообщений о передаче вируса при переливании крови и грудном вскармливании не поступало, были зарегистрированы случаи ВГЧ-6 после трансплантации органов.[12] Большинство исследователей твердо убеждены в том, что заражение ВГЧ-6В происходит в раннем возрасте, тогда как заражение ВГЧ-6А развивается позже.Оба варианта вируса были одновременно обнаружены у взрослых, что позволяет предположить, что вирусы хронически поражают многих людей.
Лабораторные исследования при ВГЧ-6 могут выявить лейкоцитоз, лейкопению и анемию.[13] У пациентов с трансплантацией почки и пациентов с дисфункцией печени следует провести исследования почек и печени соответственно, чтобы исключить нарушение электролитного баланса и гепатит.
Показания к рентгенологической визуализации зависят от клинической картины, особенно у лиц с ослабленным иммунитетом.Рентгенография грудной клетки может быть выполнена для исключения другой этиологии у взрослых, включая пневмонию и пневмонит. У детей потребность в визуализации возникает реже. Компьютерная томография (КТ) головы с контрастом или без него может быть получена для поиска других излечимых заболеваний. При поражении центральной нервной системы может быть выполнена люмбальная пункция. Инфекция HHV-6 в ЦНС часто имеет умеренный плеоцитоз с повышенным содержанием белка. СМЖ может быть отправлена на ПЦР-исследование HHV-6 для подтверждения диагноза.[14]
Лечение/управление
В настоящее время не существует утвержденного соединения, предназначенного исключительно для лечения ВГЧ-6, и нет доступной вакцины.[8] Обычно не рекомендуется проводить противовирусную профилактику инфекции HHV-6. Вместо этого рекомендуется проводить раннее противовирусное лечение, особенно в случаях энцефалита HHV-6. Рекомендуется терапия первой линии с внутривенным введением ганцикловира и фоскарнета с лечением в течение 3–4 недель.[15] У пациентов, перенесших трансплантацию стволовых клеток, лечение ганцикловиром имеет задокументированные преимущества и является рекомендуемым противовирусным препаратом выбора.[15]
Рекомендуется терапия первой линии с внутривенным введением ганцикловира и фоскарнета с лечением в течение 3–4 недель.[15] У пациентов, перенесших трансплантацию стволовых клеток, лечение ганцикловиром имеет задокументированные преимущества и является рекомендуемым противовирусным препаратом выбора.[15]
Инфекции ВГЧ-6 у иммунокомпетентных детей проходят самостоятельно и не требуют лечения. Лечение младенцев с детской розеолой обычно поддерживающее.[12] Жаропонижающие, такие как ацетаминофен или ибупрофен, рекомендуются для лечения сильной лихорадки и лиц с риском фебрильных судорог. Если возникают фебрильные судороги, противоэпилептические средства не нужны. Лица с инфекцией HHV-6, проявляющейся поражением ЦНС, включая фебрильные судороги, должны быть госпитализированы.
Дифференциальный диагноз
Дифференциальный диагноз входит:
инфекционный мононуклеоз
Вирусный гепатит
герпес симплекс вирус-инфекция
Meningitis
RUBLELLA
Вирусная пневмония
Лекарственная сыпь с эозинофилией и системными симптомами (DRESS-синдром)
У детей с классической детской розеолой этиологическим возбудителем является ВГЧ-6. Однако некоторые другие заболевания могут вызывать лихорадку и сыпь. Более тяжелые, менее доброкачественные причины таких симптомов требуют исключения. У иммунокомпетентных взрослых инфекция HHV-6 проявляется аналогично мононуклеозу. Таким образом, ВЭБ и ЦМВ следует исключить. Пациенты с ослабленным иммунитетом, особенно те, кому пересаживают органы, и больные СПИДом, как правило, имеют симптомы. Эта когорта лиц с заболеванием ВГЧ-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и DRESS-синдром.[16] Кроме того, существует документация о HHV-6 в случаях рассеянного склероза, энцефалита и интерстициального пневмонита.[17] Стоит отметить, что только HHV-6A связан с тиреоидитом Хашимото.[12]
Однако некоторые другие заболевания могут вызывать лихорадку и сыпь. Более тяжелые, менее доброкачественные причины таких симптомов требуют исключения. У иммунокомпетентных взрослых инфекция HHV-6 проявляется аналогично мононуклеозу. Таким образом, ВЭБ и ЦМВ следует исключить. Пациенты с ослабленным иммунитетом, особенно те, кому пересаживают органы, и больные СПИДом, как правило, имеют симптомы. Эта когорта лиц с заболеванием ВГЧ-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и DRESS-синдром.[16] Кроме того, существует документация о HHV-6 в случаях рассеянного склероза, энцефалита и интерстициального пневмонита.[17] Стоит отметить, что только HHV-6A связан с тиреоидитом Хашимото.[12]
Прогноз
Как правило, первичная инфекция HHV-6 проходит самостоятельно, и иммунокомпетентные люди выживают без осложнений.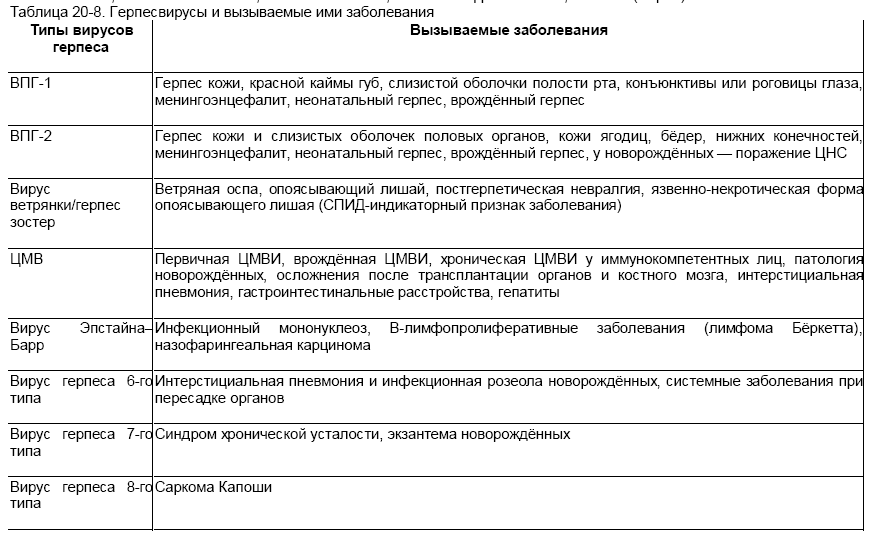 У людей с ослабленным иммунитетом в отчетах описано более тяжелое заболевание. Имеются документальные данные о пневмоните, гепатите и отторжении органов у пациентов с трансплантацией, а также о смерти пациентов с энцефалитом и менингоэнцефалитом.[18] Точно так же в Японии с 2003 по 2004 год обследование пациентов с энцефалитом, связанным с субитумной экзантемой, показало необычно плохой прогноз [19] с зарегистрированными смертельными исходами у двух детей с энцефалопатией, вторичной по отношению к инфекции HHV-6. У детей было обнаружено генетическое митохондриальное заболевание.[20]
У людей с ослабленным иммунитетом в отчетах описано более тяжелое заболевание. Имеются документальные данные о пневмоните, гепатите и отторжении органов у пациентов с трансплантацией, а также о смерти пациентов с энцефалитом и менингоэнцефалитом.[18] Точно так же в Японии с 2003 по 2004 год обследование пациентов с энцефалитом, связанным с субитумной экзантемой, показало необычно плохой прогноз [19] с зарегистрированными смертельными исходами у двух детей с энцефалопатией, вторичной по отношению к инфекции HHV-6. У детей было обнаружено генетическое митохондриальное заболевание.[20]
Осложнения
Обычно первичная инфекция ВГЧ-6 протекает доброкачественно со спонтанным исчезновением через 5–7 дней. Наиболее частым осложнением детской розеолы являются фебрильные судороги. Дополнительные осложнения часто возникают из-за нейротрофических эффектов HHV-6, что особенно заметно в случаях поражения центральной нервной системы, например, в случаях менингоэнцефалита и энцефалопатии. В этих случаях вирус проникает в мозг во время первичной инфекции и может оставаться в спящем состоянии в тканях мозга.[21] Впоследствии появились записи о случаях острого или подострого энцефалита, иногда связанных с диффузной или многоочаговой демиелинизацией.[4] HHV-6 редко вызывает оппортунистическую инфекцию у лиц с ослабленным иммунитетом. Активность HHV-6A и HHV-6B была обнаружена после трансплантации почек, печени и костного мозга (BMT) [4].
В этих случаях вирус проникает в мозг во время первичной инфекции и может оставаться в спящем состоянии в тканях мозга.[21] Впоследствии появились записи о случаях острого или подострого энцефалита, иногда связанных с диффузной или многоочаговой демиелинизацией.[4] HHV-6 редко вызывает оппортунистическую инфекцию у лиц с ослабленным иммунитетом. Активность HHV-6A и HHV-6B была обнаружена после трансплантации почек, печени и костного мозга (BMT) [4].
Сдерживание и просвещение пациентов
У в остальном здорового младенца с детской розеолой обучение родителей имеет решающее значение для снижения беспокойства по поводу лихорадки и возможных фебрильных судорог.Важность поддерживающей терапии жаропонижающими средствами и бесполезность антибиотиков требуют объяснения. У лиц с ослабленным иммунитетом сложные симптомы и другие вторичные вирусные заболевания, которые могут сопровождать инфекцию HHV-6, являются поводом для консультирования с упором на раннее обращение за медицинской помощью при появлении симптомов.
Pearls and Other Issues
Общепризнано, что HHV-6B является причинным вариантом, ответственным за большинство первичных инфекций, в то время как HHV-6A приобретается после HHV-6B в результате бессимптомной инфекции.[22]1. Отличие случаев первичной инфекции HHV-6 с типичной сыпью детской розеолы от других заболеваний является ключом к исключению более тяжелых диагнозов. Наиболее частым осложнением инфекции ВГЧ-6 является детская розеола, и на ВГЧ-6 приходится примерно 10–20 % лихорадочных заболеваний у детей в возрасте от 6 месяцев до 3 лет. Фебрильные судороги, симптомы со стороны желудочно-кишечного тракта и дыхательных путей встречаются реже и обычно проходят самостоятельно. Поддерживающая терапия с отдыхом и гидратацией является общепринятым подходом к лечению в этой подгруппе.Подобно другим вирусам герпеса, HHV-6 реплицируется в слюнных железах и находится в латентном состоянии в мононуклеарных клетках периферической крови. Диагностика ВГЧ-6 с помощью лабораторных исследований у иммунокомпетентного хозяина обычно не требуется. Тем не менее, ПЦР, серологические исследования или посев вируса часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Тем не менее, ПЦР, серологические исследования или посев вируса часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Инфекция HHV-6 коррелирует с более тяжелыми заболеваниями, включая мононуклеоз, колит, миокардит и гепатит, в дополнение к документально подтвержденным осложнениям центральной нервной системы в виде энцефалита и менингоэнцефалита.Раннее распознавание и лечение неврологических осложнений являются неотъемлемой частью предотвращения неблагоприятных исходов. Дети и взрослые, больные раком, реципиенты аллогенных трансплантатов и лица с иммуносупрессивными расстройствами, подвержены риску реактивации ВГЧ-6. В таких случаях у людей может наблюдаться лихорадка, сыпь и снижение количества циркулирующих гранулоцитов и эритроидных клеток.[12] Хотя не существует утвержденных методов лечения исключительно инфекции HHV-6, противовирусное лечение ганцикловиром и/или фоскарнетом оказалось успешным в лечении неврологических осложнений, описанных ранее.
Улучшение результатов работы бригады здравоохранения
HHV-6 обычно проявляется сыпью как у детей, обращающихся в отделение неотложной помощи, так и у педиатров. Хотя определение сыпи может быть сложной задачей, выделение конкретных сопутствующих симптомов необходимо, чтобы различать более токсичные и доброкачественные заболевания. Большинство инфекций HHV-6 протекают бессимптомно, преходящи и не требуют противовирусного лечения. [Уровень II] Консультация педиатра является рекомендацией для младенцев с детской розеолой, у которых есть фебрильные судороги.Известны осложнения HHV-6, и людям с более зловещими признаками и симптомами, включая изменения психического статуса и недостаточность органов, может помочь межпрофессиональный подход. В таких случаях необходима консультация невролога и врача-инфекциониста. При подозрении на сердечную недостаточность, связанную с HHV-6, ранняя консультация кардиолога имеет решающее значение для лечения инфекционного миокардита у иммунокомпетентных взрослых пациентов. [23] [Уровень IV]
[23] [Уровень IV]
Скоординированный уход со стороны квалифицированных медсестер целесообразен для наблюдения за ухудшением состояния и изменениями показателей жизнедеятельности.Точно так же не следует сбрасывать со счетов лабораторную помощь в ускорении предпочтительных методов обнаружения вируса в крови или спинномозговой жидкости с помощью ПЦР или вирусного антигена в ткани с помощью иммуногистохимии. (Уровень II). Наконец, фармацевт является неотъемлемой частью обеспечения противовирусного лечения ганцикловиром и фоскарнетом при энцефалите, связанном с HHV-6.[24] [Уровень III] Для улучшения исходов в сложных случаях и обеспечения наилучших результатов рекомендуется совместный, ориентированный на пациента, межпрофессиональный командный подход между клиницистами, включая врачей, лабораторию, специально обученных медсестер и фармацевтов, открыто общающихся как команда здравоохранения. исходы пациента.[Уровень 5]
Рисунок
Это гистологический препарат вируса герпеса человека-6 (HHV-6), ранее известного как HBLV, типа вируса герпеса, открытого в октябре 1986 года. Это микрофотография зараженного клетки с тельцами включения как в ядре, так и в цитоплазме. (подробнее…)
Это микрофотография зараженного клетки с тельцами включения как в ядре, так и в цитоплазме. (подробнее…)
Ссылки
- 1.
- Caserta MT, Mock DJ, Dewhurst S. Herpesvirus человека 6. Clin Infect Dis. 2001 г., 15 сентября; 33 (6): 829-33. [PubMed: 11512088]
- 2.
- Кладовая С.Н., Медвецкий П.Г. Латентность, интеграция и реактивация вируса герпеса человека-6. Вирусы. 24 июля 2017 г.; 9(7) [бесплатная статья PMC: PMC5537686] [PubMed: 28737715]
- 3.
- Элиассен Э., Лум Э., Притчетт Дж., Онгради Дж., Крюгер Г., Кроуфорд Дж. Р., Фан Т. Л., Аблаши Д., Хадналл С.Д. Вирус герпеса человека 6 и злокачественные новообразования: обзор. Фронт Онкол. 2018;8:512. [Бесплатная статья PMC: PMC6277865] [PubMed: 30542640]
- 4.
- Braun DK, Dominguez G, Pellett PE. Герпесвирус человека 6.Clin Microbiol Rev. 1997 Jul; 10(3):521-67. [Статья PMC бесплатно: PMC172933] [PubMed: 9227865]
- 5.
- Ансари А., Ли С., Абзуг М.
 Дж., Вайнберг А. Вирусы герпеса человека 6 и 7 и инфекция центральной нервной системы у детей. Эмердж Инфекция Дис. 2004 авг.; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247]
Дж., Вайнберг А. Вирусы герпеса человека 6 и 7 и инфекция центральной нервной системы у детей. Эмердж Инфекция Дис. 2004 авг.; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247] - 6.
- Agut H, Bonnafous P, Gautheret-Dejean A. Обновленная информация об инфекциях вирусами герпеса человека 6A, 6B и 7. Med Mal Infect. 2017 март; 47(2):83-91. [PubMed: 27773488]
- 7.
- Аблаши Д., Агут Х., Альварес-Лафуэнте Р., Кларк Д.А., Дьюхерст С., ДиЛука Д., Фламанд Л., Френкель Н., Галло Р., Гомпелс Ю.А., Хёльсберг П., Якобсон С., Луппи М., Луссо П., Мальнати М., Медвецкий P, Mori Y, Pellett PE, Pritchett JC, Yamanishi K, Yoshikawa T. Классификация HHV-6A и HHV-6B как отдельных вирусов. Арх Вирол. 2014 май; 159(5):863-70. [Бесплатная статья PMC: PMC4750402] [PubMed: 24193951]
- 8.
- De Bolle L, Naesens L, De Clercq E. Обновленная информация о биологии вируса герпеса человека 6, клинических особенностях и терапии.Clin Microbiol Rev. 2005 Jan; 18(1):217-45.
 [Бесплатная статья PMC: PMC544175] [PubMed: 15653828]
[Бесплатная статья PMC: PMC544175] [PubMed: 15653828] - 9.
- Tesini BL, Epstein LG, Caserta MT. Клинические последствия первичной инфекции розеоловирусами. Карр Опин Вирол. 2014 дек;9:91-6. [Бесплатная статья PMC: PMC4267952] [PubMed: 25462439]
- 10.
- Hall CB, Long CE, Schnabel KC, Caserta MT, McIntyre KM, Costanzo MA, Knott A, Dewhurst S, Insel RA, Epstein LG. Герпесвирусная инфекция человека-6 у детей. Проспективное исследование осложнений и реактивации.N Engl J Med. 1994 г., 18 августа; 331(7):432-8. [PubMed: 8035839]
- 11.
- Кристофоро Т., Ле Н.К., Рай-Бэкингем С., Хадсон В.Б., Кэрролл Л.Ф. Не очень мягкое пятно: патофизиология выпуклого родничка в связи с розеолой. Педиатр Неотложная помощь. 2020 окт; 36 (10): e576-e578. [PubMed: 29489601]
- 12.
- Agut H, Bonnafous P, Gautheret-Dejean A. Лабораторные и клинические аспекты инфекций, вызванных вирусом герпеса человека 6. Clin Microbiol Rev. 2015 Apr; 28(2):313-35.
 [Бесплатная статья PMC: PMC4402955] [PubMed: 25762531]
[Бесплатная статья PMC: PMC4402955] [PubMed: 25762531] - 13.
- Арнеж М., Авшич-Жупанц Т., Уршич Т., Петровец М. Инфекция герпеса человека 6, представляющая собой острое лихорадочное заболевание, связанное с тромбоцитопенией и лейкопенией. Дело Rep Педиатр. 2016;2016:2483183. [Бесплатная статья PMC: PMC5131235] [PubMed: 27980872]
- 14.
- Яварян Дж., Гаввами Н., Мамиши С. Обнаружение вируса герпеса человека 6 в спинномозговой жидкости детей с возможным энцефалитом. Юндишапур Дж. Микробиолог. 2014 сен;7(9):e11821. [Бесплатная статья PMC: PMC4255374] [PubMed: 25485059]
- 15.
- Причард М.Н., Уитли Р.Дж. Разработка новых методов лечения вируса герпеса человека 6. Curr Opin Virol. 2014 дек.; 9:148-53. [Статья бесплатно PMC: PMC4267975] [PubMed: 25462447]
- 16.
- Shiohara T, Iijima M, Ikezawa Z, Hashimoto K. Диагноз DRESS-синдрома в достаточной степени установлен на основании типичных клинических признаков и реактивации вируса.
 . Бр Дж Дерматол. 2007 г., май; 156(5):1083-4. [PubMed: 17381452]
. Бр Дж Дерматол. 2007 г., май; 156(5):1083-4. [PubMed: 17381452] - 17.
- Маркс Г.Л., Нолан П.Е., Эрлих К.С., Эллис М.Н.Кожно-слизистая диссеминация устойчивого к ацикловиру вируса простого герпеса у больного СПИДом. Преподобный Заражает Дис. 1989 г., май-июнь; 11(3):474-6. [PubMed: 2546244]
- 18.
- Beović B, Pecaric-Meglic N, Marin J, Bedernjak J, Muzlovic I, Cizman M. Смертельный человеческий герпесвирус 6-ассоциированный многоочаговый менингоэнцефалит у взрослой пациентки. Scand J Infect Dis. 2001;33(12):942-4. [PubMed: 11868775]
- 19.
- Йошикава Т., Охаси М., Мияке Ф., Фудзита А., Усуи С., Сугата К., Суга С., Хашимото С., Асано Ю.Exanthem subitum-ассоциированный энцефалит: общенациональное исследование в Японии. Педиатр Нейрол. 2009 ноябрь; 41 (5): 353-8. [PubMed: 19818937]
- 20.
- Al-Zubeidi D, Thangarajh M, Pathak S, Cai C, Schlaggar BL, Storch GA, Grange DK, Watson ME. Смертельный человеческий герпесвирус 6-ассоциированный энцефалит у двух мальчиков с сопутствующими митохондриальными нарушениями POLG.
 Педиатр Нейрол. 2014 г., сен; 51 (3): 448-52. [PubMed: 25160553]
Педиатр Нейрол. 2014 г., сен; 51 (3): 448-52. [PubMed: 25160553] - 21.
- Mason EE, Printen KJ. Метаболические аспекты восстановления тонкой кишки после еюноилеального шунтирования.Хирургический гинекологический акушер. 1976 г., февраль; 142 (2): 177–83. [PubMed: 813311]
- 22.
- де Андраде РП. Многоцентровая клиническая оценка новой монофазной комбинации: Минулет (гестоден и этинилэстрадиол). Инт Дж. Фертил. 1989 Сентябрь; 34 Приложение: 22-30. [PubMed: 2576253]
- 23.
- Ashrafpoor G, Andréoletti L, Bruneval P, Macron L, Azarine A, Lepillier A, Danchin N, Mousseaux E, Redheuil A. Молниеносный миокардит, вызванный вирусом герпеса 6 человека, у иммунокомпетентного взрослого: роль магнитно-резонансная томография сердца в мультидисциплинарном подходе.Тираж. 03 декабря 2013 г .; 128 (23): e445-7. [PubMed: 24297820]
- 24.
- Le J, Gantt S., AST Сообщество специалистов по инфекционным заболеваниям. Вирус герпеса человека 6, 7 и 8 при трансплантации паренхиматозных органов.
 Ам Джей Трансплант. 2013 март; 13 Приложение 4: 128-37. [PubMed: 23465006]
Ам Джей Трансплант. 2013 март; 13 Приложение 4: 128-37. [PubMed: 23465006]
Вирус герпеса типа 6 — StatPearls
Программа непрерывного образования
Известно, что он вызывает более опасную инфекцию у лиц с ослабленным иммунитетом.Члены межпрофессиональной бригады должны признать, что дальнейшая оценка этого состояния оправдана, когда у пациента с ослабленным иммунитетом наблюдаются изменения поведения с сыпью или без нее. Раннее распознавание приведет к ускоренному лечению, улучшению ухода за пациентами и предотвращению неблагоприятных исходов. В этом упражнении рассматривается диагностика, ведение и лечение вируса герпеса человека 6, а также подчеркивается роль межпрофессиональной команды в уходе за больными пациентами.
Цели:
Опишите патофизиологию вируса герпеса человека 6.
Опишите типичную клиническую картину пациента с вирусом герпеса человека 6.
Кратко изложите рекомендации по лечению пациентов, инфицированных вирусом герпеса человека 6.

Объясните важность улучшения координации помощи между межпрофессиональной командой для улучшения оказания помощи пациентам, инфицированным вирусом герпеса человека 6, особенно тем, кто подвержен риску более тяжелой инфекции.
Введение
Вирус герпеса человека 6 (HHV-6) первоначально был обнаружен в лимфоцитах крови взрослых с лимфопролиферативными заболеваниями или СПИДом и был назван В-лимфотропным вирусом человека. Дальнейшие исследования выявили HHV-6 в лимфоцитах CD4+ и в составе вирусов герпеса. Поскольку это был шестой выделенный герпесвирус, впоследствии он был переименован в человеческий герпесвирус 6. Известно, что HHV-6, типичный для вируса герпеса, вызывает острую, непрекращающуюся и постоянную инфекцию.
HHV-6 — собирательное название двухцепочечных ДНК-вирусов HHV-6A и HHV-6B.HHV-6A и HHV-6B официально признаны отдельными вирусами, а не вариантами внутри семейства герпесвирусов. Хотя о HHV-6A известно гораздо меньше, он чаще встречается у хозяина с ослабленным иммунитетом. Напротив, исследования определили, что HHV-6B является этиологическим агентом детской экзантемы (детская розеола) [1]. Приобретение HHV-6B довольно часто встречается у молодых людей и часто наблюдается в отделениях неотложной помощи по всему миру. HHV-6B является вездесущим вирусом, которым более 90% населения инфицировано в течение первых 3 лет жизни.
Хотя о HHV-6A известно гораздо меньше, он чаще встречается у хозяина с ослабленным иммунитетом. Напротив, исследования определили, что HHV-6B является этиологическим агентом детской экзантемы (детская розеола) [1]. Приобретение HHV-6B довольно часто встречается у молодых людей и часто наблюдается в отделениях неотложной помощи по всему миру. HHV-6B является вездесущим вирусом, которым более 90% населения инфицировано в течение первых 3 лет жизни.
Этиология
HHV-6A, HHV-6B и HHV-7 имеют определенный уровень гомологии с цитомегаловирусом человека (CMV), единственным другим бета-герпесвирусом человека.[1] И HHV-6A, и HHV-6B реплицируются в Т-клетках. Однако они различаются по рецепторам, используемым для входа в клетку. В отличие от человеческой кластерной дифференцировки 46 (CD46), используемой вирусом HHV-6A, исследования показывают, что кластерная дифференцировка 134 (CD134) является первичным рецептором для HHV-6B.[2] CD134 экспрессируется только на активированных Т-клетках. [3] Подобно HHV-8, также известному как вирус герпеса, ассоциированный с саркомой Капоши (KSHV), и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус является онкогенным и разрушительным для аутоиммунных клеток.После связывания с соответствующим рецептором HHV-6 устанавливает латентное состояние в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
[3] Подобно HHV-8, также известному как вирус герпеса, ассоциированный с саркомой Капоши (KSHV), и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус является онкогенным и разрушительным для аутоиммунных клеток.После связывания с соответствующим рецептором HHV-6 устанавливает латентное состояние в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
Во взрослом возрасте более 95% населения являются серопозитивными в отношении HHV-6A, HHV-6B или обоих вариантов. Существующие серологические методы неэффективны для выделения одного варианта от другого [4]. В настоящее время хорошо известно, что HHV-6 является основной причиной детской розеолы. HHV-6B в первую очередь поражает младенцев и является основной причиной реактивации вируса как у иммунокомпетентных, так и у иммунокомпрометированных хозяев.[1] В общей популяции подавляющее большинство взрослых с хроническим ВГЧ-6 остаются бессимптомными. Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией ВГЧ-6 имели ДНК вируса в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги.[5] Напротив, другие исследователи определили распространенность ДНК HHV-6 в спинномозговой жидкости детей с фебрильными судорогами и пациентов со СПИДом с неврологическими симптомами только от 0% до 4%.[5] Эти вирусы связаны с заболеваниями у пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований.[4] Кроме того, успешные исследования выявили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом.[6]
Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией ВГЧ-6 имели ДНК вируса в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги.[5] Напротив, другие исследователи определили распространенность ДНК HHV-6 в спинномозговой жидкости детей с фебрильными судорогами и пациентов со СПИДом с неврологическими симптомами только от 0% до 4%.[5] Эти вирусы связаны с заболеваниями у пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований.[4] Кроме того, успешные исследования выявили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом.[6]
Эпидемиология
Исследователи идентифицировали HHV-6B как этиологический патоген, ответственный за большинство инфекций HHV-6, проявляющихся симптомами.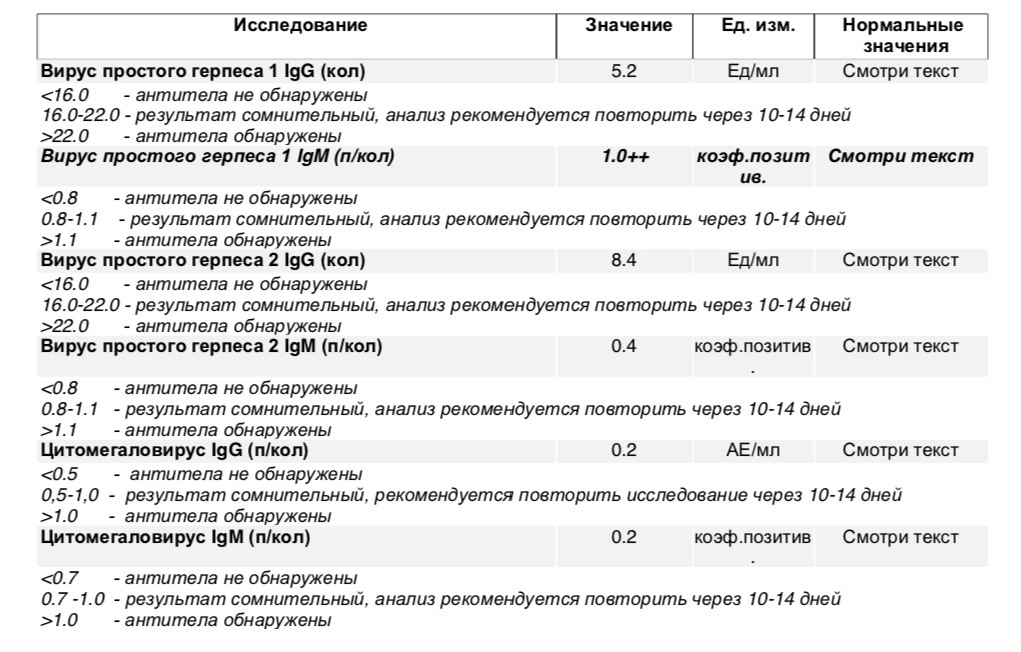 Хотя исследования подтверждают, что большинство людей были инфицированы ВГЧ-6 в какой-то момент своей жизни, первичное заражение ВГЧ-6 происходит в течение первых 2 лет. В этой возрастной группе это обычно связано с недифференцированным лихорадочным заболеванием, хотя у части детей будут проявляться классические проявления детской розеолы. В нескольких отчетах об исследованиях зафиксировано снижение серопозитивности с увеличением возраста [4]. Хотя первичная инфекция ВГЧ-6 у взрослых встречается редко, реактивация может произойти в любом возрасте.Инфекция HHV-6 не имеет склонности к половой жизни и может встречаться у людей всех рас.
Хотя исследования подтверждают, что большинство людей были инфицированы ВГЧ-6 в какой-то момент своей жизни, первичное заражение ВГЧ-6 происходит в течение первых 2 лет. В этой возрастной группе это обычно связано с недифференцированным лихорадочным заболеванием, хотя у части детей будут проявляться классические проявления детской розеолы. В нескольких отчетах об исследованиях зафиксировано снижение серопозитивности с увеличением возраста [4]. Хотя первичная инфекция ВГЧ-6 у взрослых встречается редко, реактивация может произойти в любом возрасте.Инфекция HHV-6 не имеет склонности к половой жизни и может встречаться у людей всех рас.
HHV-6 — это повсеместно распространенный вирус, встречающийся во всем мире. В крупном проспективном исследовании североамериканских детей пиковый возраст заражения HHV-6 приходился на возраст от 6 до 9 месяцев.[1] Как и в Соединенных Штатах, в Великобритании и Японии от 97 до 100 % первичных инфекций связаны с HHV-6B. Хотя эпидемиологические отчеты о HHV-6A ограничены, исследования показывают, что инфекция HHV-6A приобретается в более позднем возрасте и что первичная инфекция этим конкретным вариантом часто протекает бессимптомно. [7] Тем не менее, несколько групп зарегистрировали HHV-6A у детей с симптомами из Африки и США. Кроме того, HHV-6A был идентифицирован как преобладающая форма вируса, выделенного у ВИЧ-позитивных младенцев в эндемичном регионе Африки к югу от Сахары.[7] Среди разных популяций серопревалентность резко различается. Задокументировано 20 % серопревалентности среди беременных марокканских женщин и 100 % среди бессимптомных взрослых китайцев. Серопревалентность колебалась примерно от 39 до 80% среди этнически разнообразного взрослого населения Танзании, Малайзии, Таиланда и Бразилии.[4]
[7] Тем не менее, несколько групп зарегистрировали HHV-6A у детей с симптомами из Африки и США. Кроме того, HHV-6A был идентифицирован как преобладающая форма вируса, выделенного у ВИЧ-позитивных младенцев в эндемичном регионе Африки к югу от Сахары.[7] Среди разных популяций серопревалентность резко различается. Задокументировано 20 % серопревалентности среди беременных марокканских женщин и 100 % среди бессимптомных взрослых китайцев. Серопревалентность колебалась примерно от 39 до 80% среди этнически разнообразного взрослого населения Танзании, Малайзии, Таиланда и Бразилии.[4]
Патофизиология
В целом, первичная инфекция HHV-6 является одной из наиболее распространенных причин острых лихорадочных заболеваний у детей раннего возраста. Это также является важной причиной обращений в отделение неотложной помощи, госпитализаций и фебрильных судорог [1]. HHV-6 принадлежит к подсемейству Betaherpesvirinae и роду Roseolovirus . Частица вириона имеет характерную структуру герпесвируса с центральным ядром, содержащим вирусную ДНК, капсидом и богатым белком покровным слоем, окруженным мембраной.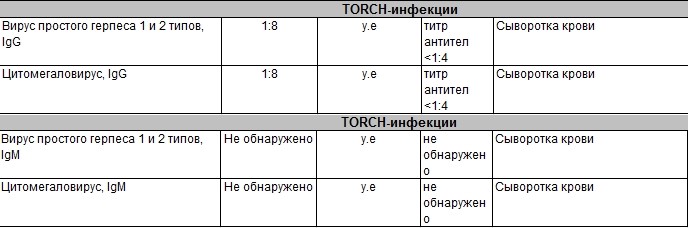
Основной клеткой-мишенью для HHV-6 является зрелая Т-клетка CD4+.[1] Вирус продемонстрировал плейотропное действие на иммунную систему, включая модуляцию функции естественных клеток-киллеров. In vivo HHV-6 в первую очередь инфицирует и реплицируется в лимфоцитах CD4 после прикрепления к клеточному рецептору CD46. Через опосредованный рецептором эндоцитоз HHV-6 проникает в клетки с последующей репликацией вируса (Ablashi). После первичного заражения ДНК вируса живет в мононуклеарных клетках периферической крови (МКПК).[1]
В то время как точный механизм передачи HHV-6 все еще находится в стадии изучения, несколько исследований выявили передачу вируса через слюну. По-видимому, наиболее распространенным путем является передача через слюну от матери к ребенку. В нескольких ранних отчетах описывалось, что инфекционный ВГЧ-6 присутствует в слюне почти каждого человека, прошедшего тестирование.[4] Кроме того, образцы слюны 90% обследованных лиц содержали ДНК ВГЧ-6, в то время как в другом исследовании, основанном на ПЦР, только 3% людей были положительными, хотя 63% образцов биопсии слюнных желез были положительными. [4] Геном HHV-6 также был обнаружен в спинномозговой жидкости детей во время первичных и латентных инфекций, а также в мозговом веществе нормальных взрослых при вскрытии, что позволяет предположить, что как ЦНС, так и слюнные железы являются резервуаром вирусной латентности и персистирующей инфекции. .[1][4]
[4] Геном HHV-6 также был обнаружен в спинномозговой жидкости детей во время первичных и латентных инфекций, а также в мозговом веществе нормальных взрослых при вскрытии, что позволяет предположить, что как ЦНС, так и слюнные железы являются резервуаром вирусной латентности и персистирующей инфекции. .[1][4]
Анамнез и медицинский осмотр
Хотя различные клинические проявления и заболевания, связанные с ВГЧ-6, все еще находятся в стадии изучения, исследования уже подтверждают, что ВГЧ-6 играет важную роль в заболеваниях центральной нервной системы и у лиц с ослабленным иммунитетом, включая реципиентов трансплантатов.[8] Инфекция ВГЧ-6 обычно протекает доброкачественно и проходит самостоятельно. Лица с симптомами, как правило, младенцы или взрослые с ослабленным иммунитетом, у которых наблюдается реактивация болезни.
ВГЧ-6В является возбудителем экзантемы субитум (также известной как детская розеола), детского заболевания, характеризующегося высокой температурой и легкой кожной сыпью, на долю которого приходится от 10 до 17% обращений детей в отделение неотложной помощи с острой лихорадкой до 36 месяцев. [9] На первичную инфекцию ВГЧ-6 приходится более 36% всех случаев острой лихорадки у детей в возрасте от 12 до 15 месяцев, и почти исключительно она вызывается ВГЧ-6В, а не ВГЧ-6А.[9][8][10]
[9] На первичную инфекцию ВГЧ-6 приходится более 36% всех случаев острой лихорадки у детей в возрасте от 12 до 15 месяцев, и почти исключительно она вызывается ВГЧ-6В, а не ВГЧ-6А.[9][8][10]
Диагноз детской розеолы устанавливается клинически. Это часто провоцируется внезапным началом высокой лихорадки с температурой, достигающей 40 ° C (104 F) в течение трех-пяти дней. Во время начальной лихорадочной фазы у некоторых детей наблюдается периорбитальный отек, конъюнктивит или воспаление барабанной перепонки, в то время как многие другие будут активны и здоровы.[9] Другие симптомы у детей включают лимфаденопатию, желудочно-кишечные (ЖКТ) симптомы, включая дисфункцию печени и гепатит, а также выбухание родничков.[11] У взрослых часто встречаются гепатит и симптомы, характерные для энцефалита.[9] У реципиентов трансплантата симптомы часто включают лихорадку, реакцию «трансплантат против хозяина» (РТПХ), симптомы отторжения трансплантата, интерстициальный пневмонит, миелит и сыпь.[12]
Результаты физикального обследования обычно соответствуют ранее описанным симптомам.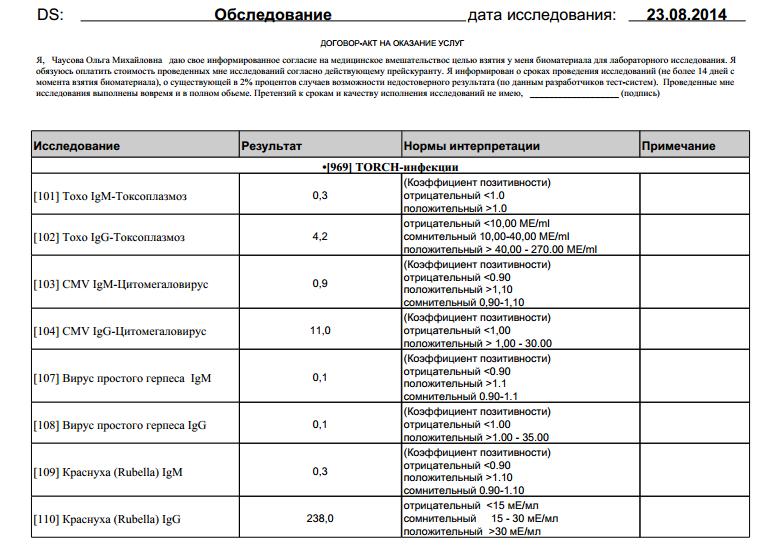 У детей при снижении лихорадки часто наблюдается побледнение макуло-папулезной сыпи розово-розового цвета размером примерно 2–5 мм с ореолом вокруг.Сыпь обычно сохраняется в течение одного-двух дней и часто распространяется центробежно. Однако есть задокументированные случаи лихорадки без сыпи.[13] Воспаление барабанной перепонки и признаки инфекции верхних или нижних дыхательных путей часто встречаются у детей, в то время как у взрослых при физикальном обследовании может быть лихорадка, гепатоспленомегалия и лимфаденопатия.[12]
У детей при снижении лихорадки часто наблюдается побледнение макуло-папулезной сыпи розово-розового цвета размером примерно 2–5 мм с ореолом вокруг.Сыпь обычно сохраняется в течение одного-двух дней и часто распространяется центробежно. Однако есть задокументированные случаи лихорадки без сыпи.[13] Воспаление барабанной перепонки и признаки инфекции верхних или нижних дыхательных путей часто встречаются у детей, в то время как у взрослых при физикальном обследовании может быть лихорадка, гепатоспленомегалия и лимфаденопатия.[12]
Оценка
Вирус герпеса человека 6 (HHV-6) можно диагностировать с помощью полимеразной цепной реакции (ПЦР), серологии или вирусных культур, причем ПЦР является преобладающим методом.[12] Однако маловероятно, что лабораторные исследования будут проведены у иммунокомпетентных лиц из-за самокупирующегося характера заболевания. Слюна является основным резервуаром для передачи вируса, так как он часто выделяется в слюнных железах. Хотя сообщений о передаче вируса при переливании крови и грудном вскармливании не поступало, были зарегистрированы случаи ВГЧ-6 после трансплантации органов. [12] Большинство исследователей твердо убеждены в том, что заражение ВГЧ-6В происходит в раннем возрасте, тогда как заражение ВГЧ-6А развивается позже.Оба варианта вируса были одновременно обнаружены у взрослых, что позволяет предположить, что вирусы хронически поражают многих людей.
[12] Большинство исследователей твердо убеждены в том, что заражение ВГЧ-6В происходит в раннем возрасте, тогда как заражение ВГЧ-6А развивается позже.Оба варианта вируса были одновременно обнаружены у взрослых, что позволяет предположить, что вирусы хронически поражают многих людей.
Лабораторные исследования при ВГЧ-6 могут выявить лейкоцитоз, лейкопению и анемию.[13] У пациентов с трансплантацией почки и пациентов с дисфункцией печени следует провести исследования почек и печени соответственно, чтобы исключить нарушение электролитного баланса и гепатит.
Показания к рентгенологической визуализации зависят от клинической картины, особенно у лиц с ослабленным иммунитетом.Рентгенография грудной клетки может быть выполнена для исключения другой этиологии у взрослых, включая пневмонию и пневмонит. У детей потребность в визуализации возникает реже. Компьютерная томография (КТ) головы с контрастом или без него может быть получена для поиска других излечимых заболеваний. При поражении центральной нервной системы может быть выполнена люмбальная пункция.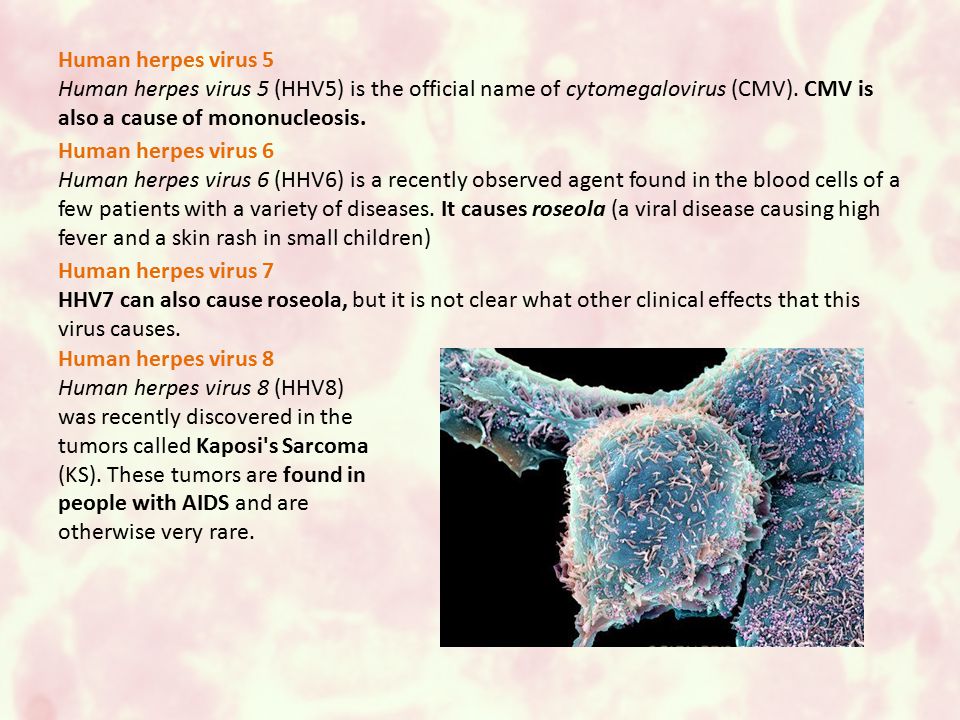 Инфекция HHV-6 в ЦНС часто имеет умеренный плеоцитоз с повышенным содержанием белка. СМЖ может быть отправлена на ПЦР-исследование HHV-6 для подтверждения диагноза.[14]
Инфекция HHV-6 в ЦНС часто имеет умеренный плеоцитоз с повышенным содержанием белка. СМЖ может быть отправлена на ПЦР-исследование HHV-6 для подтверждения диагноза.[14]
Лечение/управление
В настоящее время не существует утвержденного соединения, предназначенного исключительно для лечения ВГЧ-6, и нет доступной вакцины.[8] Обычно не рекомендуется проводить противовирусную профилактику инфекции HHV-6. Вместо этого рекомендуется проводить раннее противовирусное лечение, особенно в случаях энцефалита HHV-6. Рекомендуется терапия первой линии с внутривенным введением ганцикловира и фоскарнета с лечением в течение 3–4 недель.[15] У пациентов, перенесших трансплантацию стволовых клеток, лечение ганцикловиром имеет задокументированные преимущества и является рекомендуемым противовирусным препаратом выбора.[15]
Инфекции ВГЧ-6 у иммунокомпетентных детей проходят самостоятельно и не требуют лечения. Лечение младенцев с детской розеолой обычно поддерживающее.[12] Жаропонижающие, такие как ацетаминофен или ибупрофен, рекомендуются для лечения сильной лихорадки и лиц с риском фебрильных судорог. Если возникают фебрильные судороги, противоэпилептические средства не нужны. Лица с инфекцией HHV-6, проявляющейся поражением ЦНС, включая фебрильные судороги, должны быть госпитализированы.
Если возникают фебрильные судороги, противоэпилептические средства не нужны. Лица с инфекцией HHV-6, проявляющейся поражением ЦНС, включая фебрильные судороги, должны быть госпитализированы.
Дифференциальный диагноз
Дифференциальный диагноз входит:
инфекционный мононуклеоз
Вирусный гепатит
герпес симплекс вирус-инфекция
Meningitis
RUBLELLA
Вирусная пневмония
Лекарственная сыпь с эозинофилией и системными симптомами (DRESS-синдром)
У детей с классической детской розеолой этиологическим возбудителем является ВГЧ-6.Однако некоторые другие заболевания могут вызывать лихорадку и сыпь. Более тяжелые, менее доброкачественные причины таких симптомов требуют исключения. У иммунокомпетентных взрослых инфекция HHV-6 проявляется аналогично мононуклеозу. Таким образом, ВЭБ и ЦМВ следует исключить.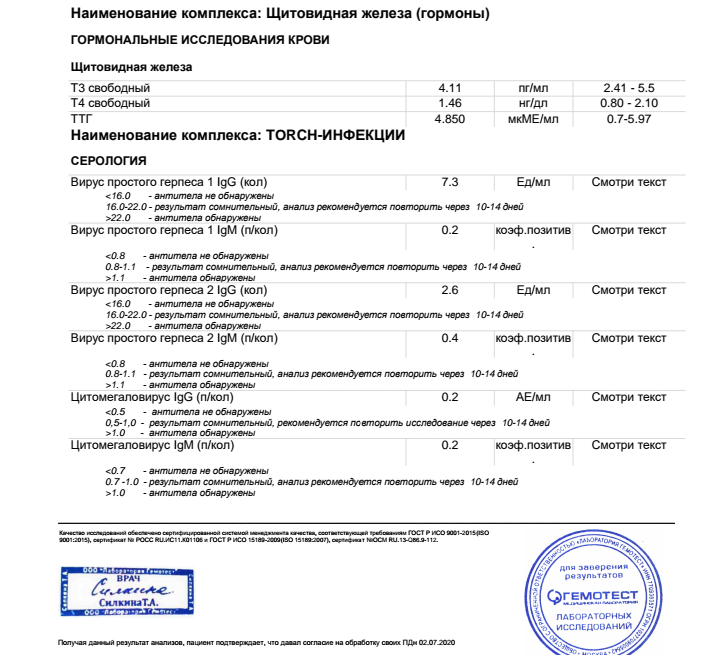 Пациенты с ослабленным иммунитетом, особенно те, кому пересаживают органы, и больные СПИДом, как правило, имеют симптомы. Эта когорта лиц с заболеванием ВГЧ-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и DRESS-синдром.[16] Кроме того, существует документация о HHV-6 в случаях рассеянного склероза, энцефалита и интерстициального пневмонита.[17] Стоит отметить, что только HHV-6A связан с тиреоидитом Хашимото.[12]
Пациенты с ослабленным иммунитетом, особенно те, кому пересаживают органы, и больные СПИДом, как правило, имеют симптомы. Эта когорта лиц с заболеванием ВГЧ-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и DRESS-синдром.[16] Кроме того, существует документация о HHV-6 в случаях рассеянного склероза, энцефалита и интерстициального пневмонита.[17] Стоит отметить, что только HHV-6A связан с тиреоидитом Хашимото.[12]
Прогноз
Как правило, первичная инфекция HHV-6 проходит самостоятельно, и иммунокомпетентные люди выживают без осложнений.У людей с ослабленным иммунитетом в отчетах описано более тяжелое заболевание. Имеются документальные данные о пневмоните, гепатите и отторжении органов у пациентов с трансплантацией, а также о смерти пациентов с энцефалитом и менингоэнцефалитом.[18] Точно так же в Японии с 2003 по 2004 год обследование пациентов с энцефалитом, связанным с субитумной экзантемой, показало необычно плохой прогноз [19] с зарегистрированными смертельными исходами у двух детей с энцефалопатией, вторичной по отношению к инфекции HHV-6. У детей было обнаружено генетическое митохондриальное заболевание.[20]
У детей было обнаружено генетическое митохондриальное заболевание.[20]
Осложнения
Обычно первичная инфекция ВГЧ-6 протекает доброкачественно со спонтанным исчезновением через 5–7 дней. Наиболее частым осложнением детской розеолы являются фебрильные судороги. Дополнительные осложнения часто возникают из-за нейротрофических эффектов HHV-6, что особенно заметно в случаях поражения центральной нервной системы, например, в случаях менингоэнцефалита и энцефалопатии. В этих случаях вирус проникает в мозг во время первичной инфекции и может оставаться в спящем состоянии в тканях мозга.[21] Впоследствии появились записи о случаях острого или подострого энцефалита, иногда связанных с диффузной или многоочаговой демиелинизацией.[4] HHV-6 редко вызывает оппортунистическую инфекцию у лиц с ослабленным иммунитетом. Активность HHV-6A и HHV-6B была обнаружена после трансплантации почек, печени и костного мозга (BMT) [4].
Сдерживание и просвещение пациентов
У в остальном здорового младенца с детской розеолой обучение родителей имеет решающее значение для снижения беспокойства по поводу лихорадки и возможных фебрильных судорог. Важность поддерживающей терапии жаропонижающими средствами и бесполезность антибиотиков требуют объяснения. У лиц с ослабленным иммунитетом сложные симптомы и другие вторичные вирусные заболевания, которые могут сопровождать инфекцию HHV-6, являются поводом для консультирования с упором на раннее обращение за медицинской помощью при появлении симптомов.
Важность поддерживающей терапии жаропонижающими средствами и бесполезность антибиотиков требуют объяснения. У лиц с ослабленным иммунитетом сложные симптомы и другие вторичные вирусные заболевания, которые могут сопровождать инфекцию HHV-6, являются поводом для консультирования с упором на раннее обращение за медицинской помощью при появлении симптомов.
Pearls and Other Issues
Общепризнано, что HHV-6B является причинным вариантом, ответственным за большинство первичных инфекций, в то время как HHV-6A приобретается после HHV-6B в результате бессимптомной инфекции.[22]1. Отличие случаев первичной инфекции HHV-6 с типичной сыпью детской розеолы от других заболеваний является ключом к исключению более тяжелых диагнозов. Наиболее частым осложнением инфекции ВГЧ-6 является детская розеола, и на ВГЧ-6 приходится примерно 10–20 % лихорадочных заболеваний у детей в возрасте от 6 месяцев до 3 лет. Фебрильные судороги, симптомы со стороны желудочно-кишечного тракта и дыхательных путей встречаются реже и обычно проходят самостоятельно.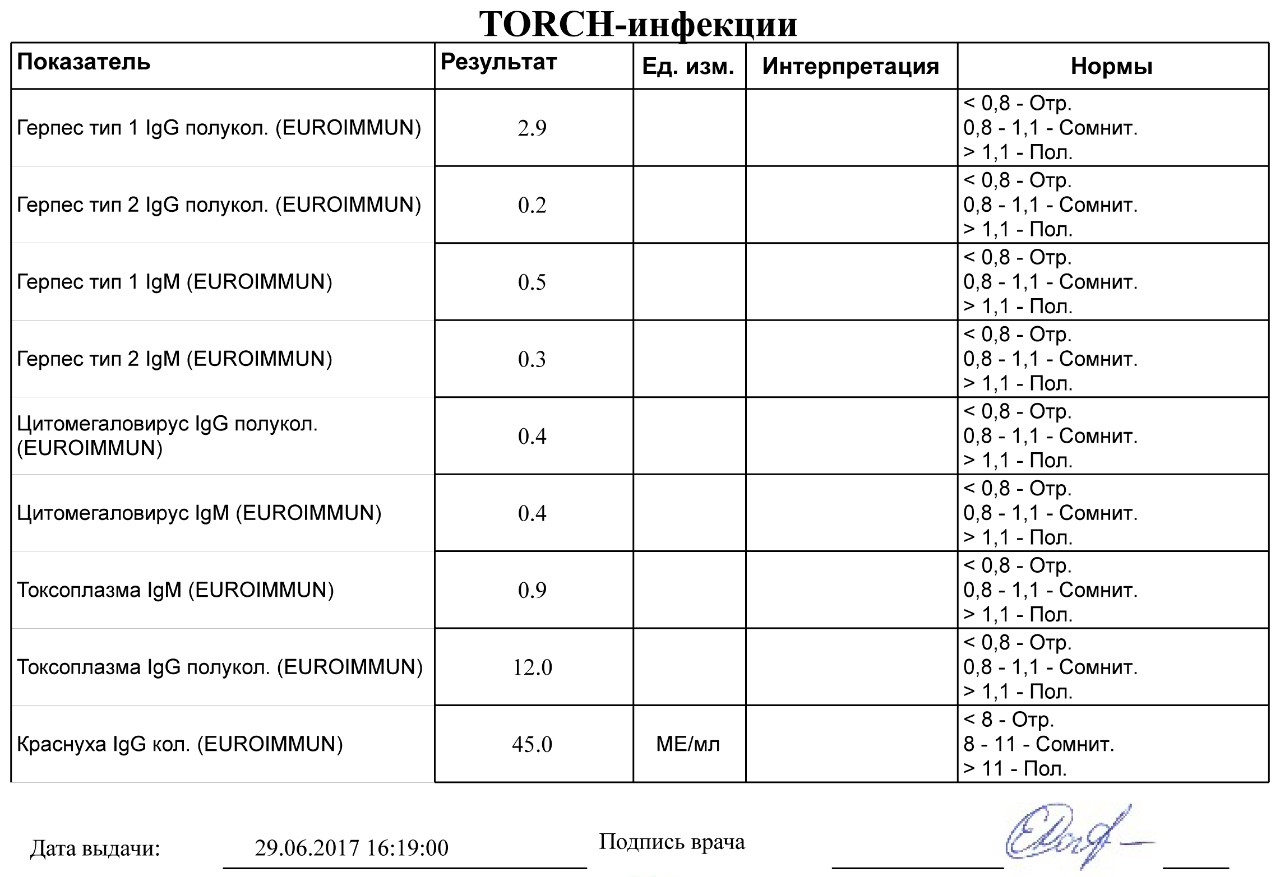 Поддерживающая терапия с отдыхом и гидратацией является общепринятым подходом к лечению в этой подгруппе.Подобно другим вирусам герпеса, HHV-6 реплицируется в слюнных железах и находится в латентном состоянии в мононуклеарных клетках периферической крови. Диагностика ВГЧ-6 с помощью лабораторных исследований у иммунокомпетентного хозяина обычно не требуется. Тем не менее, ПЦР, серологические исследования или посев вируса часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Поддерживающая терапия с отдыхом и гидратацией является общепринятым подходом к лечению в этой подгруппе.Подобно другим вирусам герпеса, HHV-6 реплицируется в слюнных железах и находится в латентном состоянии в мононуклеарных клетках периферической крови. Диагностика ВГЧ-6 с помощью лабораторных исследований у иммунокомпетентного хозяина обычно не требуется. Тем не менее, ПЦР, серологические исследования или посев вируса часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Инфекция HHV-6 коррелирует с более тяжелыми заболеваниями, включая мононуклеоз, колит, миокардит и гепатит, в дополнение к документально подтвержденным осложнениям центральной нервной системы в виде энцефалита и менингоэнцефалита.Раннее распознавание и лечение неврологических осложнений являются неотъемлемой частью предотвращения неблагоприятных исходов. Дети и взрослые, больные раком, реципиенты аллогенных трансплантатов и лица с иммуносупрессивными расстройствами, подвержены риску реактивации ВГЧ-6. В таких случаях у людей может наблюдаться лихорадка, сыпь и снижение количества циркулирующих гранулоцитов и эритроидных клеток.[12] Хотя не существует утвержденных методов лечения исключительно инфекции HHV-6, противовирусное лечение ганцикловиром и/или фоскарнетом оказалось успешным в лечении неврологических осложнений, описанных ранее.
В таких случаях у людей может наблюдаться лихорадка, сыпь и снижение количества циркулирующих гранулоцитов и эритроидных клеток.[12] Хотя не существует утвержденных методов лечения исключительно инфекции HHV-6, противовирусное лечение ганцикловиром и/или фоскарнетом оказалось успешным в лечении неврологических осложнений, описанных ранее.
Улучшение результатов работы бригады здравоохранения
HHV-6 обычно проявляется сыпью как у детей, обращающихся в отделение неотложной помощи, так и у педиатров. Хотя определение сыпи может быть сложной задачей, выделение конкретных сопутствующих симптомов необходимо, чтобы различать более токсичные и доброкачественные заболевания. Большинство инфекций HHV-6 протекают бессимптомно, преходящи и не требуют противовирусного лечения. [Уровень II] Консультация педиатра является рекомендацией для младенцев с детской розеолой, у которых есть фебрильные судороги.Известны осложнения HHV-6, и людям с более зловещими признаками и симптомами, включая изменения психического статуса и недостаточность органов, может помочь межпрофессиональный подход.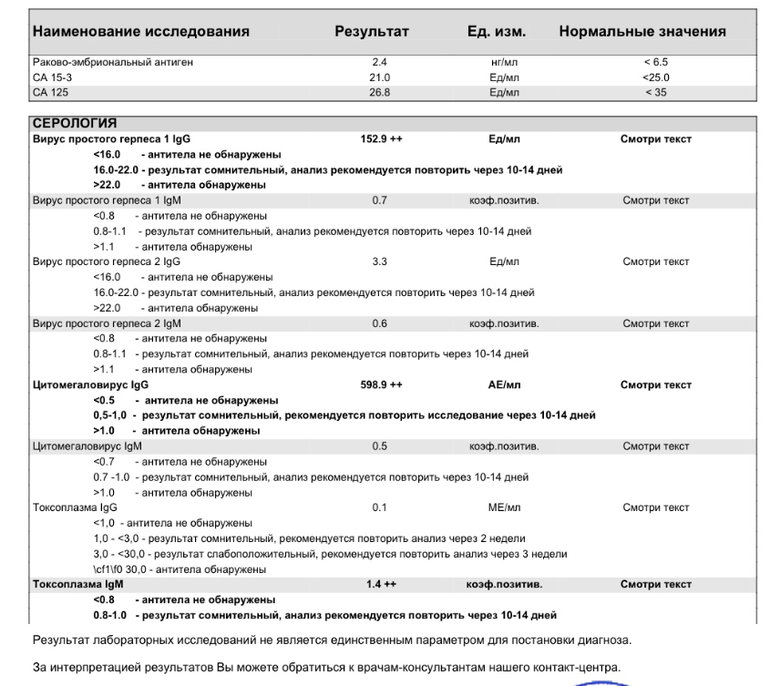 В таких случаях необходима консультация невролога и врача-инфекциониста. При подозрении на сердечную недостаточность, связанную с HHV-6, ранняя консультация кардиолога имеет решающее значение для лечения инфекционного миокардита у иммунокомпетентных взрослых пациентов.[23] [Уровень IV]
В таких случаях необходима консультация невролога и врача-инфекциониста. При подозрении на сердечную недостаточность, связанную с HHV-6, ранняя консультация кардиолога имеет решающее значение для лечения инфекционного миокардита у иммунокомпетентных взрослых пациентов.[23] [Уровень IV]
Скоординированный уход со стороны квалифицированных медсестер целесообразен для наблюдения за ухудшением состояния и изменениями показателей жизнедеятельности.Точно так же не следует сбрасывать со счетов лабораторную помощь в ускорении предпочтительных методов обнаружения вируса в крови или спинномозговой жидкости с помощью ПЦР или вирусного антигена в ткани с помощью иммуногистохимии. (Уровень II). Наконец, фармацевт является неотъемлемой частью обеспечения противовирусного лечения ганцикловиром и фоскарнетом при энцефалите, связанном с HHV-6.[24] [Уровень III] Для улучшения исходов в сложных случаях и обеспечения наилучших результатов рекомендуется совместный, ориентированный на пациента, межпрофессиональный командный подход между клиницистами, включая врачей, лабораторию, специально обученных медсестер и фармацевтов, открыто общающихся как команда здравоохранения. исходы пациента.[Уровень 5]
исходы пациента.[Уровень 5]
Рисунок
Это гистологический препарат вируса герпеса человека-6 (HHV-6), ранее известного как HBLV, типа вируса герпеса, открытого в октябре 1986 года. Это микрофотография зараженного клетки с тельцами включения как в ядре, так и в цитоплазме. (подробнее…)
Ссылки
- 1.
- Caserta MT, Mock DJ, Dewhurst S. Herpesvirus человека 6. Clin Infect Dis. 2001 г., 15 сентября; 33 (6): 829-33. [PubMed: 11512088]
- 2.
- Кладовая С.Н., Медвецкий П.Г. Латентность, интеграция и реактивация вируса герпеса человека-6. Вирусы. 24 июля 2017 г.; 9(7) [бесплатная статья PMC: PMC5537686] [PubMed: 28737715]
- 3.
- Элиассен Э., Лум Э., Притчетт Дж., Онгради Дж., Крюгер Г., Кроуфорд Дж. Р., Фан Т. Л., Аблаши Д., Хадналл С.Д. Вирус герпеса человека 6 и злокачественные новообразования: обзор. Фронт Онкол. 2018;8:512. [Бесплатная статья PMC: PMC6277865] [PubMed: 30542640]
- 4.
- Braun DK, Dominguez G, Pellett PE.
 Герпесвирус человека 6.Clin Microbiol Rev. 1997 Jul; 10(3):521-67. [Статья PMC бесплатно: PMC172933] [PubMed: 9227865]
Герпесвирус человека 6.Clin Microbiol Rev. 1997 Jul; 10(3):521-67. [Статья PMC бесплатно: PMC172933] [PubMed: 9227865] - 5.
- Ансари А., Ли С., Абзуг М.Дж., Вайнберг А. Вирусы герпеса человека 6 и 7 и инфекция центральной нервной системы у детей. Эмердж Инфекция Дис. 2004 авг.; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247]
- 6.
- Agut H, Bonnafous P, Gautheret-Dejean A. Обновленная информация об инфекциях вирусами герпеса человека 6A, 6B и 7. Med Mal Infect. 2017 март; 47(2):83-91. [PubMed: 27773488]
- 7.
- Аблаши Д., Агут Х., Альварес-Лафуэнте Р., Кларк Д.А., Дьюхерст С., ДиЛука Д., Фламанд Л., Френкель Н., Галло Р., Гомпелс Ю.А., Хёльсберг П., Якобсон С., Луппи М., Луссо П., Мальнати М., Медвецкий P, Mori Y, Pellett PE, Pritchett JC, Yamanishi K, Yoshikawa T. Классификация HHV-6A и HHV-6B как отдельных вирусов. Арх Вирол. 2014 май; 159(5):863-70. [Бесплатная статья PMC: PMC4750402] [PubMed: 24193951]
- 8.

- De Bolle L, Naesens L, De Clercq E. Обновленная информация о биологии вируса герпеса человека 6, клинических особенностях и терапии.Clin Microbiol Rev. 2005 Jan; 18(1):217-45. [Бесплатная статья PMC: PMC544175] [PubMed: 15653828]
- 9.
- Tesini BL, Epstein LG, Caserta MT. Клинические последствия первичной инфекции розеоловирусами. Карр Опин Вирол. 2014 дек;9:91-6. [Бесплатная статья PMC: PMC4267952] [PubMed: 25462439]
- 10.
- Hall CB, Long CE, Schnabel KC, Caserta MT, McIntyre KM, Costanzo MA, Knott A, Dewhurst S, Insel RA, Epstein LG. Герпесвирусная инфекция человека-6 у детей. Проспективное исследование осложнений и реактивации.N Engl J Med. 1994 г., 18 августа; 331(7):432-8. [PubMed: 8035839]
- 11.
- Кристофоро Т., Ле Н.К., Рай-Бэкингем С., Хадсон В.Б., Кэрролл Л.Ф. Не очень мягкое пятно: патофизиология выпуклого родничка в связи с розеолой. Педиатр Неотложная помощь. 2020 окт; 36 (10): e576-e578. [PubMed: 29489601]
- 12.

- Agut H, Bonnafous P, Gautheret-Dejean A. Лабораторные и клинические аспекты инфекций, вызванных вирусом герпеса человека 6. Clin Microbiol Rev. 2015 Apr; 28(2):313-35. [Бесплатная статья PMC: PMC4402955] [PubMed: 25762531]
- 13.
- Арнеж М., Авшич-Жупанц Т., Уршич Т., Петровец М. Инфекция герпеса человека 6, представляющая собой острое лихорадочное заболевание, связанное с тромбоцитопенией и лейкопенией. Дело Rep Педиатр. 2016;2016:2483183. [Бесплатная статья PMC: PMC5131235] [PubMed: 27980872]
- 14.
- Яварян Дж., Гаввами Н., Мамиши С. Обнаружение вируса герпеса человека 6 в спинномозговой жидкости детей с возможным энцефалитом. Юндишапур Дж. Микробиолог. 2014 сен;7(9):e11821. [Бесплатная статья PMC: PMC4255374] [PubMed: 25485059]
- 15.
- Причард М.Н., Уитли Р.Дж. Разработка новых методов лечения вируса герпеса человека 6. Curr Opin Virol. 2014 дек.; 9:148-53. [Статья бесплатно PMC: PMC4267975] [PubMed: 25462447]
- 16.

- Shiohara T, Iijima M, Ikezawa Z, Hashimoto K. Диагноз DRESS-синдрома в достаточной степени установлен на основании типичных клинических признаков и реактивации вируса. . Бр Дж Дерматол. 2007 г., май; 156(5):1083-4. [PubMed: 17381452]
- 17.
- Маркс Г.Л., Нолан П.Е., Эрлих К.С., Эллис М.Н.Кожно-слизистая диссеминация устойчивого к ацикловиру вируса простого герпеса у больного СПИДом. Преподобный Заражает Дис. 1989 г., май-июнь; 11(3):474-6. [PubMed: 2546244]
- 18.
- Beović B, Pecaric-Meglic N, Marin J, Bedernjak J, Muzlovic I, Cizman M. Смертельный человеческий герпесвирус 6-ассоциированный многоочаговый менингоэнцефалит у взрослой пациентки. Scand J Infect Dis. 2001;33(12):942-4. [PubMed: 11868775]
- 19.
- Йошикава Т., Охаси М., Мияке Ф., Фудзита А., Усуи С., Сугата К., Суга С., Хашимото С., Асано Ю.Exanthem subitum-ассоциированный энцефалит: общенациональное исследование в Японии. Педиатр Нейрол. 2009 ноябрь; 41 (5): 353-8.
 [PubMed: 19818937]
[PubMed: 19818937] - 20.
- Al-Zubeidi D, Thangarajh M, Pathak S, Cai C, Schlaggar BL, Storch GA, Grange DK, Watson ME. Смертельный человеческий герпесвирус 6-ассоциированный энцефалит у двух мальчиков с сопутствующими митохондриальными нарушениями POLG. Педиатр Нейрол. 2014 г., сен; 51 (3): 448-52. [PubMed: 25160553]
- 21.
- Mason EE, Printen KJ. Метаболические аспекты восстановления тонкой кишки после еюноилеального шунтирования.Хирургический гинекологический акушер. 1976 г., февраль; 142 (2): 177–83. [PubMed: 813311]
- 22.
- де Андраде РП. Многоцентровая клиническая оценка новой монофазной комбинации: Минулет (гестоден и этинилэстрадиол). Инт Дж. Фертил. 1989 Сентябрь; 34 Приложение: 22-30. [PubMed: 2576253]
- 23.
- Ashrafpoor G, Andréoletti L, Bruneval P, Macron L, Azarine A, Lepillier A, Danchin N, Mousseaux E, Redheuil A. Молниеносный миокардит, вызванный вирусом герпеса 6 человека, у иммунокомпетентного взрослого: роль магнитно-резонансная томография сердца в мультидисциплинарном подходе.
 Тираж. 03 декабря 2013 г .; 128 (23): e445-7. [PubMed: 24297820]
Тираж. 03 декабря 2013 г .; 128 (23): e445-7. [PubMed: 24297820] - 24.
- Le J, Gantt S., AST Сообщество специалистов по инфекционным заболеваниям. Вирус герпеса человека 6, 7 и 8 при трансплантации паренхиматозных органов. Ам Джей Трансплант. 2013 март; 13 Приложение 4: 128-37. [PubMed: 23465006]
Вирус герпеса типа 6 — StatPearls
Программа непрерывного образования
Известно, что он вызывает более опасную инфекцию у лиц с ослабленным иммунитетом.Члены межпрофессиональной бригады должны признать, что дальнейшая оценка этого состояния оправдана, когда у пациента с ослабленным иммунитетом наблюдаются изменения поведения с сыпью или без нее. Раннее распознавание приведет к ускоренному лечению, улучшению ухода за пациентами и предотвращению неблагоприятных исходов. В этом упражнении рассматривается диагностика, ведение и лечение вируса герпеса человека 6, а также подчеркивается роль межпрофессиональной команды в уходе за больными пациентами.
Цели:
Опишите патофизиологию вируса герпеса человека 6.
Опишите типичную клиническую картину пациента с вирусом герпеса человека 6.
Кратко изложите рекомендации по лечению пациентов, инфицированных вирусом герпеса человека 6.
Объясните важность улучшения координации помощи между межпрофессиональной командой для улучшения оказания помощи пациентам, инфицированным вирусом герпеса человека 6, особенно тем, кто подвержен риску более тяжелой инфекции.
Введение
Вирус герпеса человека 6 (HHV-6) первоначально был обнаружен в лимфоцитах крови взрослых с лимфопролиферативными заболеваниями или СПИДом и был назван В-лимфотропным вирусом человека. Дальнейшие исследования выявили HHV-6 в лимфоцитах CD4+ и в составе вирусов герпеса. Поскольку это был шестой выделенный герпесвирус, впоследствии он был переименован в человеческий герпесвирус 6. Известно, что HHV-6, типичный для вируса герпеса, вызывает острую, непрекращающуюся и постоянную инфекцию.
Известно, что HHV-6, типичный для вируса герпеса, вызывает острую, непрекращающуюся и постоянную инфекцию.
HHV-6 — собирательное название двухцепочечных ДНК-вирусов HHV-6A и HHV-6B.HHV-6A и HHV-6B официально признаны отдельными вирусами, а не вариантами внутри семейства герпесвирусов. Хотя о HHV-6A известно гораздо меньше, он чаще встречается у хозяина с ослабленным иммунитетом. Напротив, исследования определили, что HHV-6B является этиологическим агентом детской экзантемы (детская розеола) [1]. Приобретение HHV-6B довольно часто встречается у молодых людей и часто наблюдается в отделениях неотложной помощи по всему миру. HHV-6B является вездесущим вирусом, которым более 90% населения инфицировано в течение первых 3 лет жизни.
Этиология
HHV-6A, HHV-6B и HHV-7 имеют определенный уровень гомологии с цитомегаловирусом человека (CMV), единственным другим бета-герпесвирусом человека.[1] И HHV-6A, и HHV-6B реплицируются в Т-клетках. Однако они различаются по рецепторам, используемым для входа в клетку. В отличие от человеческой кластерной дифференцировки 46 (CD46), используемой вирусом HHV-6A, исследования показывают, что кластерная дифференцировка 134 (CD134) является первичным рецептором для HHV-6B.[2] CD134 экспрессируется только на активированных Т-клетках.[3] Подобно HHV-8, также известному как вирус герпеса, ассоциированный с саркомой Капоши (KSHV), и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус является онкогенным и разрушительным для аутоиммунных клеток.После связывания с соответствующим рецептором HHV-6 устанавливает латентное состояние в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
В отличие от человеческой кластерной дифференцировки 46 (CD46), используемой вирусом HHV-6A, исследования показывают, что кластерная дифференцировка 134 (CD134) является первичным рецептором для HHV-6B.[2] CD134 экспрессируется только на активированных Т-клетках.[3] Подобно HHV-8, также известному как вирус герпеса, ассоциированный с саркомой Капоши (KSHV), и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус является онкогенным и разрушительным для аутоиммунных клеток.После связывания с соответствующим рецептором HHV-6 устанавливает латентное состояние в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
Во взрослом возрасте более 95% населения являются серопозитивными в отношении HHV-6A, HHV-6B или обоих вариантов. Существующие серологические методы неэффективны для выделения одного варианта от другого [4]. В настоящее время хорошо известно, что HHV-6 является основной причиной детской розеолы.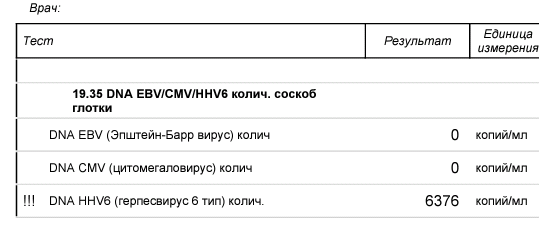 HHV-6B в первую очередь поражает младенцев и является основной причиной реактивации вируса как у иммунокомпетентных, так и у иммунокомпрометированных хозяев.[1] В общей популяции подавляющее большинство взрослых с хроническим ВГЧ-6 остаются бессимптомными. Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией ВГЧ-6 имели ДНК вируса в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги.[5] Напротив, другие исследователи определили распространенность ДНК HHV-6 в спинномозговой жидкости детей с фебрильными судорогами и пациентов со СПИДом с неврологическими симптомами только от 0% до 4%.[5] Эти вирусы связаны с заболеваниями у пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований.[4] Кроме того, успешные исследования выявили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом.
HHV-6B в первую очередь поражает младенцев и является основной причиной реактивации вируса как у иммунокомпетентных, так и у иммунокомпрометированных хозяев.[1] В общей популяции подавляющее большинство взрослых с хроническим ВГЧ-6 остаются бессимптомными. Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией ВГЧ-6 имели ДНК вируса в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги.[5] Напротив, другие исследователи определили распространенность ДНК HHV-6 в спинномозговой жидкости детей с фебрильными судорогами и пациентов со СПИДом с неврологическими симптомами только от 0% до 4%.[5] Эти вирусы связаны с заболеваниями у пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований.[4] Кроме того, успешные исследования выявили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом. [6]
[6]
Эпидемиология
Исследователи идентифицировали HHV-6B как этиологический патоген, ответственный за большинство инфекций HHV-6, проявляющихся симптомами.Хотя исследования подтверждают, что большинство людей были инфицированы ВГЧ-6 в какой-то момент своей жизни, первичное заражение ВГЧ-6 происходит в течение первых 2 лет. В этой возрастной группе это обычно связано с недифференцированным лихорадочным заболеванием, хотя у части детей будут проявляться классические проявления детской розеолы. В нескольких отчетах об исследованиях зафиксировано снижение серопозитивности с увеличением возраста [4]. Хотя первичная инфекция ВГЧ-6 у взрослых встречается редко, реактивация может произойти в любом возрасте.Инфекция HHV-6 не имеет склонности к половой жизни и может встречаться у людей всех рас.
HHV-6 — это повсеместно распространенный вирус, встречающийся во всем мире. В крупном проспективном исследовании североамериканских детей пиковый возраст заражения HHV-6 приходился на возраст от 6 до 9 месяцев. [1] Как и в Соединенных Штатах, в Великобритании и Японии от 97 до 100 % первичных инфекций связаны с HHV-6B. Хотя эпидемиологические отчеты о HHV-6A ограничены, исследования показывают, что инфекция HHV-6A приобретается в более позднем возрасте и что первичная инфекция этим конкретным вариантом часто протекает бессимптомно.[7] Тем не менее, несколько групп зарегистрировали HHV-6A у детей с симптомами из Африки и США. Кроме того, HHV-6A был идентифицирован как преобладающая форма вируса, выделенного у ВИЧ-позитивных младенцев в эндемичном регионе Африки к югу от Сахары.[7] Среди разных популяций серопревалентность резко различается. Задокументировано 20 % серопревалентности среди беременных марокканских женщин и 100 % среди бессимптомных взрослых китайцев. Серопревалентность колебалась примерно от 39 до 80% среди этнически разнообразного взрослого населения Танзании, Малайзии, Таиланда и Бразилии.[4]
[1] Как и в Соединенных Штатах, в Великобритании и Японии от 97 до 100 % первичных инфекций связаны с HHV-6B. Хотя эпидемиологические отчеты о HHV-6A ограничены, исследования показывают, что инфекция HHV-6A приобретается в более позднем возрасте и что первичная инфекция этим конкретным вариантом часто протекает бессимптомно.[7] Тем не менее, несколько групп зарегистрировали HHV-6A у детей с симптомами из Африки и США. Кроме того, HHV-6A был идентифицирован как преобладающая форма вируса, выделенного у ВИЧ-позитивных младенцев в эндемичном регионе Африки к югу от Сахары.[7] Среди разных популяций серопревалентность резко различается. Задокументировано 20 % серопревалентности среди беременных марокканских женщин и 100 % среди бессимптомных взрослых китайцев. Серопревалентность колебалась примерно от 39 до 80% среди этнически разнообразного взрослого населения Танзании, Малайзии, Таиланда и Бразилии.[4]
Патофизиология
В целом, первичная инфекция HHV-6 является одной из наиболее распространенных причин острых лихорадочных заболеваний у детей раннего возраста. Это также является важной причиной обращений в отделение неотложной помощи, госпитализаций и фебрильных судорог [1]. HHV-6 принадлежит к подсемейству Betaherpesvirinae и роду Roseolovirus . Частица вириона имеет характерную структуру герпесвируса с центральным ядром, содержащим вирусную ДНК, капсидом и богатым белком покровным слоем, окруженным мембраной.
Это также является важной причиной обращений в отделение неотложной помощи, госпитализаций и фебрильных судорог [1]. HHV-6 принадлежит к подсемейству Betaherpesvirinae и роду Roseolovirus . Частица вириона имеет характерную структуру герпесвируса с центральным ядром, содержащим вирусную ДНК, капсидом и богатым белком покровным слоем, окруженным мембраной.
Основной клеткой-мишенью для HHV-6 является зрелая Т-клетка CD4+.[1] Вирус продемонстрировал плейотропное действие на иммунную систему, включая модуляцию функции естественных клеток-киллеров. In vivo HHV-6 в первую очередь инфицирует и реплицируется в лимфоцитах CD4 после прикрепления к клеточному рецептору CD46. Через опосредованный рецептором эндоцитоз HHV-6 проникает в клетки с последующей репликацией вируса (Ablashi). После первичного заражения ДНК вируса живет в мононуклеарных клетках периферической крови (МКПК).[1]
В то время как точный механизм передачи HHV-6 все еще находится в стадии изучения, несколько исследований выявили передачу вируса через слюну. По-видимому, наиболее распространенным путем является передача через слюну от матери к ребенку. В нескольких ранних отчетах описывалось, что инфекционный ВГЧ-6 присутствует в слюне почти каждого человека, прошедшего тестирование.[4] Кроме того, образцы слюны 90% обследованных лиц содержали ДНК ВГЧ-6, в то время как в другом исследовании, основанном на ПЦР, только 3% людей были положительными, хотя 63% образцов биопсии слюнных желез были положительными.[4] Геном HHV-6 также был обнаружен в спинномозговой жидкости детей во время первичных и латентных инфекций, а также в мозговом веществе нормальных взрослых при вскрытии, что позволяет предположить, что как ЦНС, так и слюнные железы являются резервуаром вирусной латентности и персистирующей инфекции. .[1][4]
По-видимому, наиболее распространенным путем является передача через слюну от матери к ребенку. В нескольких ранних отчетах описывалось, что инфекционный ВГЧ-6 присутствует в слюне почти каждого человека, прошедшего тестирование.[4] Кроме того, образцы слюны 90% обследованных лиц содержали ДНК ВГЧ-6, в то время как в другом исследовании, основанном на ПЦР, только 3% людей были положительными, хотя 63% образцов биопсии слюнных желез были положительными.[4] Геном HHV-6 также был обнаружен в спинномозговой жидкости детей во время первичных и латентных инфекций, а также в мозговом веществе нормальных взрослых при вскрытии, что позволяет предположить, что как ЦНС, так и слюнные железы являются резервуаром вирусной латентности и персистирующей инфекции. .[1][4]
Анамнез и медицинский осмотр
Хотя различные клинические проявления и заболевания, связанные с ВГЧ-6, все еще находятся в стадии изучения, исследования уже подтверждают, что ВГЧ-6 играет важную роль в заболеваниях центральной нервной системы и у лиц с ослабленным иммунитетом, включая реципиентов трансплантатов. [8] Инфекция ВГЧ-6 обычно протекает доброкачественно и проходит самостоятельно. Лица с симптомами, как правило, младенцы или взрослые с ослабленным иммунитетом, у которых наблюдается реактивация болезни.
[8] Инфекция ВГЧ-6 обычно протекает доброкачественно и проходит самостоятельно. Лица с симптомами, как правило, младенцы или взрослые с ослабленным иммунитетом, у которых наблюдается реактивация болезни.
ВГЧ-6В является возбудителем экзантемы субитум (также известной как детская розеола), детского заболевания, характеризующегося высокой температурой и легкой кожной сыпью, на долю которого приходится от 10 до 17% обращений детей в отделение неотложной помощи с острой лихорадкой до 36 месяцев.[9] На первичную инфекцию ВГЧ-6 приходится более 36% всех случаев острой лихорадки у детей в возрасте от 12 до 15 месяцев, и почти исключительно она вызывается ВГЧ-6В, а не ВГЧ-6А.[9][8][10]
Диагноз детской розеолы устанавливается клинически. Это часто провоцируется внезапным началом высокой лихорадки с температурой, достигающей 40 ° C (104 F) в течение трех-пяти дней. Во время начальной лихорадочной фазы у некоторых детей наблюдается периорбитальный отек, конъюнктивит или воспаление барабанной перепонки, в то время как многие другие будут активны и здоровы. [9] Другие симптомы у детей включают лимфаденопатию, желудочно-кишечные (ЖКТ) симптомы, включая дисфункцию печени и гепатит, а также выбухание родничков.[11] У взрослых часто встречаются гепатит и симптомы, характерные для энцефалита.[9] У реципиентов трансплантата симптомы часто включают лихорадку, реакцию «трансплантат против хозяина» (РТПХ), симптомы отторжения трансплантата, интерстициальный пневмонит, миелит и сыпь.[12]
[9] Другие симптомы у детей включают лимфаденопатию, желудочно-кишечные (ЖКТ) симптомы, включая дисфункцию печени и гепатит, а также выбухание родничков.[11] У взрослых часто встречаются гепатит и симптомы, характерные для энцефалита.[9] У реципиентов трансплантата симптомы часто включают лихорадку, реакцию «трансплантат против хозяина» (РТПХ), симптомы отторжения трансплантата, интерстициальный пневмонит, миелит и сыпь.[12]
Результаты физикального обследования обычно соответствуют ранее описанным симптомам. У детей при снижении лихорадки часто наблюдается побледнение макуло-папулезной сыпи розово-розового цвета размером примерно 2–5 мм с ореолом вокруг.Сыпь обычно сохраняется в течение одного-двух дней и часто распространяется центробежно. Однако есть задокументированные случаи лихорадки без сыпи.[13] Воспаление барабанной перепонки и признаки инфекции верхних или нижних дыхательных путей часто встречаются у детей, в то время как у взрослых при физикальном обследовании может быть лихорадка, гепатоспленомегалия и лимфаденопатия. [12]
[12]
Оценка
Вирус герпеса человека 6 (HHV-6) можно диагностировать с помощью полимеразной цепной реакции (ПЦР), серологии или вирусных культур, причем ПЦР является преобладающим методом.[12] Однако маловероятно, что лабораторные исследования будут проведены у иммунокомпетентных лиц из-за самокупирующегося характера заболевания. Слюна является основным резервуаром для передачи вируса, так как он часто выделяется в слюнных железах. Хотя сообщений о передаче вируса при переливании крови и грудном вскармливании не поступало, были зарегистрированы случаи ВГЧ-6 после трансплантации органов.[12] Большинство исследователей твердо убеждены в том, что заражение ВГЧ-6В происходит в раннем возрасте, тогда как заражение ВГЧ-6А развивается позже.Оба варианта вируса были одновременно обнаружены у взрослых, что позволяет предположить, что вирусы хронически поражают многих людей.
Лабораторные исследования при ВГЧ-6 могут выявить лейкоцитоз, лейкопению и анемию.[13] У пациентов с трансплантацией почки и пациентов с дисфункцией печени следует провести исследования почек и печени соответственно, чтобы исключить нарушение электролитного баланса и гепатит.
Показания к рентгенологической визуализации зависят от клинической картины, особенно у лиц с ослабленным иммунитетом.Рентгенография грудной клетки может быть выполнена для исключения другой этиологии у взрослых, включая пневмонию и пневмонит. У детей потребность в визуализации возникает реже. Компьютерная томография (КТ) головы с контрастом или без него может быть получена для поиска других излечимых заболеваний. При поражении центральной нервной системы может быть выполнена люмбальная пункция. Инфекция HHV-6 в ЦНС часто имеет умеренный плеоцитоз с повышенным содержанием белка. СМЖ может быть отправлена на ПЦР-исследование HHV-6 для подтверждения диагноза.[14]
Лечение/управление
В настоящее время не существует утвержденного соединения, предназначенного исключительно для лечения ВГЧ-6, и нет доступной вакцины.[8] Обычно не рекомендуется проводить противовирусную профилактику инфекции HHV-6. Вместо этого рекомендуется проводить раннее противовирусное лечение, особенно в случаях энцефалита HHV-6. Рекомендуется терапия первой линии с внутривенным введением ганцикловира и фоскарнета с лечением в течение 3–4 недель.[15] У пациентов, перенесших трансплантацию стволовых клеток, лечение ганцикловиром имеет задокументированные преимущества и является рекомендуемым противовирусным препаратом выбора.[15]
Рекомендуется терапия первой линии с внутривенным введением ганцикловира и фоскарнета с лечением в течение 3–4 недель.[15] У пациентов, перенесших трансплантацию стволовых клеток, лечение ганцикловиром имеет задокументированные преимущества и является рекомендуемым противовирусным препаратом выбора.[15]
Инфекции ВГЧ-6 у иммунокомпетентных детей проходят самостоятельно и не требуют лечения. Лечение младенцев с детской розеолой обычно поддерживающее.[12] Жаропонижающие, такие как ацетаминофен или ибупрофен, рекомендуются для лечения сильной лихорадки и лиц с риском фебрильных судорог. Если возникают фебрильные судороги, противоэпилептические средства не нужны. Лица с инфекцией HHV-6, проявляющейся поражением ЦНС, включая фебрильные судороги, должны быть госпитализированы.
Дифференциальный диагноз
Дифференциальный диагноз входит:
инфекционный мононуклеоз
Вирусный гепатит
герпес симплекс вирус-инфекция
Meningitis
RUBLELLA
Вирусная пневмония
Лекарственная сыпь с эозинофилией и системными симптомами (DRESS-синдром)
У детей с классической детской розеолой этиологическим возбудителем является ВГЧ-6. Однако некоторые другие заболевания могут вызывать лихорадку и сыпь. Более тяжелые, менее доброкачественные причины таких симптомов требуют исключения. У иммунокомпетентных взрослых инфекция HHV-6 проявляется аналогично мононуклеозу. Таким образом, ВЭБ и ЦМВ следует исключить. Пациенты с ослабленным иммунитетом, особенно те, кому пересаживают органы, и больные СПИДом, как правило, имеют симптомы. Эта когорта лиц с заболеванием ВГЧ-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и DRESS-синдром.[16] Кроме того, существует документация о HHV-6 в случаях рассеянного склероза, энцефалита и интерстициального пневмонита.[17] Стоит отметить, что только HHV-6A связан с тиреоидитом Хашимото.[12]
Однако некоторые другие заболевания могут вызывать лихорадку и сыпь. Более тяжелые, менее доброкачественные причины таких симптомов требуют исключения. У иммунокомпетентных взрослых инфекция HHV-6 проявляется аналогично мононуклеозу. Таким образом, ВЭБ и ЦМВ следует исключить. Пациенты с ослабленным иммунитетом, особенно те, кому пересаживают органы, и больные СПИДом, как правило, имеют симптомы. Эта когорта лиц с заболеванием ВГЧ-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и DRESS-синдром.[16] Кроме того, существует документация о HHV-6 в случаях рассеянного склероза, энцефалита и интерстициального пневмонита.[17] Стоит отметить, что только HHV-6A связан с тиреоидитом Хашимото.[12]
Прогноз
Как правило, первичная инфекция HHV-6 проходит самостоятельно, и иммунокомпетентные люди выживают без осложнений. У людей с ослабленным иммунитетом в отчетах описано более тяжелое заболевание. Имеются документальные данные о пневмоните, гепатите и отторжении органов у пациентов с трансплантацией, а также о смерти пациентов с энцефалитом и менингоэнцефалитом.[18] Точно так же в Японии с 2003 по 2004 год обследование пациентов с энцефалитом, связанным с субитумной экзантемой, показало необычно плохой прогноз [19] с зарегистрированными смертельными исходами у двух детей с энцефалопатией, вторичной по отношению к инфекции HHV-6. У детей было обнаружено генетическое митохондриальное заболевание.[20]
У людей с ослабленным иммунитетом в отчетах описано более тяжелое заболевание. Имеются документальные данные о пневмоните, гепатите и отторжении органов у пациентов с трансплантацией, а также о смерти пациентов с энцефалитом и менингоэнцефалитом.[18] Точно так же в Японии с 2003 по 2004 год обследование пациентов с энцефалитом, связанным с субитумной экзантемой, показало необычно плохой прогноз [19] с зарегистрированными смертельными исходами у двух детей с энцефалопатией, вторичной по отношению к инфекции HHV-6. У детей было обнаружено генетическое митохондриальное заболевание.[20]
Осложнения
Обычно первичная инфекция ВГЧ-6 протекает доброкачественно со спонтанным исчезновением через 5–7 дней. Наиболее частым осложнением детской розеолы являются фебрильные судороги. Дополнительные осложнения часто возникают из-за нейротрофических эффектов HHV-6, что особенно заметно в случаях поражения центральной нервной системы, например, в случаях менингоэнцефалита и энцефалопатии. В этих случаях вирус проникает в мозг во время первичной инфекции и может оставаться в спящем состоянии в тканях мозга.[21] Впоследствии появились записи о случаях острого или подострого энцефалита, иногда связанных с диффузной или многоочаговой демиелинизацией.[4] HHV-6 редко вызывает оппортунистическую инфекцию у лиц с ослабленным иммунитетом. Активность HHV-6A и HHV-6B была обнаружена после трансплантации почек, печени и костного мозга (BMT) [4].
В этих случаях вирус проникает в мозг во время первичной инфекции и может оставаться в спящем состоянии в тканях мозга.[21] Впоследствии появились записи о случаях острого или подострого энцефалита, иногда связанных с диффузной или многоочаговой демиелинизацией.[4] HHV-6 редко вызывает оппортунистическую инфекцию у лиц с ослабленным иммунитетом. Активность HHV-6A и HHV-6B была обнаружена после трансплантации почек, печени и костного мозга (BMT) [4].
Сдерживание и просвещение пациентов
У в остальном здорового младенца с детской розеолой обучение родителей имеет решающее значение для снижения беспокойства по поводу лихорадки и возможных фебрильных судорог.Важность поддерживающей терапии жаропонижающими средствами и бесполезность антибиотиков требуют объяснения. У лиц с ослабленным иммунитетом сложные симптомы и другие вторичные вирусные заболевания, которые могут сопровождать инфекцию HHV-6, являются поводом для консультирования с упором на раннее обращение за медицинской помощью при появлении симптомов.
Pearls and Other Issues
Общепризнано, что HHV-6B является причинным вариантом, ответственным за большинство первичных инфекций, в то время как HHV-6A приобретается после HHV-6B в результате бессимптомной инфекции.[22]1. Отличие случаев первичной инфекции HHV-6 с типичной сыпью детской розеолы от других заболеваний является ключом к исключению более тяжелых диагнозов. Наиболее частым осложнением инфекции ВГЧ-6 является детская розеола, и на ВГЧ-6 приходится примерно 10–20 % лихорадочных заболеваний у детей в возрасте от 6 месяцев до 3 лет. Фебрильные судороги, симптомы со стороны желудочно-кишечного тракта и дыхательных путей встречаются реже и обычно проходят самостоятельно. Поддерживающая терапия с отдыхом и гидратацией является общепринятым подходом к лечению в этой подгруппе.Подобно другим вирусам герпеса, HHV-6 реплицируется в слюнных железах и находится в латентном состоянии в мононуклеарных клетках периферической крови. Диагностика ВГЧ-6 с помощью лабораторных исследований у иммунокомпетентного хозяина обычно не требуется..gif) Тем не менее, ПЦР, серологические исследования или посев вируса часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Тем не менее, ПЦР, серологические исследования или посев вируса часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Инфекция HHV-6 коррелирует с более тяжелыми заболеваниями, включая мононуклеоз, колит, миокардит и гепатит, в дополнение к документально подтвержденным осложнениям центральной нервной системы в виде энцефалита и менингоэнцефалита.Раннее распознавание и лечение неврологических осложнений являются неотъемлемой частью предотвращения неблагоприятных исходов. Дети и взрослые, больные раком, реципиенты аллогенных трансплантатов и лица с иммуносупрессивными расстройствами, подвержены риску реактивации ВГЧ-6. В таких случаях у людей может наблюдаться лихорадка, сыпь и снижение количества циркулирующих гранулоцитов и эритроидных клеток.[12] Хотя не существует утвержденных методов лечения исключительно инфекции HHV-6, противовирусное лечение ганцикловиром и/или фоскарнетом оказалось успешным в лечении неврологических осложнений, описанных ранее.
Улучшение результатов работы бригады здравоохранения
HHV-6 обычно проявляется сыпью как у детей, обращающихся в отделение неотложной помощи, так и у педиатров. Хотя определение сыпи может быть сложной задачей, выделение конкретных сопутствующих симптомов необходимо, чтобы различать более токсичные и доброкачественные заболевания. Большинство инфекций HHV-6 протекают бессимптомно, преходящи и не требуют противовирусного лечения. [Уровень II] Консультация педиатра является рекомендацией для младенцев с детской розеолой, у которых есть фебрильные судороги.Известны осложнения HHV-6, и людям с более зловещими признаками и симптомами, включая изменения психического статуса и недостаточность органов, может помочь межпрофессиональный подход. В таких случаях необходима консультация невролога и врача-инфекциониста. При подозрении на сердечную недостаточность, связанную с HHV-6, ранняя консультация кардиолога имеет решающее значение для лечения инфекционного миокардита у иммунокомпетентных взрослых пациентов. [23] [Уровень IV]
[23] [Уровень IV]
Скоординированный уход со стороны квалифицированных медсестер целесообразен для наблюдения за ухудшением состояния и изменениями показателей жизнедеятельности.Точно так же не следует сбрасывать со счетов лабораторную помощь в ускорении предпочтительных методов обнаружения вируса в крови или спинномозговой жидкости с помощью ПЦР или вирусного антигена в ткани с помощью иммуногистохимии. (Уровень II). Наконец, фармацевт является неотъемлемой частью обеспечения противовирусного лечения ганцикловиром и фоскарнетом при энцефалите, связанном с HHV-6.[24] [Уровень III] Для улучшения исходов в сложных случаях и обеспечения наилучших результатов рекомендуется совместный, ориентированный на пациента, межпрофессиональный командный подход между клиницистами, включая врачей, лабораторию, специально обученных медсестер и фармацевтов, открыто общающихся как команда здравоохранения. исходы пациента.[Уровень 5]
Рисунок
Это гистологический препарат вируса герпеса человека-6 (HHV-6), ранее известного как HBLV, типа вируса герпеса, открытого в октябре 1986 года. Это микрофотография зараженного клетки с тельцами включения как в ядре, так и в цитоплазме. (подробнее…)
Это микрофотография зараженного клетки с тельцами включения как в ядре, так и в цитоплазме. (подробнее…)
Ссылки
- 1.
- Caserta MT, Mock DJ, Dewhurst S. Herpesvirus человека 6. Clin Infect Dis. 2001 г., 15 сентября; 33 (6): 829-33. [PubMed: 11512088]
- 2.
- Кладовая С.Н., Медвецкий П.Г. Латентность, интеграция и реактивация вируса герпеса человека-6. Вирусы. 24 июля 2017 г.; 9(7) [бесплатная статья PMC: PMC5537686] [PubMed: 28737715]
- 3.
- Элиассен Э., Лум Э., Притчетт Дж., Онгради Дж., Крюгер Г., Кроуфорд Дж. Р., Фан Т. Л., Аблаши Д., Хадналл С.Д. Вирус герпеса человека 6 и злокачественные новообразования: обзор. Фронт Онкол. 2018;8:512. [Бесплатная статья PMC: PMC6277865] [PubMed: 30542640]
- 4.
- Braun DK, Dominguez G, Pellett PE. Герпесвирус человека 6.Clin Microbiol Rev. 1997 Jul; 10(3):521-67. [Статья PMC бесплатно: PMC172933] [PubMed: 9227865]
- 5.
- Ансари А., Ли С., Абзуг М.
 Дж., Вайнберг А. Вирусы герпеса человека 6 и 7 и инфекция центральной нервной системы у детей. Эмердж Инфекция Дис. 2004 авг.; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247]
Дж., Вайнберг А. Вирусы герпеса человека 6 и 7 и инфекция центральной нервной системы у детей. Эмердж Инфекция Дис. 2004 авг.; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247] - 6.
- Agut H, Bonnafous P, Gautheret-Dejean A. Обновленная информация об инфекциях вирусами герпеса человека 6A, 6B и 7. Med Mal Infect. 2017 март; 47(2):83-91. [PubMed: 27773488]
- 7.
- Аблаши Д., Агут Х., Альварес-Лафуэнте Р., Кларк Д.А., Дьюхерст С., ДиЛука Д., Фламанд Л., Френкель Н., Галло Р., Гомпелс Ю.А., Хёльсберг П., Якобсон С., Луппи М., Луссо П., Мальнати М., Медвецкий P, Mori Y, Pellett PE, Pritchett JC, Yamanishi K, Yoshikawa T. Классификация HHV-6A и HHV-6B как отдельных вирусов. Арх Вирол. 2014 май; 159(5):863-70. [Бесплатная статья PMC: PMC4750402] [PubMed: 24193951]
- 8.
- De Bolle L, Naesens L, De Clercq E. Обновленная информация о биологии вируса герпеса человека 6, клинических особенностях и терапии.Clin Microbiol Rev. 2005 Jan; 18(1):217-45.
 [Бесплатная статья PMC: PMC544175] [PubMed: 15653828]
[Бесплатная статья PMC: PMC544175] [PubMed: 15653828] - 9.
- Tesini BL, Epstein LG, Caserta MT. Клинические последствия первичной инфекции розеоловирусами. Карр Опин Вирол. 2014 дек;9:91-6. [Бесплатная статья PMC: PMC4267952] [PubMed: 25462439]
- 10.
- Hall CB, Long CE, Schnabel KC, Caserta MT, McIntyre KM, Costanzo MA, Knott A, Dewhurst S, Insel RA, Epstein LG. Герпесвирусная инфекция человека-6 у детей. Проспективное исследование осложнений и реактивации.N Engl J Med. 1994 г., 18 августа; 331(7):432-8. [PubMed: 8035839]
- 11.
- Кристофоро Т., Ле Н.К., Рай-Бэкингем С., Хадсон В.Б., Кэрролл Л.Ф. Не очень мягкое пятно: патофизиология выпуклого родничка в связи с розеолой. Педиатр Неотложная помощь. 2020 окт; 36 (10): e576-e578. [PubMed: 29489601]
- 12.
- Agut H, Bonnafous P, Gautheret-Dejean A. Лабораторные и клинические аспекты инфекций, вызванных вирусом герпеса человека 6. Clin Microbiol Rev. 2015 Apr; 28(2):313-35.
 [Бесплатная статья PMC: PMC4402955] [PubMed: 25762531]
[Бесплатная статья PMC: PMC4402955] [PubMed: 25762531] - 13.
- Арнеж М., Авшич-Жупанц Т., Уршич Т., Петровец М. Инфекция герпеса человека 6, представляющая собой острое лихорадочное заболевание, связанное с тромбоцитопенией и лейкопенией. Дело Rep Педиатр. 2016;2016:2483183. [Бесплатная статья PMC: PMC5131235] [PubMed: 27980872]
- 14.
- Яварян Дж., Гаввами Н., Мамиши С. Обнаружение вируса герпеса человека 6 в спинномозговой жидкости детей с возможным энцефалитом. Юндишапур Дж. Микробиолог. 2014 сен;7(9):e11821. [Бесплатная статья PMC: PMC4255374] [PubMed: 25485059]
- 15.
- Причард М.Н., Уитли Р.Дж. Разработка новых методов лечения вируса герпеса человека 6. Curr Opin Virol. 2014 дек.; 9:148-53. [Статья бесплатно PMC: PMC4267975] [PubMed: 25462447]
- 16.
- Shiohara T, Iijima M, Ikezawa Z, Hashimoto K. Диагноз DRESS-синдрома в достаточной степени установлен на основании типичных клинических признаков и реактивации вируса.
 . Бр Дж Дерматол. 2007 г., май; 156(5):1083-4. [PubMed: 17381452]
. Бр Дж Дерматол. 2007 г., май; 156(5):1083-4. [PubMed: 17381452] - 17.
- Маркс Г.Л., Нолан П.Е., Эрлих К.С., Эллис М.Н.Кожно-слизистая диссеминация устойчивого к ацикловиру вируса простого герпеса у больного СПИДом. Преподобный Заражает Дис. 1989 г., май-июнь; 11(3):474-6. [PubMed: 2546244]
- 18.
- Beović B, Pecaric-Meglic N, Marin J, Bedernjak J, Muzlovic I, Cizman M. Смертельный человеческий герпесвирус 6-ассоциированный многоочаговый менингоэнцефалит у взрослой пациентки. Scand J Infect Dis. 2001;33(12):942-4. [PubMed: 11868775]
- 19.
- Йошикава Т., Охаси М., Мияке Ф., Фудзита А., Усуи С., Сугата К., Суга С., Хашимото С., Асано Ю.Exanthem subitum-ассоциированный энцефалит: общенациональное исследование в Японии. Педиатр Нейрол. 2009 ноябрь; 41 (5): 353-8. [PubMed: 19818937]
- 20.
- Al-Zubeidi D, Thangarajh M, Pathak S, Cai C, Schlaggar BL, Storch GA, Grange DK, Watson ME. Смертельный человеческий герпесвирус 6-ассоциированный энцефалит у двух мальчиков с сопутствующими митохондриальными нарушениями POLG.
 Педиатр Нейрол. 2014 г., сен; 51 (3): 448-52. [PubMed: 25160553]
Педиатр Нейрол. 2014 г., сен; 51 (3): 448-52. [PubMed: 25160553] - 21.
- Mason EE, Printen KJ. Метаболические аспекты восстановления тонкой кишки после еюноилеального шунтирования.Хирургический гинекологический акушер. 1976 г., февраль; 142 (2): 177–83. [PubMed: 813311]
- 22.
- де Андраде РП. Многоцентровая клиническая оценка новой монофазной комбинации: Минулет (гестоден и этинилэстрадиол). Инт Дж. Фертил. 1989 Сентябрь; 34 Приложение: 22-30. [PubMed: 2576253]
- 23.
- Ashrafpoor G, Andréoletti L, Bruneval P, Macron L, Azarine A, Lepillier A, Danchin N, Mousseaux E, Redheuil A. Молниеносный миокардит, вызванный вирусом герпеса 6 человека, у иммунокомпетентного взрослого: роль магнитно-резонансная томография сердца в мультидисциплинарном подходе.Тираж. 03 декабря 2013 г .; 128 (23): e445-7. [PubMed: 24297820]
- 24.
- Le J, Gantt S., AST Сообщество специалистов по инфекционным заболеваниям. Вирус герпеса человека 6, 7 и 8 при трансплантации паренхиматозных органов.
 Ам Джей Трансплант. 2013 март; 13 Приложение 4: 128-37. [PubMed: 23465006]
Ам Джей Трансплант. 2013 март; 13 Приложение 4: 128-37. [PubMed: 23465006]
Вирус герпеса типа 6 — StatPearls
Программа непрерывного образования
Известно, что он вызывает более опасную инфекцию у лиц с ослабленным иммунитетом.Члены межпрофессиональной бригады должны признать, что дальнейшая оценка этого состояния оправдана, когда у пациента с ослабленным иммунитетом наблюдаются изменения поведения с сыпью или без нее. Раннее распознавание приведет к ускоренному лечению, улучшению ухода за пациентами и предотвращению неблагоприятных исходов. В этом упражнении рассматривается диагностика, ведение и лечение вируса герпеса человека 6, а также подчеркивается роль межпрофессиональной команды в уходе за больными пациентами.
Цели:
Опишите патофизиологию вируса герпеса человека 6.
Опишите типичную клиническую картину пациента с вирусом герпеса человека 6.
Кратко изложите рекомендации по лечению пациентов, инфицированных вирусом герпеса человека 6.

Объясните важность улучшения координации помощи между межпрофессиональной командой для улучшения оказания помощи пациентам, инфицированным вирусом герпеса человека 6, особенно тем, кто подвержен риску более тяжелой инфекции.
Введение
Вирус герпеса человека 6 (HHV-6) первоначально был обнаружен в лимфоцитах крови взрослых с лимфопролиферативными заболеваниями или СПИДом и был назван В-лимфотропным вирусом человека. Дальнейшие исследования выявили HHV-6 в лимфоцитах CD4+ и в составе вирусов герпеса. Поскольку это был шестой выделенный герпесвирус, впоследствии он был переименован в человеческий герпесвирус 6. Известно, что HHV-6, типичный для вируса герпеса, вызывает острую, непрекращающуюся и постоянную инфекцию.
HHV-6 — собирательное название двухцепочечных ДНК-вирусов HHV-6A и HHV-6B.HHV-6A и HHV-6B официально признаны отдельными вирусами, а не вариантами внутри семейства герпесвирусов.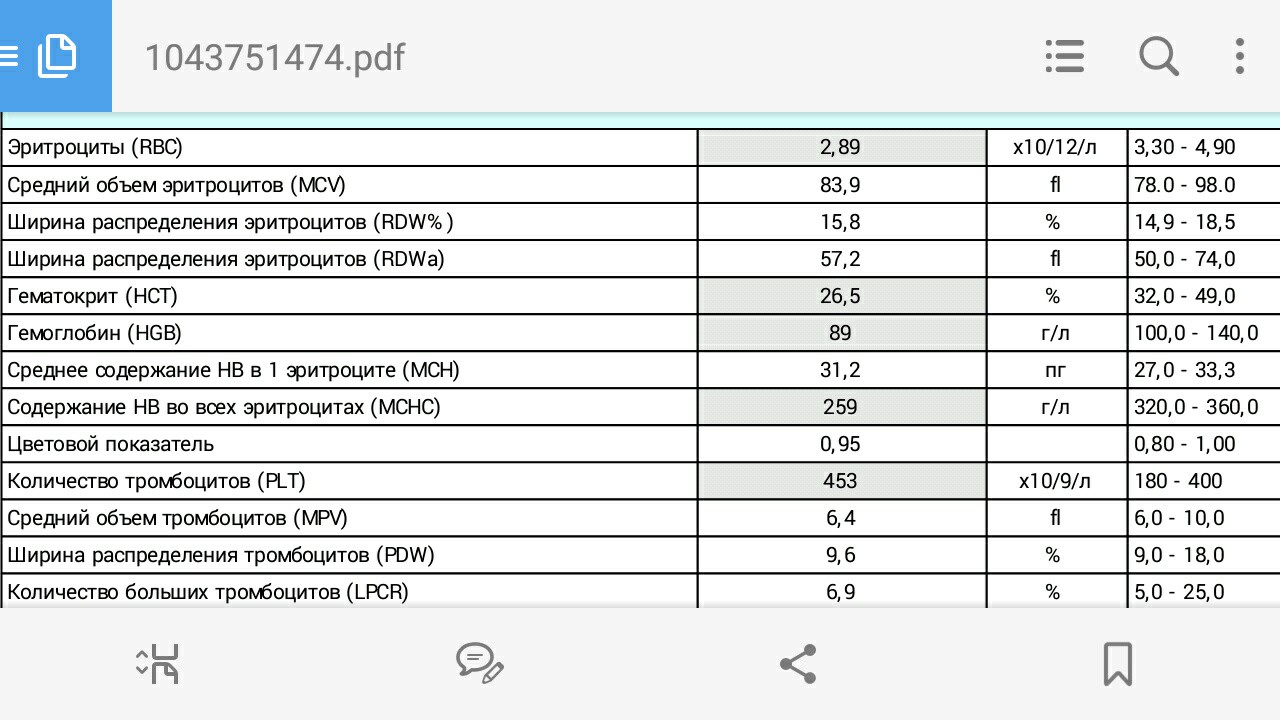 Хотя о HHV-6A известно гораздо меньше, он чаще встречается у хозяина с ослабленным иммунитетом. Напротив, исследования определили, что HHV-6B является этиологическим агентом детской экзантемы (детская розеола) [1]. Приобретение HHV-6B довольно часто встречается у молодых людей и часто наблюдается в отделениях неотложной помощи по всему миру. HHV-6B является вездесущим вирусом, которым более 90% населения инфицировано в течение первых 3 лет жизни.
Хотя о HHV-6A известно гораздо меньше, он чаще встречается у хозяина с ослабленным иммунитетом. Напротив, исследования определили, что HHV-6B является этиологическим агентом детской экзантемы (детская розеола) [1]. Приобретение HHV-6B довольно часто встречается у молодых людей и часто наблюдается в отделениях неотложной помощи по всему миру. HHV-6B является вездесущим вирусом, которым более 90% населения инфицировано в течение первых 3 лет жизни.
Этиология
HHV-6A, HHV-6B и HHV-7 имеют определенный уровень гомологии с цитомегаловирусом человека (CMV), единственным другим бета-герпесвирусом человека.[1] И HHV-6A, и HHV-6B реплицируются в Т-клетках. Однако они различаются по рецепторам, используемым для входа в клетку. В отличие от человеческой кластерной дифференцировки 46 (CD46), используемой вирусом HHV-6A, исследования показывают, что кластерная дифференцировка 134 (CD134) является первичным рецептором для HHV-6B.[2] CD134 экспрессируется только на активированных Т-клетках. [3] Подобно HHV-8, также известному как вирус герпеса, ассоциированный с саркомой Капоши (KSHV), и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус является онкогенным и разрушительным для аутоиммунных клеток.После связывания с соответствующим рецептором HHV-6 устанавливает латентное состояние в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
[3] Подобно HHV-8, также известному как вирус герпеса, ассоциированный с саркомой Капоши (KSHV), и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус является онкогенным и разрушительным для аутоиммунных клеток.После связывания с соответствующим рецептором HHV-6 устанавливает латентное состояние в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
Во взрослом возрасте более 95% населения являются серопозитивными в отношении HHV-6A, HHV-6B или обоих вариантов. Существующие серологические методы неэффективны для выделения одного варианта от другого [4]. В настоящее время хорошо известно, что HHV-6 является основной причиной детской розеолы. HHV-6B в первую очередь поражает младенцев и является основной причиной реактивации вируса как у иммунокомпетентных, так и у иммунокомпрометированных хозяев.[1] В общей популяции подавляющее большинство взрослых с хроническим ВГЧ-6 остаются бессимптомными. Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией ВГЧ-6 имели ДНК вируса в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги.[5] Напротив, другие исследователи определили распространенность ДНК HHV-6 в спинномозговой жидкости детей с фебрильными судорогами и пациентов со СПИДом с неврологическими симптомами только от 0% до 4%.[5] Эти вирусы связаны с заболеваниями у пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований.[4] Кроме того, успешные исследования выявили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом.[6]
Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией ВГЧ-6 имели ДНК вируса в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги.[5] Напротив, другие исследователи определили распространенность ДНК HHV-6 в спинномозговой жидкости детей с фебрильными судорогами и пациентов со СПИДом с неврологическими симптомами только от 0% до 4%.[5] Эти вирусы связаны с заболеваниями у пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований.[4] Кроме того, успешные исследования выявили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом.[6]
Эпидемиология
Исследователи идентифицировали HHV-6B как этиологический патоген, ответственный за большинство инфекций HHV-6, проявляющихся симптомами. Хотя исследования подтверждают, что большинство людей были инфицированы ВГЧ-6 в какой-то момент своей жизни, первичное заражение ВГЧ-6 происходит в течение первых 2 лет. В этой возрастной группе это обычно связано с недифференцированным лихорадочным заболеванием, хотя у части детей будут проявляться классические проявления детской розеолы. В нескольких отчетах об исследованиях зафиксировано снижение серопозитивности с увеличением возраста [4]. Хотя первичная инфекция ВГЧ-6 у взрослых встречается редко, реактивация может произойти в любом возрасте.Инфекция HHV-6 не имеет склонности к половой жизни и может встречаться у людей всех рас.
Хотя исследования подтверждают, что большинство людей были инфицированы ВГЧ-6 в какой-то момент своей жизни, первичное заражение ВГЧ-6 происходит в течение первых 2 лет. В этой возрастной группе это обычно связано с недифференцированным лихорадочным заболеванием, хотя у части детей будут проявляться классические проявления детской розеолы. В нескольких отчетах об исследованиях зафиксировано снижение серопозитивности с увеличением возраста [4]. Хотя первичная инфекция ВГЧ-6 у взрослых встречается редко, реактивация может произойти в любом возрасте.Инфекция HHV-6 не имеет склонности к половой жизни и может встречаться у людей всех рас.
HHV-6 — это повсеместно распространенный вирус, встречающийся во всем мире. В крупном проспективном исследовании североамериканских детей пиковый возраст заражения HHV-6 приходился на возраст от 6 до 9 месяцев.[1] Как и в Соединенных Штатах, в Великобритании и Японии от 97 до 100 % первичных инфекций связаны с HHV-6B. Хотя эпидемиологические отчеты о HHV-6A ограничены, исследования показывают, что инфекция HHV-6A приобретается в более позднем возрасте и что первичная инфекция этим конкретным вариантом часто протекает бессимптомно. [7] Тем не менее, несколько групп зарегистрировали HHV-6A у детей с симптомами из Африки и США. Кроме того, HHV-6A был идентифицирован как преобладающая форма вируса, выделенного у ВИЧ-позитивных младенцев в эндемичном регионе Африки к югу от Сахары.[7] Среди разных популяций серопревалентность резко различается. Задокументировано 20 % серопревалентности среди беременных марокканских женщин и 100 % среди бессимптомных взрослых китайцев. Серопревалентность колебалась примерно от 39 до 80% среди этнически разнообразного взрослого населения Танзании, Малайзии, Таиланда и Бразилии.[4]
[7] Тем не менее, несколько групп зарегистрировали HHV-6A у детей с симптомами из Африки и США. Кроме того, HHV-6A был идентифицирован как преобладающая форма вируса, выделенного у ВИЧ-позитивных младенцев в эндемичном регионе Африки к югу от Сахары.[7] Среди разных популяций серопревалентность резко различается. Задокументировано 20 % серопревалентности среди беременных марокканских женщин и 100 % среди бессимптомных взрослых китайцев. Серопревалентность колебалась примерно от 39 до 80% среди этнически разнообразного взрослого населения Танзании, Малайзии, Таиланда и Бразилии.[4]
Патофизиология
В целом, первичная инфекция HHV-6 является одной из наиболее распространенных причин острых лихорадочных заболеваний у детей раннего возраста. Это также является важной причиной обращений в отделение неотложной помощи, госпитализаций и фебрильных судорог [1]. HHV-6 принадлежит к подсемейству Betaherpesvirinae и роду Roseolovirus . Частица вириона имеет характерную структуру герпесвируса с центральным ядром, содержащим вирусную ДНК, капсидом и богатым белком покровным слоем, окруженным мембраной.
Основной клеткой-мишенью для HHV-6 является зрелая Т-клетка CD4+.[1] Вирус продемонстрировал плейотропное действие на иммунную систему, включая модуляцию функции естественных клеток-киллеров. In vivo HHV-6 в первую очередь инфицирует и реплицируется в лимфоцитах CD4 после прикрепления к клеточному рецептору CD46. Через опосредованный рецептором эндоцитоз HHV-6 проникает в клетки с последующей репликацией вируса (Ablashi). После первичного заражения ДНК вируса живет в мононуклеарных клетках периферической крови (МКПК).[1]
В то время как точный механизм передачи HHV-6 все еще находится в стадии изучения, несколько исследований выявили передачу вируса через слюну. По-видимому, наиболее распространенным путем является передача через слюну от матери к ребенку. В нескольких ранних отчетах описывалось, что инфекционный ВГЧ-6 присутствует в слюне почти каждого человека, прошедшего тестирование.[4] Кроме того, образцы слюны 90% обследованных лиц содержали ДНК ВГЧ-6, в то время как в другом исследовании, основанном на ПЦР, только 3% людей были положительными, хотя 63% образцов биопсии слюнных желез были положительными. [4] Геном HHV-6 также был обнаружен в спинномозговой жидкости детей во время первичных и латентных инфекций, а также в мозговом веществе нормальных взрослых при вскрытии, что позволяет предположить, что как ЦНС, так и слюнные железы являются резервуаром вирусной латентности и персистирующей инфекции. .[1][4]
[4] Геном HHV-6 также был обнаружен в спинномозговой жидкости детей во время первичных и латентных инфекций, а также в мозговом веществе нормальных взрослых при вскрытии, что позволяет предположить, что как ЦНС, так и слюнные железы являются резервуаром вирусной латентности и персистирующей инфекции. .[1][4]
Анамнез и медицинский осмотр
Хотя различные клинические проявления и заболевания, связанные с ВГЧ-6, все еще находятся в стадии изучения, исследования уже подтверждают, что ВГЧ-6 играет важную роль в заболеваниях центральной нервной системы и у лиц с ослабленным иммунитетом, включая реципиентов трансплантатов.[8] Инфекция ВГЧ-6 обычно протекает доброкачественно и проходит самостоятельно. Лица с симптомами, как правило, младенцы или взрослые с ослабленным иммунитетом, у которых наблюдается реактивация болезни.
ВГЧ-6В является возбудителем экзантемы субитум (также известной как детская розеола), детского заболевания, характеризующегося высокой температурой и легкой кожной сыпью, на долю которого приходится от 10 до 17% обращений детей в отделение неотложной помощи с острой лихорадкой до 36 месяцев.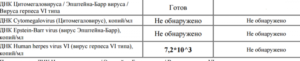 [9] На первичную инфекцию ВГЧ-6 приходится более 36% всех случаев острой лихорадки у детей в возрасте от 12 до 15 месяцев, и почти исключительно она вызывается ВГЧ-6В, а не ВГЧ-6А.[9][8][10]
[9] На первичную инфекцию ВГЧ-6 приходится более 36% всех случаев острой лихорадки у детей в возрасте от 12 до 15 месяцев, и почти исключительно она вызывается ВГЧ-6В, а не ВГЧ-6А.[9][8][10]
Диагноз детской розеолы устанавливается клинически. Это часто провоцируется внезапным началом высокой лихорадки с температурой, достигающей 40 ° C (104 F) в течение трех-пяти дней. Во время начальной лихорадочной фазы у некоторых детей наблюдается периорбитальный отек, конъюнктивит или воспаление барабанной перепонки, в то время как многие другие будут активны и здоровы.[9] Другие симптомы у детей включают лимфаденопатию, желудочно-кишечные (ЖКТ) симптомы, включая дисфункцию печени и гепатит, а также выбухание родничков.[11] У взрослых часто встречаются гепатит и симптомы, характерные для энцефалита.[9] У реципиентов трансплантата симптомы часто включают лихорадку, реакцию «трансплантат против хозяина» (РТПХ), симптомы отторжения трансплантата, интерстициальный пневмонит, миелит и сыпь.[12]
Результаты физикального обследования обычно соответствуют ранее описанным симптомам.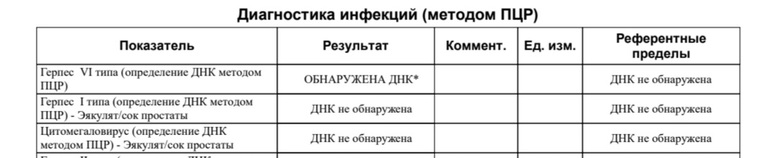 У детей при снижении лихорадки часто наблюдается побледнение макуло-папулезной сыпи розово-розового цвета размером примерно 2–5 мм с ореолом вокруг.Сыпь обычно сохраняется в течение одного-двух дней и часто распространяется центробежно. Однако есть задокументированные случаи лихорадки без сыпи.[13] Воспаление барабанной перепонки и признаки инфекции верхних или нижних дыхательных путей часто встречаются у детей, в то время как у взрослых при физикальном обследовании может быть лихорадка, гепатоспленомегалия и лимфаденопатия.[12]
У детей при снижении лихорадки часто наблюдается побледнение макуло-папулезной сыпи розово-розового цвета размером примерно 2–5 мм с ореолом вокруг.Сыпь обычно сохраняется в течение одного-двух дней и часто распространяется центробежно. Однако есть задокументированные случаи лихорадки без сыпи.[13] Воспаление барабанной перепонки и признаки инфекции верхних или нижних дыхательных путей часто встречаются у детей, в то время как у взрослых при физикальном обследовании может быть лихорадка, гепатоспленомегалия и лимфаденопатия.[12]
Оценка
Вирус герпеса человека 6 (HHV-6) можно диагностировать с помощью полимеразной цепной реакции (ПЦР), серологии или вирусных культур, причем ПЦР является преобладающим методом.[12] Однако маловероятно, что лабораторные исследования будут проведены у иммунокомпетентных лиц из-за самокупирующегося характера заболевания. Слюна является основным резервуаром для передачи вируса, так как он часто выделяется в слюнных железах. Хотя сообщений о передаче вируса при переливании крови и грудном вскармливании не поступало, были зарегистрированы случаи ВГЧ-6 после трансплантации органов. [12] Большинство исследователей твердо убеждены в том, что заражение ВГЧ-6В происходит в раннем возрасте, тогда как заражение ВГЧ-6А развивается позже.Оба варианта вируса были одновременно обнаружены у взрослых, что позволяет предположить, что вирусы хронически поражают многих людей.
[12] Большинство исследователей твердо убеждены в том, что заражение ВГЧ-6В происходит в раннем возрасте, тогда как заражение ВГЧ-6А развивается позже.Оба варианта вируса были одновременно обнаружены у взрослых, что позволяет предположить, что вирусы хронически поражают многих людей.
Лабораторные исследования при ВГЧ-6 могут выявить лейкоцитоз, лейкопению и анемию.[13] У пациентов с трансплантацией почки и пациентов с дисфункцией печени следует провести исследования почек и печени соответственно, чтобы исключить нарушение электролитного баланса и гепатит.
Показания к рентгенологической визуализации зависят от клинической картины, особенно у лиц с ослабленным иммунитетом.Рентгенография грудной клетки может быть выполнена для исключения другой этиологии у взрослых, включая пневмонию и пневмонит. У детей потребность в визуализации возникает реже. Компьютерная томография (КТ) головы с контрастом или без него может быть получена для поиска других излечимых заболеваний. При поражении центральной нервной системы может быть выполнена люмбальная пункция. Инфекция HHV-6 в ЦНС часто имеет умеренный плеоцитоз с повышенным содержанием белка. СМЖ может быть отправлена на ПЦР-исследование HHV-6 для подтверждения диагноза.[14]
Инфекция HHV-6 в ЦНС часто имеет умеренный плеоцитоз с повышенным содержанием белка. СМЖ может быть отправлена на ПЦР-исследование HHV-6 для подтверждения диагноза.[14]
Лечение/управление
В настоящее время не существует утвержденного соединения, предназначенного исключительно для лечения ВГЧ-6, и нет доступной вакцины.[8] Обычно не рекомендуется проводить противовирусную профилактику инфекции HHV-6. Вместо этого рекомендуется проводить раннее противовирусное лечение, особенно в случаях энцефалита HHV-6. Рекомендуется терапия первой линии с внутривенным введением ганцикловира и фоскарнета с лечением в течение 3–4 недель.[15] У пациентов, перенесших трансплантацию стволовых клеток, лечение ганцикловиром имеет задокументированные преимущества и является рекомендуемым противовирусным препаратом выбора.[15]
Инфекции ВГЧ-6 у иммунокомпетентных детей проходят самостоятельно и не требуют лечения. Лечение младенцев с детской розеолой обычно поддерживающее.[12] Жаропонижающие, такие как ацетаминофен или ибупрофен, рекомендуются для лечения сильной лихорадки и лиц с риском фебрильных судорог. Если возникают фебрильные судороги, противоэпилептические средства не нужны. Лица с инфекцией HHV-6, проявляющейся поражением ЦНС, включая фебрильные судороги, должны быть госпитализированы.
Если возникают фебрильные судороги, противоэпилептические средства не нужны. Лица с инфекцией HHV-6, проявляющейся поражением ЦНС, включая фебрильные судороги, должны быть госпитализированы.
Дифференциальный диагноз
Дифференциальный диагноз входит:
инфекционный мононуклеоз
Вирусный гепатит
герпес симплекс вирус-инфекция
Meningitis
RUBLELLA
Вирусная пневмония
Лекарственная сыпь с эозинофилией и системными симптомами (DRESS-синдром)
У детей с классической детской розеолой этиологическим возбудителем является ВГЧ-6.Однако некоторые другие заболевания могут вызывать лихорадку и сыпь. Более тяжелые, менее доброкачественные причины таких симптомов требуют исключения. У иммунокомпетентных взрослых инфекция HHV-6 проявляется аналогично мононуклеозу. Таким образом, ВЭБ и ЦМВ следует исключить. Пациенты с ослабленным иммунитетом, особенно те, кому пересаживают органы, и больные СПИДом, как правило, имеют симптомы. Эта когорта лиц с заболеванием ВГЧ-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и DRESS-синдром.[16] Кроме того, существует документация о HHV-6 в случаях рассеянного склероза, энцефалита и интерстициального пневмонита.[17] Стоит отметить, что только HHV-6A связан с тиреоидитом Хашимото.[12]
Пациенты с ослабленным иммунитетом, особенно те, кому пересаживают органы, и больные СПИДом, как правило, имеют симптомы. Эта когорта лиц с заболеванием ВГЧ-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и DRESS-синдром.[16] Кроме того, существует документация о HHV-6 в случаях рассеянного склероза, энцефалита и интерстициального пневмонита.[17] Стоит отметить, что только HHV-6A связан с тиреоидитом Хашимото.[12]
Прогноз
Как правило, первичная инфекция HHV-6 проходит самостоятельно, и иммунокомпетентные люди выживают без осложнений.У людей с ослабленным иммунитетом в отчетах описано более тяжелое заболевание. Имеются документальные данные о пневмоните, гепатите и отторжении органов у пациентов с трансплантацией, а также о смерти пациентов с энцефалитом и менингоэнцефалитом.[18] Точно так же в Японии с 2003 по 2004 год обследование пациентов с энцефалитом, связанным с субитумной экзантемой, показало необычно плохой прогноз [19] с зарегистрированными смертельными исходами у двух детей с энцефалопатией, вторичной по отношению к инфекции HHV-6. У детей было обнаружено генетическое митохондриальное заболевание.[20]
У детей было обнаружено генетическое митохондриальное заболевание.[20]
Осложнения
Обычно первичная инфекция ВГЧ-6 протекает доброкачественно со спонтанным исчезновением через 5–7 дней. Наиболее частым осложнением детской розеолы являются фебрильные судороги. Дополнительные осложнения часто возникают из-за нейротрофических эффектов HHV-6, что особенно заметно в случаях поражения центральной нервной системы, например, в случаях менингоэнцефалита и энцефалопатии. В этих случаях вирус проникает в мозг во время первичной инфекции и может оставаться в спящем состоянии в тканях мозга.[21] Впоследствии появились записи о случаях острого или подострого энцефалита, иногда связанных с диффузной или многоочаговой демиелинизацией.[4] HHV-6 редко вызывает оппортунистическую инфекцию у лиц с ослабленным иммунитетом. Активность HHV-6A и HHV-6B была обнаружена после трансплантации почек, печени и костного мозга (BMT) [4].
Сдерживание и просвещение пациентов
У в остальном здорового младенца с детской розеолой обучение родителей имеет решающее значение для снижения беспокойства по поводу лихорадки и возможных фебрильных судорог.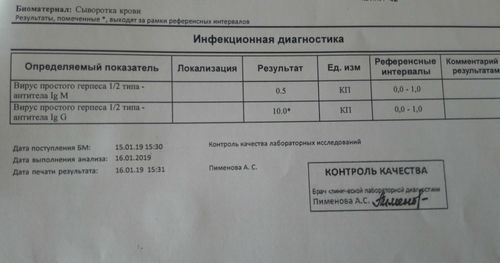 Важность поддерживающей терапии жаропонижающими средствами и бесполезность антибиотиков требуют объяснения. У лиц с ослабленным иммунитетом сложные симптомы и другие вторичные вирусные заболевания, которые могут сопровождать инфекцию HHV-6, являются поводом для консультирования с упором на раннее обращение за медицинской помощью при появлении симптомов.
Важность поддерживающей терапии жаропонижающими средствами и бесполезность антибиотиков требуют объяснения. У лиц с ослабленным иммунитетом сложные симптомы и другие вторичные вирусные заболевания, которые могут сопровождать инфекцию HHV-6, являются поводом для консультирования с упором на раннее обращение за медицинской помощью при появлении симптомов.
Pearls and Other Issues
Общепризнано, что HHV-6B является причинным вариантом, ответственным за большинство первичных инфекций, в то время как HHV-6A приобретается после HHV-6B в результате бессимптомной инфекции.[22]1. Отличие случаев первичной инфекции HHV-6 с типичной сыпью детской розеолы от других заболеваний является ключом к исключению более тяжелых диагнозов. Наиболее частым осложнением инфекции ВГЧ-6 является детская розеола, и на ВГЧ-6 приходится примерно 10–20 % лихорадочных заболеваний у детей в возрасте от 6 месяцев до 3 лет. Фебрильные судороги, симптомы со стороны желудочно-кишечного тракта и дыхательных путей встречаются реже и обычно проходят самостоятельно. Поддерживающая терапия с отдыхом и гидратацией является общепринятым подходом к лечению в этой подгруппе.Подобно другим вирусам герпеса, HHV-6 реплицируется в слюнных железах и находится в латентном состоянии в мононуклеарных клетках периферической крови. Диагностика ВГЧ-6 с помощью лабораторных исследований у иммунокомпетентного хозяина обычно не требуется. Тем не менее, ПЦР, серологические исследования или посев вируса часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Поддерживающая терапия с отдыхом и гидратацией является общепринятым подходом к лечению в этой подгруппе.Подобно другим вирусам герпеса, HHV-6 реплицируется в слюнных железах и находится в латентном состоянии в мононуклеарных клетках периферической крови. Диагностика ВГЧ-6 с помощью лабораторных исследований у иммунокомпетентного хозяина обычно не требуется. Тем не менее, ПЦР, серологические исследования или посев вируса часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Инфекция HHV-6 коррелирует с более тяжелыми заболеваниями, включая мононуклеоз, колит, миокардит и гепатит, в дополнение к документально подтвержденным осложнениям центральной нервной системы в виде энцефалита и менингоэнцефалита.Раннее распознавание и лечение неврологических осложнений являются неотъемлемой частью предотвращения неблагоприятных исходов. Дети и взрослые, больные раком, реципиенты аллогенных трансплантатов и лица с иммуносупрессивными расстройствами, подвержены риску реактивации ВГЧ-6. В таких случаях у людей может наблюдаться лихорадка, сыпь и снижение количества циркулирующих гранулоцитов и эритроидных клеток.[12] Хотя не существует утвержденных методов лечения исключительно инфекции HHV-6, противовирусное лечение ганцикловиром и/или фоскарнетом оказалось успешным в лечении неврологических осложнений, описанных ранее.
В таких случаях у людей может наблюдаться лихорадка, сыпь и снижение количества циркулирующих гранулоцитов и эритроидных клеток.[12] Хотя не существует утвержденных методов лечения исключительно инфекции HHV-6, противовирусное лечение ганцикловиром и/или фоскарнетом оказалось успешным в лечении неврологических осложнений, описанных ранее.
Улучшение результатов работы бригады здравоохранения
HHV-6 обычно проявляется сыпью как у детей, обращающихся в отделение неотложной помощи, так и у педиатров. Хотя определение сыпи может быть сложной задачей, выделение конкретных сопутствующих симптомов необходимо, чтобы различать более токсичные и доброкачественные заболевания. Большинство инфекций HHV-6 протекают бессимптомно, преходящи и не требуют противовирусного лечения. [Уровень II] Консультация педиатра является рекомендацией для младенцев с детской розеолой, у которых есть фебрильные судороги.Известны осложнения HHV-6, и людям с более зловещими признаками и симптомами, включая изменения психического статуса и недостаточность органов, может помочь межпрофессиональный подход. В таких случаях необходима консультация невролога и врача-инфекциониста. При подозрении на сердечную недостаточность, связанную с HHV-6, ранняя консультация кардиолога имеет решающее значение для лечения инфекционного миокардита у иммунокомпетентных взрослых пациентов.[23] [Уровень IV]
В таких случаях необходима консультация невролога и врача-инфекциониста. При подозрении на сердечную недостаточность, связанную с HHV-6, ранняя консультация кардиолога имеет решающее значение для лечения инфекционного миокардита у иммунокомпетентных взрослых пациентов.[23] [Уровень IV]
Скоординированный уход со стороны квалифицированных медсестер целесообразен для наблюдения за ухудшением состояния и изменениями показателей жизнедеятельности.Точно так же не следует сбрасывать со счетов лабораторную помощь в ускорении предпочтительных методов обнаружения вируса в крови или спинномозговой жидкости с помощью ПЦР или вирусного антигена в ткани с помощью иммуногистохимии. (Уровень II). Наконец, фармацевт является неотъемлемой частью обеспечения противовирусного лечения ганцикловиром и фоскарнетом при энцефалите, связанном с HHV-6.[24] [Уровень III] Для улучшения исходов в сложных случаях и обеспечения наилучших результатов рекомендуется совместный, ориентированный на пациента, межпрофессиональный командный подход между клиницистами, включая врачей, лабораторию, специально обученных медсестер и фармацевтов, открыто общающихся как команда здравоохранения. исходы пациента.[Уровень 5]
Рисунок
Это гистологический препарат вируса герпеса человека-6 (HHV-6), ранее известного как HBLV, типа вируса герпеса, открытого в октябре 1986 года. Это микрофотография зараженного клетки с тельцами включения как в ядре, так и в цитоплазме. (подробнее…)
Ссылки
- 1.
- Caserta MT, Mock DJ, Dewhurst S. Herpesvirus человека 6. Clin Infect Dis. 2001 г., 15 сентября; 33 (6): 829-33. [PubMed: 11512088]
- 2.
- Кладовая С.Н., Медвецкий П.Г. Латентность, интеграция и реактивация вируса герпеса человека-6. Вирусы. 24 июля 2017 г.; 9(7) [бесплатная статья PMC: PMC5537686] [PubMed: 28737715]
- 3.
- Элиассен Э., Лум Э., Притчетт Дж., Онгради Дж., Крюгер Г., Кроуфорд Дж. Р., Фан Т. Л., Аблаши Д., Хадналл С.Д. Вирус герпеса человека 6 и злокачественные новообразования: обзор. Фронт Онкол. 2018;8:512. [Бесплатная статья PMC: PMC6277865] [PubMed: 30542640]
- 4.
- Braun DK, Dominguez G, Pellett PE. Герпесвирус человека 6.Clin Microbiol Rev. 1997 Jul; 10(3):521-67. [Статья PMC бесплатно: PMC172933] [PubMed: 9227865]
- 5.
- Ансари А., Ли С., Абзуг М.Дж., Вайнберг А. Вирусы герпеса человека 6 и 7 и инфекция центральной нервной системы у детей. Эмердж Инфекция Дис. 2004 авг.; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247]
- 6.
- Agut H, Bonnafous P, Gautheret-Dejean A. Обновленная информация об инфекциях вирусами герпеса человека 6A, 6B и 7. Med Mal Infect. 2017 март; 47(2):83-91. [PubMed: 27773488]
- 7.
- Аблаши Д., Агут Х., Альварес-Лафуэнте Р., Кларк Д.А., Дьюхерст С., ДиЛука Д., Фламанд Л., Френкель Н., Галло Р., Гомпелс Ю.А., Хёльсберг П., Якобсон С., Луппи М., Луссо П., Мальнати М., Медвецкий P, Mori Y, Pellett PE, Pritchett JC, Yamanishi K, Yoshikawa T. Классификация HHV-6A и HHV-6B как отдельных вирусов. Арх Вирол. 2014 май; 159(5):863-70. [Бесплатная статья PMC: PMC4750402] [PubMed: 24193951]
- 8.
- De Bolle L, Naesens L, De Clercq E. Обновленная информация о биологии вируса герпеса человека 6, клинических особенностях и терапии.Clin Microbiol Rev. 2005 Jan; 18(1):217-45. [Бесплатная статья PMC: PMC544175] [PubMed: 15653828]
- 9.
- Tesini BL, Epstein LG, Caserta MT. Клинические последствия первичной инфекции розеоловирусами. Карр Опин Вирол. 2014 дек;9:91-6. [Бесплатная статья PMC: PMC4267952] [PubMed: 25462439]
- 10.
- Hall CB, Long CE, Schnabel KC, Caserta MT, McIntyre KM, Costanzo MA, Knott A, Dewhurst S, Insel RA, Epstein LG. Герпесвирусная инфекция человека-6 у детей. Проспективное исследование осложнений и реактивации.N Engl J Med. 1994 г., 18 августа; 331(7):432-8. [PubMed: 8035839]
- 11.
- Кристофоро Т., Ле Н.К., Рай-Бэкингем С., Хадсон В.Б., Кэрролл Л.Ф. Не очень мягкое пятно: патофизиология выпуклого родничка в связи с розеолой. Педиатр Неотложная помощь. 2020 окт; 36 (10): e576-e578. [PubMed: 29489601]
- 12.
- Agut H, Bonnafous P, Gautheret-Dejean A. Лабораторные и клинические аспекты инфекций, вызванных вирусом герпеса человека 6. Clin Microbiol Rev. 2015 Apr; 28(2):313-35. [Бесплатная статья PMC: PMC4402955] [PubMed: 25762531]
- 13.
- Арнеж М., Авшич-Жупанц Т., Уршич Т., Петровец М. Инфекция герпеса человека 6, представляющая собой острое лихорадочное заболевание, связанное с тромбоцитопенией и лейкопенией. Дело Rep Педиатр. 2016;2016:2483183. [Бесплатная статья PMC: PMC5131235] [PubMed: 27980872]
- 14.
- Яварян Дж., Гаввами Н., Мамиши С. Обнаружение вируса герпеса человека 6 в спинномозговой жидкости детей с возможным энцефалитом. Юндишапур Дж. Микробиолог. 2014 сен;7(9):e11821. [Бесплатная статья PMC: PMC4255374] [PubMed: 25485059]
- 15.
- Причард М.Н., Уитли Р.Дж. Разработка новых методов лечения вируса герпеса человека 6. Curr Opin Virol. 2014 дек.; 9:148-53. [Статья бесплатно PMC: PMC4267975] [PubMed: 25462447]
- 16.
- Shiohara T, Iijima M, Ikezawa Z, Hashimoto K. Диагноз DRESS-синдрома в достаточной степени установлен на основании типичных клинических признаков и реактивации вируса. . Бр Дж Дерматол. 2007 г., май; 156(5):1083-4. [PubMed: 17381452]
- 17.
- Маркс Г.Л., Нолан П.Е., Эрлих К.С., Эллис М.Н.Кожно-слизистая диссеминация устойчивого к ацикловиру вируса простого герпеса у больного СПИДом. Преподобный Заражает Дис. 1989 г., май-июнь; 11(3):474-6. [PubMed: 2546244]
- 18.
- Beović B, Pecaric-Meglic N, Marin J, Bedernjak J, Muzlovic I, Cizman M. Смертельный человеческий герпесвирус 6-ассоциированный многоочаговый менингоэнцефалит у взрослой пациентки. Scand J Infect Dis. 2001;33(12):942-4. [PubMed: 11868775]
- 19.
- Йошикава Т., Охаси М., Мияке Ф., Фудзита А., Усуи С., Сугата К., Суга С., Хашимото С., Асано Ю.Exanthem subitum-ассоциированный энцефалит: общенациональное исследование в Японии. Педиатр Нейрол. 2009 ноябрь; 41 (5): 353-8. [PubMed: 19818937]
- 20.
- Al-Zubeidi D, Thangarajh M, Pathak S, Cai C, Schlaggar BL, Storch GA, Grange DK, Watson ME. Смертельный человеческий герпесвирус 6-ассоциированный энцефалит у двух мальчиков с сопутствующими митохондриальными нарушениями POLG. Педиатр Нейрол. 2014 г., сен; 51 (3): 448-52. [PubMed: 25160553]
- 21.
- Mason EE, Printen KJ. Метаболические аспекты восстановления тонкой кишки после еюноилеального шунтирования.Хирургический гинекологический акушер. 1976 г., февраль; 142 (2): 177–83. [PubMed: 813311]
- 22.
- де Андраде РП. Многоцентровая клиническая оценка новой монофазной комбинации: Минулет (гестоден и этинилэстрадиол). Инт Дж. Фертил. 1989 Сентябрь; 34 Приложение: 22-30. [PubMed: 2576253]
- 23.
- Ashrafpoor G, Andréoletti L, Bruneval P, Macron L, Azarine A, Lepillier A, Danchin N, Mousseaux E, Redheuil A. Молниеносный миокардит, вызванный вирусом герпеса 6 человека, у иммунокомпетентного взрослого: роль магнитно-резонансная томография сердца в мультидисциплинарном подходе.Тираж. 03 декабря 2013 г .; 128 (23): e445-7. [PubMed: 24297820]
- 24.
- Le J, Gantt S., AST Сообщество специалистов по инфекционным заболеваниям. Вирус герпеса человека 6, 7 и 8 при трансплантации паренхиматозных органов. Ам Джей Трансплант. 2013 март; 13 Приложение 4: 128-37. [PubMed: 23465006]
Герпесвирус человека 6 (HHV-6) Инфекция: основы практики, фон, патофизиология
Автор
John L Kiley, MD Заместитель директора программы, Программа стипендий SAUSHEC по инфекционным заболеваниям, Медицинский факультет, Служба инфекционных заболеваний, Армейский медицинский центр Брук/Военно-медицинский центр Сан-Антонио, Консорциум санитарного просвещения силовых структур Сан-Антонио; доцент медицинского факультета Университета медицинских наук силовых структур; Доцент медицины, Центр медицинских наук Техасского университета в Сан-Антонио, Медицинская школа Лонга
Джон Л. Кили, доктор медицинских наук, является членом следующих медицинских обществ: Американский колледж врачей, Общество инфекционистов вооруженных сил, Общество инфекционистов of America
Раскрытие информации: Нечего раскрывать.
Соавтор (ы)
Дана М. Блит, доктор медицины доцент медицинского факультета Университета медицинских наук для силовых структур; адъюнкт-профессор медицинского факультета Центра медицинских наук Техасского университета в Медицинской школе Сан-Антонио; Штатный врач, Медицинское отделение, Служба инфекционных заболеваний, Армейский медицинский центр Брук, Военно-медицинский центр Сан-Антонио, Консорциум санитарного просвещения силовых структур Сан-Антонио (SAUSHEC)
Дана М. Блит, доктор медицинских наук, является членом следующих медицинских обществ: Американский колледж of Physicians, Американское общество инфекционистов
Раскрытие информации: Нечего раскрывать.
Главный редактор
Пранатарти Харан Чандрасекар, MBBS, MD Профессор, заведующий отделением инфекционных болезней, отделение внутренних болезней, Медицинский факультет Университета Уэйна
Пранатарти Харан Чандрасекар, MBBS, MD является членом следующих медицинских обществ: Американский колледж врачей , Американское общество микробиологии, Международное общество принимающих лиц с ослабленным иммунитетом, Американское общество инфекционных заболеваний
Раскрытие информации: Нечего раскрывать.
Дополнительные участники
Мишель Р. Сальваджио, доктор медицинских наук, FACP доцент кафедры внутренних болезней отделения инфекционных болезней Медицинского колледжа Университета Оклахомы; медицинский директор Института инфекционных заболеваний, директор отдела клинических испытаний, директор программ Райана Уайта, медицинский факультет, Центр медицинских наук Университета Оклахомы; Лечащий врач, Консультационная служба по инфекционным заболеваниям, Институт инфекционных заболеваний, Медицинский центр OU
Мишель Р. Сальваджо, доктор медицинских наук, FACP является членом следующих медицинских обществ: Американский колледж врачей, Американское общество инфекционных заболеваний
Раскрытие информации: Получены гонорары от Merck для выступлений и обучения.
Благодарности
Ручир Агравал, MD Заведующий отделением аллергии и иммунологии, Клиника Аврора Шебойган
Ручир Агравал, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии аллергии, астмы и иммунологии, Американской академии педиатрии, Американского колледжа аллергии, астмы и иммунологии и Американской медицинской ассоциации
.Раскрытие информации: Нечего раскрывать.
Дэвид Ф. Батлер, доктор медицины Профессор дерматологии, Медицинский колледж Техасского университета A&M; Заведующий кафедрой дерматологии, директор резидентуры по дерматологии, клиника Скотта и Уайта, клиника Нортсайд
Дэвид Ф. Батлер, доктор медицинских наук, является членом следующих медицинских обществ: Alpha Omega Alpha, Американской академии дерматологии, Американской медицинской ассоциации, Американского общества дерматологической хирургии, Американского общества хирургии MOHS, Ассоциации военных дерматологов и Phi Beta Kappa
.Раскрытие информации: Нечего раскрывать.
Франклин Флауэрс, доктор медицины Заведующий отделением дерматологии, профессор кафедры медицины и отоларингологии, адъюнкт-профессор педиатрии и патологии Медицинского колледжа Университета Флориды
Франклин Флауэрс, доктор медицинских наук, является членом следующих медицинских обществ: Американский колледж микрографической хирургии Мооса и онкологии кожи
.Раскрытие информации: Нечего раскрывать.
Рональд А. Гринфилд, доктор медицины Профессор кафедры внутренних болезней Медицинского колледжа Университета Оклахомы
Рональд А. Гринфилд, доктор медицинских наук, является членом следующих медицинских обществ: Американского колледжа врачей, Американской федерации медицинских исследований, Американского общества микробиологии, Центрального общества клинических исследований, Американского общества инфекционных заболеваний, Американского общества медицинской микологии, Phi Beta Kappa, Южное общество клинических исследований и Юго-западная ассоциация клинической микробиологии
Раскрытие информации: Pfizer Honoraria Выступления и преподавание; Галаад Гонорария Выступления и преподавание; Ortho McNeil Honoraria Говорение и преподавание; Эббот Гонорария Выступление и преподавание; Astellas Honoraria Разговорная речь и преподавание; кубистские гонорары Разговоры и преподавание; Forest Pharmaceuticals Говорение и обучение
Крис Джагар, MD Штатный врач отделения психиатрии Регионального медицинского центра Тринитас
Раскрытие информации: Нечего раскрывать.
Уильям Д. Джеймс, доктор медицинских наук Пол Р. Гросс Профессор дерматологии, заместитель председателя, директор резидентуры, отделение дерматологии, Медицинский факультет Пенсильванского университета
Уильям Д. Джеймс, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии дерматологии и Общества дерматологов-исследователей
.Раскрытие информации: Elsevier Royalty Другое
Sue J Jue, MD Адъюнкт-профессор кафедры педиатрии, секция инфекционных заболеваний, Университет Восточной Каролины
Раскрытие информации: Нечего раскрывать.
Ева Козеринска, MD Ассистент профессора неврологии, Комплексный центр эпилепсии, Медицинский центр Downstate Университета штата Нью-Йорк
Ева Козеринска, доктор медицинских наук, является членом следующих медицинских обществ: Sigma Xi
Раскрытие информации: Нечего раскрывать.
Леонард Крылов, MD Начальник отдела детских инфекционных болезней и международной усыновления, заместитель заведующего кафедрой педиатрии, профессор педиатрии, университетская больница Winthrop
Леонард Р. Крылов, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Американского педиатрического общества, Американского общества инфекционистов, Общества детских инфекционных заболеваний и Общества педиатрических исследований
.Раскрытие информации: грант Medimmune/финансовые исследования Клинические испытания; Medimmune Honoraria Говорение и преподавание; Плата за консультацию Medimmune Consulting
Ларри Лютвик, доктор медицины Профессор медицины, Медицинская школа Нижнего штата Нью-Йоркского государственного университета; Директор отдела инфекционных заболеваний по делам ветеранов New York Harbour Health Care System, Brooklyn Campus
Ларри Лютвик, доктор медицинских наук, является членом следующих медицинских обществ: Американского колледжа врачей и Американского общества инфекционистов
.Раскрытие информации: Нечего раскрывать.
Томас Дж. Марри, MD Декан медицинского факультета, Медицинский факультет Университета Далхаузи, Канада
Томас Дж. Марри, доктор медицинских наук, является членом следующих медицинских обществ: Alpha Omega Alpha, Американского колледжа врачей, Американского общества микробиологии, Канадского общества инфекционистов и Королевского колледжа врачей и хирургов Канады
.Раскрытие информации: Нечего раскрывать.
Джеффри Мефферт, MD Ассистент клинического профессора дерматологии Медицинской школы Техасского университета в Сан-Антонио
Джеффри Мефферт, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии дерматологии, Американской медицинской ассоциации, Ассоциации военных дерматологов и Техасского дерматологического общества
.Раскрытие информации: Нечего раскрывать.
Peter S Miele, MD Медицинский работник, Отдел противовирусных продуктов, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США
Peter S Miele, MD, является членом следующих медицинских обществ: American College of Physicians-American Society of Internal Medicine and Infectious Diseases Society of America
Раскрытие информации: Нечего раскрывать.
Роберт А. Шварц, MD, MPH Профессор и руководитель дерматологии, профессор патологии, педиатрии, медицины, профилактической медицины и общественного здравоохранения, Университет медицины и стоматологии Нью-Джерси, Медицинская школа Нью-Джерси
Роберт А. Шварц, доктор медицины, магистр здравоохранения, является членом следующих медицинских обществ: Alpha Omega Alpha, Американской академии дерматологии, Американского колледжа врачей и Sigma Xi
.Раскрытие информации: Нечего раскрывать.
Марго А. Смит, доктор медицины Заместитель директора программы, Департамент медицины, Вашингтонский больничный центр; Доцент, кафедра внутренних болезней, секция инфекционных болезней, Университет Джорджа Вашингтона
Марго А. Смит, доктор медицинских наук, является членом следующих медицинских обществ: Американское общество микробиологии
Раскрытие информации: Нечего раскрывать.
Russell W Steele, MD , заведующий отделением детских инфекционных заболеваний, Детский медицинский центр Окснера; Клинический профессор кафедры педиатрии Медицинской школы Тулейнского университета
Russell W Steele, MD, является членом следующих медицинских обществ: Американская академия педиатрии, Американская ассоциация иммунологов, Американское педиатрическое общество, Американское общество микробиологии, Американское общество инфекционных заболеваний, Медицинское общество штата Луизиана, Общество детских инфекционных заболеваний, Общество педиатрических исследований и Южная медицинская ассоциация
Раскрытие информации: Нечего раскрывать.
Франсиско Талавера, PharmD, PhD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Заработная плата Medscape
Мэри Л. Виндл, PharmD Адъюнкт-профессор Медицинского центра Университета Небраски, Фармацевтический колледж; Главный редактор Medscape Drug Reference
Раскрытие информации: Нечего раскрывать.
Вирус герпеса человека 6 — обзор
Хромосомная интеграция
Хромосомная интеграция вируса герпеса человека 6, или наследственный ВГЧ-6, может создавать проблемы при попытке диагностировать заболевание, связанное с ВГЧ-6.Хромосомная интеграция происходит, когда HHV-6 интегрируется в зародышевую клетку человека, и в результате потомство и последующие поколения имеют по крайней мере одну копию ДНК HHV-6 в каждой клетке своего тела. Следовательно, высокие уровни ДНК HHV-6 обнаруживаются в образцах крови, спинномозговой жидкости и тканей больных людей. Популяционные исследования показали, что хромосомно интегрированный HHV-6 присутствует примерно у 0,2–0,8% людей. 72,73 В условиях HCT высокие уровни ДНК HHV-6 обнаруживаются в крови реципиентов HCT с интегрированным HHV-6, а также у реципиентов HCT, у доноров которых интегрирован HHV-6. 74–76
Если донор HCT унаследовал HHV-6, уровни HHV-6 будут повышаться у реципиента с приживлением, и часто выявляются очень высокие уровни, особенно при тестировании цельной крови. 74,76 Например, у одного реципиента HCT, получившего трансплантат от донора с хромосомной интеграцией, в целом были обнаружены стойкие концентрации HHV-6 от 2,5×10 6 до 10×10 6 копий на мл. кровь после приживления. 74 В другом отчете у двух реципиентов HCT, получивших трансплантаты от доноров с хромосомной интеграцией, было 6.1×10 91 177 6 91 178 и 9,7×10 91 177 5 91 178 копий на мл в цельной крови после приживления, но только 3600 и 15 400 копий на мл в плазме соответственно. 76 Другие особенности хромосомной интеграции в донорских клетках заключаются в том, что уровни ДНК HHV-6 остаются постоянно и стабильно повышенными и не снижаются со временем или противовирусной терапией. 77 Следовательно, серийное тестирование и количественная оценка копий ДНК ВГЧ-6 на анализируемую клетку могут предоставить доказательства наследственного ВГЧ-6, если по крайней мере одна копия ВГЧ-6 на анализируемую клетку постоянно обнаруживается с течением времени.
В отличие от картины, наблюдаемой, когда реципиент HCT получает трансплантат от донора с хромосомной интеграцией с HHV-6, когда реципиент HCT унаследовал HHV-6, высокие уровни ДНК HHV-6 могут быть обнаружены в крови до до и сразу после трансплантации, а затем уровни снижаются при успешном приживлении.
Отличить наследственный ВГЧ-6 от заболевания, связанного с ВГЧ-6, может быть непросто, особенно при наличии единственного положительного результата. Это верно даже при интерпретации результатов образцов спинномозговой жидкости.Как отмечалось выше, высокие уровни ДНК HHV-6 могут быть обнаружены в спинномозговой жидкости у лиц с хромосомной интеграцией. Например, среди 21 пациента с предполагаемой хромосомной интеграцией ДНК ВГЧ-6 была обнаружена в спинномозговой жидкости со средним уровнем 4,0 log 10 копий на мл (95% ДИ, 3,5–4,5). 78 Это было выше, чем средний уровень, обнаруженный у иммунокомпетентных детей с первичной инфекцией HHV-6 (2,4 log 10 копий на мл, 95% ДИ, 1,0–3,7), но аналогичен уровням, обнаруженным у реципиентов HCT с HHV-6. 6 энцефалит.
Несмотря на эти проблемы, существуют стратегии, помогающие отличить интегрированное состояние от реактивации. Флуоресцентная гибридизация in situ (FISH) со специфическим зондом HHV-6, выполненная на препаратах метафазных хромосом из периферической крови, продемонстрирует интегрированный HHV-6. 74,79 Кроме того, в отличие от лиц с латентной инфекцией ВГЧ-6, у лиц с интегрированным ВГЧ-6 в волосяных фолликулах обнаруживается ВГЧ-6. 80 Таким образом, если метод FISH недоступен, можно провести амплификацию нуклеиновых кислот волосяных фолликулов на ДНК ВГЧ-6 для выявления человека с интегрированным ВГЧ-6.Это будет означать тестирование волосяных фолликулов донора в случае реципиента HCT, у донора которого подозревается интегрированный HHV-6. Когда есть подозрение на интегрированный HHV-6 в донорских клетках HCT, тестирование донорской сыворотки или цельной крови с амплификации нуклеиновой кислоты HHV-6 может предоставить подтверждающие доказательства интегрированного HHV-6. 76,80 Как HHV-6A, так и HHV-6B могут быть интегрированы и переданы по наследству. Поскольку подавляющее большинство случаев реактивации после HCT связано с HHV-6B, обнаружение HHV-6A может быть ключом к хромосомно интегрированному HHV-6. 3,6,7
Неизвестно, могут ли реципиенты HCT с интегрированным HHV-6 реактивировать HHV-6 и страдать от таких осложнений, как энцефалит или дисфункция центральной нервной системы. Сообщалось о случае энцефалита у иммунокомпетентного пациента с интегрированным ВГЧ-6. 81 Несмотря на то, что была проведена тщательная оценка и альтернативная этиология не была выявлена, причинно-следственная связь остается неопределенной. Кроме того, в другом отчете о случае описаны два брата и сестры с интегрированным ВГЧ-6 и когнитивной дисфункцией.Оба пациента, по-видимому, ответили на противовирусную терапию. 82
Возможность хромосомно интегрированного или наследственного ВГЧ-6 следует рассматривать в условиях высоких и персистирующих уровней ДНК ВГЧ-6 в периферической крови, особенно если у пациента нет клинических признаков энцефалита и/или уровень виремии не снижается после начала противовирусной терапии с активностью в отношении ВГЧ-6.
Вирус герпеса человека 6 | Клинические инфекционные болезни
Аннотация
Развитие методов культивирования лимфоидных клеток и выделения вирусов, поражающих эти клетки, привело к открытию вируса герпеса человека (ВГЧ) 6 в 1986 году.В то время HHV-6 был первым новым вирусом герпеса человека, обнаруженным примерно за четверть века, и его выделение ознаменовало начало эры открытий в герпесвирусологии с идентификацией HHV-7 и HHV-8. саркома Капоши — ассоциированный герпесвирус) в течение следующего десятилетия. Как и большинство вирусов герпеса человека, HHV-6 распространен повсеместно и способен вызывать пожизненную латентную инфекцию своего хозяина. HHV-6 особенно эффективен при заражении младенцев и детей младшего возраста, а первичное заражение вирусом связано с детской розеолой (exanthem subitum) и, чаще всего, с недифференцированным лихорадочным заболеванием.Вирусная реактивация у хозяина с ослабленным иммунитетом связана с различными заболеваниями, включая энцефалит, а ВГЧ-6 предположительно связан с рассеянным склерозом. В этой статье обсуждаются основные свойства HHV-6, его связь с заболеваниями человека и патобиологическое значение реактивации вируса.
В-лимфотропный вирус человека был впервые выделен в 1986 г. из мононуклеарных клеток периферической крови (РВМС) лиц с ВИЧ-инфекцией или лимфопролиферативными заболеваниями.Впоследствии было установлено, что вирус обладает широким тропизмом к клеткам-хозяевам, включая Т-клетки, и вирус был обозначен как «вирус герпеса человека 6 (HHV-6)».
HHV-6 был этиологически связан с заболеванием человека в 1988 г., когда Yamanishi et al. [1] описали ассоциацию вируса с exanthem subitum (детской розеолой). Впоследствии было обнаружено, что HHV-6 является вездесущим агентом, который поражает почти всех людей в раннем детстве и способен реактивироваться как у здоровых людей, так и у людей с ослабленным иммунитетом.Масштабы и характер заболевания, вызванного ВГЧ-6, еще предстоит полностью определить, особенно у лиц с реактивированной инфекцией. Цель этого обзора — сосредоточиться на биологии ВГЧ-6, так как она имеет отношение к пониманию потенциальных патогенных механизмов ВГЧ-6, а также рассмотреть информацию об ассоциациях заболеваний, уделяя особое внимание тем состояниям, которые могут быть связаны с ВГЧ-6. с реактивацией вируса.
Основы
Эпидемиология и первичная инфекция. Первичное заражение HHV-6 происходит в течение первых 2 лет жизни и обычно связано с недифференцированным лихорадочным заболеванием, хотя у части детей обнаруживаются классические проявления детской розеолы (exanthem subitum; обзор в [2, 3]). В большом проспективном исследовании североамериканских детей пик заболеваемости HHV-6 был в возрасте 6–9 месяцев; наиболее последовательной клинической картиной инфекции было внезапное начало высокой лихорадки (средняя температура 39,6°C) [4].Другие распространенные проявления инфекции включали воспаление барабанных перепонок и раздражительность [5]. Примечательно, что сыпь, характерная для розеолы, была обнаружена либо во время болезни, либо после снижения температуры только у ~20% пациентов с первичной инфекцией HHV-6 [5]. Средняя продолжительность болезни составила 6 дней, а наиболее частым осложнением первичной инфекции HHV-6 были фебрильные судороги; это произошло у 13% исследованных детей [4].
В целом первичная инфекция HHV-6 является основной причиной острого лихорадочного заболевания у детей раннего возраста.Это также является основной причиной обращений в отделение неотложной помощи, госпитализаций и фебрильных судорог. На острую инфекцию ВГЧ-6 приходилось 20% обращений в отделение неотложной помощи по поводу лихорадочных заболеваний среди детей в возрасте 6–8 месяцев; 13% этих детей были госпитализированы [4]. Эти результаты указывают на экономическую значимость инфекции HHV-6 и подчеркивают важность проведения правильного дифференциального диагноза, чтобы избежать ненужного использования антибиотиков. Однако относительно неспецифический характер симптомов заболевания, ассоциированного с ВГЧ-6, и нечастое появление классической сыпи, связанной с розеолой, затрудняют точную диагностику первичной инфекции ВГЧ-6.Следовательно, может быть полезно разработать экспресс-тест на эту инфекцию, чтобы не применять неэффективные методы лечения и/или дорогостоящие лабораторные тесты к этому распространенному самоизлечивающемуся заболеванию.
После первичной инфекции HHV-6 вирусный геном сохраняется в мононуклеарных клетках периферической крови (PBMC), возможно, в клетках миелоидного происхождения. Вирус также, по-видимому, сохраняется в слюнных железах, и вирусная ДНК может быть рутинно обнаружена в слюне с помощью ПЦР [2]. ДНК HHV-6 также была идентифицирована в спинномозговой жидкости детей как во время, так и после первичной инфекции, а также в тканях головного мозга иммунокомпетентных взрослых при вскрытии, что указывает на то, что ЦНС является дополнительным местом либо латентного, либо персистентного вируса [6]. .
Вирусология. Опубликовано много информации об основах вирусологии и генетики HHV-6; это было рассмотрено в другом месте [2, 3] и кратко обобщено в таблице 1. HHV-6 представляет собой β-герпесвирус, в основном тесно связанный с HHV-7 и несколько более отдаленно связанный с цитомегаловирусом человека (CMV).
Таблица 1
Биология вируса герпеса человека 6 (HHV-6).
Таблица 1
Биология вируса герпеса человека 6 (ВГЧ-6).
Были распознаны две группы штаммов HHV-6: вариант A и вариант B. Эти вирусы примерно на 88% идентичны на уровне нуклеотидов, а полные последовательности репрезентативных изолятов доступны через GenBank (http://www.ncbi .nlm.nih.gov:80/cgi-bin/Entrez/framik?dbpGenome&gip10586; http://www.ncbi.nlm.nih.gov/cgi-bin/Entrez/framik?dbpGenome&gip15112). Почти во всех исследованиях HHV-6B оказался преобладающим штаммом, обнаруживаемым как у здоровых людей, так и у людей с ослабленным иммунитетом. Неясно, связаны ли различия в обнаружении HHV-6A и HHV-6B с разным тканевым тропизмом, различиями в способе или возрасте заражения, различиями в способности реактивироваться и вызывать заболевания человека или географическим распространением этих вирусов. [2, 3].
Иммунология. CD46 является важным компонентом мембранного рецептора ВГЧ-6 [7]. Он также является рецептором штамма Эдмонстона вируса кори и функционирует как регуляторный белок комплемента, присутствующий на поверхности всех ядерных клеток; это согласуется с широким клеточным тропизмом HHV-6 (таблица 1).
Основной клеткой-мишенью для ВГЧ-6 являются зрелые Т-клетки CD4 + , и вирус оказывает плейотропное действие на клетки иммунной системы, которое включает способность нарушать регуляцию продукции клеточных цитокинов, модулировать функцию естественных клеток-киллеров, и модифицировать экспрессию ключевых рецепторов клеточной поверхности, включая CD3, CD4 и CXCR4 [8–10].Некоторые из этих свойств могут быть связаны с кодируемыми вирусом иммунорегуляторными молекулами, которые включают 2 гомолога хемокиновых рецепторов (U12, U51), функциональный хемокин (U83) и гомолог OX-2 (U85) [11–14].
HHV-6 у хозяина с ослабленным иммунитетом
Трансплантация костного мозга. ВГЧ-6 можно культивировать из РВМС реципиентов трансплантата костного мозга (ТКМ), но вирус нельзя культивировать из крови здоровых взрослых людей.Таким образом, было высказано предположение, что реактивация HH-6 может способствовать заболеванию у хозяина с ослабленным иммунитетом (таблица 2). Хотя точную частоту реактивации определить трудно, примерно у 30-45% реципиентов ТКМ развивается виремия ВГЧ-6 в течение первых нескольких недель после трансплантации.
Таблица 2
Возникновение инфекций, вызванных вирусом герпеса человека 6, у хозяев с ослабленным иммунитетом.
Таблица 2
Возникновение инфекций, вызванных вирусом герпеса человека 6, у хозяев с ослабленным иммунитетом.
Множественные осложнения были связаны с HHV-6 в условиях трансплантации костного мозга; однако трудно провести окончательную связь между вирусной инфекцией и заболеванием из-за повсеместного распространения и персистенции вируса почти у всех взрослых. Одной из ассоциаций, которая была выявлена в большинстве исследований, является развитие лихорадки и сыпи, связанных с виремией HHV-6 после трансплантации. Также сообщалось о низкой частоте других проявлений заболевания, ранее связанных с HHV-6, включая супрессию костного мозга, пневмонит и энцефалит (обзор в [15]), а также сообщалось о реакции «трансплантат против хозяина» у некоторых людей (обзор в [16]).Тем не менее, похоже, что бессимптомная реактивация HHV-6 преобладает в пост-ТКМ [17]. Таким образом, патогенетическое значение реактивации HHV-6 у реципиентов BMT остается неопределенным.
Трансплантация солидных органов. У различной доли пациентов с трансплантацией почки (до 66% в некоторых исследованиях) происходит реактивация или повторное инфицирование ВГЧ-6, что подтверждается выделением вируса или ПЦР-анализом. Реактивация чаще всего происходит после лечения отторжения органа ОКТ3 или антитимоцитарным глобулином и, вероятно, связана со значительной степенью иммуносупрессии, связанной с этими двумя продуктами.В некоторых сообщениях предполагается связь между реактивацией HHV-6 и отторжением трансплантата, но это остается неопределенным. Реактивация ВГЧ-6, однако, приводит к последующей реактивации ЦМВ [18], хотя недавнее проспективное исследование 52 пациентов с трансплантацией почки пришло к выводу, что не было доказательств того, что ВГЧ-6 оказывает негативное влияние на клинический исход [18]. Реактивация HHV-6 также была описана у пациентов с трансплантацией печени. В этих условиях высокие нагрузки ДНК CMV и HHV-6 были независимо связаны с подтвержденным биопсией отторжением трансплантата (обзор в [16]).
ВИЧ-инфекция 1 типа (ВИЧ-1). У лиц с ВИЧ-1-инфекцией наблюдается частая реактивация ВГЧ-6, о чем свидетельствует выделение ВГЧ-6А у ряда ВИЧ-1-положительных людей в конце 1980-х годов. Описано несколько случаев ВГЧ-6-ассоциированного заболевания у ВИЧ-1-положительных лиц (включая пневмонит и энцефалит) [19]. Однако считается, что у большинства ВИЧ-1-позитивных взрослых реактивация ВГЧ-6 оказывает минимальное влияние на прогрессирование заболевания [20].Напротив, у младенцев с вертикальной инфекцией ВИЧ-1 первичная инфекция ВГЧ-6 была связана с более быстрым прогрессированием заболевания в течение первого года жизни [21]. Необходимы дополнительные исследования, чтобы полностью понять, какую роль может играть инфекция HHV-6 в прогрессировании инфекции ВИЧ-1.
Синдром хронической усталости. У лиц с синдромом хронической усталости наблюдается ряд иммунологических нарушений, свидетельствующих об иммуносупрессии, включая, согласно некоторым исследованиям, реактивацию латентных вирусов герпеса, таких как HHV-6.В популярных средствах массовой информации и в других источниках было высказано предположение, что реактивация ВГЧ-6 может быть причинно вовлечена в патогенез синдрома хронической усталости, но аналогичные утверждения также были сделаны для различных инфекционных и неинфекционных причин. Нет убедительных доказательств того, что HHV-6 играет роль в синдроме хронической усталости, хотя необходимы дополнительные исследования этого изнурительного расстройства.
ВХВ-6 и ЦНС
Фебрильные судороги. Первичная инфекция ВГЧ-6 связана с фебрильными судорогами у младенцев и детей младшего возраста [4].Эта связь была особенно выражена у детей в возрасте 12–15 месяцев; в этой возрастной группе у 36% детей с первичной инфекцией ВГЧ-6 были судороги по сравнению с 13% детей с лихорадочными заболеваниями, не связанными с ВГЧ-6 [4]. Параллельное исследование на основе ПЦР выявило персистенцию вируса после первичной инфекции как в РВМС, так и в спинномозговой жидкости [6]. HHV-6A, хотя в целом редко, чаще обнаруживался в ЦСЖ, чем в РВМС. Тем не менее, HHV-6A по-прежнему обнаруживался гораздо реже, чем HHV-6B, даже в образцах СМЖ (HHV-6A был обнаружен отдельно или в сочетании с HHV-6B только в 17% положительных образцов СМЖ, тогда как только HHV-6B был обнаружен только в 17% положительных образцов СМЖ). в 83% таких проб) [6].
В последующем проспективном исследовании среди детей, у которых первые фебрильные судороги были вызваны HHV-6, частота повторных фебрильных судорог была значительно ниже, чем среди контрольной группы, у которых первоначальные фебрильные судороги были вызваны другими причинами (20% против 0,40% соответственно, P <0,04) [22].Однако Suga et al. [23] обнаружили, что частота более тяжелых форм судорог и постиктального паралича была достоверно выше среди детей с первичной инфекцией ВГЧ-6, чем среди детей без такой инфекции.Ясно, что необходимы дополнительные исследования, чтобы разрешить эти данные и выяснить долгосрочное неврологическое значение фебрильных судорог, связанных с HHV-6.
ВГЧ-6 как причина менингита или энцефалита. Как отмечалось выше, HHV-6 считается причиной энцефалита у реципиентов трансплантации (обзор в [15]). Вирус также считается причиной менингита и энцефалита у иммунокомпетентных лиц. В ретроспективном исследовании 138 хорошо изученных пациентов с очаговым энцефалитом неизвестной этиологии у 9 была обнаружена ДНК ВГЧ-6 в спинномозговой жидкости, тогда как результаты ПЦР и серологических анализов на другие герпесвирусы были отрицательными [24].Клинические исходы в этих предполагаемых случаях очагового энцефалита, ассоциированного с HHV-6, варьировали от полного выздоровления (в 4 случаях) до умеренных нарушений и смерти (в 1 случае) [24].
Поиск непосредственной роли ВГЧ-6 в развитии энцефалита у больных СПИДом дал противоречивые результаты. HHV-6 был обнаружен у 14-месячного ВИЧ-позитивного ребенка, у которого в анамнезе была лихорадка, вялость и судороги при поступлении и у которого развился молниеносный энцефалит, который привел к смерти через 5 дней после поступления.При вскрытии с помощью иммуногистохимии были обнаружены инфицированные HHV-6 клетки в пораженном сером веществе [25]. Признаки активной инфекции HHV-6, выявляемые иммуногистохимической локализацией вирусных белков в зонах демиелинизации, также были обнаружены у 4 из 6 неотобранных взрослых больных СПИДом [26]. Однако в других исследованиях антигены HHV-6 не могли быть обнаружены в мозговой ткани детей или взрослых со СПИДом, хотя ДНК HHV-6 можно было легко визуализировать путем гибридизации in situ в олигодендроцитах белого вещества и в других типах клеток [27]. , 28].
Вопрос о том, насколько часто ДНК ВГЧ-6 можно обнаружить в нормальной ткани головного мозга, рассматривался в нескольких исследованиях; совсем недавно исследование 31 нормальной ткани головного мозга с использованием ПЦР в растворе показало, что ДНК HHV-6 присутствует примерно в одной трети образцов [29]. В совокупности эти данные свидетельствуют о том, что HHV-6 в целом является непатогенным резидентным вирусом человеческого мозга с потенциалом нейровирулентности. Этот вывод подтверждается исследованиями in vitro, демонстрирующими способность HHV-6 вызывать ограниченную или минимально продуктивную инфекцию микроглии, астроцитов и олигодендроцитов человека.
ВГЧ-6 инфекция белого вещества ЦНС. Роль HHV-6 как потенциального агента демиелинизации белого вещества вызвала значительный интерес в последние годы. Об ассоциации между ВГЧ-6 и рассеянным склерозом (РС), наиболее распространенным демиелинизирующим заболеванием ЦНС человека, сообщили Challoner et al. [30] в 1995 г. Экспрессия белка HHV-6 была обнаружена в олигодендроцитах перилезиона в головном мозге 12 из 15 пациентов с РС, но не у 41 контрольного человека.Аналогичные результаты недавно были получены двумя другими группами [31, 32]; однако Коутс и Белл не смогли воспроизвести эти результаты в своей серии исследований тканей мозга из 23 МС с использованием тех же серологических реагентов, что и Challoner et al. [33].
Результаты как ПЦР, так и серологических исследований одинаково противоречивы. Солдан и др. [34] обнаружили ДНК ВГЧ-6 в бесклеточной сыворотке у 30% пациентов с рецидивирующим/ремиттирующим течением РС (предполагая наличие активной репликации ВГЧ-6) по сравнению с 0 (0%) из 47 контрольных лиц без РС.Повышенный IgM-ответ на вирус также был обнаружен у 73% пациентов с РС по сравнению с 18% пациентов без РС [34]. Напротив, в нескольких других исследованиях не удалось обнаружить бесклеточную ДНК HHV-6 в образцах сыворотки и спинномозговой жидкости, полученных от пациентов с РС [35-37]. Таким образом, хотя потенциальная связь ВГЧ-6 с РС провокационна, она во многом не доказана. Кроме того, следует отметить, что многие вирусы ранее были вовлечены в этиологию РС, но ни один из них не был причинно связан с заболеванием.
Недавние данные свидетельствуют о том, что ВГЧ-6 может играть роль в патогенезе другого демиелинизирующего заболевания: прогрессирующей многоочаговой лейкоэнцефалопатии (ПМЛ). ПМЛ представляет собой первичное демиелинизирующее заболевание ЦНС, возникающее почти исключительно у лиц с тяжелым нарушением клеточного иммунитета; вирус полиомы JC общепризнан как этиологический агент этого заболевания. В комбинированном исследовании, в котором применялась как ПЦР in situ, так и иммуноцитохимия, в демиелинативных поражениях ПМЛ была обнаружена высокая частота олигодендроцитов, коинфицированных HHV-6 и экспрессирующих белки вируса JC [28].Белки HHV-6 не были обнаружены в головном мозге контрольной группы, в том числе у 18 пациентов со СПИДом, но без ПМЛ. Актуальность этих невропатологических исследований для патогенеза ПМЛ и роли HHV-6 как потенциального кофактора демиелинизации еще предстоит определить.
Выводы
HHV-6 — вездесущий паразит, эффективно колонизировавший подавляющее большинство населения Земли. Он с большой эффективностью распространяется в раннем детстве и устанавливает устойчивые пожизненные отношения со своим носителем.Первичная вирусная инфекция часто сопровождается лихорадкой, которая может проявляться или не проявляться в виде классической розеолы (exanthem subitum). У взрослых может произойти реактивация вируса, особенно в контексте иммуносупрессивной терапии или заболевания. Исходы таких реактиваций могут включать редкие случаи энцефалита, пневмонита, отторжения трансплантата и бессимптомных инфекций (которые преобладают).
Недавно было высказано предположение, что вирус играет роль в РС, хотя данные остаются неполными и неубедительными.Также существует давний интерес к возможному участию HHV-6 в синдроме хронической усталости, но нет убедительных данных, подтверждающих эту предполагаемую связь. В целом, биологические свойства и патогенный потенциал HHV-6 остаются не полностью описанными и требуют дальнейшего изучения.
Каталожные номера
1, , , и др.Идентификация вируса герпеса человека-6 как возбудителя экзантемы субитум
,Ланцет
,1988
, том.1
(стр.1065
—7
)2, , .Вирус герпеса человека 6: новый патоген
,Emerg Infect Dis
,1999
, vol.5
(стр.353
—66
)3, , .Герпесвирус человека 6
,Clin Microbiol Rev
,1997
, vol.10
(стр.521
—67
)4, , , и др.Инфекция, вызванная вирусом герпеса-6 человека у детей: проспективное исследование осложнений и реактивации
331
(стр.432
—8
)5, , , и др.Первичная инфекция вирусом герпеса 6 человека у детей раннего возраста
326
(стр.1445
—50
)6, , , и др.Нейроинвазия и персистенция вируса герпеса человека 6 у детей
,J Infect Dis
,1994
, vol.170
(стр.1586
—9
)7, , , и др.CD46 представляет собой клеточный рецептор вируса герпеса человека 6
,Cell
,1999
, vol.99
(стр.817
—27
)8, , , и др.Продуктивная инфекция популяций и клонов зрелых Т-клеток CD4 + и CD8 + человека вирусом герпеса 6 человека: снижение транскрипции CD3
,J Immunol
,1991
, vol.147
(стр.685
—91
)9, , , и др.Индукция CD4 и восприимчивость к ВИЧ-1 у человека CD8 + Т-лимфоциты вирусом герпеса человека 6
,Nature
,1991
, vol.349
(стр.533
—5
)10, , .Вирус герпеса-6 человека усиливает цитотоксичность естественных клеток-киллеров посредством IL-15
97
(стр.1373
—81
)11, , , и др.Понижающая регуляция линии макрофагов посредством взаимодействия с OX2 (CD200)
290
(стр.1768
—71
)12, , , и др.Связывание и подавление RANTES новым рецептором β-хемокинов вируса герпеса-6 человека
,J Immunol
,2000
, vol.164
(стр.2396
—404
)13, , , , .Вирус герпеса человека 6 с открытой рамкой считывания U12 кодирует функциональный рецептор β-хемокинов
72
(стр.6104
—12
)14, , , и др.Вирус герпеса человека 6 с открытой рамкой считывания U83 кодирует функциональный хемокин
,J Virol
,1999
, vol.73
(стр.5926
—33
)15, .Энцефалит, вызванный вирусом герпеса человека-6 у реципиентов трансплантатов: актуальность нового нейротропного вируса
69
(стр.2474
—9
)16, , .Бетагерпесвирусы у реципиентов трансплантатов
,J Antimicrob Chemother
,2000
, vol.45
(стр.29
—34
)17, , , и др.Инфекции вирусом герпеса человека 6 после трансплантации костного мозга: клинические и вирусологические проявления
,J Infect Dis
,1999
, vol.179
(стр.311
—8
)18, , , и др.Реактивация вируса герпеса человека 6 связана с цитомегаловирусной инфекцией и синдромами у реципиентов почечного трансплантата с риском первичной цитомегаловирусной инфекции
178
(стр.1783
—6
)19, .Диссеминированные активные инфекции ВГЧ-6 у больных СПИДом
,Ланцет
,1994
, том.343
(стр.577
—8
)20, , , , .ДНК вируса герпеса человека 6 в клетках крови мужчин, инфицированных вирусом иммунодефицита человека: корреляция высоких уровней с высоким количеством клеток CD4
169
(стр.1342
—5
)21, , , и др.Первичная инфекция вирусом герпеса человека 6 у детей с вертикальной инфекцией вирусом иммунодефицита человека 1 типа
,J Infect Dis
,1999
, том.180
(стр.50
—5
)22, , , и др.Риск повторных судорог после первичных фебрильных судорог, вызванных вирусом герпеса человека 6
,Pediatr Infect Dis J
,1998
, vol.17
(стр.43
—8
)23, , , и др.Клинические и вирусологические анализы 21 ребенка с экзантемой субитум (детская розеола) и осложнениями со стороны центральной нервной системы
33
(стр.597
—603
)24, , .Вирус герпеса человека 6 ассоциирован с очаговым энцефалитом.
,Clin Infect Dis
,1995
, vol.21
(стр.571
—6
)25, , .Фульминантный энцефалит человека, вызванный вирусом герпеса 6 типа, у младенцев, инфицированных вирусом иммунодефицита человека
45
(стр.288
—92
)26, .Активная инфекция центральной нервной системы вирусом герпеса человека (HHV-6) у больных СПИДом
9
(стр.69
—73
)27, , , и др.Клеточная локализация вируса герпеса человека-6 в головном мозге детей со СПИД-энцефалопатией
,J Нейровирол
,1995
, том.1
(стр.30
—9
)28, , , и др.Ассоциация вируса герпеса человека 6 с демиелинизирующими поражениями прогрессирующей многоочаговой лейкоэнцефалопатии
,J Нейровирол
,1999
, том.5
(стр.363
—73
)29, , , и др.Инфекция вируса герпеса 6 человека в опухолевых и нормальных тканях головного мозга
63
(стр.45
—51
)30, , , и др.Ассоциированная с бляшками экспрессия вируса герпеса человека 6 при рассеянном склерозе
92
(стр.7440
—4
)31, , , и др.Вирус герпеса человека 6 типа и рассеянный склероз: системные активные инфекции у пациентов с ранним заболеванием
,Clin Infect Dis
,2000
, том31
(стр.894
—903
)32, , , и др.Ассоциация вируса герпеса-6 человека и МС
,Мульт Склер
,1999
, том.5
(стр.355
—62
)33, .HHV-6 и рассеянный склероз
,Nat Med
,1998
, vol.4
(стр.537
—8
)34, , , и др.Ассоциация вируса герпеса человека 6 (ВГЧ-6) с рассеянным склерозом: повышенный ответ IgM на ранний антиген ВГЧ-6 и обнаружение ДНК ВГЧ-6 в сыворотке
3
(стр.1394
—7
)35, , , , .Вирус герпеса человека 6 находится в латентной форме в периферической крови пациентов с рецидивирующе-ремиттирующим рассеянным склерозом
67
(стр.529
—31
)36, , , .Анализ с помощью полимеразной цепной реакции последовательностей вируса герпеса-6 человека в сыворотке и спинномозговой жидкости пациентов с рассеянным склерозом
5
(стр.134
—9
)37, , , и др.Отсутствие семи вирусов герпеса человека, включая HHV-6, по данным полимеразной цепной реакции в спинномозговой жидкости и крови пациентов с рассеянным склерозом и невритом зрительного нерва
95
(стр.280
—3
)© 2001 Американского общества инфекционистов
.



 Все это может быть признаками синдрома хронической усталости или некоторых других вирусных заболеваний. Но точную диагностику и лечение герпеса 6 типа в СПб можно получить в специализированных клиниках, имеющих возможность проводить специальные тесты и использовать в терапии данные самых последних научных исследований.
Все это может быть признаками синдрома хронической усталости или некоторых других вирусных заболеваний. Но точную диагностику и лечение герпеса 6 типа в СПб можно получить в специализированных клиниках, имеющих возможность проводить специальные тесты и использовать в терапии данные самых последних научных исследований.





 Дж., Вайнберг А. Вирусы герпеса человека 6 и 7 и инфекция центральной нервной системы у детей. Эмердж Инфекция Дис. 2004 авг.; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247]
Дж., Вайнберг А. Вирусы герпеса человека 6 и 7 и инфекция центральной нервной системы у детей. Эмердж Инфекция Дис. 2004 авг.; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247]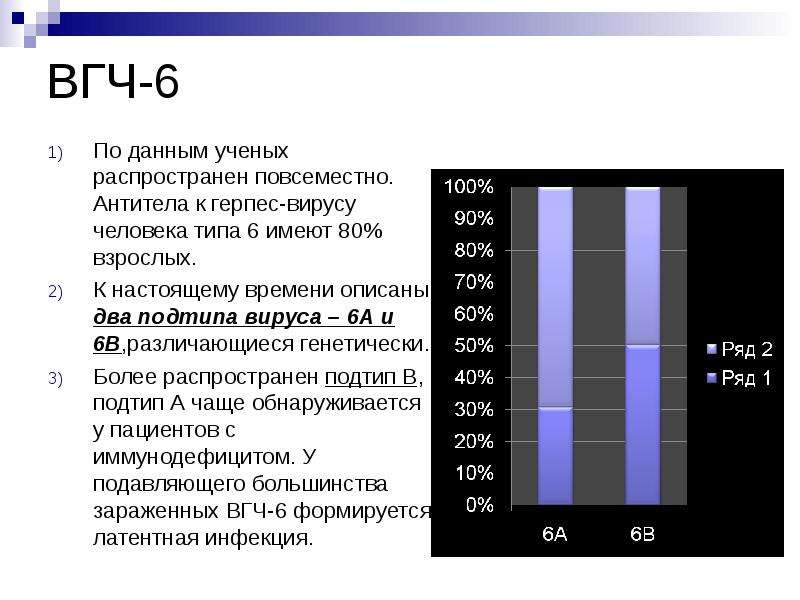 [Бесплатная статья PMC: PMC544175] [PubMed: 15653828]
[Бесплатная статья PMC: PMC544175] [PubMed: 15653828]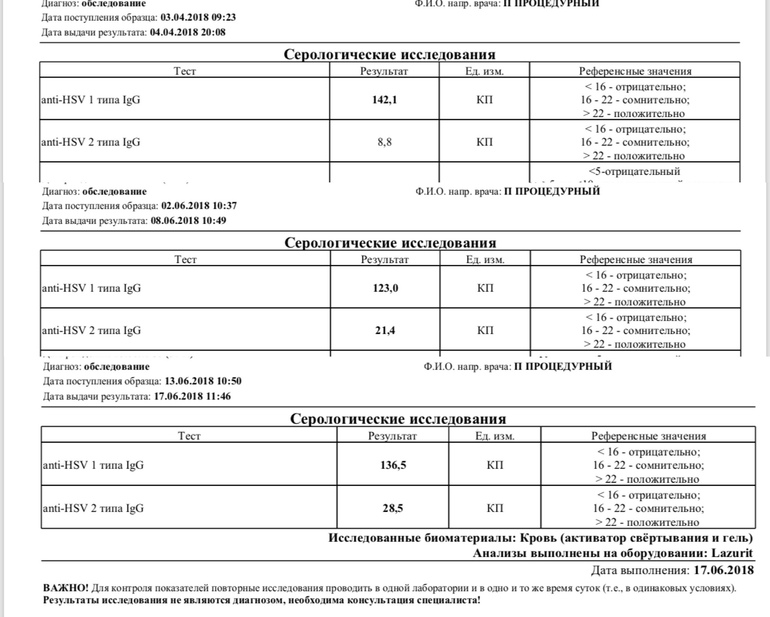 [Бесплатная статья PMC: PMC4402955] [PubMed: 25762531]
[Бесплатная статья PMC: PMC4402955] [PubMed: 25762531] . Бр Дж Дерматол. 2007 г., май; 156(5):1083-4. [PubMed: 17381452]
. Бр Дж Дерматол. 2007 г., май; 156(5):1083-4. [PubMed: 17381452]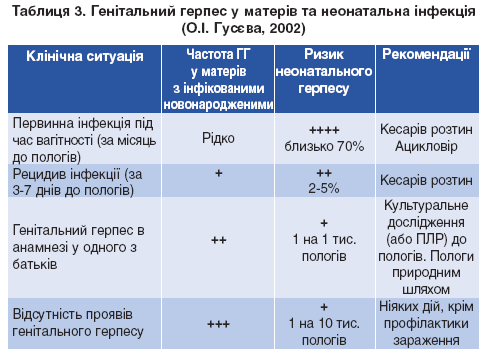 Педиатр Нейрол. 2014 г., сен; 51 (3): 448-52. [PubMed: 25160553]
Педиатр Нейрол. 2014 г., сен; 51 (3): 448-52. [PubMed: 25160553] Ам Джей Трансплант. 2013 март; 13 Приложение 4: 128-37. [PubMed: 23465006]
Ам Джей Трансплант. 2013 март; 13 Приложение 4: 128-37. [PubMed: 23465006]
 Герпесвирус человека 6.Clin Microbiol Rev. 1997 Jul; 10(3):521-67. [Статья PMC бесплатно: PMC172933] [PubMed: 9227865]
Герпесвирус человека 6.Clin Microbiol Rev. 1997 Jul; 10(3):521-67. [Статья PMC бесплатно: PMC172933] [PubMed: 9227865]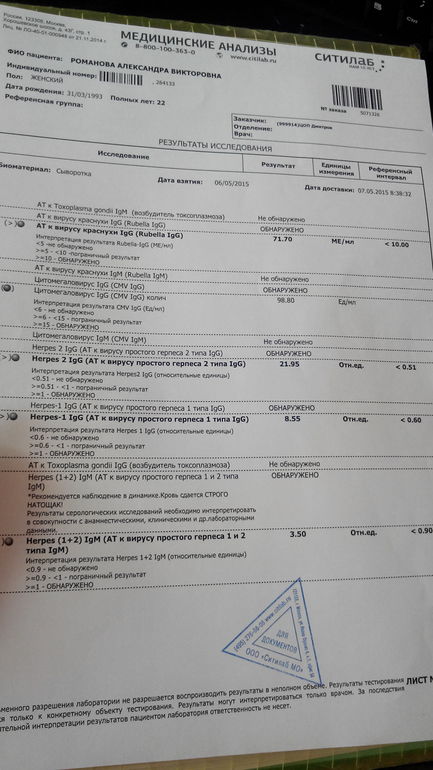


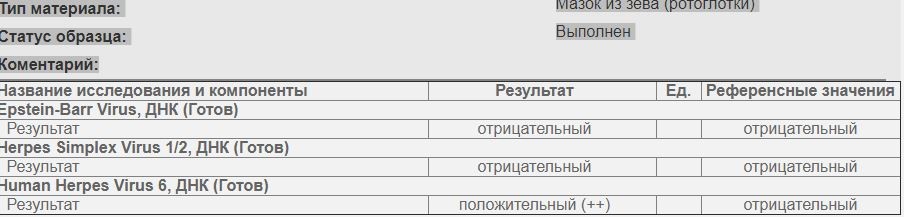 [PubMed: 19818937]
[PubMed: 19818937] Тираж. 03 декабря 2013 г .; 128 (23): e445-7. [PubMed: 24297820]
Тираж. 03 декабря 2013 г .; 128 (23): e445-7. [PubMed: 24297820] Дж., Вайнберг А. Вирусы герпеса человека 6 и 7 и инфекция центральной нервной системы у детей. Эмердж Инфекция Дис. 2004 авг.; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247]
Дж., Вайнберг А. Вирусы герпеса человека 6 и 7 и инфекция центральной нервной системы у детей. Эмердж Инфекция Дис. 2004 авг.; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247] [Бесплатная статья PMC: PMC544175] [PubMed: 15653828]
[Бесплатная статья PMC: PMC544175] [PubMed: 15653828] [Бесплатная статья PMC: PMC4402955] [PubMed: 25762531]
[Бесплатная статья PMC: PMC4402955] [PubMed: 25762531] . Бр Дж Дерматол. 2007 г., май; 156(5):1083-4. [PubMed: 17381452]
. Бр Дж Дерматол. 2007 г., май; 156(5):1083-4. [PubMed: 17381452] Педиатр Нейрол. 2014 г., сен; 51 (3): 448-52. [PubMed: 25160553]
Педиатр Нейрол. 2014 г., сен; 51 (3): 448-52. [PubMed: 25160553] Ам Джей Трансплант. 2013 март; 13 Приложение 4: 128-37. [PubMed: 23465006]
Ам Джей Трансплант. 2013 март; 13 Приложение 4: 128-37. [PubMed: 23465006]