Нормы толщины эндометрия | Базанов Павел Александрович
Сегодня мы продолжаем цикл статей, посвященных значению маточного фактора при вопросе планирования беременности. И начнем мы разговор с самого частого вашего запроса – поговорим об эндометрии и его нормах. Лайк за полезную статью, добавляйте пост в закладки!
⠀
Сначала разберемся, что такое эндометрий. Эндометрий — внутренняя слизистая оболочка тела матки, выстилающая полость матки и обильно снабжённая кровеносными сосудами. Основная функция эндометрия – это создание наиболее благоприятных условий для имплантации плодного яйца в стенку матки и дальнейшего благополучного развития беременности.
Эндометрий состоит из 2 слоев: базального и функционального. Верхний функциональный слой ежемесячно отторгается в виде кровянистых менструальных выделений, но благодаря уникальной регенерирующей способности базального слоя, восстанавливается уже в следующем цикле.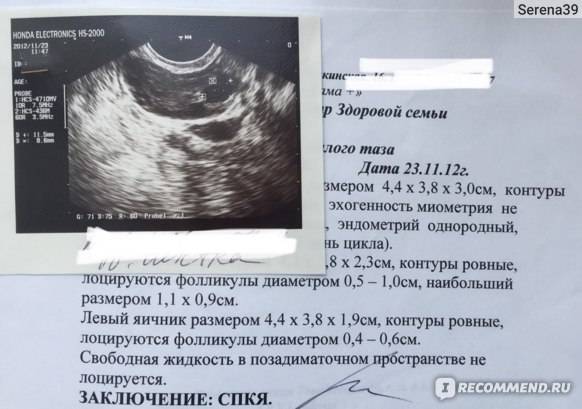 Базальный слой не теряется в ходе менструального цикла и служит, таким образом, фундаментом для функционального слоя.
Базальный слой не теряется в ходе менструального цикла и служит, таким образом, фундаментом для функционального слоя.
⠀
Нормы толщины эндометрия меняются по дням цикла под влиянием женских половых гормонов, так во второй фазе менструального цикла, он значительно утолщается, обильнее кровоснабжается. В организме идет тщательная подготовка к имплантации эмбриона, но если беременность не наступает, то функциональный слой отторгается, и начинается менструация. ⠀
Имплантация – загадочный и до конца не изученный процесс. Большинство научных исследований последних лет сводятся к тому, что основную роль в нем играет сам эмбрион. Но все же, функциональность эндометрия, его структура, а также толщина тоже имеют большое значение.
Чтобы убедиться в отсутствии у женщин патологий матки врач может назначить ряд обследований: анализы на гормоны, УЗИ-мониторинг в разные дни цикла, допплер сосудов матки, а также гистероскопию.
В норме толщина эндометрия, в зависимости от фазы цикла, должна вписываться в следующие показатели:
•В фазу ранней пролиферации (4-7 дни цикла) толщина колеблется в пределах 3-7 мм, составляя в среднем 6 мм.
•На 8-10 дни цикла (средняя пролиферация) эндометрий несколько утолщается — в среднем до 10 мм (колебания 5-10 мм).
•В фазу поздней пролиферации (11-14 дни) эндометрий утолщается до 11 мм (колебания 7-13 мм).
•Для фазы ранней секреции (15-18 дни) характерны колебания в пределах 10-15 мм, составляя в среднем 11 мм.
•В фазу средней секреции (19-23 дни) эндометрий достигает максимальной толщины — в среднем 14 мм (колебания 10-16 мм).
•На 24-27 дни цикла (поздняя секреция) толщина эндометрия чуть уменьшается — в среднем 12 мм (колебания 10-16 мм). Среди нарушений структуры эндометрия принято выделять гиперплазию (утолщение) и гипоплазию («тонкий» эндометрий), об этом и многом другом мы обязательно с вами поговорим в новых постах.
Забегая вперед отмечу, что современная медицина предлагает широкий спектр вариантов для лечения маточных патологий. Грамотное и комплексное лечение в большинстве случаев приводит к долгожданному результату – наступлению беременности и рождению здорового ребенка. Все обязательно будет хорошо.
Мы с коллегами будем рады ответить на ваши вопросы.
Нарушение менструального цикла
Здравствуйте! Последняя менструация была 18 июня. До этого цикл 27-30 дней. А сегодня уже 41. Тесты на беременность показывают отрицательный результат. Я была на Узи на 35 день — эндометрий 13 мм, второй раз была на 40 день — 5 мм. Врач говорит, что беременности нет, яичники в норме, матка в норме, кист нет и вообще не видит причин задержки, и что месячных пока можно не ожидать. Ответьте пожалуйста, мог ли так измениться эндометрий, можно ли исключить беременность и что теперь делать?
Толщина эндометрия 5 мм для беременности не характерна.
Учитывая отрицат. результат тестов, отсутствие признаков беременности при УЗИ беременность можно исключить.
Изменение толщины эндометрия с 13 до 5 мм за короткое время маловероятно. При УЗИ может указываться толщина одного слоя эндометрия, либо М-эхо (толщина двух слоев). Возможно, в первом случае 13 мм — М-эхо; во втором — 5мм — толщина одного слоя.
Причиной задержки месячных могут быть стрессы, переутомление, смена климата, физические нагрузки, прием ряда лекарств и многое другое. Задержка месячных 1раз в год на фоне регулярного цикла причиной для беспокойства не является. Однако, если нарушения цикла повторяются — стоит обратиться к врачу и пройти гормональное обследование.
Здравствуйте. Можно ли считать цикл нормальным, если его продолжительность постоянно 35-37 дней(первая фаза-21-23 дня, вторая-14 дней)?
Повода для переживаний на сегодняшний день нет, так как у Вас регулярный двуфазный цикл.
Но при планировании беременности , при нарушениях овариально-менструального цикла, для исключения скрытых дисфункций гипоталамо-гипофизарного комплекса необходимо провести дообследование. Мы будем рады Вам в этом помочь.
Мне 20.месячные идут долго, около 7-8 дней, а потом практически еще 2 недели идут коричневые выделения, не сильно.иногда болит спина, особенно перед началом цикла, другого дискомфорта не испытываю. Но к сожалению к гинекологу я не могу попасть в виду своей большой загруженности на работе.
В данной ситуации стоит найти время и обратиться к гинекологу. Помимо осмотра врача обязательно УЗИ на 10-11 день.
Откладывать надолго посещение врача не стоит. Т.к. существует риск возникновения острой ситуации (обильное кровотечение), и в этом случае может встать вопрос о госпитализации.
Во время месячных и последующих коричневых выделений самостоятельно можно принимать отвары трав, уменьшающих кровопотерю и способствующих сокращению матки(крапива, пастушья сумка, кровохлебка). Обязательно прием поливитаминов.
Подскажите, пожалуйста, может ли такое быть. Я измеряю БТ, 1-я фаза была 36,3-36,5, с 13 по 15 дни была цервикальная слизь, но на 14-й день, у меня было отравление алкоголем, и температура именно после это подскочила до 37,1, но на сл. день сразу же упала до 36,5(причем в этот день тоже была слизь). Уже 17-й день, а температура вчера была 36,6, сегодня 36,5. Что это может означать, что не было овуляции или яйцеклетка созрела и сразу же погибла. Могло ли это быть после отравления алкоголем.
Вероятно, этот цикл был ановуляторным. При приеме алкоголя увеличивается основной обмен, что и могло быть причиной повышения базальной температуры ( при правильном ее измерении). В среднем продолжительность жизни яйцеклетки после овуляции составляет 12-14 часов ( до 24 часов), в этот период прямого контакта с общим кровотоком нет.
Принимаю дюфастон 5 месцев с 5 по 25 день по поводу миомы с гиперполименореей. В середине последнего цикла были мажущие крови 2 дня. Одну таблетку (на 25 день)не выпила. Сейчас второй день нормальных menses, которые пришли в срок. Курс был назначен на полгода. Вопрос — может, стоит сделать перерыв сейчас, учитывая мазню, или допивать шестой месяц? Пожалуйста, ответьте, так как сейчас я вне пределов досягаемости врача.
Мажущие выделения в середине цикла могут свидетельствовать о недостаточной дозе препарата. В таких случаях дозу обычно увеличивают. Прерывать прием препарата не стоит, лучше увеличить его дозировку.
Скажите пожалуйста, после первого приема микрофолина(14 дн) и прогестерона (10 дн)на какой день будет менструально-подобная реакция и когда начинать второй цикл приема препаратов?
После окончания приема прогестерона обычно делают перерыв на 7 дней — в этот период появляется менструально-подобная реакция.
 По окончании 7-мидневного перерыва начинают прием нового курса.
По окончании 7-мидневного перерыва начинают прием нового курса.У меня бывают постоянные задержки месячных, по три месяца, врач прописал дюфастон и после прихода месячных пить противозачаточные таблетки. С чем могут быть связаны такие задержки, к кому обратиться, может быть необходимо, сделать какие-то анализы, врачи ничего не говорят. А я очень хотела бы в ближайшее время забеременить, но очень страшно, врач сказал, что после того как я брошу пить таблетки, сразу смогу забеременить, я попробывала и ничего не получилось, только опять результат задержки.
Действительно, здесь необходимо дообследование.
Графики базальной температуры, УЗИ органов малого таза, возможно, гормональное обследование по дням менструального цикла.
Но прежде, консультация гинеколога-эндокринолога, для того чтобы определиться с тактикой, с последовательностью действий.
Задержки и ненаступление, скорее всего связаны с нарушением работы яичников и, возможно, других эндокринных органов.

Нарушение работы яичников приводит к нерегулярным овуляциям и менструациям. А это проявляется клинически в нарушенном менструальном цикле и ненаступлении беременности.
Если срок ненаступления беременности превышает 12 месяцев, обследование можно расширить.
У меня в 2001г.были роды с осложнениями — остатки плаценты, спустя 10 дней после родов было сложное выскабливание, потеря большого количества крови. До 1года я кормила ребенка грудью. Вот уже больше года как я его не кормлю, а месячные так и не наступают. (беременность исключена). Каждый месяц выделяется мазня коричневого (без крови) цвета в очень мизерном количестве (пол дня), и все. Анализы на гормоны прошла все и неоднократно. Все они по показателям находятся в пределах нормы. Пробовала принимать контрацептивы — Регулон. Картина не изменилась. выделения не усилились. УЗИ без патологий.
Подскажите, может ли это быть проявлениями нарушения эндометрия послеродового выскабливания? Если да, то что мне предпринять??? Если это спаечный процесс, то возможно ли его отследить на УЗИ ?
Я очень хочу иметь еще детей. Но чувствую себя в свои 27 лет неполноценной.
Вы правы. Отсутствие месячных может быть следствием травматизации полости матки при выскабливании. В гинекологии выделяют отдельное заболевание — синдром Ашермана — прекращение менструаций после выскабливания вследствие образования спаек и рубцовой ткани в полости матки. При этом гормональное обследование отклонений не выявляет. В ряде случаев изменения в полости матки видны при УЗИ. Назначение гормональных контрацептивов, как правило, не приводит к улучшению ситуации, т.к. контрацептивы подавляют пролиферацию (рост) эндометрия (слизистой полости матки), но может быть использовано в качестве диагностического теста. Для подтверждения диагноза и лечения проводят гистероскопию и при необходимости рассечение спаек и удаление измененной ткани.

У меня диагноз — маточная форма аменореи.(после родов чрезмерное выскабливание). Месячные отсутствуют уже 1, 5 года. Инфекций нет, гормоны в норме.
На прием гормональных контрацептивов (Антеовин) — нет изменений. Все такие же скудные выделения коричевого цвета в течении одного дня в месяц. УЗИ патологий не выявляет, эндометрий не нарастает, 19 день цикла -6мм.
Скажите пожалуйста, видны ли на УЗИ внутриматочные синехии, могут ли они являться препятствием наступлению месячных?
Наличие внутриматочных синехий и разделение их можно установить при гистероскопии. На УЗИ не всегда их видно.
Если причина — нарушение базального слоя эндометрия, то — лечение может быть неэффективным, хотя до конца диагноз установить трудно, и всё-таки нужно пробовать проводить лечение, как гормональное, так и витаминотерапию.

Тонкий эндометрий. Пути решения проблемы
По данным отечественных и зарубежных авторов, распространенность бесплодия достигает 10—15%, в некоторых регионах России — 20%, а частота самопроизвольного выкидыша в I триместре беременности сохраняется на уровне 16% [1]. Снижение женской фертильности имеет множество причин, среди которых на долю маточного фактора бесплодия в изолированном или сочетанном варианте приходится 24—62%. Известно, что распространенность патологических изменений эндометрия при бесплодии достигает 88%, при неэффективных попытках экстракорпорального оплодотворения (ЭКО) — 77,5% [2, 3]. В настоящее время установлено, что состояние эндометрия играет важную роль в причинах бесплодия и невынашивания беременности у женщин. Толщина и зрелость эндометрия хорошо просматриваются при УЗИ влагалищным датчиком. Перед имплантацией толщина его должна составлять не менее 8 мм [4, 5]. Известно, что чем тоньше эндометрий, тем меньше шансов на благоприятный исход беременности. Поэтому в современной литературе существует термин «тонкий эндометрий», так как именно он является наиболее сложным и до конца неизученным феноменом в современной репродуктологии. Достаточная толщина эндометрия очень важна для нормальной имплантации эмбриона в полости матки [6]. Важно отметить, что частота наступления беременности уменьшается у пациенток с низким маточным кровотоком, что свидетельствует о тесной взаимосвязи кровоснабжения матки и рецептивности эндометрия [7, 8].
Поэтому в современной литературе существует термин «тонкий эндометрий», так как именно он является наиболее сложным и до конца неизученным феноменом в современной репродуктологии. Достаточная толщина эндометрия очень важна для нормальной имплантации эмбриона в полости матки [6]. Важно отметить, что частота наступления беременности уменьшается у пациенток с низким маточным кровотоком, что свидетельствует о тесной взаимосвязи кровоснабжения матки и рецептивности эндометрия [7, 8].
Методы лечения, направленные на увеличение толщины эндометрия, включают противовоспалительную терапию, интенсивное назначение препаратов эстрогенов и прогестерона, препаратов, улучшающих маточный кровоток, хирургические вмешательства, физиотерапевтические процедуры [9]. Однако последние анализы накопленного клинического материала свидетельствуют о недостаточной эффективности предложенных методов лечения с целью увеличения толщины и рецептивности эндометрия и, главное, безопасности. В течение многих лет разрабатываются способы внутриматочного воздействия, обладающие, главным образом, противовоспалительным и иммуномодулирующим свойствами, поэтому более приемлемы в практике предварительной подготовки эндометрия. Методы улучшения морфофункционального состояния эндометрия непосредственно в фертильном цикле ограничены, но их разумное применение может повысить успех как спонтанного зачатия, так и программ вспомогательных репродуктивных технологий [10]. Это и потребовало поиска новых подходов к решению проблемы лечения пациенток с тонким эндометрием и проведение дальнейших научно-практических исследований.
Методы улучшения морфофункционального состояния эндометрия непосредственно в фертильном цикле ограничены, но их разумное применение может повысить успех как спонтанного зачатия, так и программ вспомогательных репродуктивных технологий [10]. Это и потребовало поиска новых подходов к решению проблемы лечения пациенток с тонким эндометрием и проведение дальнейших научно-практических исследований.
Нами была запатентована методика лечения пациенток с тонким эндометрием с использованием аутоплазмы, содержащей тромбоциты. Аутоплазма, содержащая тромбоциты, вводилась внутриматочно в количестве 0,5—1 мл и парацервикально на глубину 0,5 см, в подслизистый слой, объемом по 1,5 мл с одной и с другой стороны на 17 и 19 часах [11].
Не являющаяся токсичной или иммунореактивной аутоплазма, содержащая тромбоциты, ускоряет естественные механизмы регенерации благодаря наличию в тромбоцитах факторов роста.
Кроме того, аутоплазма, содержащая тромбоциты, модулирует и регулирует функцию первичных факторов роста. Упомянутое свойство отличает факторы роста тромбоцитарной аутоплазмы от рекомбинантных факторов роста, каждый из которых отвечает за отдельный механизм регенерации.
Упомянутое свойство отличает факторы роста тромбоцитарной аутоплазмы от рекомбинантных факторов роста, каждый из которых отвечает за отдельный механизм регенерации.
Цель исследования — увеличить толщину и структуру эндометрия у пациенток с «тонким эндометрием» и бесплодием путем внутриматочного орошения аутоплазмой, содержащей тромбоциты, и парацервикального подслизистого ее введения для успешного наступления беременности.
Материал и методы
Обследованы 40 женщин в возрасте от 25 до 35 лет с первичным или вторичным бесплодием и наличием «тонкого эндометрия», не отвечающего на проведенные ранее гормональную стимуляцию или физиотерапевтическое лечение. Средний возраст пациенток составил 27 лет. Всем пациенткам проводилось комплексное обследование, включающее сбор анамнестических данных, стандартные клинико-лабораторные исследования, исследование гормонального профиля на 2—3-й день менструального цикла, УЗИ органов малого таза на 5—7-й день менструального цикла, доплерометрию и пайпель-биопсию эндометрия на 7—11-й день менструального цикла.
Контроль эффективности проводился путем УЗ-мониторинга с измерением толщины эндометрия и допплерометрии кровотока на 7, 9 и 12-й дни менструального цикла. Все пациентки на 8-й день менструального цикла были рандомизированы на 2 группы: с умеренным отставанием развития эндометрия — М-эхо≥5 мм (n=24) и экстремальным отставанием развития эндометрия — М-эхо<5 мм (n=16). Каждая из групп в зависимости от получаемой терапии делилась еще на две. Пациенткам 1-й подгруппы (n=14) с умеренным отставанием развития эндометрия на фоне лечения препаратами заместительной гормональной терапии (ЗГТ) проводилось внутриматочное орошение и подслизистое введение аутоплазмы, содержащей тромбоциты; 2-ю подгруппу (n=10) с умеренным отставанием развития эндометрия составляли пациентки, которые получали ЗГТ в виде монотерапии, без стимуляции регенерации тромбоцитарной аутоплазмой. В 3-ю подгруппу (n=8) вошли пациентки с экстремальным отставанием развития эндометрия (М-эхо <5 мм), которым также на фоне лечения препаратами ЗГТ проводилось внутриматочное орошение и парацервикальное подслизистое введение аутоплазмы, содержащей тромбоциты. Пациентки 4-й подгруппы (n=8) с экстремальным отставанием развития эндометрия получали только препараты ЗГТ.
Пациентки 4-й подгруппы (n=8) с экстремальным отставанием развития эндометрия получали только препараты ЗГТ.
В предполагаемом фертильном цикле, особенно при проведении стимуляции функции яичников, у женщин с «тонким эндометрием» обосновано применение препаратов ЗГТ (эстрогенов). Нами использовались трансдермальные формы эстрогенов (дивигель), которые обладают рядом преимуществ перед пероральным приемом эстрадиола ввиду высокой биодоступности и возможности легкого варьирования дозы. Препараты эстрадиола могут назначаться и на этапе подготовки к фертильному циклу в случаях, когда причиной «тонкого эндометрия» является овариальная недостаточность. Доза подбиралась индивидуально под контролем УЗИ (величина М-эха эндометрия). Эстрогены назначались по 21-дневной схеме, в течение последних 10 дней их сочетали с прогестинами (дидрогестерон 10—20 мг/сут, микронизированный прогестерон 200 мг/сут).
Внутриматочное и парацервикальное введение аутоплазмы, содержащей тромбоциты, осуществлялось в качестве прегравидарной подготовки, на фоне ЗГТ, в позднюю фазу пролиферации (9-й или 10-й день) менструального цикла однократно в течение 3 менструальных циклов. Несомненным преимуществом введения аутоплазмы, содержащей тромбоциты, является усиление кровоснабжения слизистой оболочки тела матки, а также сочетанное противовоспалительное воздействие с улучшением ростовых функций, что позволяет проводить лечение с соблюдением принципа «пролиферация без воспаления». При исследовании биоптатов эндометрия определяли следующие иммуногистохимические маркеры: трансформирующий фактор роста (TGF) и фактор роста эндотелия сосудов (VEGF).
Несомненным преимуществом введения аутоплазмы, содержащей тромбоциты, является усиление кровоснабжения слизистой оболочки тела матки, а также сочетанное противовоспалительное воздействие с улучшением ростовых функций, что позволяет проводить лечение с соблюдением принципа «пролиферация без воспаления». При исследовании биоптатов эндометрия определяли следующие иммуногистохимические маркеры: трансформирующий фактор роста (TGF) и фактор роста эндотелия сосудов (VEGF).
Важным следует признать не только длительное, не менее 6 мес сохранение эффекта терапии, но и нарастание положительной динамики. Это свидетельствует о способности аутоплазмы, содержащей тромбоциты, восстанавливать собственный регенеративный потенциал женских репродуктивных органов.
Статистическая обработка полученных данных для определения различий толщины эндометрия в группах сравнения проводилась с применением метода сравнения параметров по Стьюденту. Различия считали статистически значимыми при р<0,05.
Результаты
Исходный мониторинг продемонстрировал сходные нарушения созревания эндометрия у всех пациенток. Достоверный (р<0,05) рост толщины эндометрия в пролиферативной фазе цикла по сравнению с исходными показателями был отмечен после терапии с использованием орошения полости матки аутоплазмой, содержащей тромбоциты, уже на 3-м месяце наблюдения в 1-й и 3-й подгруппах, тогда как только ЗГТ не давала значимого эффекта. Полученный положительный результат сохранялся до 6-го месяца наблюдения в 3-й подгруппе и еще больше прогрессировал в 1-й. Таким образом, влияние аутоплазмы, содержащей тромбоциты, на эндометрий оказалось более значимым по сравнению с терапией, включавшей только препараты ЗГТ.
При проведении иммуногистохимического исследования у пациенток, получавших лечение по поводу «тонкого эндометрия» аутоплазмой, содержащей тромбоциты в 1-й и 3-й подгруппах, определялось повышение экспрессии важнейших регуляторов регенерации TGF — 5,1±0,4 и VEGF — 4,7±0,9 по сравнению с экспрессией таковых у пациенток 2-й и 4-й подгрупп, где проводилась только ЗГТ, соответственно 1,9±0,1, 1,8±0,5 и 1,7±0,1, 1,5±0,5, благодаря чему происходили усиление кровоснабжения в слизистой оболочке матки и стимуляция роста эндометрия.
При допплерометрии в 1-й и 3-й подгруппах визуализировалась равномерная васкуляризация эндометрия и суб-эндометриального слоя, а во 2-й и 4-й подгруппах отмечались уменьшение кровотока эндометрия и отсутствие суб-эндометриального кровотока.
Частота наступления беременности была оценена у 20 женщин с бесплодием, 12 из них получили курс стимуляции овуляции (предыдущие попытки стимуляции были безуспешными). Беременность наступила у 11 (55%) пациенток: у 7 из 7 женщин 1-й подгруппы, у 1 из 5 пациенток 2-й подгруппы, у 3 из 4 пациенток 3-й подгруппы, в 4-й подгруппе женщин беременность не наступила ни у кого. У 4 пациенток 1-й подгруппы беременность наступила на 3-м месяце лечения, у остальных пациенток этой подгруппы беременность наступила на 4-м месяце. У пациенток 3-й подгруппы беременность наступила на 5-м месяце лечения.
Сравнение межгрупповых различий по эффективности терапии не представляется возможным из-за малого числа наблюдений и существенных различий факторов бесплодия в группах.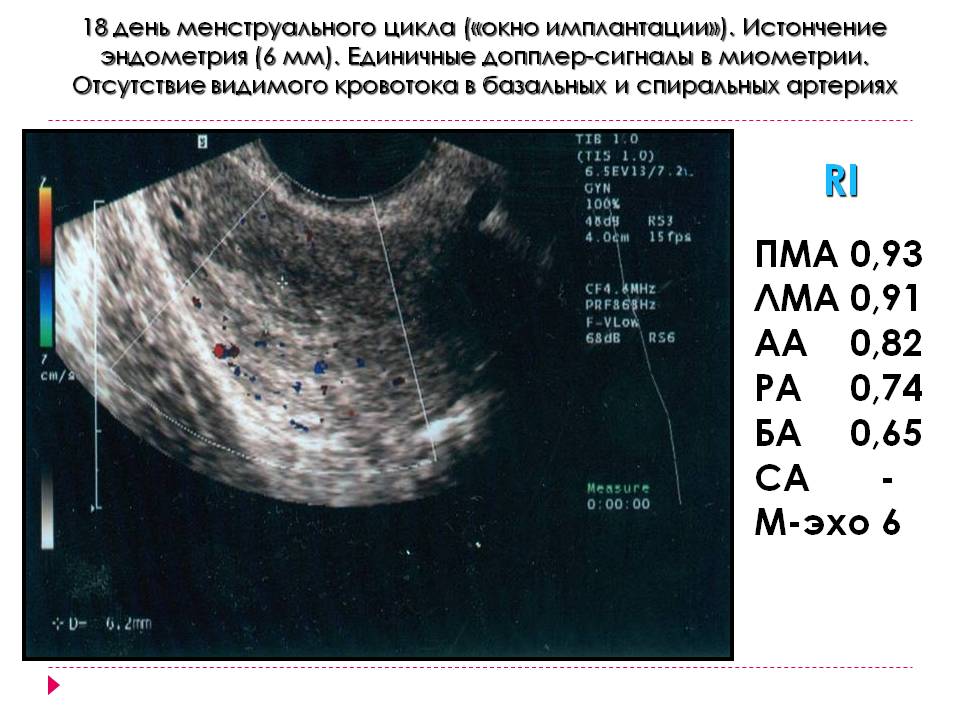 Однако наметилась тенденция. Следует признать высокий потенциал внутриматочного орошения аутоплазмой, содержащей тромбоциты, в качестве средства подготовки к восстановлению фертильности у женщин с бесплодием.
Однако наметилась тенденция. Следует признать высокий потенциал внутриматочного орошения аутоплазмой, содержащей тромбоциты, в качестве средства подготовки к восстановлению фертильности у женщин с бесплодием.
Заключение
Применение процедур орошения эндометрия полости матки аутоплазмой, содержащей тромбоциты, и введения ее в подслизистое пространство парацервикально у пациенток с «тонким эндометрием» показало, что метод оказывает положительное воздействие, и у большинства больных наблюдается существенный рост эндометрия к концу лечения. Толщина эндометрия в обследуемых подгруппах была достоверно больше, чем в подгруппах сравнения (р<0,05). Таким образом, такая терапия может быть рекомендована к использованию в практике акушера-гинеколога при подготовке пациенток к программе экстракорпорального оплодотворения.
Способ лечения пациенток с «тонким эндометрием» путем внутриматочного орошения аутоплазмой, содержащей тромбоциты, и парацервикального подслизистого ее введения является эффективным, малоинвазивным, достаточно простым и безопасным методом лечения, не требующим сложного оборудования. Обеспечивает пациенткам низкую степень болезненности и отсутствие осложнений.
Обеспечивает пациенткам низкую степень болезненности и отсутствие осложнений.
Участие авторов:
Концепция и дизайн исследования — Е.Н. Кравченко, О.Ю. Цыганкова;
Сбор и обработка материала — О.Ю. Цыганкова, К.П. Кропмаер;
Статистическая обработка данных — О.Ю. Цыганкова, К.П. Кропмаер;
Написание текста — О.Ю. Цыганкова;
Редактирование — О.Ю. Цыганкова, К.П. Кропмаер
Авторы заявляют об отсутствии конфликта интересов.
Окно имплантации | Полезное от клиники «Геном» в Калининграде
Перенос эмбриона в матку – завершающий этап протокола ЭКО. Теперь эмбриону предстоит прикрепиться к эндометрию — внутреннему слою матки. Этот процесс называется имплантацией. Если он пройдёт успешно, то наступит беременность. Необходимым условием для успешной имплантации является наличие рецептивного эндометрия и качественной бластоцисты.
Бластоциста – это эмбрион, достигший 5-6 суток развития. В этом «возрасте», при естественном зачатии, он попадает в матку из маточной трубы. Бластоциста обладает наивысшим потенциалом к имплантации.
Слово «рецептивность» означает восприимчивость. Рецептивный эндометрий восприимчив к имплантации эмбриона, способен принять его. Оптимальным для имплантации считается эндометрий, толщина которого 9-11 мм, а структура слизистой оболочки матки трёхслойная. Репродуктологи называют такой эндометрий «красивый, пышный». В него, как в уготованную маткой перинку, предстоит внедриться эмбриону.
Период максимальной рецептивности эндометрия называют «имплантационным окном». Открытие окна имплантации происходит в естественном менструальном цикле на 6-10-й день после овуляции, что соответствует 20-24-му дню менструального цикла. Открытым оно остаётся около 2-х суток.
Открытие имплантационного окна сопровождается появлением пиноподий – это гладкие выпячивания поверхностных эпителиальных клеток эндометрия. Достигнув максимальной величины, они образуют складки, напоминая цветы или грибы. Функции пиноподий до конца не изучены, но предполагается, что именно они способствуют возникновению тесного контакта между бластоцистой и поверхностью матки.
Достигнув максимальной величины, они образуют складки, напоминая цветы или грибы. Функции пиноподий до конца не изучены, но предполагается, что именно они способствуют возникновению тесного контакта между бластоцистой и поверхностью матки.
При нарушении процесса формирования пиноподий, «окно имплантации» может сдвигаться по времени. Если пиноподий будет не достаточно, «окно имплантации» будет неполноценным. Всё это может привести к отрицательному результату ЭКО. Причинами таких явлений могут быть гормональный дисбаланс, инфекционный процесс половой сферы, хирургические вмешательства.
Различают следующие этапы имплантации:
— ориентацию бластоцисты в полости матки относительно места будущей имплантации,
— адгезию (прилипание) на поверхности эндометрия
— инвазию (внедрение) в полость матки
Процесс имплантация эмбриона (с момента его прикрепления к слизистой оболочке матки и до полного погружения в нее) занимает около 40 часов.
 Во время имплантации между эмбрионом и эндометрием происходит биохимический «диалог». Бластоциста вырабатывает вещества, позволяющие матке «почувствовать» её присутствие. По качеству биохимических импульсов, посылаемых эмбрионом, эндометрий определяет его качество. Полноценная бластоциста должна быть морфологически нормальной и обладать правильным набором хромосом. Такой эмбрион пиноподии начинают привлекать, всячески способствуя его имплантации. Если же бластоциста будет генетически неполноценной или с внешними дефектами, эндометрий может её отторгнуть.
Во время имплантации между эмбрионом и эндометрием происходит биохимический «диалог». Бластоциста вырабатывает вещества, позволяющие матке «почувствовать» её присутствие. По качеству биохимических импульсов, посылаемых эмбрионом, эндометрий определяет его качество. Полноценная бластоциста должна быть морфологически нормальной и обладать правильным набором хромосом. Такой эмбрион пиноподии начинают привлекать, всячески способствуя его имплантации. Если же бластоциста будет генетически неполноценной или с внешними дефектами, эндометрий может её отторгнуть.При проведении ЭКО существует возможность создать идеальные условия для имплантации эмбриона и развития дальнейшей благополучной беременности. Так, в случае смещения окна имплантации, эмбрионы замораживают. Этот процесс называется криконсервация. В следующем цикле эндометрий искусственно подготавливают к имплантации с помощью специальных препаратов. Когда слизистая будет готова к принятию эмбриона, осуществляют перенос.
Криоконсервация позволяет провести преимплантационное генетическое тестирование эмбриона или ПГТ. Цель метода — определить генетические нарушения у эмбриона до переноса в матку. Благодаря ПГТ, повилась возможность осуществить подсадку бластоцисты с нормалным генетическим набором, что повышает шанс на успех ЭКО, благополучную беременность и рождение здорового ребёнка.
Цель метода — определить генетические нарушения у эмбриона до переноса в матку. Благодаря ПГТ, повилась возможность осуществить подсадку бластоцисты с нормалным генетическим набором, что повышает шанс на успех ЭКО, благополучную беременность и рождение здорового ребёнка.
Внушительный положительный опыт репродуктологов и эмбриологов «Геном» позволяет достигать высоких показателей частоты наступления беременности в результате протоколов ЭКО.
Поделитесь информацией:
Менструации начались с 13 лет, были регулярными, безболезненными. Со слов пациентки, до первой беременности находили фолликулярную кисту в яичнике, которая исчезла самостоятельно. Роды одни, в возрасте 25 лет. Через 1,5 года после родов — аборт, после которого начала принимать гормональные противозачаточные препараты.
 Последние 1-1,5 года менструации стали болезненные и обильные, со сгустками, появились мажущиеся кровянистые выделения в середине цикла, «шоколадные» выделения за 3-4 дня до менструации и 4-5 дней после. Боль внизу живота стала беспокоить в середине цикла и при половом акте.
Последние 1-1,5 года менструации стали болезненные и обильные, со сгустками, появились мажущиеся кровянистые выделения в середине цикла, «шоколадные» выделения за 3-4 дня до менструации и 4-5 дней после. Боль внизу живота стала беспокоить в середине цикла и при половом акте.При УЗИ-обследовании органов малого таза на 7 день цикла было выявлено: миометрий диффузно неоднородный с участками повышенной и пониженной эхогенности без четких контуров и границ; стенки неравномерной толщины — передняя 11 мм, задняя — 15 мм; эндометрий от 9 мм до 13 мм; правый яичник увеличен в размерах, объем его 9,2 см3, определяется доминантный фолликул размерами 16*12 мм. При исследовании гормонального статуса выявлено: повышение пролактина до 34 (при норме 1,2-29), повышение ФСГ до 14 (при норме 3,5 -12,5), ЛГ — ближе к нижней границе нормы, эстрадиол на верхней границе нормы, а прогестерон — на нижней границе нормы.
Пациентка взята на лечение в Клинику с диагнозом: эндометриоз, аденомиоз матки диффузной формы, гиперплазия эндометрия, эндометриоз правого яичника.
 Проведено 2 лечебных курса компьютерной рефлексотерапии с перерывом 1 месяц, гормональные препараты при этом не назначались, а гормональные противозачаточные препараты были отменены.
Проведено 2 лечебных курса компьютерной рефлексотерапии с перерывом 1 месяц, гормональные препараты при этом не назначались, а гормональные противозачаточные препараты были отменены.После первого курса лечения исчезли боли и выделения в середине цикла, значительно уменьшились боли во время менструации, менструации стали менее обильные. После второго курса — менструации безболезненные, продолжительностью 5-7 дней, мажущих выделений нет. Боли внизу живота практически нет. При этом перестал беспокоить шейный и поясничный отделы позвоночника. Повысилась работоспособность, улучшилось настроение.
Через 2 месяца после второго курса лечения проведено контрольное обследование.
На УЗИ органов малого таза: миометрий стал однородным, эндометрий в норме — на 6 день цикла 7мм, размеры правого яичника нормализовались, его объем стал 5,2 см3, определяется доминантный фолликул диаметром 11мм. Восстановился гормональный фон: пролактин, ФСГ, ЛГ, эстрадиол и прогестерон в пределах нормы. Через 6 месяцев проведен поддерживающий курс лечения методом компьютерной рефлексотерапии для закрепления полученных результатов.

Пациентка наблюдалась 2 года. Жалоб не предъявляет. Менструации регулярные, безболезненные, продолжительностью не более 5 дней.
Пациентка Д. — 35лет. Обратилась в нашу клинику с диагнозами эндометриоз, мастопатия. Последние 2 года беспокоили боль внизу живота, боль и нагрубание молочных желез, болезненные и обильные со сгустками месячные, кровянистые выделения в середине цикла.
При обследовании до лечения выявлено: на УЗИ-неоднородность миометрия, стенки матки неравномерной толщины —от 9 до 15 мм; правый яичник увеличен в размерах, протоки в молочных железах расширены до 3,5мм, справа киста 2,2см, слева множество мелких кист; пролактин, ФСГ, эстрадиол выше нормы, ЛГ и прогестерон — ниже нормы.
Проведено 2 курса компьютерной рефлексотерапии с перерывом 1 месяц, гормональные препараты при этом не назначались.
После первого курса лечения исчезли боли в животе и выделения в середине цикла, менструации стали менее обильные без сгустков. После второго курса — менструации безболезненные, молочные железы не беспокоят. Перестали беспокоить боли в шейном и поясничном отделах позвоночника. Повысилась работоспособность, улучшилось настроение.
Перестали беспокоить боли в шейном и поясничном отделах позвоночника. Повысилась работоспособность, улучшилось настроение.
После второго курса лечения проведено контрольное обследование.
На УЗИ : миометрий стал однородным, стенки матки 9мм, размеры правого яичника в пределах нормы; млечные протоки не расширены, кисты не визуализируются. Пролактин, ФСГ, ЛГ, эстрадиол и прогестерон — норма.
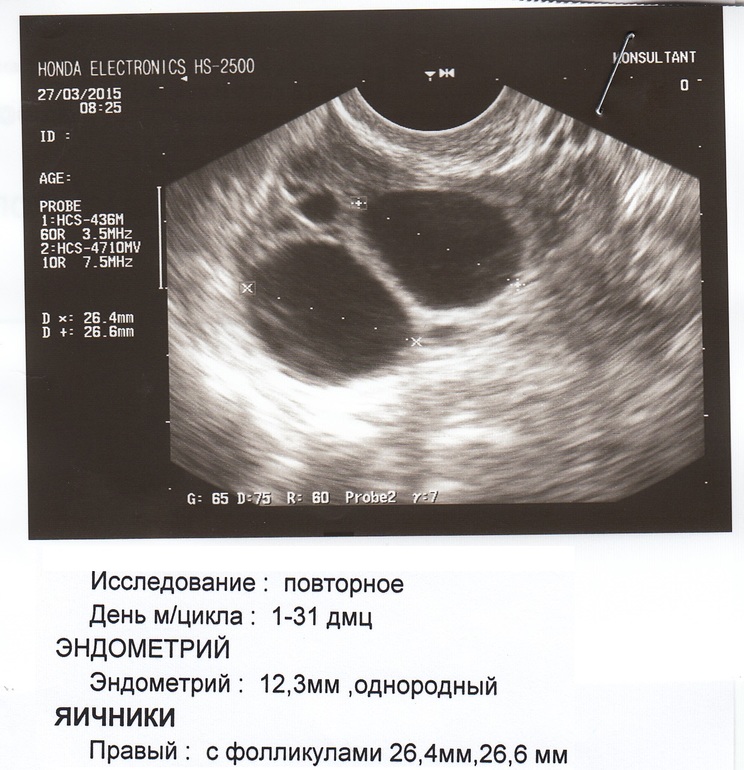
М. 44г. В 2011г. поставили диагноз эндометриоз, миомы матки (самый крупный узел был 15*13мм), гиперплазия эндометрия (эндометрий толщиной 19мм) Лечилась у гинеколога, делали выскабливание, пила гормональные таблетки. В 2012г появилась еще эндометриоидная киста в левом яичнике и киста желтого тела в правом яичнике.
В начале 2013г. — по результатам УЗИ-самый крупный узел в матке стал 20*15мм, эндометрий 19-20мм, киста желтого тела увеличилась до 26*23мм, эндометриоидная киста до 18*17мм.
Прошла 3 курса лечения в течении года в клинике Гавриловой. Медикаментозные препараты не назначались. На УЗИ после лечения: самый крупный узел в матке стал 12*11мм, эндометрий стал нормальным — 9,1мм, киста желтого тела рассосалась, а эндометриоидная киста уменьшилась до 13*10мм.
На УЗИ после лечения: самый крупный узел в матке стал 12*11мм, эндометрий стал нормальным — 9,1мм, киста желтого тела рассосалась, а эндометриоидная киста уменьшилась до 13*10мм.
Пациентка С. 41 год. Жалобы на тупые распирающие в боли в нижних отделах живота, обильные менструации, мажущие кровянистые выделения из половых путей до и после наступления менструации. По данным УЗИ ОМТ при поступлении на лечение в Клинику: матка шаровидной формы, увеличена, размеры 57*47*59 мм. Миометрий диффузно-неоднородный с выраженными признаками аденомиоза диффузной формы. Толщина стенок передняя16 мм, задняя 20 мм. Миоматозные узлы по правой боковой стенке интерстициальной локализации 15*14 мм, 20*16 мм. Эндометрий 5 мм.
В ГС: Эстрадиол 424(43-211), прогестерон 20(1,7-27), пролактин 10(4,8-23).
Было проведено 2 курса лечения, после чего уменьшился болевой синдром, менструации приобрели умеренный характер. По данным УЗИ: матка грушевидной формы, размеры 55*37*51 мм. Миометрий с единичными мелкоточечными диффузно расположенными гетеротопиями. Миоматозные узлы не визуализируются.
Миоматозные узлы не визуализируются.
В ГС: Эстрадиол 179(12,5-166), пролактин 10(4,8-23), прогестерон 23(1,7-27), ЛГ 5,3(2,4-12,6), ФСГ 6,6(3,5-12,5).
После 3 курса лечения по данным УЗИ: матка грушевидной формы, размеры 62*36*54 мм. Структура миометрия с единичными мелкими участками пониженной эхогенности с нечеткими контурами. В ГС: Эстрадиол 140(12,5-166), пролактин, прогестерон в пределах нормы.
Пациентка М. 1969 г.р. Жалобы на боли в области проекции малого таза. По данным УЗИ матка размером 58*48*61** мм, форма шаровидная, стенки передняя 11 мм , задняя 20 мм, эндометрий 14 мм. Миометрий с участками повышенной и пониженной эхогенности без четких контуров и границ, с признаками диффузного аденомиоза. Множественные мелкие интерстициальные миоматозные узлы max 15*13 мм, min до 6 мм.
В ГС: гиперэстрогенемия до 360(12,5-166), гипепролактинемия до 26(4,8-23), прогестерон в норме.
После проведения 2 курсов лечения по данным УЗИ размеры матки 56*48*50 мм, эндометрий 8 мм, сохраняются миоматозные узлы и признаки диффузного эндометриоза матки.
В ГС: эстроген 230(12,5-166), пролактин 20(4,8-23), прогестерон в норме.
После 3 курса лечения по данным УЗИ размеры матки 57*48*57 мм, форма шаровидная, миометрий с единичными гипо- и гипер- эхогенными зонами, миоматозные узлы до 15 мм эндометрий 9,7 мм.
В ГС: эстроген 140(12,5-166), пролактин, прогестерон в норме.
Пациентка М 32 лет. Поступила на лечение. По данным УЗИ матка грушевидной формы, размеры 38*50*52 мм. Миометрий диффузно-неоднородный с мелкоточечными дифузно расположенными эндометриоидными гетеротопиями . Эндометрий 23 мм с признаками гиперплазии.
В ГС: гиперэстрогенемия эстроген повышен до 390 (12,5-166), пролактин 52(4,8-23), прогестерон 20 (1,7-27).
Сопутствующая патология: ХАИТ. ДКМ.
После проведения 3 курсов лечения на УЗИ ОМТ: размеры матки 46*31*42 мм. Миометрий диффузно-неоднородный с единичными мелкоточечными зонами пониженной и повышенной эхогенности. Эндометрий 6 мм.
В ГС эстрадиол 218, пролактин 26, прогестерон в норме.
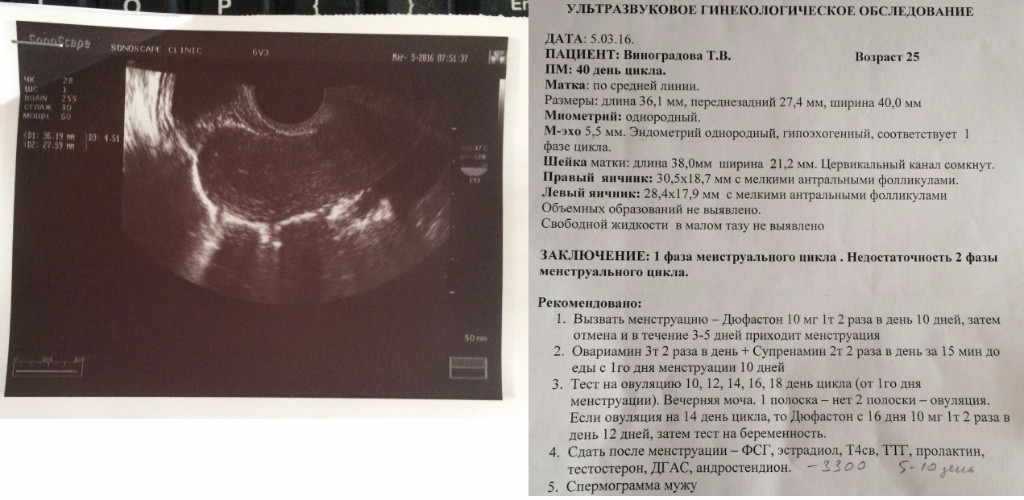
Пациентка М. обратилась в Клинику с жалобами на тупые ноющие боли в нижних отделах живота, над лоном, обильные menses.
В анамнезе: menses с 14 лет, регулярные, обильные по 7 дней, болезненные. МЦ по 28 дней. В 2011г-диагностирована киста правого яичника, в 2012г- эндометриоидная киста левого яичника. Принимала ОК 1 год. В 01.13— на УЗИ ОМТ 01.13—эндометриоидная киста левого яичника размером 5,3*5,1 см V 72,8 см3 с мелкодисперстной взвесью.
В 04. 2013г- лапароскопия, 2-х стороняя цистэктомия, коагуляция очагов эндометриоза, дренирование малого таза. После оперативного лечения назначена противовоспалительная, обезболивающая терапия и Визанна на 6 мес.
Лечение начато через 2 нед после оперативного лечения, послеоперационный период протекал без осложнений.
При обследовании в следующем после операции МЦ в крови- гиперэстрогенемия в фолл. Фазу 308(N 12,5-166), в лют. Фазу 288(N 43,8-211).
После проведения 2 -х курсов лечения- снижение уровня эстрогена до 272 в фолл. Фазу и до 76 в лют. Фазу. На УЗИ ОМТ после 2 курса:- миометрий диффузно-неоднородный, с эхогенными мелкоточечными включениями, диффузно расположенными гетеротопиями. Яичники нормальных размеров, ДФ.
Фазу и до 76 в лют. Фазу. На УЗИ ОМТ после 2 курса:- миометрий диффузно-неоднородный, с эхогенными мелкоточечными включениями, диффузно расположенными гетеротопиями. Яичники нормальных размеров, ДФ.
Заключение-эхографические признаки эндометриоза тела матки.
После 3 курса лечения : в крови- эстрадиол в фол. Фазу 114, в лют. Фазу 335, и повышение прогестерона до 29,9( 1,7-27)
на УЗИ ОМТ-миометрий диффузно-неоднородный с единичными эндометриоидными гетеротопиями.
Заключение- эндометриоз начальной стадии развития.
4 курс лечения дополнен АКТ№10 после этого .В крови эстрадиол в фолл. Фазу 99, в лют. Фазу 275, прогестерон в норме.
На УЗИ ОМТ-структура миометрия однородная. Заключение- патологии не выявлено.
Когда лучше делать УЗИ при эндометриозе? – статьи о здоровье
Оглавление
Эндометриоз – это заболевание женских органов малого таза, которое характеризуется сильным разрастанием тканей внутреннего слоя стенок матки в иные структуры (за пределы данного органа). Такие клетки попадают в яичники, влагалище и прочие области через фаллопиевы трубы, кровь и другими способами. Из них могут образоваться кисты, что приведет к нарушениям в работе мочеполовой системы.
Такие клетки попадают в яичники, влагалище и прочие области через фаллопиевы трубы, кровь и другими способами. Из них могут образоваться кисты, что приведет к нарушениям в работе мочеполовой системы.
Показания
Симптомы данного заболевания часто совпадают с признаками иных недугов мочеполовой системы. В некоторых случаях оно может не проявляться вовсе, или женщина может не обращать внимания на симптоматику, считая ее неважной или нормальной. Поэтому стоит обратиться к врачу, если зафиксированы такие явления:
- Длительные и болезненные менструации
- Присутствие выделений темного цвета в течение нескольких дней до или после месячных
- Наличие дискомфорта во время полового акта
- Нестабильный цикл
- Болезненное мочеиспускание
- Бесплодие
- Слабость, частые головокружения, утомляемость, появление дефектов кожного покрова
- Повышенная в течение длительного времени температура
Выбор времени для исследования
Одного УЗИ малого таза при эндометриозе часто оказывается недостаточно. Но и данный типа обследования может быть полезен, если его провести в правильный промежуток времени.
Но и данный типа обследования может быть полезен, если его провести в правильный промежуток времени.
Для диагностики иных заболеваний – миомы и подобные им – рекомендуется делать ультразвуковое исследование в первую неделю после окончания менструации (с пятого по седьмой день), когда ткани внутриматочного слоя наиболее тонкие.
В случае с эндометриозом этот принцип не работает, поскольку его образования лучше всего заметны при наиболее толстом внутреннем слое маточных стенок. Поэтому для наилучшего результата необходимо делать данное обследование с двадцать пятого по двадцать восьмой день, если цикл женщины тридцатидневный. В этот период эндометрий становится наиболее толстым, и, соответственно, разрастаются очаги заболевания.
Так как не всегда можно однозначно определить наличие данного недуга, то рекомендуется проходить УЗИ в течение нескольких менструальных циклов и желательно в одинаковые цикловые дни. Это помогает выявить характерные для подобного недуга признаки.
Структурные изменения эндометрия
Отмечают три основных стадии изменений состояния внутреннего слоя маточных стенок, которые делятся на несколько более коротких мини-стадий:
- Первая:
- Период менструации – толщина эндометрия минимальна, но ряд участков может быть гиперэхогенным
- Вторая:
- Пятый-седьмой дни – тонкий слой эндометрия толщиной до семи миллиметров, имеющий низкую эхогенность
- Восьмой-десятый дни – толщина растет до десяти миллиметров
- Одиннадцатый-четырнадцатый дни – слой разрастается до пятнадцати миллиметров
- Третья:
- Пятнадцатый-восемнадцатый дни – эхогенность растет, слой достигает семнадцати миллиметров
- Девятнадцатый-двадцать четвертый дни – оболочка утолщается, повышена эхогенность, а структура тканей становится неоднородной
- Двадцать четвертый-двадцать восьмой дни – толщина может снизиться до 11-17 мм, показатели эхогенности и структуры остаются прежними
Что покажет УЗИ?
На УЗИ органов малого таза эндометриоз не всегда очевиден, но ультразвук помогает определить его наличие по некоторым признакам:
- Присутствие эндометриальных клеток в промежности, влагалище и наружных половых органах
- Наличие образований на шейке матки
- Увеличение матки, изменение ее формы (становится шарообразной)
- Наличие кист в яичниках
- Утолщение стенок органов
Если очаг развития болезни в яичниках, то обследование покажет, что:
- В тканях имеются разнотипные узелковые вкрапления
- Есть круглое новообразование за маткой или сбоку от нее
- Неоднородность тканей
Если заболевание локализовано в матке, то УЗИ выявит следующие изменения:
- Нечеткость тканей эндометриального слоя
- Асимметричность стенок матки
- Наличие узловых образований
Типы болезни
По мере разрастания эндометриоза определяют четыре его степени:
- Первая – распространение точечное
- Вторая – очаги постепенно разрастаются
- Третья – образуются кисты, которые постепенно увеличиваются в размерах
- Четвертая – обширное поражение органов и тканей
Также существует классификация по его локализации:
- Внутренняя – очаги в матке и ее шейке
- Наружная – клетки эндометрия в брюшной полости, влагалище, яичниках и т.
 д.
д.
Выделяют типы болезни по форме и структуре новообразований:
- Очаговый – киста с повышенной эхогенностью размером до 16 мм, маточные стенки асимметричны
- Узловой – круглые новообразования размером до 30 мм, не имеющие четких очертаний и локализованные в конкретном органе
- Диффузный – матка приобретает округлые очертания с кальциевыми вкраплениями, ее внутренний слой имеет расплывчатые границы, задняя стенка увеличена, а эхогенность повышена
Способы диагностики
На УЗИ малого таза эндометриоз можно выявить, но врачи рекомендуют пройти несколько типов обследований, чтобы диагноз был наиболее точен.
Для определения наличия данного заболевания используют такие типы ультразвукового исследования, как:
- Абдоминальное – проводится датчиком сквозь стенку брюшной полости
- Трансвагинальное – осмотр при помощи введения датчика во влагалище
- Трансректальное – при таком типе аппарат помещается в задний проход пациентки
Для более точного выявления типа новообразований больше подходят второй и третий тип обследования. Также они позволяют взять образцы тканей на анализ.
Также они позволяют взять образцы тканей на анализ.
В качестве дополнительного метода уточнения диагноза может быть применена кольпоскопия (обследование влагалища и шейки матки при помощи прибора, включающего в себя бинокуляр).
Преимущества проведения процедуры в МЕДСИ
- Клиники МЕДСИ оборудованы современными аппаратами Pro Focus 2202, Philips iU22 для проведения тридцати типов УЗИ
- Врачи высшей квалификационной категории назначат все необходимые типы обследований, качественно расшифруют результаты и поставят точный диагноз
- Чтобы попасть на консультацию, нужно просто позвонить по телефону 8 (495) 7-800-500 , и вам назначат прием в удобные для вас время и место – МЕДСИ располагает сетью из более чем двадцати клиник
- Всегда возможно проведение срочного исследования в случае возникновения кровотечения или иной нештатной ситуации
Измерение толщины эндометрия у женщин в пременопаузе в кабинете гинеколога
1 Женская клиника Мидзухо, Кокубунджи, Япония,
2 кафедра биостатистики, Высшая школа медицины Университета Хоккайдо, Саппоро, Япония,
3 Отделение гинекологической онкологии, Национальная больничная организация, Онкологический центр Хоккайдо, Саппоро, Япония,
4 Клиника фертильности Мио, Йонаго, Япония,
5 Клиника Тасака, Осака, Япония,
6 Женская клиника Суто, Осака, Япония,
7 Женская клиника Минамиморимати, Осака, Япония,
8 Кафедра акушерства, гинекологии и анданестезии, Клиника Дозоно, Кагосима, Япония,
9 Клиника Сакура Джосей, Титосэ, Япония,
10 Женская клиника Мами, Хатинохе, Япония,
11 Клиника Сакамото Томоми, Хиросаки, Япония,
12 Клиника ритмического акушерства и гинекологии, Саппоро, Япония,
13 Женская клиника ул. Сесилия,
Аомори,
Япония,
Сесилия,
Аомори,
Япония,
14 Yokohama First Health Check Place, Йокогама, Япония,
15 Киё женская клиника, Нара, Япония,
16 Женская клиника Хиросимы, Хиросима, Япония,
17 Женская клиника Азабу Джубан Манами, Токио, Япония,
18 Кобики женская клиника, Кавасаки, Япония,
19 Общество рака Хоккайдо, Саппоро, Япония,
20 Кафедра акушерства и гинекологии, Медицинский факультет Медицинского университета Иватэ, Мориока, Япония,
21 Женская клиника Сакура, Хиросима, Япония,
22 Департамент управления трансляционными исследованиями, Высшая школа медицины Университета Хоккайдо, Саппоро, Япония,
23 Больница Какиноки, Кагосима, Япония,
24 Кафедра акушерства и гинекологии, Высшая школа медицины Университета Хиросаки, Хиросаки, Япония,
Автор, ответственный за переписку. * Переписка
* Переписка Хироси Цуда, женская клиника Мидзухо, город Кокубунджи, Япония.
Электронная почта: pj.en.noid.5s@dusth,
Поступила в редакцию 27 мая 2017 г.; Принято 22 августа 2017 г.
Толщина эндометрия — обзор
Толщина эндометрия: биомаркер действия эстрогена эндометрий (рис.33-3). Эта широко распространенная практика фактически сводится к измерению двойной толщины эндометрия, что стало общепринятой конвенцией.
Будучи относительно тонким во время менструации, эндометрий постепенно утолщается во время пролиферативной фазы менструального цикла, обычно достигая максимума от 7 до 9 мм в день выброса лютеинизирующего гормона (ЛГ). 58-60 Перед овуляцией эндометрий имеет типичный многослойный или трехрядный вид, образованный эхогенными базальными слоями: двумя гипоэхогенными функциональными слоями, разделенными гиперэхогенной интерфазой виртуальной полости матки (рис.33-4). Увеличение толщины эндометрия, наблюдаемое на протяжении всей фолликулярной фазы, представляет собой пролиферацию эндометрия, выявленную на гистологических препаратах, которая произошла под влиянием E 2 . Этот эффект эстрогена приводит к развертыванию рецепторов эстрогена (ER) и рецепторов прогестерона (PR) в эндометриальных железах и строме. В совокупности эти изменения в ткани эндометрия называются праймированием эндометрия, поскольку они отражают критический шаг для последующей реакции эндометрия на прогестерон.На гистологическом уровне эстрогенные эффекты фолликулярной фазы приводят к пролиферации и росту желез эндометрия, которые развиваются вертикально с прямыми просветами. Данные ЭКО донорских яйцеклеток и рецептивности эндометрия, индуцированной у реципиентов донорских яйцеклеток исключительно с помощью экзогенных гормонов, используются для экспериментального определения соответствующих ролей E 2 и прогестерона в различных характеристиках и рецептивности эндометрия. Удивительно, но данные о донорских яйцеклетках выявили исключительную свободу действий в отношении продолжительности и амплитуды фазы примирования эндометрия E 2 , которая может варьироваться от 10 до 100 дней без каких-либо последствий для результатов ВРТ.
Этот эффект эстрогена приводит к развертыванию рецепторов эстрогена (ER) и рецепторов прогестерона (PR) в эндометриальных железах и строме. В совокупности эти изменения в ткани эндометрия называются праймированием эндометрия, поскольку они отражают критический шаг для последующей реакции эндометрия на прогестерон.На гистологическом уровне эстрогенные эффекты фолликулярной фазы приводят к пролиферации и росту желез эндометрия, которые развиваются вертикально с прямыми просветами. Данные ЭКО донорских яйцеклеток и рецептивности эндометрия, индуцированной у реципиентов донорских яйцеклеток исключительно с помощью экзогенных гормонов, используются для экспериментального определения соответствующих ролей E 2 и прогестерона в различных характеристиках и рецептивности эндометрия. Удивительно, но данные о донорских яйцеклетках выявили исключительную свободу действий в отношении продолжительности и амплитуды фазы примирования эндометрия E 2 , которая может варьироваться от 10 до 100 дней без каких-либо последствий для результатов ВРТ. 61,62 Этот большой диапазон возможной продолжительности фазы прайминга E 2 , который остается совместимым с оптимальной восприимчивостью, затмевает возможные различия в воздействии E 2 , возникающие в результате дублирования или отсутствия предовуляторного подъема E 2 уровни, встречающиеся в менструальном цикле. Интересно, что большой диапазон, в котором продолжительность прайминга E 2 может варьироваться, не влияя на исход ВРТ, также не влияет или оказывает незначительное влияние на толщину эндометрия или другие параметры воздействия эстрогена на матку, такие как сократимость, 63 , при условии, что E 2 Достаточно грунтовки . 46 Как обсуждается далее в этой главе, толщина эндометрия 7 мм или более рассматривается как отражение достаточного праймирования эндометрия с помощью E 2 . Таким образом, мы вынуждены признать, что в рамках физиологического праймирования эндометрия по E 2 другие факторы, такие как факторы роста, оказывают основное влияние на толщину эндометрия.
61,62 Этот большой диапазон возможной продолжительности фазы прайминга E 2 , который остается совместимым с оптимальной восприимчивостью, затмевает возможные различия в воздействии E 2 , возникающие в результате дублирования или отсутствия предовуляторного подъема E 2 уровни, встречающиеся в менструальном цикле. Интересно, что большой диапазон, в котором продолжительность прайминга E 2 может варьироваться, не влияя на исход ВРТ, также не влияет или оказывает незначительное влияние на толщину эндометрия или другие параметры воздействия эстрогена на матку, такие как сократимость, 63 , при условии, что E 2 Достаточно грунтовки . 46 Как обсуждается далее в этой главе, толщина эндометрия 7 мм или более рассматривается как отражение достаточного праймирования эндометрия с помощью E 2 . Таким образом, мы вынуждены признать, что в рамках физиологического праймирования эндометрия по E 2 другие факторы, такие как факторы роста, оказывают основное влияние на толщину эндометрия. Однако различия в толщине эндометрия не влияют на реакцию эндометрия на прогестерон. Взаимосвязь между толщиной эндометрия и другими эндометриальными маркерами воздействия эстрогенов, с одной стороны, и частотой наступления беременности при ВРТ, с другой, рассматривается в разделе «Визуализирующие маркеры рецептивности эндометрия».
Однако различия в толщине эндометрия не влияют на реакцию эндометрия на прогестерон. Взаимосвязь между толщиной эндометрия и другими эндометриальными маркерами воздействия эстрогенов, с одной стороны, и частотой наступления беременности при ВРТ, с другой, рассматривается в разделе «Визуализирующие маркеры рецептивности эндометрия».
McWilliams и Frattarelli использовали оригинальную точку зрения на толщину эндометрия при ВРТ, поскольку они изучали динамические изменения, а не собирали только статические данные, то есть толщину эндометрия в одной заданной точке. 64 Для этого были изучены свежие циклы ЭКО, в которых анализировались изменения толщины эндометрия от исходного уровня до 6-го дня и оттуда до дня приема хорионического гонадотропина человека (ХГЧ). Прирост толщины эндометрия от исходного уровня до 6-го дня и с 6-го дня до дня ХГЧ составил 3.6 ± 2,4 и 2 ± 2,2 и 2,3 ± 2,6 и 2,5 ± 2,1 у забеременевших ( n = 70) и неберемевших ( n = 62) соответственно. Это динамическое сравнение показало, что прирост толщины эндометрия от исходного уровня до 6-го дня был более важным у женщин, которые забеременели, тогда как не было различий в дальнейшем приросте, происходящем от 6-го дня до дня ХГЧ. Анализ подмножества показал, что раннее увеличение толщины эндометрия было значительно меньше у женщин, страдающих сниженным овариальным резервом, по сравнению с остальными женщинами, имеющими другие причины бесплодия.По нашему мнению, эти характеристики динамических изменений толщины эндометрия подчеркивают положительное смещение, которое существует между толщиной эндометрия и качеством реакции яичников на КГЯ, объясняя, как толщина эндометрия может быть ошибочно интерпретирована как отражение рецептивности эндометрия. Поддерживая концепцию о том, что толщина эндометрия отражает воздействие гормонов, но не восприимчивость эндометрия как таковую, Ng et al. не обнаружили различий в толщине эндометрия между женщинами, забеременевшими после переноса замороженных эмбрионов (FET), и теми, кто этого не сделал.
Это динамическое сравнение показало, что прирост толщины эндометрия от исходного уровня до 6-го дня был более важным у женщин, которые забеременели, тогда как не было различий в дальнейшем приросте, происходящем от 6-го дня до дня ХГЧ. Анализ подмножества показал, что раннее увеличение толщины эндометрия было значительно меньше у женщин, страдающих сниженным овариальным резервом, по сравнению с остальными женщинами, имеющими другие причины бесплодия.По нашему мнению, эти характеристики динамических изменений толщины эндометрия подчеркивают положительное смещение, которое существует между толщиной эндометрия и качеством реакции яичников на КГЯ, объясняя, как толщина эндометрия может быть ошибочно интерпретирована как отражение рецептивности эндометрия. Поддерживая концепцию о том, что толщина эндометрия отражает воздействие гормонов, но не восприимчивость эндометрия как таковую, Ng et al. не обнаружили различий в толщине эндометрия между женщинами, забеременевшими после переноса замороженных эмбрионов (FET), и теми, кто этого не сделал. 65 В этом исследовании все участники получали стандартизированный режим E 2 и прогестерон, равный одинаковому гормональному воздействию для всех. 65
65 В этом исследовании все участники получали стандартизированный режим E 2 и прогестерон, равный одинаковому гормональному воздействию для всех. 65
Сравнение толщины эндометрия в поздней фолликулярной фазе менструального цикла после физиологического E 2 и заместительной терапии прогестероном или легкой стимуляции яичников для FET выявило аналогичные результаты. 66,67 Это говорит о том, что аналогичные формы гормонального прайминга оказывают одинаковое влияние на толщину эндометрия.Кроме того, воздействие на эндометрий уровней E 2 , которые более чем в 10 раз превышают показатели менструального цикла, как это наблюдалось при АРТ 68 и после вагинального введения 2 мг E 2 в день, 69 едва ли привело к увеличению толщины эндометрия на 20%. Это говорит о том, что прайминг E 2 , возникающий в результате уровней E 2 в менструальном цикле, почти максимален. Как отмечалось ранее, такая же свобода действий, которая существует для количества E 2 , используемого для праймирования эндометрия, также наблюдается в отношении продолжительности применения этого праймирования.В ретроспективном анализе своих данных о донорских яйцеклетках группа Пеллисера показала, что продление фазы прайминга E 2 до 100 дней не оказало существенного влияния на исход ВРТ 70 и толщину эндометрия 62 , что было подтверждено другими. 71,72 Минимальное влияние повышенного или длительного прайминга E 2 на толщину эндометрия контрастирует с сообщениями, указывающими на то, что чрезмерная реакция яичников на КГЯ с заметно повышенным уровнем E 2 оказывает негативное влияние на частоту наступления беременности и имплантацию эмбриона. 73,74 Чтобы объяснить эти расходящиеся результаты, мы предположили, что при сильном ответе на КГН именно избыточная продукция факторов яичников, отличных от E 2 , ответственна за неблагоприятное воздействие на эндометрий, а не действие высоких уровней E 2 как таковых.
Как отмечалось ранее, такая же свобода действий, которая существует для количества E 2 , используемого для праймирования эндометрия, также наблюдается в отношении продолжительности применения этого праймирования.В ретроспективном анализе своих данных о донорских яйцеклетках группа Пеллисера показала, что продление фазы прайминга E 2 до 100 дней не оказало существенного влияния на исход ВРТ 70 и толщину эндометрия 62 , что было подтверждено другими. 71,72 Минимальное влияние повышенного или длительного прайминга E 2 на толщину эндометрия контрастирует с сообщениями, указывающими на то, что чрезмерная реакция яичников на КГЯ с заметно повышенным уровнем E 2 оказывает негативное влияние на частоту наступления беременности и имплантацию эмбриона. 73,74 Чтобы объяснить эти расходящиеся результаты, мы предположили, что при сильном ответе на КГН именно избыточная продукция факторов яичников, отличных от E 2 , ответственна за неблагоприятное воздействие на эндометрий, а не действие высоких уровней E 2 как таковых. 46,75
46,75
Существует консенсус в отношении того, что женщины, у которых эндометрий менее 7 мм при ВРТ, имеют заметно сниженные шансы забеременеть. 76,77 В редких случаях, хотя и тревожных, это состояние может сохраняться и обнаруживаться во время менструальных, стимулированных и Е 2 циклов с добавками, 78 и, как правило, устойчиво к заметно повышенному воздействию эстрогенов. 69 Это может произойти после тотального облучения тела или других методов лечения рака, 79 или при отсутствии доступного объяснения. Лечение, которое было предложено для этих женщин, включает низкие дозы аспирина, 80 провокационный тест E2, 81 местно-активные вазодилататоры, 82 и комбинацию пентоксифиллина и токоферола (витамина Е). 78,83 Последние продукты, пентоксифиллин и токоферол, были протестированы на том основании, что сообщалось об их эффективности в уменьшении фиброза, вызванного лучевой терапией. 84 К сожалению, доказательств эффективности этих продуктов не существует, поскольку обнадеживающие сообщения о случаях, вызвавшие интерес к этим методам лечения, не сопровождались проспективными испытаниями.
84 К сожалению, доказательств эффективности этих продуктов не существует, поскольку обнадеживающие сообщения о случаях, вызвавшие интерес к этим методам лечения, не сопровождались проспективными испытаниями.
Вопросы, касающиеся возможной плохой прогностической ценности утолщенного эндометрия при ВРТ, о которых сообщила команда Casper 85 , остаются предметом обсуждения. В то время как это подтверждено некоторыми, 76 большая группа публикаций не подтвердила, что более толстый эндометрий оказывает явное негативное влияние на результаты ВРТ. 86-89
Менструальный цикл – обзор
Влияние менструального цикла на циркадные ритмы
Продолжительность менструального цикла у человека колеблется от 25 до 35 дней, в среднем 28 дней. Продолжительность менструального цикла человека, вероятно, определяется циркадной системой, как и у грызунов. В нормальном овуляторном менструальном цикле происходят циклические изменения четырех репродуктивных гормонов, а именно лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), эстрогена и прогестерона. Во время менструации уровни всех четырех ключевых репродуктивных гормонов низкие. После этого, по мере повышения ФСГ и эстрогена, фолликулы яичников развиваются и созревают во время фолликулярной фазы. Пик ЛГ достигается примерно за 16 ч до овуляции. Во время овуляции ооцит высвобождается из фолликула, а желтое тело затем развивается из разорванного фолликула и секретирует прогестерон и эстроген. Примерно через 7 дней после овуляции, если оплодотворение и имплантация не происходят, желтое тело дегенерирует и выработка гормонов начинает снижаться.Лютеиновая фаза после овуляции длится 14–16 дней.
Во время менструации уровни всех четырех ключевых репродуктивных гормонов низкие. После этого, по мере повышения ФСГ и эстрогена, фолликулы яичников развиваются и созревают во время фолликулярной фазы. Пик ЛГ достигается примерно за 16 ч до овуляции. Во время овуляции ооцит высвобождается из фолликула, а желтое тело затем развивается из разорванного фолликула и секретирует прогестерон и эстроген. Примерно через 7 дней после овуляции, если оплодотворение и имплантация не происходят, желтое тело дегенерирует и выработка гормонов начинает снижаться.Лютеиновая фаза после овуляции длится 14–16 дней.
Циркадные ритмы зависят от овуляторного менструального цикла. Большинство исследований женщин, следующих своему обычному графику, обнаружили, что ночное снижение температуры тела притупляется, уменьшая амплитуду температурного ритма в лютеиновую фазу по сравнению с фолликулярной фазой. Эти результаты были подтверждены у женщин, наблюдавшихся в строго контролируемых условиях процедуры ультракоротких циклов сна-бодрствования в исследовании, проведенном Шехтер и его коллегами. В контролируемых условиях нет разницы между фолликулярной и лютеиновой фазами менструального цикла в фазе суточного температурного ритма. Точно так же фаза ритма мелатонина не зависит от фазы менструального цикла при исследовании в постоянных условиях. Недавние данные свидетельствуют о том, что, в отличие от температуры тела, амплитуда ритма мелатонина, по-видимому, не снижается в лютеиновую фазу, хотя не все результаты совпадают. Снижение амплитуды температурного ритма может быть опосредовано прогестероном; концентрации прогестерона отрицательно коррелируют с амплитудой температуры.Прогестерон может действовать непосредственно на свои рецепторы в СХЯ, может ингибировать ночное гипотермическое действие мелатонина или может действовать ниже СХЯ в областях, участвующих в терморегуляции, модулируя амплитуду температурного ритма.
В контролируемых условиях нет разницы между фолликулярной и лютеиновой фазами менструального цикла в фазе суточного температурного ритма. Точно так же фаза ритма мелатонина не зависит от фазы менструального цикла при исследовании в постоянных условиях. Недавние данные свидетельствуют о том, что, в отличие от температуры тела, амплитуда ритма мелатонина, по-видимому, не снижается в лютеиновую фазу, хотя не все результаты совпадают. Снижение амплитуды температурного ритма может быть опосредовано прогестероном; концентрации прогестерона отрицательно коррелируют с амплитудой температуры.Прогестерон может действовать непосредственно на свои рецепторы в СХЯ, может ингибировать ночное гипотермическое действие мелатонина или может действовать ниже СХЯ в областях, участвующих в терморегуляции, модулируя амплитуду температурного ритма.
Дополнительные доказательства влияния половых гормонов на циркадные ритмы получены в исследованиях женщин, принимающих гормональные контрацептивы, которые обычно содержат синтетический эстроген и прогестин. Оральные контрацептивы изменяют ритмы температуры и мелатонина.Женщины, принимающие оральные контрацептивы, имеют сходные 24-часовые профили температуры тела, при этом температурные надиры происходят в то же время, что и женщины с овуляторными менструальными циклами в лютеиновую фазу. Эти повышения температуры тела, скорее всего, вызваны термогенным действием прогестинов, содержащихся в противозачаточных таблетках. Большинство исследований выявило повышенный ночной уровень мелатонина у женщин, принимающих оральные контрацептивы. Возможно повышение уровня мелатонина при ановуляции; женщины с гипоталамической и вторичной аменореей также имеют повышенный уровень мелатонина.
Оральные контрацептивы изменяют ритмы температуры и мелатонина.Женщины, принимающие оральные контрацептивы, имеют сходные 24-часовые профили температуры тела, при этом температурные надиры происходят в то же время, что и женщины с овуляторными менструальными циклами в лютеиновую фазу. Эти повышения температуры тела, скорее всего, вызваны термогенным действием прогестинов, содержащихся в противозачаточных таблетках. Большинство исследований выявило повышенный ночной уровень мелатонина у женщин, принимающих оральные контрацептивы. Возможно повышение уровня мелатонина при ановуляции; женщины с гипоталамической и вторичной аменореей также имеют повышенный уровень мелатонина.
Таким образом, наблюдаемые ритмы температуры и мелатонина у женщин с овуляторными менструальными циклами и у женщин, принимающих гормональные контрацептивы, зависят от их гормонального статуса. Поэтому эти факторы необходимо учитывать при изучении половых различий в циркадных ритмах. Хотя это выходит за рамки этой статьи, следует также отметить, что существуют изменения мелатониновых ритмов в связи с изменением репродуктивного состояния; женщины в постменопаузе имеют более раннюю мелатониновую акрофазу по сравнению с женщинами в пременопаузе, что может быть следствием возраста, гормональных изменений, связанных с менопаузой, или того и другого.
Секреторная фаза менструации и имплантации
Женская репродуктивная система подготавливает женский организм к зачатию и беременности посредством двух различных циклов: цикла яичников и цикла эндометрия. Эндометрий человека под влиянием сложных биологических сигналов подвергается циклическим изменениям при подготовке к имплантации и наступлению беременности. Массив молекулярной активности, все еще плохо изученный, приводит к относительно последовательным морфологическим изменениям эндометрия во время каждого цикла.В эпоху вспомогательных репродуктивных технологий (ВРТ) существует постоянно растущая потребность в определении этих путей для повышения частоты наступления беременности. В конечном счете, успех в области репродукции и фертильности требует понимания этих сложных процессов, от молекулярных до клеточных и тканевых, как у здорового пациента, так и в условиях различных патологических состояний.
В этой главе будет обсуждаться цикл эндометрия с акцентом на секреторную фазу, включая молекулярные и биохимические компоненты рецептивности и имплантации эндометрия. Будут рассмотрены маркеры и методы оценки восприимчивости, а также патологические состояния, влияющие на фертильность.
Будут рассмотрены маркеры и методы оценки восприимчивости, а также патологические состояния, влияющие на фертильность.
Эндометрий состоит из двух основных слоев: функционального и базального. Функционал состоит из компактной зоны, включающей строму под просветным эпителием, и губчатой зоны, лежащей над базальным слоем [1,2]. Миометрий лежит под базальным слоем, который подвергается меньшим циклическим изменениям по сравнению с функциональным слоем и способен регенерировать функциональный слой после менструации (рис. 1).
Эндометриальный цикл состоит из трех последовательных фаз — пролиферативной, секреторной и менструальной. Каждая фаза характеризуется физиологическими изменениями, которые контролируются циркулирующими уровнями эстрогена и прогестерона, на которые, в свою очередь, влияют яичники. Овариальный цикл характеризуется развитием фолликулов, опосредованным ФСГ (фолликулярная фаза), овуляцией, опосредованной выбросом ЛГ, а также развитием желтого тела и выработкой прогестерона (лютеиновая фаза). В идеальном 28-дневном цикле овуляция происходит на 14-й день, желтое тело становится атретичным на 28-й день, а менструация начинается на следующий день, 1-й день. После овуляции остаток доминантного фолликула становится желтым телом, временной эндокринной структурой, которая вырабатывает прогестерон (рис. 1) [1-4].
В идеальном 28-дневном цикле овуляция происходит на 14-й день, желтое тело становится атретичным на 28-й день, а менструация начинается на следующий день, 1-й день. После овуляции остаток доминантного фолликула становится желтым телом, временной эндокринной структурой, которая вырабатывает прогестерон (рис. 1) [1-4].
Рисунок 1. Функциональная анатомия эндометрия человека в секреторной фазе.
Во время пролиферативной фазы эстроген способствует восстановлению функционального слоя с реэпителизацией примерно на 5-й день менструального цикла.Эта фаза характеризуется гипертрофией и пролиферацией желез, увеличением стромального матрикса и удлинением терминальных артериол в просвет эндометрия. Эстроген также активирует рецепторы прогестерона, которые управляют окружающей средой во время секреторной фазы, что будет более подробно рассмотрено в следующем разделе [2,4]. В отсутствие оплодотворения уровень прогестерона снижается из-за атрезии желтого тела. Это приводит к сосудистым изменениям, последующей гибели тканей и отслоению эндометрия или менструациям.
Это приводит к сосудистым изменениям, последующей гибели тканей и отслоению эндометрия или менструациям.
На протяжении десятилетий датирование эндометрия проводилось гистологически [4,5]. После овуляции наблюдается увеличение поверхностного отека стромы, который становится генерализованным к 21 дню. Стромальные клетки вблизи терминальных спиральных артерий демонстрируют увеличение цитоплазмы и окружающего внеклеточного матрикса, процесс, называемый предецидуализацией, который в конечном итоге охватывает большую часть поверхностного эндометрия к дню. 25. К 27 дню поверхностные стромальные клетки почти неотличимы от децидуальных клеток беременности.Увеличивающийся отек во время секреторной фазы приводит к глобальному утолщению эндометрия, которое хорошо видно при УЗИ. На протяжении секреторной фазы также наблюдаются отчетливые изменения в спиральных артериях. Они быстро удлиняются, опережая утолщение эндометрия, и становятся все более извитыми [4-6,7].
Во время пролиферативной фазы наблюдается усиление митотической активности железистого эпителия и псевдостратификация ядер. Во время этой фазы также происходит параллельное увеличение пролиферации компонентов стромы.После овуляции этот процесс сменяется секреторной трансформацией желез и замедлением стромальной пролиферации. На клеточном уровне железистых эпителиальных клеток ранняя секреторная фаза характеризуется обильным эндоплазматическим ретикулумом, накоплением богатых гликогеном вакуолей и центральным смещением ядер. Через шесть дней после овуляции потеря вакуолей из цитоплазмы соответствует максимальной секреторной активности желез [4,7].
Во время этой фазы также происходит параллельное увеличение пролиферации компонентов стромы.После овуляции этот процесс сменяется секреторной трансформацией желез и замедлением стромальной пролиферации. На клеточном уровне железистых эпителиальных клеток ранняя секреторная фаза характеризуется обильным эндоплазматическим ретикулумом, накоплением богатых гликогеном вакуолей и центральным смещением ядер. Через шесть дней после овуляции потеря вакуолей из цитоплазмы соответствует максимальной секреторной активности желез [4,7].
Сложное взаимодействие между стромальными клетками и иммунными клетками подчеркивает секреторную фазу поверхностного эндометрия.Значительная часть популяции маточных лейкоцитов состоит из CD56-/CD16+ маточных естественных киллеров (uNK), которые, как полагают, играют роль в материнском аллораспознавании фетальных трофобластов, а не в цитотоксичности. uNK-клетки в основном обнаруживаются вблизи спиральных артерий и экстраворсинчатых трофобластов на ранних сроках беременности. Популяция клеток резко увеличивается после овуляции и исчезает перед менструацией при отсутствии беременности. Показано, что активность uNK-клеток контролируется регионарными стероидными гормонами, а также локальными хемокинами, в том числе содержащими мотив (C-X-C) и различными интерлейкинами [1,4].
Популяция клеток резко увеличивается после овуляции и исчезает перед менструацией при отсутствии беременности. Показано, что активность uNK-клеток контролируется регионарными стероидными гормонами, а также локальными хемокинами, в том числе содержащими мотив (C-X-C) и различными интерлейкинами [1,4].
Макрофаги (CD163+) также обнаруживаются в поверхностном эндометрии, быстро накапливаясь в строме после овуляции и уменьшаясь в отсутствие прогестерона. Т-клетки разбросаны по всему эндометрию с незначительным изменением концентрации в клеточном цикле или вообще без него, а также маточные дендритные клетки (uDCs), которые более заметны в децидуальной оболочке беременных [4].
Конец секреторной фазы и начало предменструальной фазы характеризуется деградацией стромальной сети, инфильтрацией стромы лейкоцитами и прекращением активности желез при отсутствии соответствующих сигналов от ХГЧ.Деградация стромальной сети катализируется матриксными металлопротеиназами (ММП), которые активируются в условиях пониженного уровня прогестерона. Признаки апоптоза очевидны во всей ткани, а плотные внутренние структурные изменения в железистых клетках, характерные для секреции, исчезают [1,4].
Признаки апоптоза очевидны во всей ткани, а плотные внутренние структурные изменения в железистых клетках, характерные для секреции, исчезают [1,4].
Имплантация бластоцисты представляет собой высокоорганизованный избирательный процесс, который с некоторыми вариациями сохраняется у многих видов. Он вращается вокруг «окна имплантации» (WOI), во время которого эндометрий способен «принимать» трофэктодерму бластоцисты.Взаимодействие организовано различными молекулами и в целом регулируется стероидными гормонами [4,7]. Более поздние исследования показывают, что WOI длится от 12 часов до 2 дней и часто смещается у пациентов с бесплодием [3].
В 1950 г. Noyes et al. провели гистологическое исследование ранней имплантации человека и не обнаружили изменений между ожидаемым небеременным эндометрием средней секреторной фазы, за исключением инвазии трофобластов, смещающих соседние железистые структуры [5].В 1999 г. Уилкокс и соавт. сузили сроки имплантации до 8-10 дней после овуляции, при этом повышенные потери коррелировали с более поздней имплантацией [8].
Процесс имплантации состоит из нескольких хорошо описанных этапов, которые координируются с подготовкой эндометрия путем изменения стероидных гормонов. Фокус здесь начинается с аппозиции и временного прикрепления клеток синцитиального трофобласта к эпителию эндометрия, за которым следует прочное прикрепление и инвазия.Когда бластоциста попадает в полость матки, блестящая оболочка сбрасывается, что позволяет обнажить трофэктодерму [7,9]. Управляемые прогестероном, эпителиальные клетки секреторной фазы эндометрия переходят в гиперсекреторное состояние с ультраструктурными изменениями, описанными как реакция Ариаса-Стелла . Это гиперсекреторное состояние ткани обеспечивает необходимое питание, необходимое для выживания эмбриона, поскольку ремоделирование сосудов происходит позже [10].
Молекулярная основа инвазии вызывает активный интерес в этой области, поскольку нарушение этих механизмов связано с невынашиванием беременности. Текущие исследования показывают, что MUC1, большой трансмембранный муцин и барьер для имплантации, подавляется и/или удаляется под действием поверхностных протеаз и сниженной экспрессии рецепторов прогестерона. Потеря MUC1 делает возможной соответствующую аппозицию и прикрепление между эмбрионом и эндометрием. Первоначальное временное прикрепление опосредуется различными молекулами, включая селектины и галектины. Более прочное прикрепление обеспечивается интегринами, включая ανβ3 и α4β1, а также CD44 и их ассоциированный лиганд остеопонтин (OPN).Другие ассоциированные молекулы прикрепления включают трофинин, HB-EGF, фибронектин, витронектин, SPP1, ламинин, IGFBP1 и связанный с латентностью пептид, связанный с TGFβ [2,3,4,7,9].
Текущие исследования показывают, что MUC1, большой трансмембранный муцин и барьер для имплантации, подавляется и/или удаляется под действием поверхностных протеаз и сниженной экспрессии рецепторов прогестерона. Потеря MUC1 делает возможной соответствующую аппозицию и прикрепление между эмбрионом и эндометрием. Первоначальное временное прикрепление опосредуется различными молекулами, включая селектины и галектины. Более прочное прикрепление обеспечивается интегринами, включая ανβ3 и α4β1, а также CD44 и их ассоциированный лиганд остеопонтин (OPN).Другие ассоциированные молекулы прикрепления включают трофинин, HB-EGF, фибронектин, витронектин, SPP1, ламинин, IGFBP1 и связанный с латентностью пептид, связанный с TGFβ [2,3,4,7,9].
Специализированные поверхностные макромолекулярные структуры также участвуют в адгезии и инвазии бластоцисты. Эпителий эндометрия состоит как из реснитчатых, так и из нереснитчатых секреторных клеток, пропорции которых регулируются уровнями эстрогенов. Секреторные клетки образуют временные поверхностные структуры в ответ на уровни прогестерона, называемые пиноподами, во время максимальной восприимчивости.Эти структуры участвуют в пиноцитозе и содержат различные молекулы адгезии, включая ανβ3 и OPN. Развитие пиноподов зависит от HOXA-10, гена гомеобокса, экспрессия которого жизненно важна для рецептивности эндометрия, регулируя как пролиферацию эндометриальных стромальных клеток, так и морфогенез эпителиальных клеток [11]. Блокирование экспрессии HOXA-10 показывает значительное снижение числа пиноподов. Хотя некоторые данные указывают на роль пиноподов в адгезии и инвазии эмбриона, их точная функция и общая важность все еще обсуждаются [2,3].
Секреторные клетки образуют временные поверхностные структуры в ответ на уровни прогестерона, называемые пиноподами, во время максимальной восприимчивости.Эти структуры участвуют в пиноцитозе и содержат различные молекулы адгезии, включая ανβ3 и OPN. Развитие пиноподов зависит от HOXA-10, гена гомеобокса, экспрессия которого жизненно важна для рецептивности эндометрия, регулируя как пролиферацию эндометриальных стромальных клеток, так и морфогенез эпителиальных клеток [11]. Блокирование экспрессии HOXA-10 показывает значительное снижение числа пиноподов. Хотя некоторые данные указывают на роль пиноподов в адгезии и инвазии эмбриона, их точная функция и общая важность все еще обсуждаются [2,3].
Адгезия через эти молекулы далеко не статичный процесс. Внеклеточный контакт с соответствующими лигандами передает сигналы посредством различных процессов во внутриклеточные каскады, что приводит к транскрипции генов и экспрессии белков. Результирующий эффект включает адгезию, а также миграцию, пролиферацию и ремоделирование цитоскелета. Конечным результатом является инвазия эмбриона в праймированный эндометрий, где он имеет потенциал для роста и развития [2-4].
Конечным результатом является инвазия эмбриона в праймированный эндометрий, где он имеет потенциал для роста и развития [2-4].
Датирование эндометрия резко изменилось с момента установления критериев Noye для гистологического датирования в 1950 г. [5]. С более подробным пониманием биохимических путей, на которые влияют стероидные гормоны во время менструального цикла, появились новые мишени для определения рецептивности эндометрия. Первоначально анализировались отдельные молекулы. С появлением технологии микрочипов можно одновременно анализировать огромное количество молекул, чтобы получить гораздо более полную картину среды эндометрия [1,3,4].
Цитокины участвуют во многих процессах на протяжении менструального цикла и, как было показано, играют решающую роль в овуляции и имплантации. Ингибирующий лейкемию фактор (LIF) относится к семейству IL-6, и его экспрессия была продемонстрирована в эпителии эндометрия человека во время средней и поздней секреторной фазы [11]. У женщин с доказанной фертильностью биопсия эндометрия продемонстрировала экспрессию мРНК LIF с 18 по 28 день с пиком на 20 день менструального цикла с показателем 2.2-кратное увеличение секреции LIF между пролиферативной и секреторной фазами [12]. IL-6, другой цитокин, экспрессируемый в эндометрии, демонстрирует регулируемый временной паттерн в течение всего менструального цикла с самыми высокими обнаруженными уровнями во время лютеиновой фазы. Уровни мРНК IL-6 прогрессивно увеличиваются в течение средней и поздней секреторной фазы с сильной экспрессией во время окна имплантации. Белок сильно выражен в эпителиальных и железистых клетках. Костный морфогенный белок 2 (BMP2), член суперсемейства TGF-β, впервые обнаруживается в строме, окружающей место прикрепления бластоцисты, во время средней секреторной фазы.BMP2 считается критическим регулятором децидуализации из-за его роли в регуляции пролиферации и дифференцировки, а также его экспрессии в период имплантации [13].
У женщин с доказанной фертильностью биопсия эндометрия продемонстрировала экспрессию мРНК LIF с 18 по 28 день с пиком на 20 день менструального цикла с показателем 2.2-кратное увеличение секреции LIF между пролиферативной и секреторной фазами [12]. IL-6, другой цитокин, экспрессируемый в эндометрии, демонстрирует регулируемый временной паттерн в течение всего менструального цикла с самыми высокими обнаруженными уровнями во время лютеиновой фазы. Уровни мРНК IL-6 прогрессивно увеличиваются в течение средней и поздней секреторной фазы с сильной экспрессией во время окна имплантации. Белок сильно выражен в эпителиальных и железистых клетках. Костный морфогенный белок 2 (BMP2), член суперсемейства TGF-β, впервые обнаруживается в строме, окружающей место прикрепления бластоцисты, во время средней секреторной фазы.BMP2 считается критическим регулятором децидуализации из-за его роли в регуляции пролиферации и дифференцировки, а также его экспрессии в период имплантации [13].
Амниотическая жидкость содержит значительное количество пролактина (ПРЛ), который вырабатывается децидуальной оболочкой. Было установлено, что выработка ПРЛ в эндометрии начинается примерно на 22-й день цикла, и его уровень повышается на протяжении всей беременности. Точно так же высокие уровни IGFBP-1 и LEFTY2 продуцируются секреторной фазой эндометрия в ответ на прогестерон.Учитывая их обилие и выработку во время менструального цикла, эти белки служат потенциальными маркерами рецептивности эндометрия, хотя клиническая полезность еще не ясна [1-4,9].
Было установлено, что выработка ПРЛ в эндометрии начинается примерно на 22-й день цикла, и его уровень повышается на протяжении всей беременности. Точно так же высокие уровни IGFBP-1 и LEFTY2 продуцируются секреторной фазой эндометрия в ответ на прогестерон.Учитывая их обилие и выработку во время менструального цикла, эти белки служат потенциальными маркерами рецептивности эндометрия, хотя клиническая полезность еще не ясна [1-4,9].
Простагландины (ПГ) играют решающую роль в успешной имплантации эмбриона благодаря своим вазоактивным свойствам. Генерация PG достигается цитозольной фосфолипазой A 2 (cPL) и циклооксигеназой (COX). Исследования на самках мышей, лишенных ферментов cPLA 2 или ЦОГ-2, продемонстрировали жизненно важную роль PG в имплантации.Экспрессия PGE 2 и PGF 2α была обнаружена в эндометрии человека на всех стадиях менструального цикла, но снижалась во время поздней секреторной фазы [11].
Несколько интегринов рассматривались как возможные маркеры рецептивности матки, и было отмечено, что они претерпевают изменения в эпителии и децидуальной оболочке во время имплантации. Коэкспрессия α1β1, ανβ3 и α4β1 отмечает период рецептивности эндометрия, опосредуя прочное прикрепление между эмбрионом и эндометрием.Регулируемая экспрессия интегринов секреторной фазы предполагает, что стероидные гормоны, вероятно, играют роль в их присутствии. Обнаружение экспрессии рецептора α1β1/ламинина (VLA-1) на секреторной фазе эпителия эндометрия свидетельствует о том, что прогестерон активирует α1β1 в эндометрии. Прочное прикрепление, опосредованное интегринами, также зависит от лигандов, ассоциированных с интегринами. Секретируемый фосфопротеин 1 (SPP1), также известный как остеопонтин, является лигандом для ανβ3, который продемонстрировал значительную активацию в эпителиальных клетках эндометрия во время секреторной фазы.Этот гликопротеин опосредует клеточную адгезию и миграцию во время имплантации эмбриона. Кальцитонин, известный повышающий регулятор ανβ3, временно продуцируется в маточном эпителии в период имплантации. Он способствует росту трофобластов на эпителиальных клетках эндометрия человека и подавляет экспрессию E-кадгерина [11,14].
Кальцитонин, известный повышающий регулятор ανβ3, временно продуцируется в маточном эпителии в период имплантации. Он способствует росту трофобластов на эпителиальных клетках эндометрия человека и подавляет экспрессию E-кадгерина [11,14].
Другим гликопротеином, обнаруженным в эндометрии человека, является муцин-1 (MUC1), фактор, который препятствует клеточной адгезии при высокой экспрессии на клеточной поверхности.MUC1, вероятно, является первой молекулой, с которой эмбрион сталкивается на пути к прикреплению, и считается, что она отталкивает бластоцисту до тех пор, пока время и место не станут идеальными для имплантации. Это подтверждается очевидным подавлением MUC1 прогестероном перед имплантацией в рецептивный эндометрий мышей. Сниженная экспрессия облегчает эмбрио-эпителиальные взаимодействия, демаскируя молекулы клеточной адгезии на поверхности эндометрия [11]. При измерении у людей MUC1 показал повышенную экспрессию в периимплантационный период, что противоречит исследованиям на других видах.
Два связанных с цитоскелетом белка, статмин 1 и аннексин А2, обнаруживают противоположную регуляцию в рецептивном и дорецептивном эндометрии. Статмин 1 представляет собой фосфопротеин и регулирует динамику микротрубочек во время развития клеточного цикла, особенно в месте имплантации эмбриона. В рецептивном эндометрии человека он подавляется из-за более низких уровней, необходимых для поддержки децидуализации. Аннексин А2, недавно идентифицированный как одна из молекул апикальной поверхности в рецептивном эндометрии человека, участвует в клеточной трансформации, дифференцировке, регуляции секреторных процессов, высвобождении пролактина и образовании простагландинов.В эпителии эндометрия человека экспрессия аннексина А2 высока в средней и поздней секреторной фазе и снижена в пререцептивной фазе. Этот паттерн экспрессии, наряду с исследованиями in vitro, показывающими роль в адгезивности эмбрионов, предполагает, что аннексин А2 жизненно важен для имплантации [15].
Биомаркер гена-репрессора, BCL6, измеряется для выявления эндометриоза у женщин с необъяснимым бесплодием. Экспрессия этого белка связана с воспалением, и его значительно повышенные значения наблюдаются в секреторной фазе у пациенток с эндометриозом.Данные свидетельствуют о том, что BCL6 связан с дисфункцией эндометрия, в первую очередь с резистентностью к прогестерону, что приводит к дефектам имплантации и увеличению числа неудачных попыток ЭКО [16,17].
Ионные каналы в эндометрии продемонстрировали свою роль в регуляции рецептивности эндометрия и имплантации эмбриона. Объем электролитсодержащей жидкости в просвете матки колеблется на протяжении менструального цикла под влиянием гормонов яичников и значительно снижается в среднесекреторную фазу.Это наводит на мысль о чистой абсорбции жидкости через эндометрий во время рецептивной фазы. Трансмембранный регулятор проводимости при муковисцидозе (CFTR) опосредует отток Cl —, который необходим для секреции эпителиальной жидкости. Известно, что эпителий эндометрия содержит CFTR, играющий активную роль в эндометриальном Cl — и секреции жидкости. Понижающая регуляция CFTR прогестероном во время секреторной фазы, вероятно, способствует уменьшению объема, что способствует имплантации эмбриона.Эпителиальный натриевый канал (ENaC) присутствует в эндометрии и обеспечивает движущую силу для абсорбции воды после установления градиента натрия, способствуя динамической регуляции жидкости в просвете матки. CFTR оказывает ингибирующее действие на ENaC, поэтому подавление CFTR во время секреторной фазы усиливает абсорбционную активность эпителия эндометрия. ENaC активируется прогестероном, способствуя абсорбционным свойствам эпителия эндометрия во время секреторной фазы.Другие ионные каналы, такие как K + и Ca 2+ , и переносчики ионов, SLC4 и SLC26, становятся важными игроками в регуляции некоторых процессов имплантации эмбриона [13].
Известно, что эпителий эндометрия содержит CFTR, играющий активную роль в эндометриальном Cl — и секреции жидкости. Понижающая регуляция CFTR прогестероном во время секреторной фазы, вероятно, способствует уменьшению объема, что способствует имплантации эмбриона.Эпителиальный натриевый канал (ENaC) присутствует в эндометрии и обеспечивает движущую силу для абсорбции воды после установления градиента натрия, способствуя динамической регуляции жидкости в просвете матки. CFTR оказывает ингибирующее действие на ENaC, поэтому подавление CFTR во время секреторной фазы усиливает абсорбционную активность эпителия эндометрия. ENaC активируется прогестероном, способствуя абсорбционным свойствам эпителия эндометрия во время секреторной фазы.Другие ионные каналы, такие как K + и Ca 2+ , и переносчики ионов, SLC4 и SLC26, становятся важными игроками в регуляции некоторых процессов имплантации эмбриона [13].
Микроматричный анализ ткани эндометрия позволяет одновременно оценивать от сотен до тысяч молекул. Геномный и протеомный анализ выявил различные уровни генов и белков, участвующих в широком спектре действий во время децидуализации. Оценка секретируемой жидкости, называемая секретомикой, которая в основном касается уровней белков и липидов, позволяет проводить высокопроизводительный анализ секрета эндометрия во время секреторной фазы без необходимости биопсии.Хотя наше понимание технологии микрочипов в связи с бесплодием все еще развивается, на рынке есть продукты, которые находят клиническое применение и будут обсуждаться более подробно позже в этой главе [3,18,19].
Геномный и протеомный анализ выявил различные уровни генов и белков, участвующих в широком спектре действий во время децидуализации. Оценка секретируемой жидкости, называемая секретомикой, которая в основном касается уровней белков и липидов, позволяет проводить высокопроизводительный анализ секрета эндометрия во время секреторной фазы без необходимости биопсии.Хотя наше понимание технологии микрочипов в связи с бесплодием все еще развивается, на рынке есть продукты, которые находят клиническое применение и будут обсуждаться более подробно позже в этой главе [3,18,19].
Человеческий эндометрий имеет уникальную протеомную сигнатуру во время секреторной фазы, что подтверждается многими исследованиями. Маркеры восприимчивости измеряются в клинических условиях, чтобы избежать неудач при имплантации и, как мы надеемся, обеспечить более благоприятный исход для пациентов, использующих АРТ.Хотя некоторые из упомянутых биомаркеров только недавно были обнаружены как ключевые игроки в рецептивном эндометрии человека, эти открытия обещают лучшее понимание сложных взаимодействий на протяжении секреторной фазы и окна имплантации.
Учитывая сложную природу рецептивности эндометрия, неудивительно, что возникают проблемы. Местные факторы, которые могут негативно влиять на восприимчивость и имплантацию, можно разделить на механические и воспалительные факторы.К местным факторам относятся воспалительные состояния, такие как эндометриоз, аденомиоз, гидросальпингез и эндометрит, а механические аномалии охватывают как врожденные аномалии, так и приобретенные состояния [2,20,21].
Механические аномалии матки, такие как маточные перегородки, миомы, полипы и спайки, приводят к физическим препятствиям для успешного оплодотворения и имплантации. Эти состояния связаны с невынашиванием беременности и бесплодием, и существуют существенные доказательства того, что хирургическая коррекция этих аномалий может улучшить результаты [2,21].
Учитывая тонкую регуляцию менструального цикла и биологии имплантации, воспалительные факторы, влияющие на сигнальные пути, могут явно нарушать нормальные физиологические процессы. В условиях локального воспаления резистентность к прогестерону и доминирование рецепторов эстрогена были показаны с помощью микрочипового анализа, что приводит к нарушению имплантации. Например, при эндометриозе наблюдается увеличение воспалительных цитокинов, включая TNFα, INFγ, IL-1 и IL-17.Это приводит к последующим эффектам, таким как фосфорилирование STAT3, что, в свою очередь, помогает привести к доминированию эстрогена и резистентности к прогестерону [2,20]. Снижение экспрессии IL-11 и CCL4, связанных с рецептивностью эмбрионов, обнаруживается при хроническом эндометрите и, как полагают, связано с бесплодием, связанным с этим состоянием [22]. Низкий уровень интегрина был связан с воспалительными состояниями и снижением экспрессии ανβ3, что может быть вызвано повышенным уровнем эстрогена, и было связано с неудачей ЭКО.И наоборот, гиперэкспрессия ароматазы наблюдается при воспалительных состояниях и связана с прогнозированием неудачи в циклах ВРТ. Другие хемокины и цитокины, такие как интерлейкины, также связаны с воспалением и невынашиванием беременности [2].
В условиях локального воспаления резистентность к прогестерону и доминирование рецепторов эстрогена были показаны с помощью микрочипового анализа, что приводит к нарушению имплантации. Например, при эндометриозе наблюдается увеличение воспалительных цитокинов, включая TNFα, INFγ, IL-1 и IL-17.Это приводит к последующим эффектам, таким как фосфорилирование STAT3, что, в свою очередь, помогает привести к доминированию эстрогена и резистентности к прогестерону [2,20]. Снижение экспрессии IL-11 и CCL4, связанных с рецептивностью эмбрионов, обнаруживается при хроническом эндометрите и, как полагают, связано с бесплодием, связанным с этим состоянием [22]. Низкий уровень интегрина был связан с воспалительными состояниями и снижением экспрессии ανβ3, что может быть вызвано повышенным уровнем эстрогена, и было связано с неудачей ЭКО.И наоборот, гиперэкспрессия ароматазы наблюдается при воспалительных состояниях и связана с прогнозированием неудачи в циклах ВРТ. Другие хемокины и цитокины, такие как интерлейкины, также связаны с воспалением и невынашиванием беременности [2].
Хотя в нашем понимании рецептивности эндометрия и имплантации на уровне матки все еще существует много пробелов, беременность и неудачи ВРТ не могут быть полностью объяснены местными факторами. Существует множество системных нарушений, которые могут повлиять на среду матки и способность эмбриона к имплантации.Эти факторы включают заболевания щитовидной железы, дефицит витамина D, нарушения пролактина, воспалительные заболевания кишечника, ожирение и курение. Имеются убедительные доказательства, связывающие гипотиреоз и бесплодие/уровень успеха ЭКО, что побуждает к лечению левотироксином у пациентов с ТТГ < 2,5 мМЕ/л [2]. Ожирение также было связано с бесплодием, с доказательствами, поддерживающими снижение веса для улучшения показателей беременности [2,23]. Однако наше понимание того, как эти системные состояния влияют на фертильность, все еще ограничено, и необходимы дальнейшие исследования для полной оценки этих взаимосвязей.
Исторически датирование рецептивного эндометрия в значительной степени основывалось на морфологических критериях [5]. Недостатки этого метода, вызванные значительным прогрессом в нашем молекулярном понимании эндометриального цикла, привели к появлению новых технологий. Хотя использование отдельных молекулярных сигнатур не дало удовлетворительных результатов, более многообещающим оказался высокопроизводительный анализ широкого спектра маркеров [3]. Недавнее создание «-omics», или полей, которые используют высокопроизводительные методы со сложным анализом больших данных для создания гораздо более подробных картин молекулярных и биохимических процессов, произвело революцию в нашем понимании рецептивного эндометрия [3,4,18, 19].
Недостатки этого метода, вызванные значительным прогрессом в нашем молекулярном понимании эндометриального цикла, привели к появлению новых технологий. Хотя использование отдельных молекулярных сигнатур не дало удовлетворительных результатов, более многообещающим оказался высокопроизводительный анализ широкого спектра маркеров [3]. Недавнее создание «-omics», или полей, которые используют высокопроизводительные методы со сложным анализом больших данных для создания гораздо более подробных картин молекулярных и биохимических процессов, произвело революцию в нашем понимании рецептивного эндометрия [3,4,18, 19].
Анализ эндометриального цикла с использованием транскриптомики, или изучение транскрипции ДНК в различных средах, находится под пристальным вниманием уже более десяти лет [3]. Используя методы экспрессии генов на микрочипах, исследователи смогли одновременно изучить экспрессию тысяч генов на разных фазах эндометриального цикла. Они определили уникальный генный профиль во время окна имплантации, который включает ранее идентифицированные важные факторы, такие как фактор ингибирования лейкемии (LIF), остеопонтин, CXCL14, гликоделин, IL15, лиганды L-селектина и различные антиоксиданты [3]. Используя эту подпись транскрипции, Díaz-Gimeno et al. [24] создали клинический инструмент для определения рецептивности эндометрия. В контролируемых исследованиях использование этого инструмента, получившего название «Матрица восприимчивости эндометрия» (ERA), выявило сдвинутые окна имплантации у женщин с бесплодием. Кроме того, перенос эмбрионов в течение соответствующего окна приводит к беременности и частоте имплантации, аналогичной контрольным группам [25].
Используя эту подпись транскрипции, Díaz-Gimeno et al. [24] создали клинический инструмент для определения рецептивности эндометрия. В контролируемых исследованиях использование этого инструмента, получившего название «Матрица восприимчивости эндометрия» (ERA), выявило сдвинутые окна имплантации у женщин с бесплодием. Кроме того, перенос эмбрионов в течение соответствующего окна приводит к беременности и частоте имплантации, аналогичной контрольным группам [25].
Хотя транскриптомика дала впечатляющие результаты, она опирается на биопсию ткани.Исследователи анализировали эндометриальную жидкость на состав, начиная с 1970-х годов [21]. В последнее время технологии позволяют проводить высокопроизводительный анализ вагинальных выделений. Эта область исследования была названа секретомикой [26,27]. Поскольку основное внимание уделяется забору внеклеточной жидкости, интересующие молекулы в основном представляют собой белки и липиды. Анализ белков в значительной степени выявил повышенные уровни белков, описанные другими методами. Однако постулируется, что травма от простого введения катетера для получения образца коррелирует с повышенным уровнем структурных белков [18].Анализ уровней липидов выявил повышенные уровни PGE2 и PGF2α во время WOI. Хотя предварительная информация об анализе эндометриальной секреции интригует, необходимы дальнейшие исследования [18,27].
Однако постулируется, что травма от простого введения катетера для получения образца коррелирует с повышенным уровнем структурных белков [18].Анализ уровней липидов выявил повышенные уровни PGE2 и PGF2α во время WOI. Хотя предварительная информация об анализе эндометриальной секреции интригует, необходимы дальнейшие исследования [18,27].
Наше понимание бесплодия и рецептивности эндометрия значительно расширилось за последние несколько десятилетий. Однако многие вопросы остаются без ответа. Продолжает поступать новая информация о молекулярных и биохимических маркерах эндометриального цикла.К ним относятся потенциальные цели для фармацевтических препаратов. Эти открытия подпитываются значительными достижениями в исследовательских технологиях. Высокопроизводительный анализ произвел революцию в этой области. Секвенирование нового поколения, или массивно-параллельное секвенирование, позволит еще более детально изучить уникальную сигнатуру рецептивного эндометрия. Перевод этого исследования в клинические испытания, а затем и в клиническую практику окажет большое влияние на область репродуктивной эндокринологии и бесплодия.
- Critchley HO, Saunders PT (2009)Динамика гормональных рецепторов в восприимчивом эндометрии человека. Reprod Sci 16: 191-199. [Перекрестная ссылка]
- Fox C, Morin S, Jeong JW, Scott RT Jr, Lessey BA (2016) Местные и системные факторы и имплантация: каковы доказательства? Fertil Steril 105: 873-884. [Перекрестная ссылка]
- Гомес Э., Руис-Алонсо М., Миравет Дж., Симон С. (2015) Транскриптомика эндометрия человека: значение для имплантации эмбрионов. Колд Спринг Харб Perspect Med 5: a022996. [Перекрестная ссылка]
- Геллерсен Б., Бросенс Дж. Дж. (2014) Циклическая децидуализация эндометрия человека при репродуктивном здоровье и неудачах. Endocr Rev 35: 851-905. [Перекрестная ссылка]
- Noyes RW, Hertig AT, Rock J (1950) Датировка биопсии эндометрия. Fertil Steril 1: 3-25.
- Rock J, Bartlett MK (1937) Биопсия человеческого эндометрия: критерии датирования и информация об аменорее, меноррагии и времени овуляции.
 J Am Med Assoc 108: 2022-2028. [Перекрестная ссылка]
J Am Med Assoc 108: 2022-2028. [Перекрестная ссылка] - Bazer FW, Spencer TE, Johnson GA, Burghardt RC, Wu G (2009) Сравнительные аспекты имплантации. Репродукция 138: 195-209. [Перекрестная ссылка]
- Wilcox AJ, Baird DD, Weinberg CR (1999) Время имплантации зачатия и потеря беременности. N Engl J Med 340: 1796-1799. [Перекрестная ссылка]
- Bazer FW, Wu G, Spencer TE, Johnson GA, Burghardt RC, et al. (2010) Новые пути имплантации, установления и поддержания беременности у млекопитающих. Mol Hum Reprod 16: 135-152. [Перекрестная ссылка]
- Ариас-Стелла Дж. (2002) Реакция Ариаса-Стеллы: факты и фантазии спустя четыре десятилетия. Адв Анат Патол 9: 12-23. [Перекрестная ссылка]
- Achache H, Revel A (2006)Маркеры рецептивности эндометрия, путь к успешной имплантации эмбриона. Hum Reprod Обновление 12: 731-746. [Перекрестная ссылка]
- Гарридо-Гомес Т., Киньонеро А.
 , Антунес О., Диас-Химено П., Беллвер Дж. и др. (2014)Расшифровка протеомной сигнатуры восприимчивости человеческого эндометрия. Hum Reprod 29: 1957-1967. [Перекрестная ссылка]
, Антунес О., Диас-Химено П., Беллвер Дж. и др. (2014)Расшифровка протеомной сигнатуры восприимчивости человеческого эндометрия. Hum Reprod 29: 1957-1967. [Перекрестная ссылка] - Ruan YC, Chen H, Chan HC (2014)Ионные каналы в эндометрии: регуляция восприимчивости эндометрия и имплантация эмбриона. Hum Reprod Обновление 20: 517-529. [Перекрестная ссылка]
- Lessey BA (1998)Интегрины эндометрия и формирование рецептивности матки. Hum Reprod 13 Приложение 3: 247–258. [Перекрестная ссылка]
- Домингес Ф., Гарридо-Гомес Т., Лопес Дж. А., Камафейта Э., Хинонеро А. и др. (2009) Протеомный анализ восприимчивого и невосприимчивого эндометрия человека с использованием дифференциального электрофореза в геле и MALDI-MS показывает, что статмин 1 и аннексин А2 регулируются по-разному. Hum Reprod 24: 2607-2617. [Перекрестная ссылка]
- Evans-Hoeker E, Lessey BA, Jeong JW, Savaris RF, Palomino WA, et al. (2016)Сверхэкспрессия эндометрия BCL6 в эутопическом эндометрии женщин с эндометриозом.
 Reprod Sci 23: 1234-1241. [Перекрестная ссылка]
Reprod Sci 23: 1234-1241. [Перекрестная ссылка] - Миравет-Валенсиано Дж. А., Ринкон-Бертолин А., Вилелла Ф., Саймон С. (2015) Понимание и улучшение рецептивности эндометрия. Curr Opin Obstet Gynecol 27: 187-192. [Перекрестная ссылка]
- Берланга О., Брэдшоу Х.Б., Вилелла-Митьяна Ф., Гарридо-Гомес Т., Симон С. (2011) Как секретомика эндометрия может помочь в прогнозировании имплантации. Плацента 3: S271-S275. [Перекрестная ссылка]
- Диас-Химено П., Руис-Алонсо М., Блеса Д., Симон С. (2014) Транскриптомика человеческого эндометрия. Int J Dev Biol 58: 127-137. [Перекрестная ссылка]
- Ahn SH, Singh V, Tayade C (2017)Биомаркеры при эндометриозе: проблемы и возможности. Fertil Steril 107: 523-532. [Перекрестная ссылка]
- Ревель А (2012) Дефектная рецептивность эндометрия. Fertil Steril 97: 1028-1032. [Перекрестная ссылка]
- Китая К., Мацубаяси Х., Ямагучи К.
 , Нишияма Р. и др.(2016) Хронический эндометрит: потенциальная причина бесплодия и акушерских и неонатальных осложнений. Am J Reprod Immunol 75: 13-22. [Перекрестная ссылка]
, Нишияма Р. и др.(2016) Хронический эндометрит: потенциальная причина бесплодия и акушерских и неонатальных осложнений. Am J Reprod Immunol 75: 13-22. [Перекрестная ссылка] - Marsh CA, Hecker E2 (2014) Материнское ожирение и неблагоприятные репродуктивные исходы: снижение риска. Obstet Gynecol Surv 69: 622-628. [Перекрестная ссылка]
- Wolf DP, Mastroianni L Jr (1975) Белковый состав маточной жидкости человека. Fertil Steril 26: 240-247. [Перекрестная ссылка]
- Диас-Химено П., Оркахадас Дж. А., Мартинес-Конехеро Дж. А., Эстебан Ф. Дж., Алама П. и др.(2011)Инструмент геномной диагностики рецептивности эндометрия человека на основе транскриптомной сигнатуры. Fertil Steril 95: 50-60,60.e1-15. [Перекрестная ссылка]
- Худ Б.Л., Лю Б., Алхас А., Шоджи Ю., Чалла Р. и др. (2015)Протеомика железистого эпителия и стромы эндометрия человека из пролиферативной и секреторной фаз менструального цикла. Biol Reprod 92: 106.
 [Crossref]
[Crossref] - Cheong Y, Boomsma C, Heijnen C, Macklon N (2013)Маточная секретомика: окно на интерфейсе мать-эмбрион. Fertil Steril 99: 1093-1099. [Перекрестная ссылка]
Подготовка эндометрия к переносу замороженных-размороженных эмбрионов в искусственном цикле: трансдермальный эстроген по сравнению с вагинальным
Наше исследование показало, что трансдермальный эстроген был связан с большей толщиной эндометрия, более короткой продолжительностью лечения, меньшим количеством побочных эффектов и более высокой удовлетворенностью пациентов, но более высокой частота отмены цикла по сравнению с вагинальным путем подготовки эндометрия в искусственных циклах FET.Различий в клинической беременности, клинической невынашиваемости, биохимической невынашиваемости и коэффициенте живорождения между двумя путями не наблюдалось.
Толщина эндометрия является критически важным элементом для успеха цикла ЭКО при пересадке свежего и замороженного материала. В нескольких исследованиях оценивалось его влияние на результаты цикла, и пороговое значение, используемое для того, чтобы считать толщину эндометрия приемлемой, колеблется между 7, 8 или 9 мм в соответствии с исследованиями. El-Toukhy и др. . в одном из самых ранних исследований толщины эндометрия при FET сообщили о значительно более высоком LBR в циклах с толщиной эндометрия от 9 до 14 мм по сравнению с 7–8 мм (25% против 14%, p = 0.002) 18 . В ретроспективном анализе 2997 циклов FET за 3-летний период Bu Z et al . показали, что толщина эндометрия в день переноса от 9 до 14 мм была связана со значительно лучшим LBR по сравнению с ≤ 8 мм после поправки на возраст, ИМТ, исходный уровень ФСГ, протокол FET и количество перенесенных эмбрионов (aOR = 1,5; 95% ДИ: 1,16–1,95) 19 . Самый большой отчет на сегодняшний день, ретроспективное когортное исследование канадского реестра ВРТ 20 , включало 18 942 цикла FET и показало, что CPR и LBR снижались с каждым мм уменьшением ниже 7 мм.
В нескольких исследованиях оценивалось его влияние на результаты цикла, и пороговое значение, используемое для того, чтобы считать толщину эндометрия приемлемой, колеблется между 7, 8 или 9 мм в соответствии с исследованиями. El-Toukhy и др. . в одном из самых ранних исследований толщины эндометрия при FET сообщили о значительно более высоком LBR в циклах с толщиной эндометрия от 9 до 14 мм по сравнению с 7–8 мм (25% против 14%, p = 0.002) 18 . В ретроспективном анализе 2997 циклов FET за 3-летний период Bu Z et al . показали, что толщина эндометрия в день переноса от 9 до 14 мм была связана со значительно лучшим LBR по сравнению с ≤ 8 мм после поправки на возраст, ИМТ, исходный уровень ФСГ, протокол FET и количество перенесенных эмбрионов (aOR = 1,5; 95% ДИ: 1,16–1,95) 19 . Самый большой отчет на сегодняшний день, ретроспективное когортное исследование канадского реестра ВРТ 20 , включало 18 942 цикла FET и показало, что CPR и LBR снижались с каждым мм уменьшением ниже 7 мм. Однако сравнения толщины ≥ 8 мм (85,9% циклов) не проводились.
Однако сравнения толщины ≥ 8 мм (85,9% циклов) не проводились.
В нашем исследовании средняя толщина эндометрия была > 9 мм в обеих группах, что соответствует допустимой толщине для переноса в литературе, но она была значительно выше в группе Т (9,9 против 9,3 мм, p = 0,03) . Кроме того, в группе Т было значительно меньше циклов, когда перенос выполнялся, несмотря на толщину эндометрия < 8 мм. Несмотря на то, что увеличение толщины могло быть несущественным в этом исследовании, оно могло быть гипотетически полезным в случаях с тонким эндометрием ( < 7 мм) для достижения приемлемого порога.
С другой стороны, что касается толщины эндометрия, наше исследование показало, что трансдермальный путь значительно более эффективен, чем вагинальный, для достижения необходимого порога. Мы не нашли в литературе никаких других исследований, сравнивающих эти два пути, но нашли несколько исследований, сравнивающих трансдермальный и пероральный пути, с противоречивыми результатами. Одно рандомизированное контролируемое исследование (РКИ) показало, что толщина эндометрия была значительно выше при трансдермальном введении по сравнению с пероральным лечением 21 , в то время как в двух других РКИ не удалось обнаружить каких-либо существенных различий в толщине эндометрия между двумя путями 22,23 .
В целом, пациенты, получавшие трансдермальные эстрогены, имели значительно более короткую продолжительность лечения (13,6 ± 2,7 дня против 15,5 ± 3,2 дня, р < < 0,001), с меньшим количеством случаев, требующих повторной ультразвуковой оценки (10,1% против 30,6%, р < 0,001), по сравнению с вагинальным путем. Предлагая более короткую продолжительность лечения и меньшее количество визитов в клинику, трансдермальный путь может быть более привлекательным для пациентов, чем вагинальный путь.
Средние уровни эстрадиола в плазме были более чем в пять раз выше в вагинальной группе по сравнению с трансдермальной группой (268 против 1332 пг/мл).Это различие было ожидаемым и может быть объяснено разным метаболизмом этих двух путей: оба пути обходят печеночный метаболизм первого прохождения, а вагинальный приводит к очень высоким уровням в сыворотке из-за важного всасывания через слизистую оболочку влагалища, в то время как трансдермальный обеспечивает наиболее стабильный устойчивый метаболизм. государственные уровни 12,24 . Высокий уровень эстрадиола связан со многими недостатками: более высоким сосудистым риском 25,26 , более низким LBR в FET и более высоким риском малого для гестационного возраста, аномальной плацентации и преэклампсии в последующей беременности после переноса свежих эмбрионов 27,28, 29 .Более того, более физиологичная гормональная среда, обнаруженная в циклах FET, является одним из основных аргументов в пользу переноса замороженных, а не свежих эмбрионов. Следовательно, более низкие уровни эстрадиола в плазме при трансдермальном введении эстрогена могут быть дополнительным преимуществом по сравнению с вагинальным введением.
государственные уровни 12,24 . Высокий уровень эстрадиола связан со многими недостатками: более высоким сосудистым риском 25,26 , более низким LBR в FET и более высоким риском малого для гестационного возраста, аномальной плацентации и преэклампсии в последующей беременности после переноса свежих эмбрионов 27,28, 29 .Более того, более физиологичная гормональная среда, обнаруженная в циклах FET, является одним из основных аргументов в пользу переноса замороженных, а не свежих эмбрионов. Следовательно, более низкие уровни эстрадиола в плазме при трансдермальном введении эстрогена могут быть дополнительным преимуществом по сравнению с вагинальным введением.
Представляется противоречивым наличие значительно более низких уровней эстрадиола в сыворотке в группе Т при значительно более короткой продолжительности лечения. Одно из возможных объяснений состоит в том, что очень высокие уровни эстрадиола в сыворотке, полученные при вагинальном введении, могут иметь антипролиферативный эффект. Действительно, было показано, что ядерные рецепторы эстрадиола \(\бета (ER\бета)\), а также трансмембранные рецепторы, связанные с G-белком, расположенные в эндоплазматическом ретикулуме, активируют клеточную пролиферацию при низких уровнях эстрадиола в сыворотке, в то время как они могли бы антипролиферативный эффект с высоким уровнем эстрадиола в сыворотке 30,31,32 .
Действительно, было показано, что ядерные рецепторы эстрадиола \(\бета (ER\бета)\), а также трансмембранные рецепторы, связанные с G-белком, расположенные в эндоплазматическом ретикулуме, активируют клеточную пролиферацию при низких уровнях эстрадиола в сыворотке, в то время как они могли бы антипролиферативный эффект с высоким уровнем эстрадиола в сыворотке 30,31,32 .
Отмен цикла из-за спонтанной овуляции было больше в группе T по сравнению с группой V (7,6% против 2%, p = 0,02). Это можно объяснить более низкими уровнями эстрадиола в сыворотке при трансдермальном лечении, что приводит к менее эффективному ингибированию гипоталамо-гипофизарной оси (ГГС).Действительно, уровни ЛГ в сыворотке были значительно выше в день ультразвуковой оценки в группе Т (12,1 против 5 мМЕ/мл, p < 0,001). Этот недостаток трансдермального эстрогена можно преодолеть с помощью подавления гипофиза до лечения с использованием агониста гонадотропин-рилизинг-гормона (GnRHa). Действительно, подавление с помощью GnRHa обычно используется в искусственных циклах FET, независимо от типа используемого эстрогена и без какого-либо негативного воздействия на толщину эндометрия 18,33 . Однако результаты не показали каких-либо дополнительных преимуществ при пероральном или вагинальном применении эстрадиола, когда частота спонтанной овуляции уже низкая 34 .Тем не менее, это может быть полезно при использовании трансдермального эстрогена для FET, поскольку спонтанная овуляция, по-видимому, выше. Другим вариантом снижения частоты спонтанной овуляции с помощью трансдермального лечения может быть начало лечения на 2–3-й день с двух пластырей по 100 мкг вместо одного, что повышает уровень эстрадиола в сыворотке и отрицательную обратную связь по оси HPO.
Однако результаты не показали каких-либо дополнительных преимуществ при пероральном или вагинальном применении эстрадиола, когда частота спонтанной овуляции уже низкая 34 .Тем не менее, это может быть полезно при использовании трансдермального эстрогена для FET, поскольку спонтанная овуляция, по-видимому, выше. Другим вариантом снижения частоты спонтанной овуляции с помощью трансдермального лечения может быть начало лечения на 2–3-й день с двух пластырей по 100 мкг вместо одного, что повышает уровень эстрадиола в сыворотке и отрицательную обратную связь по оси HPO.
Мы не обнаружили различий в СЛР, клиническом невынашивании беременности, биохимическом невынашивании беременности и LBR между трансдермальными и вагинальными группами.CPR и LBR, полученные в нашем исследовании, соответствуют французским национальным и европейским нормам после FET 35,36 . Несколько исследований уже показали, что тип лечения эстрогенами не влияет на исходы беременности в FET 21,34,37 , но наше исследование является первым, в котором напрямую сравниваются трансдермальный и вагинальный пути, и подтверждается отсутствие различий между два.
Наше исследование показало лучшую переносимость трансдермального эстрогена по сравнению с вагинальным эстрогеном.Действительно, общая оценка удовлетворенности была значительно выше, а частота нежелательных побочных эффектов была значительно ниже в группе Т. Более того, 85,7 % пациентов, получивших два вида лечения в двух разных циклах, заявили, что отдают предпочтение трансдермальному способу введения. Более высокий уровень нежелательных побочных эффектов можно объяснить более высоким уровнем эстрадиола в сыворотке в вагинальной группе. С другой стороны, единственным побочным эффектом, который был значительно выше при трансдермальном лечении, было покраснение/зуд в месте нанесения, часто упоминаемый побочный эффект пластырей 21,22 .Переносимость пациента является важным фактором, который следует учитывать при выборе лечения ФЭТ, учитывая, что пациенты должны быть строго соблюдены в течение 8 недель беременности. Только в одном исследовании, опубликованном в литературе, сравнивали переносимость и соблюдение пациентами чрескожного и перорального пути введения и обнаружили, что пероральное лечение было более удобным для пациентов с меньшим количеством побочных эффектов 21 .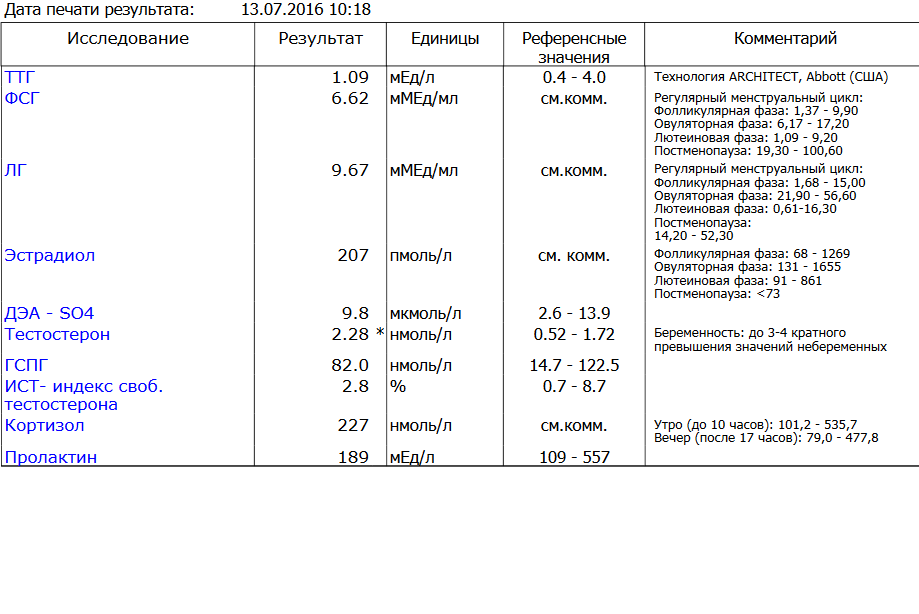
Насколько нам известно, наше исследование является первым, в котором сравнивались толщина эндометрия и результаты циклов, а также удовлетворенность пациентов и переносимость трансдермального и вагинального эстрадиола для подготовки эндометрия в циклах FET.Более того, наши клинические данные были подтверждены биологическими данными, что еще больше подтвердило наши выводы. Нашими основными ограничениями были отсутствие рандомизации и моноцентрический дизайн. Кроме того, наше исследование включало перенос эмбрионов на 2–3-й день (90%) и на 5–6-й день (10%) и не имело достаточных возможностей для сравнения частоты наступления беременности и живорождения. На ответы пациентов в опросе об удовлетворенности могли повлиять результаты предыдущего цикла с использованием того или иного маршрута. Наконец, было бы интересно добавить к сравнению пероральный путь, но мы не используем пероральный эстроген для подготовки эндометрия в нашем центре.
В заключение, наше исследование показало, что трансдермальный эстроген был связан с большей толщиной эндометрия и меньшей продолжительностью лечения по сравнению с вагинальным эстрогеном для подготовки эндометрия перед ФЭТ, но с более высокой частотой отмены цикла из-за спонтанной овуляции. Более того, трансдермальный эстроген лучше переносился пациентами со значительно меньшим количеством побочных эффектов. Наконец, исходы беременности были сопоставимы между ними. Эти данные свидетельствуют о том, что трансдермальные эстрогены должны быть предложены в первую очередь для подготовки эндометрия перед ФЭТ.Предварительная инъекция агониста ГнРГ может быть добавлена для снижения частоты спонтанной овуляции и отмены цикла.
Более того, трансдермальный эстроген лучше переносился пациентами со значительно меньшим количеством побочных эффектов. Наконец, исходы беременности были сопоставимы между ними. Эти данные свидетельствуют о том, что трансдермальные эстрогены должны быть предложены в первую очередь для подготовки эндометрия перед ФЭТ.Предварительная инъекция агониста ГнРГ может быть добавлена для снижения частоты спонтанной овуляции и отмены цикла.
Аномальное маточное кровотечение — американский семейный врач
КЭТЛИН А. ОРИЛ, доктор медицины, и САРИНА ШРАГЕР, доктор медицины, Медицинский факультет Университета Висконсина, Мэдисон, Висконсин
Am Fam Physician. 1 октября 1999 г. ; 60(5):1371-1380.
См. соответствующий информационный раздаточный материал для пациентов об аномальных маточных кровотечениях, написанный авторами этой статьи.
Наиболее вероятная этиология аномальных маточных кровотечений связана с репродуктивным возрастом пациентки, как и вероятность серьезной патологии эндометрия. Конкретный диагностический подход зависит от того, находится ли пациентка в пременопаузе, перименопаузе или постменопаузе. У женщин в пременопаузе с нормальными результатами физикального обследования наиболее вероятным диагнозом является дисфункциональное маточное кровотечение (ДМК), вторичное по отношению к ановуляции, и диагностическое исследование направлено на выявление этиологии ановуляции.У пациенток в перименопаузе биопсия эндометрия и другие методы выявления гиперплазии или карциномы эндометрия должны быть рассмотрены на ранней стадии исследования. Патология матки, особенно карцинома эндометрия, часто встречается у женщин в постменопаузе с аномальными маточными кровотечениями. Таким образом, в этой возрастной группе биопсия эндометрия или трансвагинальное УЗИ включаются в начальное исследование. Женщины в пременопаузе с ДМК могут реагировать на оральные контрацептивы, циклическую терапию медроксипрогестероном или циклическим кломифеном.Женщин в перименопаузе также можно лечить низкодозированными оральными контрацептивами или медроксипрогестероном.
Конкретный диагностический подход зависит от того, находится ли пациентка в пременопаузе, перименопаузе или постменопаузе. У женщин в пременопаузе с нормальными результатами физикального обследования наиболее вероятным диагнозом является дисфункциональное маточное кровотечение (ДМК), вторичное по отношению к ановуляции, и диагностическое исследование направлено на выявление этиологии ановуляции.У пациенток в перименопаузе биопсия эндометрия и другие методы выявления гиперплазии или карциномы эндометрия должны быть рассмотрены на ранней стадии исследования. Патология матки, особенно карцинома эндометрия, часто встречается у женщин в постменопаузе с аномальными маточными кровотечениями. Таким образом, в этой возрастной группе биопсия эндометрия или трансвагинальное УЗИ включаются в начальное исследование. Женщины в пременопаузе с ДМК могут реагировать на оральные контрацептивы, циклическую терапию медроксипрогестероном или циклическим кломифеном.Женщин в перименопаузе также можно лечить низкодозированными оральными контрацептивами или медроксипрогестероном. Беспорядочные кровотечения во время заместительной гормональной терапии у женщин в постменопаузе без явной патологии могут реагировать на манипуляции с гормональным режимом.
Беспорядочные кровотечения во время заместительной гормональной терапии у женщин в постменопаузе без явной патологии могут реагировать на манипуляции с гормональным режимом.
Аномальные маточные кровотечения являются частой причиной обращения женщин всех возрастов к семейным врачам. Термины, используемые для описания патологических маточных кровотечений, основаны на периодичности и количестве выделений (таблица 1). Дисфункциональное маточное кровотечение (ДМК), определяемое как аномальное маточное кровотечение, не вызванное патологией органов малого таза, приемом лекарств, системным заболеванием или беременностью, является наиболее частой причиной аномального маточного кровотечения, но остается диагнозом исключения.Другие причины ненормального материнового кровотечения перечислены в таблице 2.
вид / принтной таблица
Таблица 1терминология, используемая для описания ненормального маточного кровотечения
| срок | определение | |
|---|---|---|
Menorrhagia | длительное или чрезмерное кровотечение на регулярных интервалах | |
| 2 | ||
| 2 | ||
Metrorrhagia Нерегулярное, частое маточное кровотечение различных количеств, но не чрезмерных | ||
Menometrorrorrhagia | длительное или чрезмерное кровотечение при нерегулярных интервалах | |
Полименорея | Регулярное кровотечение с интервалом менее 21 дня | |
Oligomenorhea | кровотечение с интервалом превышает каждые 35 дней | |
Amenorrehea 9 0538 | без матки кровотечение по крайней мере 6 месяцев | |
Мартование матки между регулярными циклами |
терминология, используемая для описания ненормального кровотечения матки
| срок | определение | |
|---|---|---|
Menorrhagia | Продолжительное или чрезмерное кровотечение через регулярные интервалы | |
Метроррагия | Нерегулярные, частые маточные кровотечения в различных количествах, но не чрезмерно | |
Menometrorrhagia | длительного или чрезмерного кровотечения на нерегулярных интервалах | |
Polymenorhea | Регулярное кровотечение с интервалом менее 21 дня | |
Олигоменорея | Кровотечение в I NterVals превышает каждые 35 дней | |
без матки кровотечение не менее 6 месяцев | ||
Вид / Печать Таблица
Таблица 2Дифференциальная диагностика Аномальное маточное кровотечение
Осложнения беременности | |
внутриматочная беременность | |
Внематочная беременность | |
Спонтанный аборт | |
Гестационное трофебластовое заболевание | |
| 32 | |
Placenta Preventa | |
40527 | 27CerviCite |
Endometrisit | |
Trauma | |
терзания, истиранию | |
инородного тела | |
Злокачественные новообразования | |
Шейки | |
Endometrial | |
яичников | |
Доброкачественная тазовой патологии | |
шейки полипа | |
Эндометриальный полип | |
Лейомиома | |
аденомиоз | |
Системное заболевание | |
Печеночная Болезнь | |
почечная заболевание | |
7 | 32 |
Von Willebrand, | |
Лейкоз | |
Медикаменты / ятрогенная | |
внутриматочное устройство | |
Гормоны (оральные контрацептивы, эстроген, прогестерон) | |
Ановуляторные циклов | |
гипотиреоз | |
Гиперпролактинемия | |
болезнь Кушинга | |
синдром поликистоза яичников | |
дисфункции надпочечников / опухоль | |
Стресс (эмоциональный, чрезмерные физические нагрузки) |
Дифференциальный диагноз ненормального маточного кровотечения
Осложнения беременности |
интратрон беременности |
Самопроизвольный аборт |
гестационного трофобласта болезнь |
Плацента предлежание |
Заражение |
цервицит |
Эндометрит |
Травма |
терзания, истиранию |
инородного тела |
Злокачественные новообразования |
шейки |
Endometrial |
яичников |
Доброкачественная Патология таза |
шейный полип |
эндометрия Polyp |
лейомиома |
аденомиоз |
Печеночная |
Болезни почек |
Коагулопатия |
болезнь тромбоцитопении |
фон Виллебранда |
Лейкоз |
Медикаменты / ятрогенная |
внутриматочное устройство |
Гормоны (оральные контрацептивы, эстроген, прогестерон) |
Ановуляторные циклов |
гипотиреоз |
HyperProlactinemia |
поликистоз яичников |
дисфункция надпочечников / опухоль |
Стресс (эмоциональный, чрезмерная физическая нагрузка) |
Понимание нормального менструального цикла необходимо для расследования жалоб на аномальное вагинальное кровотечение. Интервалы менструального цикла, продолжительность выделений и объем выделений остаются относительно постоянными в репродуктивном возрасте женщины. В первой части цикла эстроген останавливает менструальный цикл и способствует пролиферации эндометрия. После овуляции прогестерон останавливает рост эндометрия, а затем способствует его дифференцировке. Если беременность не наступает, желтое тело регрессирует, выработка прогестерона падает, эндометрий отторгает свою оболочку и возникают менструальные кровотечения.
Интервалы менструального цикла, продолжительность выделений и объем выделений остаются относительно постоянными в репродуктивном возрасте женщины. В первой части цикла эстроген останавливает менструальный цикл и способствует пролиферации эндометрия. После овуляции прогестерон останавливает рост эндометрия, а затем способствует его дифференцировке. Если беременность не наступает, желтое тело регрессирует, выработка прогестерона падает, эндометрий отторгает свою оболочку и возникают менструальные кровотечения.
Причина ДМК обычно связана с одним из трех состояний, связанных с нарушением гормонального баланса: кровотечение прорыва эстрогена, кровотечение отмены эстрогена и кровотечение прорыва прогестерона.1 Прорывное кровотечение из-за эстрогена возникает, когда избыток эстрогена стимулирует недифференцированное разрастание эндометрия. При недостатке прогестерона для обеспечения структурной поддержки участки слизистой оболочки эндометрия отслаиваются через неравные промежутки времени. Обычная прогестероновая вазоконстрикция и закупорка тромбоцитов не происходят, что часто приводит к обильному кровотечению.
Обычная прогестероновая вазоконстрикция и закупорка тромбоцитов не происходят, что часто приводит к обильному кровотечению.
Кровотечение отмены эстрогенов возникает в результате внезапного снижения уровня эстрогенов, например, после двусторонней овариэктомии, прекращения экзогенной терапии эстрогенами или непосредственно перед овуляцией при нормальном менструальном цикле.Кровотечение отмены эстрогена обычно самокупируется и, как правило, не повторяется, если уровень эстрогена остается низким.
Прорывное кровотечение из-за прогестерона возникает, когда соотношение прогестерона и эстрогена высокое, например, при использовании методов контрацепции, содержащих только прогестерон. Эндометрий становится атрофичным и изъязвляется из-за недостатка эстрогена и склонен к частым нерегулярным кровотечениям.
Сбор анамнеза и физикальное обследование
Если аномальное маточное кровотечение не является тяжелым и не требует неотложного вмешательства, оценка начинается с тщательного сбора анамнеза, включая обычный менструальный цикл, степень недавнего кровотечения, сексуальную активность, травму и симптомы инфекции или системное заболевание. Полный физикальный осмотр, дополненный лабораторными исследованиями, должен выявить любые признаки системного заболевания.
Полный физикальный осмотр, дополненный лабораторными исследованиями, должен выявить любые признаки системного заболевания.
Гинекологический осмотр состоит из тщательного осмотра нижних отделов половых путей на наличие разрывов, патологии вульвы или влагалища, цервикальных поражений или полипов. Бимануальное исследование матки может выявить увеличение вследствие миомы матки, аденомиоза или карциномы эндометрия.
Лабораторное исследование включает определение беременности у всех пациенток репродуктивного возраста.Общий анализ крови позволяет оценить кровопотерю и адекватность тромбоцитов. Посев шейки матки и мазок Папаниколау являются подходящими начальными шагами для оценки наличия заболеваний, передающихся половым путем, или дисплазии шейки матки.
Женщины в пременопаузе
Подход к женщинам в пременопаузе с аномальным маточным кровотечением показан на рисунке 1. Если женщина репродуктивного возраста не беременна и у нее нормальный физикальный осмотр, аномальное маточное кровотечение обычно носит дисфункциональный характер и поддается лечению с гормональной терапией. Рис. (ОАК = общий анализ крови; β-ХГЧ = бета-хорионический гонадотропин человека; КОК = оральные контрацептивы; ВМС = внутриматочная спираль; ТТГ = тиреотропный гормон; ЛГ = лютеинизирующий гормон; ФСГ = фолликулостимулирующий гормон; ДГЭА-С = дигидроэпиандростерона сульфат)
Рис. (ОАК = общий анализ крови; β-ХГЧ = бета-хорионический гонадотропин человека; КОК = оральные контрацептивы; ВМС = внутриматочная спираль; ТТГ = тиреотропный гормон; ЛГ = лютеинизирующий гормон; ФСГ = фолликулостимулирующий гормон; ДГЭА-С = дигидроэпиандростерона сульфат)
Первоначальный подход к аномальному маточному кровотечению у пациенток в пременопаузе
РИСУНОК 1.
Алгоритм диагностической оценки аномальных маточных кровотечений у пациенток в пременопаузе. (ОАК = общий анализ крови; β-ХГЧ = бета-хорионический гонадотропин человека; КОК = оральные контрацептивы; ВМС = внутриматочная спираль; ТТГ = тиреостимулирующий гормон; ЛГ = лютеинизирующий гормон; ФСГ = фолликулостимулирующий гормон; ДГЭА-С = дигидроэпиандростерона сульфат)
АНОВУЛЯТОРНОЕ КРОВОТЕЧЕНИЕ
Первым шагом в определении этиологии аномального маточного кровотечения является определение овуляторного статуса пациентки (таблица 3).Ановуляция является наиболее частой причиной ДМК у женщин репродуктивного возраста, особенно у подростков. До 80 процентов менструальных циклов являются ановуляторными в первый год после менархе. Циклы становятся овуляторными в среднем через 20 месяцев после менархе. Если ановуляторное кровотечение не является обильным или продолжительным, лечение не требуется. Если девушка-подросток обеспокоена нерегулярностью менструаций или ановуляторная аномалия длится более года, предпочтительным методом лечения являются оральные контрацептивы.
До 80 процентов менструальных циклов являются ановуляторными в первый год после менархе. Циклы становятся овуляторными в среднем через 20 месяцев после менархе. Если ановуляторное кровотечение не является обильным или продолжительным, лечение не требуется. Если девушка-подросток обеспокоена нерегулярностью менструаций или ановуляторная аномалия длится более года, предпочтительным методом лечения являются оральные контрацептивы.
Посмотреть / Распечатать таблица
Таблица 3Характеристики овуляторных и ановулаторных менструальных циклов
IVulatoratory Cycles |
Протяженность регулярных циклов |
Наличие предменструальных симптомов |
эндометрит |
груди нежность |
Изменение цервикальной слизи |
Mittleschmertz |
температурная кривая Двухфазный |
Положительный результат от использования лютеинизирующего гормона Prentictor Kit |
непредсказуемый цикл длина |
непредсказуемого кровотечения |
Частые Specting |
Нечастое тяжелое кровотечение |
монофазный температурной кривой |
Характеристики предовуляторного и Ановуляторное менструальных циклов
овуляторных циклов | |
Длина обычного цикла | |
Наличие предменструальный симптомов | |
эндометрит | |
груди нежность | |
Изменение цервикальной слизи | |
Mittleschmertz | |
кривая температуры Biphasic | |
положительный результат от использования лютеинизирующих предиктор гормонов | |
ановулаторные циклы | |
непредсказуемый цикл длина | |
непредсказуемое блесло ding pattern | |
Частые Spotting | |
Нечастое тяжелое кровотечение | |
| 27 | Монофазная кривая температуры |
Некоторые женщины по-прежнему имеют ановулятивные циклы после оси гипоталамического гипофиза. Уровни тиреотропного гормона и пролактина в сыворотке должны быть измерены, чтобы исключить значительную патологию. Потеря веса, расстройства пищевого поведения, стресс, хронические заболевания или чрезмерные физические нагрузки могут вызвать ановуляцию гипоталамуса.
Уровни тиреотропного гормона и пролактина в сыворотке должны быть измерены, чтобы исключить значительную патологию. Потеря веса, расстройства пищевого поведения, стресс, хронические заболевания или чрезмерные физические нагрузки могут вызвать ановуляцию гипоталамуса.
Другой причиной ановуляции является поликистоз яичников, который обычно связан с ожирением, повышенным уровнем циркулирующих андрогенов и резистентностью к инсулину.2 Избыток андрогенов преобразуется в эстроген в периферических тканях. Это непротиворечивое состояние эстрогена увеличивает риск гиперплазии эндометрия и рака.Некоторые женщины с хронической ановуляцией не попадают ни в одну из вышеперечисленных категорий, и считается, что у них идиопатическая хроническая ановуляция.
Все причины ановуляции связаны с дефицитом прогестерона. Варианты лечения включают введение экзогенного прогестерона каждые три месяца для защиты от рака эндометрия, оральные контрацептивы или, если беременность желательна, индукцию овуляции кломифеном (серофеном)3,4. Гормональные схемы, используемые для контроля ДМК, представлены в таблице 4. Смотреть / Распечатать таблица
Гормональные схемы, используемые для контроля ДМК, представлены в таблице 4. Смотреть / Распечатать таблица
Параметры лечения для дисфункционального матки кровотечение
| возрастная группа | Comments * | комментариев |
|---|---|---|
Premenopausaul | Острых оральных контрацептивов | низкая доза 35 мкг) монофазных или трехфазных пероральных контрацептивов могут регулировать циклы, обеспечивая при этом контрацепцию. |
Медроксипрогестерон, 10 мг в день в течение 10 дней | Если нет проблем с контрацепцией, медроксипрогестерон можно использовать для регулирования цикла. | |
Кломифен, от 50 до 150 мг в день с 5 по 9 день | Может вызвать овуляцию у женщины, желающей забеременеть.При отсутствии ответа или беременности в течение 3–6 месяцев целесообразно направление к врачу. | |
Перименопауза | Медроксипрогестерон, 10 мг в день в течение 10 дней | Можно использовать ежемесячно для регулирования характера кровотечений. |
Оральные контрацептивы | Обычно используют таблетки по 20 мкг. | |
Постменопаузальный (принимающий ЗГТ) | Циклическая ЗГТ | Можно рассмотреть вопрос об увеличении дозы прогестерона в случае раннего кровотечения отмены. Увеличьте дозу эстрогена, если присутствуют межменструальные кровотечения. |
Непрерывная комбинированная ЗГТ | Возможно увеличение дозы эстрогена на 1–3 мес для стабилизации состояния эндометрия. Также можно попробовать увеличить дозу прогестерона.Если кровотечение продолжается, рассмотрите возможность смены режима на циклическую ЗГТ или использование другого типа эстрогена. |
Параметры лечения для дисфункционального кровотечения матки
| Age Group | Comments | |
|---|---|---|
Premenopausal | Низкая доза (35 мкг ) монофазные или трехфазные оральные контрацептивы могут регулировать циклы, обеспечивая при этом контрацепцию. | |
Медроксипрогестерон, 10 мг в день в течение 10 дней | Если нет проблем с контрацепцией, медроксипрогестерон можно использовать для регулирования цикла. У женщин с аменореей или олигоменореей введение медроксипрогестерона каждые 3 месяца может защитить от гиперплазии эндометрия. | |
Кломифен, от 50 до 150 мг в день с 5 по 9 день | Может вызвать овуляцию у женщины, желающей забеременеть.При отсутствии ответа или беременности в течение 3–6 месяцев целесообразно направление к врачу. | |
Перименопауза | Медроксипрогестерон, 10 мг в день в течение 10 дней | Можно использовать ежемесячно для регулирования характера кровотечений. |
Оральные контрацептивы | Обычно используют таблетки по 20 мкг. Можно продолжать прием оральных контрацептивов до тех пор, пока у женщины не закончится менопауза, а затем перейти на ЗГТ. | |
Постменопаузальный (принимающий ЗГТ) | Циклическая ЗГТ | Можно рассмотреть вопрос об увеличении дозы прогестерона в случае раннего кровотечения отмены. Увеличьте дозу эстрогена, если присутствуют межменструальные кровотечения. |
Непрерывная комбинированная ЗГТ | Возможно увеличение дозы эстрогена на 1–3 мес для стабилизации состояния эндометрия. Также можно попробовать увеличить дозу прогестерона.Если кровотечение продолжается, рассмотрите возможность смены режима на циклическую ЗГТ или использование другого типа эстрогена. |
ОВУЛЯТОРНОЕ ДИСФУНКЦИОНАЛЬНОЕ КРОВОТЕЧЕНИЕ
Хотя овуляторная ДМК встречается реже, чем ановуляторное кровотечение. ДМК у женщин с овуляторными циклами протекает в виде регулярных циклических кровотечений. Меноррагия может означать нарушение свертываемости крови или структурное поражение, такое как лейомиома матки, аденомиоз или полипы эндометрия. До 20 процентов подростков с меноррагией страдают нарушениями свертываемости крови, такими как болезнь фон Виллебранда.5 Заболевания печени с вытекающими отсюда нарушениями коагуляции и хронической почечной недостаточностью также могут вызывать меноррагию.
ДМК у женщин с овуляторными циклами протекает в виде регулярных циклических кровотечений. Меноррагия может означать нарушение свертываемости крови или структурное поражение, такое как лейомиома матки, аденомиоз или полипы эндометрия. До 20 процентов подростков с меноррагией страдают нарушениями свертываемости крови, такими как болезнь фон Виллебранда.5 Заболевания печени с вытекающими отсюда нарушениями коагуляции и хронической почечной недостаточностью также могут вызывать меноррагию.
Полименорея обычно вызывается недостаточностью лютеиновой фазы или короткой фолликулярной фазой. Олигоменорея у овулирующей женщины обычно вызвана удлиненной фолликулярной фазой. Межменструальные кровотечения могут быть вызваны заболеванием шейки матки или наличием внутриматочной спирали. Пятнистость в середине цикла может быть результатом быстрого снижения уровня эстрогена перед овуляцией.1
Биопсия эндометрия должна быть рассмотрена на ранней стадии процесса оценки женщин, которые имеют историю длительного воздействия непротиворечивого эстрогена, которые не реагируют на первоначальные стратегии лечения или которые старше 35 лет.
Женщины в перименопаузе
По мере приближения менопаузы у женщин циклы укорачиваются и часто становятся периодически ановуляторными. Эти изменения являются результатом снижения количества фолликулов яичников и уровня эстрадиола.6 По мере уменьшения количества фолликулов повышается уровень фолликулостимулирующего гормона, необходимого для стимуляции овуляции.
ЗА ИСКЛЮЧЕНИЕМ РАКА ЭНДОМЕТРИЯ
Диагностический алгоритм для женщин в перименопаузе с аномальными маточными кровотечениями представлен на рисунке 2.Всех женщин в перименопаузе с постоянным аномальным маточным кровотечением следует обследовать на наличие гиперплазии или карциномы эндометрия. Биопсия эндометрия является наиболее широко используемым и лучше всего изученным методом исключения карциномы эндометрия в этой возрастной группе.7–9 У женщин с нормальными результатами биопсии лечение обычно состоит из ежемесячной отмены прогестерона или приема низких доз пероральных контрацептивов, как указано в таблице 4.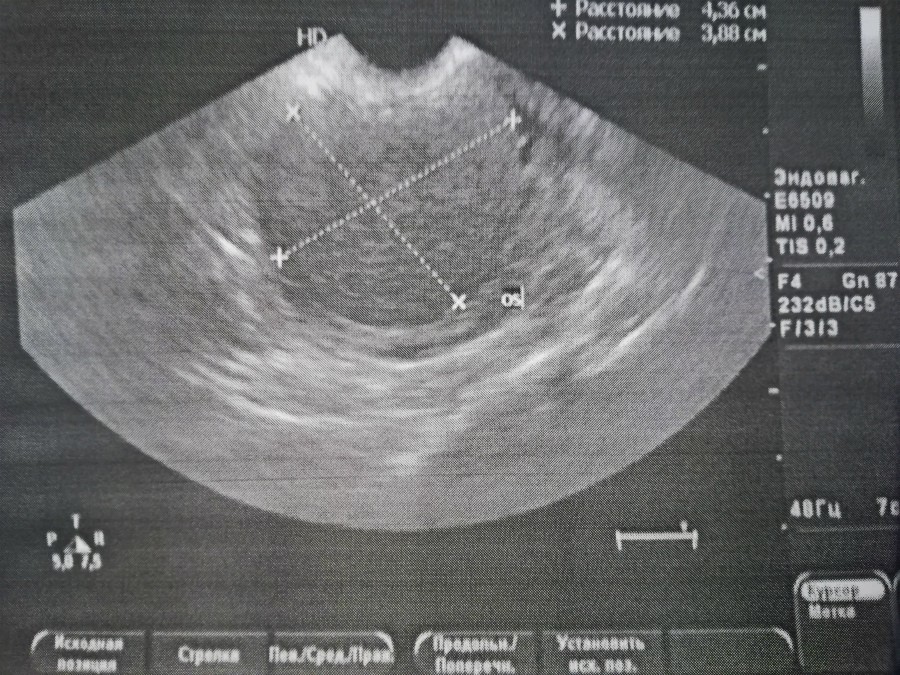 Обычно дозы эстрогена при заместительной гормональной терапии недостаточно для остановки кровотечения из атрофического эндометрия, и обычно необходимы более высокие дозы эстрогена.
Обычно дозы эстрогена при заместительной гормональной терапии недостаточно для остановки кровотечения из атрофического эндометрия, и обычно необходимы более высокие дозы эстрогена.
Посмотреть/распечатать рисунок (CBC = общий анализ крови; β-HCG = бета-хорионический гонадотропин человека; D&C = дилатация и кюретаж)
Алгоритм диагностической оценки аномальных маточных кровотечений у пациенток в перименопаузе. (ОАК = общий анализ крови; β-ХГЧ = бета-хорионический гонадотропин человека; D&C = дилатация и выскабливание)
Если кровотечение продолжается, несмотря на гормональную терапию, необходимо дальнейшее обследование. Трансвагинальное УЗИ может выявить атрофический эндометрий, гипертрофический эндометрий (подозрение на гиперплазию или карциному), лейомиому и полипы эндометрия, но не всегда может отличить подслизистую фиброму, полип эндометрия или аденомиоз.10 В одном исследовании роли трансвагинального УЗИ у женщин в перименопаузе было обнаружено, что этот метод эффективен для исключения карциномы эндометрия, когда он проводится на 4, 5 или 6 день менструального цикла. 11 Результаты также свидетельствуют о его полезности. оказалось ограниченным числом женщин, нуждающихся в дополнительных диагностических исследованиях. Более новый метод, соногистерография, использует инфузию физиологического раствора в полость эндометрия для улучшения обнаружения миомы и полипов. Однако биопсия эндометрия является более удобным и экономически эффективным способом оценки аномального кровотечения в этой возрастной группе.
11 Результаты также свидетельствуют о его полезности. оказалось ограниченным числом женщин, нуждающихся в дополнительных диагностических исследованиях. Более новый метод, соногистерография, использует инфузию физиологического раствора в полость эндометрия для улучшения обнаружения миомы и полипов. Однако биопсия эндометрия является более удобным и экономически эффективным способом оценки аномального кровотечения в этой возрастной группе.
ГИСТЕРОСКОПИЯ
Гистероскопия с биопсией позволяет визуализировать полость эндометрия и считается «золотым стандартом» для оценки состояния эндометрия.14,15 Диагностическая гистероскопия может быть выполнена в амбулаторных условиях и не требует анестезии или седации. Оперативная гистероскопия использует жесткий эндоскоп с жидкой растягивающей средой и полезна для диагностики и лечения. До появления гистероскопии кюретаж был основным методом оценки аномального маточного кровотечения.Кюретаж, однако, делает забор эндометрия слепым и неполным, поэтому диагностическая точность выскабливания меньше, чем у гистероскопии.
Женщины в постменопаузе
Наиболее серьезной проблемой у женщин в постменопаузе с аномальными маточными кровотечениями является рак эндометрия. Среди всех женщин в постменопаузе с кровотечением у 5–10% обнаруживается карцинома эндометрия.16,17 Другими потенциальными причинами кровотечения являются рак шейки матки, цервицит, атрофический вагинит, атрофия эндометрия, подслизистые миомы, гиперплазия эндометрия и полипы эндометрия.
ЗАМЕСТИТЕЛЬНАЯ ГОРМОНАЛЬНАЯ ТЕРАПИЯ
У женщин, получающих заместительную гормональную терапию, часто возникают аномальные кровотечения, из них 30 процентов имеют патологию матки.18 Другие причины включают поражение шейки матки, вагинальную патологию или саму гормональную терапию. У женщин, получающих последовательную заместительную гормональную терапию, могут возникнуть прорывные кровотечения в середине цикла в результате пропуска приема таблеток, взаимодействия с лекарствами или мальабсорбции. Если незапланированное кровотечение происходит в течение двух или более циклов, показано дальнейшее обследование. 19
19
При непрерывной комбинированной заместительной гормональной терапии до 40 процентов женщин имеют нерегулярные кровотечения в первые четыре-шесть месяцев терапии.19 Кровотечения чаще встречаются, когда гормональная терапия начинается менее чем через 12 месяцев после менопаузы. Большинство источников рекомендуют оценку аномального кровотечения, если оно длится более шести-девяти месяцев после начала заместительной гормональной терапии. Менее широко рекомендуемым подходом является прекращение гормональной терапии с последующей диагностической оценкой, если кровотечение не останавливается в течение трех недель.19
БИОПСИЯ ЭНДОМЕТРИЯ VS. ТРАНСВАГИНАЛЬНОЕ УЛЬТРАЗВИТИЕ
Диагностический подход к оценке аномального маточного кровотечения у женщин в постменопаузе показан на рисунке 3. Первоначальное обследование включает биопсию эндометрия или трансвагинальное УЗИ. Рис. 3.
(ОАК = общий анализ крови; ЗГТ = заместительная гормональная терапия)Первоначальный подход к аномальному маточному кровотечению у пациенток в постменопаузе
РИСУНОК 3.
Алгоритм диагностической оценки аномального маточного кровотечения у пациенток в постменопаузе. (ОАК = общий анализ крови; ЗГТ = заместительная гормональная терапия)
Толщина эндометрия больше у женщин, получающих гормональную терапию, но тонкая полоска на ультразвуковом изображении имеет высокую отрицательную прогностическую ценность для рака эндометрия.20,21 Точность трансвагинального УЗИ по сравнению с биопсией эндометрия у женщин в постменопаузе с аномальным кровотечением была оценена в метаанализе.22 Данные показали, что 96% женщин с раком эндометрия и 92% женщин с другими заболеваниями эндометрия имели толщина полосы эндометрия более 5 мм, независимо от того, применялась ли заместительная гормональная терапия. У женщин с нормальной гистологией, которые не принимали гормоны, у 8% были обнаружены ложные аномалии при ультразвуковом исследовании.Напротив, ложноположительные результаты были обнаружены у 23 процентов женщин, получавших заместительную гормональную терапию. субмукозная миома или полип эндометрия. Гистероскопия с биопсией обеспечивает наиболее полную оценку состояния эндометрия и рекомендуется для любой женщины с сомнительными результатами биопсии или УЗИ.
субмукозная миома или полип эндометрия. Гистероскопия с биопсией обеспечивает наиболее полную оценку состояния эндометрия и рекомендуется для любой женщины с сомнительными результатами биопсии или УЗИ.
Стоимость биопсии эндометрия и трансвагинального УЗИ сопоставима.17 Преимущество биопсии в том, что она обеспечивает диагностику тканей, и ее можно проводить во время поступления. Однако биопсия эндометрия вызывает больший дискомфорт, чем трансвагинальное УЗИ, и часто невозможна у женщин со стенозом шейки матки. Трансвагинальное УЗИ может быть более полезным для женщин в постменопаузе, которые не получают заместительную гормональную терапию, чем для тех, кто ее получает. Четверть женщин, получающих заместительную гормональную терапию, нуждаются в дополнительном диагностическом обследовании после трансвагинального УЗИ, что доставляет больше неудобств и может вызвать ненужное беспокойство.И наоборот, исследователи метаанализа, в котором сравнивали биопсию эндометрия и трансвагинальное УЗИ, пришли к выводу, что, поскольку 8% ложноотрицательных результатов УЗИ выгодно отличаются от 5-15% ложноотрицательных результатов офисной биопсии, трансвагинальное УЗИ эффективно для определения которые женщины в постменопаузе с кровотечением имеют низкий риск серьезного заболевания эндометрия. 22
22
Заключительный комментарий
Диагностический подход к аномальному маточному кровотечению не должен быть пугающим.Клиническая информация, наряду с репродуктивной стадией пациента, сужает этиологические возможности. Этиологию аномального кровотечения можно выявить экономически эффективным способом, если врач знает наиболее распространенные причины кровотечения в каждой возрастной группе и использует логический диагностический подход.
Корреляция между толщиной эндометрия и исходами беременности в свежих циклах ВРТ в разных возрастных группах: ретроспективное исследование | Журнал Middle East Fertility Society Journal
Мы изучили свежий цикл ЭКО/ИКСИ у 1000 пациентов и определили влияние ЛОР в день окончательного запуска на исход беременности.Наши результаты показали, что существует значительная корреляция между толщиной эндометрия и частотой наступления беременности.
В то время как несколько исследований подтвердили связь тонкого эндометрия с низкой клинической частотой наступления беременности, точка отсечения Ent для исхода беременности ЭКО-ЭТ не была определена.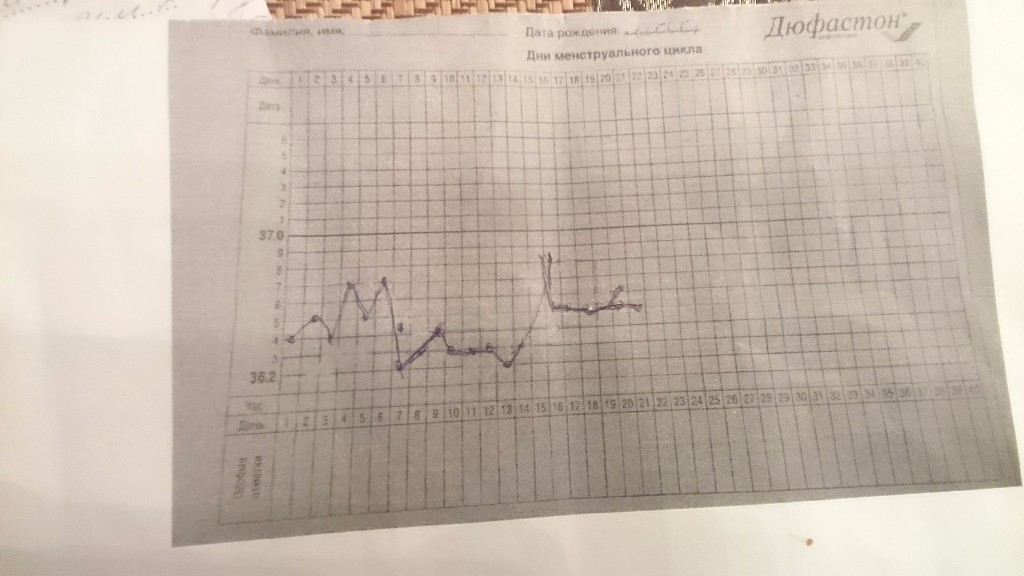 Исследования показали, что частота клинической беременности и частота продолжающейся беременности значительно снижаются, когда Ent составляет менее 7 мм в день ХГЧ [7, 8], что соответствовало нашему исследованию. Сообщалось, что частота самопроизвольных абортов значительно увеличивается, когда Ent > 14 мм [9], тогда как другое исследование предполагает отсутствие неблагоприятного влияния на исход беременности, когда Ent > 14 мм [7].В нашем исследовании мы наблюдали, что частота наступления беременности увеличивалась с Ent = 8 мм до Ent = 11 мм, затем уменьшалась, и при Ent > 14 мм частота наступления беременности равнялась нулю.
Исследования показали, что частота клинической беременности и частота продолжающейся беременности значительно снижаются, когда Ent составляет менее 7 мм в день ХГЧ [7, 8], что соответствовало нашему исследованию. Сообщалось, что частота самопроизвольных абортов значительно увеличивается, когда Ent > 14 мм [9], тогда как другое исследование предполагает отсутствие неблагоприятного влияния на исход беременности, когда Ent > 14 мм [7].В нашем исследовании мы наблюдали, что частота наступления беременности увеличивалась с Ent = 8 мм до Ent = 11 мм, затем уменьшалась, и при Ent > 14 мм частота наступления беременности равнялась нулю.
Чтобы получить более точную взаимосвязь между толщиной эндометрия и результатами ЭКО, Bu et al. продемонстрировали, что у пациенток, перенесших ЭКО, с различной реакцией яичников, тонкая толщина эндометрия в день введения ХГЧ связана с более низкой частотой наступления беременности [10]. Толстый эндометрий вызывает больше споров.Несколько предыдущих исследователей предположили, что толстый эндометрий (> 16 или ≥ 17 мм) связан с повышенной частотой зачатия, в то время как другие сообщили о вредном влиянии толстого эндометрия (> 14 мм) на скорость зачатия [11, 12]. . Yuan и соавторы в своем исследовании обнаружили устойчивую положительную корреляцию между Ent и частотой зачатия, при этом пациенты, у которых Ent больше 15 мм, достигли самого высокого уровня зачатия 53,3% [3]. Однако важно отметить, что утолщенный эндометрий связан с рядом внутриматочных патологий, таких как полипы или миомы, которые, как было показано, отрицательно влияют на имплантацию и снижают частоту наступления беременности [13].Таким образом, у женщин с аномально утолщенным эндометрием целесообразно провести дополнительные исследования, такие как гистероскопия, для исключения и лечения любых внутриполостных поражений.
. Yuan и соавторы в своем исследовании обнаружили устойчивую положительную корреляцию между Ent и частотой зачатия, при этом пациенты, у которых Ent больше 15 мм, достигли самого высокого уровня зачатия 53,3% [3]. Однако важно отметить, что утолщенный эндометрий связан с рядом внутриматочных патологий, таких как полипы или миомы, которые, как было показано, отрицательно влияют на имплантацию и снижают частоту наступления беременности [13].Таким образом, у женщин с аномально утолщенным эндометрием целесообразно провести дополнительные исследования, такие как гистероскопия, для исключения и лечения любых внутриполостных поражений.
Ваня Коста Рибера и ее коллеги в исследовании оценивали, влияет ли Ent на исход переноса свежего эмбриона, в ретроспективной одноцентровой когорте из 3350 циклов ЭКО. В многофакторном регрессионном анализе Ent был нелинейно связан с живорождением, коэффициент живорождения был самым низким при Ent менее 7.0 мм (21,6%; p < 0,001), а затем от 7,0 до 9,0 мм (30,2%; p = 0,008). Ent менее 7,0 мм также был связан со снижением массы тела новорожденного при рождении z -баллов. Они пришли к выводу, что использование Ent является потенциальным прогностическим инструментом для показателей живорождения и веса новорожденного [4].
Ent менее 7,0 мм также был связан со снижением массы тела новорожденного при рождении z -баллов. Они пришли к выводу, что использование Ent является потенциальным прогностическим инструментом для показателей живорождения и веса новорожденного [4].
Мохаммади и его коллеги в своем исследовании оценили влияние комбинированной толщины и структуры эндометрия на успешность циклов интрацитоплазматической инъекции сперматозоидов (ИКСИ) и пришли к выводу, что толщина эндометрия составляет 10–12.9 мм с триламинарным рисунком ассоциируется с более высокой СЛР при циклах ИКСИ [14].
Джулиан и др. в своем исследовании оценивали влияние структуры эндометрия на триггерный день после имплантации [15]. Паттерн эндометрия (Enp) был зарегистрирован как относящийся к одной из следующих трех категорий, как описано Grunfeld et al. [16]: (1) поздний пролиферативный (гиперэхогенный эндометрий, составляющий < 50% эндометрия, с гиперэхогенным базальным и гипоэхогенным функционалом), (2) ранний секреторный (гиперехогенный базальный и функциональный, распространяющийся на > 50% эндометрия, но не покрывающий всю полость эндометрия), и (3) средне-поздний секреторный (гомогенный гиперэхогенный функционализм, распространяющийся от базального отдела к просвету). В исследуемой популяции Ent не был значимо связан с клиническими исходами эуплоидных ET. Энп 3 типа в триггерный день свидетельствует о преждевременном закрытии окна имплантации [15].
В исследуемой популяции Ent не был значимо связан с клиническими исходами эуплоидных ET. Энп 3 типа в триггерный день свидетельствует о преждевременном закрытии окна имплантации [15].
Zhao и коллеги показали значительную разницу в толщине эндометрия в день введения ХГЧ и изменение толщины эндометрия с третьего дня стимуляции гонадотропином до дня введения ХГЧ между беременными и небеременными женщинами. Это открытие указывает на то, что адекватное развитие эндометрия способствует повышению частоты наступления беременности.Они предполагают, что эндометрий небеременных женщин может быть связан с патологическими аномалиями, такими как плоскоклеточная метаплазия или отсутствие нормальной пролиферативной реакции на повышение уровня эстрадиола. В модели бинарной логистической регрессии толщина эндометрия на 3-й день стимуляции гонадотропином, толщина эндометрия в день введения ХГЧ и изменение толщины эндометрия с третьего дня стимуляции гонадотропином до дня введения ХГЧ были независимыми прогностическими факторами для беременность [1] Хотя во многих исследованиях оценивалась взаимосвязь между толщиной эндометрия и исходом ЭКО, результаты все еще противоречивы. Некоторые авторы сообщают об отсутствии связи между толщиной эндометрия и частотой наступления беременности у пациенток, перенесших ЭКО [17, 18].
Некоторые авторы сообщают об отсутствии связи между толщиной эндометрия и частотой наступления беременности у пациенток, перенесших ЭКО [17, 18].
Из-за основных параметров пациента, таких как количество извлеченных ооцитов, качество и количество перенесенных эмбрионов, в большинстве исследований не проводилась точная оценка, и их результаты были сомнительными. В нашем исследовании мы показали, что существует значительная разница между клиническими параметрами, такими как АМГ, уровень эстрадиола в день окончательного запуска, а также количество извлеченных ооцитов и зрелых ооцитов у беременных и небеременных пациенток.Также была выявлена положительная корреляция Ent с этими клиническими параметрами. Ent является решающим фактором для беременности, но есть вероятность, что эти параметры могут быть более важными, чем Ent, и могут влиять на него. На самом деле овариальный резерв и внутренняя выработка эстрадиола вызывают рост эндометрия. АМГ считается признаком овариального резерва; например, это обычно выражается теми фолликулами, которые недавно образовались из пула примордиальных фолликулов. Следовательно, уровни АМГ в сыворотке демонстрируют количество и особенности фолликулярного пула яичников [19].Кроме того, АМГ связан с количеством зрелых ооцитов и частотой оплодотворения. С другой стороны, существовала отрицательная корреляция между Энтом и возрастом женщины. Выявлено, что женский возраст является важным фактором фертильности, и его увеличение, хотя и незначительно, приводит к снижению клинической частоты наступления беременности. Кин и др. в соответствии с нашим исследованием показано, что как АФК, так и АМГ сильно зависят от возраста пациента и могут оценивать результаты ЭКО, включая частоту наступления беременности и живорождения [20]. Райхман и его коллеги показали, что АМГ является надежным показателем для прогнозирования отмены ВРТ и количества ооцитов, которые могут быть извлечены после стимуляции, но, наоборот, они показали, что это умеренно плохой тест для прогнозирования беременности после любого заданного цикла лечения.Пациенты с чрезвычайно низким уровнем АМГ все еще могут достичь разумных результатов лечения, и им не следует препятствовать попыткам ЭКО исключительно на основании значения АМГ [21].
Следовательно, уровни АМГ в сыворотке демонстрируют количество и особенности фолликулярного пула яичников [19].Кроме того, АМГ связан с количеством зрелых ооцитов и частотой оплодотворения. С другой стороны, существовала отрицательная корреляция между Энтом и возрастом женщины. Выявлено, что женский возраст является важным фактором фертильности, и его увеличение, хотя и незначительно, приводит к снижению клинической частоты наступления беременности. Кин и др. в соответствии с нашим исследованием показано, что как АФК, так и АМГ сильно зависят от возраста пациента и могут оценивать результаты ЭКО, включая частоту наступления беременности и живорождения [20]. Райхман и его коллеги показали, что АМГ является надежным показателем для прогнозирования отмены ВРТ и количества ооцитов, которые могут быть извлечены после стимуляции, но, наоборот, они показали, что это умеренно плохой тест для прогнозирования беременности после любого заданного цикла лечения.Пациенты с чрезвычайно низким уровнем АМГ все еще могут достичь разумных результатов лечения, и им не следует препятствовать попыткам ЭКО исключительно на основании значения АМГ [21].

 д.
д.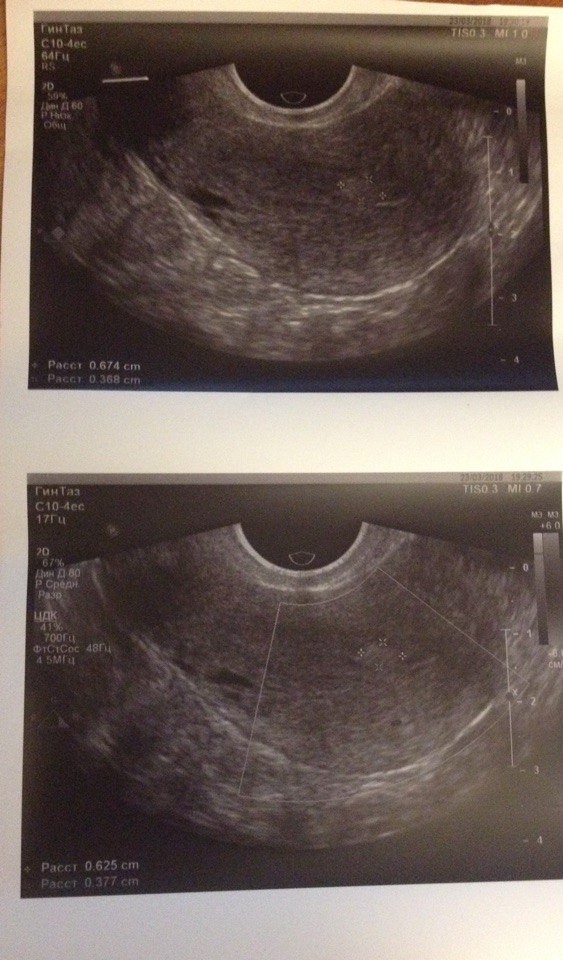 J Am Med Assoc 108: 2022-2028. [Перекрестная ссылка]
J Am Med Assoc 108: 2022-2028. [Перекрестная ссылка]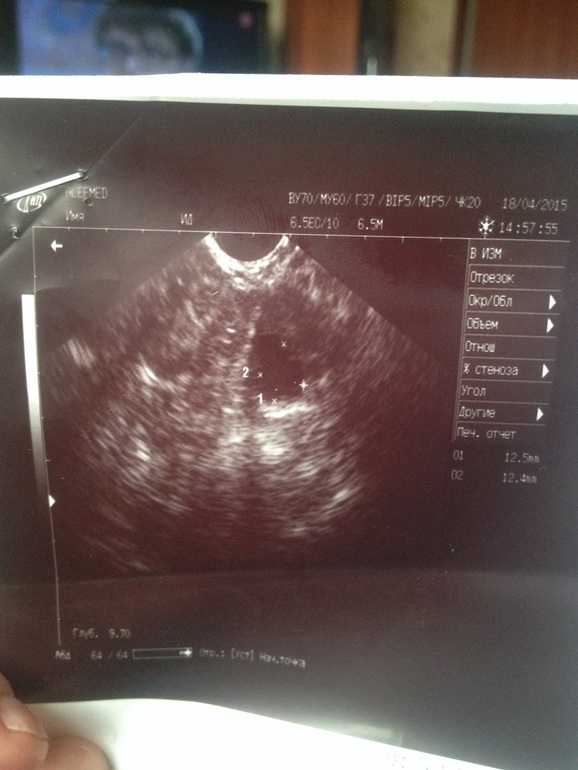 , Антунес О., Диас-Химено П., Беллвер Дж. и др. (2014)Расшифровка протеомной сигнатуры восприимчивости человеческого эндометрия. Hum Reprod 29: 1957-1967. [Перекрестная ссылка]
, Антунес О., Диас-Химено П., Беллвер Дж. и др. (2014)Расшифровка протеомной сигнатуры восприимчивости человеческого эндометрия. Hum Reprod 29: 1957-1967. [Перекрестная ссылка] Reprod Sci 23: 1234-1241. [Перекрестная ссылка]
Reprod Sci 23: 1234-1241. [Перекрестная ссылка] , Нишияма Р. и др.(2016) Хронический эндометрит: потенциальная причина бесплодия и акушерских и неонатальных осложнений. Am J Reprod Immunol 75: 13-22. [Перекрестная ссылка]
, Нишияма Р. и др.(2016) Хронический эндометрит: потенциальная причина бесплодия и акушерских и неонатальных осложнений. Am J Reprod Immunol 75: 13-22. [Перекрестная ссылка] [Crossref]
[Crossref] У женщин с аменореей или олигоменореей введение медроксипрогестерона каждые 3 месяца может защитить от гиперплазии эндометрия.
У женщин с аменореей или олигоменореей введение медроксипрогестерона каждые 3 месяца может защитить от гиперплазии эндометрия.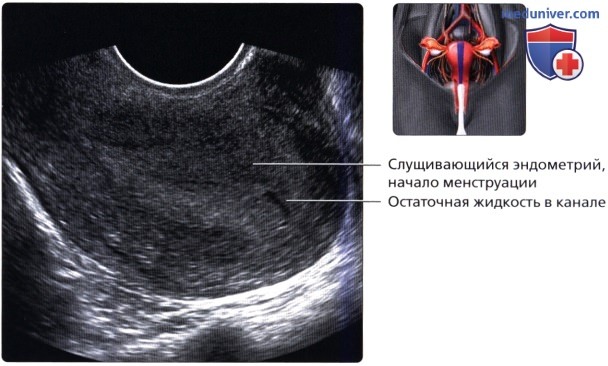 Можно продолжать прием оральных контрацептивов до тех пор, пока у женщины не закончится менопауза, а затем перейти на ЗГТ. (Может быть относительным противопоказанием для курящих женщин старше 35 лет.)
Можно продолжать прием оральных контрацептивов до тех пор, пока у женщины не закончится менопауза, а затем перейти на ЗГТ. (Может быть относительным противопоказанием для курящих женщин старше 35 лет.)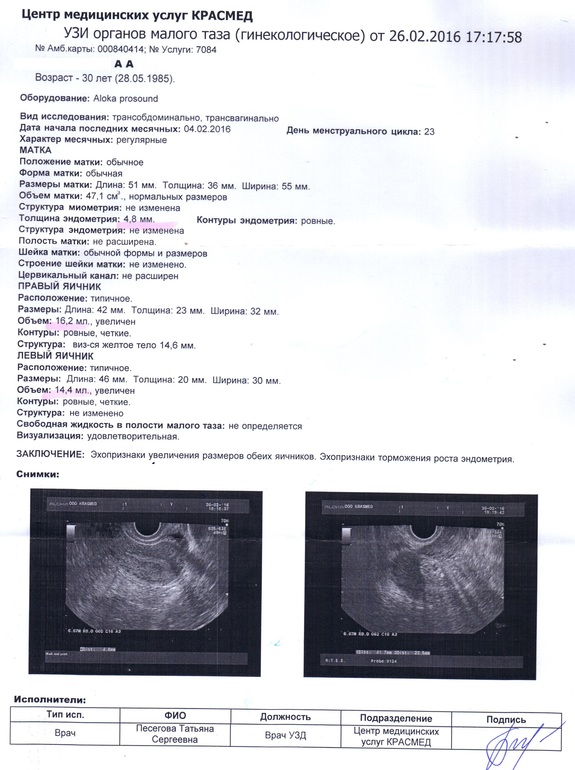

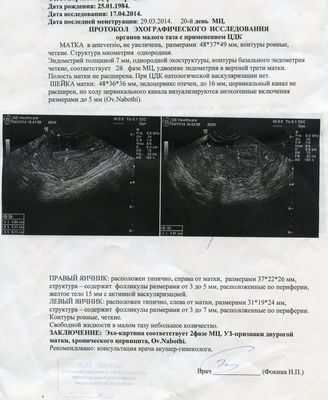 (Может быть относительным противопоказанием для курящих женщин старше 35 лет.)
(Может быть относительным противопоказанием для курящих женщин старше 35 лет.)